Сенсорные системы, 2019, T. 33, № 2, стр. 135-141
Роль донора молекул NO в регуляции ответов первичного сенсорного нейрона
В. Б. Плахова 1, *, В. А. Пеннияйнен 1, И. В. Рогачевский 1, А. Д. Калинина 1, С. А. Подзорова 1, Б. В. Крылов 1
1 Федеральное государственное бюджетное учреждение науки
Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, наб. Макарова, д. 6, Россия
* E-mail: verapl@mail.ru
Поступила в редакцию 27.09.2018
Аннотация
Методами локальной фиксации потенциала и органотипической культуры нервной ткани исследованы эффекты донора молекул NO нитропруссида натрия (SNP) на первичные сенсорные нейроны. SNP (10–2 моль/л) снижает потенциалочувствительность каналов NaV1.8, ответственных за кодирование ноцицептивной информации. Методом органотипической культуры установлено, что данный агент также ингибирует рост нейритов при концентрациях, превышающих 10–4 моль/л. Полученные результаты позволяют заключить, что антиноцицептивный эффект SNP, основанный на снижении потенциалочувствительности каналов NaV1.8, сопряжен с его негативным ингибирующим действием на развитие эмбриональной нервной ткани теплокровных животных. На уровне первичного сенсорного нейрона модулирующее действие NO-ергической системы на ноцицептивную систему представляется маловероятным.
ВВЕДЕНИЕ
Медленные (тетродотоксиннечувствительные, TTX-R, NaV1.8) натриевые каналы были обнаружены в мембране сенсорных нейронов (Kostyuk et al., 1981). Позже была установлена их ключевая роль в кодировании ноцицептивной информации (Gold et al., 1996; Borovikova et al., 1997). Снижение функциональной активности каналов NaV1.8 приводит к антиноцицептивной реакции на организменном уровне, соответственно, агенты, вызывающие этот эффект, являются претендентами на роль лекарственных субстанций новых анальгетиков (Jarvis et al., 2007).
Согласно нашим данным, вызванное субстанциями эндогенной и экзогенной природы снижение потенциалочувствительности активационного воротного устройства каналов NaV1.8 приводит к снижению частоты повторных ответов мембраны ноцицептивного нейрона и, как следствие, к антиноцицептивной реакции на организменном уровне (Крылов и др.,1999; Krylov et al., 2017). Исследования влияния модуляторов NO-ергической системы на эти каналы носят фрагментарный характер (Tyurenkov et al., 2018). В отношении других представителей суперсемейства натриевых каналов известно, что нитропруссид натрия (SNP) увеличивает функциональную активность ТТХ-чувствительных натриевых каналов нейронов гиппокампа, тем самым увеличивая частоту их импульсной активности (Hammarström, Gage, 1999), и, возможно, вызывая проноцицептивную реакцию организма.
NO-доноры и эндогенно продуцируемые молекулы NO играют важнейшую роль во многих физиологических процессах, включая релаксацию гладких мышц, пролиферацию и дифференцировку клеток, высвобождение нейротрансмиттеров (Park et al., 2014). Оксид азота является сигнальной молекулой, выполняющей регуляторную функцию в нервной системе млекопитающих (Ahern et al., 2002; Calabrese et al., 2007; Cury et al., 2011; Park et al., 2014). Также в последние годы появились данные, указывающие на то, что оксид азота может быть цитотоксичным и индуцировать апоптоз (Liu et al., 2016; Wang et al., 2016). Поэтому представляющий практический интерес возможный антиноцицептивный эффект SNP, скорее всего, сопряжен с негативным действием на функционирование нервных клеток. В настоящей работе нами было обнаружено влияние SNP на активационную воротную систему каналов NaV1.8: их потенциалочувствительность снижалась при приложении данного агента в концентрации 10–2 моль/л. Однако его негативное действие на первичные сенсорные нейроны проявляется при концентрациях на два порядка меньше, что заставляет с осторожностью рассматривать перспективы практического применения SNP в качестве модулятора ноцицептивной системы теплокровных животных.
МЕТОДИКИ ИССЛЕДОВАНИЯ
Метод локальной фиксации потенциала. В наших электрофизиологических экспериментах был использован метод локальной фиксации потенциала (patch-clamp method) в конфигурации “регистрация активности целой клетки” (“whole-cell”) (Hamill et al., 1981). Объектом исследования являлись полученные методом краткосрочного культивирования изолированные сенсорные нейроны, выделенные из областей L5–S1 ганглиев спинного мозга новорожденных крысят линии Wistar. Интактные нервные клетки были получены путем культивирования изолированных нейронов в течение двух часов в стандартных питательных средах с использованием СО2-инкубатора. Более подробно модифицированный метод краткосрочного культивирования диссоциированных сенсорных нейронов описан ранее (Плахова и др., 2003).
Работа была проведена на животных из ЦКП Биоколлекция ИФ РАН, поддержанной Программой ФАНО России по сохранению и развитию биоресурсных коллекций.
Для регистрации характеристик каналов NaV1.8. применяли стандартные растворы (концентрации представлены в ммоль/л). Внеклеточный: NaCl – 65, CaCl2 – 2, MgCl2 – 2, Choline Cl – 70, HEPES Na – 10, TTX – 0.0003, pH 7.4. Внутриклеточный: CsF – 100, NaCl – 10, CsCl – 40, MgCl2 – 2, HEPES Na – 10, pH 7.2. Наличие ионов фтора во внутриклеточном растворе и полное отсутствие ионов калия позволили избавиться от всех компонентов калиевых и кальциевых токов (Kostyuk et al., 1975; Elliott, Elliott, 1993). Благодаря присутствию во внеклеточном растворе тетродотоксина блокировалось функционирование быстрых тетродотоксинчувствительных каналов, что делало возможным регистрировать ответы только одной популяции натриевых каналов, NaV1.8. В работе использовали реактивы фирмы “Sigma Chemical Co.” (США).
Токи натриевых каналов NaV1.8 фиксировали до и после приложения нитропруссида натрия. Количественное описание изменения потенциалочувствительности медленного натриевого канала NaV1.8 при воздействии SNP осуществляли посредством оценки величины эффективного заряда (Zeff) активационного воротного устройства данного типа каналов (Крылов и др., 1999; Krylov et al., 2017) по методу Алмерса (Almers, 1978).
Метод органотипической культуры эмбриональной нервной ткани. Применяемая нами методика подробно описана ранее (Lopatina et al., 2012). Объектами исследования являлись эксплантаты сенсорных ганглиев 10-12-дневных куриных эмбрионов. Было исследовано более двухсот эксплантатов, культивированных в СО2-инкубаторе (Sanyo) в течение трех суток на подложках из коллагена в чашках Петри при 36.5°С и 5%-ном СО2. Контрольными служили эксплантаты, культивированные только в условиях питательной среды. В питательную среду добавляли исследуемое вещество в широком диапазоне концентраций. Для количественной оценки роста эксплантатов применяли морфометрический метод. Индекс площади (ИП) рассчитывали как отношение площади зоны роста эксплантата к исходной центральной площади, где находились немигрирующие клетки. Контрольное значение ИП принимали за 100%. Для визуализации объектов использовали микроскоп AxioObserverZ1 (Carl Zeiss, Германия). Полученные изображения анализировали с использованием программ ImageJ и ZEN_2012. Работу выполняли на оборудовании ЦКП “Конфокальная микроскопия” Института физиологии им. И.П. Павлова РАН.
Статистическую обработку полученных результатов осуществляли в программе STATISTICA 8.0 (StatSoft, США) с использованием t-критерия Стьюдента. Данные представлены в виде среднего значения ± стандартная ошибка среднего. Различия принимались статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ
Методом локальной фиксации потенциала была исследована способность SNP в концентрации 10–2 моль/л снижать потенциалочувствительность медленных натриевых каналов NaV1.8, ответственных за кодирование болевых сигналов.
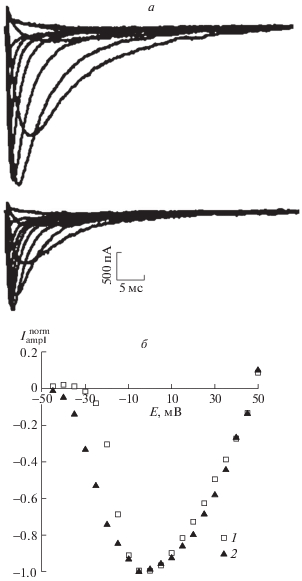
Семейства токов каналов Nav1.8, полученные при изменении фиксированного потенциала в контрольных экспериментах и после приложения SNP (10–2 моль/л), представлены на рис. 1, а. Присущий методу локальной фиксации потенциала “run-down эффект” обусловливал небольшое уменьшение максимальных значений амплитуд натриевых токов в течение эксперимента. На рис. 1, б показаны нормированные “пиковые” вольт-амперные характеристики, полученные в контрольных экспериментах и после приложения SNP (10–2 моль/л). Данные зависимости построены обычным способом (Hodgkin, Huxley, 1952): при подаче на мембрану последовательности ступенек напряжения (E) регистрировали амплитудные (пиковые) значения токов (Iampl), которые можно представить в виде функции Iampl(E).
Рис. 1.
Влияние нитропруссида натрия на потенциалочувствительность медленных натриевых каналов NaV1.8
а – семейства медленных натриевых токов в контрольных экспериментах (сверху) и после приложения SNP в концентрации 10–2 моль/л (снизу). Диапазон тестирующего потенциала от –45 до 45 мВ, шаг – 10 мВ. Во всех записях поддерживаемый потенциал, длительность которого составляла 500 мс, был равен 110 мВ. Вычитание токов утечки и емкостных токов осуществлялось программным способом.
б – нормированные значения пиковых вольт-амперных характеристик натриевых каналов NaV1.8, построенные по данным контрольного эксперимента (1) и после приложения SNP в концентрации 10–2 моль/л (2).
Исследуемая нами потенциалочувствительность активационной воротной системы медленных натриевых каналов NaV1.8, характеризующая возбудимость мембраны нейрона, определяется величиной ее эффективного заряда. Эффект, позволяющий обнаружить количественную связь между потенциалочувствительностью и воздействием SNP, проявляется в изменении крутизны левой ветви вольт-амперной характеристики, что легко видеть на графике зависимости нормированной хордовой проводимости от потенциала (рис. 2, а). Потенциалочувствительность активационного воротного устройства каналов NaV1.8 определялась методом Алмерса (Almers, 1978), основанным на построении так называемой функции лимитирующей логарифмической чувствительности. Эта функция, построенная по нашим экспериментальным данным, позволяет количественно оценить величину эффективного заряда (Zeff) по тангенсу угла наклона регрессионной прямой (рис. 2, б). Установлено, что величина эффективного заряда снижалась с контрольного значения Zeff = 7.2 до Zeff = 4.2 после приложения SNP в концентрации 10–2 моль/л.
Рис. 2.
Влияние нитропруссида натрия на величину эффективного заряда активационной воротной системы медленных натриевых каналов NaV1.8
a – потенциалозависимость хордовой проводимости медленных натриевых каналов NaV1.8, полученная в контрольных экспериментах (1) и после приложения SNP в концентрации 10–2 моль/л (2).
б – экспоненциальная функция, представленная в логарифмическом масштабе (ось ординат), позволяет определить величину Zeff по тангенсу угла наклона асимптот, проведенных к начальным участкам этих функций в контрольном опыте (1) и после приложения SNP в концентрации 10–2 моль/л (2).
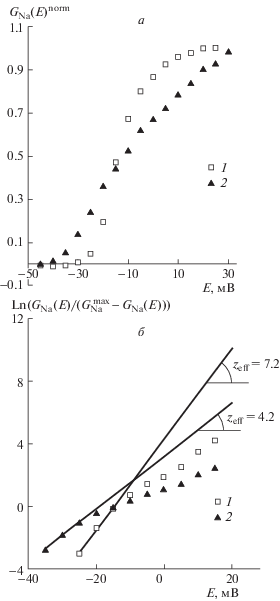
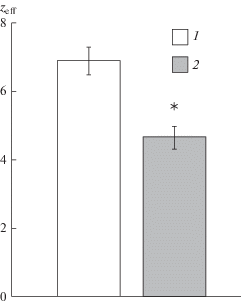
Рисунок 3 иллюстрирует наши обобщенные данные, полученные в контрольных экспериментах и после воздействия SNP в концентрации 10–2 моль/л. Эти результаты свидетельствуют о статистически достоверном снижении величины эффективного заряда с контрольного значения Zeff = 6.9 ± 0.4 (n = 30) до Zeff = 4.7 ± 0.3 (n = 30), где n соответствует числу исследованных нейронов, мембрана которых содержала только каналы NaV1.8. Отметим также, что приложение SNP в меньшей концентрации (10–3 моль/л) не влияло на потенциалочувствительность.
Рис. 3.
Снижение эффективного заряда активационной воротной системы медленных натриевых каналов после приложения нитропруссида натрия
1 – контрольные записи.
2 – после приложения SNP в концентрации 10–2 моль/л.
* – различия достоверны относительно контрольных значений, p < 0.05.
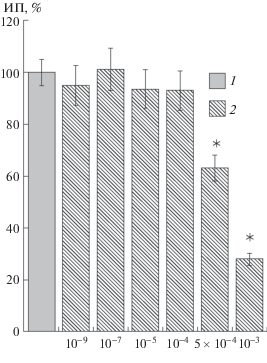
В экспериментах, выполненных методом органотипической культуры ткани, SNP в концентрациях 10–9, 10–7, 10–5 и 10–4 моль/л практически не влиял на рост эксплантатов. В концентрации 5 × × 10–4 моль/л исследуемый агент достоверно ингибировал рост нейритов сенсорных нейронов (рис. 4), ИП составлял 63 ± 6% (n = 35). При увеличении концентрации SNP до 10–3 моль/л наблюдалось резкое усиление процесса ингибирования роста нейритов. Среднее значение ИП экспериментальных эксплантатов в этом случае было на 72% ниже своего контрольного значения. Таким образом, наши результаты свидетельствуют об относительно безопасном действии SNP на эмбриональную нервную ткань в диапазоне концентраций от 10–9 до 10–4 моль/л, который сменяется сильным ингибирующим эффектом при увеличении концентрации агента до 5 × 10–4 моль/л и выше. Это указывает на возможный цитотоксический эффект SNP по отношению к сенсорным нейронам, что также подтверждается данными исследований на других типах клеток (Liu et al., 2016; Wang et al., 2016).
Рис. 4.
Влияние различных концентраций нитропруссида натрия на рост нейритов сенсорных ганглиев 10–12-дневных куриных эмбрионов (3-и сутки культивирования)
По оси ординат – индекс площади эксплантатов (ИП, %).
1 – контрольные значения.
2 – после приложения SNP.
* – различия достоверны относительно контрольных эксплантатов, p < 0.05.
ОБСУЖДЕНИЕ
Анализируя полученные результаты, подчеркнем, что нами изучались первичные сенсорные нейроны, которые характеризуются отсутствием синаптических связей. Хорошо известно, что NO-ергическая система контролирует механизмы внутриклеточной сигнализации именно на этом уровне (Cury et al., 2011). Здесь можно ожидать возникновения тончайшей модуляции ноцицептивной системы со стороны NO-ергической системы. Использование активатора NO-ергической системы (SNP) в наших экспериментах позволило выявить его влияние на первичные сенсорные нейроны, но эти эффекты были получены в случае применения исследуемого агента лишь в относительно высоких концентрациях. Как оказалось, приложение SNP резко ингибирует рост нейритов сенсорных нейронов (рис. 4), что может приводить к цитотоксическому эффекту агента в концентрации, снижающей возбудимость ноцицептивного нейрона (рис. 3). Известно, что зарегистрированное в настоящей работе уменьшение переноса эффективного заряда активационной воротной системы каналов NaV1.8 на организменном уровне должно проявляться в антиноцицептивной реакции (Krylov et al., 2017). Однако практическое использование SNP в качестве анальгетической лекарственной субстанции представляется малоперспективным ввиду негативных побочных эффектов, сопровождающих действие этого агента уже на уровне первичного сенсорного нейрона. Ранее нами были получены данные (Плахова и др., 2016), указывающие на то, что другой активатор NO-ергической системы, L-аргинин, оказывается совершенно неэффективным при воздействии на каналы NaV1.8. Можно предположить, что модуляторы NO-ергической системы, которые найдут свои мишени на синаптических мембранах на спинальном и супраспинальном уровнях, будут более эффективно регулировать ноцицептивную систему, и это в свою очередь сможет в дальнейшем найти практическое применение. Обнаруженное нами модулирование функциональной активности каналов NaV1.8, ответственных за кодирование ноцицептивной информации, со стороны активатора NO-ергической системы (SNP) в первичных сенсорных нейронах реализуется при относительно высоких концентрациях исследуемого агента, что делает его применение небезопасным на организменном уровне (Calabrese et al., 2007). Поэтому поиск новых эффективных и безопасных механизмов запуска антиноцицептивной реакции организма со стороны NO-ергической системы является задачей дальнейших исследований. Полученные результаты позволяют заключить, что антиноцицептивный эффект SNP, основанный на снижении потенциалочувствительности каналов NaV1.8, сопряжен с его негативным ингибирующим действием на развитие эмбриональной нервной ткани теплокровных животных.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 64), гранта РФФИ N 18-015-00071.
Список литературы
Крылов Б.В., Дербенев А.В., Подзорова С.А., Людыно М.И., Кузьмин А.В., Изварина Н.Л. Морфин уменьшает чувствительность к потенциалу медленных натриевых каналов. Российский физиологический журнал им. И.М. Сеченова. 1999. Т. 85. № 2. С. 225–236.
Плахова В.Б., Подзорова С.А., Мищенко И.В., Баграев Н.Т., Клячкин Л.Е., Маляренко А.М., Романов В.В., Крылов Б.В. Возможные механизмы действия инфракрасного излучения на мембрану сенсорного нейрона. Сенсорные системы. 2003. Т. 17. № 1. С. 24–31.
Плахова В.Б., Рогачевский И.В., Шелых Т.Н., Подзорова С.А., Крылов Б.В. Циклический полипептид PP-14 модулирует потенциалочувствительность медленных натриевых каналов. Сенсорные системы. 2016. Т. 30. № 3. С. 234–240.
Ahern G.P., Klyachko V.A., Jackson M.B. cGMP and S-nitrosylation: two routes for modulation of neuronal excitability by NO. Trends in Neurosci. 2002. V. 25. № 10. P. 510–517.
Almers W. Gating currents and charge movements in excitable membranes. Rev. Physiol. Biochem. Pharmacol. 1978. V. 82. P. 97–190.
Borovikova L., Borovikov D., Ermishkin V., Revenko S. The resistance of cutaneous feline C-fiber mechano-heat-sensitive unit termination to tetrodotoxin and its possible relation to tetrodotoxinresistant sodium channels. Prim. Sens. Neuron. 1997. V. 2. № 1. P. 65–75.
Calabrese V., Mancuso C., Calvani M., Rizzarelli E., Butterfield D.A., Stella A.M. Nitric oxide in the central nervous system: neuroprotection versus neurotoxicity. Nat. Rev. Neurosci. 2007. V. 8. № 10. P. 766–775. DOI: https://doi.org/10.1038/nrn2214
Cury Y., Picolo G., Gutierrez V.P., Ferreira S.H. Pain and analgesia: the dual effect of nitric oxide in the nociceptive system. Nitric Oxide. 2011. V. 25. № 3. P. 243–254. https://doi.org/10.1016/j.niox.2011.06.004
Elliott A.A., Elliott J.R. Characterization of TTX-sensitive and TTX-resistant sodium currents in small cells from adult rat dorsal root ganglia. J. Physiol (Lond). 1993. V. 463. № 4. P. 39–56.
Gold M.S., Reichling D.B., Shuster M.J., Levine J.D. Hyperalgesic agents increase a tetrodotoxin-resistant Na+ current in nociceptors. Proc. Natl. Acad. Sci. USA. 1996. V. 93. № 3. P. 1108–1112.
Hamill O.P., Marty A., Neher E., Sakmann B., Sigworth F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers. Arch. 1981. V. 391. № 1. P. 85–100.
Hammarström A.K.M., Gage P.W. Nitric oxide increases persistent sodium current in rat hippocampal neurons. J. Physiol. 1999. V. 520. № 2. P. 451–461.
Hodgkin A.L., Huxley A.F. Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo. J. Physiol. 1952. V. 116. № 4. P. 449–472.
Jarvis M.F., Honore P., Shieh C.C., Chapman M., Joshi S., Zhang X.F., Kort M., Carroll W., Marron B., Atkinson R., Thomas J., Liu D., Krambis M., Liu Y., McGaraughty S., Chu K., Roeloffs R., Zhong C., Mikusa J.P., Hernandez G., Gauvin D., Wade C., Zhu C., Pai M., Scanio M., Shi L., Drizin I., Gregg R., Matulenko M., Hakeem A., Gross M., Johnson M., Marsh K., Wagoner P.K., Sullivan J.P., Faltynek C.R., Krafte D.S. A-803467, a potent and selective Nav1.8 sodium channel blocker, attenuates neuropathic and inflammatory pain in the rat. Proc. Natl. Acad. Sci. USA. 2007. V. 104. № 20. P. 8520–8525. https://doi.org/10.1073/pnas.0611364104
Kostyuk P.G., Krishtal O.A., Pidoplichko V.I. Effect of internal fluoride and phosphate on membrane currents during intracellular dialysis of nerve cells. Nature. 1975. V. 257. № 5528. P. 691–693.
Kostyuk P.G., Veselovsky N.S., Tsyndrenko A.Y. Ionic currents in the somatic membrane of rat dorsal root ganglion neurons – I. Sodium currents. Neuroscience. 1981. V. 6. № 12. P. 2423–2430.
Krylov B.V., Rogachevskii I.V., Shelykh T.N., Plakhova V.B. Frontiers in pain science. Volume 1. New nonopioid analgesics: understanding molecular mechanisms on the basis of patch-clamp and quantumchemical studies. Sharjah, U.A.E., Bentham Science Publishers Ltd., 2017. 203 p.
Liu X., Tang L., Chen B., Jiang W. Role of sodium nitroprusside in regulating retinal ganglion cell damage through mitochondrial transcription factor A. Neurosci. Lett. 2016. V. 635. P. 90–96. DOI: https://doi.org/10.1016/j.neulet.2016.10.045
Lopatina E.V., Yachnev I.L., Penniyaynen V.A., Plakhova V.B., Podzorova S.A., Shelykh T.N, Rogachevsky I.V., Butkevich I.P., Mikhailenko V.A., Kipenko A.V., Krylov B.V. Modulation of signal-transducing function of neuronal membrane Na+,K+-ATPase by endogenous ouabain and low-power infrared radiation leads to pain relief. Med. Chem. 2012. V. 8. № 1. P. 33–39.
Park A.R., Lee H.I., Semjid D., Kim D.K., Chun S.W. Dual effect of exogenous nitric oxide on neuronal excitability in rat substantia gelatinosa neurons. Neural. Plast. 2014. V. 2014. P628531. https://doi.org/10.1155/2014/628531
Tyurenkov I., Perfilova V., Vasil’eva O., Rogachevskii I., Penniyaynen V., Shelykh T., Podzorova S., Krylov B, Plakhova V. GABA- and NO-ergic modulators control antinociceptive responses. Act. Nerv. Super. Rediviva. 2018. V. 60. № 1. P. 1–8.
Wang R., Zhao J., Zhang L., Peng L., Zhang X., Zheng W., Chen H. Genipin derivatives protect RGC-5 from sodium nitroprusside-induced nitrosative stress. Int. J. Mol. Sci. 2016. V. 17. № 1. P. E117. DOI: https://doi.org/10.3390/ijms17010117
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


