Сенсорные системы, 2019, T. 33, № 4, стр. 343-350
Активность нейронов ядра солитарного тракта при стимуляции гипоталамических ядер в норме и после вибрационного воздействия
С. Г. Саркисян 1, М. А. Даниелян 2, В. А. Чавушян 2, *
1 Ереванский государственный университет, Биологический факультет,
Республика Армения
0025 г. Ереван, ул. Алека Манукяна, 1, Армения
2 Институт физиологии им. Л.А. Орбели НАН РА, Республика Армения
0028 г. Ереван, ул. бр. Орбели 22, Армения
* E-mail: verginechavushyan@gmail.com
Поступила в редакцию 25.02.2019
После доработки 29.03.2019
Принята к публикации 15.04.2019
Аннотация
В статье представлены данные экстраклеточной регистрации и математического анализа вызванной импульсной активности нейронов ядра солитарного тракта при высокочастотной стимуляции паравентрикулярного и супраоптического ядер гипоталамуса у крыс в норме и в условиях длительного вибрационного воздействия. Показано, что в норме доминируют ответы в виде тетанической потенциации со стойкой воспроизводимостью в многократных испытаниях. В группе с вибрационным воздействием выявлено понижение числа ответоспособных нейронов и значительное повышение доли таковых, проявляющих постстимульную активацию. Выявленное адаптивное перераспределение баланса возбудительных и тормозных постстимульных ответов в условиях длительного вибрационного воздействия может быть результатом перестройки нейромедиаторных систем гипоталамо-бульбарных проекций. Морфогистохимические результаты выявили при этом снижение активности кислой фосфатазы и тесное взаимодействие нейронов и глиоцитов в качестве интегральной единицы, обеспечивающей выживаемость нейронов в условиях вибрационного воздействия.
ВВЕДЕНИЕ
Перспективным направлением в изучении бульбарных механизмов регуляции гипоталамо-бульбарных функций является выяснение роли в этих процессах реакций нейронов ядра солитарного тракта, на которых оканчиваются первичные афферентные волокна блуждающего нерва. Известно, что ряд ядер продолговатого мозга, в частности, группа ядер вагосолитарного комплекса, а именно ядро солитарного тракта – ЯСТ и дорсальное моторное ядро блуждающего нерва, включаются в механизмы реализации собственных рефлексов внутренних органов (Norgren, 1978; Cottle, Calaresu, 1975). В этом отношении особый интерес представляет нейронная организация гипоталамо-бульбарной системы регуляции висцеральных функций. Данные многочисленных морфологических и электрофизиологических исследований показали, что большинство висцеральных вагусных афферентов оканчиваются в каудальной области ЯСТ (Грин и др., 1983; Hlavacka et al., 1995). Регистрируемые сопряженные изменения артериального давления и дыхания при интерорецептивных раздражениях представляют серьезный аргумент в пользу участия висцеральных афферентов в контроле рефлекторных реакций на бульбарном уровне. Известно, что первое синаптическое переключение афферентных импульсов блуждающего нерва осуществляется на клетках ядра этого тракта. Аксоны вторичных афферентных нейронов блуждающих нервов отдают коллатерали в ретикулярную формацию ствола мозга и, перекрещиваясь на уровне Варолиева моста, входят в состав медиальной петли, заканчивающейся в ядрах таламуса и гипоталамуса (Альтова, 1967; Cottle, Calaresu, 1975). Висцеральная афферентация участвует при этом в формировании трех типов физиологической регуляции: органной, гомеостатической и поведенческой. Вызываемая вибрацией активация первичных сенсорных нейронов ЯСТ доставляется как по полисинаптическим путям ретикулярной формации ствола мозга (Cottle, Calaresu, 1975), так и по афферентным волокнам прямых проекций каудальной висцерорецептивной части ЯСТ в структуры гипоталамуса (Hlavacka et al., 1995). Характер изменения активности отражает процесс переработки висцеральной афферентной импульсации в ЯСТ направленный, возможно, на обеспечение оптимального для данного воздействия уровня функционального состояния бульбарных висцеральных нейронов.
Цель настоящей работы – изучение характеристик импульсной активности нейронов ЯСТ в норме, и в условиях высокочастотной стимуляции паравентрикулярного (ПВЯ) и супраоптического ядер (СОЯ).
МАТЕРИАЛЫ И МЕТОДЫ
Активность гипоталамо-вестибулярных связей у крыс линии Альбино исследовали, регистрируя билатерально спайковую активность одиночных нейронов ЯСТ, вызываемую высокочастотной стимуляцией ПВЯ и CОЯ. Выполняли две серии исследований: первая – на интактных крысах; вторая – на крысах, подвергавшихся предварительному длительному вибрационному воздействию – 15 дней, ежедневно по 2 ч, на вибростенде с колебаниями частотой 60 Гц и амплитудой колебаний в 0.4 мм. Работая в остром эксперименте, животных обездвиживали 1%-ным дитилином (25 мг/кг, в/б), переводили на искусственное дыхание и фиксировали череп в стереотаксическом аппарате. Высокочастотную стимуляцию гипоталамических ядер осуществляли биполярными концентрическими электродами с межэлектродным расстоянием 0.5–0.8 мм и диаметром кончика 30 мкм (прямоугольными толчками тока длительностью 0.05 мс, амплитудой 0.12–0.18 мВ и частотой 100 Гц на протяжении 1 с). Для регистрации импульсной активности одиночных нейронов при высокочастотной стимуляции ипсилатерального (и) и контралатерального (к) ПВЯ и СОЯ (и-ПВЯ, к-ПВЯ, и-СОЯ, к-СОЯ) стереотаксически ориентированные стеклянные микроэлектроды с диаметром кончика 1–2 мкм, заполненные 2М-ным раствором NaCl, вводили в ЯСТ. Отводящий и раздражающий электроды вводились согласно координатам стереотаксического атласа (Paxinos, Watson, 2005). Селекция спайков при регистрации обеспечивалась программой, выполняющей амплитудную дискриминацию с последующим выводом статистически анализированного пре- и постстимульного спайковых потоков (как для единичного, так и для множества нейронов), а также диаграмм усредненной частоты перистимульного спайкинга (разработчик В.С. Каменецкий). Для определения статистической достоверности различий в длительности межспайковых интервалов до и после действия стимула, а также во время высокочастотной тетанической стимуляции использовали непараметрический критерий проверки однородности двух независимых выборок – двухвыборочный критерий Вилкоксона-Манна-Уитни (Wilcoxon-Mann-Whitney test). Так как число регистрируемых спайков при этом было достаточно велико (до нескольких сотен спайков за 20 с до и после действия стимула), в ходе анализа использовали разновидность указанного теста, учитывающую его асимптотическую нормальность – z-тест. Сравнение критических значений с табличными значениями нормального распределения при уровнях значимости 0.05, 0.01 и 0.001 (для различных испытаний), показало, что в результате высокочастотной стимуляции для большинства выборок спайкинга нейрональной активности в этих случаях имели место статистически значимые изменения с уровнем значимости, достигающим 0.05.
Для гистохимических исследований соответствующие участки мозга крыс (1–2 дня) фиксировали в 5%-ном нейтральном формалине, приготовленном на фосфатном буфере. Фронтальные замороженные срезы (40–50 мкм) ЯСТ обрабатывали, выявляя активность Са2+-зависимой кислой фосфатазы (Меликсетян, 2007). После промывки срезы проявляли в 3% -ном растворе сульфида натрия и заключали в канадский бальзам. Все эксперименты выполнялись в соответствии с Xельсинкской Декларацией о гуманном обращении с животными.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Электрофизиологическое исследование
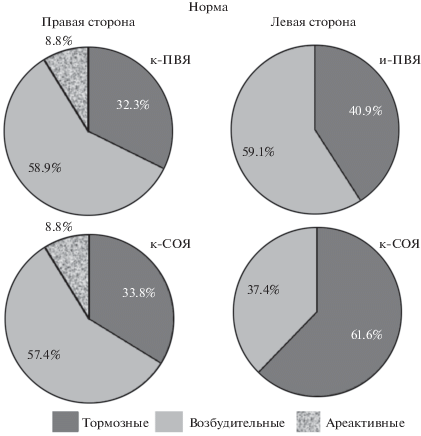
Исследовали характер реакций 108 нейронов ЯСТ интактных животных, из них в правостороннем ЯСТ – 68 нейронов, из коих ареактивными на стимуляцию ПВЯ и СОЯ были по 8.8% нейронов, и в левостороннем – 39 нейронов. Из числа ответоспособных нейронов (68 единиц) правостороннего ЯСТ на стимуляцию к-ПВЯ и и-СОЯ мономодальными к каждому раздражителю были 12 единиц (17.6%), а остальные 56 нейронов были бимодальными, поскольку отвечали на стимуляцию обеих гипоталамических ядер. Эффекты большинства бимодальных нейронов (52.9%) при этом были разнонаправленными. Однонаправленные реакции были зарегистрированы в 20 единицах (29.4%). В 39 реактивных нейронах левостороннего ЯСТ единицы, отвечающие мономодально на стимуляцию и-ПВЯ и к-СОЯ, отсутствовали, а в 30 реактивных нейронах ответы были бимодальными с преобладанием разнонаправленных эффектов (77%); и только лишь в девяти единицах (23%) выявлялись однонаправленные эффекты. Анализ направленности реакций нейронов правостороннего ЯСТ на тетаническую стимуляцию к-ПВЯ и и-СОЯ выявил: практически одинаковый уровень тетанической потенциации (20.6 и 16.2%), посттетанической потенциации (29.4 и 22.0%) и посттетанической депрессии (по 23.5%). При стимуляции и-ПВЯ и к-СОЯ левостороннего ЯСТ распределение ответов по типу реакции было следующим: посттетаническая потенциация была зарегистрирована в 31 и 25.6%, посттетаническая депрессия – в 23 и в 41%, и тетаническая депрессия в сочетании с посттетанической потенциацией в 10.2 и в 10.3% (рис. 1).
Рис. 1.
Долевое соотношение (в %) тормозных, возбудительных и ареактивных типов ответов нейронов правостороннего и левостороннего ядер солитарного тракта (ЯСТ) на высокочастотную стимуляцию гипоталамических ядер в норме. и-ПВЯ – паравентрикулярное ядро ипсилатеральной стороны по отношению к регистрирующему электроду, к-ПВЯ – тоже контралатеральной стороны; и-СОЯ – супраоптическое ядро ипсилатеральной стороны по отношению к регистрирующему электроду, к-СОЯ – тоже контралатеральной стороны; тормозные, возбудительные – типы ответов; ареактивные – ареактивность на ВЧС.
Всего в электрофизиологических исследованиях выполнен анализ 81 нейрона ЯСТ, из них в правостороннем – 36 единиц, и в левостороннем ЯСТ – 45 нейронов после 15-дневного вибрационного воздействия. В первом ареактивными на стимуляцию ПВЯ и СОЯ были 5.8 и 17.6%, во втором – 9.3 и 6.9% нейронов (рис. 2). В правостороннем ЯСТ на стимуляцию к-ПВЯ и и-СОЯ мономодальный характер к каждому раздражителю проявили 23.5% нейронов, а остальные ответоспособные нейроны отвечали на стимуляцию обеих гипоталамических ядер.
Рис. 2.
Долевое соотношение (в %) тормозных, возбудительных и ареактивных типов ответов нейронов правостороннего и левостороннего ядер солитарного тракта (ЯСТ) на высокочастотную стимуляцию гипоталамических ядер после 15-дневного вибрационного воздействия. и-ПВЯ – паравентрикулярное ядро ипсилатеральной стороны по отношению к регистрирующему электроду, к-ПВЯ – тоже контралатеральной стороны; и-СОЯ – супраоптическое ядро ипсилатеральной стороны по отношению к регистрирующему электроду, к-СОЯ – тоже контралатеральной стороны; тормозные, возбудительные – типы ответов; ареактивные – ареактивность на ВЧС.
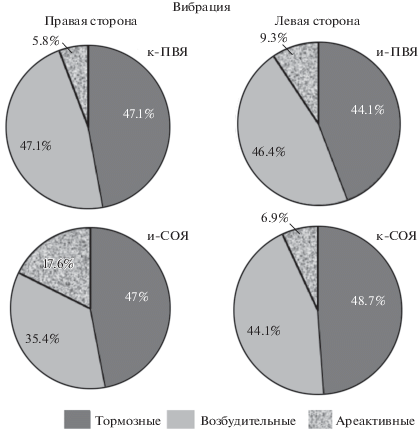
Как отмечалось выше, большинство бимодальных нейронов (58.8%) обладали разнонаправленными эффектами. Однонаправленные реакции были представлены лишь у шести единиц (17.6%). Из 43 реактивных нейронов левостороннего ЯСТ на стимуляцию и-ПВЯ и к-СОЯ 18.6% нейронов проявляли мономодальный тип ответов, а 35 единиц из числа реактивных нейронов были бимодальными с преобладанием разнонаправленных эффектов (51.1%) и только лишь 13 единиц (30.2%) выявляли однонаправленные эффекты.
Анализ характера реакций нейронов правостороннего ЯСТ на тетаническую стимуляцию к-ПВЯ и и-СОЯ обнаружил посттетаническую потенциацию в 29.4%, посттетаническую депрессию в 32.3% и 35.2% соответственно. При стимуляции и-ПВЯ и к-СОЯ левостороннего ЯСТ распределение ответов по типу реакции было таким: посттетаническая потенциация в 25.6 и 37.2% нейронах, посттетаническая депрессия в 11.6 и 27.9%, тетаническая депрессия в сочетании с посттетанической потенциацией в 20.9 и 13.9%.
Гистохимическое исследование
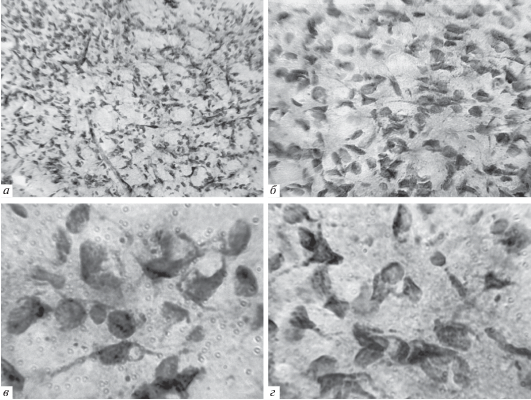
Полученные морфогистохимические данные касались в основном изменений размеров и формы тел нейронов, а также характера реагирования отростков, что имеет большое значение для сравнения пораженных клеток с таковыми у контрольных животных. Немаловажными были также различия в характере осадка фосфата свинца и степени интенсивности окрашивания нервных клеток. Находясь в продолговатом мозге, ЯСТ лежит вблизи дорсального моторного ядра блуждающего нерва и состоит из плотно упакованных мелких клеток, с умеренно выраженной интенсивностью окраски. Контактирующие друг с другом отростки при этом прослеживаются на далеком от тела расстоянии (рис. 3, а–г). Цитоплазма этих клеток окрашена интенсивно из-за высокой активности кислой фосфатазы, и осадок в виде мелких гранул равномерно распределен по телу длинным и коротким отростками. Светлые ядра центрально расположены в цитоплазме нейронов, и в них отчетливо выделяется ядрышко (рис. 3, в, г).
Рис. 3.
Микрофотографии нейронов ядра солитарного тракта мозга интактных крыс (а−е) (отчетливое выявление гранулярного осадка в перикарионах и отростках клеток).
Увеличение: ок. 10, об. 16 (а), 40 (б); 100 (в, г).
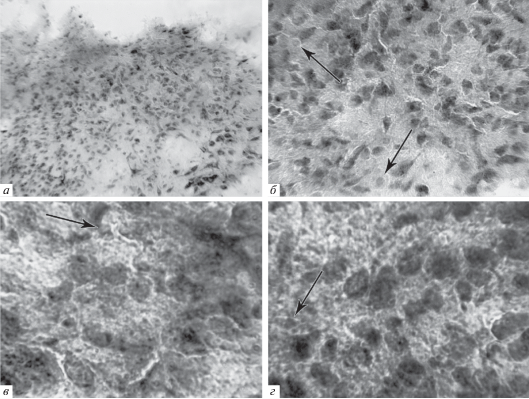
Анализ срезов мозга животных из серии с вибрационным воздействием показал, что вибрация не вызывает особых морфологических изменений клеток ЯСТ (рис. 4, а–г). Результаты свидетельствуют о том, что под воздействием вибрации в ЯСТ в сравнении с интактными животными не наблюдается отчетливого набухания нервных клеток. Форма и размеры нейронов сохранены. У большинства нейронов при этом на соме и отростках обнаруживаются синапсы (рис. 4, в, г). Морфологическая картина напоминает таковую у интактных крыс, за исключением того, что под воздействием вибрации имеет место незначительное снижение ферментной активности нейронов ЯСТ, являющееся результатом изменения обменных процессов (рис. 4, а–г). Подобные морфологические данные со сниженной фосфатазной активностью, с мелкой грануляцией в цитоплазме и в длинных отростках нейронов ЯСТ ранее мы получили у животных, подвергнутых сочетанному воздействию делабиринтации и вибрации (Даниелян, Саркисян, 2017). Снижение процессов фосфорилирования в нейронах является морфологическим доказательством нарушений их метаболизма, однако, благодаря действию компенсаторно-приспособительных механизмов, по-видимому, проявляется также тенденция к восстановлению нормальной морфологической картины. Результаты морфогистохимического анализа в группе животных с вибрацией показали, что патологические сдвиги в нейронах при этом не формируются, а наличие нейронов с нормальными морфологическими характеристиками свидетельствует об их резистентности. Однако вибрация приводит к реакции сателлитной нейроглии, весьма чувствительной к действиям различного рода повреждающих факторов (рис. 4, б–г). Реакции сателлитной нейроглии играют в обменных процессах нервной ткани большую роль (Verkhratsky et al., 2006). Вероятно, в данном случае проявляется защитная реакция глиоцитов по отношению к нейронам, что соответствует современным представлениям о существовании тесного взаимодействия нейрона и глиоцита, составляющих интегральную единицу. Вибрация вызывает пролиферацию глиоцитов, что приводит к очистке продуктов дистрофического расщепления. Как было показано ранее, глиальные клетки являются партнерами в формировании и функционировании синапсов (Eroglu et al., 2008).
Рис. 4.
Микрофотографии нейронов ядра солитарного тракта мозга крыс, подвергнутых вибрации (а–г) (форма и размеры клеток не нарушены, глиоз). Стрелками указаны ядра нейроглии.
Увеличение: ок. 10, об.16 (а), 40 (б); 100 (в, г).
Снижение процессов фосфорилирования в ряде нейронов ЯСТ является морфологическим доказательством расстройства их метаболизма, однако, анализируя изложенные данные, можно сказать, что под воздействием вибрации, благодаря действию в организме компенсаторно-приспособительных механизмов, в нейронах ЯСТ сохраняется морфологическая картина, близкая к таковой у интактных животных.
Согласно данным последних лет, можно предположить, что вибрационный синдром обусловливает развитие нарушений функций ЦНС (Hirata, Sakakibara, 2008). Авторы работы Милева и соавт. (Mileva et al., 2009) утверждают, что вибрация альтерирует внутрикорковые процессы, и патологические изменения наблюдаются при этом в стволе мозга, диэнцефальных структурах (Katmanova et al., 2010), и даже в отсутствие реального движения периферическая сенсорная стимуляция может вызвать длительное повышение кортикоспинальной возбудимости (Forner-Cordero et al., 2008). В целом локальная вибрация и шум способствуют формированию у людей однонаправленных механизмов патологического ответа (Kartapol’tseva, Katamanova, 2009). Более того, повторная мышечная вибрация, приложенная в течение произвольного сокращения, может вызвать пролонгированные изменения в возбудительно/тормозном статусе первичной моторной коры и может служить важным шагом в реабилитации моторных заболеваний (Marconi et al., 2008). В последние годы было показано также, что вибрация, наложенная на тоническое сокращение, вызывает длительные пластические сдвиги, в то время как при суммации с одиночными сокращениями она неэффективна (Christova et al., 2010). Когда в процесс вовлекаются главным образом собственно внутрикорковые механизмы, а спинальная адаптация исключается, это в перспективе может служить в качестве терапевтического содействия функциональному восстановлению моторного дефицита (Christova et al., 2010).
Интенсивное изучение молекулярных основ дисфункции вестибулярной системы, выживания/поддержания вестибулярных нейронов и иннервации сенсорных мишеней подтверждают критическую вовлеченность TrkB (tyrosine kinase B) в структуральный аспект пластичности сенсорных нейронов (Sciarretta et al., 2010). BDNF (Вrain Derive Neurotrophic Factor) и TrkB имеют важную роль в контролировании функций ствола мозга (движения, баланса) и TrkB-рецепторы наиболее высокочувствительные компоненты этой системы (Tang et al., 2010). Нейротрофические факторы регулируют ряд нейрональных функций при повреждении ЦНС, в том числе модулируют нейрональное выживание и рост аксона (Huang, Reichardt, 2001).
Наши результаты согласуются также с представлениями о прямых проекциях от гипоталамических ядер к ЯСТ (Kooy et al., 1984), и ключевой роли кратковременных изменений активности ингибиторных нейронов в облегчении синаптической интеграции в ЯСТ (Grabauskas, Bradley, 1998). Механизмы, опосредующие гомеостатическую пластичность, разнообразны и включают как минимум изменения возбудимости, возникающие в результате изменения числа, свойств или локализации ионных каналов; пре- и постсинаптические изменения силы возбуждающих и тормозных синапсов, а также изменения количества этих синапсов (Tatti et al., 2017). Сохранение баланса возбуждение/торможение в синаптической передаче, очевидно, является решающим для сохранения стабильности функций нервных цепей в целом, и в частности звена гипоталамус – ЯСТ.
Список литературы
Альтова Л.С. Экспериментально-морфологические данные о внутристволовых связях блуждающего нерва. Организация межнейронных связей. М. 1967.
Грин З.А., Ибрагимов И.И., Вайнеровская А.И. Функциональные нарушения сердечно-сосудистой системы при вибрационной болезни. Гигиена труда и профзаболеваний. 1983. Т. 12. № 4. С. 26–28.
Даниелян М.А., Саркисян С.Г. Морфофункциональные изменения в ядре солитарного тракта крыс после лабиринтэктомии в комплексе с вибрацией. Вестник Башкирского гос. мед. ун-та. Уфа. 2017. № 4. С. 60–66.
Меликсетян И.Б. Выявление активности Са2+ – зависимой кислой фосфатазы в клеточных структурах мозга крыс. Морфология. СПБ. 2007. Т. 131. № 2. С. 77–80.
Christova M., Rafolt D., Mayr W., Wilfling B., Gallasch E. Vibration stimulation during non-fatiguing tonic contraction induces outlasting neuroplastic effects. J. Electromyogr. Kinesiol. 2010. V. 20. № 4. P. 627–635. https://doi.org/10.1016/j.jelekin.2010.03.001
Cottle M.K., Calaresu F.R. Projections from the nucleus of tractussolitarius in the rat. J. Comp. Neurol. 1975. V. 161. № 1. P. 143–152. https://doi.org/10.1002/cne.901610202
Eroglu C., Barres B.A., Stevens B. Glia as active paricipants in the development and function of synapses . Eds Hell J,, Ehlers M., Structural and Functional Organization of the Synapse. Springer. 2008. P. 683–714. https://doi.org/10.1007/978-0-387-77232-5_23
Forner-Cordero A., Steyvers M., Levin O., Alaerts K., Swinnen S.P. Changes in corticomotor excitability following prolonged muscle tendon vibration. Behav. Brain Res. 2008. V. 190. № 1. P. 41–49. https://doi.org/10.1016/j.bbr.2008.02.019
Grabauskas G., Bradley R.M. Tetanic stimulation induces short-term potentiation of inhibitory synaptic activity in the rostral nucleus of the solitary tract. J. Neurophysiol. 1998. V. 79. P. 595–604. https://doi.org/10.1152/jn.1998.79.2.595
Hirata M., Sakakibara H. Visually-evoked P300 and NOGO potentials as indicators of central nervous system function in patients with vibration syndrome. Int. Arch. Occup. Environ Health. 2008. V. 82. № 1. P. 79–85. https://doi.org/10.1007/s00420-008-0309-1
Hlavacka F., Krizkova M., Horak F.B. Modification of human postural response to leg muscle vibration by electrical vestibular stimulation. Neuroscince Letter. 1995. V. 189. № 1. P. 9–18. PMID:7603629
Huang E.J., Reichardt L.F. Neurotrophins: roles in neuronal development and function. Annu Rev Neurosci. 2001. V. 24. P. 677–736. https://doi.org/10.1146/annurev.neuro.24.1.677
Kartapol’tseva N.V., Katamanova E.V. Characteristics of long latent auditory evoked potentials under workers' exposure to occupational local vibration and noise. Med. Tr. Prom. Ekol. 2009. № 1. P. 15–18. PMID:19278186
Katmanova E.V., Lakhman O.L, Nurbaeva D.Zh., Kartapol’tseva N.V., Sudakova N.G. Bioelectric brain activity under exposure to vibration. Med. Tr. Prom. Ekol. 2010. № 7. P. 6–9. PMID:20853622
Kooy D., Koda L.Y., McGinty J.F., Gerfen Ch.R., Bloom F.E. The organization of projections from the cortes, amygdala, and hypothalamus to the nucleus of the solitary tract in rat. Journal Comparative Neurology. 1984. V. 224. P. 1–24. DOI.org/10.1002/cne.902240102
Marconi B., Filippi G.M., Koch G., Pecchioli C., Salerno S., Don R., Camerota F., Saraceni V.M., Caltagirone C. Long-term effects on motor cortical excitability induced by repeated muscle vibration during contraction in healthy subjects. J. Neurol. Sci. 2008. V. 275. № 1–2. P. 51–59. https://doi.org/10.1016/j.jns.2008.07.025
Mileva K.N., Bowtell J.L., Kossev A.R. Effects of low-frequency whole-body vibration on motor-evoked potentials in healthy men. Exp. Physiol. 2009. V. 94. № 1. P. 103–116. https://doi.org/10.1113/expphysiol.2008.042689
Norgren R. Projections from the nucleus of the solitary tract in the rat. Neuroscience. 1978. V. 3. № 2. P. 207–218. PMID:733004
Paxinos G.,Watson Ch. The rat brain in stereotaxic coordinates. NewYork: Acad. Press, 2005. 376 p.
Sciarretta C., Fritzsch B., Beisel K., Rocha-Sanchez S.M., Buniello A., Horn J.M. PLCγ-activated signalling is essential for TrkB mediated sensory neuron structural plasticity. BMC Developmental Biology. 2010. V. 10. № 1. P. 103. https://doi.org/10.1186/1471-213X-10-103
Tang S., Machaalani R., Waters K.A. Immunolocalisation of pro- and mature-brain derived neurotrophic factor (BDNF) and receptor TrkB in the human brainstem and hippocampus. Brain Res. 2010. P. 1–14. https://doi.org/10.1016/j.biopsych.2010.07.051
Tatti R, Haley M.S., Swanson O.K., Tselha T., Maffei A. Neurophysiology and Regulation of the Balance Between Excitation and Inhibition in Neocortical Circuits. Biol Psychiatry. 2017. V. 81 (10). P. 821–831. https://doi.org/10.1016/j.biopsych.2016.09.017
Verkhratsky A., Toescu E.C. Neuronal-glial networks as substrate for CNS integration. J. Cell. Mol. Med., 2006. V.10. № 4. P. 826–836. PMID:17125587
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


