Сенсорные системы, 2021, T. 35, № 1, стр. 3-10
Оммохромы сложного глаза насекомых: антигликирующее действие
А. Е. Донцов 1, *, М. А. Яковлева 1, М. А. Островский 1
1 ФГБУН Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, д. 4, Россия
* E-mail: adontsovnick@yahoo.com
Поступила в редакцию 14.10.2020
После доработки 20.10.2020
Принята к публикации 02.11.2020
Аннотация
Оммохромы – экранирующие и антиоксидантные органеллы сложного глаза беспозвоночных животных выполняют функцию светофильтрации, светопоглощения и антиоксидантной защиты. В настоящей работе впервые обнаружено, что оммохромы in vitro проявляют антигликирующую активность. Оммохромы были получены из глаз насекомых трех различных семейств: Strationyidae, Sphingidae и Acrididae. Показано, что все изученные оммохромы ингибировали реакцию образования флуоресцирующих продуктов модификации сывороточного альбумина в присутствии высоких концентраций фруктозы (фруктозилирование). Оммохромы из глаз мухи “черная львинка” (Hermetia illucens) были наиболее эффективными ингибиторами процесса фруктозилирования. Оммохромы, окисленные пероксидом водорода, не проявляли ингибирующего действия в отношении процесса гликирования. Полученные результаты представляют интерес как для понимания биологической роли оммохромов у беспозвоночных животных, в частности, для выяснения их влияния на окислительную модификацию белков ретинулярных и пигментных клеток омматидия, так и для создания на их основе фармакологических препаратов для лечения и предотвращения патологий, связанных с развитием метаболического синдрома.
ВВЕДЕНИЕ
Природные органические пигменты оммохромы широко распространены среди беспозвоночных животных и особенно характерны для различных членистоногих (тип Arthropoda) (Butenandt, Sсhafer, 1962). Оммохромы синтезируются из триптофана через промежуточное образование кинуренина (Linzen, 1974). Оммохромы, как правило, подразделяют на три различных класса – омматины, оммины и оммидины. Структура и химические свойства омматинов довольно хорошо изучены, в то время как пока немного известно относительно двух других групп оммохромов. Экранирующие пигменты беспозвоночных животных, как и меланины позвоночных, локализуются в специфических оммохромных гранулах или оммохромосомах (Figon, Casas, 2019). Гранулы, содержащие экранирующий пигмент, присущи почти всем клеткам, составляющим омматидий. В глазах беспозвоночных оммохромы локализуются как в пигментных, так и в рецепторных ретинулярных клетках. Количество оммохромов, содержащихся в глазах членистоногих, довольно высокое. Так, например, сухой вес оммохромов в глазах реликтовой креветки (Mysis relicta) может достигать 20% от общего веса глаза, а концентрация оммохромов в глазу мухи “черная львинка” (Hermetia illucens) достигает 90 мг/мл (Dontsov et al., 1999; Донцов и др., 2020).
Основные функции оммохромов, как экранирующих пигментов глаза, это: защита фоторецепторных элементов ретинулярных клеток в ходе световой адаптации; экранирование отдельных омматидиев друг от друга и повышение, таким образом, разрешающей способности глаза; регулировка спектральной чувствительности фоторецепторов, а также раскраска кожных покровов (Langer, 1975; Грибакин, Чеснокова, 1984; Островский и др., 2018). Наряду с оптической, оммохромы также могут участвовать в регуляции клеточного гомеостаза путем детоксикации свободного триптофана и ослаблении оксидативного стресса (Figon, Casas, 2019). Регуляция оксидативного стресса оммохромами связана с их способностью быть как донорами, так и акцепторами электронов и функционировать как эффективные антиоксидантные молекулы (Ostrovsky et al., 1987; Insausti et al., 2013; Romero, Martinez, 2015; Farmer et al., 2017; Dontsov, Ostrovsky, 2019; Островский, Донцов, 2019). Высокая антиоксидантная активность оммохромов, выделенных из глаз различных насекомых, была показана нами ранее (Ushakova et al., 2019; Донцов и др., 2020).
Хорошо известно, что антиоксиданты могут подавлять развитие реакции Майяра (Edeas et al., 2010). Реакция Майяра или не-энзиматическое гликирование – это сложный реакционный процесс между альдегидными (или кетонными) группами редуцирующих сахаров и аминогруппами белков, в результате которого образуются так называемые поздние продукты гликирования (ППГ). Считается, что ППГ, аккумулирующиеся в клетках в результате гипергликемии, один из основных факторов риска развития таких возрастных заболеваний, как разные формы диабета, в том числе диабетические атеросклероз и катаракта (Lapolla et al., 2005), возрастная макулярная дегенерация сетчатки и сердечно-сосудистые заболевания (Chiu, Taylor, 2011; Uchiki et al., 2012). Так, известно, что избыток фруктозы может приводить к усилению биохимических изменений, способствующих развитию метаболического синдрома и диабета 2-го типа (Gugliucci, 2017). В связи с этим очень важен поиск новых антиоксидантов, способных ингибировать развитие реакции Майяра при гипергликемии. Ранее мы показали, что как природные, так и синтетические антиоксиданты способны подавлять развитие не-энзиматической модификации белков, вызванной избыточными концентрациями фруктозы (Донцов и др., 2017; Донцов и др., 2019). Цель настоящей работы – получение оммохромов из различных насекомых и исследование их антигликирующей активности.
МЕТОДИКА
В работе использовали реактивы фирм “Sigma-Aldrich” (США), “Fluka” (Швейцария) и “Компонент-реактив” (Россия).
Выделение оммохромов. Оммохромы были выделены из трех видов насекомых: мухи “черная львинка” (Hermetia illucens, семейство Strationyidae), бабочки “бражник табачный” (Manduca sexta, семейство Sphingidae) и саранчи пустынной (Schistocerca gregaria, семейство Acrididae), чистые культуры которых были получены из Института проблем экологии и эволюции им. А.Н. Северцева РАН и из энтомологического отдела Московского зоопарка. Экстракцию и очистку оммохромов проводили из голов насекомых без их гомогенизации по стандартной методике (Донцов и др., 2020). Оммохромы из полученных экстрактов осаждали 20%-ным раствором аммиака, центрифугировали при 5000× g в течение 15 мин и высушивали в эксикаторе над слоем безводного хлорида кальция. Для исследования использовали либо растворы оммохромов в метаноле, содержащем 0.5%-ный хлористый водород (MeOH-HCL), либо тонко дисперсные взвеси в 0.1 М K-фосфатном буфере, рН 7.4.
Получение окисленных и восстановленных оммохромов. Окисленные оммохромы получали путем окисления исходных оммохромов избытком пероксида водорода. Для этого суспензию пигментов (2–3 мг/мл) в 0.1 М K-фосфатном буфере, рН 7.4, или раствор оммохромов в MeOH–HCl (0.5–1.0 мг/мл) инкубировали в присутствии 200 мМ пероксида водорода не менее 1 ч. После чего оммохромы осаждали 20%-ным раствором аммиака и отмывали от избытка пероксида водорода дистиллированной водой. Восстановленные оммохромы получали путем восстановления исходных оммохромов избытком аскорбата натрия (50 мМ) с последующим осаждением и отмывкой оммохромов от избытка восстановителя.
Анализ экстрактов оммохромов. Анализ экстрактов оммохромов проводили методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хроматографе фирмы “Knauer” (Германия) с колонкой “Диасфер 120 С18” (4 × 250 мм, размер сорбента 5 мкм). Растворитель А – 10% ацетонитрил + 90% воды (+0.5% муравьиной кислоты). Растворитель Б – 100% ацетонитрил (+0.5% муравьиной кислоты). Разделение осуществляли путем линейного градиентного элюирования в системе: от 100%-ного растворителя А до 60%-ного растворителя А и 40%-ного растворителя Б за 60 мин, скорость потока 0.4 мл/мин. Температура колонки 24°С. Продукты хроматографического разделения измеряли при помощи фотометрического детектора “Knauer К-2501”, а также флуориметрического детектора (RF-10A-xl, Shimadzu). Образец оммохромов или стандарта растворяли в 100 мкл смеси метанола с 0.5%-ным HCl. Для работы использовали готовые стандарты: триптофан, кинуренин, 3-гидроксикинуренин, ксантуреновая кислота фирмы “Sigma”. Ксантоматин был синтезирован путем окисления 3-гидроксикинуренина феррицианидом калия, согласно методике, описанной ранее (Butenandt et al., 1954). Спектры оптического поглощения измеряли на спектрофотометре “Shimadzu UV–1601PC” (Япония). Спектры флуоресценции регистрировали на флуориметре “Shimadzu RF-5301PC” (Япония). Для обработки полученных данных использовали программное обеспечение RFPC версия 2.0 (“Shimadzu”).
Фруктозилирование альбумина. В качестве субстрата гликирования и карбонилирования использовали бычий сывороточный альбумин (БСА). Для модификации БСА в процессе гликирования в качестве редуцирующего сахара использовали фруктозу. Фруктоза в 8–10 раз более реакционноспособна, чем глюкоза в формировании продуктов реакции Майяра (Suarez et al., 1991; Dontsov et al., 2016). Поэтому гликирование в присутствии фруктозы (фруктозилирование) значительно быстрее приводит к накоплению флуоресцирующих белковых аддуктов. Среда инкубации содержала: 0.1 M калий-фосфатный буфер, pH 7.4; 50 мМ фруктоза, 2–4 мг/мл БСА, 2–5 мМ азид натрия и оммохромы в разных концентрациях. В качестве контрольных образцов использовали пробы, содержащие оммохромы и не содержащие фруктозу, а также пробы без оммохромов. Образцы инкубировали при 37°C в темноте при постоянном перемешивании в течение 1–5 сут. После инкубации аликвоты образцов диализовали против фосфатного буфера для удаления непрореагировавших низкомолекулярных молекул. Для диализа использовали целлюлозно-эфирную мембрану Float-A-Lyser (“SPECTRUM Labs”, США), пропускающую молекулы с молекулярной массой менее 3.5 кДа. Диализ проводили в течение 25 ч при 6°C. После диализа измеряли интенсивность эмиссионного максимума флуоресценции модифицированного альбумина при длине волны 435 нм (длина волны возбуждающего света 365 нм). Скорость модификации БСА выражали как скорость накопления флуоресцирующих продуктов в альбумине (амплитуда эмиссии в условных единицах) за 1 ч реакции.
Карбонилирование БСА осуществляли при помощи метилглиоксаля. Образцы, содержащие 0.1 M калий-фосфатный буфер (pH 7.4), 2–5 мМ метилглиоксаля, 2–4 мг/мл БСА и разные концентрации оммохромов, инкубировали в темноте при 37°C в течение 2–40 ч при постоянном перемешивании. Контрольные пробы не содержали оммохромы или содержали оммохромы и метил-глиоксаль в отсутствие БСА. После инкубации аликвоты образцов обрабатывали также, как и при фруктозилировании БСА и измеряли флуоресценцию при длинах волн возбуждающего света 365 и 460 нм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
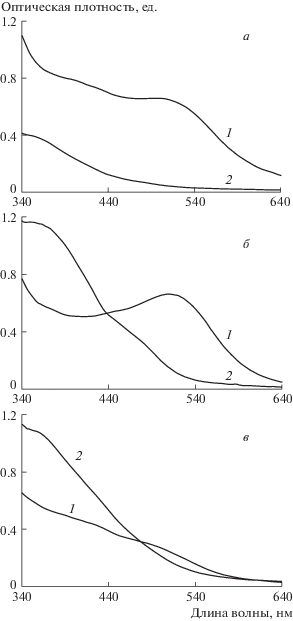
Абсорбционные спектры окисленных и восстановленных оммохромов
Спектры поглощения изолированных оммохромов насекомых в восстановленном (1) и окисленном состоянии (2) для видимой и УФА области спектра приведены на рис. 1. Наиболее длинноволновый максимум поглощения был характерен для восстановленных оммохромов бабочки “бражник табачный” (508 нм – б). Восстановленные оммохромы мухи “черная львинка” и пустынной саранчи имели максимумы поглощения при 490 и 483 нм (а и в) соответственно. Оммохромы саранчи пустынной не показывали выраженного максимума поглощения в видимой области спектра, демонстрируя лишь “плечо” в области 483 нм (в). Максимумы поглощения оммохромов при 430–490 нм в основном присущи для пигментов из класса омматинов, а максимумы поглощения при 520 нм и выше характерны для класса омминов (Butenandt, Sсhafer, 1962). Абсорбционные спектры оммохромов мухи “черная львинка” и пустынной саранчи более характерны для спектров омматинов; абсорбционный спектр бабочки “бражник табачный” имеет промежуточный характер, что может быть связано с наличием у них двух типов оммохромов – омматинов и омминов. Окисление оммохромов пероксидом водорода приводит к исчезновению выраженного максимума поглощения в видимой области спектра (кривая 2), что может быть связано с окислением феноксазиновой группы оммохромов и с их частичной окислительной деструкцией.
Действие оммохромов глаза насекомых на накопление флуоресцирующих продуктов реакции БСА с фруктозой и метилглиоксалем
В экспериментах исследовали влияние оммохромов на процесс гликирования БСА в присутствии высоких концентраций фруктозы (рис. 2,а). Поскольку этот процесс представляет собой последовательную серию химических реакций между карбонильной группой фруктозы и аминогруппами БСА с формированием на начальной стадии реакции флуоресцирующих оснований Шиффа, в экспериментах измеряли кинетику нарастания интенсивности флуоресценции при длине волны возбуждения 365 нм. Мы обнаружили, что оммохромы в диапазоне концентраций от 50–250 мкг/мл значительно угнетали процесс фруктозилирования БСА. Инкубация БСА в присутствии фруктозы в течение 72 ч приводит к значительному увеличению флуоресценции белка (в 8–10 раз) по сравнению с образцами, не содержащими фруктозу (а, кривая 1). Это свидетельствует о протекании процесса модификации белка с образованием шиффовых оснований. Оммохромы мухи “черная львинка” в концентрации 75 мкг/мл более чем в 2 раза снижали интенсивность флуоресценции БСА за тот же период инкубации (а, кривая 2), что свидетельствует о довольно хорошей ингибирующей активности оммохромов. Концентрационная зависимость ингибирующего действия оммохромов мухи “черная львинка” на процесс фруктозилирования БСА приведена на б. Кривая концентрационной зависимости не линейна и постепенно выходит на насыщение. При концентрациях оммохромов мухи, достигающих 150 мкг/мл, наблюдается примерно 65–70% ингибирования процесса фруктозилирования. Практически полное ингибирование процесса фруктозилирования БСА (≥90%) достигается при концентрации оммохромов мухи “черная львинка”, превышающих 250 мкг/мл. Именно эта концентрация оммохромов была использована для сравнения ингибирующего действия пигментов, изолированных из различных насекомых (рис. 3). Присутствие оммохромов всех трех видов насекомых в этой концентрации приводило к значительному ингибированию процесса фруктозилирования БСА, причем оммохромы мухи “черная львинка” проявляли наибольшую ингибирующую активность (1), а оммохромы бабочки “бражник табачный” и пустынной саранчи проявляли примерно равное ингибирующее действие на этот процесс (2 и 3 соответственно). Результаты экспериментов свидетельствуют о том, что оммохромы проявляют защитное действие на процесс фруктозилирования белка на стадии формирования флуоресцирующих продуктов в реакции Майяра. Механизм антигликирующего действия оммохромов неясен, но, по-видимому, связан со способностью оммохромов, как антиоксидантов, подавлять развитие процесса фруктозилирования. В то же время на модификацию БСА, уже сформировавшимися ППГ, оммохромы, по-видимому, не оказывают существенного влияния. В наших экспериментах модификация БСА метилглиоксалем не ингибировалась оммохромами мухи “черная львинка” (на рисунке не показано). Более того, в отсутствие БСА метилглиоксаль, по-видимому, реагировал с оммохромами, образуя флуоресцирующий продукт с максимумом эмиссии при 450 нм. Природа этого продукта не известна, однако можно предположить, что это вещество не способно проявлять ингибирующее действие на процесс гликирования.
Рис. 2.
Ингибирующее действие оммохромов мухи “черная львинка” на процесс фруктозилирования БСА. а – дифференциальный спектр эмиссии модифицированного фруктозой БСА в контроле (1) и в присутствии 75 мкг/мл оммохромов (2); б – зависимость ингибирования реакции модификации БСА фруктозой от концентрации оммохромов. Инкубацию проводили при постоянном перемешивании в течение 72 ч при 37°С. Длина волны возбуждающего света – 365 нм.
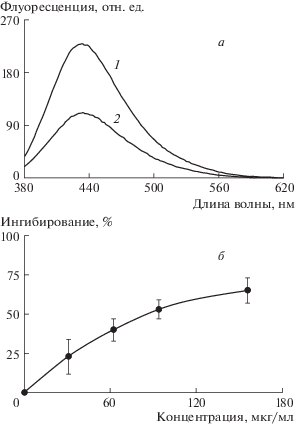
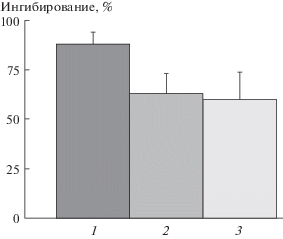
Рис. 3.
Сравнение степени ингибирования модификации БСА фруктозой оммохромами различных насекомых. 1 – оммохромы мухи “черная львинка”; 2 – оммохромы бабочки “бражник табачный”; 3 – оммохромы пустынной саранчи. Концентрация оммохромов была одинаковой для всех видов и составляла 250 мкг/мл. Процент ингибирования рассчитывали как среднее трех различных определений.
Сравнение ингибирующего действия восстановленных и окисленных оммохромов
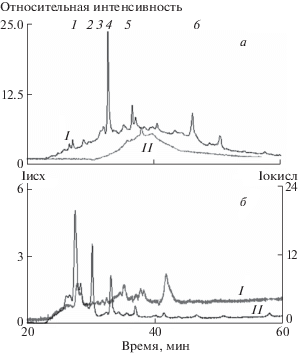
В отличие от оммохромов, находящихся в восстановленном виде, окисленные оммохромы не проявляли способности ингибировать фруктозилирование БСА. На рис. 4 показано сравнительное действие исходных (восстановленных) оммохромов мухи “черная львинка” и оммохромов, окисленных пероксидом водорода, на процесс фруктозилирования БСА. Видно, что в одинаковых концентрациях окисленные оммохромы, в отличие от восстановленных, практически не уменьшали скорости модификации БСА фруктозой (рис. 4, 3). Это связано, вероятно, со значительными изменениями в составе оммохромов. Рисунок 5 демонстрирует сравнительные хроматограммы исходных (I) и окисленных (II) оммохромов мухи “черная львинка”. Хорошо видны значительные изменения в составе оммохромов после их окисления пероксидом водорода. Наблюдается исчезновение некоторых пиков, характерных для исходных оммохромов, например, ксантомматинового пика, и появление новых пиков, не присущих исходным оммохромам (а и б). Вероятно, это связано с частичной окислительной деструкцией оммохромов, потерей ими свободно радикальных свойств и антирадикальной активности (Ushakova et al., 2019; Донцов и др., 2020). В результате окисление оммохромов приводит к потере ими антиоксидантной и антигликирующей активности. Обнаруженное свойство оммохромов проявлять антиоксидантное и анти-гликирующее действие в зависимости от их окислительно-восстановительного состояния может расширить наши представления о регуляции окислительной модификации белков в клетках глаза.
Рис. 4.
Сравнение ингибирующего действия нативных и окисленных оммохромов. 1 – контроль без оммохромов; 2 – добавлено 100 мкг/мл оммохромов мухи “черная львинка”; 3 – добавлено 100 мкг/мл окисленных оммохромов мухи “черная львинка”. Скорость модификации БСА рассчитывали как среднее трех различных определений.
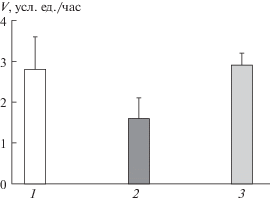
Рис. 5.
Сравнительная хроматография исходных (I) и окисленных (II) оммохромов из глаз мухи “черная львинка”. а – детектирование по поглощению на длине волны 490 нм; б – детектирование по флуоресценции на длине волны 520 нм при возбуждении длиной волны 460 нм. Оммохромы были окислены пероксидом водорода. Пики: 1 – ксантуреновая кислота, 2 – декарбоксилированный ксантомматин, 4 – ксантомматин. Для хроматограмм с детектированием по флуоресценции (б) показаны отдельные оси ординат для образцов I и II.
Важно, что оммохромы, которые могут быть легко получены в больших количествах из промышленно разводимых насекомых, могут быть использованы в фармакологической практике для создания новых средств для предотвращения и лечения заболеваний, связанных с накоплением в клетках ППГ в результате гипергликемии. Накопление ППГ имеет место при старении, диабете, артритах, атеросклерозе, хронической почечной недостаточности, нефропатии, нейропатии, болезни Альцгеймера, а также при таких глазных заболеваниях, как катаракта, возрастная макулярная дегенерация, диабетическая ретинопатия. Лекарственные препараты на основе оммохромов могли бы оказаться при этих патологиях, в том числе при глазных, очень полезными.
Работа выполнена при финансовой поддержке РФФИ (грант № 19-04-00411).
Список литературы
Грибакин Ф.Г., Чеснокова Е.Г. Использование глазных мутантов для исследования физиологии зрения насекомых. Успехи соврем. биологии. 1984. Т. 97. С. 69–82.
Донцов А.Е., Зак П.П., Островский М.А., Воспельникова Н.Д. Антигликирующее действие мелатонина. Доклады РАН. 2017. Т. 475. № 5. С. 1–4.
Донцов А.Е., Сакина Н.Л., Кузнецов Ю.В., Островский М.А. Антиоксидантные и антигликирующие свойства N-ацетилцистеината-6-гидрокси-2-амино-бензотиазола. Химическая физика. 2019. Т. 38. № 12. С. 54–58.
Донцов А.Е., Сакина Н.Л., Яковлева М.А., Бастраков А.И., Бастракова И.Г., Загоринский А.А., Ушакова Н.А., Фельдман Т.Б., Островский М.А. Оммохромы сложного глаза насекомых: физико-химические свойства и антиоксидантная активность. Биохимия. 2020. Т. 85. № 6. С. 783–795.
Островский М.А., Донцов А.Е. Меланосомы глаза позвоночных и оммохромы глаза беспозвоночных как антиоксидантные клеточные органеллы. Известия РАН. Серия биологическая. 2019. № 1. С. 95–108,
Островский М.А., Зак П.П., Донцов А.Е. Меланосомы глаза позвоночных и оммохромы глаза беспозвоночных как экранирующие клеточные органеллы. Известия РАН. Серия биологическая. 2018. № 6. С. 638–648.
Butenandt A., Schafer W. Recent Progress in the Chemistry of Natural and Synthetic Coloring Matters and Related Fields. Eds Gore T.S. Acad. Press. NY. USA. 1962. P. 13–34. https://doi.org/10.1177/004051756303300710
Butenandt A., Schiedt U., Biekert E. Uber Ommochrome, III. Mitteilung: Synthese des Xanthommatins. Eur. JOC. 1954. V. 258 (2). P. 106–116.
Chiu C.-J., Taylor A. Dietary hyperglycemia, glycemic index and metabolic retinal diseases. Prog. Retin. Eye Res. 2011. V. 30 (1). P. 18–53. https://doi.org/10.1016/j.preteyeres.2010.09.001
Dontsov A., Koromyslova A., Ostrovsky M., Sakina N. Lipofuscins prepared by modification of photoreceptor cells via glycation or lipid peroxidation show the similar phototoxicity. World J. Exp. Med. 2016. V. 6. P. 63–79.
Dontsov A.E., Fedorovich I.B., Lindstrom M., Ostrovsky M.A. Comparative study of spectral and antioxidant properties of pigments from the eyes of two Mysis relicta populations, with different light damage resistance. J. Comp. Physiol. B. 1999. V. 169. P. 157–164.
Dontsov A.E., Ostrovsky M.A. Screening Eye Pigments as Natural Antioxidants. Antioxidants in Systems of Varying Complexity: Chemical, Biochemical, and Biological Aspects. Eds Shishkina L.N. et al., CRC Press. Apple Acad. Press Inc. Oakville. Canada; Palm Bay. USA. 2019. P. 141–178.
Edeas M., Attaf D., Mailfert A.-S., Nasu M., Joubet R. Maillard reaction, mitochondria and oxidative stress: potential role of antioxidants. Pathol. Biol (Paris). 2010. V. 58 (3). P. 220–225. https://doi.org/10.1016/j.patbio.2009.09.011
Farmer L.A., Haidasz E.A., Griesser M., and Pratt D.A. Phenoxazine: a privileged scaffold for radical-trapping antioxidants. J. Org. Chem. 2017. V. 82. P. 10523–10536. https://doi.org/10.1021/acs.joc.7b02025
Figon F., Casas J. Ommochromes in invertebrates: biochemistry and cell biology. Biol. Rev. Camb. Philos. Soc. 2019. V. 94. P. 156–183. https://doi.org/10.1111/brv.12441
Gugliucci A. Formation of fructose-mediated advanced glycation end products and their roles in metabolic and inflammatory diseases. Adv. Nutr. 2017. V. 8. P. 54–62. https://doi.org/10.3945/an.116.013912
Insausti T.C., LeGall M., and Lazzari C.R. Oxidative stress, photodamage and the role of screening pigments in insect eyes. J. Exp. Biol. 2013. V. 216. P. 3200–3207. https://doi.org/10.1242/jeb.082818
Langer H. Properties and functions of screening pigments in insect eyes. Photoreceptor optics. Berlin; New York: Springer. 1975. P. 429–455.
Lapolla A., Traldi P., Fedele D. Importance of measuring products of non-enzymatic glycation of proteins. Clinical Biochem. 2005. V. 38 (2). P. 103–115.
Linzen B. The tryptophan → ommochrome pathway in insects.I. Advances in insect physiology. Eds Treheme J.E. N.-Y. Acad. Press. 1974. V. 10. P. 117–246.
Ostrovsky M.A., Sakina N.L., Dontsov A.E. An antioxidative role of ocular screening pigments. Vis.Res. 1987. V. 27. P. 893–899. https://doi.org/10.1016/0042-6989(87)90005-8
Romero Y., Martinez A. Antiradical capacity of Ommochromes. J. Mol. Model. 2015. V. 21. P. 220. https://doi.org/10.1007/s00894-015-2773-3
Suarez G., Maturana J., Oronsky A.L., Raventos-Suarez C. Fructose-induced fluorescence generation of reductively methylated glycated bovine serum albumin: evidence for nonenzymatic glycation of Amadori adducts. Biochim. Biophys. Acta. 1991. V. 1075. P. 12–19.
Uchiki T., Weikel K.A., Jiao W., Shang F., Caceres A., Pawlak D., Handa J.T., Brownlee M., Nagaraj R., Taylor A. Glycation-altered proteolysis as a pathobiological mechanism that links dietary glycemic index, aging, and age-related disease (in nondiabetics). Aging Cell. 2012. V. 11 (1). P. 1–13. https://doi.org/10.1111/j.1474-9726.2011.00752.x
Ushakova N., Dontsov A., Sakina N., Bastrakov A., Ostrovsky M. Antioxidative properties of melanins and ommochromes from black soldier fly Hermetiaillucens. Biomolecules. 2019. V. 9 (9). P. 408. https://doi.org/10.3390/biom9090408
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы