Сенсорные системы, 2022, T. 36, № 2, стр. 136-152
Регенерация органа зрения Helix lucorum в 185-суточном орбитальном полете на международной космической станции
1 ФГБУН Государственный научный центр Российской Федерации, Институт медико-биологических проблем РАН
123007 Москва, Хорошевское шоссе, д. 7ба, Россия
* E-mail: gio119193@mail.ru
Поступила в редакцию 10.09.2021
После доработки 24.01.2022
Принята к публикации 04.02.2022
- EDN: LCSOCK
- DOI: 10.31857/S0235009222020044
Аннотация
В статье изложены результаты космического эксперимента (КЭ) “Регенерация-1” на брюхоногой наземной легочной улитке Helix lucorum. Улитки в количестве 101 особи были разделены на три экспериментальные группы: на полетную группу (ПГ) и на две контрольные группы – группу синхронного сопровождения (СГ) и виварийную группу (ВГ). За 10–11 ч перед началом КЭ у всех улиток ампутировали глазные щупальца. Улиток ПГ в специальном светонепроницаемом контейнере на пилотируемом космическом корабле (ПКК) “Союз ТМА-19” доставляли на Международную космическую станцию (МКС). Продолжительность экспозиции в орбитальном полете (ОП) составила 185 сут и 22 ч. Улитки СГ находились в аналогичном “полетному” контейнере при температуре, близкой к бортовой. Улитки ВГ содержались в просторных террариумах при нормальном световом режиме и температуре 20–22°С и имели свободный доступ к пище и воде. Состояние зрения нативных и регенерировавших глаз оценивали по морфологическим параметрам, суммарной электрической активности сетчатки и спайковой активности зрительного нерва в ответ на одиночные и парные световые стимулы разной яркости и длительности. После завершения КЭ регенерация глазных щупалец с функционирующими глазами наблюдалась у 78% улиток ПГ, 69% улиток СГ и 96% улиток ВГ. Регенераты как полетных, так и контрольных улиток по морфологическим и электрофизиологическим показателям были схожи между собой и заметно уступали таковым нативных глазных щупалец в течение 4-летнего периода после завершения эксперимента. Световая депривация не влияла на характер регенерации. В регенерировавшем зрительном нерве отсутствовала “off”-реакция на выключение светового стимула.
ВВЕДЕНИЕ
Из всех абиотических факторов только гравитация, характеризующаяся величиной ускорения свободного падения g = 9.8 м/с2, оставалась неизменным фоном развития жизни на Земле. Такой уровень гравитации называют 1 g. Гравитация наложила отпечаток на структурно-функциональную организацию большинства земных существ. Выяснение значимости силы тяжести в различных жизненных процессах – парадигма космической биологии. Сохранится ли способность к восстановлению поврежденных или утраченных частей тела в такой необычной и незнакомой среде, какой является невесомость? Эта проблема имеет и практическое значение. Длительность пребывания человека в космосе увеличивается, объем работ, сложность операторских задач постоянно растет – все это повышает вероятность несчастного случая и получения различного рода травм, требующих хирургического вмешательства. По этой причине сведения по регенерации в космическом полете, полученные в модельных опытах на животных, окажутся полезными в системе мер по медицинскому обеспечению пилотируемых космических полетов. Животные первыми стали “осваивать” космос. Они были и остаются источником получения опережающей информации о возможных рисках для космонавта.
Улитка – один из первых биологических объектов, на котором опытным путем были исследованы регенерационные способности животного организма. Итальянский натуралист Ладзаро Спалланцани отрезал садовой улитке Helix aspersa (близкородственный вид улиток Helix lucorum и Helix pomatia) переднюю часть головы вместе с передними и задними (глазными) щупальцами. Спустя некоторое время после операции удаленная часть головы вместе со всеми щупальцами полностью восстанавливалась (работа была опубликована в 1768 г., цитируется по Mattson, 1976). В дальнейшем этот эксперимент известного натуралиста, показав легкость манипуляции, наглядность результатов и доступность объекта, привлек внимание многих исследователей. Регенерацию глазных щупалец стали изучать на наземных, пресноводных и морских моллюсках. Значительное внимание было уделено выяснению зависимости регенерации от различных биотических и абиотических факторов (Сидельников, 1991; 1997, 2000; Gilary, 1983; Тартаковская, 2003).
Глаз улитки имеет камерное строение. Сетчатка неинвертированная, однослойная и состоит из первичночувствующих рабдомерных (микровиллярных) фоторецепторов и опорных (пигментных) клеток. Большая часть фоторецепторов содержит микровиллы длиной 9–11 мкм, меньшая– микровиллы длиной 4–6 мкм. Отходящие от фоторецепторов аксоны образуют зрительный нерв, соединяющий глаз с церебральными ганглиями. Опорные клетки сетчатки содержат только один фотопигмент – родопсин, из-за чего улитки лишены цветового зрения (Догель, 1981; Зайцева, 1992; Черноризов и др., 1992). Простота структурной организации органа зрения улитки подвигла сотрудников кафедры психофизиологии МГУ использовать глаз этого животного (Helix lucorum, Helix pomatia) в качестве модели для изучения механизмов кодирования яркости света. В диапазоне малых значений яркости пиковые значения электроретинограммы (ЭРГ) коррелировали с яркостью светового стимула. При бóльших значениях яркости света рост амплитуды реакции замедлялся, в дальнейшем достигая “плато насыщения”. На включение света активировались фоторецепторы с длинными микровиллярными образованиями, на выключение – фоторецепторы с укороченными микровиллами. На основании полученных результатов был сделан вывод о том, что в глазу улитки интенсивность света кодируется соотношением активности “яркостной” и “темновой” фоторецепторных систем. Другими словами, сетчатка улитки функционирует как “двойная ретина” с яркостной и темновой системами фоторецепторов, и настроена только на восприятие яркости света и его градации (Chernorizov et al., 1994; Шехтер, Греченко, 2009; Шехтер и др., 2010). Чувствительность к свету высокая. Порог реагирования для Helix pomatia составляет 6 ×10–11 Вт/см2. Для человеческого глаза в тех же условиях требуется многоминутная темновая адаптация для различения источника света как слабо светящейся точки (von Berg, Schneider, 1967).
Цель настоящей работы – оценка воздействия невесомости на структурно-функциональное восстановление органа зрения в опытах на наземных легочных улитках Helix lucorum в полугодовом орбитальном полете (ОП) на МКС. В статье представлены результаты космического эксперимента (КЭ) “Исследование влияния различных факторов космического полета на процессы регенерации у биообъектов по морфологическим и электрофизиологическим показателям” (шифр “Регенерация-1”), проводимого по долгосрочной программе научно-прикладных исследований и экспериментов РКА и Роскосмоса на МКС.
ОПИСАНИЕ МЕТОДИКИ
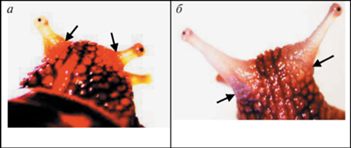
Объект исследования. Наземная легочная двуполая улитка Helix lucorum var. taurica (Kryn., 1833) – турецкая или горная улитка, подвид из рода Helix (L.). Голова улитки снабжена двумя парами подвижных щупалец-тентакулов. Передние короткие губные щупальца используются для ощупывания окружающей среды, задние – заметно большей длины являются глазными щупальцами-омматофорами. Масса взрослой улитки может достигать 25 г, средняя продолжительность жизни 5–6 лет. В сухую жаркую погоду и во время зимней спячки для предотвращения потери влаги устье раковины закрывается защитной известковой пленкой – эпифрагмой (Джавелидзе, 1972; Догель, 1981). Орган зрения Helix lucorum – пара глазных щупалец (рис. 1). Дистальный конец каждого щупальца расширен, образуя так называемый глазной пузырь. В его средней части расположен бокаловидный глаз камерного типа, состоящий из роговицы, хрусталика, стекловидного тела и сетчатки. Глаз заключен в глазную капсулу. В норме правые и левые глазные щупальца, бокаловидные глаза и сферической формы или формы эллипса хрусталики по своим размерам практически идентичны друг другу. Длина глазного щупальца взрослой улитки 20 мм, диаметр глазного бокала 300–320 мкм. Глаза неподвижны. Их подвижность достигается несущими структурами, каковыми являются сами щупальца. Благодаря последним глаза могут отклоняться по всем направлениям одновременно и симметрично, либо раздельно друг от друга и в разные стороны, и менять свое положение в щупальцах при помощи специального механизма ретракции. Глазные щупальца в отличие от тела улитки, защищенного довольно прочным известковым панцирем – раковиной, являющейся ее экзоскелетом, – наиболее выступающие и незащищенные образования. В ответ на механическое воздействие они вместе с глазными бокалами мускулом-ретрактором вворачиваются в тело улитки.
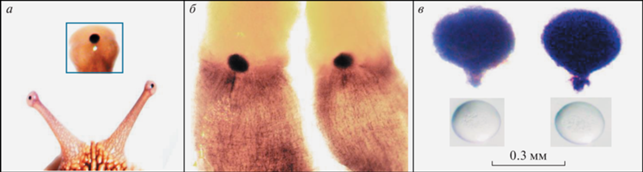
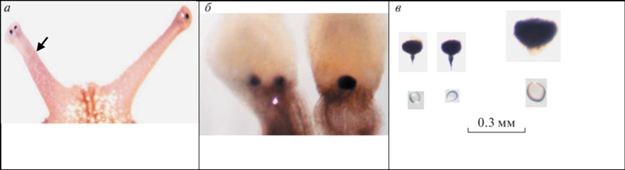
Рис. 1.
Орган зрения Helix lucorum крупным планом.
а – глазные щупальца, в рамке глазной пузырь при большом увеличении; б – извлеченные из тела улитки глазные щупальца с глазами; в – извлеченные из глазных щупалец глазные бокалы и хрусталики. Взрослая половозрелая улитка: масса 12 г, диаметр раковины 35 мм.
Подготовка КЭ. Предварительно отобранные улитки, прошедшие 1.5-месячный карантинный срок, были разделены на полетную группу (ПГ) и две контрольные группы – группу синхронного сопровождения (СГ) и виварийную группу (ВГ). Для кормления улиток использовали морковь, огурец, листья салата, обильно смоченные водой. За восемь суток до начала КЭ прекращали кормление улиток ПГ и СГ. За трое суток до начала эксперимента улитки были доставлены на техническую позицию г. Байконур (Казахстан). Улиток взвешивали на электронных весах “Accula3 V-1 mg” и измеряли диаметр раковины штангенциркулем. За 10–11 ч перед стартом космического корабля улиток погружали на 2 мин в 1-процентный раствор нембутала и различные части глазных щупалец ампутировали специальными ножницами с одной или обеих сторон (рис. 2).
Научная аппаратура. Научная аппаратура (НА) состоит из светонепроницаемого контейнера “Улитка” и автоматического регистратора температуры (АРТ). Контейнер снабжен фильтрационной системой для предотвращения попадания в окружающую среду продуктов жизнедеятельности животных, а также летучих химических выделений и неприятного запаха, возникающих при возможной гибели отдельных особей (Горгиладзе и др., 2010). На МКС НА доставляли на пилотируемом космическом корабле (ПКК) “Союз ТМА-19М” № 719. Члены российского экипажа переносили НА в служебный модуль (СМ) российского сегмента (РС) и размещали на панели № 406, предварительно сняв крышку контейнера для доступа воздуха (рис. 3). Улитки СГ находились в аналогичном “полетному” контейнере при температуре, близкой к бортовой. Улитки ВГ содержались в просторном террариуме при нормальном световом режиме и температуре 20−22° и имели свободный доступ к корму и воде. Все улитки были пронумерованы арабскими цифрами, нанесенными на наружной поверхности раковины.
Рис. 3.
Этапы подготовки КЭ.
а – контейнер “Улитка” с улитками; б – контейнер “Улитка” закрывается герметически крышкой; в − контейнер “Улитка” в транспортировочном чехле; г – контейнер “Улитка” со снятой крышкой и АРТ (обозначен стрелкой) на панели № 406 в СМ РС МКС.

Методы исследования. Фотовидеосъемку интактных и регенерировавших глазных щупалец осуществляли при помощи фотоадаптера и цифровой видеокамеры (“Сolor digital camera Levenhuk C510 NG”), установленной на окуляре стереоскопического микроскопа “Микромед МС-2” с функцией захвата и сохранения изображений. Изображение в режиме реального времени отображалось на экране ноутбука и одновременно сохранялось в его памяти для последующей обработки. Регенераты, появившиеся на месте ампутации, сравнивались с ампутированными, а также с нативными глазными щупальцами у одной и той же улитки. Для регистрации ЭРГ использовали полуинтактный препарат улитки. Регистрирующий электрод располагался в центральной части роговицы. Световую стимуляцию глаз после 40-минутной темновой адаптации осуществляли одиночными и парными световыми стимулами. Яркость света регулировалась при помощи электрического тока напряжением 5, 10, 15, 20, 30, 40, 50, 60 В, подаваемого на светодиод белого свечения от электрического стимулятора MSE-3R (“Nihon Kohden”) (Горгиладзе, 2008). Длительность светового стимула составила 0.01, 0.1, 0.3, 0.5, 1 и 2 с. Интервалы между парными световыми стимулами – 0.3, 5, 10 с, 0.5 мин, 1, 2, 3 и 4 мин. Каждый цикл световой стимуляции, состоящий из семи световых стимулов нарастающей яркости при заданной длительности 0.5 с, и 5 световых стимулов нарастающей длительности при заданной яркости света на 40 В, завершался повторением первого светового стимула. Для регистрации спайковой активности зрительного нерва использовали два метода: вольфрамовый микроэлектрод диаметром 20−30 мкм вводили в нерв непосредственно у выхода из глазного яблока; глазное щупальце рассекали продольным разрезом, и основание глазного бокала в месте выхода зрительного нерва обрабатывали в 0.6% проназы, приготовленном на физиологическом растворе для наземных гастропод. Спустя 30 мин, этот участок препарата отмывали физиологическим раствором, под зрительный нерв подводили крючок из платиновой проволочки диаметром 40 мкм и заливали приготовленным на физиологическом растворе агар-агаром. В ряде случаев из глазных бокалов извлекали хрусталики. Нативные и регенерировавшие глазные щупальца фиксировали в жидкости Буэна и после дегидратации заключали в парафин. Серийные срезы глазных бокалов толщиной 5–7 мкм окрашивали по методу Карачи и железным гематоксилином по Гейденгайну. Исследования проводили при комнатной температуре 19–22°С, начиная с 3–5 сут после завершения КЭ, и продолжались с определенной периодичностью в течение четырех лет.
Условия орбитального полета (ОП). Уровень гравитации на МКС составил 10–4–10–5 g, параметры орбиты (апогей/перигей, км) – 390/375. Температура в зоне расположения НА регистрировалась АРТ каждые 3 ч в автоматическом режиме. Кроме того, через каждые двое суток показатели температуры с табло АРТ передавались в Центр управления полетом. В течение ОП параметры микроклимата в зоне расположения НА состояли из: температуры воздушной среды 19–21°С, относительной влажности 42–45%, парциального давления кислорода 166–168 мм рт.ст., углекислого газа 1.0–1.8 мм рт.ст., атмосферного давления 735–740 мм рт.ст. За сутки перед завершением экспедиции космонавты закрывали контейнер крышкой, размещали в транспортировочный чехол и вместе с АРТ переносили в спускаемый аппарат ПКК “Союз ТМА-19М” № 719. Длительность ОП составила 185 сут и 22 ч (сеанс в экспедиции 46/47 на МКС с 15 декабря 2015 г. по 18 июня 2016 г.).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ПГ (16 улиток)
Масса улиток перед полетом составила 5.2 ± ± 0.9 г при диаметре раковины ~25.6 мм. У трех улиток было ампутировано правое глазное щупальце, у 11 левое глазное щупальце, у двух оба глазных щупальца. При вскрытии контейнера после полета у всех улиток устье раковины было затянуто эпифрагмой. Под ней на разной глубине имелась вторая и, в ряде случаев, третья эпифрагма. На вторые сутки после завершения КЭ определяли массу улиток и измеряли диаметр раковины. Средняя потеря массы составила 31%. Диаметр раковины оставался без изменений. Улиток размещали в просторный террариум, на дне которого был уложен смоченный водой лигнин. Спустя 2 ч улитки проснулись и начали медленно ползти. Улиток на 2 мин погружали в воду, после чего они стали более активными и стали поедать корм (листья салата, протертая морковь). На пятые сутки масса улиток приблизилась к предполетным показателям и через полгода превысила предполетные показатели на 27%. У них кроме роста массы отмечалось увеличение размеров раковины (рис. 4). Из 18 ампутированных глазных щупалец 14 щупалец регенерировали с глазными бокалами (78%) (табл. 1). В глазном пузыре одного регенерировавшего щупальца находились два глазных бокала. В двух регенератах отсутствовали глазные бокалы. Еще у двух улиток регенерат полностью отсутствовал. Часть глазного щупальца, оставшаяся после ампутации, представляла собой ампутационную культю конической формы, вершина которой была затянута соединительной тканью, и она оставалась в таком виде практически без изменений по прошествии четырех лет после завершения КЭ (рис. 5, 6, 7, 8). Две улитки, подвергнутые перед полетом ампутации обоих глазных щупалец, демонстрировали регенераты с обеих сторон с глазными пузырями и глазными бокалами. У одной улитки глаз в правом регенерате был заметно крупнее в сравнении с глазом левого регенерата (рис. 9, 10). Все регенерировавшие глазные щупальца были короче, тоньше и с глазными пузырями в большинстве случаев меньшего размера. Некоторые регенераты выглядели как оголенные. У них отсутствовала присущая интактному щупальцу кожа с характерным окрасом и сквозь полупрозрачный покров просматривался мускул-ретрактор. Размеры глазных бокалов и их хрусталиков в регенерировавших щупальцах на 40–60% уступали таковым, извлеченным из ампутированных перед полетом глазных щупалец, а также из нативных глазных щупалец у той же улитки. По прошествии четырех лет после завершения КЭ не отмечалось полного восстановления изначальных размеров регенерировавших глазных щупалец и глазных бокалов, разве что щупальца могли несколько прибавиться в длину и кожный покров регенерата приобрести более темный окрас. Функция ретракции была восстановлена: на механическое воздействие регенерировавшее глазное щупальце вворачивалось в тело улитки.
Рис. 4.
Рост раковины в послеполетном периоде. Граница роста отмечена прерывистой линией. Спустя полгода после завершения КЭ.

Таблица 1.
Регенерация глазных щупалец улиток полетной группы
| Особенности регенерации глазных щупалец улиток ПГ | Число щупалец | |||
|---|---|---|---|---|
| Справа | Слева | Справа и слева | Всего | |
| Было ампутировано | 3 | 11 | 4 | 18 |
| Регенерировали с глазным пузырем и глазным бокалом | 3 | 6 | 4 | 13 |
| Регенерировали с двумя глазными бокалами в одном глазном пузыре | – | 1 | – | 1 |
| Регенерировали с глазным пузырем без глазного бокала | – | 2 | – | 2 |
| Регенерат отсутствовал | – | 2 | – | 2 |
Рис. 5.
Ампутированы глазные щупальца с правой стороны.
Регенераты спустя: а − полгода и б – 4 года после завершения КЭ; в – глазные пузыри с глазными бокалами нативного глаза (справа) и регенерата (слева) на пятые сутки (1) и спустя 4 года и 2 мес (2) при большом увеличении. Стрелками здесь и на остальных рисунках отмечены границы ампутации глазных щупалец.
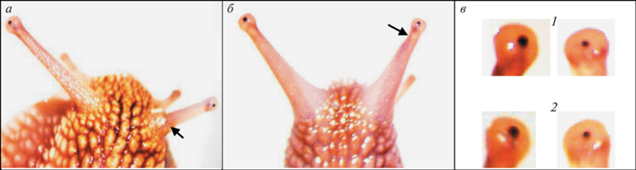
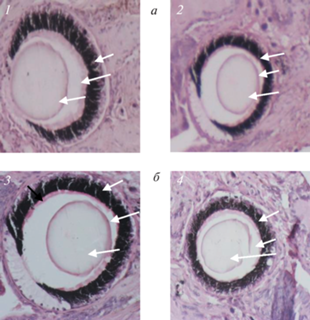
Рис. 6.
Ампутировано глазное щупальце с правой стороны. Регенерат: а – 4-е сутки после завершения КЭ; б − извлеченные из тела улитки нативное и регенерировавшее глазные щупальца; в – извлеченные из щупалец глазные бокалы и хрусталики.
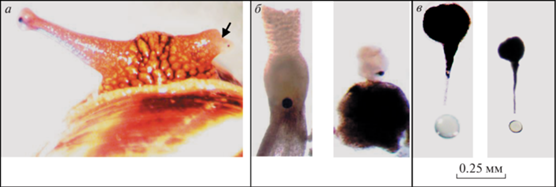
Рис. 7.
Ампутированы глазные щупальца с левой стороны.
Регенераты спустя: а – 0.5 мес; б –3 мес; в – полгода; г, д, е – 4 года. На б стрелкой обозначен просвечивающий сквозь кожный покров регенерата мускул-ретрактор; на д – глазной пузырь регенерата без глазного яблока; на е – отсутствие регенерата.

Рис. 8.
Ампутировано глазное щупальце с левой стороны.
В глазном пузыре регенерата два глазных бокала. После завершения КЭ спустя: а – полмесяца; б – излеченные из тела улитки глазные щупальца, 3 года и 8 мес; в – извлеченные из глазных щупалец глазные бокалы и хрусталики.
СГ (22 улитки)
Масса улиток синхронного сопровождения перед полетом составила 5.2 ± 1.2 г при диаметре раковины ~25.6 мм. У семи улиток было ампутировано правое глазное щупальце, у 11 – левое глазное щупальце, у четырех – оба глазных щупальца. Контейнер вскрывали на третьи сутки после завершения КЭ. Устье раковины улиток было затянуто 1–3 эпифрагмами. Масса составила 3.8 ± ± 0.9 г (уменьшение в сравнении с исходной на 27%). Они были помещены в просторный террариум, где имели свободный доступ к обильно увлажненному корму. Спустя полгода после завершения эксперимента масса улиток составила 6.4 ± 1.1 г (увеличение в сравнении с исходной на 23%). У улиток отмечался рост диаметра раковины. Из 26 ампутированных глазных щупалец 18 щупалец регенерировали с глазными бокалами (69%) (табл. 2). У одной улитки в глазном пузыре регенерата на левой стороне имелись два глазных бокала. У трех улиток в глазном пузыре регенерата глазной бокал отсутствовал. У четырех улиток вместо регенерата имелась культя (рис. 11). Две улитки из четырех, перед началом эксперимента подвергнутых ампутации обоих глазных щупалец, демонстрировали регенераты с глазными бокалами. У одной из них глазной бокал в правом регенерате был заметно крупнее в сравнении с таковым на левой стороне. У оставшихся двух улиток левое глазное щупальце регенерировало с глазным бокалом. У одной из них на правой стороне в глазном пузыре регенерата глазной бокал отсутствовал, у другой раневая поверхность ампутированного щупальца на левой стороне зажила без появления регенерата (рис. 12).
Таблица 2.
Регенерация глазных щупалец улиток синхронного сопровождения
| Особенности регенерации глазных щупалец улиток СГ | Число щупалец | |||
|---|---|---|---|---|
| Справа | Слева | Справа и слева | Всего | |
| Было ампутировано | 7 | 11 | 8 | 26 |
| Регенерировали с глазным пузырем и глазным бокалом | 5 | 6 | 6 | 17 |
| Регенерировали с двумя глазными бокалами в одном глазном пузыре | – | 1 | – | 1 |
| Регенерировали с глазным пузырем без глазного бокала | 1 | 1 | 1 | 3 |
| Регенерат отсутствовал | 1 | 2 | 2 | 5 |
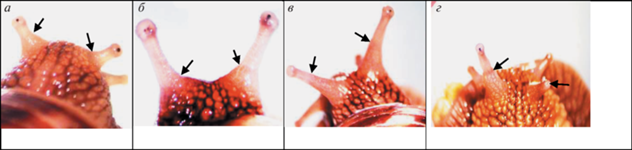
Рис. 11.
Ампутированы глазные щупальца с правой стороны.
После завершения КЭ спустя: а – 10 сут; б – 15 сут, стрелкой отмечена раневая поверхность на месте ампутированного у основания глазного щупальца; в – извлеченные глазные щупальца, вместо регенерата небольшой тканевой вырост; г – 2.5 года, регенерат отсутствует, культя.
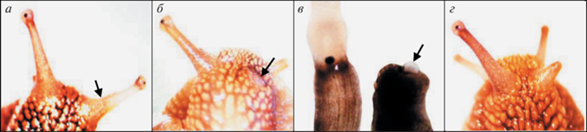
Рис. 12.
Ампутированы оба глазных щупальца.
После завершения КЭ спустя: а – 5 сут, с левой стороны вместо регенерата культя; б – спустя 2 мес; в – спустя полгода, глазной бокал в правом регенерате крупнее глазного бокала левого регенерата; г – спустя год и 4 мес, в глазном пузыре регенерата с правой стороны отсутствует глазной бокал.

ВГ (63 улитки)
Масса улиток этой контрольной группы составила 6.0 ± 1.3 г при диаметре раковины ~ 27.6 мм. Перед началом эксперимента 23 улиткам было ампутировано правое глазное щупальце, 29 улиткам левое глазное щупальце, 11 улиткам оба глазных щупальца. Спустя полгода после завершения КЭ масса улиток составила 8.6 ± 1.2 г (увеличение в сравнении с исходной на 30%). Все улитки находились в активном состоянии. Из 74 ампутированных глазных щупалец 71 щупальце регенерировало с глазными бокалами (96%) (табл. 3). У одной улитки из 52, подвергнутых односторонней ампутации глазного щупальца, в глазном пузыре регенерата на правой стороне глазной бокал отсутствовал. У восьми улиток из 11 с двусторонней ампутацией глазных щупалец регенераты с обеих сторон имели глазные бокалы. В двух случаях глазной бокал в регенерате на правой стороне был крупнее в сравнении с таковым на левой стороне. У одной улитки в глазном пузыре регенерата на левой стороне находились два глазных бокала. У другой ампутированная часть левого щупальца регенерировала с глазным пузырем без глазного бокала. У третьей на левой стороне вместо регенерата имелась ампутационная культя. В течение всего периода наблюдения регенерировавшие глазные бокалы оставались практически без изменений. Кроме того, отсутствовало восстановление изначального размера и кожного покрова новообразованных щупалец (рис. 13, 14).
Таблица 3.
Регенерация глазных щупалец улиток виварийной контрольной группы
| Особенности регенерации глазных щупалец улиток ВГ | Число щупалец | |||
|---|---|---|---|---|
| Справа | Слева | Справа и слева | Всего | |
| Было ампутировано | 23 | 29 | 22 | 74 |
| Регенерировали с глазным пузырем и глазным бокалом | 23 | 28 | 19 | 70 |
| Регенерировали с двумя глазными бокалами в одном глазном пузыре | – | – | 1 | 1 |
| Регенерировали с глазным пузырем без глазного бокала | − | 1 | 1 | 2 |
| Регенерат отсутствовал | – | – | 1 | 1 |
Рис. 13.
Ампутированы глазные щупальца с левой стороны.
После завершения КЭ спустя: а – 5 мес; б – полгода; в – 4 года; г – глазные пузыри регенерировавшего и нативного глазных щупалец с глазными бокалами спустя полгода 1 и 4 года 2 при большом увеличении.
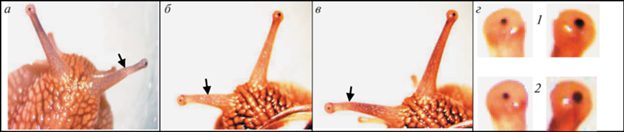
Рис. 14.
Ампутированы оба глазных щупальца.
После завершения КЭ спустя: а – 7 сут, правый глазной бокал в правом регенерате крупнее глазного бокала левого регенерата; б – 2 года, два глазных бокала в глазном пузыре регенерата с левой стороны; в – 3.5 года, отсутствие глазного бокала в регенерате с левой стороны; г – 3.5 года, отсутствие регенерата с правой стороны.
ЭРГ нативных глаз
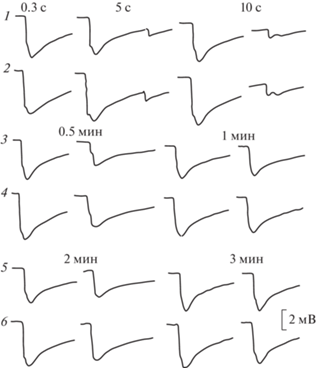
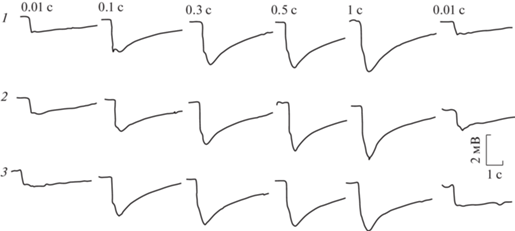
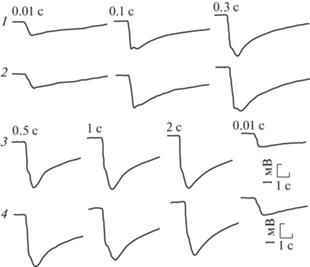
На световой стимул от корнеальной поверхности темноадаптированного глаза регистрировалась ЭРГ в виде отрицательного потенциала пиковой амплитудой до 7.1 мВ (табл. 4). Передний фронт ЭРГ состоял из двух компонентов: быстрого и медленного. Быстрый компонент составлял не менее 2/3 переднего фронта. Довольно часто после быстрого компонента появлялась небольшая инцизура (выемка) с последующим кратковременным небольшим подъемом-реполяризацией. Помимо инцизуры переход быстрого в медленный компонент происходил через небольшое плато и перегибы, либо этот участок ЭРГ был сглажен, и быстрый компонент плавно переходил в медленный. Передний фронт мог состоять целиком из быстрого компонента. В этом случае медленный компонент развивался на заднем фронте ЭРГ (рис. 15). Такое разнообразие ЭРГ можно было увидеть в процессе тестирования глаза светом нарастающей яркости и длительности. Конфигурация и амплитудные характеристики ЭРГ на одни и те же световые стимулы при одновременной регистрации с обоих глаз, как правило, были близки между собой. С увеличением яркости и длительности света крутизна быстрого компонента ЭРГ нарастала. В первом случае уменьшалась латентность ее появления с 0.35 до 0.1 с. Латентность медленного компонента колебалась в пределах 0.2–0.4 с. Увеличение длительности света при заданной яркости не отражалось сколько-нибудь заметно на латентность ЭРГ. На выключение света ЭРГ, как правило, не реагировала, и потенциал медленно снижался до исходного состояния. На самый слабый световой стимул, используемый в настоящей работе, этот процесс занимал около 4 с. Увеличение яркости и длительности света растягивал это время до 13–15 с. На световые стимулы нарастающей яркости наибольший прирост амплитуды ЭРГ отмечался в диапазоне 5–20 В, после чего рост амплитуды ЭРГ заметно снижался и при яркости света на 40–50 В наступало плато насыщения (рис. 16, 17). Такая же нелинейность ЭРГ-реакции проявлялась на нарастающую длительность света. Наибольший прирост амплитуды ЭРГ отмечался в диапазоне 0.01–0.3 с, и плато насыщения наступало при длительности света 1 с (рис. 18). После завершения каждого цикла световой стимуляции нарастающей яркости и длительности повторение первого светового стимула вызывало практически идентичную с исходной ЭРГ-реакцию. На парные световые стимулы реакция на второй стимул, отстающий от первого на 0.3 с, оставалась без ответа. Первая более или менее заметная реакция на второй стимул появлялась при интервале 5 с. С увеличением интервалов амплитуда ЭРГ на второй световой стимул увеличивалась, и при 3–4-минутном интервале достигала величины ЭРГ на первый световой стимул (рис. 19). Регистрация ЭРГ нативных глаз не выявила сколько-нибудь заметной разницы на световую стимуляцию между улитками всех экспериментальных групп, вне зависимости от условий их содержания (рис. 20).
Таблица 4.
Характеристики ЭРГ улиток ПГ, СГ и ВГ на световые стимулы
| Показатели ЭРГ | ПГ | СГ | ВГ | |||
|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | |
| Амплитуда, мВ | 0.3−2.2 | 1.4–6.7 | 0.3−1.9 | 1.3−6.8 | 0.3−2.2 | 1.2−7.0 |
| Латентность, мс | 105−200 | 80−135 | 108−205 | 80−139 | 103−198 | 82−140 |
Рис. 15.
Конфигурация ЭРГ нативных глаз Helix lucorum.
Стрелками отмечены инцизура (1), плато (2) и перегибы (3, 4) между быстрым и медленным компонентами ЭРГ; плавный переход быстрого компонента ЭРГ в медленный (5); медленный компонент на заднем фронте ЭРГ (6). Яркость света на 40 В, длительность 0.5 с.
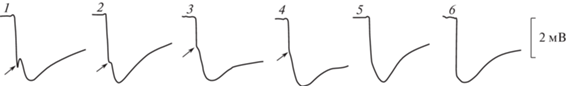
Рис. 16.
ЭРГ нативных глаз на световые стимулы нарастающей яркости.
1 и 3 – правый глаз; 2 и 4 – левый глаз. Заданная длительность света 0.5 с. Здесь и на остальных рисунках цифровые значения над ЭРГ – подаваемое на светодиоды напряжение электрического тока в Вольтах, длительность света в секундах, отклонение вниз соответствует негативности.
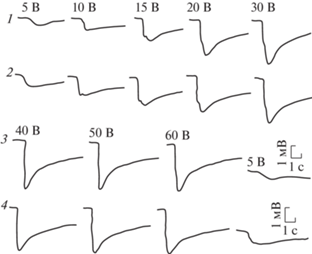
Рис. 17.
Пиковая амплитуда и плато насыщения ЭРГ на световые стимулы нарастающей яркости.
1 – нативные глаза; 2 – регенерировавшие глаза ПГ; 3 − регенерировавшие глаза СГ; 4 − регенерировавшие глаза ВГ. Средние значения от пяти улиток для каждой экспериментальной группы. По оси абсцисс – яркость световых стимулов, заданные напряжением электрического тока в Вольтах; по оси ординат – пиковая амплитуда ЭРГ.
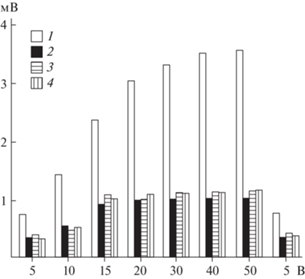
Рис. 18.
ЭРГ нативных глаз на световые стимулы нарастающей длительности.
1 и 3 – правый глаз; 2 и 4 – левый глаз. Заданная яркость света на 40 В.
ЭРГ регенерировавших глаз
В регенерировавших глазах конфигурация ЭРГ в целом соответствовала таковой, описанной для ЭРГ нативных глаз. Она состояла из быстрого и медленного компонентов, с инцизурой и перегибами между ними. Отличие от ЭРГ нативных глаз проявлялось в ее амплитудно-временных параметрах. Она имела несколько большую латентность и меньшую (в 2–4 раза) пиковую амплитуду (табл. 4). Динамика ее возрастания на световые стимулы нарастающей яркости и длительности характеризовалась небольшим приростом. Плато насыщения наступало при яркости света на 20–30 В и длительности света 0.3 с (рис. 17, 21).
Рис. 21.
ЭРГ регенерировавшего (1) и нативного (2) глаз улитки ВГ на световые стимулы нарастающей яркости (а) и длительности (б). 190-е сутки после завершения КЭ.

На парные световые стимулы ЭРГ на второй стимул, аналогичный с реакцией на первый стимул, отмечалась при интервале 2 мин (рис. 22). Вышеописанная картина наблюдалась в регенератах как полетных улиток, так и улиток наземного контроля. У одной улитки ПГ с ампутированными перед полетом глазными щупальцами на обе стороны, регенерировавшие глаза по-разному реагировали на одни и те же световые стимулы (рис. 23). Два глаза, появившиеся в регенерировавшем глазном пузыре улитки ПГ, реагировали ЭРГ-реакцией на световую стимуляцию значительно меньшей амплитудой в сравнении с ЭРГ нативного глаза той же улитки. Кроме того, амплитуда и конфигурация ЭРГ этих “близнецов” заметно отличались друг от друга (рис. 24). У двух улиток ПГ на фон медленного затухания ЭРГ накладывались небольшие колебания потенциала, как правило, отсутствующие в ЭРГ нативных глаз (рис. 25).
Рис. 22.
ЭРГ регенерировавшего (1, 3, 5) и нативного (2, 4, 6) глаз улитки ВГ на парные световые стимулы. Заданная яркость света на 40 В, длительность 0.5 с. 190-е сутки после завершения КЭ.

Рис. 23.
ЭРГ регенерировавших глаз улитки ВГ на световые стимулы нарастающей яркости (а) и длительности (б).
а – 1, 3 – правый глаз; 2, 4 – левый глаз. Заданная длительность света 0.5 с; б – 1 – правый глаз; 2 – левый глаз. Заданная яркость света на 40 В. Стрелками отмечены небольшие колебания потенциала. 188-е сутки после завершения КЭ.
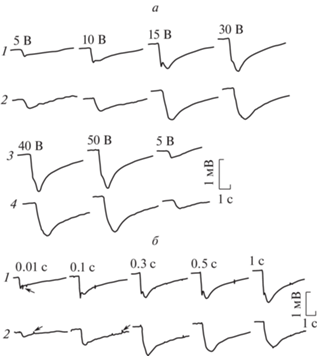
Рис. 24.
ЭРГ нативного глаза (1) и двух регенерировавших глаз улитки ПГ из одного глазного пузыря регенерата (2, 3) на нарастающие по длительности световые стимулы. На 2 – стрелками отмечены положительные потенциалы. 97-е сутки после завершения КЭ.
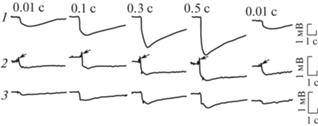
Рис. 25.
ЭРГ регенерировавших глаз на правой и левой стороне улитки ПГ на парные световые стимулы.
1, 3, 5 – правый глаз; 2, 4, 6 – левый глаз. Цифровые значения – интервалы между парными световыми стимулами. Яркость света на 40 В, длительность 0.5 с. Стрелками отмечены небольшие колебания потенциала. 97-е сутки после завершения КЭ.

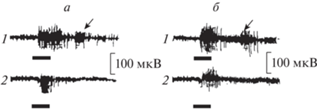
Спайковая активность зрительного нерва
В зрительном нерве нативного глаза включение света вызывал высокочастотный “on”-ответ спайковой активности, его отключение – относительно более слабый “off”-ответ. В зрительном нерве регенерировавшего глаза на включение света регистрировался “on”-ответ, уступающий таковому нативного нерва. На отключение света “off”-ответ отсутствовал (рис. 26).
Структура глазного бокала
В регенерировавших глазах представлены все элементы, присущие этим образованиям. На препаратах различимы капсула, окружающая глазной бокал, роговица, сетчатка, стекловидное тело и хрусталик. Все регенераты имели значительно меньшие размеры по сравнению с нативными структурами (рис. 27).
ОБСУЖДЕНИЕ
В ходе КЭ выявлены несколько сценариев восстановления удаленного органа зрения – глазного щупальца улитки Helix lucorum: регенерация с функционирующим глазом; избыточность регенерации в виде появления двух глаз в регенерате; регенерация глазного щупальца без глаза; полное отсутствие регенерации. Регенерация ампутированных глазных щупалец в невесомости, в реальных условиях полугодового ОП, завершалась восстановлением органа зрения у 78% полетных улиток и 69% улиток синхронного сопровождения. Они отращивали новые структуры взамен утраченных, “рассчитывая” исключительно на свои внутренние ресурсы. Причинами отставания регенерации глазных щупалец этих улиток в сравнении со свободно живущими и кормящимися улитками (96%) могли быть исчерпание внутренних ресурсов и невозможность их восполнения из-за отсутствия корма. Ни в одном случае регенераты не стали копией удаленному органу. Они были короче и тоньше в сравнении с ампутированными и нативными глазными щупальцами. У большинства регенератов отсутствовал присущий нативным глазным щупальцам пигментированный кожный покров. Глазные пузыри, и особенно, глазные бокалы и их хрусталики, как правило, были заметно меньшего размера, тоньше был зрительный нерв. У трех улиток (по одной из каждой экспериментальной группы) глазное щупальце регенерировало с двумя глазными бокалами в глазном пузыре. Подобная аномалия довольно характерна для регенерировавших глазных щупалец наземной легочной улитки Achatina fulica (Сидельников, 1991; Тартаковская, 2003). Глазные щупальца регенерировали при полной световой депривации, максимальном ограничении двигательной активности, отсутствии пищи и в состоянии спячки. Близкие результаты в лабораторных условиях были получены на морском моллюске Strombus luhuanus (Gillary, 1983) и Achatina fulica (Тартаковская, 2003). В регенерировавших глазах зрительная функция была сохранена в рабочем состоянии, но с определенными изъянами. На световые стимулы ЭРГ имела несколько большую латентность и небольшую пиковую амплитуду в сравнении с реакцией нативных глаз, и плато насыщения было сдвинуто в сторону меньших значений светового воздействия. Спайковая активность на свет в регенерировавшем зрительном нерве была слабее реакции нативного зрительного нерва. Кроме того, в регенерировавшем зрительном нерве отсутствовал “off”-ответ на отключение света. Таким образом, регенерировавший глаз из “двойной ретины” превратился в “одинарную ретину” и в результате отсутствия темновых фоторецепторов утратил “векторность кодирования яркости”, что вместе со сдвигом плато насыщения влево не могло не отразиться на восприятии света в сторону его ухудшения. Исчезновение “оff”-ответа в регенерировавших глазах после ампутации глазных щупалец было показано на Strombus luhuanus (Gillary, 1972, 1983). Слабая реакция регенерировавших глаз на свет очевидно связано с меньшим в сравнении с нативными глазами числом фотоэлементов в сетчатке регенерата (Flores, de Iraldi, 1973; Chase, Kamil, 1983; Тартаковская, 2003).
Невесомость повышает результативность восстановительного морфогенеза глазных щупалец. Она оказала стимулирующее влияние на регенерацию органа зрения у большего числа улиток в сравнении с улитками синхронного сопровождения при 1 g. Этот феномен впервые был обнаружен в 163-суточном ОП на МКС, в ходе которого ампутированные глазные щупальца регенерировали вместе с глазами у 69% улиток против 48% улиток синхронного сопровождения (Горгиладзе, 2011). С этими данными, полученными нами на беспозвоночном животном, созвучны исследования лаборатории проблем регенерации Института биологии РАН им. Кольцова на низших позвоночных – хвостатых амфибиях Pleurodeles waltl (тритон иглистый) и Triturus vulgaris (тритон обыкновенный). У этих животных, подвергнутых ампутации конечности и хвоста, а также удалению сетчатки и хрусталика глаза и экспонированных в ОП на автоматических беспилотных космических аппаратах “Космос”, “Фотон” и “Бион” длительностью от 7 до 30 сут, был прослежен ход восстановления тканей. Согласно полученным результатам, невесомость “ускоряла” дедифференцировку клеток – источников регенерации, а также их пролиферацию и последующую дифференцировку регенерирующих структур (сетчатки, хрусталика и конечности), приводящую к образованию более развитых регенератов, чем в контроле при 1g”. Симуляция микрогравитации клиностатированием показала аналогичные результаты (Grigoryan, Radugina, 2019). Повышенная центрифугированием доза гравитации, напротив, приводила к задержке и несовершенной регенерации (Grigoryan et al., 2017).
Таким образом, генетическая программа восстановительного морфогенеза на примере органа зрения улитки реализуется вне зависимости от гравитационного фактора среды. Вместе с тем этот процесс привязан к изменениям гравитационного поля: ускоряется при утрате веса и угнетается при его повышении. Орган зрения улитки –глазное щупальце регенерирует, заметно уступая первоначальному образу. Несовершенная регенерация присуща не только органу зрения улитки, и примеров достаточно много (Короткова, 1997). Такой тип регенерации обозначен термином гипоморфоз, соответствующий ему регенерат – гипоморфотическим регенератом (Воронцова, 1949; Воронцова, Лиознер, 1957).
Автор выражает благодарность командиру ПКК “Союз ТМА-19М” № 719 летчику-космонавту Ю.И. Маленченко, сотрудникам РКК “Энергия” им. С.П. Королева и ФГБУ “НИИ ЦПК им. Ю.А. Гагарина” за содействие при выполнении настоящей работы.
Список литературы
Воронцова М.А. Регенерация органов у животных. М., 1949. 270 с.
Воронцова М.А., Лиознер Л.Д. Бесполое размножение и регенерация. М., 1957. 416 с.
Горгиладзе Г.И. Регенерационная способность у планарий и улиток, экспонированных в невесомости в орбитальном полете на Международной космической станции. Доклады акад. наук. 2008. Т. 421. № 1. С. 1–4.
Горгиладзе Г.И. Регенерация органа зрения в 163-суточном орбитальном полете на Международной космической станции. Доклады акад. наук. 2011. Т. 440. № 4. М. 553–556.
Горгиладзе Г.И., Короткова Е.В., Кузнецова Е.Е., Мухамедиева Л.Н., Бегров В.В., Пепеляев Ю.В. Аппаратура для проведения биологических экспериментов с улитками на пилотируемых орбитальных станциях. Авиакосм. и экол. мед. 2010. Т. 44. № 3. С. 61–64.
Джавелидзе Г. Определитель наземных моллюсков Грузии. Тбилиси. Изд-во “Тбилисского Гос. ун-та”. 1972. (На груз. яз.).
Догель В.А. Зоология беспозвоночных. Под ред. Полянского Ю.И. 7-е изд. перераб. и доп. М. Изд-во “Высш. школа”. 1981. 606 с.
Зайцева О.В. Структурная организация сенсорных систем улитки. Журн. высш. нервн. деят. 1992. Т. 42. № 6. С. 1132–1149.
Короткова Г.П. Регенерация животных. СПб. Изд-во “С.-Петербург. ун-та”, 1997. 480 с.
Сидельников А.П. Регенерация глазного щупальца у гигантской африканской улитки Achatina fulica. Известия РАН. Сер. биол. 1991. № 5. С. 716–725.
Сидельников А.П. Регенерация глазного щупальца у улитки Аchatina fulica и ее регуляция. Автореф. дис. канд. биол. наук. Санкт-Петербург. 1997. 16 с.
Сидельников А.П. Влияние плотности популяции на рост и регенерационную способность улитки Achatina fulica. Известия РАН. Сер. биол. 2000. № 5. С. 525–532.
Тартаковская О.С. Влияние экологических факторов (плотность популяции, световой режим) и возраста на регенерацию периферического отдела зрительного аппарата брюхоногого моллюска Achatina fulica. Дис. канд. биол. наук. Калининград. 2003. 138 с.
Черноризов А.М., Шехтер Е.Д., Аракелов Г.Г., Зимачев М.М. Зрение виноградной улитки: спектральная чувствительность темно-адаптированного глаза. Журн. высш. нерв. деят. 1992. Т. 42. Вып. 6. С. 1150–1155.
Шехтер Е.Д., Греченко Т.Н. Два типа фоторецепторов в ахроматической зрительной системе виноградной улитки. Экспериментальная психология. 2009. Т. 2. № 2. С. 5–15.
Шехтер М.С., Черноризов А.М., Гадельшина Д.Ф. Модульная организация механизмов ахроматического зрения: от человека к простым нервным системам. Национальный психологический журнал. 2010. № 2 (4). С. 92–99.
Berg E., von, Schneider G. Langsame Belichtungspotentiale des Auges von Helix pomatias L. Naturwissenschaften. 1967. 54 Jahrgang. H. 22. S. 591–592.
Chase R., Kamil R. Morphology and odor sensitivity of regenerated snail tentacles. J. Neurobiol. 1983. V. 14. № 1. P. 43–50.
Chernorizov A.M., Shekhter E.D., Arakelov G.G., Zimachev M.M. The Vision of the Snail: The Spectral Sensitivity of the Dark- Adapted Eye. Neurocsi. & Behav. Physiol. 1994. V. 24. № 1. P. 59–62.
Flores S.V., de Iraldi A. On the regeneration of the eye in Helix aspersa and Cryptomphallus aspersa. Z. Zellforsch. 1973. V. 142. P. 63–68.
Gillary H.L. The regenerating eye of Strombus: anatomy and electrophysiology. American zoologist. 1972. V. 12. № 4. P. 691.
Gillary H. Electrical potentials from the regenerating eye of Strombus. J. exp. biol. 1983. V. 107. P. 293–310.
Grigoryan E.N., Dvorochkin N., Poplinskaya V.A., Yousuf R., Radugina E.A., Almeida E.A. The effect of hypergravity on the lens, cornea and tail regeneration in Urodela. Acta Astronautica. 2017. V. 138. P. 423–433.
Grigoryan E.N., Radugina E.A. Behavior of stem-like cells, precursors for tissue regeneration in Urodela, under conditions of microgravity. Stem Cells and Development. 2019. V. 28. № 7. P. 1–15. https://doi.org/10.1089/scd.2018.0220
Mattson P. Regeneration. Bobbs-Merrill comp. inc. Indianapolis. 1976.
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы