Сенсорные системы, 2022, T. 36, № 3, стр. 226-233
Влияние спектральной составляющей повседневного освещения на формирование структур глаза японского перепела Coturnix japonica
Н. Н. Трофимова 1, *, Ю. С. Петронюк 1, Т. С. Гурьева 2, Е. И. Медникова 2, П. П. Зак 1
1 Федеральное государственное бюджетное учреждение науки
Институт биохимической физики им. Н.М. Эмануэля РАН
119991 Москва, ул. Косыгина, д. 4, Россия
2 Федеральное государственное бюджетное учреждение науки
Государственный научный центр Российской Федерации – Институт медико-биологических проблем РАН
123007 Москва, Хорошевское шоссе, д. 76А, Россия
* E-mail: ntrofimova@mail.ru
Поступила в редакцию 25.03.2022
После доработки 12.04.2022
Принята к публикации 28.04.2022
- EDN: AQBXLL
- DOI: 10.31857/S0235009222030088
Аннотация
Размеры растущего детского глаза оперативно подстраиваются под фокусировку доминантной спектральной полосы освещения. Именно преобладающий вид освещения играет важную роль в формировании глазного яблока в детском возрасте. Повседневное использование ламп с преобладанием в спектральном составе красной компоненты может привести к удлинению глаза (миопия или близорукость) в самый ответственный период развития. Эти изменения могут носить в том числе и необратимый характер. В данном исследовании были проведены измерения различных параметров глаз птенцов перепела в разных возрастных точках в период созревания. Для измерений использовался метод акустической микроскопии. Измерения проводились для двух групп птиц. В качестве повседневного освещения были взяты: в первом случае лампа накаливания, во втором – светодиодный светильник с доминирующей спектральной полосой 525–700 нм. Полученные результаты показывают недостатки применения лампы накаливания как повседневного освещения для детей в период формирования глазного яблока.
ВВЕДЕНИЕ
Детский глаз находится в стадии формирования. Его рефракция в процессе взросления всецело зависит от зрительного опыта, который ему сопутствует. Для того чтобы этот процесс проходил без последствий, нужно соблюдение соответствующих условий. Важнейшим из условий является повседневное освещение. Рост случаев детской миопии неуклонно растет и правильное искусственное освещение, в отсутствие дневного, выходит на первый план (Зак, Островский, 2012; Зак, 2015).
Несмотря на появление новых искусственных источников света (люминесцентные, светодиодные) лампы накаливания по-прежнему имеют достаточно широкое распространение. Это обусловлено высоким индексом цветопередачи, отсутствием мерцания и, прежде всего, низкой ценой и традициями.
Недостатком лампы накаливания является большая “красная” составляющая ее спектра. Этот показатель имеет величину на 44% больше для спектра ламп накаливания, чем для солнечного света (Пашков, 2004).
Для изучения этой проблемы в ускоренной шкале времени были выбраны в качестве модели глаза птенцов перепела японского (Coturnix japo-nica). В настоящее время использование этих животных является перспективным в работах по моделированию и профилактике детской миопии (Llombart et al., 2009).
Аналогичная модель была предложена американскими учеными и с использованием домашних кур (Wisely et al., 2017).
Перепел японский – некрупная домашняя птица, весом до двухсот грамм. Это уникальная животная модель для изучения возрастной физиологии глаза. Перепел так же является оригинальной животной моделью зрительных нарушений различной этиологии (Зак, 2015; Донцов и др., 2017; Петронюк и др., 2022). Преимущество и оригинальность этой модели состоит в том, что в отличие от лабораторных грызунов и наравне с человеком перепел имеет колбочко-палочковую сетчатку и центральную зону острого зрения. Эффективность исследования возрастных изменений на перепелах обусловлена биологическим сроком жизни птицы. Всего за один год можно отследить все возрастные фазы развития глаза. Развитие детской близорукости у человека происходит за период от полугода до полутора лет (Карпенко, Тимаков, 2016). У перепела этот период длится около месяца.
В данном исследовании нами была проведена методическая работа по выявлению закономерностей формирования структур глаза у птенцов японского перепела. Цель исследований – определение зависимости роста глаза и его структур от спектральных характеристик повседневного освещения. Для этой задачи птенцов суточного возраста разделили на группы. Каждая группа содержалась при повседневном освещении с заданными спектральными характеристиками. Длительность эксперимента была обусловлена особенностями полового созревания этого вида птиц – 35–45 дней.
Использовалось два вида освещения: лампа накаливания 40 Вт и светодиодный светильник с желтым светофильтром λ = 500–700 нм (рис. 1).
Рис. 1.
Спектры излучения естественного дневного (1) и искусственных источников освещения: лампа накаливания (2); светодиодный светильник с желтым светофильтром (3). Спектральная чувствительность центральных колбочек сетчатки человеческого глаза (4).

Спектр используемого нами в эксперименте светильника был приближен к спектру “центральных” колбочек сетчатки человека. Работа проводилась совместно с лабораторией акустической микроскопии ИБХФ РАН.
МАТЕРИАЛЫ И МЕТОДИКА
Для выполнения экспериментов брали близких по возрасту птенцов японского перепела, инкубированных из яиц. Исходную линию птиц приобретали в ООО “Генофонд”, Сергиев Посад. С момента вылупления из яиц и до достижения суточного возраста птенцов содержали при стандартных условиях повседневного освещения. Таким стандартом для перепелов были лампы накаливания 40 Вт, что необходимо для адаптации птенцов к самостоятельному нахождению воды и пищи.
Далее птенцов делили на две группы с разными условиями повседневного освещения. Монохроматические источники света были выровнены по квантовому составу. Одна группа была контрольной и содержалась с использованием ламп накаливания (Philips, 40 Вт, матовая, освещенность 130 лк). Вторая группа содержалась при использовании светодиодного светильника (Меридиан, IP40, 10 Вт, призматический, освещенность 125 лк, расстояние 40 см, энергия 1825 мкВт/см2/нм, мощность 98.5 Дж) с доминирующей спектральной полосой 525–700 нм (λмакс. = 530 нм), что соответствует чувствительности MWS-колбочек (рис. 1). Для обеспечения нужной длины волны света на светодиодном светильнике закреплялся в два слоя желтый светофильтр (Roskoe-color #101).
Во избежание нежелательного бокового засвета боковые поверхности заклеивали черной изолентой. Источники освещения прошли необходимый контроль и спектрометрическую калибровку для обеспечения физиологического уровня освещенности ≈200 лк. Калибровку проводили спектрометром МК-350 (Uptech, Тайвань). Суточный режим освещения задавался таймером на 9 ч (ночь) и 15 ч (день). Необходимый обогрев осуществляли инфракрасными обогревателями мощностью 50 Вт. Использовали стандартный корм ПК 5–41, разработанный специально для птенцов перепела. Содержание птиц и их вывод из эксперимента декапитацией выполняли согласно “Правилам надлежащей лабораторной практики”, утвержденным Приказом Министерства здравоохранения РФ от 1 апреля 2016 г. N 199н.
Для эксперимента брали птенцов перепела в возрастном диапазоне от 10 до 45 дней. Для группы с повседневным желтым светом птенцы, взятые для эксперимента, были возрастом 10, 20, 28 и 34 сут. Для группы с лампой накаливания в качестве повседневного освещения возраст птиц был 14, 24, 27, 45 сут. Для получения большей достоверности при сравнительном анализе ультразвуковых данных птенцов перепела взвешивали и калибровали по весу ±10 г с точностью 1 г. Исследовали левый и правый глаз у трех птиц каждого возраста.
Для изучения структур глаза в процессе его роста в работе применяли ультразвуковые методы (УЗИ) высокого разрешения. С начала 90-х годов (Pavlin et al., 1991) ультразвуковая биометрия применяется в офтальмологии для исследования мелких структур. Датчиками с частотой 20 МГц исследуются такие элементы глаза, как сетчатка, хориоидея и склера (Coleman et al., 2004). С повышением частоты измерительной ультразвуковой системы возрастает пространственное разрешение визуализации, но одновременно уменьшается глубина проникновения. Акустическая микроскопия (АМ) активно применяется в научных исследованиях биологических объектов, в том числе офтальмологической направленности (Foster et al., 2003; Nakamura et al., 2013; Pavlin et al., 1993; Presby et al., 2020). В основе высокочастотной импульсной АМ лежат принципы эхо метода – отражения и затухания ультразвука в биотканях. Акустическая линза генерирует короткие фокусированные импульсы, проникающие сквозь структуры глаза и отражающиеся от поверхности тканей с различной плотностью и упругостью. Эхосигналы от границ раздела и неоднородностей биотканей принимаются тем же акустическим датчиком, при этом регистрируются их амплитуда и время задержки. По величине амплитуды можно судить о физических особенностях структурных элементов, а время задержки соответствует глубине их расположения. Ультразвуковые измерения и электронная обработка сигналов позволяют определить скорости звука в структурных элементах глаза, расстояние между элементами и геометрию глазного яблока.
Для визуализации использовали режим В-сканирования в сочетании с динамической фокусировкой (B/D-scan). Малоапертурный фокус ультразвукового зондирующего пучка перемещали по поверхности глазного яблока вдоль одной из его осей (экватора), затем фокус смещали вглубь с шагом 25 мкм и операцию повторяли. Таким образом, обеспечивался максимальный акустический контраст по всей глубине глаза. На рис. 2 представлено В/D-изображение глаза перепела в возрасте 30 сут.
Рис. 2.
Ультразвуковая биомикроскопия энуклеированного глаза половозрелой особи перепела Coturnix japonica:
а – схематичное изображение; б – акустическое B/D изображение поперечного сечения со стороны роговицы; в – осциллограмма импульсов переднего отдела: 1 – оптическая ось; 2 – роговица; 3 – передняя камера; 4 – радужка; 5 − соединительнотканное образование между ресничным краем радужки и роговицей; 6 – хрусталик; 7 – стекловидное тело; 8 – склера; 9 – хориоретинальный комплекс.
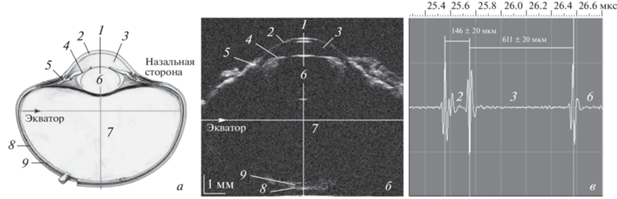
Можно видеть границы роговицы, передней камеры, хрусталика, хориоретинального комплекса и склеры. Осциллограмма эхоимпульсов (в) позволяет измерять время задержки Δt между границами структурных элементов и определять их размеры D = $0.5(vt)$, где $v$ – скорость звука в образце. Следует отметить, что величина скорости звука для таких обводненных тканей, как глаз, близка к скорости звука в воде (1490 м/c). Эта величина несколько отличается для хрусталика (1620 м/с) и склеры (1540 м/c), поскольку ткани имеют более плотную структуру (Hill et al., 2004). Приведенные выше значения использовались нами для измерений.
Применяемая в данной работе методика была разработана и опробована на цыплятах японского перепела возрастом 10 и 20 дней в сравнении с взрослыми животными (Зак и др., 2019). Исследования выполняли при помощи ультразвуковых акустических микроскопов, разработанных в ИБХФ РАН. В условиях in vitro применяли двумерное В/D-сканирование с визуализацией эхолокационного “разреза” глаза от верхушки роговицы до основания зрительного нерва в назально-дорсальной плоскости.
Акустический микроскоп был оснащен объективом с рабочей частотой 50 МГц, малой угловой апертурой 220 и фокусным расстоянием 13 мм. Перемещение акустической линзы осуществляли прецизионными двигателями с шагом 25 мкм по оси вдоль экватора и по глубине вдоль оптической оси глаза. Эхо-импульсным методом измеряли толщину структурных элементов глаза с абсолютной погрешностью ±20 мкм. Измерения проводили со стороны роговицы при их естественном положении в глазных орбитах. Ультразвуковая микроскопия требует применения иммерсионной жидкости, в данном случае роль иммерсии выполняли дистиллированная вода и ультразвуковой гель низкой вязкости.
Исследования проводили при комнатной температуре 23 ± 2°C. Время проведения одного измерения, не учитывая подготовку и настройку прибора, составляло около 20 мин.
Статистическую обработку результатов измерения проводили при помощи программы Excel. Данные, полученные в результате акустомикроскопических измерений, были проверены на нормальность распределения. Внутри каждой выборки определены медианные значения величины и соответствующие доверительные интервалы. В тексте приведены медианные значения размеров (X), доверительные интервалы (±E). Уровень статистической значимости был принят p = 0.05. На диаграммах поставлены интервалы относительной погрешности, полученной для каждого из параметров внутри диапазона возрастов ΔХ = E/X, где E = Σ(±E)/2 – среднее значение доверительного интервала для измеренного значения, X – медианное значение измеренной величины. Поскольку доверительные интервалы различались для возрастов, на диаграмме указано максимальное значение относительной погрешности внутри всего возрастного диапазона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При сравнении параметров глаза в онтогенезе нет четко прослеживаемой зависимости размеров глаза от веса птицы. Зависимость имеет место только от возраста. При постановке эксперимента нами предполагалось, что при равных стартовых условиях развитие глаза будет иметь различия между повседневным освещением светодиодным светильником с преобладающей желтой компонентой спектра и лампой накаливания с преобладающей красной компонентой спектра.
На рис. 3 представлены результаты ультразвукового измерения структурных элементов глаза перепела в развитии от рождения (10 сут) до полного наступления зрелости (45 сут).
Рис. 3.
Зависимость размеров структурных элементов глаза от возраста для перепела Coturnix japonica:
а – переднезадняя ось; б – сферичность; в – стекловидное тело; г – роговица; д – передняя камера; е – хрусталик, измеренный методом ультразвуковой микроскопии вдоль оптической оси. 1 – группа “лампы накаливания”, 2 – группа “желтого фильтра”, 3 и 4 – соответствующие линии тренда.

Основным показателем состояния глаза является размер его переднезадней оси (ПЗО). На а можно видеть рост этого показателя у обеих групп птиц. Так, у группы “желтого фильтра” этот показатель соответствует 5.85 мм для птенцов 10-суточного развития и затем 6.45 мм для 20-суточного развития. У группы “лампы накаливания” значения оказываются ниже в среднем на 15%: 6.58 мм для птенцов 14 сут и 7.00 мм для 24 сут развития. Условные линии роста, показанные на диаграмме (а), являются линейной аппроксимацией и наглядно отображают постоянную разницу в величине ПЗО (15%) для обеих групп. Эта закономерность прослеживается в эксперименте для всех возрастов. Учитывая то, что лампа накаливания имеет преобладающую красную компоненту спектра, можно предположить, что в условиях ее повседневного использования развитие глаза птенца перепела имеет тенденцию к миопическим изменениям, о чем свидетельствует удлинение переднезадней оси глаза. Это согласуется с ранее полученными данными (Сигаева и др., 2015; Зак и др., 2015), которые свидетельствуют о том, что развитие глаз у детенышей разных видов животных (обезьян, цыплят) в случае красного повседневного освещения происходит в сторону миопизации.
Не менее важным параметром развития глаза является его сферичность. Величина этого параметра, измеренного ультразвуковым методом, варьируется от 0.71 до 0.74 отн. ед. для желтого освещения и от 0.68 до 0.77 отн. ед. – для лампы накаливания (б). Нужно отметить, что глаз перепела в норме имеет форму чечевичного зерна (рис. 2). Измерения показывают, что в случае содержания птиц при повседневном использовании лампы накаливания форма глаза становится более сферичной. Это, предположительно, может являться критерием развития близорукости у перепела. Для птиц, содержащихся при использовании желтого светофильтра, рост глаза идет соответственно возрасту без изменения формы.
Также был измерен осевой размер стекловидного тела. Его величина варьируется в диапазоне от 3.05 до 4.23 мм для желтого освещения; от 3.75 до 4.60 мм – для лампы накаливания (рис. 3, в). В обоих случаях происходит рост параметра, что естественным образом вносит свой вклад в рост величины ПЗО. Однако можно отметить, что тенденция роста стекловидного тела вдоль оптической оси, в зависимости от условий, имеет некоторую разницу в скорости увеличения. Для развития глаза при лампе накаливания характерен более пологий рост. Это сопровождается неизменяющейся величиной сферичности, т.е. глаз растет в этом случае, пропорционально увеличиваясь в размерах за счет стекловидного тела без его деформации в сторону удлинения по оптической оси.
Важными компонентами оптической системы глаза являются также роговица, передняя камера и хрусталик. Толщина роговицы при измерениях варьировалась от 0.14 до 0.17 мм для желтого освещения; от 0.15 до 0.17 мм – для лампы накаливания (рис. 3, г). Тенденция к росту этого параметра внутри всего диапазона возрастов отсутствует для группы “лампы накаливания” или совсем незначительная для группы “желтого фильтра”. Можно отметить некоторое увеличение толщины роговицы для обеих групп для возрастов 30–34 сут. Это, возможно, связано с накоплением влияния “красного” света к этому возрасту у птиц и его влиянием на выработку коллагена в структурах глаза с последующим торможением этого процесса в более зрелом возрасте (Araújo et al., 2014). Если стимуляция роста коллагена напрямую связана с утолщением роговицы, тогда максимум этого параметра должен достигаться быстрее для группы “лампы накаливая” по сравнению с группой “желтого фильтра”, поскольку доза “красного” света в этом случае оказывается больше (рис. 1). Похожую тенденцию мы наблюдали в нашем эксперименте в пределах ошибки измерения методом ультразвуковой микроскопии и разброса значений внутри выборки для каждого возраста (рис. 3, г).
Средний размер передней камеры для птенцов (10–34 сут) составил 0.6 ± 0.02 мм для желтого света и 0.58 ± 0.02 мм – для лампы накаливания (рис. 3, д). Исследования, проведенные нами с более взрослыми птицами (45 + сут), содержащимися при лампе накаливания, показали существенное увеличение размера передней камеры по мере взросления до 0.77 мм у птиц возрастом 65 сут и 0.9 мм у птицы возрастом 100 сут. Возможно, рост свидетельствует о пролонгированном влиянии полученной дозы света красного диапазона на развитие близорукости, или же он является естественным для данного вида животных.
Толщина хрусталика при измерениях соответствовала диапазону от 1.85 до 2.17 мм для желтого освещения; от 1.9 до 2.2 мм – для лампы накаливания (рис. 3, е). В обоих случаях параметр имеет тенденцию к равномерному росту внутри всего диапазона возрастов с разницей в 5% между группами.
ЗАКЛЮЧЕНИЕ
По имеющимся в литературе данным в современном мире развитие детской близорукости приобрело скачкообразный массовый характер. Именно поэтому одним из актуальных направлений исследования механизмов близорукости у детей является исследование зависимости ее формирования от спектрального состава искусственного освещения.
Развитие структур глаза в условиях повседневной освещенности источниками разного спектра было исследовано методом ультразвуковой микроскопии. На живой модели японского перепела были получены данные о размерах переднезадней оси глаза, роговицы, передней камеры, хрусталика, стекловидного тела и сферичности в зависимости от возраста птенцов, содержащихся при повседневном освещении лампой накаливания и светодиодным светильником с желтым светофильтром. Было показано, что наличие в спектре красной составляющей, характерной для лампы накаливания, приводит к росту переднезадней оси глаза, взаимосвязанным изменениям геометрических параметров других его структурных элементов (хрусталика, передней камеры) и некоторой деформации стекловидного тела. Основываясь на полученных данных, можно предположить, что при ежедневном использовании лампы накаливания происходит развитие глаза в сторону близорукости. Поскольку данный вид освещения по-прежнему имеет широкое распространение, вопрос о формировании и профилактике детской близорукости остается актуальным. Проблема усугубляется современным образом жизни и, бесспорно, требует более тщательного подхода к обеспечению безопасных спектральных характеристик источников искусственного повседневного освещения.
Список литературы
Донцов А.Е., Воробьев И.А., Зольникова И.В., Погодина Л.С., Поташникова Д.М., Сережникова Н.Б., Зак П.П. Фотобиомодулирующее действие низкодозового светодиодного облучения синего диапазона (450 нм) на митохондриальную активность. Сенсорные системы. 2017. Т. 31. № 4. С. 312–321.
Зак П.П., Островский М.А. Потенциальная опасность освещения светодиодами для глаз детей и подростков. Светотехника. 2012. № 3. С. 4–6.
Зак П.П. Основания ограничения цветовой температуры светодиодного освещения в образовательных, дошкольных и лечебных учреждениях. М.: ООО “Мессе Франкфурт РУС” В кн.: Материалы IX Международного Форума по светодиодным технологиям 9–11 ноября 2015. 2015. С. 28–32.
Зак П.П., Сережникова Н.Б., Погодина Л.С., Трофимова Н.Н., Гурьева Т.С., Дадашева О.А. Фотоиндуцированные изменения субклеточных структур ретинального пигментного эпителия перепела Coturnix japonica. Биохимия. 2015. Т. 80. № 6. С. 931–936.
Зак П.П., Петронюк Ю.С., Храмцова Е.А., Трофимова Н.Н., Мисяков А.Н., Гурьева Т.С., Дадашева О.А., Левин В.М. Акустико-микроскопическое исследование возрастных изменений структур глаза японского перепела Сoturnix japonica. Актуальные вопросы биологической физики и химии. 2019. Т. 4. № 2. С. 233–236.
Карпенко И.В., Тимаков В.В. Проблемы зрения у школьников. Медицинская сестра. 2016. № 1. С. 24–25.
Пашков Б.А. Биофизические основы квантовой медицины. Методическое пособие к курсам по квантовой медицине. М.: ЗАО “МИЛТА-ПКПГИТ”, 2004. 116 с.
Петронюк Ю.С., Трофимова Н.Н., Зак П.П., Храмцова Е.А., Андрюхина О.М., Андрюхина А.С., Рябцева А.А., Гурьева Т.С., Медникова Е.И., Титов С.А., Левин В.М. Исследование глазных патологий на биомодели японского перепела Сoturnix japonica. Химическая физика. Т. 41. № 2. 2022. С. 27–33.
Сигаева А.О., Сережникова Н.Б., Погодина Л.С., Трофимова Н.Н., Зак П.П. Возрастные изменения сосудистой оболочки глаза экспериментальной животной модели: японский перепел Coturnix japonica. Материалы Российского общенационального офтальмологического форума. М.: “Апрель”. 2015. Т. 2. С. 906–910.
Araújo A.R., Piancastelli A.C.C., Pinotti M. Effects of low-power light therapy on wound healing: LASER x LED. An. Bras.Dermatol. 2014. V. 89. N 4. P. 616–623.
Foster F.S., Zhang M.Y., Duckett A.S., Cucevic V., Pavlin Ch.J. In vivo imaging of embryonic development in the mouse eye by ultrasound biomicroscopy. Invest. Ophtalmol.Vis.Sci. 2003. N 44. P. 2361–2366. https://doi.org/10.1167/iovs.02-0911
Coleman D.J., Silverman R.H., Chabi A., Mark J Rondeau, K Kirk Shung, Jon Cannata, Harvey Lincoff. High resolution ultrasonic imaging of the posterior segment. Ophalmology. 2004. V. 111. N 7. P. 1344–51.
Hill C.R., Bamber J.C., ter Haar G.R. Physical Principles of Medical Ultrasonics. John Wiley & Sons, Ltd. 2004. 528 p. https://doi.org/10.1002/0470093978
Llombart C., Nacher V., Ramos D., Luppo M., Carretero A., Navarro M., Melgarejo V., Armendol C. Morphological characterization of pecteneal hyalocytes in the developing quail retina. J Anat. 2009. N 3. P. 280–291. https://doi.org/10.1111/j.1469-7580.2009.01117.x
Nakamura Y., Kusano K., Nakamura K., Kobayashi K., Hozumi N., Saijo Y., Ohe T. A new diagnostic feasibility for cardiomyopathy utilizing acoustic microscopy. World Journal of Cardiovascular Diseases. 2013. N 3. P. 22–30. https://doi.org/10.4236/wjcd.2013.31006
Pavlin C., Easterbrook M., Hurwitz J., Harasiewicz K., Foster F.S. Am. J. Ophthalmol. 1993. V. 116. P. 854–857. https://doi.org/10.1016/s0002-9394(14)73207-6
Pavlin C.J., Harasiewicz K., Sherar M.D. Clinical use of ultrasound biomicroscopy. Ophalmology. 1991. V. 98. N 3. P. 287–295.
Presby J.A., Scott E.M., Norman K.N. Hoppes Sh.M., Tizard I. Normative ocular data for juvenile and adult Japanese quail (Coturnix japonica). Veterinary Ophthalmology. 2020. N 23. P. 526–533.
Wisely C.E., Sayed J.A., Tamez H., Zelinka Ch., Abdel-Rahman M.H., Fischer A.J., Cebulla C.M. The chick eye in vision research: an excellent model for the study of ocular disease. Prog Retin Eye Res. 2017. V. 61. P. 72–97. https://doi.org/10.1016/j.preteyeres.2017.06.004
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


