Сенсорные системы, 2022, T. 36, № 3, стр. 234-243
Противоречия в данных электрофизиологических и поведенческих экспериментов на примере результатов тестирования слуховой системы бабочек – совок (Lepidoptera, Noctuidae)
1 Федеральное государственное бюджетное учреждение науки
Институт проблем передачи информации им. А.А. Харкевича РАН
127051 Москва, Б. Каретный переулок, д. 19, Россия
* E-mail: lapshin@iitp.ru
Поступила в редакцию 25.03.2022
После доработки 19.04.2022
Принята к публикации 26.04.2022
- EDN: TNPOXE
- DOI: 10.31857/S0235009222030040
Аннотация
Бабочек-совок Agrochola macilenta Hbn. и Scoliopteryx libatrix L. в условиях закрепленного полета тестировали сериями акустических пульсов, сходными с эхолокационными сигналами летучих мышей. Исследовали изменения курсового аэродинамического усилия летящей бабочки в зависимости от амплитуды и частоты заполнения акустических стимулов в частотном диапазоне 10–140 кГц. Усредненные частотно-пороговые графики представителей обоих видов по форме были сходными с аудиограммами слуховых рецепторов тимпанальных органов совок, но значения порогов, зарегистрированных в поведенческих тестах, были ниже порогов слуховых рецепторов тимпанальных органов в среднем на 35 дБ. Обсуждаются возможные механизмы регуляции акустической чувствительности интактных совок и влияние на получаемые результаты методов регистрации двигательной активности подопытных бабочек.
Измерение порога чувствительности животного к внешним раздражителям обычно реализуют, устанавливая корреляцию между тестовыми стимулами и изменениями, наблюдаемыми либо в поведении интактного животного, либо в активности его нейронов. Эффективность обоих методов во многом определяется степенью соответствия используемых стимулов параметрам “ключевых” сигналов, с наибольшей вероятностью вызывающих определенный тип ответной реакции. Эксперименты осложняются необходимостью учитывать влияние гормонального статуса животного, физических условий (температуры, влажности, времени суток) и пространственной обстановки, в которой проводится тестирование.
Нейронные ответы, регистрируемые на уровне периферической части сенсорного пути, как правило, отличаются высокой повторяемостью. Это облегчает исследователям определение тех диапазонов интенсивности стимулов, в которых наблюдаются резкое нарастание ответной нейронной активности и последующий выбор на основе этих данных критериев порога реакции.
В теории пороги реакций, измеренные в ходе физиологического и поведенческого тестирования, должны давать согласованную картину. Однако в реальности это наблюдается далеко не всегда. В качестве примера такого очевидного несоответствия можно привести результаты исследования слуховой системы ночных чешуекрылых – совок (Noctuidae).
Совки способны воспринимать ультразвуки при помощи пары тимпанальных органов (ТО), расположенных симметрично на метатораксе. Чувствительными элементами ТО являются два слуховых рецептора (A1 и A2), реагирующие на колебания тимпанальной мембраны.
В процессе исследования слуха бабочек были разработаны методики, позволявшие раздельно регистрировать спайковую активность обоих слуховых рецепторов и измерять их частотно-пороговые характеристики (аудиограммы). При общем сходстве формы аудиограмм пороги клеток А2 оказались примерно на 20 дБ выше по сравнению с порогами клетки А1 (Suga, 1961; Surlykke, Miller, 1982). Был сделан вывод, что форма аудиограмм рецепторов определяется механикой тимпанального органа, в частности, резонансными свойствами тимпанальной мембраны (Adams, 1972; Schiolten et al., 1981).
С учетом простой морфологии периферической части слуховой системы совок получила развитие теория, согласно которой возбуждение каждого из двух слуховых рецепторов инициирует специфические формы реакций бабочек: при сравнительно слабых сигналах возбуждается более чувствительная клетка А1, и бабочка стремится улететь от источника звука, тогда как в случаях превышения сигналом порога менее чувствительной клетки А2 запускается режим хаотического полета, либо бабочка прекращает полет и падает в траву (Roeder, 1962; 1967). Все эти особенности поведения совок хорошо укладывались в картину их защитного поведения при нападении летучих мышей, использующих в процессе охоты на насекомых ультразвуковую эхолокацию.
В то же время попытки измерить характеристики слуха бабочек с использованием поведенческих тестов не давали однозначных результатов (Madsen, Miller, 1987). Первые стабильные реакции были получены в условиях частично закрепленного полета подопытных насекомых (Fyodorova, Lapshin, 1990). В этих опытах бабочку приклеивали к тонкой нити, другой (верхний) конец которой был закреплен на электромеханическом датчике. Регистрирующая система позволяла оценить интенсивность маневров летавшего насекомого в ответ на акустическую стимуляцию. Параллельно с поведенческими опытами проводились электрофизиологические исследования рецепторной чувствительности того же вида совок. Однако полученные результаты поведенческих и электрофизиологических опытов не совпали ни по форме аудиограмм, ни по пороговым уровням.
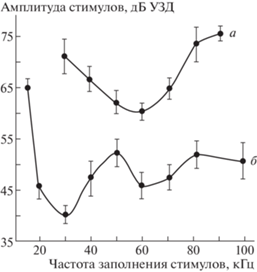
Сравнительно высокие поведенческие пороги, полученные в том исследовании (рис. 1, а), можно было объяснить тем, что электромеханическая система регистрировала энергичные маневры бабочек, инициируемые в ЦНС высокопороговыми рецепторными клетками А2, в то время как электрофизиологические измерения (рис. 1, б) отражали характеристики более чувствительных рецепторов А1. Однако оставался невыясненным вопрос о причинах несовпадения формы аудиограмм.
Рис. 1.
Частотно-пороговые характеристики совок Blepharita satura Schiff., измеренные в поведенческих (а) и электрофизиологических экспериментах (б). Указаны ошибки средних значений (Fyodorova, Lapshin, 1990).
Известно, что акустическая стимуляция вызывает у совок изменение натяжения тимпанальной мембраны за счет смещения окружающих ее структур (Callahan, Carlysle, 1972). На параметры слуховой системы бабочек должны также существенно влиять факторы, связанные с полетом. В частности, Пейн и соавт. (Payne et al., 1966) показали, что дирекциональная направленность ТО зависит от положения крыльев в момент восприятия звука. Весьма вероятно влияние переменного давления в тимпанальной полости, которое может возникать вследствие дыхания бабочки (тимпанальная полость связана с трахейной системой (Roeder, Treat, 1957)) или механической деформации торакса при маховых движениях. Ритмичное изменение воздушного давления под мембраной должно приводить к сдвигу основного резонанса ТО.
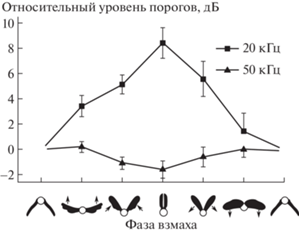
Экспериментально вопрос о степени стабильности частотной настройки ТО удалось решить при помощи методики, в которой акустическую стимуляцию осуществляли короткими ультразвуковыми пульсами, следовавшими в определенной фазе цикла взмаха крыльями подопытной бабочки (Лапшин, Воронцов, 2000). Перед опытом совок Amphipyra pyramidea L. приклеивали теплым воском к механическому датчику – измерителю усилий, которые возникали при попытках летящего насекомого совершать развороты в горизонтальной плоскости. Оказалось, что частотно-пороговая характеристика слуховой системы совок меняет форму в зависимости от фазы взмаха: при движении крыльев вниз до нижней точки основной оптимум аудиограммы расположен в области 20–30 кГц, но в процессе движения крыльев вверх этот оптимум смещается в высокочастотную область к 50–60 кГц (рис. 2). Общий уровень поведенческих порогов, зарегистрированных в этих опытах, примерно соответствовал данным электрофизиологических измерений. Однако ниже физиологических порогов сохранялась некоторая вероятность двигательных реакций на стимуляцию. Это обстоятельство усложняло измерение порогов и, по-видимому, и было одной из проблем в более ранних попытках провести подобные измерения.
Рис. 2.
Относительные уровни поведенческих порогов на частотах 20 и 50 кГц в зависимости от фазы взмаха в моменты восприятия акустических стимулов. По горизонтальной оси в условных единицах представлены последовательные фазы взмаха, которые характеризуются определенным положением крыльев и направлением их движения. Под горизонтальной осью схематично изображено положение крыльев бабочек в каждой фазе, стрелками указано направление их движения. По вертикальной оси – относительный сдвиг порогов реакций в дБ. Указаны ошибки средних значений (Лапшин, Воронцов, 2000).
Способность ночных бабочек перестраивать основной резонанс ТО позже была подтверждена Джеймсом Уиндмилом и соавт. (Windmill et al., 2006). В этой работе было показано, что при высоких уровнях акустических сигналов основная настройка ТО сдвигается в высокочастотную область.
Совки – акустически активные насекомые, способные не только издавать ультразвуковые щелчки, но и реагировать на эхо от собственных щелчков (Лапшин, 2005). В экспериментах с синхронизацией акустических стимулов с собственными щелчками бабочек эффекты частотных перестроек слуховой системы проявились значительно контрастнее (рис. 3). В этих опытах в качестве признака реакции на звук был использован эффект ответного учащения подопытной бабочкой эмиссии щелчков (Лапшин, Воронцов, 2005).
Рис. 3.
Усредненные частотно-пороговые характеристики совок Blepharita satura, полученные при трех значениях задержек стимулов относительно собственных щелчков бабочек (обозначения приведены в верхней части рисунка). По горизонтальной оси – частота заполнения стимулирующих посылок, по вертикальной – порог реакций. Указаны ошибки средних (Лапшин, Воронцов, 2005).

В процессе тестирования стимулами, синхронными со щелчками, были зарегистрированы очень низкие пороги реакций – порядка 11 дБ уровня звукового давления (УЗД). Эти результаты вошли в существенное противоречие с оценками пороговой чувствительности совок, полученными в электрофизиологических экспериментах (рис. 1). Позже выполненные измерения показали, что такую разницу нельзя объяснить температурными различиями при проведении экспериментов или влиянием времени суток (Лапшин, Воронцов, 2004). Можно было бы предположить, что собственный щелчок бабочки или определенный тип ее двигательной активности, предшествовавший тональному стимулу, способствовал снижению порогов чувствительности. Для решения этого вопроса надо было провести серию экспериментов, в которых ритм акустической стимуляции не зависел от поведения подопытных насекомых.
Цель данной работы – измерение минимальных поведенческих порогов совок на ультразвуковые пульсы, сходные по динамике следования с эхолокационными сигналами насекомоядных летучих мышей. В предварительной серии опытов было выяснено, что акустическая стимуляция инициирует у летящих совок усиление или сильные вариации аэродинамической тяги, поэтому в качестве основного признака реакций насекомых на звук были использованы изменения интенсивности их полета.
МАТЕРИАЛ И МЕТОДИКА
В экспериментах использовали совок Agrochola macilenta Hbn. и Scoliopteryx libatrix L., отловленных на пищевой аттрактант. С представителями каждого вида проведено по восемь опытов, причем в каждом опыте использовали одну бабочку.
Перед началом эксперимента бабочку приклеивали за нотум разогретой канифольно-восковой смесью к мягкой пружине держателя механодатчика, позволявшего регистрировать изменения аэродинамического усилия летящего насекомого в курсовом направлении (рис. 4). На фоне вибрации от машущих крыльев пружинная подвеска уменьшала переменную механическую нагрузку на поверхность кутикулы в области приклейки. Через несколько часов после проведения операции приклейки, клеящая смесь при небольшом усилии отслаивалась от кутикулы подопытного насекомого. После проведения экспериментов бабочек освобождали от приклейки и выпускали в естественную среду.
Рис. 4.
Схема экспериментальной установки: летящая бабочка укреплена на держателе датчика курсового аэродинамического усилия через амортизирующую пружину. Справа от бабочки установлен излучатель акустических стимулов.

Исследовали двигательные реакции летевших бабочек в ответ на акустические стимулы, состоявшие из четырех серий тональных пульсов (рис. 5). Период следования серий – 0.4 с. Каждая серия содержала восемь пульсов длительностью 10 мс каждый с фронтами нарастания и спада 0.5 мс, период следования пульсов в серии 25 мс. Частоту синусоидального заполнения пульсов варьировали в ходе опыта в диапазоне от 10 до 140 кГц. Управление экспериментами осуществлялось под контролем авторской компьютерной программы. Всего было зарегистрировано 416 ответов бабочек на акустическую стимуляцию. После установки нового значения частоты заполнения пульсов тестирование начинали с подпороговых уровней. Общее количество предъявлений стимулов с подпороговым уровнем превышало 1500.
Рис. 5.
Примеры осциллограмм двигательных реакций бабочек в ответ на акустическую стимуляцию: а – увеличение интенсивности полета во время действия второго цикла стимуляции и раскачивание в продольном направлении (Agrochola macilenta, 40 кГц, 10 дБ УЗД); б – увеличение интенсивности полета в начале второго цикла стимуляции (Scoliopteryx libatrix, 40 кГц, 16 дБ УЗД); в – черными прямоугольниками под осциллограммами обозначены тональные пульсы в составе стимулирующих серий.

За реакцию принимали отклонения сигнала механодатчика от базовой линии с амплитудой, в 2 и более раза превышавшие сходные по форме спонтанные колебания за предшествовавшие 4 с наблюдений. Основная схема определения порога была следующая: при уровне стимула, который принимали как подпороговый (на 2 дБ ниже порога), в четырех последовательных предъявлениях стимулов только 1 раз могла наблюдаться реакция; в двух последующих предъявлениях, но уже при пороговом уровне стимула, реакция должна была повториться последовательно 2 раза. В сомнительных случаях в зависимости от конкретной ситуации либо увеличивали период наблюдения за фоновой активностью, либо повторяли предъявления с околопороговыми уровнями. Такая схема тестирования была выбрана для снижения вероятности привыкания подопытного насекомого к надпороговой акустической стимуляции.
В конце опыта на то место, где до этого располагался грудной отдел подопытного насекомого, помещали измерительный конденсаторный микрофон и проводили калибровку стимулирующего тракта при разных частотах заполнения тональных посылок. В процессе калибровки использовали измеритель акустического давления B&K 2235 (Brüel & Kjær, Дания) совместно с 1/4" микрофоном B&K 4135 при измерениях в частотном диапазоне 10–70 кГц и 1/8" микрофоном 40DP (G.R.A.S., Дания) при измерениях в пределах диапазона 70–140 кГц. Для контроля соответствия показаний измерителя уровня принятому стандарту (0 дБ соответствует акустическому давлению 2 × 10−5 Па) использовали калибратор 05 000 MMF (VEB Metra Meß Frequeztechnik).
Поскольку в опытах предполагалось использовать акустические стимулы с амплитудой, заведомо меньшей нижней границы чувствительности измерительных микрофонов, были предприняты специальные меры для снижения влияния неконтролируемых помех в электрическом тракте стимулирующего канала. С этой целью на выходе усилителя мощности, питавшего акустический излучатель, был установлен управляемый от компьютера резистивный аттенюатор. Ослабление сигнала на выходе аттенюатора составляло –50 дБ или 1:316. Аттенюатор программно активировался при работе в диапазоне амплитуд стимулов 0–49 дБ УЗД. При этом на входе акустического излучателя уменьшался не только сам сигнал, но и все виды шумов, которые потенциально могли появиться в тракте формирования стимула из-за воздействия на аппаратуру электрических помех различного происхождения. Контроль качества электрического сигнала на выходе формирователя стимулирующих пульсов при этом не представлял особых трудностей.
В качестве источника стимулов был использован конденсаторный акустический излучатель, изготовленный в лаборатории. Излучающим элементом служила мембрана диаметром 3 см из металлизированной лавсановой пленки толщиной 35 мкм. На мембрану поступало поляризующее напряжение +180 В в сумме с управляющим синусоидальным сигналом. Неравномерность амплитудно-частотной характеристики излучателя в диапазоне 10–140 кГц составляла порядка 14 дБ. Поправки на неравномерность частотной характеристики стимулирующего тракта в ходе опыта вносились автоматически при каждом изменении частоты заполнения стимула.
Так как совки в ходе экспериментов могли издавать собственные щелчки, было важно уменьшить уровень эха от окружающих предметов в сторону подопытной бабочки. Для этого экспериментальную зону на расстоянии ~70 см от бабочки экранировали поролоновыми листами с волнистой поверхностью, а мембрана акустического излучателя была закрыта конусом из полупрозрачной для акустических волн бумаги, ослаблявшей отражение звука от мембраны в сторону подопытного насекомого.
Ранее было показано, что индивидуальные пороги реакций совок на акустические стимулы постепенно снижались от экземпляра к экземпляру в течение августа (Лапшин, Воронцов, 2000). С учетом этого обстоятельства экспериментальные работы были запланированы на сентябрь и частично октябрь, когда можно было ожидать проявления максимальной акустической чувствительности у подопытных бабочек.
Эксперименты проводили в лабораторных условиях при температуре воздуха 18–20°С. Место проведения экспериментов – биостанция ИБР РАН “Кропотово” (105 км к юго-востоку от Москвы).
РЕЗУЛЬТАТЫ
Двигательные реакции бабочек на акустическую стимуляцию
Изменения в активности подопытных бабочек на фоне акустической стимуляции были выражены в попытках маневрировать в курсовом направлении (53%; рис. 5, а) или в плавном увеличении аэродинамического усилия (31%; рис. 5, б), а также в сочетании обоих типов реакций. Более редкие формы ответов включали возбуждение собственной акустической эмиссии (генерацию ультразвуковых щелчков, 6%) и прекращение полета (10%).
При действии стимуляции с надпороговой амплитудой наиболее характерным было развитие ответной реакции в интервале с середины первой серии пульсов до конца второй серии. В 50% случаев реакция развивалась на фоне действия первой серии пульсов, в 35% – на фоне второй серии и 11 и 4% на фоне действия третьей и четвертой серий соответственно (N = 416). Вероятность регистрации поведенческого ответа увеличивалась по мере приближения уровня стимуляции к порогу со стороны бóльших значений. Статистику этого явления подробно не исследовали из-за ограниченных летных ресурсов подопытных бабочек.
Частотно-пороговые характеристики
Усредненные частотно-пороговые графики представителей обоих видов по форме были сходными (рис. 6). Локальный оптимум в диапазоне 15–25 кГц присутствовал на всех индивидуальных аудиограммах. В диапазоне 40–60 кГц еще один широкий минимум содержали шесть из восьми аудиограмм в каждой видовой группе. В области минимума графиков в диапазоне 50–70 кГц усредненные пороги составляли в группе S. libatrix 11 дБ УЗД, а в группе A. macilenta – 12 дБ УЗД.
ОБСУЖДЕНИЕ
Оценки минимальных порогов поведенческих реакций совок (рис. 6) в целом совпали с полученными ранее данными опытов, в которых использовали стимуляцию, синхронную с собственными щелчками бабочек (рис. 3: 6 мс). Форма поведенческих графиков в пределах 10–60 кГц напоминала “сглаженный” вариант аудиограммы рецептора А1 тимпанального органа совок (например, при сравнении графика на рис. 1, б и двух графиков рис. 6). Так как моменты предъявления тональных стимулов определялись программно и не зависели от двигательной активности насекомого, можно сделать вывод, что поведенческие аудиограммы формировались как результат усреднения нескольких состояний слуховой системы, последовательно сменявшихся в такт с крыловыми взмахами. Следовало учитывать, что при каждом взмахе крыльями изменялась не только частотная характеристика ТО, но и пространственная ориентация диаграмм направленности слуховой системы (Payne et al., 1966). По этой причине внешние звуки неизбежно получали дополнительную амплитудную модуляцию, также синхронную с маховыми движениями насекомого. На настоящий момент затруднительно дать ответ, как последнее обстоятельство отразилось на восприятии акустических стимулов.
В диапазоне от 80 кГц и выше “сглаживанию” поведенческих аудиограмм дополнительно мог способствовать механизм настройки на воспринимаемый сигнал. Признаки активности такого механизма ранее были обнаружены при исследовании реакций слуховых интернейронов совок в околопороговой области (Лапшин, Воронцов, 2004).
На рис. 7 приведена диаграмма, качественно характеризующая вероятность появления двигательных ответов совок в зависимости от амплитуды и частоты заполнения тональных стимулов. Если в этих координатах нанести данные измерений поведенческих порогов, полученные с использованием различных критериев реакций, то в результирующей картине будет наблюдаться “слоистая структура”. Рассмотрим отдельные “слои” диаграммы последовательно от больших амплитуд стимуляции до результатов измерений, полученных в данном исследовании.
Рис. 7.
Диаграмма, отображающая систему областей проявления поведенческих реакций совок на звуковые стимулы в координатах “частота” (горизонтальная ось) и “амплитуда акустических стимулов” (вертикальная ось). Плотностью серого тона на диаграмме обозначена вероятность ответных реакций: светло-серый цвет закраски областей диаграммы соответствует малой вероятности ответов, темно-серый цвет – высокая вероятность ответов. Описание структурных элементов диаграммы, обозначенных на рисунке буквами, приведено в тексте статьи.

а – Область выраженных двигательных реакций, с высокой вероятностью инициируемых высокоамплитудными ультразвуковыми сигналами (Fyodorova, Lapshin, 1990). Эта зона, скорее всего, связана с активностью слухового рецептора ТО А2. В зоне “а” двигательные реакции регистрируются наиболее надежно: ответы имеют стереотипную форму и повторяются от предъявления к предъявлению. Если бабочка до стимуляции щелкала, то высокоамплитудные стимулы акустическую активность подавляют. В области выше зоны “а” для совок более характерна остановка полета в ответ на стимуляцию.
б – Область попыток бабочек непредсказуемо маневрировать в ответ на акустические стимулы. Вероятность таких реакций снижается с увеличением количества повторных сеансов акустической стимуляции (Agee, 1969a; 1969b).
в – Типичная частотно-пороговая характеристика рецептора А1 (Fyodorova, Lapshin, 1990; Лапшин, Воронцов, 2004), приведенная на рисунке для удобства сравнения данных поведенческих и электрофизиологических измерений.
г – Усредненная поведенческая аудиограмма, полученная в опытах с регистрацией попыток насекомого совершать маневры в горизонтальной плоскости (Лапшин, Воронцов, 2000, 2004). Зоны “б”, “г” и “д” ассоциируются с активностью наиболее чувствительного слухового рецептора А1.
д – Область нестабильных поведенческих реакций совок на акустические стимулы.
е – Положение усредненной аудиограммы, измеренной при помощи датчика курсового аэродинамического усилия (в соответствии с рис. 5 и 6).
Диапазон по шкале уровней диаграммы между самым нижним оптимумом реакций и самым верхним составляет примерно 60 дБ – это значение соответствует тысячекратному соотношению уровней акустической стимуляции. Практически в каждой закрашенной точке диаграммы можно получить развернутую форму двигательной реакции бабочки на звук, особенно при первом предъявлении. Однако при последующей стимуляции вероятность реакций уже существенно зависит от уровня сигналов и интервалов их следования. Не зная этих нюансов, легко сделать неверное заключение о недостоверности получаемых данных.
Существенные различия в порогах в вариантах тестирования “г” и “е” можно объяснить тем, что типы маневров (развороты в горизонтальной плоскости или ускорение полета) в естественных условиях могли развиваться при реализации разных стратегий поведения. Вариант “г” логично отнести к реакции избегания источника ультразвука (отклонение в полете в бок от траектории потенциального хищника – защитная реакция при нападении летучих мышей), тогда как увеличение интенсивности полета и, следовательно, скорости (вариант “е”) вполне могло быть частью поведенческой программы, направленной на выход из зоны облучения ультразвуком в сочетании с минимизацией уровня эха от крыльев (Roeder, Treat, 1961). Неравномерное изменение вероятности реакций бабочек вдоль оси интенсивности сигналов можно объяснить приуроченностью тех или иных поведенческих паттернов к определенным уровням внешних акустических сигналов.
То обстоятельство, что измеренные в экспериментах электрофизиологические пороги, как правило, оказывались выше результатов поведенческих тестов, не вызывает особого удивления, так как у животных критерии обнаружения биологически важных сигналов с высокой вероятностью не соответствуют исторически сложившимся требованиям к результатам экспериментальных исследований. Тем не менее субъективными факторами можно объяснить разницу порядка 6 дБ, но не 20 дБ или более.
Скорее всего высокая акустическая чувствительность совок обеспечивается несколькими механизмами, в полной мере активными только у интактных насекомых. Какие это могут быть механизмы?
1. Синхронное детектирование с накоплением информации. Суть синхронного детектирования состоит в увеличении чувствительности воспринимающего тракта в период ожидаемого появления очередного сигнала в ритмическом потоке. В качестве косвенного признака активности такого механизма можно принять задержку поведенческого ответа бабочки на интервале от 0.5 до 2 стимулирующих серий, т.е. после накопления ответов на 4–16 пульсов (рис. 5). Характерные признаки синхронного детектирования ритмических сигналов в ЦНС совок ранее были обнаружены в процессе акустической стимуляции подопытных насекомых смесью из двух ритмических последовательностей (Лапшин, 2010, 2011).
2. Модуляция чувствительности клеток А1 со стороны центральной нервной системы, в том числе, посредством гуморальных факторов.
3. Эффект стохастического резонанса. При соизмеримом уровне сигнала и аддитивных шумов присутствие шума на входе приемника повышает вероятность обнаружения сигнала (Bezrukov, Vodyanoy, 1997). Экспериментально рост эффективности выделения слуховыми интернейронами ритмической составляющей сигнала при добавлении полосового шума ранее был показан Н.Г. Бибиковым (Bibikov, 2002).
4. Сканирование по частотному диапазону путем перестройки резонанса ТО. Метод потенциально обладает повышенной помехозащищенностью, так как реальное восприятие звука при этом происходит не в широком диапазоне частот, например, 10–140 кГц, а селективно, в пределах ширины резонансной кривой.
5. Настройка одного из резонансов ТО на частоту входного сигнала. Этот режим требует определенного времени для настройки на стимул и больше подходит для слежения за уже обнаруженным сигналом. В электрофизиологических экспериментах эффект настройки на воспринимаемый сигнал был описан для высокочастотной части диапазона акустического восприятия совок (Лапшин, Воронцов, 2004).
6. Специфика обработки сигналов в ЦНС перед запуском того или иного поведенческого ответа. При формировании реакции маневрирования в горизонтальной плоскости важна информация о пространственном расположении источника звука, которая кодируется на основе различий нейронных откликов в правом и левом ТО. Напротив, реакция ускорения полета могла инициироваться суммарной информацией, поступающей от обоих ТО (Roeder, 1966).
Однонаправленное влияние нескольких из перечисленных механизмов и их возможная приуроченность к конкретным поведенческим программам должны порождать неопределенность в измерении слуховых порогов, причем область такой неопределенности, согласно результатам экспериментов, весьма обширная: на диаграмме рис. 7 ей соответствует зона “д” шириной в диапазоне амплитуд порядка 35 дБ. По существу это значение – мера нашего незнания механизмов регуляции слуховой чувствительности совок и, соответственно, реальной стратегии их акустического поведения.
Нет оснований полагать, что многослойная система поведенческих порогов, обнаруженная у совок, представляет собой специфическое свойство этих насекомых. Более вероятно, что подобные многоуровневые системы – обычное явление в природе. Если животное по-разному реагирует на внешние стимулы одной модальности в зависимости от их физических параметров (например, разные поведенческие ответы на громкий, либо тихий акустические сигналы), то значения измеренных порогов будут определяться теми критериями реакций, которые исследователи приняли в процессе подготовки экспериментов. Таким образом, актуализация определенной пороговой области (или слоя) в ходе изучения сенсорной системы животного может зависеть либо от априорных установок, в том числе, принятых по аналогии, либо даже от случайных факторов.
Работа частично поддержана РФФИ (грант № 02-04-48256).
Список литературы
Лапшин Д.Н. Эхолокационная система бабочек. М.: Наука, 2005. 207 с.
Лапшин Д.Н. Центральные механизмы параллельной обработки информации в слуховой системе бабочек (Lepidoptera, Noctuidae). Сенсорные системы. 2010. Т. 24. № 3. С. 242–254.
Лапшин Д.Н. Обработка суммы двух ритмических потоков в центральных отделах слуховой системы бабочек (Lepidoptera, Noctuidae). Сенсорные системы. 2011. Т.25. № 2. С. 143–155.
Лапшин Д.Н., Воронцов Д.Д. Частотная настройка слуховой системы совок (Lepidoptera, Noctuidae) в полете. Сенсорные системы. 2000. Т. 14. № 4. С. 304–313.
Лапшин Д.Н., Воронцов Д.Д. Процессы захвата и сопровождения акустического сигнала слуховой системой совок (Noctuidae, Lepidoptera). Сенсорные системы. 2004. Т. 18. № 3. С. 265–272.
Лапшин Д.Н., Воронцов Д.Д. Механизмы динамического формирования частотной характеристики слуховой системы совок (Noctuidae, Lepidoptera). Сенсорные системы. 2005. Т. 19. № 4. С. 322–331.
Adams W.B. Mechanical tuning of the acoustic receptor of Prodenia eridania (Cramer) (Noctuidae). J. Exp. Biol. 1972. V. 57. P. 297–304.
Agee H.R. Response of flying bollworm moths and other tympanate moths to pulsed ultrasound. Ann. Entomol. Soc. Amer. 1969a. V. 62. № 4. P. 801–807. https://doi.org/10.1093/aesa/62.4.801
Agee H.R. Response of Heliothis spp. (Lepidoptera: Noctuidae) to ultrasound when resting, feeding, courting, mating, or ovipositing. Ann. Entomol. Soc. Amer. 1969b. V. 62. № 5. P. 1122–1128. https://doi.org/10.1093/aesa/62.5.1122
Bezrukov S.M., Vodyanoy I. Stochastic resonance in non-dynamical systems without response threshold. Nature. 1997. V. 385. № 23. P. 319–321. https://doi.org/10.1038/385319a0
Bibikov N.G. Addition of noise enhances neural synchrony to amplitude-modulated sounds in the frog’s midbrain. Hearing Research. 2002. V. 173. P. 21–28. https://doi.org/10.1016/s0378-5955(02)00456-2
Callahan P.S., Carlysle T.C. Comparison of the epaulette and micronodules on the tympanic membrane of the corn earworm moth with those of the cabbage looper. Ann. Entomol. Soc. Amer. 1972. V. 65. P. 918–925. https://doi.org/10.1093/aesa/65.4.918
Fyodorova M.V., Lapshin D.N. Responses of moths to ultrasounds. Sensory System and Communication in Arthropods. Edit. F.G. Gribakin, K. Wiese, A.V. Popov. Basel. Birkhäuser Verlag. 1990. P. 178–182.
Madsen B.M., Miller L.A. Auditory input to motor neurons of the dorsal longitudinal flight muscles in a noctuid moth (Barathra brassicae L.). J. Comp. Physiol. 1987. V. 160. P. 23–31. https://doi.org/10.1007/bf00613438
Payne R.S., Roeder K.D., Wallman J. Directional sensiti-vity of the ears of noctuid moths. J. Exp. Biol. 1966. V. 44. № 1. P. 17–32. https://doi.org/10.1242/jeb.44.1.17
Roeder K.D. The behavior of free flying moths in the pre-sence of artificial ultrasonic pulses. Anim. Behav. 1962. V. 10. № 3. P. 300–304.
Roeder K.D. Acoustic sensitivity of the noctuid tympanic organ and its range for the cries of bats. J. Insect. Phy-siol. 1966. V. 12. P. 843–859. https://doi.org/10.1016/0022-1910(66)90035-7
Roeder K.D. Turning tendency of moths exposed to ultrasound while in stationary flight. J. Insect. Physiol. 1967. V. 13. P. 873–888. https://doi.org/10.1016/0022-1910(67)90051-0
Roeder K.D., Treat A.E. Ultrasonic reception by the tympanic organ of noctuid moths. J. Exp. Zool. 1957. V. 134. P. 127–158. https://doi.org/10.1002/jez.1401340107
Roeder K.D., Treat A.E. The detection and evasion of bats by moths. Am. Sci. V. 49. 1961. P. 135–148.
Schiolten P., Larsen O.N., Michelsen A. Mechanical time resolution in some insect ears. J. Comp. Physiol. A. 1981. V. 143. P. 289–295. https://doi.org/10.1007/BF00611164
Suga N. Functional organisation of two tympanic neurons in noctuid moths. Jpn. J. Physiol. 1961. V. 11. P. 666–677. https://doi.org/10.2170/jjphysiol.11.666
Surlykke A., Miller L.A. Central branchings of three sensory axons from a moth ear (Agrotis segetum, Noctuidae). J. Insect. Physiol. 1982. V. 28. № 4. P. 357–364. https://doi.org/10.1016/0022-1910(82)90048-8
Windmill J.F.C., Jackson J.C., Tuck E.J., Robert D. Keeping up with bats: dynamic auditory tuning in a moth. Current Biology. 2006. V. 16. P. 2418–2423. https://doi.org/10.1016/j.cub.2006.09.066
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы



