Сенсорные системы, 2023, T. 37, № 1, стр. 17-34
Что дала адаптивная оптика для понимания механизмов цветового зрения человека
1 Федеральное государственное бюджетное учреждение науки
Институт проблем передачи информации им. А.А. Харкевича Российской академии наук (ИППИ РАН)
127051 Москва, Большой Каретный переулок, д.19, Россия
* E-mail: maximova@iitp.ru
Поступила в редакцию 28.09.2022
После доработки 24.10.2022
Принята к публикации 03.11.2022
- EDN: AUAGVN
- DOI: 10.31857/S0235009223010055
Аннотация
Кратко представлены сведения о цветовом зрении животных и человека, истории и методах его изучения. Описаны результаты фундаментальных исследований в этой области, полученные при помощи адаптивной оптики и сканирующей лазерной офтальмоскопии (AOSLO) в комплексе с денситометрией, фазочувствительной оптической когерентной томографией (AO-PSOCT) и кальциевым имаджингом (Ca++ imaging). Эти методы позволили впервые in vivo увидеть мозаику колбочек сетчатки человека, построить карты расположения колбочек трех разных типов (L, M, S), исследовать цветовосприятие человека в ответ на стимуляцию одиночных колбочек.
ВВЕДЕНИЕ
Изучение цветового зрения (ЦЗ) человека начиналось в восемнадцатом веке с работ Исаака Ньютона и продолжается по сей день. Многие великие ученые прошлого внесли свой вклад в исследование этого явления (см. обзор Орлов, 2006). Осмысление наблюдений и результатов психофизических исследований привело к пониманию того, что ЦЗ человека трехмерно, т.е. основано на наличии в сетчатке трех приемников – трех типов специализированных фоторецепторов – колбочек (L, M, S), кривые спектральной чувствительности которых расположены в длинноволновой (L), средневолновой (M) и коротковолновой (S) областях спектра. Сигналы колбочек сравниваются затем попарно оппонентно (L/M, (L + M)/S) специальными нервными клетками на разных этажах зрительной системы (Dacey, 1999; Dacey, 2000; Dacey, Packer, 2003; Lee, 2004; Solomon, Lennie, 2007; Thoreson, Dacey, 2019).
По этическим и методическим ограничениям исследования ЦЗ человека ранее проводились только в рамках психофизических опытов и теоретических рассмотрений. Понимание физиологических механизмов ЦЗ человека к настоящему времени (в 20-м и 21 веках) существенно обогатилось, благодаря расширению круга объектов исследования (модельные животные) и появлению новых методов, не представимых в докомпьютерную эпоху. Цветовое зрение человека (приматов) рассматривается в плане эволюционном, как одно из решений, выработанных под влиянием адаптации к изменяющимся условиям существования и закрепленных естественным отбором (Bowmaker, 1998; Jacobs, 2009).
Сетчатки позвоночных животных устроены по единому плану из типовых клеточных элементов (Ramon-y-Cajal, 1892; Walls,1942). Развитие зрительной системы животных происходит по общему плану под контролем единого мастер-гена – Рах 6 (Gehring, Ikeo, 1999). Это дает основание для обобщения результатов, получаемых в работе на животных, и использования их для понимания механизмов зрения человека. Выбраны модельные организмы (мышь, рыбка Danio rerio и другие), на которых проводятся разнообразные исследования, имеющие не только познавательное (теоретическое) значение, но и выход в медицинскую практику (Bilotta, Saszik, 2001; Movshon, 2014).
Краткие сведения о ЦЗ в животном мире. Исследования ЦЗ животных начались во второй половине прошлого века, тогда и был открыт целый мир разнообразных систем ЦЗ, отличных от человеческой. О наличии ЦЗ у животных свидетельствуют как данные о рецепторном составе сетчаток, зрительных пигментах рецепторов, так и результаты поведенческих экспериментов и исследований обработки зрительных сигналов на нейронном уровне (Thoreson, Dacey, 2019). Очевидно, что ЦЗ полезно, более того, необходимо животным, как в пищедобывательном, так и в территориальном, социальном, оборонительном и брачном поведении. Цвет (окраска) – это один из признаков предмета, облегчающий узнавание предмета, оценку его качества (например, спелость фруктов), обнаружение его на фоне (вишня или рябина в зеленой кроне дерева).
Все современные животные за редкими исключениями обладают той или иной системой ЦЗ. У многих видов рыб, птиц и насекомых – ЦЗ четырехмерно. У большинства млекопитающих ЦЗ двумерно; у приматов и нескольких видов сумчатых – трехмерно (Bowmaker, 1998; Dominy, Lucas, 2001; Arrese et al., 2002; Arrese et al., 2006). Только у нескольких видов ныне живущих позвоночных животных отсутствует ЦЗ – это 13 видов китообразных; десять видов ластоногих; ночные грызуны и два вида ночных приматов (Jacobs et al., 1996). Отсутствие ЦЗ у этих животных рассматривается как адаптация к образу жизни, в частности, к условиям низкого уровня освещения или обитанию в мутной среде (Peichl, Moutairou, 1998; Peichl et al., 2001; Peichl, 2005; Levenson et al., 2006).
К настоящему времени изучены биохимия, молекулярная структура и генетика зрительных пигментов (ЗП) (Yokoyama, 2000; Yokoyama, Yokoyama, 1996; Yokoyama, 2002). Молекула ЗП состоит из белка-опсина и связанного с ним хромофора – остатка витамина А. Этот комплекс и определяет спектральную чувствительность ЗП (Овчинников и др., 1982; Островский, Говардовский,1992; Каламкаров, Островский, 2002; Говардовский и др., 2015). Методом микроспектрофотометрии сняты кривые спектральной чувствительности отдельных колбочек (впервые на рыбе, а к настоящему времени на многих видах) (Marks, 1965; Bowmaker, 1984; Govardovskii et al., 2000). Показано, что зрительные пигменты являются одним из основных “строительных материалов” мембраны наружных сегментов фоторецепторов. Известны гены, кодирующие опсины ЗП. Как показывают молекулярные часы11, эти гены возникли более 500 млн лет тому назад в результате дупликации анцестрального гена и последующих мутаций. Уже тогда появилась возможность возникновения ЦЗ (Baden et al., 2020; Maximov, 1998; 2000; Yokoyama, 2000; Collin, Trezise, 2021). У современной миноги – потомка древних бесчелюстных – и современных рыб, амфибий, рептилий, птиц в молекулах зрительных пигментов представлены опсины четырех типов (Marc, 1999).
В 60-е годы прошлого века изучение ЦЗ человека и животных было одной из основных тем лаборатории “Биофизики зрения” Института биофизики АН СССР. Для колориметрии на животных (на изолированном глазу или отдельных клетках сетчатки) был разработан метод колориметрии замещения и создан на основе монохроматора прибор – колориметр замещения (Бонгард, 1955; Danilova, Mollon, 2022). В колориметре замещения сравнение и уравнивание излучений происходит во времени (идет чередование стимулов без темнового промежутка). О равенстве (неразличимости) сравниваемых излучений при замене одного излучения на другое говорит отсутствие ответного сигнала: ретинограммы, нейрограммы, реакции одиночной клетки. Этим методом в 60-е годы прошлого века были получены данные о размерности ЦЗ и свойствах приемников ящериц, черепах, рыб и насекомых (Орлов, Бызов, 1961; Орлов, Максимова, 1964; Mazohin-Porshnyakov, 1959; 1962; Orlov, Maximova, 1965; Кондрашев, Орлов, 1975). На этом приборе исследовали и ЦЗ человека (Бонгард, Смирнов, 1956; Бонгард, Смирнов, 1965). Идею колориметрии замещения (silent substitution) использовали и иностранные авторы (обзор Estévez, Spekreijse, 1982).
ЦЗ И РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
Сам факт, что ЦЗ поддерживается в эволюции сотни миллионов лет, свидетельствует о его важной роли в жизни животных. В то же время цветоразличение, на первый взгляд, как бы соперничает с такой важной функцией, как острота зрения. Обе функции используют на входе одну и ту же матрицу фоторецепторов. С одной стороны – пространственное зрение (в частности, стереозрение, построение объема) требует максимально возможной остроты, в пределе достигаемой максимальной плотностью одинаковых фоторецепторов. С другой стороны, ЦЗ – обнаружение цветных объектов на цветном фоне, узнавание и различение объектов по их окраске – требует соответствующей обработки сигналов, идущих от колбочек разных типов (колбочек с разной спектральной чувствительностью). Чтобы понять, как разрешается противоречие между пространственным зрением и ЦЗ, полезно знать, по крайней мере, как колбочки (L, M и S) распределены на сетчатке (Williams et all.,1991).
Расположение колбочек в сетчатке рыб, рептилий и птиц. У рыб, амфибий, рептилий, птиц – колбочки гетероморфны (Walls, 1942; Marc, 1999). В сетчатке рыб колбочки разных морфологических типов образуют матрицы с регулярной кристаллической мозаикой, характерной для каждого вида (Engström, 1960; Stieb et al., 2019). Показано, что с морфологическим типом колбочки коррелирует ее спектральная чувствительность, т.е. наличие в ее наружном сегменте того или иного зрительного пигмента (Li et al., 2012; Allison et al., 2010; Stieb et al., 2019). Регулярность рецепторной мозаики транслируется в более глубокие слои сетчатки (Подугольникова, Максимов, 1973; 1977). Не исключено, что кристаллическая правильность “монтажа” клеточных элементов сетчатки рыб способствует “экономности” организации обработки цветовой информации. У рыб уже в сетчатке имеется несколько типов дважды цветооппонентных ганглиозных клеток. Их аксоны проецируются ретинотопически в tectum opticum – главный первичный зрительный центр рыб, где их терминали образуют целый слой (Максимова и др., 2020).
У рептилий и птиц маркером колбочек с разной спектральной чувствительностью в живой сетчатке служат внутриколбочковые фильтры. Это жировые капли, окрашенные каротиноидами. Красные капли расположены в L колбочках (с длинноволновочувствительным пигментом), оранжевые и желтые – в M колбочках. В синечувствительных и УФ-чувствительных колбочках жировые капли бесцветны (Toomey, Corbo, 2017; Wilkie et al., 1999; Marc, 1999). Расположение колбочек разных типов у этих животных можно видеть прямо на живой инвертированной сетчатке.
Для некоторых животных, в том числе для рыб, мышей, показано экологически значимое распределение разных типов колбочек в разных участках сетчатки. Сцены природы над и под горизонтом различаются по распределению хроматических и ахроматических признаков. В сетчатке мыши S и M колбочки распределены по дорзовентральной оси по градиентам с преобладанием M колбочек в дорзальной сетчатке (нижние поля зрения), а S колбочек в вентральной сетчатке (верхние поля зрения). У мальков данио колбочки, чувствительные к УФ, преобладают в назальной и вентральной областях сетчатки. Это обеспечивает контрастное силуэтное зрение на фоне неба в верхних полях зрения и различение планктона, отражающего УФ, в ближнем переднем поле зрения. Обработка сигналов от трех типов (L, M, S) колбочек сосредоточена в дорзальной сетчатке (в нижних полях зрения) (Baden et al., 2013; Qiu et al., 2021).
Рецепторы млекопитающих. Колбочки млекопитающих (и змей) мономорфны, и нет признаков, указывающих на наличие в них тех или иных зрительных пигментов (Marc, 1999; Ahnelt, Kolb, 2000). Причину мономорфности колбочек млекопитающих (и змей) принято объяснять особенностями их эволюции – долгий период роющего, скрытного сумеречного образа жизни (Walls, 1942; Marc, 1999).
С появлением иммунохимических методов удалось выявить в сетчатках млекопитающих синечувствительные колбочки. Они составляют от трех до 10% от общего количества колбочек (Wikler, Rakic, 1990; Jacobs et al., 1991; Jacobs, 2013). Многие животные, считавшиеся до того ахроматами, оказались дихроматами. Большинство наземных млекопитающих – дихроматы. Только у современных дневных приматов вновь возникла трихромазия в результате дупликации гена длинноволновочувствительного пигмента (Jacobs, Deegan, 1999; Marc, 1999; Dominy, Lucas, 2001; Dulai et al., 1999; Silveira et al., 2014; Henriques et al., 2021). Как показывают молекулярные часы, у приматов Старого Света это произошло 40 млн лет назад, а у ревунов (рода Aluatta) – крупных приматов Нового Света –14 млн лет назад (Hunt et al.,1998). Эти два независимых события, разнесенные по времени и территориально, привели к возникновению двух одинаковых наборов из трех колбочковых пигментов с максимумами ~430; 532 и 563 нм, что говорит, в частности, о жестком давлении естественного отбора на ЦЗ (Henriques et al., 2021).
Морфологию сетчатки человека и обезьян изучали на уровне световой и электронной микроскопии, используя разные модификации техники серебрения по Гольджи (Polyak, 1941; Boycott, Dowling, 1969; Dowling, Boycott, 1966). Позднее подробное исследование рецепторной матрицы сетчатки человека было выполнено на целой фиксированной сетчатке с использованием дифференциальной интерференционно-контрастной техники Номарского (Curcio et al., 1990). Измерена пространственная плотность колбочек и палочек в восьми изолированных целых сетчатках человека, и построены карты плотности фоторецепторов. Оценена индивидуальная изменчивость. Годом позже были выделены иммунохимически синечувствительные S колбочки (Curcio et al., 1991). Они составляли <10% от общей популяции колбочек, отсутствовали в центральной ямке (фовеа), и наибольшей плотности достигали в парафовеальной области в 10° от ее центра. Однако L и M колбочки и иммунохимически по-прежнему различить не удалось, в частности, из-за очень сходной структуры L и M опсинов (Nathans et al., 1986).
В 60-х годах прошлого века делались попытки выяснить относительное количество и расположение L и M колбочек в фовеа человека косвенным путем. В психофизических опытах на людях измеряли разрешающую способность для красных и зеленых ортогональных решеток. В одном случае она оказалась одинаковой и сравнимой с плотностью колбочек в фовеа (Бонгард, Смирнов, 1957). Это дало основание для гипотезы о содержании в каждой колбочке и красного и зеленого приемников одновременно. Было также показано, что информация от разных приемников может идти по одному нервному волокну (Бонгард, Смирнов, 1957). Результаты других авторов были в пользу того, что красночувствительные и зеленочувствительные колбочки образуют отдельные скопления – “грозди” (Hartridge, 1946). Только прямое наблюдение матрицы рецепторов сетчатки человека, маркированных по признаку спектральной чувствительности, могло бы разрешить эти разночтения. Сетчатка человека достается исследователям только после операции или после смерти, и провести микроспектрофотометрию удается только на выделенных рецепторах (Bowmaker, Dartnall, 1980; Dartnall et al.,1983). На нескольких крошечных фовеальных участках сетчатки макака-резуса были профотометрированы 183 колбочки. (Mollon, Bowmaker, 1992). На тот момент это было колоссальным достижением экспериментального мастерства. Было показано, что L, M и S колбочки с максимумами чувствительности 560; 530 и 440 нм расположены хаотично. Расположения колбочек разной спектральной чувствительности в сетчатке человека никто не видел до 1999 г. Это наконец удалось благодаря применению адаптивной оптики (АО).
ИЗУЧЕНИЕ СЕТЧАТКИ ЧЕЛОВЕКА IN SITU ПРИ ПОМОЩИ АО
Еще у Гельмгольца возникла мысль неинвазивного исследования сетчатки живого человека. Он придумал, как заглянуть в глаз через зрачок. В 1851 г. Гельмгольц предъявил ученому миру первый офтальмоскоп. Свет свечи при помощи зеркала направлялся в глаз испытуемого, в отраженном от глазного дна свете исследователю впервые открылась картина внутренней поверхности глаза (Keeler, 2002). Сейчас трудно представить медицину без офтальмоскопии. Три основных направления усовершенствования офтальмоскопа, указанных Гельмгольцем, по которым шла работа офтальмологов последующие 150 лет, – это подбор оптимального источника освещения отражающей поверхности, направляющей свет в глаз, и способы коррекции нечеткого изображения глазного дна. До сих пор в наших поликлиниках при стандартном обследовании пациентов используется офтальмоскоп, где свеча заменена на щелевую лампу, а прямое зеркало – на вогнутое с центральным отверстием. Такой прибор позволяет видеть кровеносные сосуды, выход зрительного нерва (слепое пятно), желтое пятно и выявить некоторые патологии. Для того чтобы увидеть через зрачок матрицу фоторецепторов, понадобилась вся мощь современных научных технологий: компьютеризация, лазерное освещение, система, следящая за движениями глаза и компенсирующая эти движения, конфокальная микроскопия и деформируемое зеркало, исправляющее волновой фронт отраженного от глазного дна света – адаптивная оптика (АО).
Идея АО была позаимствована у астрономов. Для борьбы с неоднородностью атмосферы все наземные телескопы имеют зеркала, набранные из многочисленных маленьких зеркал, настраиваемых на наилучшее видение. В офтальмологии, при картировании рецепторной матрицы АО представляет собой инструмент, с применением которого измеряются и затем компенсируются монохроматические аберрации, существующие на оптическом пути через передние среды глаза (роговицу, зрачок, хрусталик и стекловидное тело) и ткань сетчатки. Идея картирования и компенсации оптических искажений в глазу человека высказывалась еще в 1961 г. (Смирнов, 1961). Тогда невозможно было реализовать технически применение методов АО.
Система АО измеряет искаженный в результате оптических аберраций волновой фронт при помощи датчика волнового фронта Шака-Хартмана (a Shack-Hartmann Wavefront Sensor) и компенсирует его с использованием корректора волнового фронта. Эти два компонента АО связаны центральной системой управления (рис. 1).
Рис. 1.
Схема системы адаптивной оптики для визуализации рецепторной матрицы сетчатки живого человека, показывающая как взаимосвязаны три основные ее компонента: сенсор, корректор и контроллер.
1 – сенсор – Шака-Хартмана – измеритель волнового фронта, 2 – корректор волнового фронта – трансформируемое зеркало, 3 – контроллер.
Стрелкой показана обратная связь с сенсора через компьютер на деформируемое зеркало (по K.M. Hampson Adaptive optics and vision. Journal of Modern Optics. 2008).
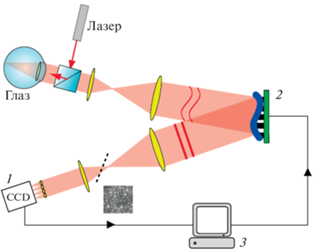
Изображение участка сетчатки, скорректированное АО, записывается при помощи камеры высокого разрешения (Roorda, Williams, 1999; Hampson, 2008; Gill et al., 2019). Один и тот же участок сетчатки записывается несколько раз для увеличения соотношения сигнала над шумом на изображении. Измерение и полная коррекция волнового фронта позволили улучшить оптическое разрешение с 10–15 мкм до ~2 мкм и визуализировать фоторецепторы, ганглиозные клетки, клетки пигментного эпителия сетчатки.
История и этапы разработки установки с АО для изучения рецепторов глаза живого человека описаны в обзорaх (Hampson, 2008; Williams, 2011; Merino, Loza-Alvarez, 2016) и могут быть представлены кратко следующим образом.
В 1980 г. для исследования глазного дна был предложен сканирующий лазерный офтальмоскоп (scanning laser ophthalmoscope – SLO). В 1989 г. для улучшения ретинального изображения, получаемого при помощи SLO, было применено деформируемое зеркало. В 1996 г. была сконструирована фотокамера специально для фиксации отдельных колбочек в нормальном глазу человека.
В 1999 г. в журнале “Nature” появилось краткое сообщение “The arrangement of the three cone classes in the living human eye” (Расположение колбочек трех классов в живом глазу человека) (Roorda, Williams, 1999). Началась качественно новая эпоха изучения рецепторов сетчатки человека.
Первое открытие, сделанное благодаря применению АО
Впервые расположение S, M и L колбочек было показано на изображениях участков матрицы сетчаток двух испытуемых, полученное in vivo при помощи АО в комплексе с денситометрией (Roorda, Williams, 1999)22.
Освещая сетчатку светом разных длин волн, можно вызвать частичное или полное (в зависимости от интенсивности) дифференциальное обесцвечивание зрительного пигмента в наружных сегментах колбочек и, как результат, – изменение их отражательной способности.
Изображение матрицы фоторецепторов темноадаптированной сетчатки сравнивается с изображениями, полученными после селективного обесцвечивания фотопигментов колбочек светом 550 нм. Для каждой области сетчатки было сделано примерно 50 изображений, снятых в течение пяти дней и усредненных для увеличения отношения сигнал/шум. L и M колбочки выглядят светлыми, так как они поглощают сильно, и, соответственно, обесцвечиваются. Так как S колбочки практически не поглощают свет 550 нм, они выглядят темными пятнышками на изображениях поглощения. Идентифицированные таким образом S-колбочки отмечали на карте рецепторной матрицы и удаляли из последующего анализа.
Для разделения оставшихся L и M колбочек сравниваются изображения поглощения, полученные в двух других условиях обесцвечивания. В первом – при освещении сетчатки светом 650 нм обесцвечиваются L колбочки, во втором, – при освещении светом 470 нм обесцвечиваются M колбочки. Распределения темных фоторецепторов на изображениях поглощения (или светлых на картине отражения) в этих двух случаях оказываются противоположными и дополнительными.
Идентифицированные таким способом L, M и S колбочки, содержащие разные зрительные пигменты (имеющие разные спектральные чувствительности), представляют на картах рецепторной матрицы для наглядности разными цветами: L колбочки – красным, M колбочки – зеленым и S колбочки – синим. Подробный статистический анализ распределения каждого из трех типов колбочек на матрице фоторецепторов в сетчатках (примерно в 1° от фовеа) двух мужчин был представлен в 2001 г. Во всех глазах M и L колбочки были расположены случайно, что приводит к образованию небольших участков, содержащих колбочки одного типа. S колбочки составляли не более 10% от общего числа колбочек. Соотношение количества М и L колбочек испытуемых сильно различалось. Несмотря на это, оба испытуемых были нормальными трихроматами (Roorda et al., 2001). В 2005 г. эти результаты были подтверждены уже на восьми испытуемых с нормальным ЦЗ (Hofer et al., 2005). Фенотип цветового зрения каждого из восьми обследуемых лиц оценивали с использованием равенства Рэлея, псевдоизохроматических таблиц (AO-HRR, Dvorine и Ishihara) и теста “100 оттенков” Фарнсворта-Манселла. Показатели каждого испытуемого во всех тестах соответствовали принятым критериям нормального цветового зрения. Генетический анализ показал, что испытуемые мужчины имели наборы L и M генов, обеспечивающие нормальное ЦЗ. Отношение количества L к M колбочкам у пяти испытумых (с инициалами HS, YY, AP, MD, BS) было следующим: HS, 1: 2.7; YY, 1.1: 1; AP, 1.2: 1; MD, 1.9: 1; и BS, 16.5: 1. Сорокократная вариация относительного количества L и M колбочек у разных испытуемых не отражалась на их цветоразличительных способностях (Hofer et al., 2005; Williams, 2011). Результат казался шокирующим. Из него следовало, что и небольшое количество колбочек каждого типа достаточно для организации процесса цветоразличения при соответствующей обработке сигналов последующими, связанными с этими колбочками нервными клетками. Напомним, что и S колбочек всегда не более десяти процентов от общего количества колбочек, и они отсутствуют в фовеа.
Причина случайного распределения L, M и S колбочек в картине рецепторной мозаики сетчатки человека, выявленного при помощи АО in vivo, определяется как расположением генов, кодирующих опсины зрительных пигментов в хромосомах человека, так и случайным процессом, определяющим наличие того или иного пигмента в каждой колбочке. Ген, кодирующий S-опсин, расположен в седьмой хромосоме. Гены, кодирующие опсины фотопигментов L и M колбочек, расположены тандемом в q-плече Х-хромосомы. В нормальной сетчатке экспрессия L гена или M гена в каждой колбочке опосредована случайным процессом. Предполагается, что в каждой колбочке взаимоисключающую экспрессию L/M генов красных и зеленых опсинов контролирует специальный участок хромосомы – (Locus Control Region). Он связывается с промотором либо L, либо M гена, определяя экспрессию только одного гена опсина в этой клетке, и тем самым, как правило, случайное расположение этих двух классов (L, M) колбочек (Nathans et al., 1986).
Второе открытие, сделанное благодаря применению АО: разная природа L, M и S дихромазий
Примерно в четырех процентах человеческой популяции (в основном у мужчин) обнаруживаются отклонения от трехмерности ЦЗ – дихромазии. Отсутствие красного приемника (– L) – протанопия; отсутствие зеленого приемника (– M) – дейтеранопия и очень редко отсутствие синего приемника (– S) – тританопия. Для констатации нормального трехмерного ЦЗ и выявления его аномалий разработаны психофизические тесты: установление равенства Рэлея; псевдоизохроматические таблицы Ишихара; Рабкина; тест “100 цветовых оттенков” и другие (Lakowski, 1981). В настоящее время существуют специальные тестирующие приложения в смартфонах, позволяющие пользователю быстро самостоятельно оценить свои цветоразличительные способности. Как говорилось выше, гены, кодирующие L и M опсины, расположены тандемом в q-плече Х-хромосомы. Причем может быть разное число копий этих генов: с одним геном L- и от одного до трех копий гена M-опсина (Nathans et al.,1986). Такое расположение генов опсинов красно- и зеленочувствительного пигментов при обмене генетическим материалом в мейозе между Х-хромосомами партнеров может в результате привести как к нормальному, так и дефектному набору этих генов в Х-хромосомах дочернего организма. Дихромазии (– L и –M) встречаются чаще у мужчин, наследующих одну Х-хромосому, чем у женщин, имеющих две Х-хромосомы.
Причину дихроматического ЦЗ (протанопию – утрату длинноволново чувствительного (L) приемника и дейтеранопию – средневолново чувствительного (M) приемника) можно представить по-разному: во-первых, как результат потери одного класса колбочек; во-вторых, при нормальном количестве колбочек, содержанием во всех колбочках только одного из двух пигментов. Эта дилемма была разрешена при помощи АО. Было показано что протанопия и дейтеранопия имеют разную природу.
При помощи АО-денситометрии были получены карты рецепторной мозаики двух испытуемых – протанопа и дейтеранопа. У протанопа в центральной сетчатке было нормальное количество функционирующих колбочек, и все они были зеленочувствительные. Генетический анализ показал, что у этого испытуемого L-ген в Х-хромосоме был замещен M-геном, кодирующим опсин зеленочувствительного пигмента.
У дейтеранопа на изображении матрицы фоторецепторов М-колбочки отсутствовали. Регулярность общей мозаики колбочек у этого человека была нарушена, тогда как отдельные мозаики L и S колбочек были нормальны (Carroll et al., 2004). Генетический анализ показал в этом случае, что нормальный М-ген фотопигмента был замещен дефектным M-геном, кодирующим нефункционирующий пигмент. Зеленочувствительные колбочки в результате резорбировались по всей мозаике фоторецепторов. (Напомним, что только нормальный фотопигмент является строительным материалом наружного сегмента фоторецептора.) При обследовании еще трех дейтеранопов и двух протанопов новым методом – АО, совмещенной с когерентной томографией (см. далее), было обнаружено иное проявление L и M дихромазий на рецепторной матрице (Zhang et al., 2019).
Тританопия – редко встречающийся дефицит цветового зрения в сине-зеленой области спектра. Предполагалось, что причиной этого нарушения ЦЗ может быть нарушение структуры или стабильности пигмента S-колбочек, связанного с различными аминокислотными заменами в молекуле опсина. При помощи АО – денситометрии было проведено обследование 56-летнего мужчины–тританопа (по всем психофизическим тестам) и его 33-летней дочери со слабыми тритан отклонениями. У отца на картах рецепторной мозаики не было обнаружено S-колбочек. В результате отсутствия S-колбочек была нарушена общая регулярная мозаика колбочек. У дочери в разных участках сетчатки рецепторной мозаики присутствовали все три типа колбочек, и практически не обнаружено дефектов регулярности мозаики. И у отца, и у дочери в гене опсина синечувствительного пигмента (расположенного в седьмой хромосоме) была выявлена новая мутация – R283Q. Фенотипическая разница между отцом и дочерью, имеющая одну и ту же мутацию, может объясняться тем, что они находились в момент исследования на разных стадиях прогрессирующей с возрастом атрофии наружных сегментов S-колбочек, приведшей у отца к утрате S-колбочек (Baraas et al., 2007).
Третье открытие, сделанное благодаря применению АО. Цветовые ощущения при стимуляции одиночных колбочек
Развитие и совершенствование методов АО в комплексе с денситометрией и сканирующей лазерной офтальмоскопией (AOSLO – adaptive optics combined with scanning laser ophthalmoscopy) позволило не только получать карты высокого разрешения матрицы фоторецепторов сетчатки человека вблизи фовеа, но и возбуждать одиночные колбочки. Для зрительной стимуляции AOSLO может производить стимулы с высочайшей пространственной точностью. Это связано с тем, что визуализация и стимуляция могут быть пространственно и во времени совмещены в одном и том же луче в SLO (Roorda et al., 2002).
Было показано на картах высокого разрешения одних и тех же участков сетчатки испытуемого вблизи фовеа (1°–1.5°), снятых через разные промежутки времени (через день, месяц), что расположение отдельных идентифицированных L, M и S колбочек в точности воспроизводится. Это дало возможность многократно стимулировать разные заранее идентифицированные (L, M) отдельные колбочки и узнавать субъективные ощущения испытуемого. Первый такой опыт был проведен на двух нормальных трихроматах. Спектральная чувствительность выбранных для стимуляции колбочек и их положение на карте были заранее определены. Поскольку кривые спектральной чувствительности L и M колбочек человека имеют близко расположенные максимумы и перекрываются в желто-зеленой области, использовался один стимул (543 нм, с шириной полосы 25 нм), возбуждающий те и другие колбочки. Селективность возбуждения одиночной колбочки достигалась положением стимула (светового пятнышка) на наружном сегменте только одной либо L, либо M колбочки (рис. 2).
Рис. 2.
Схема возбуждения одиночных заранее идентифицированных L и M колбочек (показаны окрашенными кружочками на фрагменте рецепторной матрицы) стимулом 543 нм; кривые спектральной чувствительности L и M колбочек человека и спектральное положение стимула, возбуждающего как L, так и M колбочки; положения светового пятна на наружном сегменте L или M колбочки обозначены стрелками.
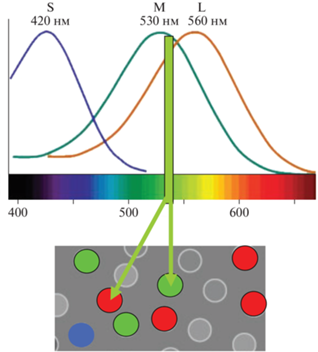
Размер стимула (~0.45' в диаметре) составлял менее половины размера внутреннего сегмента колбочки. Было показано, что: повторная селективная стимуляция отдельных рецепторов от опыта к опыту, в разные дни, вызывала у испытуемых повторяющиеся ощущения; в большинстве случаев (более, чем в половине) селективная стимуляция как L, так и M колбочек, у обоих испытуемых вызывала ощущение белого; стимуляция меньшей части колбочек вызывала ощущения, соответствующие их “номиналу”: возбуждение L колбочек – ощущение красного, М колбочек – ощущение зеленого. Отсюда был сделан вывод, что за цветовые и ахроматические ощущения ответственны разные популяции колбочек, причем за цветовые – малочисленная популяция (Hofer et al., 2005).
Результаты опытов с возбуждением отдельных колбочек вызвал новый вопрос: способствует ли ощущению цвета оппонентное окружение тестируемой колбочки?
Был поставлен следующий опыт: для стимуляции выбирали на матрице фоторецепторов колбочку (например, L), окруженную шестью M колбочками, или М колбочку, окруженную L колбочками. Ответ был отрицательный: стимуляция колбочек, окруженных в мозаике колбочками другой спектральной чувствительности, в большинстве случаев вызывала ощущение белого (Sabesan et al., 2016). При малой вероятности попадания на колбочку, вовлеченную в ЦЗ (такие колбочки относятся к малочисленной популяции), и относительно малом количестве проб такой результат легко объясним.
В редких случаях при возбуждении тех M колбочек (стимуляция которых на белом фоне вызывала у испытуемых ощущение “зеленого”) на цветном, коротковолновым фоне, вызывала ощущение “синего”. У одного из двух испытуемых при стимуляции M колбочек вероятность “синих” ответов повышалась у тех колбочек, вблизи которых находились S колбочки. Для объяснения этого результата высказано предположение, что освещение M колбочки возбуждает и зеленый, и синий оппонентные каналы обработки сигнала, а относительная активность соседних колбочек отдает предпочтение одному из них (Schmidt et al., 2018).
КОМБИНИРОВАНИЕ АО И КОГЕРЕНТНОЙ ТОМОГРАФИИ
Трихроматическое картирование мозаики колбочек человека in vivo при помощи АО в комплексе с денситометрией – первый прямой (и до недавнего времени единственный) метод визуализации рецепторной мозаики и оценки участия отдельных фоторецепторов в ЦЗ. Недавно был предложен новый комплекс – АО и фазочувствительной оптической когерентной томографии (phase-sensitive optical coherence tomography – АО-PSОCТ) (Hillmann et al., 2016; Zhang et al., 2019). АО-денситометрия сетчатки опирается на изменения отражательной способности колбочек при фотообесцвечивании. Метод АО-PSOCT использует тот факт, что при стимуляции сетчатки короткой вспышкой видимого света наружные сегменты колбочек демонстрируют быстрое увеличение длины оптического пути (optical path length – OPL) света. Амплитуда этого изменения достигает сотен нанометров в зависимости от длины волны, силы светового раздражителя и типа (S, M или L) колбочек. Исследование этого индуцированного светом изменения OPL (в терминах эквивалентного изменения фазы) показало, что оно является результатом фототрансдукции в колбочках. Авторы нового метода отмечают его преимущества по сравнению с АО-денситометрией сетчатки. Они состоят в том, что при классификации типов колбочек достигнуты значительно меньшие неопределенности (<0.02%) (по оценке самих авторов АО-денситометрии, составляющие 3.6 ± 1.6%). Существенно укорачивается время сбора данных. Оно составляет от 5 с до 30 мин, тогда как опыты АО-денситометрией, длятся по несколько часов (3–9 ч) в течение нескольких дней, что утомляет испытуемого (Sabesan et al., 2015).
Новым методом были измерены индивидуальные реакции многих сотен колбочек у 16 испытуемых с разными фенотипами и генотипами ЦЗ (пять нормальных трихроматов, три дейтеранопа, два протанопа и три дейтераномала) (Zhang et al., 2019; 2021). Были классифицированы три спектральных типа колбочек (S, M, и L) их пространственное распределение и их индивидуальные мозаики. Соотношение L/M колбочек у испытуемых сильно варьировало, что не отражалось на цветоразличительных способностях. Результаты, полученные методом АО-PSOCT на нормальных трихроматах, не отличаются от полученных ранее методом АО-денситометрии. В то же время авторы не разделяют мнения о разной природе протанопии и дейтеранопии (см. выше (Carroll et al., 2004)). У обследованных ими дейтеранопов отсутствовали M колбочки, а у протанопов – L колбочки; в остальном они были нормальны (Zhang et al., 2021).
Причина разногласий, вероятно, кроется в генетическом разнообразии дихромазий. Протанопия и дейтеранопия могут быть обусловлены, помимо отсутствия одного из генов, разными мутациями в молекуле колбочкового пигмента, приводящими к дисфункции и морфологическим нарушениям, вплоть до дегенерации колбочек. Эти дегенеративные процессы развиваются по-разному во времени, что в свою очередь приводит к нарушению регулярности колбочковой мозаики (Wagner-Schuman et al., 2010). Необходимо дальнейшее накопление данных для каждого индивидуального случая нарушения ЦЗ.
Стимуляция отдельных рецепторов и наблюдение картины возбуждения ганглиозных клеток разных типов на сетчатке животных
Со времени исследований Хьюбела и Визела обработку сигнала о цвете у приматов связывают с парвоцеллюлярной системой. К ней относятся малые бистратифицированные, зонтичные и карликовые ГК, которые посылают свои аксоны в парвоцеллюлярные слои наружного коленчатого тела (НКТ). В их кониоцеллюлярные подслои проецируются отдельно карликовые ГК, с красно-зеленой центрально-периферической оппонентной организацией рецептивных полей и в отдельные подслои – бистратифицированные (L+M/S) ГК. Сигналы нейронов этих подслоев НКТ приходят в специальные области зрительной коры (Wiesel, Hubel ,1966; Jacobs, 2009; Lee, 2004; Zeki, Marini, 1998).
В нескольких современных работах продемонстрирована связь отдельных колбочек с ганглиозными клетками трех из четырех классов парвоцеллюлярной системы на изолированной сетчатке макака ex vivo (Field et al., 2010). Для одновременной регистрации реакций полных популяций карликовых, зонтичных и мелких двухслойных ганглиозных клеток сетчатки использовалась мультиэлектродная технология. Для определения местоположения, типа и силы функционального входа каждой колбочки в каждую ГК применялась тонко структурная визуальная стимуляция. Были исследованы связи 17.380 колбочек с 1.961 ГК на семи препаратах. Показано, что рецептивные поля ГК каждого класса образуют регулярные мозаики, покрывающие все поле регистрации. Зрительный сигнал, вызванный возбуждением отдельной колбочки, вызывал сильные реакции с различной кинетикой в трех из четырех численно доминирующих типах ГК. Каждая из популяций on и off карликовых и зонтичных ГК собирала сигналы с полной популяции L и M колбочек. Только карликовые клетки off-типа часто получали сильные сигналы от S колбочек (Li et al., 2014; Kling et al., 2019). (Мы не останавливаемся подробнее на этих работах, так как в них не использовалась АО).
AOSLO (an adaptive optics scanning laser ophthalmoscope) был использован для визуализации и прямой стимуляции отдельных колбочек in vivo на целом наркотизированном животном (макаке). Реакции нейронов регистрировали экстраклеточным микроэлектродом в НКТ. Показано, что парвоцеллюлярные нейроны НКТ с высокой надежностью реагировали на стимуляцию одиночных колбочек (Sincich et al., 2009). Эти немногие работы на животных с использованием новых технологий непротиворечиво (гармонично) дополняют результаты, полученные ранее методами электрофизиологии и индикаторной гистохимии, и новые результы, полученные на людях при помощи АО.
Структура фовеа примата, исследованная комбинированием АО и Са++ имаджинга
Как говорилось выше, острота зрения, или разрешающая способность, в пределе определяется плотностью расположения функционально одинаковых колбочек. В сетчатках животных, как правило, имеется специализированная область (области) острого зрения, где плотность колбочек максимальна. У черепах и птиц – это “красное пятно”, у многих рыб, птиц, дельфинов – две области острого зрения, у животных с панорамным зрением, животных-жертв, (например, кроликов) – зрительная полоска – visual streak (Marc, 1999). У человека и приматов это фовеа (Provis et al., 2013).
Для человеческой фовеа характерны очень высокая плотность тончайших колбочек и смещение нейронов внутренней сетчатки и кровеносных сосудов на сотни микрон от фовеального центра. Самые центральные колбочки расположены в фовеоле, в 350 мкм свободной от палочек зоне, образующей пол фовеального уплощения. В фовеа одна колбочка либо L, либо M (S колбочки отсутствуют в фовеа) связана через два биполяра (on и off) с двумя карликовыми on и off ганглиозными клетками. Подобная фовеальная структура существует и в сетчатке человекообразных обезьян и приматов Старого Света (Hendrickson, 2005). Фовеальные специализации определяют способность читать и узнавать лица.
Фовеола приматов с ее высокой плотностью колбочек и увеличенным представительством в коре идеальна для пространственного зрения с высоким разрешением. Однако изучение схем связей нейронов сетчатки, участвующих в осуществлении этой функции, было практически невозможно из-за сложности регистрации рецептивных полей фовеальных ГК сетчатки in vivo. Ранее визуализация клеточных элементов сетчатки была возможна лишь вблизи фовеа (1.5° от центра). Использование AOSLO позволило визуализировать кальциевые реакции (Са++ imaging) ГК у живых приматов на стабильные, высокоточные зрительные стимулы. Генетически кодируемый индикатор кальция G-CaMP5 был введен в фовеальные ГК. Были записаны импульсные Са++ реакции на высокоточные зрительные стимулы, размеры которых приближались к размерам наружных сегментов фовеальных колбочек, как от тел ганглиозных клеток, так и от их дендритов. Была выявлена очень точная радиальная пространственная организация фовеальных ГК. Пространственное смещение тел фовеальных ГК от их входов (колбочек через один биполяр) позволяет визуализировать ответы ГК повторно, в течение нескольких дней и месяцев, без чрезмерной адаптации колбочек к свету. Обратная проекция линий, соединяющих тела ГК с их рецептивными полями, позволила in vivo определить “физиологический центр” фовеолы и локализацию вертикального меридиана, разделяющего правое и левое полуполя зрения. (Yin et al.,2014; McGregor et al., 2018). Пока эти опыты не могут дополнить наши знания о ЦЗ. Можно надеяться, что в похожей постановке опыта удастся выделить из карликовых ГК, те, что участвуют в обработке цветового сигнала.
ЗАКЛЮЧЕНИЕ
Разработка систем АО в комплексе со сканирующей лазерной офтальмоскопией и денситометрией, фазочувствительной когерентной томографией и Са++ имаджингом предоставила новые беспрецедентные возможности для исследования функционирования зрительной системы in vivo. АО дала возможность исследовать in vivo рецепторную топографию сетчатки человека в близкой к фовеа области и топографию рецептивных полей ГК фовеа. Возможность стимулировать отдельные колбочки в живом человеческом глазу и получать ответы испытуемых позволила установить прямую связь между активацией колбочек (визуальными характеристиками) и субъективным ощущением.
Результаты, полученные при помощи АО, подтвердили и уточнили фундаментальные предположения, сделанные в предыдущих исследованиях относительно двух раздельных путей обработки цветовой и ахроматической информации. Большинство парвоцеллюлярных нейронов служат для ахроматического восприятия с высоким разрешением. В этот процесс вовлечено большинство колбочек всех трех типов по принципу унивариантности. Среди карликовых ганглиозных клеток находятся редкие ганглиозные клетки (подмножество карликовых), получающие сигналы от ограниченной группы колбочек трех типов, сигналы которых, благодаря соответствующему коннектому, используются в цветокодировании.
Две картины внешнего мира – одна бесцветная (черно-белая) с высоким разрешением, другая цветная – с низким разрешением, возникающие параллельно в зрительной системе приматов, в нашем восприятии существуют нераздельно.
Список литературы
Бонгард М.М. Колориметрия на животных. Доклады Академии наук СССР. 1955. Т. 103. № 2. С. 239–242.
Бонгард М.М., Смирнов М.С. Четырехмерность цветового пространства человека. Доклады Академии наук СССР. 1956. Т. 108. № 3. С. 447–449.
Бонгард М.М., Смирнов М.С. Визуальная колориметрия методом замещения (новая система колориметра для исследования цветового зрения человека). Биофизика. 1957. Т. 2. № 1. С. 119–123.
Бонгард М.М., Смирнов М.С. Кривые спектральной чувствительности приемников, связанных с одиночными волокнами зрительного нерва лягушки. Биофизика. 1957. Т. 2. № 3. С. 336–342.
Бонгард М.М., Смирнов М.С. О “кожном зрении” Р. Кулешовой. Биофизика. 1965. Т. 10. № 1. С. 48–54.
Говардовский В.И., Астахова Л.А., Фирсов М.Л. Специфика физиологических и биохимических механизмов возбуждения и адаптации колбочек сетчатки. Сенсорные системы. 2015. Т. 29. № 4. С. 296–308.
Каламкаров Г.Р., Островский М.А. Молекулярные механизмы зрительной рецепции. М.: Наука, 2002. 279 с.
Кондрашев С.Л., Орлов О.Ю. Колориметрическое изучение цветового зрения травяной лягушки. Вестник Московского университета. Серия 6: биология, почвоведение. 1975. № 4. С. 107–110.
Максимова Е.М., Алипер А.Т., Дамянович И.З., Зайчикова А.А., Максимов П.В. Ганглиозные клетки с фоновой активностью сетчатки рыб и их возможная функция в оценке зрительной сцены. Российский физиологический журнал им. И.М. Сеченова. 2020. Т. 106. № 4. С. 486–503. https://doi.org/10.31857/S0869813920040044
Мазохин-Поршняков Г.А. Колориметрическое изучение свойств зрения стрекоз (электрофизиологическое исследование). Биофизика. 1959. Т. 4. № 4. С. 427–436.
Мазохин-Поршняков Г.А. Колориметрическое доказательство трихромазии пчелиных (на примере шмелей). Биофизика. 1962. Т. 7 (2). С. 211–217.
Нюберг Н.Д. Парадоксы цветного зрения. Природа. 1960. № 8. С. 53–59.
Овчинников Ю.А., Абдулаев Н.Г., Фейгина Н.Ю., Артамонов И.Д., Золотарев А.С. Полная аминокислотная последовательность зрительного родопсина. Биоорган. химия. 1982. Т. 8. № 10. С. 1424–1427.
Орлов О.Ю. Физиологические основы цветового зрения человека. Сб.: Клиническая физиология зрения. Очерки. Под ред. А.М. Шамшиновой, 3-е изд. М.: Научно-медицинская фирма МБН, 2006. С. 298–340.
Орлов О.Ю., Бызов А.Л. Колориметрическое исследование зрения головоногих моллюсков (Cephalopoda). Доклады АН СССР. 1961. Т. 139. № 3. С. 723–725.
Орлов О.Ю., Максимова Е.М. О роли внутриколбочковых светофильтров (механизм ЦЗ ящерицы и черепахи). Доклады АН СССР. 1964. Т. 154. № 2. С. 463–466.
Островский М.А., Говардовский В.И., Механизмы фоторецепции позвоночных. В кн.: “Физиология зрения”. М.: Наука, 1992. Гл. 1. С. 5–59.
Подугольникова Т.А., Максимов В.В. Регулярность пространственной структуры рецепторного и нервных слоев сетчатки костистых рыб: световая микроскопия. Зоологический журнал. 1973. Т. LII. Вып. 4. С. 541–551.
Подугольникова Т.А., Максимов В.В. Мозаика фоторецепторов и нервных элементов сетчатки рыб. Сб.Сенсорные системы. 1977. С. 178–196.
Смирнов M.C. Измерение волновой аберрации человеческого глаза. Биофизика. 1961. Т. 6. № 6. С. 687–703.
Ahnelt P.K., Kolb H. The mammalian photoreceptor mosaic-adaptive design. Prog Ret Eye Res. 2000. V. 19 (6). P. 711–777. https://doi.org/10.1016/S1350-9462(00)00012-4
Allison W.T., Barthel L.K., Skebo K.M., Takechi M., Kawamura S., Raymond P.A. Ontogeny of cone photoreceptor mosaics in zebrafish. J. Comp. Neurol. 2010. V. 518 (20). P. 4182–4195. https://doi.org/10.1002/cne.22447
Arrese C.A., Hart N.S., Thomas N., Beazley L.D., Shand J. Trichromacy in Australian marsupials. Curr. Biol. 2002. V. 12. P. 657–660. https://doi.org/10.1016/S0960-9822(02)00772-8
Arrese C.A., Beazley L.D., Neumeyer C. Behavioural evidence of marsupial trichromacy. Curr. Biol. 2006. V. 16. P. R193–R194. https://doi.org/10.1016/j.cub.2006.02.036
Baden T. Circuit mechanisms for colour vision in zebrafish. Review. Current Biology. 2021. V. 31. P. R807–R820. https://doi.org/10.1126/sciadv.abj6815
Baden T., Euler T., Berens P. Understanding the retinal basis of vision across species. Nat Rev Neurosci. 2020. V. 21 (1). P. 5–20. https://doi.org/10.1038/s41583-019-0242-1
Baden T., Osorio D. The retinal basis of vertebrate color vision. Annu Rev Vis Sci. 2019. V. 5. P. 177–200. https://doi.org/10.1146/annurev-vision-091718-014926
Baden T., Schubert T., Chang L., Wei T., Zaichuk M., Wissinger B., Euler T. A tale of two retinal domains: Near-Optimal sampling of achromatic contrasts in natural scenes through asymmetric photoreceptor distribution. Neuron. 2013. V. 80 (5). P. 1206–1217. https://doi.org/10.1016/j.neuron.2013.09.030
Baraas R.C., Carroll J., Gunther K.L., Chung M., Williams D.R., Foster D.H., Neitz M. Adaptive optics retinal imaging reveals S-cone dystrophy in tritan color-vision deficiency. J. Opt. Soc. Am. A. 2007. V. 24 (5). P. 1438–1447. https://doi.org/10.1364/josaa.24.001438
Bilotta J., Saszik S. The zebrafish as a model visual system. Int J Dev Neurosci. 2001. V. 19 (7). P. 621–629. https://doi.org/10.1016/s0736-5748(01)00050-8
Boycott B.B., Dowling J.E., Kolb H. Organization of the primate retina: light microscopy. Philos Trans R Soc Lond B Biol Sci. 1969. V. 255. P. 109–184. https://doi.org/10.1098/rstb.1969.0004
Bowmaker J.K., Dartnall H.J. Visual pigments of rods and cones in a human retina. J Physiol. 1980. V. 298. P. 501–511. https://doi.org/10.1113/jphysiol.1980.sp013097
Bowmaker J.K. Evolution of colour vision in vertebrates. Eye (Lond). 1998. V. 12. P. 541–547. https://doi.org/10.1038/eye.1998.143
Bowmaker J.K., Microspectrophotometry of vertebrate photoreceptors: A brief review. Vision Research. 1984. V. 24 (11). P. 1641–1650. https://doi.org/10.1016/0042-6989(84)90322-5
Campbell F.W. and Rushton W.A.H. Measurement of the scotopic pigment in the living human eye. J Physiol. 1955. V. 130 (1). P. 131–147. https://doi.org/10.1113/jphysiol.1955.sp005399
Carroll J., Neitz M., Hofer H., Neitz J., Williams D.R. Functional photoreceptor loss revealed with adaptive optics: An alternate cause of color blindness. PNAS. 2004. V. 101 (22). P. 8461–8466. https://doi.org/10.1073/pnas.0401440101
Collin S.P., Trezise A.E. The origins of colour vision in vertebrates. Clin Exp Optom. 2004. V. 87 (4–5). P. 217–223. https://doi.org/10.1111/j.1444-0938.2004.tb05051.x
Curcio C.A., Sloan K.R., Kalina R.E., Hendrickson A.E. Human photoreceptor topography. J. Comp Neurol. 1990. V. 292 (4). P. 497–523. https://doi.org/10.1002/cne.902920402
Curcio C.A., Allen K.A., Sloan K.R., Lerea C.L., Hurley J.B., Klock I.B., Milam A.H. Distribution and morphology of human cone photoreceptors stained with anti-blue opsin. J. Comp Neurol. 1991. V. 312 (4). P. 610–624. https://doi.org/10.1002/cne.903120411
Dacey D.M. Primate retina: cell types, circuits and color opponency. Prog Retin Eye Res.1999. V. 18 (6). P. 737–763. https://doi.org/10.1016/s1350-9462(98)00013-5
Dacey D.M. Parallel pathways for spectral coding in primate retina. Annu. Rev. Neurosci. 2000. V. 23. P. 743–775. https://doi.org/10.1146/annurev.neuro.23.1.743
Dacey D.M., Packer O.S. Colour coding in the primate retina: diverse cell types and cone-specific circuitry. Curr Opin Neurobiol. 2003.V. 13 (4). P. 421–427. https://doi.org/10.1016/s0959-4388(03)00103-x
Danilova M.V., Mollon J.D. Bongard and Smirnov on the tetrachromacy of extra-foveal vision. Vision Research. 2022. V. 195. P. 107952. https://doi.org/10.1016/j.visres.2021.08.007
Dartnall H.J.A., Bowmaker J.K., Mollon J.D. Human visual pigments: microspectrophotometric results from the eyes of seven persons. Proc. R. Soc. Lond. B. Biol. Sci. 1983. V. 220 (1218). P. 115–130. https://doi.org/10.1098/rspb.1983.0091
Dominy N.J., Lucas P.W. Ecological importance of trichromatic vision to primates. Nature. 2001. V. 410 (6826). P. 363–366. https://doi.org/10.1038/35066567
Dowling J.E., Boycott B.B. Organization of the primate retina: electron microscopy. Proc. R. Soc. Lond. B. Biol. Sci. 1966. V. 166 (1002). P. 80–111. https://doi.org/10.1098/rspb.1966.0086
Dulai K.S., von Dornum M., Mollon J.D., Hunt D.M. The evolution of trichromatic color vision by opsin gene duplication in New World and Old World primates. Genome Res. 1999. V. 9. P. 629–638. https://doi.org/10.1101/gr.9.7.629
Engstrom K. Cone Types and Cone Arrangement in the Retina of Some Cyprinids. Acta Zoologica. 1960. V. 41 (3). P. 277–295. https://doi.org/10.1111/j.1463-6395.1960.tb00481.x
Estévez O., Spekreijse H. The “silent substitution” method in visual research. Vision Research. 1982. V. 22. P. 681–69. https://doi.org/10.1016/0042-6989(82)90104-3
Field G.D., Gauthier J.L., Sher A., Greschner M., Machado T.A., Jepson L.H., Shlens J., Gunning D.E., Mathieson K., Dabrowski W., Paninski L., Litke A.M., Chichilnisky E.J. Functional connectivity in the retina at the resolution of photoreceptors. Nature. 2010. V. 467 (7316). P. 673–677. https://doi.org/10.1038/nature09424
Gehring W.J., Ikeo K. Pax 6: mastering eye morphogenesis and eye evolution. Trends in Genetics. 1999. V. 15 (9). P. 371–377. https://doi.org/10.1016/S0168-9525(99)01776-X
Gill J.S., Moosajee M., Dubis A.M. Cellular imaging of inherited retinal diseases using adaptive optics. Eye. 2019. V. 33. P. 1683–1698. https://doi.org/10.1038/s41433-019-0474-3
Govardovskii V.I., Fyhrquist N., Reuter T., Kuzmin D.G., Donner K. In search of the visual pigment template. Visual Neurosci. 2000. V. 17. P. 509–528. https://doi.org/10.1017/ S0952523800174036
Hampson K.M. Adaptive optics and vision. Journal of Modern Optics. 2008. V. 55. № 21. P. 3425–3467. https://doi.org/10.1080/09500340802541777
Hart N.S., Partridge J.C., Cuthill I.C., Bennett A.T. Visual pigments, oil droplets, ocular media and cone photoreceptor distribution in two species of passerine bird: the blue tit (Parus caeruleus L.) and the blackbird (Turdus merula L.) J. Comp. Physiol. A. 2000. V. 186 (4). P. 375–387. https://doi.org/10.1007/s003590050437
Hartridge H. Cluster formation by the foveal cones. J. Physiol. 1946. V. 15. P. 105.
Hendrickson A. Organization of the Adult Primate Fovea. Macular Degeneration. Penfold P.L., Provis J.M. (eds). Berlin, Heidelberg. Springer, 2005. https://doi.org/10.1007/3-540-26977-0_1
Henriques L.D., Hauzman E., Bonci D.M.O., Chang B.S.W., Muniz J.A.P.C., Souza G.S., Silveira L.C.L., Galvão O.F., Goulart P.R.K., Ventura D.F. Uniform trichromacy in Alouatta caraya and Alouatta seniculus: behavioural and genetic colour vision evaluation. Front Zool. 2021. V. 18. P. 36 (1–10). https://doi.org/10.1186/s12983-021-00421-0
Hillmann D., Spahr H., Pfäffle C., Sudkamp H., Franke G., Hüttmann G. In vivo optical imaging of physiological responses to photostimulation in human photoreceptors. PNAS. 2016. V. 113 (46). P. 13138–13143. https://doi.org/10.1073/pnas.1606428113
Hofer H., Carroll J., Neitz J., Neitz M., Williams D.R. Organization of the Human Trichromatic Cone Mosaic. J. Neurosci. 2005. V. 19 (42). P. 9669–9679. https://doi.org/10.1523/JNEUROSCI.2414-05.2005
Hunt D.M., Dulai K.S., Cowing J.A., Julliot C., Mollon J.D., Bowmaker J.K., Li W.-H., Hewett-Emmett D. Molecular evolution of trichromacy in primates. Vision Res. 1998. V. 38 (21). P. 3299–3306. https://doi.org/10.1016/s0042-6989(97)00443-4
Jacobs G.H., Neitz J., Deegan J.F. Retinal receptors in rodents maximally sensitive to ultraviolet light Nature. 1991. V. 353. P. 655–656. https://doi.org/10.1038/353655a0
Jacobs G.H. Evolution of colour vision in mammals. Phil. Trans. R. Soc. B. 2009. V. 364 (1531). P. 2957–2967. https://doi.org/10.1098/rstb.2009.0039
Jacobs G.H. Losses of functional opsin genes, short-wavelength cone photopigments, and color vision – a significant trend in the evolution of mammalian vision. Vis Neurosci. 2013. V. 30 (1–2). P. 39–53. https://doi.org/10.1017/S0952523812000429
Jacobs G.H., Neitz M., Neitz J. Mutations in S-cone pigment genes and the absence of colour vision in two species of nocturnal primate. Proc. R. Soc. Lond. B. 1996. V. 263 (1371). P. 705–710. https://doi.org/10.1098/rspb.1996.0105
Jacobs G.H., Deegan J.F.D.I. Uniformity of colour vision in Old World monkeys. Proc. Biol. Sci. 1999. V. 266 (1432). P. 2023–2028. https://doi.org/10.1098/rspb.1999.0881
Keeler C.R. The Ophthalmoscope in the Lifetime of Hermann von Helmholtz. Arch Ophthalmol. 2002. V. 120 (2). P. 194–201. https://doi.org/10.1001/archopht.120.2.194
Kling A., Field G.D., Brainard D.H., Chichilnisky E.J. Probing Computation in the Primate Visual System at Single-Cone Resolution. Annu. Rev. Neurosci. 2019. V. 42. P. 169–186. https://doi.org/10.1146/annurev-neuro-070918-050233
Lakowski R. Theory and practice of colour vision testing: A Review. Part 2. British Journal of Industrial Medicine. 1969. V. 26 (4). P. 265–288. https://doi.org/10.1136/oem.26.4.265
Lee B.B. Paths to colour in the retina. Clin. Exp.Optom. 2004. V. 87. P. 239–248. https://doi.org/10.1111/j.1444-0938.2004.tb05054.x
Levenson D.H., Ponganis P.J., Crognale M.A., Deegan J.F. 2nd, Dizon A., Jacobs G.H. Visual pigments of marine carnivores: pinnipeds, polar bear, and sea otter. J. Comp. Physiol. A. Neuroethol. Sens. Neural. Behav. Physiol. 2006. V. 192 (8). P. 833–843. https://doi.org/10.1007/s00359-006-0121-x
Li Y.N., Tsujimura T., Kawamura S., Dowling J.E. Bipolar cell-photoreceptor connectivity in the zebrafish (Danio rerio) retina. J. Comp. Neurol. 2012. V. 520 (16). P. 3786–3802. https://doi.org/10.1002/cne.23168
Li P.H., Field G.D., Greschner M., Ahn D., Gunning D.E., Mathieson K., Sher A., Litke A.M., Chichilnisky E.J. Retinal representation of the elementary visual signal. Neuron. 2014. V. 81 (1). P. 130–139. https://doi.org/10.1016/j.neuron.2013.10.043
Marc R.E. The structure of vertebrate retinas. The Retinal Basis of Vision. Toyoda J. (ed.). Amsterdam. Elsevier, 1999. P. 3–19.
Marks W.B. Visual pigments of single goldfish cones. J. Physiol. 1965. V. 178 (1). P. 14–32. https://doi.org/10.1113/jphysiol.1965.sp007611
Maximov V. Colour vision in early vertebrates. Iugoslav. Physiol. Pharmacol. Acta. 1998. V. 34 (2). P. 343–349.
Maximov V. Environmental factors which may have led to the appearance of colour vision. Phil. Trans. R. Soc. Lond. B. 2000. V. 355. P. 1239–1242. https://doi.org/10.1098/rstb.2000.0675
McGregor J.E., Yin L., Yang Q., Godat T., Huynh K.T., Zhang J., Williams D.R., Merigan W.H. Functional architecture of the foveola revealed in the living primate. PLOS ONE. 2018. V. 13 (11). P. e0207102. https://doi.org/10.1371/journal.pone.0207102
Merino D., Loza-Alvarez P. Adaptive optics scanning laser ophthalmoscope imaging: technology update. Clin Ophthalmol. 2016. V. 10. P. 743–755. https://doi.org/10.2147/OPTH.S64458
Mollon J.D., Bowmaker J.K. The spatial arrangement of cones in the primate fovea. Nature.1992. V. 360 (6405). P. 677–679. https://doi.org/10.1038/360677a0
Movshon A. Animal models for visual neuroscience. Journal of Vision. 2014. V. 14 (15). P. 8. https://doi.org/10.1167/14.15.8
Nathans J., Thomas D., Hogness D.S. Molecular genetics of human color vision: the genes encoding blue, green and red pigments. Science. 1986. V. 232 (4747). P. 193–202. https://doi.org/10.1126/science.2937147
Orlov O.Yu., Maximova E.M. S-potential sources as excitation pools. Vision res. 1965. V. 5. P. 573–582. https://doi.org/10.1016/0042-6989(65)90032-5
Peichl L., Behrmann G., Kröger R. For whales and seals the ocean is not blue: a visual pigment loss in marine mammals. Eur. J. Neurosci. 2001. V. 13. P. 1520–1528. https://doi.org/10.1046/j.0953-816x.2001.01533.x
Peichl L., Moutairou K. Absence of short-wavelength sensitive cones in the retinae of seals (Carnivora) and African giant rats (Rodentia). Eur. J. Neurosci. 1998. V. 10 (8). P. 2586–2594. https://doi.org/10.1046/j.1460-9568.1998.00265.x
Peichl L. Diversity of mammalian photoreceptor properties: adaptations to habitat and lifestyle? Anat Rec A Discov Mol Cell Evol Biol. 2005. V. 287 (1). P. 1001–1012. https://doi.org/10.1002/ar.a.20262
Polyak S.L. The Retina. Chicago, The Univercity of Chicago Press, 1941. 607 p.
Provis J.M., Dubis A.M., Maddess T., Carroll J. Adaptation of the central retina for high acuity vision: Cones, the fovea and the avascular zone. Prog Retin Eye Res. 2013. V. 35. P. 63–81. https://doi.org/10.1016/j.preteyeres.2013.01.005
Qiu Y., Zhao Z., Klindt D., Kautzky M., Szatko K.P., Schaeffel F., Rifai K., Franke K., Busse L., Euler T. Natural environment statistics in the upper and lower visual field are reflected in mouse retinal specializations. Curr Biol. 2021. V. 31 (15). P. 3233–3247. https://doi.org/10.1016/j.cub.2021.05.017
Ramon-Y-Cajal S. La rétine des vertébrés. Cellule. 1892. V. 9. P. 121–255.
Roorda A., Williams D.R. The arrangement of the three cone classes in the living human eye. Nature. 1999. V. 397 (6719). P. 520–522. https://doi.org/10.1038/17383
Roorda A., Metha A.B., Lennie P., Williams D.R. Packing arrangement of the three cone classes in primate retina. Vision Res. 2001. V. 41 (10–11). P. 1291–1306. https://doi.org/10.1016/s0042-6989(01)00043-8
Roorda A., Romero-Borja F., Donnelly W.J. III, Queener H., Hebert T.J., Campbell M. Adaptive optics scanning laser ophthalmoscopy. Opt Express. 2002. V. 10 (9). P. 405–412. https://doi.org/10.1364/OE.10.000405
Sabesan R., Hofer H.J., Roorda A. Characterizing the human cone photoreceptor mosaic via dynamic photopigment densitometry. PLoS One. 2015. V. 10 (12). P. e0144891. https://doi.org/10.1371/journal.pone.0144891
Sabesan R., Schmidt B.P., Tuten W.S., Roorda A. The elementary representation of spatial and color vision in the human retina. Sci Adv. 2016. V. 2 (9). P. e1600797. https://doi.org/10.1126/sciadv.1600797
Schmidt B.P., Sabesan R., Tuten W.S., Neitz J., Roorda A. Sensations from a single M-cone depend on the activity of surrounding S-cones. Scientific REPORTS. 2018. V. 8. P. 8561. https://doi.org/10.1038/s41598-018-26754-1
Silveira L.C.L., Saito C.A., Filho M. da S., Kremers J., Bowmaker J.K., Lee B.B. Alouatta trichromatic color vision: cone spectra and physiological responses studied with microspectrophotometry and single unit retinal electrophysiology. PLOS ONE. 2014. V. 9 (11). P. e113321. https://doi.org/10.1371/journal.pone.0113321
Sincich L.C., Zhang Y., Tiruveedhula P., Horton J.C., Roorda A. Resolving single cone inputs to visual receptive fields. Nat Neurosci. 2009. V. 12 (8). P. 967–969. https://doi.org/10.1038/nn.2352
Solomon S.G., Lennie P. The machinery of colour vision. Nat Rev Neurosci. 2007. V. 8. P. 276–286. https://doi.org/10.1038/nrn2094
Stieb S.M., de Busserolles F., Carleton K.L., Cortesi F., Chung W.-S., Dalton B.E., Hammond L.A., Marshall N.J. A detailed investigation of the visual system and visual ecology of the Barrier Reef anemonefish, Amphiprion akindynos. Sci Rep. 2019. V. 9. P. 16459. https://doi.org/10.1038/s41598-019-52297-0
Thoreson W.B., Dacey D.M. Diverse cell t`ypes, circuits, and mechanisms for color vision in the vertebrate retina. Physiol Rev. 2019. V. 99 (3). P. 1527–1573. https://doi.org/10.1152/physrev.00027.2018
Toomey M.B., Corbo J.C. Evolution, development and function of vertebrate cone oil droplets. Front Neural Circuits. 2017. V. 11. P. 97. https://doi.org/10.3389/fncir.2017.00097
Wagner-Schuman M., Neitz J., Rha J., Williams D.R., Neitz M., Carroll J. Color-deficient cone mosaics associated with Xq28 opsin mutations: A stop codon versus gene deletions. Vision Res. 2010. V. 50 (23). P. 2396–2402. https://doi.org/10.1016/j.visres.2010.09.015
Walls G.L. The Vertebrate Eye and Its Adaptive Radiation. Bloomfield hills, mich., cranbrook institute of science. 1942. 814 p. https://doi.org/10.5962/bhl.title.7369
Wikler K.C., Rakic P. Distribution of photoreceptor subtypes in the retina of diurnal and nocturnal primates. J Neurosci. 1990. V. 10 (10). P. 3390–3401. https://doi.org/10.1523/JNEUROSCI.10-10-03390.1990
Williams D.R. Imaging single cells in the living retina. Vis. Res. 2011. V. 51 (13). P. 1379–1396. https://doi.org/10.1016/j.visres.2011.05.002
Williams D.R., Sekiguchi N., Haake W., Brainard D, Packer O. The cost of trichromacy for spatial vision. From Pigments to Perception: Advances in Understanding Visual Processes. Eds. Valberg A., Lee B.B. New York. Plenum Press, 1991. P. 11–22. https://doi.org/10.1007/978-1-4615-3718-2_2
Wilkie D., Hunt D.M., Bowmaker J.K. Visual pigments and oil droplets in the retina of a passerine bird, the canary Serinus canaria: microspectrophotometry and opsin sequences. Vis. Res. 1999. V. 39 (17). P. 2801–2815. https://doi.org/10.1016/s0042-6989(99)00023-1
Wiesel T.N., Hubel D.H. Spatial and chromatic interactions in the lateral geniculate body of the rhesus monkey. J Neurophysiol. 1966. V. 29 (6). P. 1115–1156. https://doi.org/10.1152/jn.1966.29.6.1115
Yin L., Masella B., Dalkara D., Zhang J., Flannery J.G., Schaffer D.V., Williams D.R., Merigan W.H. Imaging light responses of foveal ganglion cells in the living macaque eye. J. Neurosci. 2014. V. 34 (19). P. 6596–6605. https://doi.org/10.1523/JNEUROSCI.4438-13.2014
Yokoyama S., Yokoyama R. Adaptive evolution of photoreceptors and visual pigments in vertebrates. Ann Rev Ecol Sys. 1996. V. 27 (1). P. 543–567. https://doi.org/10.1146/annurev.ecolsys.27.1.543
Yokoyama S. Molecular evolution of vertebrate visual pigments. Prog Retin Eye Res. 2000. V. 19 (4). P. 385–419. https://doi.org/10.1016/s1350-9462(00)00002-1
Yokoyama S. Molecular evolution of color vision in vertebrates. Gene2002. V. 300 (1–2). P. 69–78. https://doi.org/10.1016/s0378-1119(02)00845-4
Zeki S. and Marini L. Three cortical stages of colour processing in the human brain. Brain. 1998. V. 121. P. 1669–1685. https://doi.org/10.1093/brain/121.9.1669
Zhang F., Kurokawa K., Lassoued A., Crowell J.A., Miller D.T. Cone photoreceptor classification in the living human eye from photostimulation-induced phase dynamics. PNAS. 2019. V. 116(16). P. 7951–7956. https://doi.org/10.1371/journal.pone.0207102
Zhang F., Kurokawa K., Bernucci M.T., Jung H.W., Lassoued A., Crowell J.A., Neitz J., Neitz M., and Miller D.T. Revealing how color vision phenotype and genotype manifest in individual cone cells. Invest. Ophthalmol. Vis. Sci. 2021. V. 62 (2). Art. 8. https://doi.org/10.1167/iovs.62.2.8
Дополнительные материалы отсутствуют.
Инструменты
Сенсорные системы


