Теплофизика высоких температур, 2019, T. 57, № 4, стр. 578-587
Лазероиндуцированное кипение биологических жидкостей
В. М. Чудновский 1, *, А. Ю. Майор 2, В. И. Юсупов 3, С. А. Жуков 4, **
1 Тихоокеанский океанологический институт им. В.И. Ильичева ДВО РАН
г. Владивосток, Россия
2 Институт автоматики и процессов управления ДВО РАН
г. Владивосток, Россия
3 Институт фотонных технологий ФНИЦ “Кристаллография и фотоника” РАН
Москва, г. Троицк, Россия
4 Институт проблем химической физики РАН
г. Черноголовка, Россия
* E-mail: vm53@mail.ru
** E-mail: zhukov@cat.icp.ac.ru
Поступила в редакцию 01.03.2018
После доработки 03.04.2018
Принята к публикации 27.03.2019
Аннотация
Рассматривается лазероиндуцированное кипение и связанное с ним вспенивание биологических жидкостей (водных растворов поверхностно-активных веществ, белков и содержащих дисперсную фазу) на лазерных нагревателях, преобразующих лазерное излучение ближнего ИК-диапазона (0.97 мкм, 1.47 мкм) в тепло. Объектами исследования служили модельные жидкости и биологическая жидкость – сыворотка крови, а также записи ультразвукового изображения кипения эндокистозной жидкости и крови человека, полученные в процессе лазерного лечения кист и вен под ультразвуковым контролем. В предлагаемом подходе модификация и разрушение биотканей происходят не путем их прямого лазерного нагрева, а за счет, с одной стороны, быстрой доставки тепла двухфазными струйными потоками, формируемыми при пузырьковом кипении жидкости, с другой, в результате прекращения кровотока, вызванного окклюзией (закрытием) сосудов пеной. При проведении лазерных хирургических манипуляций в венах, помимо закипания, кровь под действием лазерного нагрева одномоментно вспенивается. Возникает ранее не описанный эффект, когда при кипении вспенивается раствор денатурированных белков крови. Пена, возникшая в просвете сосуда, вызывает окклюзию вены, что приводит к остановке кровотечения – гемостазу.
ВВЕДЕНИЕ
Биологические жидкости составляют в зависимости от возраста 50–85% массовой доли человеческого организма и представляют собой различные водные растворы. В процентном отношении распределение жидкости в организме неоднородно и зависит от органа, в котором она сосредоточена. В полых органах концентрация жидкости может приближаться к 100%. Среди патологических образований к таковым относятся кисты, патологически измененные вены, заполненные кровью, свищи, экссудаты, транссудаты и другие. Кипение содержащихся в них жидкостей может быть использовано для эффективного разрушения патологического образования и, собственно, хирургического лечения соответствующего заболевания. Например, кипение биологической жидкости – водного раствора с температурой насыщения ~100°С в процессе конвективной теплоотдачи на стенки будет приводить к разогреву и необратимой денатурации белков, входящих в состав оболочек патологических образований и тем самым приводить их к тепловому разрушению [1–3].
Все биологические жидкости находятся в организме при физиологической температуре, которая в норме не превышает 37°С. Эта температура много меньше температуры насыщения воды (~100°С). Поэтому кипение в такой жидкости, вызванное сосредоточенным источником тепла (нагревателем), будет кипением жидкости, недогретой до температуры насыщения [4]. В отличие от кипения жидкостей, находящихся при температуре насыщения, кипение с недогревом сопровождается не только ростом парогазовых пузырьков, но также их схлопыванием, что приводит к известным из теплофизики кипения недогретой жидкости эффектам, таким как сверхинтенсивное пузырьковое кипение (СПК) [5], локальный перегрев [6], эмиссия микропузырьков (microbubble emission boiling (MEB) при вынужденной конвекции) [7, 8], взрывной рост и кавитационное замыкание паровых полостей (термокавитация) [9–11], различные автоколебания, возникающие при кипении в резонаторах [12].
При пузырьковом кипении недогретых до температуры насыщения жидкостей формируются максимальные тепловые потоки [4, 5], которые интенсивно исследуются в связи с поиском высокоэффективных методов отвода тепла при охлаждении поверхности нагрева и широко используются в технике [4, 5, 13]. Однако в отношении биологических систем, в частности человеческого организма, представляет интерес использование этих тепловых потоков не для охлаждения, а наоборот, селективного разогрева и теплового разрушения патологических образований.
Идеальными для этой цели являются лазерные “нагреватели”. Если лазерное излучение подавать через оптоволокно, кварцевый торец которого предварительно покрыт слоем поглощающего излучение вещества (зачернен), то при прохождении излучения этот слой разогреется до высоких температур [10, 14, 15]. При контакте с биологическими жидкостями на разогретом торце оптоволокна будет инициировано кипение, которому будут присущи все характерные для пузырькового кипения недогретой жидкости эффекты, инициированные на поверхности нагревателя.
Другая важная особенность лазерных нагревателей основана на способности лазерного излучения к фокусировке. В этом случае лазерное излучение может инициировать кипение без использования поверхности нагревателя. Излучение, поглощаемое жидкостью, можно сфокусировать в малом объеме жидкости и тем самым инициировать ее гомогенное вскипание [2, 9, 11].
Все биологические жидкости насыщены растворенным газом (воздухом), в основном это гидрофобный азот и кислород. Они содержат в своем составе поверхностно-активные вещества (ПАВ) – органические вещества, содержащие гидрофильные группы, например полисахариды, – и также являются раствором различных белков. Поэтому кипение биологических жидкостей должно сопровождаться денатурацией белков и вспениванием. Вспенивание водного раствора денатурированных белков приводит к образованию устойчивых пен. Пена, возникающая при кипении, например, крови, будет заполнять просвет сосудов и, следовательно, приведет к остановке кровотечения – гемостазу, что имеет большое значение в хирургии.
Исследования эффектов кипения биологических жидкостей являются весьма актуальными в связи с разработкой новых лазерных медицинских технологий. При этом лазероиндуцированные гидродинамические процессы могут эффективно контролироваться с помощью дистанционных акустических методов, быстродействующей микрооптической рефлектометрии [16] и видеосъемки.
УСЛОВИЯ ЭКСПЕРИМЕНТА И РЕЗУЛЬТАТЫ
Для исследования11 лазероиндуцированного вскипания жидкостей использовались лазеры производства ООО “ЭЛОМЕД” с длиной волны 0.97 мкм и диодный лазер Ceralas Biolitec, работающий на длине волны 1.47 мкм, излучение которых проводилось по кварц-кварц-полимерному волокну диаметром 600 мкм. Излучение с длиной волны 0.97 мкм слабо поглощается водой (с коэффициентом поглощения 0.47 см–1), тогда как излучение с длиной волны 1.47 мкм, напротив, очень сильно поглощается в воде (26 см–1) [17].
Использовались два режима лазерного воздействия. В первом случае на торец кварцевого волокна наносилось поглощающее покрытие (чернение волокна), во втором поглощающего покрытия не было и лазерное излучение свободно выходило в объем жидкости. Поглощающее покрытие наносилось на рабочий торец кварцевого волокна путем кратковременного (около 1 с) его контакта с деревянным бруском при мощности лазерного излучения ~3 Вт, что приводило к стабильному покрытию торца волокна слоем аморфного углерода [10, 14, 18]. Волокна с поглощающим покрытием позволяют возбуждать гетерогенный режим кипения, инициируемый на торце волокна, независимо от длины волны лазерного излучения, тогда как волокна без покрытия дают возможность инициировать гомогенное вскипание. В последнем случае излучение с длинами волн, которые интенсивно поглощаются в жидкости, свободно выходит за пределы световода и может инициировать гомогенное вскипание вблизи торца оптоволокна, как это имеет место в водных растворах при использовании лазерного излучения диодного лазера Ceralas Biolitec, работающего на длине волны 1.47 мкм.
Объектами исследования служили модельные жидкости и биологическая жидкость – сыворотка крови, а также записи ультразвукового (УЗ) изображения кипения эндокистозной жидкости и крови человека, полученные в процессе лазерного лечения кист и вен под УЗ-контролем. Поскольку биологические жидкости – это водные растворы, содержащие газ и поверхностно-активные вещества, лазероиндуцированное (лазерное) кипение моделировалось в недеаэрированной воде и водном недеаэрированном растворе ПАВ – натриевой соли стеариновой кислоты (мыльный раствор) с концентрацией ~0.1%. Модельные жидкости заполняли открытую кювету размером 24 × 40 × 24 мм3 и стеклянный капилляр длиной 300 мм с внутренним диаметром 3 мм, в которые погружались рабочий конец лазерного волокна, а также “конвективная метка” – фрагмент синтетической нити длиной 0.4 мм и диаметром 10 мкм. Отдельные эксперименты по лазерному кипению проводились с сывороткой крови человека, полученной в клинической лаборатории Медобъединения ДВО РАН (г. Владивосток) по стандартной методике [19]. Эксперименты с сывороткой крови проводились в стеклянном капилляре. В капилляр на расстояние 70 мм от одного из концов вводился дистальный участок кварц-кварц-полимерного оптоволокна, торец которого предварительно чернился. Проксимальный конец оптоволокна (световода) соединялся с источником лазерного излучения, работающим в непрерывном режиме. Для наблюдения кипения наполненная жидкостью кювета и капилляр устанавливались на рабочем столе микроскопа Olympus EX51 c видеокамерой Видеоскан 285-USB (экспозиция – 8 мс, до 4 кадр/с). Для контроля мощности излучений использовался измеритель мощности Field Master с измерительной головкой LM-10HTD (Coherent). Измерение мощности лазерного излучения, выходящего из оптоволокна с чернением и без, показало, что в слое углерода на торце оптоволокна поглощается до 30% мощности генерируемого излучения, а 70% выходит за пределы световода. Таким образом, в описанных экспериментах при использовании оптоволокна с поглощающим покрытием только ~30% генерируемой энергии расходуется на нагрев торца оптоволокна. Все эксперименты проводились при комнатной температуре.
Процессы лазероиндуцированного кипения жидкости в кистах (эндокистозной жидкости) исследовались при анализе УЗ-изображений, полученных при проведении хирургической пункционной манипуляции, выполняемой под контролем ультразвукового исследования (УЗИ). Операции на кистах Беккера проводились в клинике ООО “Просто лаборатория”, г. Ангарск (Иркутская область), а на кистах молочной железы в ООО “Прима Мед” (г. Владивосток) с участием одного из авторов данной статьи. В экспериментах с модельными жидкостями, а также в операциях с кистами использовались только волокна с зачерненным торцом и лазерное излучение с длиной волны 0.97 мкм.
Кипение крови в патологически измененной вене исследовалось путем анализа УЗ-изображений, полученных при проведении УЗ-ассистированных процедур эндовенозной (эндовазальной) лазерной коагуляции, которая выполнялась с использованием волокна без поглощающего покрытия (“радиальное” волокно) и ультразвукового линейного датчика аппарата ультразвукового исследования (Samsung Medison Sonacer 3), работающего в диапазоне 7–12 МГц. Манипуляции проводились с использованием лазера Ceralas Biolitec.
При представлении количественных результатов рассчитывались средние величины и стандартная ошибка среднего (M ± m). Статистическая выборка производилась из результатов, полученных при проведении не менее пяти аналогичных процедур.
На рис. 1, 2 показаны различные этапы пузырькового гетерогенного кипения недеаэрированной воды на поверхности торца лазерного оптоволокна, покрытого слоем аморфного углерода, в зависимости от мощности лазерного излучения с длиной волны 0.97 мкм. На рис. 3, 4 показано гетерогенное кипение на торце оптоволокна в водном растворе ПАВ.
Рис. 1.
Кипение недогретой до температуры насыщения воды на торце зачерненного световода (вид сверху) при мощности лазерного излучения 4 Вт: (а), (б) – первый цикл; (в), (г) – второй цикл; время между кадрами – 0.25 с; 1 – оптоволокно, 2 – парогазовый пузырек, 3 – потоки мелких газовых пузырьков.

Рис. 2.
Интенсивное гетерогенное кипение недогретой воды с образованием струйных потоков микрогазовых пузырьков на поверхности зачерненного световода при мощности лазерного излучения 7 Вт (вид сверху): 1 – оптоволокно, 2 – потоки мелких газовых пузырьков.

Рис. 3.
Первый кризис кипения (λ = 0.97 мкм) в водном растворе ПАВ при мощности лазерного излучения 10 Вт: 1 – светящийся торец оптоволокна в растворе, 2 – капилляр.

Рис. 4.
Кипение недогретого водного раствора ПАВ (концентрация ~0.1%) на торце черненного световода при различных мощностях лазерного излучения: (а) – 2 Вт, (б) – 4, (в) – 5, (г) – 7; 1 – оптоволокно, 2 – газовые микропузырьки (вид сверху).

При контакте с водой на торце оптоволокна диаметром 0.6 мм при мощности излучения 2 Вт формируется парогазовый пузырек (или несколько пузырьков), который приблизительно через 60 с достигает максимального размера и стабилизируется, оставаясь неизменным, пока лазер генерирует излучение. В этот период скорость конвективных потоков, измеренная по движению метки, составляла ~0.3 мм/с. Диаметр растущего на торце волокна пузырька d хорошо описывается функцией корня квадратного от времени t: d ~ t 1/2. В одной из экспериментальных реализаций рост пузырька прекращался, когда диаметр достигал 480 мкм. После выключения лазера диаметр пузырька быстро (за ~0.8 с) сокращался до 370 мкм, и далее его размеры практически не менялись. Данное сокращение пузырька соответствует изменению его объема примерно в 2.2 раза. Поскольку уменьшение объема вызвано конденсацией пара, можно оценить, что такой парогазовый пузырек состоит примерно на 45% из газа и на 55% из водяного пара. Можно полагать, что газовая составляющая пузырька образовалась вследствие диффузии из объема воды растворенного воздуха, 80% которого составляет азот.
При увеличении мощности лазерного излучения до 3–4 Вт пузырьки значительно быстрее увеличиваются в размерах вплоть до некоторого критического уровня, после чего схлопываются с выбросом в окружающую среду большого количества мелких газовых пузырьков диаметром 4–20 мкм (рис. 1). Затем вновь образуются и вновь схлопываются. Мелкие пузырьки движутся в жидкости в потоках, образуя на некотором расстоянии от торца затопленные струи. Скорость струй варьируется в пределах 1–9 мм/с в зависимости от расстояния до торца световода (рис. 1).
С увеличением мощности лазерного излучения до 7 Вт интенсивность кипения существенно нарастает (рис. 2). Пузырьки быстро растут и схлопываются с выбросом потоков мелких газовых пузырьков, которые со скоростью порядка 37 ± 3 мм/с перемещаются в воде в различных направлениях от торца оптоволокна. С расстоянием скорость движения пузырьков уменьшается: на расстоянии 1 мм от торца она снижается до 11 ± 5 мм/с. В сравнении с режимом, когда мощность лазерного излучения равна 2 Вт, скорость движения жидкости вблизи торца световода возросла в ~120 раз.
При дальнейшем увеличении мощности лазерного излучения до 10–15 Вт кипение становится пленочным. При этом торец волокна полностью покрывается паровой пленкой, которая резко уменьшает теплоотвод в воду, в результате чего торец световода разогревается до высоких температур, вызывающих его свечение (рис. 3).
Картина кипения воды с растворенным ПАВ, недогретой до температуры насыщения, существенно отличается. Из поля зрения исчезают крупные парогазовые пузыри. На торце световода формируются потоки множества мелких микрогазовых пузырьков, размером в диаметре 4–20 мкм, образуя затопленные струи, всплывающие на различных расстояниях от торца световода, зависящих от мощности лазерного излучения (рис. 4).
Струйный поток микрогазовых пузырьков, когда его скорость стремится к нулю в ограниченном пространстве, каковым является кровеносный сосуд (вена) либо киста, преобразуется в пену. В этом состоянии пузырьки могут объединяться, образуя более крупные газовые пузыри. На рис. 5 показана пена, образованная при лазероиндуцированном кипении водного раствора ПАВ в стеклянном капилляре.
Рис. 5.
Эволюция пены, заполняющей весь просвет стеклянного капилляра с внутренним диаметром 3 мм сразу после выключения лазерного излучения (a), через 30 с (б), 10 мин (в) и 2 ч (г); размер кадра – 1.5 × 1.1 мм2.

Процесс образования пены существенно изменяется при лазероиндуцированном кипении сыворотки крови (рис. 6): в него вовлекаются белки, денатурированные вследствие нагрева сыворотки крови. Двойная подсветка: снизу белым светом и через оптоволокно красным светом пилотного луча лазера. В окрестности торца оптоволокна на фоне потока газовых микропузырьков появляется область денатурированных белков, в которую встроены газовые пузырьки. При этом пузырьки увеличиваются в размере (рис. 7). Подобное образование, состоящее из конгломератов денатурированных белков с пузырьками, также формирует пену. По мере нагревания сыворотки крови и вследствие движения жидкости от нагревателя область, заполненная денатурированным белком с газовыми пузырьками, распространяется вдоль капилляра со скоростью ~3 мм/с. Таким образом, капилляр заполняется конгломератами из денатурированных белков с пузырьками газа. Данный процесс можно интерпретировать как вспенивание водного раствора денатурированного белка. В отличие от случая, представленного на рис. 5, эта пена является весьма устойчивым образованием, которое наблюдалось в стеклянном капилляре более 10 ч.
Рис. 6.
Гетерогенное лазероиндуцированное кипение сыворотки крови в окрестности торца оптоволокна (вид сверху): 1 – микрогазовые пузырьки, 2 – область денатурированного белка, 3 – торец оптоволокна; время между кадрами – 1.3 с; размер кадра – 2.9 × 2.2 мм2.
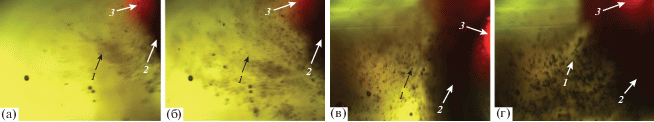
Рис. 7.
Газовые пузыри, встроенные в тело денатурированных белков сыворотки крови (a), и конгломерат газового пузырька диаметром 1.8 мм с денатурированными белками (б): 1 – газовые пузыри, 2 – денатурированные белки (вид сверху).

Кипение в вене. Кровь оптически непрозрачна, поэтому ее кипение удобно исследовать с помощью ультразвуковых методов. Во время выполнения УЗ-ассистированных эндовазальных лазерных операций лазероиндуцированное кипение крови непосредственно в вене пациента отображается на экране монитора УЗ-сканера (рис. 8, 9). Проводится эндовазальная лазерная коагуляция с использованием диодного лазера c длиной волны излучения 1.47 мкм и волокна с радиальным типом высвечивания при мощности излучения 7 Вт. В большой подкожной вене (БПВ) отчетливо наблюдается кипение крови – образование пузырьков и интенсивное движение двухфазной жидкости вблизи торца оптоволокна, которое прослеживается на расстоянии вплоть до 24 ± 2 мм. При продвижении оптоволокна по БПВ против кровотока просвет вены заполняется пузырьками, подобно тому как просвет стеклянного капилляра заполняется конгломератами газовых пузырьков с денатурированными белками плазмы крови. Предполагается, что в данном случае аналогия процессов в вене и стеклянном капилляре полная и в просвете сосуда образуется пена из газовых пузырьков с денатурированными белками плазмы и форменных элементов крови. Данная аналогия подтверждается не только фактом инициации двухфазного потока жидкости от торца оптоволокна, но также образованием “пенной” окклюзии на всем протяжении БПВ, подвергнутой лазерному воздействию (рис. 8, 9).
Рис. 8.
Кипение крови вблизи кончика оптоволокна и образование пены, заполняющей просвет БПВ при продвижении оптоволокна со скоростью 1 мм/с: 1 – лазерное оптоволокно, 2 – область кипения крови, 3 – пенная окклюзия сосуда.

Рис. 9.
Участки большой подкожной вены с одним (а) и двумя (б) притоками, подвергнутые действию лазерного излучения c длиной волны 1.47 мкм и мощ-ностью 7 Вт. (радиальное волокно): 1 – волокно, 2 – газовые пузырьки в БПВ, 3 – пузырьки в притоке БПВ.
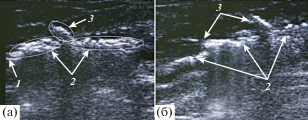
После того как движение пузырьков прекращается, они скапливаются в пену, состоящую из конгломератов пузырьков и денатурированного белка. Это образование весьма устойчивое и обнаруживается на УЗИ более 24 ч. Пена препятствует кровотоку, вызывая окклюзию вены, а также притоков и перфорантов на всем протяжении БПВ, подверженной лазерному воздействию. В области кипения пузырьки, аналогично тому, как это показано на рис. 1–4, 6, устремляются от торца световода вглубь вены с большой скоростью, которая зависит от расстояния от торца. Вблизи торца скорость двухфазного потока – струи – достигает значений 50 ± 5 мм/с и на расстоянии 2–4 мм уменьшается до 20–30 мм/с. На расстоянии 10–12 мм скорость потока падает до 5 ± 1 мм/с и далее уменьшается вплоть до полной остановки на расстоянии 24 ± 2 мм. Пузырьки, распространяющиеся в вене вблизи торца, являются парогазовыми, а на удалении уже практически только газовыми, поскольку температура крови в этих отделах ниже температуры насыщения и пар конденсируется. Пена заполняет просвет БПВ на всем ее протяжении, подверженном действию лазерного излучения (рис. 8, 9). При этом пузырьки заходят в притоки БПВ и перфоранты против тока крови – ретроградно (рис. 9). Это означает, что гидродинамическое давление в потоке струйного кипения превосходит давление тока крови из глубокой вены, за счет которого происходит переток крови из глубокой вены в БПВ. На рис. 9 приведен фрагмент видеосъемки с монитора УЗ-аппарата во время проведения УЗ, ассистированной эндовазальной лазерной коагуляцией.
Кипение в кистах. На рис. 10, 11 показано УЗ-изображение гетерогенного пузырькового кипения кистозной жидкости в процессе лазерного пункционного лечения кисты молочной железы и кисты Беккера соответственно. При мощности лазерного излучения 5 Вт кипение жидкости в кисте молочной железы приводит к генерации струй парогазовых пузырьков, распространяющихся от торца оптоволокна со средней скоростью 5 ± 2 мм/с. Струи – потоки разогретой двухфазной жидкости – огибают внутреннюю поверхность кистозной оболочки и нагревают внутреннюю выстилку – интиму, что приводит к ее тепловому разрушению. Когда скорость потоков устремляется к нулю, пузырьки скапливаются преимущественно на противоположных стенках кисты (рис. 10в). За время проведения лазерной манипуляции (~5 мин) объем кисты сократился до полной облитерации (склеивания оболочки) (рис. 10г).
Рис. 10.
Кипение эндокистозной жидкости в кисте молочной железы; P = 5 Вт; λ = 0.97 мкм; торец оптоволокна диаметром 600 мкм зачернен: 1 – контур кисты, 2 – оптоволокно, 3 –газовые пузырьки; (a) – киста молочной железы объемом 18 мл с введенным в нее лазерным оптоволокном; (б) – начало кипения на торце волокна в той же кисте после эвакуации 15 мл жидкого содержимого; (в) – распространение кипения на весь оставшийся объем кисты молочной железы; (г) – окончание процедуры.

Рис. 11.
Кипение эндокистозной жидкости в кисте Беккера: 1 – контур кисты, 2 – оптоволокно, 3 – пузырьки; торец оптоволокна зачернен; (a) – киста Беккера с введенной в ее объем иглой; (б) – гетерогенное кипение на торце оптоволокна при мощности лазерного излучения 5 Вт; (в) – процедура окончена, лазерное оптоволокно удалено вместе с иглой; (г) – результат лазерного лечения через двое суток после проведения манипуляции.

В кисте Беккера при мощности лазерного излучения 5 Вт и λ = 0.97 мкм кипение на торце зачерненного оптоволокна также приводит к генерации двухфазных потоков (рис. 11б). Пузырьки движутся вдоль верхней стенки кисты и далее вокруг всей кистозной оболочки со средней скоростью ~3 мм/с. Сразу после выключения лазерного излучения и далее на протяжении ~60 мин в кисте определяется область, заполненная газовыми пузырьками в окружении более плотной, чем жидкость, ткани (рис. 11в). На верхней границе кисты хорошо видны крупные газовые пузырьки и поле мелких, заполняющих объем кисты. В результате процедуры лазерного лечения кисты Беккера объем кисты существенно сократился (более чем на 50%), а ее содержимое представляет собой крупные неоднородные эхогенные области, по-видимому, денатурированных белков синовиальной жидкости в стадии деградации (рис. 11г).
ОБСУЖДЕНИЕ
Кипение воды, недогретой до температуры насыщения, приводит к тому, что по достижении некоего критического размера пузырек схлопывается. Однако, как показали проведенные эксперименты, при мощности лазерного излучения ниже значений Р = 2.5 ± 0.2 Вт пузырек медленно нарастает до некоего фиксированного объема и далее остается неизменным (термостабилизируется) в течение всего времени работы лазерного генератора. С увеличением мощности лазерного излучения выше данного порога динамика пузырьков, обнаруженная в проведенных исследованиях, в основном аналогична описанной в работах [8, 20], где также использовались “лазерные нагреватели”. При мощности лазерного излучения 3 Вт и тепловом потоке до 3.3 МВт/м2 пузырьки растут значительно быстрее, достигают некоторого критического размера и затем схлопываются. При схлопывании пузырька в пространство перед торцом оптоволокна, покрытого слоем углерода, выбрасывается пул микрогазовых пузырьков размером 4–20 мкм, двигающихся в струйном потоке жидкости, направленном в пространство от торца световода независимо от направления силы тяжести (рис. 1, 2). Скорость потока максимальна у торца оптоволокна и с расстоянием экспоненционально уменьшается [15]. Предположительно струйные потоки – это либо результат микровзрывов перегретого погранслоя [5], либо результат отдачи кумулятивных струй, возникающих при схлопывании пузырьков и направленных на торец оптоволокна, как это имеет место при кавитации паровых пузырьков [11, 12].
Кипение водных растворов ПАВ отличается тем, что на торце оптоволокна сразу формируются потоки газовых микропузырьков, скорость и размеры которых зависят от мощности лазерного излучения (рис. 4). В этом случае камера не фиксирует крупных парогазовых пузырьков. При остановке движения микропузырьки образуют пену (рис. 5), которая в модельном водном растворе натриевой соли стеариновой кислоты (мыльном растворе) весьма неустойчива и буквально за несколько минут распадается. Однако в водном растворе ПАВ и белков, как это имеет место в сыворотке крови, картина кипения существенно усложняется. Одновременно с генерацией микрогазовых пузырьков по причине нагрева жидкости вблизи торца оптоволокна начинается денатурация белков сыворотки, что приводит к образованию конгломератов денатурированного белка и газовых пузырьков (рис. 6, 7). Поскольку гидрофильность денатурированных белков резко снижается, поверхностное натяжение оболочки контактирующих с ними пузырьков возрастает, и пузырьки могут достигать больших размеров. Они либо объединяются, либо нарастают непосредственно на торце оптоволокна в денатурированном белке. Совокупность образованных таким образом конгломератов движется в потоке сыворотки крови и, когда движение останавливается, скапливается, формируя пену, которая, в отличие от пены микрогазовых пузырьков, в мыльном растворе устойчива. В стеклянном капилляре она наблюдалась более 10 ч.
Лазероиндуцированное кипение крови в вене описано в работе [21]. В процессе проведения УЗ-ассистированной процедуры эндовазального лазерного лечения варикозной болезни было обнаружено, что от торца оптоволокна распространяются потоки пузырьков, которые были предположительно описаны как чисто паровые. На этой основе авторы предложили механизм разогрева венозных стенок, основанный на модели тепловой трубки, когда интима разогревается за счет скрытой теплоты парообразования, выделяющейся при конденсации паровых пузырьков [21]. Однако в [1, 2] показано, что наблюдаемые пузырьки являются парогазовыми либо чисто газовыми, что снижает эффективность теплоотдачи при конденсации пара. Предположение о прямом лазерном нагреве венозных стенок также не выдерживает критики, поскольку кровь эффективно экранирует интиму от лазерного излучения. В подходе, предлагаемом в настоящей работе, модификация и разрушение биотканей происходят не путем их прямого лазерного нагрева либо конденсации пара, а за счет быстрой доставки тепла двухфазными струйными потоками от торца оптоволокна, которые формируются при гетерогенном кипении жидкости [1, 2].
В данной работе показано, что под действием лазерного нагрева, помимо струйного кипения, кровь одномоментно вспенивается. Возникает не описанный ранее эффект, когда при кипении вспенивается водный раствор денатурированных белков крови. Пена, возникшая в просвете сосуда, вызывает окклюзию (закрытие) вены, что приводит к остановке кровотечения – гемостазу (рис. 8–10). Кипение крови и связанное с ним движение пузырьков способствуют тому, что окклюзирующие массы – конгломерат пузырьков и денатурированных белков плазмы и форменных элементов крови – проникают в притоки и перфоранты (рис. 11). Скорость потоков кипящей крови (50 ± 5 мм/с) вблизи торца существенно больше скорости кровотока в венах (11–30 мм/с) [22], поэтому потоки разогретой крови заходят в притоки и перфоранты ретроградно, против тока крови. В этой связи пенообразование в БПВ автоматически обеспечивает гемостаз притоков и перфорантов, что исключает необходимость отдельного лазирования перфорантов. Таким образом, при лазероиндуцированном кипении крови в БПВ одновременно реализуются два взаимно дополняющих процесса – тепловое разрушение венозных стенок и гемостаз. Считается, что в прогнозе результатов хирургического лечения варикозной болезни последнее обстоятельство имеет решающее значение [23].
Следует отметить, что гетерогенное кипение ограничено “сверху” первым кризисом, поэтому с целью практического применения важно использовать лазеры умеренной мощности (1–10 Вт). В крови кризис кипения обнаруживается при мощности излучения 10 ± 3 Вт, когда на нагрев расходуется 30% лазерного излучения, а диаметр кварцевой жилы оптоволокна составляет 600 мкм.
Кисты – патологические образования, имеющие стенку (оболочку) и наполненные жидкостью, могут быть локализованы практически во всех тканях организма и представлять большую опасность [22]. Лечение кист посредством нагрева кистозной жидкости представляется очевидным. Однако гипертермия всего объема кистозной жидкости может привести к нежелательному нагреву близлежащих тканей и осложнениям, тогда как для успешного лечения необходимо разрушить только интиму – выстилающую поверхность внутренней оболочки кисты [24, 25]. На торце оптоволокна, покрытого слоем углерода, развивается пузырьковое кипение с образованием затопленных микроструй двухфазных потоков (рис. 10, 11). Тепло, которое в основном сосредоточено в двухфазных потоках, доставляется к выстилающей внутреннюю поверхность кисты интиме. При этом температура окружающей струю среды из-за слабого теплообмена увеличивается незначительно, что исключает объемный разогрев всей эндокистозной жидкости. Таким образом, гетерогенное кипение на торце лазерного оптоволокна позволяет в недогретой жидкости осуществлять избирательное тепловое разрушение патологического органа без перегрева окружающих тканей. Различные скорости потоков в кистах молочной железы и кистах Беккера объясняются различной вязкостью жидкостей, заполняющих данные патологические образования.
ЗАКЛЮЧЕНИЕ
Работа посвящена исследованию особенностей кипения биологических жидкостей на лазерных нагревателях, актуальных в отношении разработки новых лазерных медицинских технологий. Кипение недогретых до температуры насыщения биологических жидкостей – водных растворов белков, поверхностно активных веществ, насыщенных газом и имеющих дисперсную фазу, помимо больших значений тепловых потоков, локализованных в затопленных двухфазных струях, приводит к одномоментному вспениванию раствора. Струйные потоки кипящей жидкости инициируют избирательный нагрев и температурное разрушение патологических образований без перегрева окружающих тканей, а вспенивание приводит к окклюзии (перекрытию) сосудов, в частности кровеносных, что обеспечивает гемостаз, ишемию и последующий фиброз (рубцевание) патологического очага. Например, в предлагаемых ранее механизмах лазерного лечения варикозно расширенных вен не рассматривалось индуцированное лазерным излучением вспенивание крови, насыщенной газом, поверхностно активными веществами и белками. В частности, не рассматривалась связанная с образованием лазероиндуцированной устойчивой пены окклюзия просвета кровеносных сосудов. В предложенной работе показано, что лазероиндуцированная гидродинамика в модели, связанной с кипением крови, одномоментно обеспечивает разогрев венозных стенок и эффективный гемостаз сосудов, что создает необходимые и достаточные условия для успешного проведения эндовазальной лазерной коагуляции большой подкожной вены.
Работа выполнена при частичной поддержке РФФИ (грант № 18-02-00165), Министерства науки и высшего образования в рамках выполнения работ по госзаданию ФНИЦ “Кристаллография и фотоника” РАН в части лазерной инженерии, а также темам госзадания № 0271-2018-0006, № 0271-2018-0001 и № 0089-2018-0020.
Список литературы
Чудновский В.М., Юсупов В.И., Захаркина О.Л., Игнатьева Н.Ю., Жигарьков В.С., Яшкин М.Н., Баграташвили В.Н. Вклад лазероиндуцированной газопарожидкостной динамики в механизм эндовенозной лазерной облитерации // Современные технологии в медицине. 2016. Т. 8. № 2. С. 6. https://doi.org/10.17691/stm2016.8.2.01
Чудновский В.М., Юсупов В.И., Дыдыкин А.В., Невожай В.И., Кисилев А.Ю., Жуков С.А., Баграташвили В.Н. Лазероиндуцированное кипение биологических жидкостей в медицинских технологиях // Квантовая электроника. 2017. № 4 (47). С. 361.
Чудновский В.М., Юсупов В.И., Жуков С.А., Ечмаев С.Б., Баграташвили В.Н. Лазероиндуцированный режим сверхинтенсивного пузырькового кипения // ДАН. 2017. № 5 (473). С. 533.
Несис Е.И. Кипение жидкостей. М.: Наука, 1973. 280 с.
Zhukov S.A., Afanas’ev S.Yu., Echmaev S.B. Concerning the Magnitude of Maximum Heat Flux and the Mechanisms of Superintensive Bubble Boiling // Int. J. Heat Mass Transfer. 2003. V. 46. P. 3411.
Skripov P.V., Skripov A.P. The Phenomenon of Superheat of Liquids: In Memory of Vladimir P. Skripov // Int. J. Thermophys. 2010. V. 31. P. 816.
Kubo R., Kumagai S. Occurrence and Stability of Micro Bubble Emission Boiling-Stormy and Calm Regimes // Proc. 10th Int. Heat Transfer Conf. V. 5. Brighton. U.K. 1994. P. 99.
Зейгарник Ю.А., Платонов Д.Н., Ходаков К.А., Шехтер Ю.Л. О природе эмиссии микропузырей при кипении недогретой воды // ТВТ. 2012. Т. 50. № 1. С. 83.
Rastopov S.F., Sukhodolky A.T. Self-organization of the Heat Cycle due to Thermal Cavitation During Continuous Laser Heating of a Liquid // Sov. Phys. Dokl. 1987. № 32 (8). P. 671.
Yusupov V.I., Chudnovskii V.M., Bagratashvili V.N. Laser-induced Hydrodynamics in Water-saturated Biotissues. 1. Generation of Bubbles in Liquid // Laser Phys. 2010. № 20 (7). P. 1641.
Padilla-Martinez J.P., Berrospe-Rodriguez C., Aguilar G., Ramirez-San-Juan J.C., Ramos-Garcia R. Optic Cavitation with CW Lasers: A Review // Phys. Fluids. 2014. V. 26. 122007.
Дорофеев Б.М., Волкова В.И. Гидродинамические и термоакустические автоколебания при поверхностном кипении в каналах // Акуст. журн. 2008. Т. 54. № 5. С. 732.
Кебадзе В.В., Александров К.А. О надежности обнаружения кипения натрия с помощью корреляции акустических и нейтронных шумов // Атомная энергия. 1979. Т. 47. № 3. С. 197.
Yusupov V.I., Chudnovskii V.M., Bagratashvili V.N. Laser-induced Hydrodynamics in Water-saturated Biotissues: 2. Effect on Delivery Fiber // Laser Phys. 2011. № 21 (7). P. 1230.
Yusupov V.I., Chudnovskii V.M., Bagratashvili V.N. Laser – Induced Hydrodynamics in Water and Biotissues Nearby Optical Fiber Tip. In: Hydrodynamics – Advanced Topics / Ed. Schulz H.E. In Tech., 2011. P. 95.
Gurashkin A.L., Starostin A.A., Uimin A.A., Yampol’skiy A.D., Ermakov G.V., Skripov P.V. Experimental Determination of Superheated Liquid Density by the Optical Fiber Method // J. Eng. Thermophys. 2013. V. 22. № 3. P. 194.
Deng R., He Y., Qin Y., Chen Q., Chen L. Measuring Pure Water Absorption Coefficient in the Near-infrared Spectrum (900–2500 nm) // Yaogan Xuebao – J. Remote Sensing. 2012. V. 16. № 1. C. 192.
Yusupov V.I., Bulanov V.V., Chudnovskii V.M., Bagra-tashvili V.N. Laser-induced Hydrodynamics in Water-saturated Tissue: III. Optoacoustic Effects // Laser Phys. 2014. № 24(1). https://doi.org/10.1088/1054-660X/24/1/015601
Камышников В. Методы клинических лабораторных исследований. М.: ООО “Медпресс-информ”, 2015. 736 с.
Зейгарник Ю.А., Платонов Д.Н., Ходаков К.А., Шехтер Ю.Л. Визуализация кипения недогретой воды // ТВТ. 2011. Т. 49. № 4. С. 584.
Van der Geld C.W., van den Bos R.R., van Ruijven P.W., Nijsten T., Neumann H.A., van Gemert M.J. The Heat-pipe Resembling Action of Boiling Bubbles in Endovenous Laser Ablation // Lasers Med. Sc. 2010. № 25 (6). P. 907.
Струков А.И., Серов В.В. Патологическая анатомия. Учеб. М.: Литтерра, 2010. 880 с.
Кириенко А.И. Современные принципы лечения хронической венозной недостаточности // 50 лекций по хирургии / Под ред. Савельева В.С. М.: Медиа Медика, 2003. С. 115.
Кухарева Л.И., Невожай В.И., Чудновский В.М. Возможности эхографии в диагностике и склерозирующей терапии кистозных образований молочных желез // Дальневосточный мед. журн. 2008. № 3. С. 49.
Mohamad Feras Marqa, Serge Mordon, Nacim Betrouni. Laser Interstitial Thermotherapy of Small Breast Fibroadenomas: Numerical Simulations // Lasers in Surgery and Medicine. 2012. V. 44. Iss. 10. P. 832.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


