Теплофизика высоких температур, 2019, T. 57, № 5, стр. 769-776
Исследование процессов конденсации и кристаллизации при образовании газовых гидратов в сверхзвуковых струях
М. З. Файзуллин 1, *, А. В. Виноградов 1, А. С. Томин 1, В. П. Коверда 1
1 Институт теплофизики УрО РАН
г. Екатеринбург, Россия
* E-mail: faizullin@itp.uran.ru
Поступила в редакцию 13.03.2019
После доработки 16.05.2019
Принята к публикации 16.05.2019
Аннотация
Экспериментально исследована устойчивость газонасыщенных слоев аморфного льда, приготовленных осаждением сверхзвуковых молекулярных пучков разреженного водяного пара и метана на охлажденную жидким азотом подложку. Адиабатическое расширение молекулярного пучка пара на выходе из сверхзвукового сопла приводит к понижению температуры и образованию кристаллических нанокластеров в потоке. Присутствие готовых кристаллических центров в неравновесных аморфных конденсатах сдвигает начало кристаллизации в область низких температур. Форма сигнала дифференциального термического анализа, состоящего из нескольких экзотермических пиков, свидетельствует о кристаллизации из разных центров и случайном характере их распределения в объеме аморфной среды. При кристаллизации водно-газовых конденсатов образуется гидрат метана. В условиях глубокой метастабильности лавинообразное зарождение центров кристаллизации захватывает молекулы газа, поэтому не происходит их вытеснения движением фронта кристаллизации.
ВВЕДЕНИЕ
Аморфные твердые слои низкомолекулярных веществ можно получить осаждением молекулярных пучков на охлажденную поверхность. При низких температурах устойчивость таких конденсатов, которые представляют собой глубоко переохлажденную замороженную жидкость, обеспечивается высокой вязкостью и низкой частотой зародышеобразования кристаллической фазы. При нагревании аморфные конденсаты кристаллизуются путем зарождения и роста кристаллических центров. В отличие от случая малых переохлаждений, в глубоко переохлажденных жидкостях процесс кристаллизации аморфных слоев может сам себя интенсифицировать за счет положительной обратной связи между скоростью выделения тепла и уменьшением вязкости [1].
Для возникновения спонтанного режима кристаллизации необходимо, чтобы тепловыделение обгоняло тепловую релаксацию. Взаимодействие тепловых полей растущих центров кристаллизации в местах их случайного скопления приводит к их разогреву и появлению горячего центра. Отличительной особенностью кристаллизации в аморфных твердых телах при интенсивном зародышеобразовании является возможность спонтанного возникновения горячих центров и инициирования взрывной кристаллизации в местах локального скопления флуктуационно возникающих зародышевых кристаллов.
Для низкотемпературных аморфных слоев воды интенсивная кристаллизация в условиях хорошего теплоотвода на флуктуационно зарождающихся центрах наблюдается в диапазоне температур 160–170 К [2]. При температурах ниже 160 К горячий центр кристаллизации в аморфном слое может возникнуть в результате внешнего теплового воздействия [1, 3] либо при искусственном внесении в аморфную среду дополнительных зародышей [4–6]. При этом спонтанная кристаллизация может начаться при более низких температурах, чем в случае, когда кристаллизация происходит за счет флуктуационно образующихся зародышевых кристаллов. Условие возникновения горячего центра в аморфной среде с зародышевыми кристаллами и спонтанного перехода к взрывному режиму кристаллизации реализуется при их высокой концентрации, но в общем не важно, каким способом оно достигается – в результате естественного процесса возникновения флуктуационных зародышей или в результате искусственного внесения в неравновесную среду центров кристаллизации.
Кристаллизация газонасыщенных слоев аморфного льда приводит к образованию газовых гидратов [2, 7–13]. Высокопористая структура аморфного льда, полученного низкотемпературной конденсацией молекулярных пучков разреженного водяного пара, способствует его насыщению газовыми молекулами. Нагревание приводит к стеклованию аморфной структуры (переходу из твердой аморфной в жидкую вязкотекучую фазу) и кристаллизации с необратимым захватом газовых молекул и образованием газового гидрата. Формирование гидратов происходит с построением кристаллической структуры, характерной для них в равновесных условиях [8–10]. Рентгеноструктурные исследования показывают, что в аморфных конденсатах смеси воды и диоксида углерода образуются гидраты с кубической структурой I типа [10]. Кубическая структура II типа образуется при кристаллизации аморфного льда, насыщенного молекулами O2, N2, CO и Ar [8, 9].
К числу газов, способных к гидратообразованию при кристаллизации газонасыщенных слоев аморфного льда, относятся и легкие углеводороды метанового ряда. Эксперименты с низкотемпературными водно-газовыми конденсатами показали возможность получения массивных образцов кристаллогидратов с высоким содержанием газа [2, 12, 13]. Такой способ получения газовых гидратов имеет существенные преимущества по сравнению с традиционными методами, в которых гидрат формируется в условиях высокого давления с необходимостью длительного и интенсивного перемешивания водно-газовой смеси. Газовые гидраты, полученные неравновесной конденсацией молекулярных пучков, служат удобными объектами для исследования их теплофизических свойств, границ устойчивости и фазовых превращений в них. Сохранение газовых гидратов при атмосферном давлении в метастабильном состоянии наблюдается вплоть до температуры плавления льда, т.е. до 273 К. Способность газовых гидратов сохранять устойчивость при температурах значительно выше их равновесной температуры разложения известна как эффект самоконсервации, который заключается в том, что при разложении гидраты покрываются слоем льда, препятствующим их дальнейшему разложению [14].
Интерес к газовым гидратам обусловлен существованием огромных запасов углеводородов на Земле в газогидратном виде и перспективой его использования как источника топлива [15, 16]. Обсуждается возможность использования гидратов в качестве своеобразных контейнеров для хранения и транспортировки газа в газогидратном состоянии [17–19]. Острой практической проблемой, связанной с газовыми гидратами, является предупреждение и ликвидация техногенного гидратообразования в газодобывающем и газоперекачивающем оборудовании [15, 16]. В последние годы исследованию свойств газовых гидратов и условий их формирования посвящены многочисленные теоретические и экспериментальные работы. Среди них важное место занимают исследования кинетики нуклеации и разложения гидратов [20–26]. Актуальными остаются разработки новых методов получения газовых гидратов и интенсификации процесса гидратизации см., например, [27–29].
Цель настоящей работы – экспериментальное исследование условий возникновения спонтанной кристаллизации в слоях аморфного льда, насыщенных метаном, и образования газового гидрата в присутствии искусственно внесенных в них зародышевых кристаллов воды.
ГОРЯЧИЕ ЦЕНТРЫ КРИСТАЛЛИЗАЦИИ ПРИ ИНТЕНСИВНОЙ НУКЛЕАЦИИ
В твердой аморфной фазе, которая представляет собой глубоко переохлажденную замороженную жидкость, процесс кристаллизации включает в себя нуклеацию и последующий рост кристаллических центров. Кинетика кристаллизации определяется зависимостью доли закристаллизовавшегося объема V от времени $\tau $ [30]:
Процесс кристаллизации слоев аморфного льда имеет нестационарный характер из-за высокой вязкости вещества. Скорость нуклеации описывается соотношением
где ${{J}_{0}}$ – стационарная скорость нуклеации. J(t) увеличивается со временем. Время запаздывания при установлении стационарного распределения кристаллических зародышей ${{\tau }_{0}}$ возрастает экспоненциально с уменьшением температуры. Это обеспечивает устойчивость аморфного состояния при низких температурах.Рассмотрим аморфную фазу, содержащую в объеме множество вмороженных кристалликов, как сплошную среду с эффективными тепловыми параметрами, величины которых зависят от объемной доли X зародышевых кристаллов.
Скорость распространения фронта взрывной кристаллизации в такой среде ${{u}_{X}}$ связана со скоростью фронта взрывной кристаллизации $u$ в аморфной среде без кристалликов при той же температуре на фронте соотношением
(1)
${{u}_{X}} = {u \mathord{\left/ {\vphantom {u {(1 - {{X}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}})}}} \right. \kern-0em} {(1 - {{X}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}})}},$Другая причина, понижающая устойчивость частично кристаллической аморфной фазы, связана с эффектом экранирования кристаллизационного тепла. Каждый из растущих в объеме аморфной фазы кристалликов является источником тепла, действующим тем интенсивнее, чем выше его температура, которая всегда выше температуры окружающей аморфной среды. Поэтому переток от одного кристаллика к другому невозможен, а при достаточно большой концентрации зародышевых кристаллов произойдет полное запирание потоков кристаллизационного тепла, что приведет к быстрому адиабатическому разогреву среды.
Численно охарактеризовать такое экранирование тепла можно с помощью эффективной температуропроводности среды aX. Кристаллизационное тепло от поверхности маленького кристалла распространяется на расстояние порядка его радиуса R. Эффективный радиус экранирования тепла этим кристалликом составляет 2$~R.$ Поэтому для выбранного центра кристаллизации сечение для теплопроводности через слой ближайших соседей уменьшится на величину, приблизительно равную 4X 2/3. Следовательно, эффективная температуропроводность среды определяется выражением
С уменьшением доли закристаллизованного вещества aX быстро уменьшается. При $X = 0.125$ αX становится равной нулю. Это означает, что теплота кристаллизации не распространяется дальше тонкого слоя аморфной фазы, окружающего кристалл. Толщина слоя не превышает расстояния до соседних кристаллических центров. Кроме того, в аморфной фазе, содержащей большое количество центров, скорость движения фронта спонтанной кристаллизации может превосходить скорость линейного роста отдельного кристалла благодаря вкладу объемной кристаллизации вещества.Рассмотрим аморфную фазу, содержащую в своем объеме большое число кристаллов, в приближении гомогенной среды. Предположим, что скорость роста кристаллов и температуропроводность определяются уравнениями (1) и (2). Одной из характеристик среды является величина X, которая меняется со временем. Ясно, что эта аппроксимация будет удовлетворительной, когда характерные линейные размеры значительно превосходят характерный размер кристаллических центров. Минимальный размер кристалла, который может расти с саморазогревом, т.е. минимальный размер горячего центра кристаллизации, можно оценить по формуле
(3)
${{R}_{{{\text{min}}}}} = {a \mathord{\left/ {\vphantom {a {{{u}_{{{\text{max}}}}}}}} \right. \kern-0em} {{{u}_{{{\text{max}}}}}}}{\kern 1pt} ,$Эта величина значительно меньше, чем в чистой аморфной среде. Влияние центров кристаллизации, распределенных в объеме аморфной среды, становится сильным, когда их объемная доля начинает превышать 0.01. При X = 0.125 перекрываются тепловые поля отдельных кристаллов и возникает взрывная кристаллизация за счет преимущественного зарождения центров кристаллизации [1]. Результаты проведенного анализа пригодны не только для трехмерной объемной среды, но и аморфных слоев, если их толщина $d \gg {{R}_{{{{X}_{{{\text{min}}}}}}}}.$
ЭКСПЕРИМЕНТ И ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Слои аморфного льда, насыщенные метаном, получались в вакуумном криостате конденсацией сверхзвуковых молекулярных пучков разреженного пара и газа на охлажденную жидким азотом подложку. В камере криостата поддерживался вакуум не хуже 10–5–10–6 мм рт. ст. Откачкой паров азота из криостата понижалась температура подложки до 65 К. Толщина образцов составляла 50–100 мкм, скорость осаждения – ∼100 мкм/ч. В опытах использовалась дважды дистиллированная вода. Чистота метана составляла 99.99 мас. %. При нагревании полученных конденсатов наблюдалось их стеклование (размягчение) и последующая спонтанная кристаллизация.
Для наблюдения за образцом использовался емкостный датчик, который закреплялся на подложке и позволял определять температуры стеклования ${{T}_{g}}$ и кристаллизации ${{T}_{c}}$ по изменению диэлектрических свойств образца при нагревании. Подробное описание криостата и конструкции датчика приводится в работах [2, 31]. Датчик представлял собой пленочный конденсатор, изготовленный методом термического напыления. Обкладками конденсатора служили тонкие медные полоски (шириной 0.1 мм, высотой 1–3 мкм), нанесенные на диэлектрическую пластинку с поверхностью 20 × 20 мм, толщиной 0.2 мм. В опыте наблюдалось изменение емкости датчика и тангенса угла диэлектрических потерь tg δ образца, осажденного на поверхность конденсатора. Измерения проводились в условиях вакуума в режиме непрерывного нагревания со скоростью 0.05 К/с на частоте электрического поля 10 кГц. Температура на поверхности датчика при конденсации аморфного слоя не превышала 70 К при ее значении на медной подложке 65 К. По изменению диэлектрических свойств при изменении температуры можно судить о превращениях в образце. Тепловые эффекты, связанные с превращениями, регистрировались дифференциальной термопарой. Точность определения температур стеклования и кристаллизации составляла ±1 К. Наблюдения за выделением газа при нагревании конденсата осуществлялись с помощью ионизационного датчика давления.
Молекулярные пучки поступали в вакуумную камеру через сопла Лаваля, которые разгонялись до сверхзвуковой скорости. Осаждение при фиксированных расходах воды и газа позволяло получать конденсаты заданного состава. Адиабатическое расширение молекулярного потока пара на выходе из сверхзвукового сопла приводит к понижению температуры и образованию кристаллических нанокластеров льда кубической структуры в сверхзвуковом потоке [32]. Размер кластеров зависит от давления на входе в сопло и от расстояния между выходным отверстием сопла и подложкой. Чем выше давление и чем больше расстояние, тем крупнее кластеры и, следовательно, доля кристаллической фазы в объеме образца.
Для определения концентрации газа в конденсатах образцы при заданных условиях осаждения и расходах воды и газа готовились на дополнительной медной пластине диаметром 20 мм, толщиной 1 мм, которая закреплялась в непосредственной близости от емкостного датчика на подложке криостата. После проведения измерений и повторного охлаждения до 77 К пластина вместе с закристаллизованным конденсатом извлекалась из вакуумной камеры и погружалась в U-образную стеклянную мензурку с н-пентаном при 150 К. Одно из колен мензурки было наглухо запаяно и заполнено жидкостью. При нагревании и плавлении образца выделившийся газ собирался в запаянном колене мензурки. Объем газа определялся по повышению уровня пентана в открытом, более высоком колене. После определения объемов газа и воды, содержавшихся в образце, оценивался его состав. Возможность растворения газа в н-пентане не учитывалась. Погрешность определения концентрации газа в конденсате не превышала 3%.
Влияние присутствия готовых центров кристаллизации в аморфной среде демонстрирует рис. 1, на котором показано поведение термограмм дифференциального термического анализа (ДТА) при нагревании двух конденсатов чистого аморфного льда толщиной 100 мкм, один из которых приготовлен без использования сверхзвукового сопла (кривая 1), другой – сверхзвуковым осаждением молекулярного пучка (кривая 2). Давление пара в резервуаре с водой составляло 2.5 кПа. На кривой 1 присутствует один резкий экзотермический пик при 158 К, связанный с выделением тепла при кристаллизации образца. Характер сигнала указывает на спонтанный, лавинообразный режим фазового перехода.
Рис. 1.
Поведение ДТА-термограмм при нагревании конденсатов аморфного льда, приготовленных без использования сверхзвукового сопла (1) и с использованием сверхзвукового осаждения молекулярного пучка (2).

Для конденсата, приготовленного сверхзвуковым осаждением, присутствие готовых кристаллических центров в образце сдвигает начало кристаллизации в область низких температур, а сама форма теплового сигнала, состоящего из нескольких пиков, свидетельствует о кристаллизации из разных центров. На термограмме показаны три резких экзотермических сигнала при 147, 154 и 158 К и слабо выраженный пик тепловыделения при 141 К. В серии проведенных опытов со слоями аморфного льда, приготовленными сверхзвуковой конденсацией, на ДТА-термограммах наблюдалось не менее трех экзотермических сигналов с высокой воспроизводимостью положения первого пика при ∼141 К и последнего при 158–160 К.
Рис. 2 демонстрирует поведение ДТА-термограмм при нагревании насыщенных метаном конденсатов аморфного льда, приготовленных без использования сверхзвукового сопла и при сверхзвуковом осаждении молекулярных пучков пара и газа. Содержание газа в образцах составляет 10 мас. %. Для конденсата, приготовленного без использования сверхзвукового сопла, присутствие газа в образце приводит к сдвигу температуры кристаллизации в сторону высоких значений, так как на формирование кристаллической решетки накладываются ограничения, связанные с диффузионными процессами в двухкомпонентной системе. Температура кристаллизации увеличивается от 158 К при нулевом содержании метана до 166–168 К при его содержании в 10 мас. %. Для газонасыщенного конденсата, приготовленного сверхзвуковым осаждением молекулярных пучков, как и в случае с конденсатами чистого аморфного льда, на термограмме наблюдается три экзотермических сигнала со смещением начального сигнала кристаллизации в сторону низких температур до 140–142 К.
Рис. 2.
Поведение ДТА-термограмм при нагревании насыщенных метаном конденсатов аморфного льда: 1, 2 – см. рис. 1.
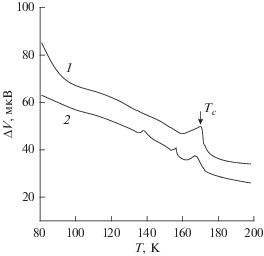
На рис. 3 показано поведение температурной зависимости тангенса угла диэлектрических потерь при нагревании насыщенного метаном аморфного льда, приготовленного сверхзвуковым осаждением молекулярных пучков пара и газа. Здесь же приведена ДТА-термограмма и показания датчика газовыделения. Содержание метана в образце составляет 10 мас. %. При стекловании и кристаллизации конденсата наблюдается характерное поведение температурной зависимости tg δ. При температуре выше Tg = 135 К наблюдается заметное возрастание tg δ, связанное со структурной релаксацией в области стеклования. Резкое уменьшение показаний датчика при температурах 142, 153 и 166 К обусловлено кристаллизацией осажденного образца. Следующее за завершающим сигналом кристаллизации возрастание диэлектрических потерь характерно для кристаллического льда. Положение экзотермических пиков на ДТА-термограмме, связанных с кристаллизацией, совпадает с показаниями емкостного датчика. Чувствительность дифференциальной термопары не позволяла зарегистрировать сигнал стеклования.
Рис. 3.
Поведение тангенса угла диэлектрических потерь (а), показания ДТА-термограммы (б) и датчика газовыделения (в) при нагревании аморфного конденсата смеси вода–метан, приготовленного при сверхзвуковом осаждении молекулярных пучков пара и газа: штриховые участки кривых – повторное охлаждение и последующее нагревание образца после кристаллизации.

Как и в случае с конденсатами чистого аморфного льда, полученными сверхзвуковым осаждением, на ДТА-термограмме присутствует несколько сигналов кристаллизации со смещением начала в сторону низких температур. Увеличение содержания метана в конденсатах приводило к постепенному ослаблению сигналов кристаллизации и их полному вырождению при концентрации, близкой 15 мас. %. Осаждение молекулярных пучков при концентрации более 15 мас. % вызывало существенное нарушение вакуума в криостате и образование кристаллического конденсата. Заметного влияния изменения концентрации газа на температуру стеклования не наблюдалось. Нагревание образца выше 180 К приводило к его испарению в вакуумной камере.
В диапазоне 140–160 К наблюдался отчетливый пик газовыделения, вызванный крипом образца при стекловании. Его начало совпадает с началом перехода из твердого аморфного состояния в жидкое вязкотекучее. Интенсивное выделение газа прекращалось к началу кристаллизации конденсата. Повышенное газонасыщение слоев аморфного льда, приготовленных низкотемпературной конденсацией водяного пара и метана, обусловлено их рыхлой пористой структурой, заполняемой дополнительным количеством газа при осаждении.
Если нагреть образец до 170 К, а затем вновь охладить его до 77 К, то при повторном нагревании показания емкостного датчика и дифференциальной термопары будут следовать по пути, который соответствует штриховому участку на кривой для tg δ и термограмме. При повторном нагревании газовыделения из образца не наблюдается. Последующие циклы охлаждения–нагревания конденсата показывают воспроизводимость хода этих участков кривых.
Увеличение числа центров кристаллизации в неравновесных водно-газовых конденсатах происходит при увеличении доли кристаллической фазы в образце, которое достигается как повышением давления на входе в сверхзвуковое сопло, так и увеличением расстояния между выходным отверстием сверхзвукового сопла и подложкой. Существенного влияния давления в диапазоне от 0.6 до 10 кПа на характер кристаллизации и на значения температур стеклования и окончания кристаллизации не обнаружено. Однако увеличение давления приводило к изменению соотношения в величине экзотермических сигналов кристаллизации. Изменение давления в указанном диапазоне также не влияло и на газонасыщение конденсатов. Аналогичные выводы получены относительно влияния изменения расстояния между выходным отверстием сопла и подложкой при его значениях в диапазоне 3–10 см. Увеличение толщины конденсатов до ∼1 мм при скорости осаждения 1 мм/ч не приводило к изменению фазового состояния образца и не меняло характера поведения ДТА-термограммы и температурной зависимости tg δ.
Кристаллизация аморфного льда приводит к образованию кубической алмазоподобной структуры [9, 33]. Эта фаза льда является метастабильной, она отсутствует на фазовой диаграмме воды. При дальнейшем нагревании, начиная примерно со 180–190 К, происходит превращение кубического льда в гексагональный. Этот переход происходит в широком диапазоне температуры без заметного изменения в теплофизических свойствах из-за низкой скорости процесса. При кристаллизации водно-газового конденсата наряду с кубическим льдом образуется газовый гидрат. Образец при малом содержании газа представляет собой смесь льда и гидрата. При атмосферном давлении сохранение гидрата метана в среде охлажденного пентана наблюдалось при нагревании до его температуры плавления вблизи 273 К. Образец, охлажденный до 77 К, извлекался из вакуумной камеры и погружался в жидкий пентан при температуре ∼150 К. Самоконсервация обеспечивала его устойчивость в метастабильном состоянии при температурах значительно выше равновесной температуры диссоциации. Вблизи 273 К начиналось его плавление и разложение, которое сопровождалось интенсивным выделением газа. Объем выделившегося метана при его содержании в образце в 10 мас. % превышал объем осажденного конденсата в 120 раз.
При максимальном расходе метана во время осаждения концентрация газа в закристаллизованном образце достигала 15 мас. %. Такая концентрация соответствует избыточному содержанию газа по сравнению с теоретическим значением, которое составляет 13.4 мас. % для кубической структуры I типа при полном заполнении больших и малых полостей клатратной решетки. Пересыщение указывает на присутствие молекул метана в образце в свободном состоянии.
Проведенные опыты показали эффективность использования конденсации молекулярных пучков пара и газа со сверхзвуковыми скоростями для получения газовых гидратов. Сверхзвуковая конденсация газонасыщенных слоев аморфного льда обеспечивает многократное увеличение производительности процесса гидратообразования по сравнению с конденсацией с дозвуковыми скоростями и традиционными способами получения газовых гидратов в условиях, близких к равновесным.
ЗАКЛЮЧЕНИЕ
Опыты со слоями аморфного льда, насыщенного метаном, в присутствии искусственно внесенных в них готовых центров кристаллизации демонстрируют неустойчивость неравновесной системы к локальному тепловому воздействию. Малое тепловое возмущение в такой системе может диссипировать, а большое приводит к возникновению взрывной кристаллизации, т.е. является катастрофическим для всей системы. Критическое тепловое возмущение может возникнуть в системе спонтанно в скоплении центров кристаллизации. Присутствие готовых кристаллических центров в образце сдвигает начало кристаллизации в область низких температур, а сама форма теплового сигнала на ДТА-термограмме, состоящего из нескольких экзотермических пиков, свидетельствует о кристаллизации из разных «горячих» центров и случайном характере их распределения в объеме аморфной среды. Температура, соответствующая завершающему сигналу кристаллизации аморфного конденсата, увеличивается. Присутствие газа в образце приводит к сдвигу этой температуры в сторону высоких значений, так как на формирование кристаллической решетки накладываются ограничения, связанные с диффузионными процессами в двухкомпонентной системе. Заметного влияния изменения концентрации газа на температуру стеклования газонасыщенного аморфного льда не обнаружено.
Увеличение числа центров кристаллизации происходит при увеличении доли кристаллической фазы в образце, которое достигается как повышением давления на входе в сверхзвуковое сопло, так и увеличением толщины образца. Однако существенного влияния давления, как и толщины конденсатов, на характер взрывной кристаллизации и на значения температур стеклования и окончания кристаллизации не обнаружено.
Кристаллизация неравновесных газонасыщенных слоев аморфного льда в присутствии готовых центров кристаллизации приводит к образованию газового гидрата. В условиях глубокой метастабильности реализуется спонтанный режим кристаллизации, который обеспечивает захват молекул газа, поэтому не происходит их вытеснения движением фронта кристаллизации.
Результаты исследования показывают успешность применения метода конденсации сверхзвуковых молекулярных пучков разреженного пара и метана для получения газовых гидратов. Использование сверхзвуковой конденсации позволяет увеличить газонасыщение неравновесных водно-газовых слоев за счет заполнения их пористой структуры дополнительным количеством газа.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проекты №№ 18-08-00352а, 18-38-00443 мол-а) и Программы фундаментальных исследований УрО РАН (проект № 18-2-2-3).
Список литературы
Скрипов В.П., Коверда В.П. Спонтанная кристаллизация переохлажденных жидкостей. М.: Наука, 1984. 232 с.
Faizullin M.Z., Vinogradov A.V., Koverda V.P. Hydrate Formation in Layers of Gas-saturated Amorphous Ice // Chem. Eng. Sci. 2015. V. 130. P. 135.
Koverda V.P., Bogdanov N.M., Skokov V.N. Self-sustaining Crystallization of Amorphous Layers of Water and Heavy Water // J. Non-Cryst. Solids. 1983. V. 57. P. 203.
Богданов Н.М., Коверда В.П., Скоков В.Н., Дик А.А., Скрипов В.П. Спонтанная взрывная кристаллизация ультрадисперсных порошков аморфного германия // ДАН СССР. 1987. Т. 293. № 3. С. 595.
Faizullin M.Z., Vinogradov A.V., Tomin A.S., Koverda V.P. Nonstationary Nucleation (Explosive Crystallization) in Layers of Amorphous Ice Prepared by Low-temperature Condensation of Supersonic Molecular Beams // Int. J. Heat Mass Transfer. 2017. V. 108. P. 1292.
Файзуллин М.З., Виноградов А.В., Томин А.С., Коверда В.П. Нестационарная нуклеация в слоях аморфного льда в присутствии искусственно внесенных кристаллических центров // ДАН. 2017. Т. 472. № 6. С. 645.
Bar-Nun A., Herman G., Laufer D., Rappaport M.L. Trapping and Release of Gases by Water Ice and Implications for Icy Bodies // Icarus. 1985. V. 63. P. 317.
Mayer E., Hallbrucker A. Unexpectedly Stable Nitrogen and Oxygen Clathrate Hydrates from Vapour Deposited Amorphous Solid Water // J. Chem. Soc. Chem. Commun. 1989. № 12. P. 749.
Hallbrucker A., Mayer E. Unexpectedly Stable Nitrogen, Oxygen, Carbon Monoxide, and Argon Clathrate Hydrates from Vapour-deposited Amorphous Solid Water: An X-Ray and Two-step Differential Scanning Calorimetry Study // J. Chem. Soc., Faraday Transactions. 1990. V. 86 (22). P. 3785.
Mitterdorfer C., Bauer M., Loerting T. Clathrate Hydrate Formation after CO2–H2O Vapour Deposition // Phys. Chem. Chem. Phys. 2011. V. 13. P. 19765.
Malyk S., Kumi G., Reisler H., Wittig C. Trapping and Release of CO2 Guest Molecules by Amorphous Ice // J. Phys. Chem. A. 2007. V. 111. P. 13365.
Файзуллин М.З., Виноградов А.В., Коверда В.П. Свойства газовых гидратов, полученных неравновесной конденсацией молекулярных пучков // ТВТ. 2014. Т. 52. № 6. С. 852.
Faizullin M.Z., Vinogradov A.V., Koverda V.P. Formation of Clathrate Hydrates under Crystallization of Gas-saturated Amorphous Ice // Int. J. Heat Mass Transfer. 2013. V. 65. P. 649.
Истомин В.А., Якушев В.С. Газовые гидраты в природных условиях. М.: Недра, 1992. 236 с.
Sloan E.D., Koh C. Clathrate Hydrates of Natural Gases. 3rd ed. Chemical Industries. Taylor & Francis, 2007. 721 p.
Makagon Yu.F. Natural Gas Hydrates – a Promising Source of Energy // J. Natural Gas Science Engineering. 2010. V. 2. № 1. P. 49.
Pang W.X., Chen G.J., Dandekar A., Sun C.Y., Zhang C.L. Experimental Study on the Scale-up Effect of Gas Storage in the Form of Hydrate in a Quiescent Reactor // Chem. Eng. Sci. 2007. V. 62. P. 2198.
Nam-Jin Kim, Jeong Hwan Lee, Yil Sik Cho, Wongee Chun. Formation Enhancement of Methane Hydrate for Natural Gas Transport and Storage // Energy. 2010. V. 35. P. 2717.
Mimachi H., Takeya S., Yoneyama A., Hyodo K., Takeda T., Gotoh Y., Murayama T. Natural Gas Storage and Transportation within Gas Hydrate of Smaller Particle: Size Dependence of Self-preservation Phenomenon of Natural Gas Hydrate // Chem. Eng. Sci. 2014. V. 118. P. 208.
Bishnoi P.R., Natarajan V. Formation and Decomposition of Gas Hydrates // Fluid Phase Equilib. 1996. V. 117. P. 168.
Kashchiev D., Firoozabadi A. Nucleation of Gas Hydrates // J. Crystal Growth. 2002. V. 243. P. 476.
Шагапов В.Ш., Хасанов М.К. Режимы восстановления метана из газогидрата при инжекции “теплого” диоксида углерода в пористую среду // ТВТ. 2017. Т. 55. № 5. С. 753.
Ohmura R., Ogawa M., Yasuoka K., Mori Y.H. Statistical Study of Clathrate Hydrate Nucleation in a Water/Hydrochlorofluourcarbon System: Search for the Nature of the “Memory Effect” // J. Phys. Chem. B. 2003. V. 107. P. 5289.
Smirnov G.S., Stegailov V.V. Melting and Superheating of sI Methane Hydrate: Molecular Dynamics Study // J. Chem. Phys. 2012. V. 136. № 4. P. 044523.
Субботин О.С., Белослудов В.Р., Бродская Е.Н., Пиотровская Е.М., Сизов В.В. Изучение механизма самоконсервации газовых гидратов методами компьютерного моделирования // ЖФХ. 2008. Т. 82. № 8. С. 1467.
Zhong D.L., Yang C., Liu D.P., Wu Z.M. Experimental Investigation of Methane Hydrate Formation on Suspended Water Droplets // J. Crystal Growth. 2011. V. 327. P 237.
Dontsov V.E., Chernov A.A. Dilution and Hydrate Forming Process in Shock Waves // Int. J. Heat Mass Transfer. 2009. V. 52. P. 4919.
Chernov A.A., Pil’nik A.A., Elistratov D.S., Mezentsev I.V., Meleshkin A.V., Bartashevich M.V., Vlasenko M.G. New Hydrate Formation Methods in a Liquid-gas Medium // Sci. Reports. 2017. V. 7. P. 40809.
Chernov A.A., Elistratov D.S., Mezentsev I.V., Meleshkin A.V., Pil’nik A.A. Hydrate Formation in the Cyclic Process of Refrigerant Boiling-condensation in a Water Volume // Int. J. Heat Mass Transfer. 2017. V. 108. P. 1320.
Колмогоров А.Н. К статистической теории кристаллизации металлов // Изв. АН СССР. Сер. Матем. 1937. Вып. 3. С. 355.
Faizullin M.Z., Skokov V.N., Koverda V.P. Glass Transition and Crystallization of Water and Aqueous Solutions of Organic Liquids // J. Non-Cryst. Solids. 2010. V. 356. № 23–24. P. 1153.
Torchet G., Schwartz J., Farges J., de Feraudy M.F., Raoult B. Structure of Solid Water Formed in a Free Jet Expansion // J. Chem. Phys. 1983. V. 79. № 12. P. 6196.
Файзуллин М.З., Виноградов А.В., Скоков В.Н., Коверда В.П. Формирование газового гидрата при кристаллизации аморфного льда, насыщенного этаном // ЖФХ. 2014. Т. 88. № 10. С. 1706.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


