Теплофизика высоких температур, 2020, T. 58, № 2, стр. 249-255
Расчетно-теоретическая модель уноса массы углеродных теплозащитных материалов в окислительных газовых потоках
В. В. Горский *
АО “ВПК "НПО машиностроения”
г. Реутов, Россия
* E-mail: vpk@npomash.ru
Поступила в редакцию 05.07.2016
После доработки 11.05.2018
Принята к публикации 24.12.2019
Аннотация
Приводится физико-математическая постановка задачи о квазистационарной абляции углеродного материала, учитывающая протекание всех основных сопутствующих физико-химических процессов. Рассматривается типичный пример распределения параметров уноса массы углеродного материала по поверхности затупленного конуса.
ВВЕДЕНИЕ
Основная проблема, связанная с проектированием абляционной тепловой защиты, заключается в отсутствии возможности воспроизведения в наземных экспериментальных установках условий ее натурной эксплуатации.
В этой связи единственной реальной возможностью для корректного перенесения результатов наземной отработки этого вида тепловой защиты на натурные условия ее эксплуатации является использование расчетно-теоретической модели протекания этого явления, апробированной на результатах систематических стендовых экспериментов.
Данная статья посвящена созданию такой расчетно-теоретической модели абляции углеродных материалов, учитывающей протекание всех основных физико-химических процессов.
ФИЗИКО-МАТЕМАТИЧЕСКАЯ ПОСТАНОВКА ЗАДАЧИ
Согласно предлагаемой модели расчета массовая скорость абляции материала ${{G}_{{{\text{Abl}}}}}$ представляется в виде алгебраической суммы скоростей гетерогенного окисления ${{G}_{{{\text{Ox}}}}},$ сублимации ${{G}_{{{\text{Sub}}}}},$ механической эрозии ${{G}_{{{\text{Er}}}}}$ и гетерогенного нитрирования ${{G}_{{{\text{Nit}}}}}$ углерода
Форма записи уравнения для расчета скорости окисления углерода в парах молекулярного кислорода, установленная более 50 лет назад (см., например, [1, 2]) на базе анализа результатов систематического экспериментального изучения этого процесса, имеет вид [1]
Индекс w относится к стенке, т.е. к поверхности материала, обтекаемой окислительным газовым потоком.
Отделить влияние, оказываемое на скорость окисления углерода температурой стенки, от влияния, оказываемого на эту скорость парциальным давлением окислителя, возможно только при столь малых скоростях окисления углерода, при которых процесс подачи окислителя к стенке практически не влияет на парциальное давление окислителя на ней. В этих условиях имеет место экспериментальная функциональная зависимость вида
По Аррениусу, произведение числа 20 000 на универсальную газовую постоянную называется энергией активации гетерогенной химической реакции окисления углерода в парах молекулярного кислорода, при этом детальный процесс протекания этой реакции не рассматривается.
Если принять, что процесс гетерогенного химического взаимодействия конденсированного углерода с аккомодированными стенкой молекулами кислорода протекает согласно реакции вида
с последующей десорбцией диоксида углерода со стенки, то экспериментально определенная энергия активации может быть названа энергией активации химической реакции окисления углерода молекулярным кислородом.Более распространенная на практике гипотеза о механизме протекания этой химической реакции (см., например, [3]) предполагает, что этот процесс является двухстадийным
В этом случае экспериментально установленное значение энергии активации разумно относить уже не к молекулярному, а к атомарному кислороду.
Важно также отметить, что не существует никакой альтернативы изложенному выше описанию скорости окисления углерода в парах молекулярного кислорода. В частности, предложенная в работе [4] и используемая в [5] формула для расчета скорости гетерогенного окисления углерода атомарным и молекулярным кислородом вида
Здесь ${{R}_{{{\text{Ox}}}}}$ – газовая постоянная окислителя, Дж/(кг К); $\alpha $ – показатель, значение которого определяется экспериментально.
Уменьшение угла наклона кинетической кривой ${\text{ln}}{{G}_{{{\text{Ox}}}}}\left( {{{\text{1}} \mathord{\left/ {\vphantom {{\text{1}} {{{T}_{w}}}}} \right. \kern-0em} {{{T}_{w}}}}} \right),$ наблюдаемое в эксперименте при увеличении температуры стенки и связанного с ним нарастания скорости окисления углерода, в первую очередь обусловлено уменьшением парциального давления кислорода на стенке. Дело в том, что из балансов массы химических элементов на стенке однозначно следует, что скорость окисления углерода пропорциональна скорости диффузионной подачи кислорода к ней. Увеличению же последней скорости соответствует уменьшение парциального давления окислителя на стенке.
Естественно, нельзя исключить из рассмотрения и возможность уменьшения энергии активации с ростом температуры, которое, однако, может иметь место, а может и не иметь. Первый же из указанных факторов присутствует всегда.
В конечном счете, возможности увеличения скорости подачи окислителя к стенке за счет диффузии исчерпываются при близком к нулю парциальном давлении последнего. Следствием чего является возникновение так называемого диффузионного режима окисления углерода, в котором скорость протекания данного процесса практически перестает зависеть от температуры стенки.
В этой связи использование в работе [5] числа Дамкелера для объяснения диффузионного режима окисления углерода представляется ошибочным, так как при рассмотрении процесса абляции в квазистационарной постановке все физико-химические процессы, сопутствующие окислению, проходят с одинаковыми скоростями.
А именно, скорость адсорбции окислителя стенкой, скорость гетерогенного взаимодействия его с углеродом и скорость десорбции продуктов реакции тождественно равны между собой. Это же относится и к скорости диффузионного подвода окислителя к стенке, но только в том случае, если он является единственным источником данного подвода.
Предположение же о том, что физика протекания процесса окисления углерода не зависит от называния режима абляции углерода (кинетический, диффузионный или сублимационный), представляется физически непротиворечивым и базируется на фундаментальных данных по окислению углерода в парах молекулярного кислорода. Скорость окисления углерода в рамках данного предположения всегда проходит в кинетическом режиме и в первую очередь зависит от содержания окислителя на стенке и температуры последней.
Получение кинетических констант, входящих в уравнения типа (2), в прямом физическом эксперименте возможно только для паров молекулярного кислорода, так как при малых скоростях окисления углерода весь кислород в смеси аргона, азота и кислорода, находится в молекулярном состоянии.
В то же время известно, что, начиная с тех достаточно больших скоростей окисления углерода, при которых режим окисления близок к диффузионному, окислитель на стенке находится в основном в атомарном состоянии. Поэтому определение кинетических констант для этого вещества возможно только из решения обратной задачи по отношению к суммарному абляционному эксперименту, как, в частности, описано в [6].
Базируясь на предположении о том, что скорость окисления углерода любым окислителем пропорциональна парциальному давлению этого вещества на стенке и кинетическому члену, записанному в форме Аррениуса, суммарную скорость окисления углерода можно представить в виде аддитивной суммы скоростей окисления отдельными веществами:
Отметим также, что в рамках используемой на практике методики расчета абляции углерода Ю.Д. Пчелкина [2] расчет скорости окисления углерода производится по формуле (3).
Однако в [2] применение формулы (3) ограничивается диффузионным режимом абляции углерода, а в излагаемой в настоящей работе методике (3) используется во всех режимах его абляции: кинетическом, диффузионном и сублимационном.
Следствием использования такого подхода является возможность возникновения третьей, кинетической, ветви в зависимости скорости окисления углерода от температуры, на которой величина этой скорости может существенно превысить скорость диффузионного окисления углерода [6].
И в этом нет никаких противоречий, так как скорость окисления углерода зависит не от расхода окислителя, протекающего через пограничный слой, а от его содержания на стенке (экспериментальный факт), которое определяется всей гаммой физико-химических превращений, происходящих на каталитической углеродной стенке.
Резюмируя выше сказанное, можно утверждать, что используемый в данной работе подход к расчету скорости гетерогенного окисления углерода:
• физически непротиворечив;
• базируется на использовании фундаментальных экспериментальных данных;
• является логичным развитием методики расчета обгара углеродных материалов, сформулированной Ю.Д. Пчелкиным [2].
Следует отметить, что применению предложенной модели должно предшествовать проведение экспериментальных исследований, направленных на получение кинетических констант окисления углерода для конкретного углеродного материала.
Скорость сублимации углерода в данной методике рассчитывается с использованием формулы Ленгмюра–Кнудсена [7], впервые примененной для этой цели в работе [8], записываемой в виде
В этой связи необходимо отметить, что существуют и другие подходы к описанию процесса сублимации [9, 10].
Для описания процесса эрозии углерода к настоящему времени не существует сколько-нибудь установившегося подхода.
Процесс абляции композиционных теплозащитных материалов обычно характеризуется различными индивидуальными скоростями, с которыми происходило бы разрушение отдельных компонент материала, если бы на него не оказывала влияния абляция его остальных компонент [1, 7]. В то же время процесс абляции материала в целом проходит с единой скоростью разрушения за счет того, что компоненты материала, обладающие большими индивидуальными скоростями линейного разрушения, оказываются утопленными по отношению к стенке [7]. Следствием этого является возникновение “наведенной” шероховатости стенки, величина которой, по всей видимости, пропорциональна скорости газификации материала.
Если предположить, что эрозия углерода в первую очередь представляет собой процесс удаления части шероховатости, образовавшейся на поверхности материала, то в достаточной степени обоснованной представляется гипотеза о том, что и массовая скорость этого процесса пропорциональна скорости газификации материала.
Соответствующее этой гипотезе расчетное соотношение для определения скорости эрозии углерода может быть записано в виде
В то же время если предположить, что процесс эрозии является следствием выкрашивания частиц углерода, то, очевидно, более обоснованным является применение формулы вида
(6)
${{G}_{{{\text{Er}}}}} = \left\{ \begin{gathered} 0,\,\,\,\,{{p}_{w}} \leqslant {{p}_{{{\text{Lim}}}}} \hfill \\ {{C}_{{{\text{Er}}}}}{{\rho }_{{{\text{Mat}}}}}\left[ {{{{\left( {{{{{p}_{w}}} \mathord{\left/ {\vphantom {{{{p}_{w}}} {{{p}_{{{\text{Lim}}}}}}}} \right. \kern-0em} {{{p}_{{{\text{Lim}}}}}}}} \right)}}^{n}} - 1} \right],\,\,\,\,{{p}_{w}} > {{p}_{{{\text{Lim}}}}}. \hfill \\ \end{gathered} \right.$Формула такого типа предложена в [11] на базе анализа результатов экспериментальных исследований, проведенных в струе жидкостного ракетного двигателя (ЖРД) при давлении торможения порядка 10 МПа. Однако крайне ограниченный объем экспериментальных исследований, проведенных в [11], не позволяет использовать полученные в ней данные на практике.
Окончательный же выбор типа расчетного соотношения для вычисления скорости эрозии может быть сделан только на базе результатов систематических экспериментальных исследований крупномасштабных моделей в струях продуктов сгорания ЖРД.
Поэтому в данную методику для расчета скорости эрозии углерода включены формулы (5) и (6).
Вопрос о необходимости учета гетерогенных химических реакций нитрирования, протекающих на поверхности углеродного материала, омываемой азотно-кислородной газовой смесью, до сих пор остается открытым. Конечно, сложно ожидать, что роль азота окажется заметной при значительном содержании кислорода на стенке, которое имеет место при достаточно малых значениях безразмерной скорости уноса массы углерода. К тому же в этих условиях азот на каталитической углеродной стенке находится в молекулярном состоянии. В качестве примера здесь можно сослаться на проведенное экспериментальное исследование, результаты которого опубликованы в работе [12].
В то же время в диффузионном режиме абляции углерода концентрация кислорода на стенке близка к нулю, а азот находится в молекулярном состоянии. Многочисленные экспериментальные данные свидетельствуют о том, что в этих условиях наблюдается удовлетворительное соответствие между экспериментальными данными по скорости абляции углерода и соответствующими расчетно-теоретическими данными, полученными без учета гетерогенного нитрирования углерода. Таким образом, и в этих условиях участием молекулярного азота в гетерогенных физико-химических превращениях, протекающих на углеродной стенке, в первом приближении можно пренебречь.
Принципиально другая картина наблюдается для сублимационного режима абляции углерода, в котором отмечается наличие атомарного азота на стенке в количестве, соизмеримом с содержанием кислорода, также находящегося в атомарном состоянии. В связи с этим отсутствуют основания для пренебрежения ролью азота в гетерогенных физико-химических превращениях, протекающих на углеродной стенке в данном режиме абляции материала. Целесообразно также сослаться на известную монографию [1], в которой отмечается, что при высоких температурах углеродной стенки необходимо учитывать гетерогенное химическое взаимодействие ее именно с атомарным азотом. О необходимости учета этой химической реакции говорится и в [2].
Вывод же, сделанный в работе [5] на базе экспериментальных исследований, проведенных при низких температурах стенки [12], о том, что данными реакциями можно пренебречь, не представляется обоснованным.
В рамках данной методики расчета скорость уноса массы углерода, обусловленная гетерогенными химическими реакциями между атомарным азотом и углеродом, записывается в той же форме (3), что и для окислительных реакций:
(7)
${{G}_{{{\text{Nit}}}}} = p_{{{\text{N}},w}}^{{{{n}_{{\text{N}}}}}}{{K}_{{{\text{Nit}},{\text{N}}}}}\exp \left( {{{ - {{\alpha }_{{{\text{Nit}},{\text{N}}}}}} \mathord{\left/ {\vphantom {{ - {{\alpha }_{{{\text{Nit}},{\text{N}}}}}} {{{T}_{w}}}}} \right. \kern-0em} {{{T}_{w}}}}} \right).$Естественно, что применению формулы (7) должно предшествовать проведение экспериментальных исследований по абляции углерода в сублимационном режиме уноса его массы.
ПРИМЕР РАСЧЕТА С ПОМОЩЬЮ ПРЕДЛОЖЕННОЙ МОДЕЛИ
Система уравнений, предназначенная для расчета абляционных характеристик углеродного материала, помимо выписанных выше уравнений (1), (3)–(7) содержит и стандартные термогазодинамические уравнения.
Эта система уравнений применима, в частности:
• при использовании допущения об аналогии между процессами тепломассопереноса в пограничном слое;
• при рассмотрении эффекта вдува паров материала в пограничный слой в линейной постановке;
• при исследовании процесса уноса массы материала в квазистационарной постановке;
• при ограничении состава газовой смеси набором химических веществ O, O2, N, N2, NO, C, C2, C3, CO, CO2, CN, Ar
и записывается в следующем виде:
Здесь ${{C}_{i}},$ ${{M}_{i}},$ ${{h}_{i}}$ – массовая концентрация, молекулярная масса и энтальпия $i$-го вещества; ${{\Theta }_{{j,{\text{out}}}}}$ – концентрация $j$-го химического элемента на внешней границе пограничного слоя; ${{\kappa }_{{{\text{eq,}}i}}}$ – константа равновесия гомогенной химической реакции образования $i$-го молекулярного вещества из атомов; ${{A}_{h}},$ ${{A}_{{h{\text{,im}}}}}$ – коэффициенты теплообмена на проницаемой и непроницаемой стенке, кг/(м2 с); $\gamma $ – коэффициент вдува; $h_{{{\text{C,}}w}}^{s},$ $h_{{{\text{C}},300}}^{s}$ – энтальпия конденсированного углерода при температуре стенки и при 300 К, Дж/кг; $\varepsilon $ – степень черноты; $\sigma $ – константа Стефана–Больцмана, Вт/(м2 К4).
Термин квазистационарная абляция материала при этом означает, что тепловой поток, проникающий в материал, равен произведению массовой скорости его абляции на увеличение энтальпии материала от исходного состояния (принимается, что ему соответствует температура 300 К) до состояния при температуре стенки.
В качестве примера на рис. 1–5 приводятся результаты расчетов, выполненных по сформулированному алгоритму для случая обтекания затупленного по сфере кругового конуса сверхзвуковым потоком воздуха. Для расчета взяты следующие параметры и условия:
Рис. 1.
Распределение скоростей разрушения углеродного материала и степени равновесности процесса сублимации углерода по поверхности затупленного конуса: 1 – $G_{{{\text{Abl}}}}^{'},$ 2 – $G_{{{\text{Ox}}}}^{'},$ 3 – $G_{{{\text{Sub}}}}^{'},$ 4 – $\Upsilon = {{{{p}_{{{\text{C}},w}}}} \mathord{\left/ {\vphantom {{{{p}_{{{\text{C}},w}}}} {{{p}_{{{\text{C}}, \oplus }}}}}} \right. \kern-0em} {{{p}_{{{\text{C}}, \oplus }}}}}.$

Рис. 2.
Распределение температуры стенки и эффективной энтальпии углеродного материала по поверхности затупленного конуса: 1 – ${{T}_{w}},$ 2 – ${{H}_{{{\text{Eff}}}}}.$
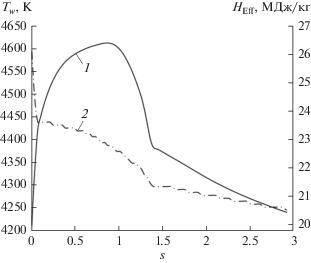
Рис. 3.
Распределение мольных концентраций кислородосодержащих веществ по поверхности затупленного конуса: 1 – ${{\kappa }_{{{\text{O}},w}}},$ 2 – ${{\kappa }_{{{{{\text{O}}}_{2}},w}}},$ 3 – ${{\kappa }_{{{\text{NO}},w}}},$ 4 – ${{\kappa }_{{{\text{CO}},w}}},$ 5 – ${{\kappa }_{{{\text{C}}{{{\text{O}}}_{2}},w}}}.$

Рис. 4.
Распределение мольных концентраций азотосодержащих веществ по поверхности затупленного конуса: 1 – ${{\kappa }_{{{\text{N}},w}}},$ 2 – ${{\kappa }_{{{{{\text{N}}}_{2}},w}}},$ 3 – ${{\kappa }_{{{\text{NO}},w}}},$ 4 – ${{\kappa }_{{{\text{CN}},w}}}.$

Рис. 5.
Распределение мольных концентраций углеродосодержащих веществ по поверхности затупленного конуса: 1 – ${{\kappa }_{{{\text{C}},w}}},$ 2 – ${{\kappa }_{{{{{\text{C}}}_{2}},w}}},$ 3 – ${{\kappa }_{{{{{\text{C}}}_{3}},w}}},$ 4 – ${{\kappa }_{{{\text{CO}},w}}},$ 5 – ${{\kappa }_{{{\text{C}}{{{\text{O}}}_{2}},w}}},$ 6 – ${{\kappa }_{{{\text{CN,}}w}}}.$

• угол полураствора тела равен 10°;
• радиус затупления тела составляет 0.05 м;
• число Маха в набегающем потоке равно 20;
• высота полета – 10 км, что соответствует числу Рейнольдса ${{\operatorname{Re} }_{{\infty ,R,{\text{Sph}}}}},$ рассчитанному по параметрам газа в набегающем потоке и радиусу сферы и равному 8.54 × 106;
• эффективная песочная шероховатость стенки, используемая для определения усиления теплообмена и положения переходной области на поверхности тела, соответствует 10 и 20 мкм;
• кинетические константы окисления углерода атомарным и молекулярным кислородом имеют следующие значения:
• реакции гетерогенного нитрирования углеродного материала и его эрозия не учитываются;
• коэффициенты аккомодации углерода взяты из [8]:
Здесь массовые скорости уноса углерода измеряются в долях от величины коэффициента теплообмена на непроницаемой стенке, а координата $s$ отсчитывается вдоль образующей тела от критической точки в долях его радиуса сферического затупления.
Из представленных результатов следует, что в рассмотренных условиях силового и теплового нагружения тела термохимическое разрушение углерод-углеродного композиционного материала характеризуется:
• температурами стенки, превышающими 4500 К;
• относительно низкими значениями эффективной энтальпии;
• существенным превышением скоростью окисления углерода его значения в диффузионном режиме окисления;
• протеканием процесса сублимации в режиме конденсации на затупленной части тела с постепенным переходом его в режим сублимации.
Существенное превышение скорости окисления углерода ее значения, соответствующего режиму диффузионного окисления, является следствием протекания в сублимационном режиме абляции материала целой совокупности гомогенных химических реакций на стенке, приводящих к образованию в значительных количествах таких веществ, как CN, C, C2, C3.
Протекание этих реакций может в принципе сопровождаться как образованием окислителя, так и его исчезновением, что, естественно, должно сказаться на скорости окисления углерода.
В рассмотренных в данном примере условиях наблюдается образование окислителя и, соответственно, возрастание скорости окисления углерода по сравнению со скоростью его диффузионного окисления.
ЗАКЛЮЧЕНИЕ
На базе анализа литературных данных сформулирована физически непротиворечивая физико-математическая модель абляции углеродных материалов, пригодная для практического использования при апробации ее на результатах систематических стендовых экспериментов по суммарным абляционным характеристикам материала данного класса определенной рецептуры.
Список литературы
Полежаев Ю.В., Юревич Ф.Б. Тепловая защита. М.: Энергия, 1976. 391 с.
Пчелкин Ю.Д. Приближенный метод расчета уноса массы углеродных материалов в высокотемпературном потоке // Космонавтика и ракетостроение. 2014. Вып. 2. С. 19.
Мур Дж.А., Злотник М. Горение углерода в потоке воздуха // Ракетная техника. 1961. Т. 1. № 10. С. 35.
Рознер Д.Е., Аллендорф Г.Д. Сравнительное исследование окисления пиролитического и изотропного графита под воздействием атомарного и молекулярного кислорода при высоких температурах // Ракетная техника и космонавтика. 1968. Т. 6. № 4. С. 91.
Власов В.И., Залогин Г.Н. Численное моделирование термохимического разрушения углеродосодержащих материалов тепловой защиты // Космонавтика и ракетостроение. 2015. Вып. 2. С. 84.
Горский В.В. Теоретические основы расчета абляционной тепловой защиты. М.: Научный мир, 2015. 688 с.
Полежаев Ю.В. Сублимация. В кн.: Физический энциклопедический словарь. М.: Сов. энц., 1956. Т. 5. С. 101.
Анфимов Н.А. Горение графита в потоке воздуха при высоких температурах // Изв. АН СССР. ОТН. Механика и машиностроение. 1964. № 5. С. 3.
Герасимов Д.Н., Юрин Е.И. Параметры, определяющие кинетические процессы на поверхности испарения // ТВТ. 2015. Т. 53. № 4. С. 530.
Герасимов Д.Н., Юрин Е.И. Функция распределения атомов по скорости при испарении жидкости // ТВТ. 2014. Т. 52. № 3. С. 377.
Gorskii V.V., Resh V.G. The Study of Carbon Matherial’s Aerothermochemical Destruction in Combustion Products of Liquid-propellant Rocket Engines // 29th Congress of the Int. Council of the Aeronautical Sciences. St. Petersburg, 2014. P. 8.
Гордеев А.Н., Залогин Г.Н., Колесников А.Ф. Экспериментальное исследование уноса массы углеродных материалов в потоке чистого диссоциированного азота // Физико-химическая кинетика в газовой динамике. 2010. Т. 9. http://chemphys.edu.ru/ issues/2010-9/articles/126/
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


