Теплофизика высоких температур, 2020, T. 58, № 2, стр. 300-305
Моделирование электрохимического преобразования химической энергии биотоплива в электричество
А. З. Жук 1, П. П. Иванов 1, *, Е. А. Киселева 1
1 Объединенный институт высоких температур РАН
Москва, Россия
* E-mail: peter-p-ivanov@yandex.ru
Поступила в редакцию 07.02.2019
После доработки 07.02.2019
Принята к публикации 22.10.2019
Аннотация
Предложена термодинамическая модель электрохимического процесса преобразования химической энергии биотоплива в электричество в топливном элементе прямого окисления углерода. Показано, что при использовании поляризационного сопротивления из эксперимента плотность тока от 0.1 до 0.5 А/см2 обеспечивает к. п. д. энергетической установки в диапазоне 87–55%. При рабочей температуре 1073 К углерод окисляется в основном до монооксида, из-за чего начальный участок топливного элемента представляет собой фактически газификатор, а остальная часть является обычным твердооксидным топливным элементом на синтез-газе. На участке газификации электрохимический процесс идет с поглощением тепла и имеет идеальный термический к. п. д. выше единицы. Целесообразно конструктивно разделить эти два участка для оптимизации теплообмена между ними.
ВВЕДЕНИЕ
Использование биотоплива в энергетике связано приблизительно с теми же проблемами, что и использование углей. Характер этих проблем зависит от конкретного вида топлива. В связи с чем наблюдается устойчивая тенденция вынесения специфики топлива за пределы энергетической установки путем введения этапа газификации [1, 2]. Особенно логичной представляется эта тенденция для энергетических установок с электрохимическим преобразователем [3–10].
Новые перспективы открываются в связи с появлением топливных элементов прямого окисления углерода DCFC (direct carbon fuel cell), особенно их гибридного варианта HDCFC (hybrid DCFC) [11–18]. Гибридность состоит в том, что эти топливные элементы имеют два электролита: твердооксидный и жидкокарбонатный. Ионы кислорода поступают в анодную зону через твердооксидную мембрану, а углерод окисляется в контакте с жидкокарбонатным электролитом. Взвешенными в жидком электролите могут быть частицы не только чистого углерода, но и реального угля и измельченного биотоплива. Таким образом, можно в принципе считать, что с помощью топливного элемента типа HDCFC возможно прямое преобразование химической энергии биотоплива в электричество. Термодинамика этого процесса и моделируется в настоящей работе.
ОПИСАНИЕ МОДЕЛИ
Расчетная схема энергетической установки с топливным элементом типа HDCFC приведена на рис. 1. Топливо нагревается между позициями 1 и 2 до рабочей температуры топливного элемента (1073 К), смешивается с рециркулирующим карбонатом лития и подается в анодное пространство (позиция 5). На выходе из анодного пространства (позиция 7) поток делится на конденсированную фазу (12) и газообразную (11), содержащую продукты окисления и остаток горючего. В позиции 3 подается подогретый воздух для дожигания горючего остатка. Продукты сгорания после охлаждения в теплообменнике 9–10 выбрасываются. Из конденсированной фазы карбонат идет на рециркуляцию (позиция 15), остальное (зола) после охлаждения выбрасывается (позиции 13, 14).
Начальная энтальпия топлива. Предполагается, что при рабочей температуре топливного элемента рассматриваемое биотопливо (позиция 2) находится в равновесии, его состав и энтальпия определяются с помощью программы расчета термодинамического равновесия в многокомпонентной химически реагирующей системе и базы данных свойств индивидуальных веществ типа ИВТАНТЕРМО [19]. Например, энтальпия вычисляется по формуле
где ${{x}_{i}}$ – весовая доля компонента топлива, ${{T}_{{FC}}}$ – рабочая температура топливного элемента.Условие равновесия распространяется на все другие точки схемы “вниз по течению”. Исключением является начальная точка 1. Энтальпия биотоплива ${{h}_{{F1}}},$ необходимая для расчета подогрева до рабочей температуры, неизвестна. Биотопливо, как и твердое ископаемое топливо (угли, торф), нельзя представить в виде смеси индивидуальных веществ. Такие виды топлива в справочниках задаются теплотой сгорания q и элементным составом горючей массы, включающим углерод, водород, серу, кислород и азот. Сухая масса содержит дополнительно золу (A), рабочая масса – влагу (W). Как правило, задается низшая теплота сгорания $q_{H}^{P},$ отнесенная к рабочей массе горючего вещества без учета теплоты конденсации водяного пара. Энтальпия ${{h}_{{F1}}}$ может быть определена из условия, что при полном окислении между точками 5 и 7 горючих компонент, содержащихся в равновесном составе топлива в точке 5, разность между потоком энтальпии, входящим в схему в точке 1, и потоком энтальпии, выходящим из нее, равна теплоте сгорания топлива, умноженной на его расход.
Входной поток равен
где ${{m}_{{F1}}}$ и ${{m}_{{A6}}}$ – расходы топлива и окислителя (воздуха), ${{h}_{{A6}}}$ – энтальпия воздуха.Выходной поток (после охлаждения продуктов окисления) составляет
(2)
$\begin{gathered} {{H}_{{{\text{out}}}}} = {{H}_{7}} - {{Q}_{{{\text{COOL}}}}},\,\,\,\,{{H}_{7}} = {{m}_{{F7}}}{{h}_{{F7}}} + {{m}_{{A8}}}{{h}_{{A8}}}, \\ {{Q}_{{{\text{COOL}}}}} = {{m}_{{F7}}}({{h}_{{F7}}} - {{h}_{{F{\text{out}}}}}). \\ \end{gathered} $Закон сохранения энергии:
Предположение о полном окислении горючих компонент между точками 5 и 7 позволяет вычислить расход кислорода ${{m}_{{{{{\text{O}}}_{2}}}}},$ необходимый для этого, и суммарный энтальпийный эффект реакций окисления ${{Q}^{{{\text{REA}}}}},$ а также тепло для подогрева кислорода до рабочей температуры топливного элемента ${{Q}_{{{{{\text{O}}}_{{\text{2}}}}}}} = {{m}_{{{{{\text{O}}}_{{\text{2}}}}}}}\left( {h_{{{{{\text{O}}}_{{\text{2}}}}}}^{7} - h_{{{{{\text{O}}}_{{\text{2}}}}}}^{6}} \right).$ С помощью этих вычисляемых величин можно написать следующие замыкающие уравнения: Решение системы уравнений (1)–(7) относительно начальной энтальпии биотоплива ${{h}_{{F1}}}$ выглядит какТермодинамическая модель электрохимического процесса. Предположим, что:
– топливный элемент представляется параллельными потоками горючего и окислителя вдоль мембранно-электродного узла (MEA – membrane electrode assembly);
– окислителем является воздух;
– горючее представляет собой взвесь частиц биотоплива в расплаве карбоната лития;
– в анодном пространстве после поступления каждой порции кислорода устанавливается термодинамическое равновесие;
– температура постоянна.
Расчетная схема топливного элемента показана на рис. 2. Горючее и окислитель на входе в топливный элемент и поток кислорода через электролит можно представить векторами мольных расходов:
Уравнения массопереноса на одном шаге:
Локальные значения идеального термического к. п. д. электрохимического процесса и э. д. с. холостого хода на одном шаге:
(8)
${{\eta }_{T}} = \frac{{{{G}_{{j - 1}}} - {{G}_{j}}}}{{{{H}_{{j - 1}}} - {{H}_{j}}}},\,\,\,\,E = \frac{{{{G}_{{j - 1}}} - {{G}_{j}}}}{{4F\Delta {\text{O}}}}.$Локальное рабочее напряжение на одном шаге определяется по формуле
где $J$ – плотность тока; ${{R}_{{{\text{POL}}}}}$ – поляризационное сопротивление, которое вычисляется по экспериментальным вольт-амперным характеристикам мембранно-электродного узла. Таким образом, эффективность энергетической установки с топливным элементом будет оцениваться на основе конкретной технологии.Поляризационное сопротивление позволяет определить рабочую площадь топливного элемента в рамках термодинамической модели и сделать при необходимости стоимостные оценки.
Удобно пользоваться понятием коэффициент нагрузки ${{k}_{{{\text{LOAD}}}}}$ и написать формулу (9) в виде
При этом шаговые приращения электрической и тепловой мощностей записываются в виде:
ПРИМЕР РАСЧЕТА СХЕМЫ HDCFC
Для расчета выбрано биотопливо из класса водорослей Water Hyacinth [20] с таблицей Ultimate Analysis ($q_{В}^{С}$ – сухая высшая теплотворная способность, МДж/кг):
В отечественных расчетах обычно используется низшая теплота сгорания $q_{Н}^{Р}.$ Формулу пересчета можно позаимствовать из [21]:
(11)
$q_{Н}^{Р} = (1 - W)\left[ {q_{В}^{С} - {{q}_{{{\text{vap}}}}}\left( {\frac{W}{{1 - W}} + 0.09H} \right)} \right],$Предположения об остаточной влажности (3.3%) и об упрощенном составе золы (треть – глина (Al2O3) и две третьих – песок (SiO2)) делают задание биотоплива полностью детерминированным. Согласно (11), при такой влажности рабочая низшая теплотворная способность $q_{Н}^{Р}$ равна 13 300 кДж/кг.
Исходные данные для расчета топливного элемента:
– расход топлива – 1 кг/с;
– расход карбоната лития – 1 кг/с;
– рабочая температура – 1073 К;
– поляризационное сопротивление – 0.83 Ом см2 (обобщение данных из [15, 16, 18]);
– плотность тока – 0.25 А/см2;
– коэффициент избытка окислителя – 1.1;
– температура воздуха – 288.15 К;
– коэффициент использования топлива – 0.994 (получается из условия равенства температурного напора между суммарными TQ-диаграммами для источников и стоков тепла 35 К).
Полученный в расчете состав топлива на входе в анодное пространство топливного элемента (рис. 1, позиция 5) и на выходе из него (позиция 7) показан в табл. 1. Первые четыре строки в табл. 1 занимают горючие компоненты, которые полностью или почти исчезают на выходе. Наоборот, продукты окисления – углекислый газ и водяной пар – становятся на выходе доминирующими компонентами. Карбонат лития, компоненты золы и нейтральный азот проходят от входа к выходу без изменения.
Таблица 1.
Состав топлива в молях на входе и выходе из топливного элемента
| Вещество | Вход | Выход |
|---|---|---|
| H2 | 21.66 | 0.1737 |
| CO | 19.38 | 0.218 |
| C | 11.37 | 0 |
| CH4 | 0.4945 | 0 |
| CO2 | 1.206 | 32.23 |
| H2O | 1.245 | 23.72 |
| N2 | 0.52 | 0.52 |
| SiO2 | 2.103 | 2.103 |
| Al2O3 | 0.6196 | 0.6196 |
| Li2CO3 | 13.53 | 13.53 |
Результаты расчета схемы рис. 1 в параметрах рабочих тел приведены в табл. 2.
Таблица 2.
Параметры рабочих тел в отмеченых точках схемы рис. 1
| Позиция на рисунке | Т, К | h, кДж/кг | G, кг/с |
|---|---|---|---|
| 1 | 288.2 | –7835 | 1 |
| 2 | 1073 | –4064 | 1 |
| 3 | 1073 | 1138 | 0.02701 |
| 4 | 288.2 | 290.6 | 0.02701 |
| 5 | 1073 | –8983 | 2 |
| 6 | 288.2 | 290.6 | 5.038 |
| 7 | 1073 | –10 653 | 3.056 |
| 8 | 288.2 | 298.1 | 3.982 |
| 9 | 1073 | –8380 | 1.894 |
| 10 | 330 | –9425 | 1.894 |
| 11 | 1073 | –8518 | 1.867 |
| 12 | 1073 | –14 002 | 1.19 |
| 13 | 1073 | –14 534 | 0.1895 |
| 14 | 330 | –15 354 | 0.1895 |
| 15 | 1073 | –13 901 | 1 |
Интегральные характеристики топливного элемента и энергетической установки в целом в этом расчете получаются следующими:
| – электрическая мощность топливного элемента, кВт | 10 051 |
| – тепловая мощность топливного элемента, кВт | 3974 |
| – средний э. д. с. холостого хода топливного элемента, В | 0.9965 |
| – средний идеальный термический к. п. д. топливного элемента | 0.8538 |
| – средний коэффициент нагрузки | 0.7918 |
| – к. п. д. установки, % | 75.56 |
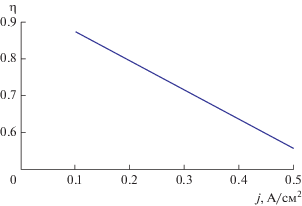
Зависимость к. п. д. установки от плотности тока при прочих равных условиях показана на рис. 3.
ЗАВИСИМОСТЬ ЛОКАЛЬНЫХ ХАРАКТЕРИСТИК ОТ КООРДИНАТЫ ЭЛЕКТРОХИМИЧЕСКОЙ РЕАКЦИИ
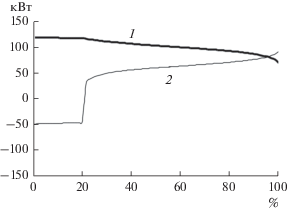
Средние интегральные характеристики топливного элемента, приведенные выше, представляются нормальными для электрохимического процесса. Однако локальные характеристики вдоль координаты электрохимического процесса весьма нестандартны. На рис. 4 приведена зависимость э. д. с. холостого хода E, идеального термического к. п. д. ηT и коэффициента нагрузки k от координаты электрохимического процесса. Можно обратить внимание на снижение всех характеристик при приближении к 100%. Это ожидаемо, но более всего вызывает интерес поведение идеального термического к. п. д. на первых 20% процесса: его значение больше 1.8. Анализ формул (8) и (10) показывает, что ситуация ηT > 1 должна сопровождаться отрицательными значениями шагового приращения тепловой мощности, что и подтверждается кривой Q на рис. 5.
Рис. 4.
Зависимость э. д. с. холостого хода E (1), идеального термического к. п. д. ηT (2) и коэффициента нагрузки k (3) от координаты электрохимического процесса.
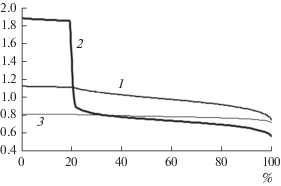
Рис. 5.
Зависимости шаговых приращений электрической P (1) и тепловой Q (2) мощности от координаты электрохимического процесса.
Нестандартное поведение ηT и Q объясняется ходом процесса окисления углерода вдоль координаты электрохимического процесса (рис. 6). Видно, что углерод полностью окисляется за 20% процесса, в основном окисляется до СО, а прирост концентрации CO2 за это время незначителен. Можно утверждать, что именно реакция С + + (1/2)О2 → СО2 ответственна за идеальный термический к. п. д. больше единицы.
ЗАКЛЮЧЕНИЕ
Предложена термодинамическая модель электрохимического процесса преобразования химической энергии биотоплива в электричество в топливном элементе типа HDCFC. Показано, что при использовании поляризационного сопротивления из эксперимента плотность тока от 0.1 до 0.5 А/см2 обеспечивает к. п. д. энергетической установки в диапазоне 87–55%.
Полный процесс электрохимического преобразования энергии биотоплива четко делится на два этапа, отличающихся наличием и отсутствием свободного углерода. Первый этап, пока есть свободный углерод, вполне заслуживает названия “газификатор” (GC – gasifier cell). Второй этап без свободного углерода уже нельзя рассматривать как топливный элемент типа HDCFC, это уже достаточно обычный твердооксидный топливный элемент (SOFC), работающий на синтез-газе.
Эти два этапа процесса, по-видимому, и конструктивно должны быть оформлены отдельно, потому что физика процесса отличается, а самое главное – в GC тепло поглощается, в SOFC выделяется.
Рассматриваемая термодинамическая модель предусматривает строгое соблюдение законов сохранения массы и энергии, но обходит стороной возможные гидродинамические проблемы, некоторые из которых лежат на поверхности:
– из табл. 1 видно, что биотопливо на входе в топливный элемент с рабочей температурой 1073 К уже хорошо газифицировано, и модель взвеси частиц в жидком карбонате является большой натяжкой;
– эта проблема усугубляется к концу процесса газификации;
– вывод конденсата из потока (12 из 7 на рис. 1) в термодинамической модели считается простой операцией, но вывод золы из конденсата (13 из 12) такой операцией не является.
Указанные проблемы служат поводом для создания более сложных моделей.
Список литературы
Aslanian G.S., Farinelli Ugo, Ivanov P.P., Medin S.A. Advanced Integrated Coal Based Power Generation // Perspectives in Energy. 1997–1998. V. 4. P. 241.
Батенин В.М., Иванов П.П., Ковбасюк В.И. Повышение термодинамической эффективности использования влажного биотоплива в энергоисточниках распределенной генерации // ТВТ. 2017. Т. 55. № 1. С. 70.
Verma A., Rao A.D., Samuelsen G.S. Sensitivity Analysis of a Vision 21 Coal Based Zero Emission Power Plant // J. Power Sources. 2006. V. 158. P. 417.
Seitarides Th., Athanasiou C., Zabaniotou A. Modular Biomass Gasification-based Solid Oxide Fuel Cells (SOFC) for Sustainable Development // Renewable Sustainable Energy Rev. 2008. V. 12. P. 1251.
Romano M.C., Campanari S., Spallina V., Lozza G. SOFC-based Hybrid Cycle Integrated with a Coal Gasification Plant // GT2009-59551. Proc. ASME Turbo Expo 2009: Power for Land, Sea, and Air GT2009, June 8–12, 2009, Orlando, Florida, USA.
Newby R., Keairns D. Analysis of Integrated Gasification Fuel Cell Plant Configurations // DOE/NETL-2011-1482, February 25, 2011.
Dey T., Singdeo D., Pophale A., Bose M., Ghosh P.C. SOFC Power Generation System by bio-Gasification // 4th Int. Conf. Advances in Energy Research. 2013. ICAER 2013. Energy Proc. 2014. V. 54. P. 748.
Chen S., Lior N., Xiang W. Coal Gasification Integration with Solid Oxide Fuel Cell and Chemical Looping Combustion for High-efficiency Power Generation with Inherent CO2 Capture // Appl. Energy. 2015. V. 146. P. 298.
Galvagno A., Prestipino M., Zafarana G., Chiodo V. Analysis of an Integrated Agro-waste Gasification and 120 kW SOFC CHP System: Modeling and Experimental Investigation // 71st Conf. of the Italian Thermal Machines Engineering Association. ATI2016. 14–16 Sept. 2016. Turin, Italy. Energy Proc. 2016. V. 101. P. 528.
Dubinin A.M., Shcheklein S.E. Mini Coal-fired CHP Plant on the Basis of Synthesis Gas Generator (CO + H2) and Electrochemical Current Generator // Int. J. Hydrogen Energy. 2007. V. 42. P. 26048.
Pointon K., Lakeman B., Irvine J., Bradley J., Jain S. The Development of a Carbon–Air Semi Fuel Cell // J. Power Sources. 2006. V. 162. P. 750.
Nabae Y., Pointon K.D., Irvine J.T.S. Electrochemical Oxidation of Solid Carbon in Hybrid DCFC with Solid Oxide and Molten Carbonate Binary Electrolyte // Energy Environ. Sci. 2008. V. 1. P. 148.
Jiang C., Ma J., Bonaccorso A.D., Irvine J.T.S. Demonstration of High Power, Direct Conversion of Waste-derived Carbon in a Hybrid Direct Carbon Fuel Cell // Energy Environ. Sci. 2012. V. 5. P. 6973.
Arenillas A., Menéndez J.A., Marnellos G.E., Konsolakis M., Kyriakou V., Kammer K., Jiang C., Chien A., Irvine J.T.S. Direct Coal Fuel Cells (DCFC). The Ultimate Approach for a Sustainable Coal Energy Generation // Bol. Grupo Español Carbón. 2013. № 29. P. 8.
Lee J.-Y., Song R.-H., Lee S.-B., Lim T.-H., Park S.-J., Shul Y.G., Lee J.-W. A Performance Study of Hybrid Direct Carbon Fuel Cells: Impact of Anode Microstructure // Int. J. Hydrogen Energy. 2004. V. 39. P. 11 749.
Deleebeeck L., Hansen K.K. Hybrid Direct Carbon Fuel Cell Performance with Anode Current Collector Material // J. Fuel Cell Sci. Technol. 2015. V. 12. 064501-3.
Fuente-Cuesta A., Jiang C., Arenillas A., Irvine J.T.S. Role of Coal Characteristics in the Electrochemical behaviour of Hybrid Direct Carbon Fuel Cells // Energy Environ. Sci. 2016. V. 9. P. 2868.
Wu W., Zhang Y., Ding D., He T. A High-performing Direct Carbon Fuel Cell with a 3D Architectured Anode Operated Below 600°C // Adv. Mater. 2017. 1704745.
Белов Г.В., Иориш В.С., Юнгман В.С. Моделирование равновесных состояний термодинамических систем с использованием ИВТАНТЕРМО для Windows // ТВТ. 2000. Т. 38. № 2. С. 209.
Gaur S., Reed T. Thermal Data for Natural and Synthetic Fuels. Marcel Dekker, 1998.
Jenkins B.M., Ebeling J.M. Thermochemical Properties of Biomass Fuels // California Agriculture. May–June, 1985.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур