Теплофизика высоких температур, 2020, T. 58, № 3, стр. 445-453
Кинетика и энергетика высокотемпературного пиролиза высоконаполненных эластомеров
В. Л. Страхов 1, *, В. О. Каледин 1, А. А. Кульков 1
1 АО “Центральный научно-исследовательский институт специального машиностроения”
г. Хотьково, Московская обл., Россия
* E-mail: strakhovvl@gmail.com
Поступила в редакцию 25.07.2019
После доработки 05.12.2019
Принята к публикации 24.12.2019
Аннотация
На основании анализа и обобщения результатов теоретических и экспериментальных исследований основных закономерностей физико-химических превращений, происходящих в высоконаполненных эластомерах при нагреве, сформулирована дифференциальная математическая модель кинетики и энергетики процесса пиролиза этих материалов. Отличительной особенностью модели является учет изменения состава материала в процессе нагрева до высоких температур, а также влияния скорости нагрева на параметры процесса. Результаты численных исследований удовлетворительно согласуются с экспериментальными данными.
ВВЕДЕНИЕ
Высоконаполненные эластомеры (ВЭ) – резиноподобные материалы, широко применяемые для теплозащиты изделий, работающих при высоких температурах. Для обеспечения требуемых технологических и эксплуатационных качеств этих материалов в состав резиновых смесей вводятся порошковые и волокнистые наполнители [1‒5]. При высокотемпературном нагреве материалы подвергаются термическому разложению (пиролиз), сопровождающемуся поглощением теплоты и выделением газообразных продуктов. Параметры указанного процесса необходимо учитывать при проведении оценок эксплуатационных качеств теплозащиты и определении требуемых толщин теплозащиты [6–11]. Очевидно, что для этого необходима комплексная математическая модель, включающая модель теплофизических характеристик материала и модель тепломассообмена в теплозащите. Эта комплексная математическая модель должна учитывать физико-химические процессы, происходящие в теплозащитном материале (ТЗМ) при высокотемпературном нагреве, и их влияние на теплофизические характеристики материала в рабочем диапазоне температур. Для оптимизации рецептур композиционных теплозащитных материалов модель должна быть построена с учетом параметров их состава и структуры.
Такая модель была создана на основе общего математического аппарата теории теплозащиты, разработанного ранее в основном в [6, 7], с доработками, выходящими за пределы того круга научных проблем, на которые была ориентирована теория этих работ. Основные положения комплексной математической модели теплозащиты из высоконаполненных эластомеров изложены в статьях [8–11].
В упомянутой выше комплексной математической модели теплозащиты для описания кинетики и энергетики процесса пиролиза использована интегральная модель, основанная на аппроксимации экспериментальных данных термического анализа алгебраическими формулами, не позволяющими учитывать в явной форме изменения состава материала при нагреве до высоких температур и влияние скорости нагрева на параметры процесса пиролиза.
Целью данной работы является построение дифференциальной математической модели кинетики и энергетики процесса пиролиза высоконаполненных эластомеров, свободной от указанных недостатков, и уточнение на этой основе комплексной математической модели теплозащиты.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Экспериментальные исследования процесса пиролиза высоконаполненных эластомеров проводились известными методами дифференциального термического анализа (ДТА), дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (ТГА) в широком диапазоне температур (до 1500°С) и скоростей нагрева (до 150 К/мин). Характерные результаты экспериментов11 для типичного ВЭ [5] на основе этиленпропиленового каучука и фенолформальдегидной смолы с порошковыми наполнителями (технического углерода и оксида цинка) приведены на рис. 1, 2.
Рис. 1.
Результаты термогравиметрического и дифференциально-термического анализа типичного ВЭ, проведенного на дериватографе STA 449 F3 Jupiter® NETZSCH при нагреве образцов с постоянной скоростью 50 К/мин.
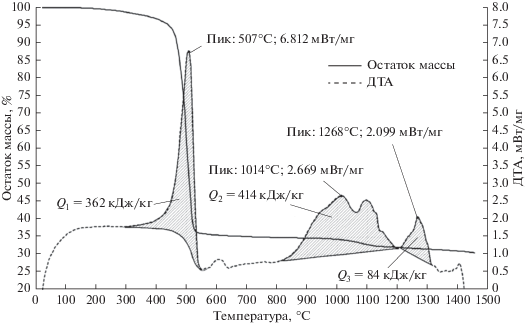
Рис. 2.
Изменение массы образца типичного ВЭ в зависимости от скорости нагрева: 1 – 1 К/мин, 2 – 2, 3 – 5, 4 – 10, 5 – 40, 6 – 80, 7 – 100, 8 – 150.

Можно видеть, что с увеличением скорости нагрева термогравиметрические кривые смещаются в область высоких температур. Однако это смещение практически прекращается при скоростях нагрева, превышающих 40 К/мин, и кинетика процесса перестает зависеть от скорости нагрева. Кроме того, с ростом скорости нагрева увеличивается доля конденсированного остатка в продуктах пиролиза рассматриваемого материала.
Во многих практических приложениях, когда речь идет о высокотемпературном воздействии, темп нагрева может составлять 100‒300 градусов в секунду. Справедливость сделанного вывода в столь широком диапазоне скоростей применительно к процессу пиролиза каучуков обоснована в статье [12].
Проведенный анализ полученных результатов экспериментальных исследований позволил выделить в процессе пиролиза материалов рассматриваемого типа три характерных стадии:
а) термическое разложение полимерной части композиционного материала, сопровождающееся поглощением теплоты и выделением газообразных продуктов (первая основная стадия, протекающая в диапазоне температур от 250 до 550°С);
б) химическое взаимодействие между диоксидом углерода, входящим в состав газообразных продуктов термического разложения, и углеродом, содержащимся в составе конденсированного остатка (вторая стадия, протекающая в диапазоне температур 800–1200°С);
в) химическое взаимодействие между углеродом и неразлагающимся при нагреве наполнителем – оксидом цинка (третья стадия, протекающая в диапазоне температур 1200–1300°С).
Анализ результатов исследований на газовом хроматомасс-спектрометре GCMS-QP2010SE “замороженного” состава продуктов термического разложения рассматриваемых полимеров показывает, что на первой стадии пиролиза в основном происходит выделение углеводородов различных типов (С6H12, C8H16, C8H18, C9H20, C13H28, C10H22, C11H24, C12H24). Это объясняется относительно низким уровнем энергии химических связей С–С и С–Н в макромолекуле каучука. Вместе с тем из термодинамических расчетов равновесного состава продуктов пиролиза фенолкаучуковых композиций следует (табл. 1), что основными газообразными продуктами термического разложения этих полимеров (кроме углеводородов с различной молекулярной массой) являются газы: Н2, СН4, СО, СО2, Н2О, а также пар Zn (температура испарения 907°С), образующийся в результате реакции оксида цинка с углеродом.
Таблица 1.
Содержание основных компонентов в газообразных продуктах пиролиза типичной фенолкаучуковой композиции при давлении 1.0 атм
| Компоненты газовой смеси | Объемная доля компонентов (%) при температуре, °С | ||
|---|---|---|---|
| 780 | 1340 | 1540 | |
| H2 | 48.89 | 93.97 | 94.35 |
| CH4 | 45.19 | 0.55 | 0.19 |
| H2O | 4.91 | 0.02 | 0 |
| CO | 0.25 | 3.66 | 3.67 |
| CO2 | 0.12 | 0 | 0 |
| Zn | 0 | 0.73 | 0.73 |
Результаты термодинамического расчета равновесного состава газообразных продуктов пиролиза рассматриваемого материала, приведенные в табл. 1, также подтверждают сделанные выводы о стадийности процесса пиролиза: доля диоксида углерода уменьшается с ростом температуры (при этом доля оксида углерода увеличивается), а при температурах, превышающих 1300°С, в составе газообразных продуктов появляются пары цинка, свидетельствующие о протекании соответствующей химической реакции.
Таким образом, при наличии углекислого газа в составе продуктов термического разложения полимерной части ВЭ взаимодействие углерода с углекислым газом протекает по реакции
(1)
${{{\text{C}}}_{{({\text{т}})}}} + {\text{C}}{{{\text{O}}}_{{2({\text{г}})}}} = 2{\text{C}}{{{\text{O}}}_{{({\text{г}})}}}.$Согласно следствию из закона Гесса, тепловой эффект химической реакции равен разности суммы энтальпий образования продуктов реакции и суммы энтальпий образования исходных веществ. Тогда из соответствующего расчета получается значение теплового эффекта реакции (1), равное +172.13 кДж/моль. Следовательно, рассматриваемая реакция – эндотермическая.
При наличии в составе ВЭ термостойких наполнителей (оксида цинка, диоксида кремния и т.п.) в обугленном слое теплозащитного покрытия происходят гетерогенные химические реакции между частицами наполнителя и углеродом, сопровождающиеся поглощением теплоты и выделением газообразных продуктов реакции.
Термохимическое уравнение химической реакции оксида цинка с углеродом имеет вид
(2)
${\text{Zn}}{{{\text{O}}}_{{{\text{(т)}}}}} + {{{\text{C}}}_{{{\text{(т)}}}}} = {\text{Z}}{{{\text{n}}}_{{({\text{г}})}}} + {\text{C}}{{{\text{О}}}_{{({\text{г}})}}}.$Значение теплового эффекта реакции (2) равно +237.5 кДж/моль. Знак плюс свидетельствует о том, что эта реакция эндотермическая. Из анализа характера изменения свободной энергии Гиббса следует, что реакция (2) протекает при температурах, превышающих 1100°С.
МАТЕМАТИЧЕСКАЯ МОДЕЛЬ
На основе результатов экспериментальных исследований процесса пиролиза высоконаполненных эластомеров разработана математическая модель кинетики и энергетики данного процесса. Ее основные положения заключаются в следующем.
Для математического описания кинетических закономерностей потери массы и поглощения теплоты при пиролизе на каждой стадии процесса использован феноменологический подход, основанный на применении комбинации стандартных трехпараметрических зависимостей активационного (аррениусовского) типа:
(3)
$\frac{{d\chi }}{{dT}} = {{A}_{T}}\exp \left( {{{ - E} \mathord{\left/ {\vphantom {{ - E} {RT}}} \right. \kern-0em} {RT}}} \right)f\left( \chi \right),$В соответствии с принятым подходом выбор модели реакции осуществляется, исходя из имеющихся в литературе моделей кинетики различных физико-химических процессов (реакций), которые были получены при различных механистических предположениях [13, 14]. Некоторые характерные математические модели кинетики представлены в табл. 2.
Таблица 2.
Характерные теоретические модели кинетики реакций
| Код | Название модели и описываемый процесс | Дифференциальная форма модели реакции f(χ) | Интегральная форма модели реакции $g\left( \chi \right) = ~\mathop \smallint \limits_{{{\alpha }_{0}}}^\alpha \frac{{d\chi }}{{f\left( \chi \right)}}$ |
|---|---|---|---|
| Диффузионные модели | |||
| D1 | 1-мерная диффузия | ${1 \mathord{\left/ {\vphantom {1 {\left( {2\chi } \right)}}} \right. \kern-0em} {\left( {2\chi } \right)}}$ | ${{\chi }^{2}}$ |
| D2 | 2-мерная диффузия | $ - {{\left[ {\ln \left( {1 - \chi } \right)} \right]}^{{ - 1}}}$ | $\left( {1 - \chi } \right)\ln \left( {1 - \chi } \right) + \chi $ |
| D3 | 3-мерная диффузия | $1.5{{\left( {1 - \chi } \right)}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}~1 - {{\left( {1 - \chi } \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}{{]}^{{ - 1}}}$ | ${{\left[ {1 - {{{\left( {1 - \chi } \right)}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}} \right]}^{2}}$ |
| Модели зародышеобразования | |||
| A (n) | Модели Аврами–Ерофеева (cтатистичское зародышеобразование и рост) | $n\left( {1 - \chi } \right)~{{\left[ { - \ln \left( {1 - \chi } \right)} \right]}^{{{{\left( {n - 1} \right)} \mathord{\left/ {\vphantom {{\left( {n - 1} \right)} n}} \right. \kern-0em} n}}}}1 - \alpha ,$ $n = 1,{\text{\;}}2,{\text{\;}}3,{\text{\;}}4$ |
${{\left[ { - \ln \left( {1 - \chi } \right)} \right]}^{{{1 \mathord{\left/ {\vphantom {1 n}} \right. \kern-0em} n}}}}$ |
| P (n) | Законы Мампеля (cтепенной закон развития) | $n{{\chi }^{{{{\left( {n - 1} \right)} \mathord{\left/ {\vphantom {{\left( {n - 1} \right)} n}} \right. \kern-0em} n}}}},$ n = 1, 2/3, 2, 3, 4 |
${{\chi }^{{{1 \mathord{\left/ {\vphantom {1 n}} \right. \kern-0em} n}}}}$ |
| E1 | Экспоненциальный закон | $\alpha $ | ${\text{ln}}\left( \alpha \right)$ |
| Модели химических реакций | |||
| F (n) | Реакции n-го порядка (нулевого порядка, моно-, би-, тримолекулярные) | $(1 - {{\chi }^{n}}),$ n = 0, 1, 2, 3 |
${{\left( {1 - \chi } \right)}^{{1 - n}}} - 1 - \ln \left( {1 - \chi } \right),$ $n = 1$ |
| Bnm | Модель Праута–Томкинса (реакция n-го порядка с автокатализом) | ${{\chi }^{n}}{{\left( {1 - \chi } \right)}^{m}}$ | ${\text{ln}}[{\chi \mathord{\left/ {\vphantom {\chi {\left( {1 - \chi } \right)}}} \right. \kern-0em} {\left( {1 - \chi } \right)}}] + {{c}^{\chi }}$ для n = m = 1 |
| Модели геометрического сжатия (реакции на границе фаз) | |||
| R1 | Плоская симметрия (одно направление) | 1 | $\chi $ |
| R2 | Сжимающийся цилиндр (поверхность) | $2{{\left( {1 - \chi } \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ | $1 - {{\left( {1 - \chi } \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}$ |
| R3 | Сжимающаяся сфера (объем) | $3{{\left( {1 - \chi } \right)}^{{{2 \mathord{\left/ {\vphantom {2 3}} \right. \kern-0em} 3}}}}$ | $1 - {{\left( {1 - \chi } \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}$ |
Вместе с тем при моделировании первой основной стадии процесса пиролиза ВЭ (термического разложения полимерной части композита) при высоких скоростях нагрева следует учитывать резкий рост скорости термического разложения при приближении к температуре достижимого перегрева полимера [15]. С этой целью можно воспользоваться известной функцией температуры вида
Корректирующая функция K(Т) учета резкого роста скорости потери массы вблизи Т * вводится в правую часть уравнения (3).
При построении математической модели кинетики пиролиза ВЭ, работающих при повышенном уровне давления, необходимо также учитывать влияние давления на протекание пиролиза полимерной части композита. С этой целью можно воспользоваться результатами экспериментальных исследований поведения типичного резиноподобного материала при нагреве до температуры 600°С под давлением до 40 атм, которые показали33, что давление приводит к замедлению выхода продуктов пиролиза из слоя материала. Данный вывод подтверждается результатами экспериментов О.Ф. Шленского [12].
Объяснить это явление удается с помощью известного уравнения Клапейрона–Клаузиуса, устанавливающего зависимость температуры кипения Tb жидкости от давления p:
(4)
${{T}_{b}} = {1 \mathord{\left/ {\vphantom {1 {\left( {\frac{1}{{{{T}_{{ba}}}}} - \frac{{R\ln \left( {{p \mathord{\left/ {\vphantom {p {{{p}_{a}}}}} \right. \kern-0em} {{{p}_{a}}}}} \right)}}{{\Delta {{H}_{b}}}}} \right)}}} \right. \kern-0em} {\left( {\frac{1}{{{{T}_{{ba}}}}} - \frac{{R\ln \left( {{p \mathord{\left/ {\vphantom {p {{{p}_{a}}}}} \right. \kern-0em} {{{p}_{a}}}}} \right)}}{{\Delta {{H}_{b}}}}} \right)}},$В работе [18] приведены молярные энтальпии (теплоты) испарения ряда органических веществ (ΔHb) при температуре кипения (Тb) и давлении 101.325 кПа. Согласно данным этой работы, для углеводородов с температурой кипения 130–150°С теплота испарения имеет значение около 35 кДж/моль. Температуры начала кипения углеводородных смесей (испарения нефтяных топлив) имеют близкие значения. Из расчета по формуле (4) при указанном значении теплоты испарения следует, что температура начала кипения углеводородных смесей при давлении 30 атм смещается до уровня 370°С.
Таким образом, уравнение Клапейрона–Клаузиуса можно использовать для экстраполяции экспериментальных данных по кинетике пиролиза ВЭ, полученных при нормальном давлении, в область высоких давлений.
Для обеспечения связи математической модели кинетики пиролиза с разработанной ранее математической моделью высокотемпературных теплофизических характеристик резиноподобных теплозащитных материалов [10] в формулы (7), (8) этой работы вводятся значения степени завершенности пиролиза, получаемые из решения дифференциального уравнения (3). Для первой стадии процесса пиролиза указанные формулы имеют вид44
При этом для расчета удельной мощности стоков теплоты в слое теплозащиты при пиролизе ее материала, входящей в уравнение сохранения энергии [11], применяется формула
где ${{Q}_{i}} = \Delta {{H}_{i}}\left( {1 - {{K}_{i}}} \right)$ – значения тепловых эффектов термического разложения полимерной части материала (i = 1) и вторичных химических реакций (i = 2, 3) в зависимости от степени превращения исходных реагентов (1 – Ki), ΔHi – тепловые эффекты реакций, отнесенные к единице массы выделившегося газа (для вторичных реакций – оксида углерода).Суммарный тепловой эффект процесса термического разложения полимерной части композиционного материала может быть определен в соответствии с законом Гесса как разность между теплотами образования продуктов разложения и теплотой образования исходного полимера:
(5)
$\Delta {{H}_{с}} = (1 - K)\sum\limits_\alpha {\Delta {{H}_{\alpha }}{{\mu }_{\alpha }} + {{K}_{с}}\Delta {{H}_{{{\text{ку}}}}} - \Delta {{H}_{0}}} ,$Теплоты образования компонентов смеси газов пиролиза, входящие в формулу (5), определяются по [16, 19]. Согласно работе [10], с достаточной для практики точностью значения мольных долей компонентов газовой смеси равновесного состава могут быть определены по результатам термодинамического расчета с использованием компьютерной программы, широко применяемой при расчетах равновесного состава и термодинамических характеристик продуктов сгорания (для высоких скоростей нагрева).
Теплота образования исходного полимера, входящая в формулу (5), зависит от соотношения исходных компонентов, химического состава полимера и строения его макромолекулы. Теплота образования полимера может быть определена экспериментально с помощью калориметра методом сжигания или расчетом по энергиям связи и теплотам атомизации.
Согласно расчетному методу, теплота образования полимера в стандартном состоянии рассчитывается по формуле
где ${{\nu }_{j}}$ – число связей j-го вида, ${{h}_{j}}$ – энергии связей j-го вида, Hk – теплота атомизации k-го элемента.Число связей j-го вида определяется по структурной формуле полимера.
В результате проведенных параметрических расчетов в качестве основной модели реакции f(χ) выбрана модель Праута–Томкинса (табл. 1):
а) для стадии термического разложения $f\left( {{{\chi }_{1}}} \right)$ = ${{\left[ {1 - \left( {1 - {{\chi }_{1}}} \right){{{\bar {\mu }}}_{{с0}}}} \right]}^{n}}{{\left[ {\left( {1 - {{\chi }_{1}}} \right){{{\bar {\mu }}}_{{с0}}}} \right]}^{m}};$
б) для вторичных химических реакций $f\left( {{{\chi }_{i}}} \right)$ = = ${{\left( {1 - {{\chi }_{i}}} \right)}^{n}}\chi _{i}^{m}.$
Параметры математической модели процесса пиролиза рассматриваемого ВЭ определялись известным методом коэффициентной обратной задачи [20]. Была принята следующая формулировка обратной задачи: экспериментально получена серия кривых термического анализа, перекрывающих всю исследуемую область условий нагрева; требуется определить такие значения параметров принятой математической модели пиролиза, при которых эта аппроксимация наилучшим образом описывает имеющуюся совокупность экспериментальных данных.
При решении сформулированной обратной задачи производился поиск минимума функционалов вида
В результате решения сформулированной коэффициентной обратной задачи для серии результатов термического анализа получены следующие значения параметров кинетики и энергетики процесса пиролиза рассматриваемого ВЭ:
а) для первой основной стадии процесса: Е1 = = 53 кДж/моль, Кс = 0.08 ΔН1 = 580 кДж/кг, Q1 = = 360 кДж/кг, Т * = 520°С, р = 10, n = 1.8
б) для вторичной химической реакции между конденсированным углеродом, образующимся на первой стадии, и диоксидом углерода: Е2 = = 80 кДж/моль, ΔН2 = 3074 кДж/кг, n = 1, m = 1
в) для вторичной химической реакции между конденсированным углеродом и оксидом цинка: Е3 = 104 кДж/моль, ΔН3 = 8482 кДж/кг, n = 1.5, m = 1
При расчетах учитывались следующие значения среднеквадратичной погрешности измерений соответствующих параметров: Δm = 0.01, ΔТ = = 20 К, ΔQ = 20 кДж/кг.
Важно отметить, что, как видно из полученных результатов, при скоростях нагрева больше 3.2 К/с на практике можно не учитывать влияние скорости нагрева на кинетику пиролиза материала.
СРАВНЕНИЕ РАСЧЕТА С ЭКСПЕРИМЕНТОМ
На основании проведенных исследований для математического моделирования кинетики процесса пиролиза высоконаполненных эластомеров в широком диапазоне условий нагрева предложено использовать следующую систему обыкновенных дифференциальных уравнений:
(6)
$\left. \begin{gathered} \hfill \frac{{d{{\chi }_{1}}}}{{dT}} = {{A}_{{T1}}}\exp {{\left( {{T \mathord{\left/ {\vphantom {T {T{\text{*}}}}} \right. \kern-0em} {T{\text{*}}}}} \right)}^{p}} \times \\ \hfill \times \,\,\exp \left( {{{{{E}_{1}}} \mathord{\left/ {\vphantom {{{{E}_{1}}} {RT}}} \right. \kern-0em} {RT}}} \right){{\left[ {1 - \left( {1 - {{\chi }_{1}}} \right){{{\bar {\mu }}}_{{с0}}}} \right]}^{n}}\left( {1 - {{\chi }_{1}}} \right){{{\bar {\mu }}}_{{с0}}}, \\ \hfill \frac{{d{{\chi }_{2}}}}{{dT}} = {{A}_{{T2}}}\exp \left( {{{{{E}_{2}}} \mathord{\left/ {\vphantom {{{{E}_{2}}} {RT}}} \right. \kern-0em} {RT}}} \right)\left( {1 - {{\chi }_{2}}} \right){{\chi }_{2}}, \\ \hfill \frac{{d{{\chi }_{3}}}}{{dT}} = {{A}_{{T3}}}\exp \left( {{{{{E}_{3}}} \mathord{\left/ {\vphantom {{{{E}_{3}}} {RT}}} \right. \kern-0em} {RT}}} \right){{\left( {1 - {{\chi }_{3}}} \right)}^{n}}{{\chi }_{3}}. \\ \end{gathered} \right\}$Cистема обыкновенных дифференциальных уравнений (6) решается численно методом Рунге–Кутта при начальных условиях: Т = Т0, χ1 = χ2 = = χ3 = 0.
Полученные значения степени завершенности процесса на соответствующих стадиях используются для определения зависимостей от температуры и скорости нагрева массовых долей полимерной части (${{\bar {\mu }}_{с}}\left( Т \right)$) и конденсированного углерода (${{\bar {\mu }}_{{{\text{ку}}}}}\left( Т \right)$), используемых при расчете высокотемпературных теплофизических характеристик деструктирующего материала, а также удельной мощности стоков теплоты в слое теплозащиты при пиролизе ее материала (${{\dot {Q}}_{i}}\left( Т \right)$), по методике, рассмотренной в работах [10, 11].
Изменение относительной массы деструктирующего ВЭ рассчитывается по формуле
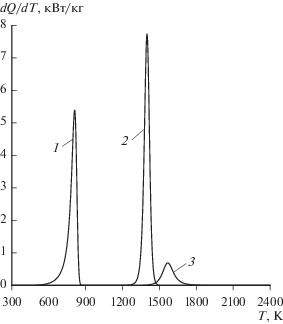
В качестве примера на рис. 3, 4 показаны расчетные зависимости от температуры основных параметров процесса пиролиза рассматриваемого ВЭ при скорости нагрева 0.83 К/с.
Рис. 3.
Зависимость от температуры относительной убыли массы ТЗМ (1), степени завершенности пиролиза полимерной части ТЗМ (2), химической реакции между конденсированным углеродом и диоксидом углерода (3), конденсированным углеродом и оксидом цинка (4).
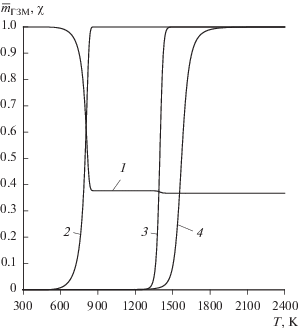
Рис. 4.
Зависимость от температуры удельной мощности поглощения теплоты при пиролизе полимерной части ТЗМ (1), в ходе химической реакции между конденсированным углеродом и диоксидом углерода (2), конденсированным углеродом и оксидом цинка (3).
Сравнение расчетных и экспериментальных значений основных параметров процесса пиролиза исследуемого материала дано в табл. 3–5.
Таблица 3.
Основные параметры процесса термического разложения полимерной части ВЭ на основе этиленпропиленового каучука и фенолформальдегидной смолы с порошковыми наполнителями технического углерода и оксида цинка (первой стадии пиролиза)
| Параметры | Значения параметров при скорости нагрева, К/с | ||||
|---|---|---|---|---|---|
| 0.17 | 0.42 | 0.83 | 3.2 | ||
| Пиковая температура, °С | расчет | 460 | 480 | 500 | 520 |
| эксперимент | 466 | 498 | 507 | 520 | |
| Конечная температура, °С | расчет | 500 | 510 | 515 | 520 |
| эксперимент | 500 | 520 | 520 | 530 | |
| Тепловой эффект, кДж/кг | расчет | 356 | 356 | 356 | 356 |
| эксперимент | 260 | 357 | 362 | – | |
Таблица 4.
Основные параметры вторичной химической реакции между конденсированным углеродом, образующимся на первой стадии процесса пиролиза ВЭ, и диоксидом углерода (второй стадии пиролиза ВЭ)
| Параметры | Значения параметров при скорости нагрева, К/с | ||||
|---|---|---|---|---|---|
| 0.17 | 0.42 | 0.83 | 3.2 | ||
| Пиковая температура, °С | расчет | 950 | 970 | 1050 | 1050 |
| эксперимент | 950 | 960 | 1014–1100 | – | |
| Конечная температура, °С | расчет | 1100 | 1150 | 1200 | 1200 |
| эксперимент | 1080 | 1170 | 1200 | – | |
| Тепловой эффект, кДж/кг | расчет | 1690 | 799 | 430 | 430 |
| эксперимент | 1697 | 790 | 414 | – | |
Таблица 5.
Основные параметры вторичной химической реакции между конденсированным углеродом и оксидом цинка (третьей стадии пиролиза ВЭ)
| Параметры | Значения параметров при скорости нагрева, К/с | ||||
|---|---|---|---|---|---|
| 0.17 | 0.42 | 0.83 | 3.2 | ||
| Пиковая температура, °С | расчет | 1210 | 1250 | 1275 | 1275 |
| эксперимент | 1208 | 1249 | 1268 | – | |
| Конечная температура, °С | расчет | 1275 | 1300 | 1330 | 1330 |
| эксперимент | 1300 | 1300 | 1320 | – | |
| Тепловой эффект, кДж/кг | расчет | 1530 | 253 | 84 | 84 |
| эксперимент | 1562 | 245 | 81 | – | |
Можно видеть, что результаты расчета удовлетворительно согласуются с экспериментальными данными.
Важно также отметить, что с увеличением скорости нагрева уменьшается интенсивность вторичных реакций конденсированного углерода, образующегося на первой стадии процесса, с оксидом углерода и оксидом цинка. При этом уменьшается и доля прореагировавшего углерода и оксида цинка.
С увеличением скорости нагрева кривые потери массы реагентов практически перестают зависеть от скорости нагрева. Следовательно, при практических расчетах деструкции теплозащиты, когда скорости роста температуры материала составляют сотни градусов в секунду, можно с достаточной точностью пренебречь зависимостью кинетики и энергетики пиролиза от скорости нагрева и использовать при расчетах параметры, полученные экспериментально при скорости нагрева около 1 К/с.
Разработанная авторами дифференциальная математическая модель кинетики и энергетики процесса пиролиза совместно с моделью высокотемпературных теплофизических характеристик высоконаполненных эластомеров [10] была использована при расчетах термической деструкции резиноподобных теплозащитных материалов в условиях камеры сгорания современных энергетических установок, работающих при высоких температурах. Результаты также могут быть применены для аналогичных расчетов теплозащиты под слоем конденсированной фазы с учетом результатов работы [21].
ЗАКЛЮЧЕНИЕ
Исследованы закономерности кинетики и энергетики процесса пиролиза теплозащиты из высоконаполненных эластомеров, содержащие новую информацию, которая не только характеризует индивидуальный материал, но и служит основой для построения и развития моделей целого класса теплозащитных материалов. Удовлетворительное согласие результатов теоретического моделирования и опытных данных подтверждает справедливость принципов и гипотез, использованных при построении описанных в данной работе моделей. Установленная связь математической модели кинетики пиролиза с разработанной ранее математической моделью высокотемпературных теплофизических характеристик резиноподобных теплозащитных материалов позволяет учесть в явной форме влияние изменения состава материала в процессе нагрева до высоких температур и скорости нагрева на теплофизические характеристики деструктирующей теплозащиты. Полученные результаты свидетельствуют о перспективности развиваемого подхода для описания поведения теплозащиты в условиях интенсивного теплового воздействия.
Список литературы
Михайлин Ю.А. Специальные полимерные композиционные материалы. СПб.: Научные основы и технологии, 2008. 660 с.
Bhuvaneswari C.M., Sureshkumar M.S., Kakade S.D., Gupta M. Ethylene-propylene Diene Rubber as a Futuristic Elastomer for Insulation of Solid Rocket Motors // Defence Sci. J. 2006. V. 56. № 3. P. 309.
Ahmed A.F., Hoa S.V. Thermal Insulation by Heat Resistant Polymers for Solid Rocket Motor Insulation // J. Compos. Mater. 2012. V. 46. № 13. P. 1544.
Singh Sangita, Guchhait P.K., Singha N.K., Chaki T.K. EPDM Nanocomposites using Polyimide as Ablator: Morphology and Thermophysical Properties // Amer. J. Macromol. Sci. 2014. V. 1. № 1. P. 1.
Каблов В.Ф., Кейбал Н.А., Новопольцева О.М., Руденко К.Ю., Мотченко А.Ю. Теплозащитный материал. Патент RU 2 637 932. 2017. Бюл. № 34.
Полежаев Ю.В., Юревич Ф.Б. Тепловая защита. М.: Энергия, 1976. 392 с.
Панкратов Б.М., Полежаев Ю.В., Рудько А.К. Взаимодействие материалов с газовыми потоками. М.: Машиностроение, 1976. 224 с.
Страхов В.Л., Кузьмин И.А. Математическое моделирование физико-химических свойств внутренней теплозащиты // Механика и процессы управления. Т. 1. Матер. XXXXIV Всерос. cимп. по механике и процессам управления. М.: РАН, 2014. С. 87.
Страхов В.Л., Кульков А.А., Кузьмин И.А. Система компьютерного моделирования работы внутренней теплозащиты // Новые технологии. Т. 1. Матер. ХII Всерос. конф., посвященной 70-летию Победы. М.: РАН, 2015. С. 3.
Страхов В.Л., Атаманов Ю.М., Кузьмин И.А., Бакулин В.Н. Математическое моделирование высокотемпературных теплофизических характеристик резиноподобных теплозащитных материалов // ТВТ. 2017. Т. 55. № 4. С. 528.
Страхов В.Л., Кузьмин И.А., Бакулин В.Н. Комплексное математическое моделирование теплозащиты из высоконаполненных эластомеров // ТВТ. 2019. Т. 57. № 2. С. 278.
Шленский О.Ф. Высокоскоростной пиролиз бутадиенового каучука // ТВТ. 2008. Т. 46. № 3. С. 468.
Vyazovkin S., Linert W. False Isokinetic Relationships Found in the Nonisothermal Decomposition of Solids // Chem. Phys. 1995. V. 193. P. 109.
Khawam A., Flanagan D.R. Solid-state Kinetic Models: Basics and Mathematical Fundamentals // J. Phys. Chem. 2006. V. 110. P. 17315.
Шленский О.Ф. Горение и взрыв материалов. Новые аспекты. 3-е изд., перераб. М.: Инновационное машиностроение, 2015. 232 с.
Термический и окислительный пиролиз топлив и высокополимерных материалов / Под ред. Фарберова И.Л., Богданова И.Ф. М.: Наука, 1966. 215 с.
Гаращенко А.Н., Страхов В.Л., Каблов В.Ф., Кочетков В.Г. Определение параметров вспучивания–усадки теплозащиты с учетом влияния давления // Вопр. оборон. техники. Сер. 15. 2017. Вып. 2(185). С. 18.
David R., Lide. Handbook of Chemistry and Physics. 85th ed. (V. 85). CRC Press. 2004.
Гурвич Л.В., Хачкурузов Г.А., Медведев В.А. и др. Термодинамические свойства индивидуальных веществ. Спр. изд.: В 4-х т. М.: Изд-во АН СССР, 1962. Т. 2. 915 с.
Алифанов О.М., Артюхин Е.А., Румянцев С.В. Экстремальные методы решения некорректных задач и их приложения к обратным задачам теплообмена. М.: Наука; Гл. ред. физ.-мат. лит., 1988. 288 с.
Миронов В.В., Толкач М.А. Термическая деструкция резиноподобных теплозащитных материалов под слоем конденсированной фазы // ТВТ. 2019. Т. 57. № 2. С. 269.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


