Теплофизика высоких температур, 2020, T. 58, № 6, стр. 958-960
Калорические свойства сплава RbBi2 в конденсированном состоянии
С. В. Станкус 1, *, И. В. Савченко 1, О. С. Яцук 1, А. Р. Хайрулин 1
1 ФГБУН Институт теплофизики им. С.С. Кутателадзе
Сибирского отделения РАН
г. Новосибирск, Россия
* E-mail: stankus@itp.nsc.ru
Поступила в редакцию 03.07.2019
После доработки 20.02.2020
Принята к публикации 18.06.2020
Аннотация
С использованием массивного калориметра смешения с изотермической оболочкой измерено приращение энтальпии интерметаллического соединения RbBi2 в твердом и жидком состояниях в интервале температур 432–1176 К. Получены аппроксимирующие уравнения, определены изобарная теплоемкость и изменение энтальпии при плавлении. Оцениваемые погрешности данных по энтальпии и теплоемкости составили 0.4 и 1.0% соответственно. Определена энтальпия образования сплава в жидком состоянии. Проведено сопоставление полученных данных с результатами расчетов по закону идеальных растворов.
ВВЕДЕНИЕ
Расплавы систем щелочных металлов с висмутом, оловом, свинцом и рядом других металлов проявляют свойства, которые нехарактерны для металлических сплавов в жидком состоянии. Так, для системы рубидий–висмут электросопротивление в интервале концентраций 25–40 ат. % Bi превышает электросопротивление висмута в 13–16 раз, рубидия в 27–31 раз [1], а относительное отклонение мольного объема расплавов от аддитивных значений достигает 35% [2]. Такое поведение растворов объясняется образованием ассоциатов с частично ионным характером межатомного взаимодействия, однако прямые доказательства отсутствуют [3‒6]. По этой причине важную роль играет получение комплекса свойств расплавов данной системы, которые могут быть использованы для апробации теоретических моделей. Обзор литературы показал, что калорические свойства сплавов Rb–Bi измерялись только при содержании висмута 27 ат. % [7]. Чтобы установить общий характер изменения энтальпии и теплоемкости расплавов от концентрации, необходимо иметь данные для сплавов с более высоким содержанием висмута.
Цель настоящей работы состоит в измерении приращения энтальпии конгруэнтно плавящегося соединения RbBi2 в широком интервале температур твердого и жидкого состояний и определении его теплоемкости.
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ И ОБСУЖДЕНИЕ
Эксперименты выполнены с использованием массивного изопериболического калориметра смешения, конструкция которого, а также методики проведения измерений и обработки первичных данных описаны в [8]. Температура измерялась термопарой (тип S), которая поверялась по точкам затвердевания чистых Sn, Pb, Al и Cu.
Сплав массой 45.931 г приготавливался из компонентов чистотой 99.9 мас. % (Rb) и 99.98 мас. % (Bi). Использовалась ампула из нержавеющей стали 12Х18Н10Т массой 41.319 г. Все операции по заполнению и герметизации измерительной ячейки дуговой сваркой проводились в перчаточном боксе с аргоновой атмосферой. Сплав RbBi2 синтезировался путем плавления навесок рубидия и висмута заданных масс непосредственно в герметизированной ампуле при температуре 1073 К в течение нескольких часов. Время, необходимое для гомогенизации образца, определялось по результатам измерений коэффициента взаимной диффузии данного жидкого сплава гамма-методом, в котором проводились измерения градиента концентрации в зависимости от времени [2]. Концентрация находилась весовым методом и составила ХRb = 33.355 ± 0.005 ат. %. Рассчитанная молекулярная масса сплава MAlloy = 167.783 г/моль.
Области фазовой стабильности сплава RbBi2 определялись методом термического анализа путем охлаждения ампулы с образцом в печи калориметра с постоянной скоростью 5 К/мин. На термограммах наблюдался один тепловой эффект, который соответствовал началу кристаллизации сплава:
Эта величина воспроизводилась при двух охлаждениях в пределах 0.03 К. Кристаллизации предшествовало переохлаждение на 18 и 20 К. Значение (1) совпало с температурой ликвидуса TL = 883 ± 5 К [9] и TL = 883.4 ± 1.5 К [2] в пределах суммарных погрешностей определения.
Приращение мольной энтальпии сплава рассчитывалось по формуле HT – H298 = MAlloyh298(T), где h298(T) – приращение массовой энтальпии RbBi2 при нагреве от 298.15 до температуры T. Измерение h298(T) проводилось вразброс по температуре, т.е. чередуя низкие и высокие значения T. Такая процедура применена для контроля сохранения состояния образца (гомогенность, чистота) по воспроизводимости результатов.
Аппроксимация первичных данных (табл. 1) проводилась методом наименьших квадратов полиномами вида
(2)
${{H}_{T}} - {{H}_{{298}}} = \sum\limits_{j = 0}^k {{{A}_{j}}{{{\left( {T - {{T}_{0}}} \right)}}^{j}}} .$Таблица 1.
Результаты измерений приращения энтальпии соединения RbBi2
| T, К | HT – H298, Дж/моль | T, К | HT – H298, Дж/моль |
| 431.8 | 3529 | 826.9 | 14 854 |
| 456.4 | 4233 | 851.6 | 15 564 |
| 481.2 | 4912 | 871.4 | 16 279 |
| 506.0 | 5547 | 906.4 | 33 290 |
| 506.7 | 5618 | 975.5 | 35 795 |
| 530.7 | 6279 | 976.0 | 35 824 |
| 579.2 | 7598 | 1025.6 | 37 536 |
| 629.1 | 9037 | 1075.6 | 39 329 |
| 678.4 | 10 471 | 1170.5 | 42 722 |
| 727.9 | 11 903 | 1175.6 | 42 850 |
| 777.5 | 13 417 |
Коэффициенты Aj вместе с другой дополнительной информацией приведены в табл. 2. Оцениваемые общие погрешности определения энтальпии и теплоемкости не превышают 60–110 Дж/моль и 1.0% соответственно. Рассчитанное по аппроксимационным уравнениям изменение энтальпии при плавлении составляет ΔHfus = = (15 920 ± 70) Дж/моль.
Таблица 2.
Данные для расчета по (2)
| Твердая фаза | Расплав | |
|---|---|---|
| T0, К | 298.15 | 884.9 |
| Tmax, К | 884.9 | 1175 |
| A0, Дж/моль | 0 | 32 557 |
| A1, Дж/(моль К) | 25.99 | 35.51 |
| A2, Дж/(моль К2) | 4.04 × 10–3 | 0 |
| СКО, Дж/моль | 29 | 29 |
Примечание. Tmax – верхняя граница применимости уравнения (2), СКО – среднеквадратическое отклонение.
Погрешность величины ΔHfus определялась по случайным погрешностям (доверительная вероятность ‒ 95%) энтальпии при температуре плавления, которые составили 55 Дж/моль для расплава и 40 Дж/моль для твердого тела.
Рис. 1.
Относительные отклонения измеренных значений энтальпии образования и теплоемкости расплава RbBi2 от результатов расчетов по правилу аддитивности.
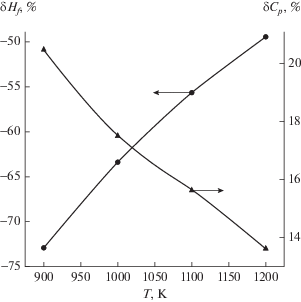
На рисунке приведено сопоставление экспериментальных значений (верхний индекс exp) энтальпии образования ΔHf и изобарной теплоемкости CP расплава RbBi2 с расчетом калорических свойств по правилу аддитивности (индекс add) в форме относительных отклонений, рассчитанных по формулам:
Использовались справочные данные по калорическим свойствам чистых рубидия и висмута, а также данные по энтальпии образования соединения RbBi2 при 298.15 К [10]: ΔHf = (–25.94 ± ± 2.1) кДж/моль. Значительное отклонение калорических свойств от законов для идеальных растворов косвенно подтверждает предположение о существовании в расплаве комплексов с частично ионным характером межатомного взаимодействия, а приближение экспериментальных значений к аддитивным при нагреве свидетельствует о распаде ассоциатов с ростом температуры.
ЗАКЛЮЧЕНИЕ
Впервые получены экспериментальные данные по энтальпии и теплоемкости сплава интерметаллического соединения RbBi2 в твердом и жидком состояниях. Установлено, что в пределах оцениваемых погрешностей теплоемкость жидкого сплава остается постоянной при перегреве до температур над ликвидусом. Показано, что калорические свойства сплава существенно отличаются от расчетов по законам для идеальных растворов.
Исследование выполнено за счет гранта Российского научного фонда (проект № 16-19-10 023-П).
Список литературы
Xu R., Kinderman R., van der Lugt W. Electrical Resistivities of Liquid Na–Bi and Rb–Bi Alloys // J. Phys.: Condens. Matter. 1991. V. 3. P. 127.
Stankus S.V., Abdullaev R.N., Khairulin R.A. Density of Rubidium–Bismuth Melts // High Temp.–High Press. 2018. V. 47. № 5. P. 403.
Hochgesand K., Winter R. Structure of the Equiatomic Liquid Alloys K–Sb, K–Bi, and Rb–Bi over a Wide Temperature Range // J. Chem. Phys. 2000. V. 112. P. 7551.
Liu M., Li C., Du Z., Guo C., Niu C. Thermodynamic Assessment of the Bi–Rb Binary System // Thermochim. Acta. 2013. V. 551. P. 27.
Petric A., Pelton A. D., Saboungi M.-L. Electromotive Force Measurements in Molten Rb-Bi Alloys with a Rubidium β"-Alumina Electrolyte // J. Electrochem. Soc. 1988. V. 135. P. 2754.
Van der Lugt W. Zintl Ions as Structural Units in Liquid Alloys // Phys. Scr. 1991. V. 39. P. 372.
Станкус С.В., Савченко И.В., Яцук О.С., Расчектаева Е.П. Калорические свойства “металлической соли” Rb73Bi27 в твердом и жидком состояниях // ЖФХ. 2018. Т. 92. № 9. С. 1379.
Станкус С.В., Савченко И.В., Яцук О.С. Калорические свойства жидкого висмута // ТВТ. 2018. Т. 56. № 1. С. 30.
Pelton A.D., Petric A. The Bi–Rb (Bismuth–Rubidium) System // J. Phase Equilib. 1993. V. 14. P. 368.
Воронин Г.Ф., Герасимов Я.И., Мухамеджанова Н.М. Теплоты и энтропии образования соединений рубидия с висмутом // ЖФХ. 1974. Т. 48. № 12. С. 2941.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур


