Теплофизика высоких температур, 2021, T. 59, № 1, стр. 82-85
Теплоаккумулирующая смесь из галогенидов и хроматов натрия
Н. Н. Вердиев 1, *, И. К. Гаркушин 2, З. Н. Вердиева 1, А. В. Бурчаков 2, И. М. Кондратюк 2, Е. М. Егорова 2
1 Институт проблем геотермии и возобновляемой энергетики –
филиал Объединенного института высоких температур РАН
г. Махачкала, Россия
2 Самарский государственный технический университет
г. Самара, Россия
* E-mail: verdiev55@mail.ru
Поступила в редакцию 18.12.2019
После доработки 20.05.2020
Принята к публикации 18.06.2020
Аннотация
Дифференциальным термическим, дифференциальным сканирующим калориметрическим методами физико-химического анализа исследована трехкомпонентная система из хлоридов, бромидов и хроматов натрия. Установлено соотношение компонентов в нонвариантном составе, который кристаллизуется при 555°С с удельной энтальпией плавления 92.9 Дж/г. Отмечено, что в твердой фазе присутствует полиморфное превращение Na2CrO4 при 423°С с удельной энтальпией 42.6 Дж/г. Разработанный состав может быть использован в качестве рабочего тела в устройствах, аккумулирующих тепловую энергию в интервале температур от 300 до 600°С. Построена 3D-модель фазового комплекса системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$, и выявлены моно- и нонвариантные фазовые реакции. Пространственная модель системы позволяет анализировать фазовый комплекс системы, строить произвольно выбранные изотермические и политермические сечения.
ВВЕДЕНИЕ
Нонвариантные составы многокомпонентных солевых систем имеют широкий спектр применений. Они используются в качестве теплоаккумулирующих материалов, высокотемпературных теплоносителей, расплавленных катализаторов, электролитов многоцелевого назначения, в производстве современного стрелкового вооружения, ядерной энергетике и т.д. [1–9]. Существующая в настоящее время информация по солевым системам недостаточна, что связано с длительностью и трудоемкостью проведения экспериментальных исследований. В связи с этим расширение спектра солевых составов является актуальной задачей, необходимой для обеспечения высокой конкурентоспособности и технологичности современных изделий. Исследования предприняты с целью разработки солевых смесей с практически значимыми свойствами.
МЕТОДИКА ЭКСПЕРИМЕНТА
Эксперимент по выявлению температуры плавления и состава нонвариантной точки планировался в соответствии с общими положениями проекционно-термографического метода [10]. Схема кристаллизующихся фаз систем Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ сформирована в соответствии с алгоритмами [11, 12]. В исследованиях использованы предварительно обезвоженные реактивы следующих квалификаций: NaCl – ос. ч., NaBr – ч, Na2CrO4 – ч. д. а., с содержанием основного компонента NaCl более 99%, NaBr – не менее 98%, а Na2CrO4 – более 98%. Температуры плавления компонентов соответствовали справочным данным [13, 14]. В качестве индифферентного вещества использован оксид алюминия (Al2O3) квалификации ч. д. а. Исследования проводились дифференциальным термическим (ДТА) и дифференциальным сканирующим калориметрическим (ДСК) методами физико-химического анализа [15–17]. ДТА и ДСК проведены на установке синхронного термического анализа STA 449 F3 Phoenix фирмы Netzsch, предназначенной для работы в интервале температур от комнатной до 1500°С в инертной среде (аргон). Скорость нагревания и охлаждения образцов составляла 10°С/мин. Точность измерения температур – ±1.5°С, энтальпии фазовых переходов – ±3%. Масса навесок составила 0.1000–0.2000 г для ДТА и 0.0010–0.0015 для ДСК. Составы выражены в эквивалентных процентах, температуры – в градусах Цельсия.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
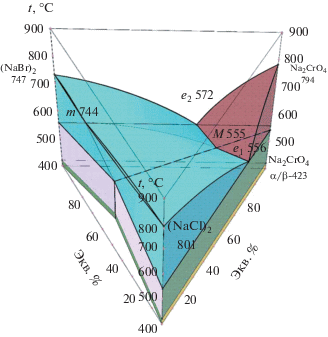
В огранение системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ входят три двухкомпонентные системы: NaCl–NaBr [18], непрерывный ряд твердых растворов с минимумом при 744°С и 30 экв. % NaCl; NaBr–Na2CrO4 [19], эвтектика при 572°С и 35 экв. % NaBr, твердые фазы – NaBr, Na2CrO4; NaBr–Na2CrO4 [20], эвтектика при 556°С и 30 экв. % NaCl, твердые фазы – NaCl, Na2CrO4, полиморфное превращение Na2CrO4 при 423°С (рис. 1).
Рис. 1.
Политермические сечения: AB; Na2CrO4 → → $\bar {M}$ → M системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}.$
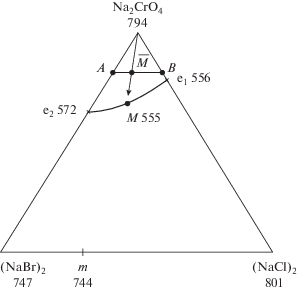
С учетом того, что две системы огранения эвтектические и одна с твердыми растворами, для подтверждения устойчивости или распада твердых растворов экспериментально с помощью ДТА исследован одномерный политермический разрез АВ, где А – 18% NaCl + 82% Na2CrO4, В – 18% NaBr + 82% Na2CrO4 (рис. 1). Разрез АВ выбран в поле кристаллизации компонента без твердых растворов, что значительно упрощает интерпретацию экспериментальных данных.
На рис. 2 представлена Т–х-диаграмма разреза АВ. На кривых ДТА охлаждения образцов, соответствующих разрезу АВ, отмечены термоэффекты первичной кристаллизации β-Na2CrO4, совместной кристаллизации β-Na2CrO4 с твердыми растворами на основе хлорида и бромида натрия, а также полиморфного перехода Na2CrO4 при 423°С.
Рис. 2.
Т–х-диаграмма разреза АВ системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}.$
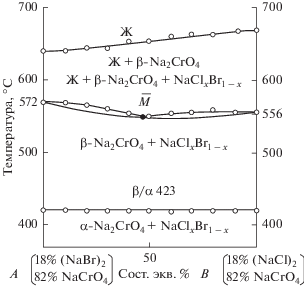
Об устойчивости твердых растворов NaClxBr1– x в исследуемой системе свидетельствует отсутствие на кривой ДТА эффектов совместной кристаллизации трех исходных компонентов (рис. 2). Исследованием Т–х-диаграммы разреза АВ определено направление на состав с минимальной температурой кристаллизации системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}.$ Исследованием разреза Na2CrO4 → → $\bar {M}$ → M, проведенного из полюса кристаллизации Na2CrO4 через точку $\bar {M},$ выявлен состав минимума M, содержащий NaCl – 12.5 экв. %, NaBr – 19.5, Na2CrO4 – 68, температура плавления – 555°С, энтальпия плавления, выявленная ДСК в результате проведения трех измерений, равна 92.9 Дж/г.
Исследованные ранее системы [21–23] с участием галогенидов, молибдатов, вольфраматов, карбонатов s1-элементов предложено использовать в качестве теплоаккумулирующих материалов. Эвтектические смеси этих систем содержат ингредиенты Li2SO4, Na2MoO4, Na2WO4, Na2SO4, K2MoO4, K2WO4 с полиморфными превращениями, а их эффекты не учтены. Разработка теплоаккумулирующих составов с участием солей с полиморфными превращениями позволит аккумулировать тепловую энергию и в твердой, и в жидкой фазах.
Результаты экспериментальных исследований и информация по элементам огранения использованы для выявления нон- и моновариантных фазовых реакций (таблица) и построения пространственной модели фазового комплекса системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{ - {\text{2}}}}$ (рис. 3) в программе КОМПАС-3D [24].
Фазовые реакции для элементов ликвидуса системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$
| Элемент диаграммы | Равновесное состояние | Фазовая реакция |
|---|---|---|
| Поверхности: | ||
| Na2CrO4-е1–М-е2–Na2CrO4 | Дивариантное | Жидкость ⇄ ß-Na2CrO4 |
| NaBr-е2–М-е1–NaCl–m–NaBr | Дивариантное | Жидкость ⇄ NaClxBr1 – x |
| Линии: | ||
| е1–М | Моновариантное | Жидкость ⇄ ß-Na2CrO4 + NaClxBr1 – x |
| е2–М | Моновариантное | Жидкость ⇄ ß-Na2CrO4 + NaClxBr1 – x |
| Точка минимума М | Нонвариантное | Жидкость ⇄ ß-Na2CrO4 + NaClxBr1 – x |
3D-модель отражает весь фазовый комплекс системы целиком в концентрационно-температурных координатах так же полно, как и плоские Т–х-диаграммы двухкомпонентных систем, кроме этого, позволяет прогнозировать изотермические и политермические сечения системы, выявлять качественный и количественный фазовый состав для любой заданной фигуративной точки (по составу и температуре фазового равновесия) в условиях фазового равновесия.
ЗАКЛЮЧЕНИЕ
Исследованием ДТА серии образцов, расположенных на двух политермических сечениях, получена информация о фазовых превращениях в системе Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}.$ С помощью ДСК установлено, что выявленный состав обладает повышенной способностью к аккумулированию тепловой энергии за счет полиморфизма хромата натрия и составляет суммарно 135.5 Дж/г, таким образом, теплота фазового превращения в твердой фазе повышает более чем на 30% способность запасать и высвобождать тепловую энергию.
Выявленные моно- и нонвариантные фазовые реакции, 3D-модель фазового комплекса позволяют рассчитывать составы равновесных фаз, выбирать политермические, изотермические сечения и изотермы поверхности ликвидуса системы Na+||Cl–, Br–, ${\text{CrO}}_{{\text{4}}}^{{{\text{2}} - }}$ в заданном температурном интервале. Компьютерная 3D-модель является эффективным подспорьем при прогнозировании фазового комплекса, теоретического и экспериментального исследования фазовых равновесных состояний многокомпонентных систем.
Список литературы
Вердиева З.Н., Алхасов А.Б., Вердиев Н.Н., Рабаданов Г.А., Искендеров Э.Г., Арбуханова П.А. Фазовые равновесия в системе (LiF)2–Li2CO3–Li2SO4 // Изв. вузов. Химия и хим. технология. 2019. Т. 62. № 1. С. 20.
Козырева М.С. Физико-химический анализ системы Li, Na, K, Cs||F, Cl. Автореф. дис. … канд. хим. наук. Саратов: Сарат. нац. иссл. гос. ун-т им. Н.Г. Чернышевского, 2018. 22 с.
Колесников И.М. Катализ и производство катализаторов. М.: Техника, 2004. 400 с.
Степанов В.П. Плотность и адиабатическая сжимаемость смесей LiF + KBr в двухфазной области // ТВТ. 2019. Т. 57. № 3. С. 371.
Трифонов К.И., Александров И.А., Ларионов А.С., Трифонов И.И. Солевые расплавы в технологии производства стрелково-пушечного вооружения // Оборонная техника. 2015. № 1–2. С. 90.
Игнатьев В.В., Фейнберг О.С., Загнитько А.В., Мерзляков А.В., Суренков А.И., Панов А.В., Субботин В.Г., Афоничкин В.К., Хохлов В.А., Кормилицын М.В. Жидкосолевые реакторы: новые возможности, проблемы и решения // Атомная энергия. 2012. Т. 112. № 3. С. 135.
Дементьев Б.А. Кинетика и регулирование ядерных реакторов. М.: Энергоатомиздат, 1986. 272 с.
Бабаев Б.Д. Высокотемпературные фазопереходные теплоаккумулирующие материалы на основе системы Li, Na, Ca, Ba||F, MoO4 и их свойства // ТВТ. 2014. Т. 52. № 4. С. 568.
Zhou D., Eames P. Thermal Characterisation of Binary Sodium/Lithium Nitrate Salts for Latent Heat Storage at Medium Temperatures // Sol. Energy Mater. Sol. Cells. 2016. V. 157. P. 1019.
Космынин А.С., Трунин А.С. Оптимизация экспериментального исследования гетерогенных многокомпонентных систем. Самара: Сам. ГТУ, 2007. Т. 14. 160 с.
Вердиева З.Н., Бурчаков А.В., Вердиев Н.Н., Алхасов А.Б., Магомедбеков У.Г. Моделирование фазовых реакций в многокомпонентных системах // Вестн. ТвГУ. Сер. Химия. 2019. № 3(37). С. 31.
Бурчаков А.В., Егорова Е.М., Кондратюк И.М., Мощенский Ю.В. Фазовые равновесия в системе LiF–KI–KF–K2CrO4 // Журн. неорган. химии. 2018. Т. 63. № 7. С. 909.
База данных. Термические константы веществ. Ин-т теплофизики экстремальных состояний РАН Объединенного ин-та высоких температур РАН. Химический факультет МГУ им. М.В. Ломоносова. http://www.chem.msu.ru/cgi-bin/tkv.pl. show=welcome. html
Быковская А.С., Светлов Д.В. Химические реактивы и высокочистые химические вещества: каталог. 4-е изд., перераб. М.: Росхимреактив, 2005. 576 с.
Уэндландт У. Термические методы анализа. Пер. с англ. / Под ред. Степанова В.А., Берштейна В.А. М.: Мир, 1978. 526 с.
Егунов В.П. Введение в термический анализ. Самара: СамВен, 1996. 270 с.
Гаркушин И.К., Кондратюк И.М., Егорцев Г.Е., Истомова М.А. Теоретические и экспериментальные методы исследования многокомпонентных систем. Самара: Сам. ГТУ, 2012. 125 с.
Посыпайко В.И., Алексеева Е.А., Васина Н.А. Диаграммы плавкости солевых систем. Ч. III. Двойные системы с общим катионом. М.: Металлургия, 1979. 204 с.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И., Верещетина И.П. Справочник по плавкости систем из безводных неорганических солей. Двойные системы. Т. 1. М.–Л.: Изд-во АН СССР, 1961. 845 с.
Топшиноева З.Н., Бухалова Д.Г. Система NaBr–Na2CrO4 // Журн. неорган. химии. 1975. Т. 20. № 4. С. 615.
Кочкаров Ж.А., Локьяева С.М. Четырехкомпонентная взаимная система Na, K||CO3, MoO4, WO4 // Журн. неорган. химии. 2004. Т. 49. № 11. С. 1890.
Вердиева З.Н., Алхасов А.Б., Мусаева П.А., Вердиев Н.Н. Теплоаккумулирующий материал. Патент РФ на изобретение № 2 703 220. Кл. МПК-C09K 5/06. 15.10.2019.
Омарова С.М., Вердиева З.Н., Алхасов А.Б., Магомедбеков У.Г., Арбуханова П.А., Вердиев Н.Н. Фазовые равновесия в системе (LiF)2–(NaCl)2–Na3FSO4 // Изв. вузов. Химия и хим. технология. 2017. Т. 60. № 10. С. 4.
Ганин Н.Б. Трехмерное проектирование в КОМПАС-3D. Сер. Проектирование. М.: Изд-во ДМК-Пресс, 2012. 784 с.
Дополнительные материалы отсутствуют.
Инструменты
Теплофизика высоких температур