Теоретические основы химической технологии, 2019, T. 53, № 5, стр. 595-600
Теоретические основы технологии получения карбоната лития аммиачным способом
А. Д. Рябцев 1, *, Н. П. Коцупало 1, А. А. Кураков 1, Л. Т. Менжерес 1, В. И. Титаренко 1
1 ООО “Экостар-Наутех”
Новосибирск, Россия
* E-mail: nautech@mail.ru
Поступила в редакцию 28.05.2018
После доработки 08.02.2019
Принята к публикации 22.02.2019
Аннотация
Разработаны теоретические основы технологии получения карбоната лития батарейного качества аммиачным способом. В основу технологии положено осаждение карбоната лития из водного раствора хлорида лития путем его прямого контакта с газовой смесью NH3 и CO2, взятых в соотношении 2 : 1 с последующим воспроизводством NH3 путем разложения гидроксидом кальция хлорида аммония, являющегося побочным продуктом взаимодействия в системе LiCl−NH3–CO2−H2O. Показана применимость аммиачного способа для получения Li2CO3 батарейного качества из сульфатных, нитратных и смешанных литиевых растворов.
ВВЕДЕНИЕ
Начало XXI века ознаменовалось бурным производством лития и его соединений [1–3]. Существенно изменилась и структура потребления литиевых продуктов. Потребление лития и его соединений за последние 2 десятилетия увеличилось в 4 раза, в основном, за счет новых бурно развивающихся отраслей производства. В их числе – производство химических источников тока, алюмолитиевых сплавов, термоэластополимеров и др. В свою очередь, как следует из литературы, возросла потребность в чистых и особо чистых литиевых реагентах (Li2CO3 и LiOH ⋅ H2O), используемых для получения катодных масс в производстве литийионных и литийполиионных аккумуляторов, являющихся наиболее энергоемкими среди перезаряжаемых электрохимических систем [4].
Возрастающая потребность в литиевых реагентах неизбежно приводит к усилению конкуренции среди производителей литиевой продукции. Ведущее место в номенклатуре выпускаемых литиевых продуктов в настоящее время занимает карбонат лития, и его доля в литиевом производстве в ближайшей перспективе будет только возрастать [5]. Отсюда разработка технологических процессов, направленных на снижение себестоимости производства карбоната лития при одновременном повышении его чистоты, становится крайне актуальной.
Традиционное получение карбоната лития осуществляется осаждением Li2CO3 содой из продуктивных водных растворов хорошо растворимых солей лития (LiCl или Li2SO4), произведенных из различных сырьевых источников лития [6]. Высокая концентрация натрия в маточных растворах операций содового осаждения карбоната лития неизбежно приводит к тому, что производимый продукт характеризуется повышенным уровнем содержания натрия и по этому показателю не соответствует Li2CO3 батарейного качества. Полученный таким способом карбонат лития даже после отмывки от маточного раствора содержит остаточное количество хлорида натрия на уровне ~0.04 мас. %, вследствие чего мировой выпуск основного количества этого продукта ограничивается сортом “технический”. Для получения высокочистого Li2CO3 с низким остаточным содержанием Na+ (~0.0002 мас. %) карбонат лития очищают, переводя в более растворимый бикарбонат лития, который затем при нагревании разлагают с получением Li2CO3 с минимальным содержанием Na+. Таким образом, для получения высокочистого карбоната лития в технологическую схему вводится дополнительный довольно трудоемкий технологический передел, связанный с карбонизацией и декарбонизацией литийсодержащих растворов.
Кроме того, анализ структуры себестоимости действующих литиевых производств [7, табл. 32, 33 ] показывает, что ввиду достаточно высокой рыночной стоимости цены на соду (25–30 руб./кг) затраты на реагентную соду в себестоимости товарного Li2CO3 составляют 33 и 9% на предприятиях, использующих соответственно гидроминеральное и твердорудное сырье.
Таким образом, целью настоящей работы является поиск новых осадителей карбоната лития из продуктивных литиевых растворов, исключающих повышенное содержание примесей в виде щелочных элементов, с одной стороны, и имеющих более низкую цену, чем сода, с другой стороны.
РЕШЕНИЕ ПОСТАВЛЕННОЙ ЗАДАЧИ
Проблема получения карбоната лития, практически не содержащего примеси щелочных элементов, решается путем использования в качестве осадителя углеаммонийной соли (смесь солей NH4HCO3 и (NH4)2CO3) [8, 9].
Процесс осаждения Li2CO3 с использованием углеаммонийной соли осуществляется в соответствии со следующими уравнениями химических реакций:
(1)
$\begin{gathered} {\text{2LiCl}} + 2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{HC}}{{{\text{O}}}_{3}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{3 \downarrow }}} + \\ + \,\,2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{Cl}} + {\text{CO}}_{2}^{ \uparrow } + {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
$2{\text{LiCl}} + {{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} \to {\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{3 \downarrow }}} + 2{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{Cl}}.$Авторами данного способа получения Li2CO3 изучено взаимодействие в системе LiCl− NH4HCO3−H2O, подтверждена возможность получения карбоната лития, практически не содержащего натрий, и оптимизированы условия и параметры ведения данного процесса [8, 9]. При этом высушенный продукт также практически не содержит примеси хлорида аммония, который ввиду своей низкой термоустойчивости разлагается на операции термической сушки Li2CO3 по реакции, описываемой уравнением
(3)
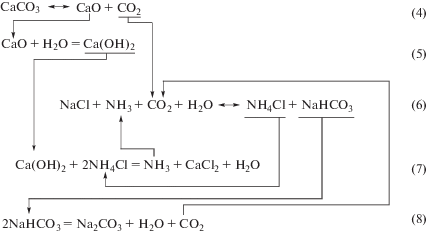
${\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{l}}}_{{\left( {\text{т}} \right)}}} \to {\text{N}}{{{\text{H}}}_{{3\left( {\text{г}} \right)}}} + {\text{HC}}{{{\text{l}}}_{{\left( {\text{г}} \right)}}}.$Однако, несмотря на получение более чистого продукта, использование углеаммонийной соли в качестве осадителя Li2CO3 не решает проблему снижения себестоимости, так как, во-первых, расход и цена углеаммонийной соли соизмеримы с аналогичными показателями для соды, во-вторых, процесс осаждения сопровождается образованием большого количества отходов в виде водного раствора хлорида аммония, требующего утилизации в обязательном порядке. По нашему мнению, проблему утилизации хлорида аммония, образующегося при углеаммонийном осаждении Li2CO3, можно решить по принципу, составляющему основу промышленного производства соды по методу Сольве [10], химическая схема которого представлена на рис. 1.
Представленная схема свидетельствует о возможности применения аммиачного способа Сольве к получению Li2CO3 из концентрированного раствора хлорида лития. Кроме того, преимущество взаимодействия в системе LiCl−NH3–CO2−H2O заключается в более высоком показателе выхода конечного продукта перед взаимодействием в системе NaCl−NH3–CO2−H2O, потому что в системе LiCl−NH3–CO2−H2O образуется продукт с более низкой растворимостью (растворимость Li2CO3 при 20°С составляет 13.3 г/дм3 [11]), чем бикарбонат натрия, растворимость которого составляет 96 г/дм3. Вследствие высокой растворимости NaHCO3 степень использования NaCl в методе Сольве составляет всего 70–75% [10].
Для осуществления основной реакции (6) содового производства раствор хлорида натрия насыщают аммиаком и диоксидом углерода при сравнительно низкой температуре, что обеспечивает достаточно высокий выход твердой фазы наименее растворимого продукта взаимодействия − бикарбоната натрия, превращаемого далее в карбонат натрия термическим разложением (реакция (8)).
Регенерацию аммиака из маточного раствора процесса осаждения, содержащего хлорид аммония, осуществляют обработкой маточного раствора гидроксидом кальция по реакции (7). Источником СO2 и Ca(OH)2 являются продукты операций обжига известняка (реакция (4)) и гашения (реакция (5)), образующегося при обжиге CaCO3 оксида кальция (негашеный известняк).
Предлагаемая авторами химическая схема производства карбоната лития аммиачным способом из продуктивного раствора LiCl, разработанная в соответствии с принципом, составляющим основу производства соды по методу Сольве, представлена на рис. 2.
Рис. 2.
Химическая схема технологии получения карбоната лития карбонизацией раствора хлорида лития в присутствии аммиака.
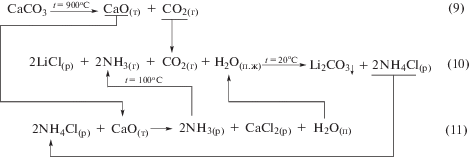
Как следует из схемы на рис. 2, технологический процесс получения карбоната лития по данной схеме является аналогом процесса получения кальцинированного карбоната натрия. При этом технология производства Li2CO3 даже упрощается, поскольку в результате основной реакции (10) в осадок выпадает непосредственно Li2CO3, как значительно менее растворимое соединение из всех соединений, образующихся при взаимодействии в системе LiCl−NH3−CO2−H2O.
Основным расходным реагентом в этом случае является известняк, себестоимость переработки которого на CaO и CO2 находится в пределах 2.5–7.5 руб./кг, что существенно ниже себестоимости производимой соды. Доступность известняка, как правило, достаточно высокая, поскольку месторождения известняка или доломита имеются практически в каждом регионе, что минимизирует транспортные расходы.
Единственным отходом производства Li2CO3 аммиачным способом является раствор хлорида кальция, который может быть использован для десульфатизации смешанных хлоридно-сульфатных литиеносных рассолов, являющихся исходным сырьевым гидроминеральным источником литиевых производств, а также в коммунальном хозяйстве в качестве противогололедного реагента в холодный период года и материала для укрепления грунтовых дорог, снижающего пыление в теплый период. Кроме того, раствор СаС12 может быть использован для заводнения нефтяных пластов в случае извлечения лития из попутных вод нефтяных месторождений или переработан на карбонат кальция.
В работе [8] показано, что максимально возможная степень осаждения карбоната лития углеаммонийной солью не превышает 80% вследствие высокой растворимости его в растворе NH4Cl [12], но предлагаемое нами решение позволяет исключить потери лития за счет возможности проведения глубокого высаливания NH4Cl при упаривании маточного раствора операции осаждения карбоната лития с последующим возвратом обогащенного LiCl упаренного раствора на операцию осаждения Li2CO3.
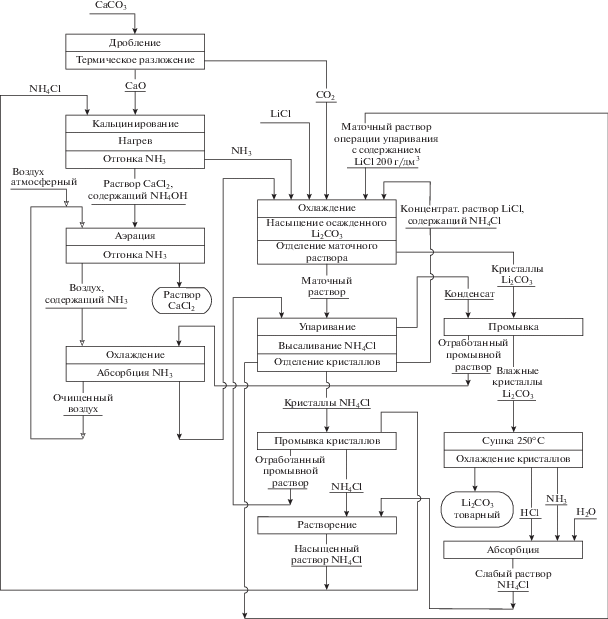
Изложенное выше позволило авторам предложить для практической реализации [13] технологическую схему производства аммонийным способом карбоната лития батарейного качества из продуктивного раствора хлорида лития, представленную на рис. 3.
Согласно предложенной схеме операцию насыщения продуктивного раствора LiCl газовой смесью аммиака и диоксида углерода (реакция (10)) проводят при комнатной температуре в противотоке контактирующих фаз при полном соотношении NH3 : CO2 = 2 : 1, раствор хлорида аммония, содержащий LiCl и NH4HCO3 в качестве примеси, отделяют от твердой фазы Li2CO3. Карбонат лития отмывают от остатка маточного раствора деминерализованной водой (конденсат сокового пара). Маточный раствор операции осаждения Li2CO3 упаривают, высаливая NH4Cl и возвращая литийсодержащий упаренный раствор на операцию осаждения Li2CO3. Кристаллы NH4Cl промывают насыщенным раствором NH4Cl для удаления LiCl, содержащегося в кристаллах в виде остатка маточного раствора операции упаривания. Промытые кристаллы NH4Cl растворяют, получая насыщенный водный раствор NH4Cl, малую часть которого используют для промывки кристаллов NH4Cl от остатка LiCl, а основную часть направляют на операцию дистилляции и отгонки NH3 (реакция (11)).
Раствор CaCl2 c остатками NH4OH аэрируют потоком воздуха, отгоняя остаточный аммиак, и выводят из процесса как побочный продукт производства. Воздушный поток, содержащий аммиак, очищают от последнего абсорбцией. В качестве абсорбента используют отработанный промывной раствор операции промывки кристаллов Li2CO3 от маточного раствора операции осаждения. Для растворения NH4Cl и получения его насыщенного раствора используют водный раствор NH4Cl, полученный водной абсорбцией газообразных продуктов разложения NH4Cl (NH3 и HCl), образующихся при сушке Li2CO3.
Предлагаемая схема получения Li2CO3 имеет замкнутый цикл, исключающий образование жидких и газообразных отходов. Побочный продукт производства – CaCl2 может быть реализован на рынке не только в виде концентрированного водного раствора, но и в виде кристаллогидрата CaCl2 ∙ 6Н2О, полученного упариванием раствора CaCl2.
Поскольку аппаратурное оформление предложенного способа получения Li2CO3 может являться практически полным аналогом аппаратурного оформления содового производства, разработка промышленной аммиачной технологии производства карбоната лития сводится к оптимизации параметров технологических операций в составе предлагаемой авторами технологической схемы.
На рис. 4 и 5 представлены также химические схемы технологических процессов производства карбоната лития из растворов других хорошо растворимых солей лития.
Рис. 4.
Химическая схема технологии получения карбоната лития карбонизацией раствора сульфата лития в присутствии аммиака.
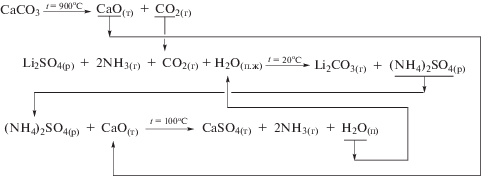
Рис. 5.
Химическая схема технологии получения карбоната лития карбонизацией раствора нитрата лития в присутствии аммиака.
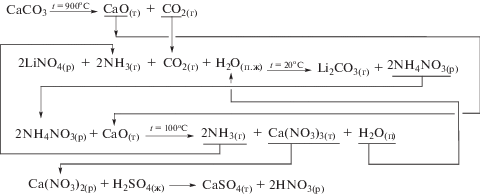
Представленные схемы позволяют сделать однозначный вывод о возможности организации производств карбоната лития батарейного качества не только из хлоридного литиевого раствора, но и из сульфатных и нитратных литиевых растворов, а также из смешанных растворов в различных их комбинациях. Отходом предлагаемых производств является твердофазное вещество – гипс, а в случае использования в качестве исходного литиевого сырья раствора LiNO3, в качестве побочного продукта возможно получение раствора азотной кислоты.
ЗАКЛЮЧЕНИЕ
Снижение себестоимости производства карбоната лития при одновременном повышении его качества достигается за счет исключения из технологического процесса дорогостоящего реагента – соды, затраты на который в себестоимости производства Li2CO3 из гидроминерального сырья составляют 30%, и замены соды на менее дорогостоящий и более доступный реагент – известняк.
На основе использования CaCO3 разработаны теоретические основы аммиачной технологии производства карбоната лития из продуктивного раствора LiCl, исключающей наличие в его составе примеси натрия, и предложена технологическая схема реализации данной разработки на практике, в свою очередь, исключающая потери лития.
Показана принципиальная возможность получения карбоната лития аммиачным способом из продуктивных растворов Li2SO4, LiNO3 или из смешанных литиевых растворов.
Список литературы
Анализ конъюнктуры мирового рынка лития и его соединений на начало ХХI в. Отчет по проекту “Литий России”, гл. 2. Координаторы проекта: Ляхов Н.З., Владимиров А.Г. Новосибирск, 2008.
Кудрявцев П.Г. Литий: мировые запасы и перспективы применения // Альтернативная энергетика и экология. 2016. № 13–14. С. 62.
Обзор рынка лития и его соединений в мире и России. 2-е изд. ООО ИГ Инфомайн, 2017.
Бурмистрова Н.А., Сычёва В.А., Чуриков А.В., Иванищева И.А. Фосфат лития и железа LiFePO4 как катодный материал литийионного аккумулятора // Электрохимическая энергетика. 2009. Т. 9. № 4. С. 188.
Global Lithium Market Outlook to 2026 [Электронный ресурс] // Market Watch. URL: www.marketwatch.com/story/the-global-lithium-market-outlook-to-2026-2026-11-15-4203139 (дата обращения: 28.04.2018).
Коцупало Н.П., Рябцев А.Д. Химия и технология получения соединений лития из литиеносного гидроминерального сырья. Новосибирск: ГЕО, 2008.
Маркетинговые исследования по проекту “Организация производства по получению карбоната лития попутной продукции из природного рассола [Электронный ресурс] // Отчет MOST marketing. Бизнес центр "Cabba”, Москва, 2010. URL: http://www.m-marketing.ru (дата обращения: 28.04.2018).
Ryabtsev A.D., Menzheres L.T., Kurakov A.A., Gushchina E.P. Interaction of Ammonium Bicarbonate with Lithium Chloride Solutions // Theor. Found. Chem. Eng. 2006. V. 40. № 6. P. 649. [Рябцев А.Д., Менжерес Л.Т., Кураков А.А., Гущина Е.П. О взаимодействии бикарбоната аммония с растворами хлорида лития // Теорет. основы хим. технологии. 2006. Т. 40. № 6. С. 690.]
Рябцев А.Д., Титаренко В.И., Коцупало Н.П. и др. Способ получения ультрачистого карбоната лития и установка для его осуществления. Пат. 2544806 РФ. 2015.
Плющев В.Е., Степин Б.Д. Химия и технология соединений лития, рубидия, цезия. М.: Химия, 1970.
Зайцев И.Д., Ткач Г.А., Стоев И.Д. Производство соды. М.: Химия, 1986.
Экспериментальные данные по растворимости многокомпонентных водно-солевых систем: справочник. В 2-х томах, 4-х книгах. 3-е изд., перераб. и доп. СПб.: ХИМИЗДАТ, 2003.
Рябцев А.Д., Титаренко В.И., Коцупало Н.П. и др. Кальцинатный способ получения карбоната лития из литиеносного сырья. Пат. 2560359 РФ. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии