Теоретические основы химической технологии, 2019, T. 53, № 5, стр. 493-499
Кондиционирование тяжелокислородной воды методом ректификации под вакуумом
Э. П. Магомедбеков 1, *, И. Л. Селиваненко 1, Н. Н. Кулов 1, 2, Г. В. Веретенникова 1
1 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: eldar@muctr.ru
Поступила в редакцию 20.05.2019
После доработки 27.05.2019
Принята к публикации 27.05.2019
Аннотация
Проведены исследования процесса ректификации тяжелокислородной воды под вакуумом. Определены условия и параметры работы ректификационных колонн для кондиционирования тяжелокислородной воды.
ВВЕДЕНИЕ
В производстве изотопов кислорода метод ректификации является основным. С точки зрения исторической хронологии первое промышленное производство высокообогащенного тяжелого изотопа кислорода-18 было основано именно на ректификации воды [1]. В России в ЗАО “Глобальные научные технологии” в г. Сосновый бор (Ленинградская область) было создано и пущено производство тяжелокислородной воды методом ректификации воды под вакуумом в 1997 г. [2]. Установка включала в себя два разделительных каскада с расчетной производительностью 9 кг/год изотопа 18О с концентрацией 92–95 ат. % и 1.5 кг/год с концентрацией 36 ат. %. Бурный рост позитронно-эмиссионной томографии (ПЭТ) с использованием в качестве радиационного фармацевтического препарата 2-[18F]-2-фтор-2-дезокси-D-глюкозы [3] требует на проведение одной ПЭТ-процедуры 0.5 г Н218О, обогащенной до 89–90% для получения 18F по реакции 18О(p, n)18F. По прогнозам, приведенным в работе [4], мировая потребность в Н218О составляет около 2000 кг в год, рост потребления до 2026 г. составит 5–7% в год. В этих условиях будет расти спрос и дефицит тяжелокислородной воды. Поэтому актуальной становится задача переработки тяжелокислородных отходов ПЭТ-центров, доведение концентрации 18О до приемлемого значения с целью повторного использования тяжелокислородной воды. Таким образом, целью настоящей работы было определение оптимальных условий процесса ректификации воды под вакуумом для получения кондиционной тяжелокислородной воды.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
В настоящей работе в качестве “выгоревшей” тяжелокислородной воды была выбрана модельная система с концентрацией 70 ат. % 18О. Концентрирование кислорода 18О проводили методом периодической ректификации под вакуумом.
На рис. 1 изображена схема установки ректификации воды периодического действия с верхним накопительным объемом. Сырьевая вода заливается в куб 1 объемом V1, имеющий уровнемер 2. Куб обогревается при помощи водяной паровой рубашки, работающей при атмосферном давлении.
Рис. 1.
Схема ректификационной установки: 1 – куб с паровой рубашкой; 2 – уровнемер куба; 3 – ректификационная колонна; 4 – конденсатор.
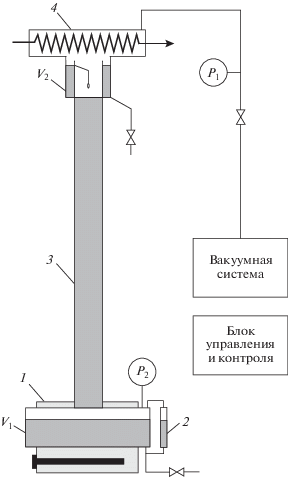
Ректификационная колонна 3 заполнена спирально-призматической насадкой (СПН). Высота слоя 6,7 м. Флегма, вытекающая из конденсатора 4, попадает в верхний накопительный объем V2 с переливом в верхней его части. Пробы воды на изотопный анализ отбирали из куба и из верхней накопительной емкости. Установка имеет вакуумную систему, позволяющую поддерживать абсолютное давление ректификации Р1 от 0.05 до 0.9 атм. Давление в кубе Р2 измеряли манометром. Разность между Р2 и Р1 представляет собой гидравлическое сопротивление колонны.
Изотопный анализ проб воды осуществляли масс-спектрометрически с использованием масс-спектрометра МИ-1309 по стандартной методике переводом воды в углекислый газ при помощи поташа и ортофосфорной кислоты [5].
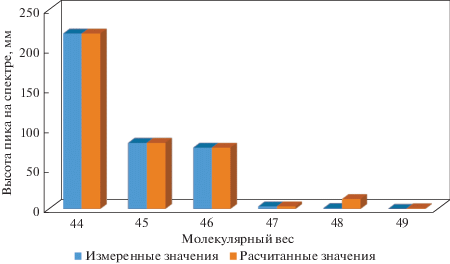
Данный метод характеризуется высокой чувствительностью и точностью (средняя относительная ошибка анализа не превышает 1%). Кроме того, для повышения точности измерения на масс-спектрометре была использована методика программной обработки полученных спектров. Для этого проводился поиск методом обобщенного приведенного градиента значений концентраций изотопов кислорода, для которых значение суммы средних квадратичных отклонений рассчитанных спектров от экспериментальных было минимальным. Пример сравнения расчетного спектра с экспериментальным представлен на рис. 2.
Для поддержания требуемой точности анализа необходимо исключить возможность попадания паров воды в систему напуска прибора. Для этого пары воды вымораживаются с применением холодильной смеси, температуру которой поддерживали в интервале 233–243 К. Применение чистого жидкого азота в данном случае не допускается, поскольку температура кипения жидкого азота (Тb = 77 К) ниже температуры замерзания углекислого газа (Тf = 195 К).
Расчет концентрации 18О проводили по следующему уравнению:
(1)
${\text{[}}{}^{{18}}{\text{O]}} = \frac{{{{I}_{{48}}} + 0.5{{I}_{{46}}}}}{{{{I}_{{48}}} + {{I}_{{46}}} + 0.5{{I}_{{44}}}}},$В связи с тем, что вода является непригодной для анализа на масс- спектрометре, ее переводили в удобную для анализа форму – углекислый газ.
Во избежание изотопного разбавления полученной пробы углекислым газом воздуха подготовку пробы осуществляли под вакуумом в специальной установке, схема которой приведена на рис. 3.
Рис. 3.
Лабораторная установка для подготовки проб к анализу: 1, 2 – колбы, содержащие реагенты; 3 – ловушка; 4 – сосуд Дьюара с жидким азотом; 5 – шлиф, посредством которого установка присоединяется к масс-спектрометру; 6 – вентиль соединения установки с системой напуска.
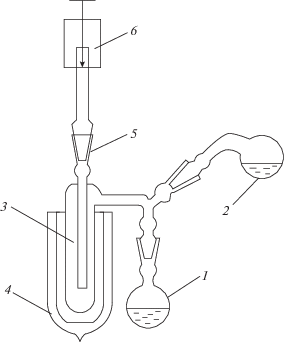
Установка состоит из двух колб 1, 2 и ловушки для вымораживания воды 3. Перед использованием детали установки тщательно очищали от смазки, отмывали и высушивали.
Перевод пробы проводился карбонатным методом, для чего осуществляли реакцию изотопного обмена между карбонатом калия и водой с последующим разложением карбоната с образованием углекислого газа:
(2)
${{{\text{K}}}_{{\text{2}}}}{{{\text{C}}}^{{{\text{16}}}}}{{{\text{O}}}_{3}} + {\text{H}}_{2}^{{18}}{\text{O }} = {\text{ }}{{{\text{K}}}_{{\text{2}}}}{{{\text{C}}}^{{{\text{16}}}}}{\text{O}}_{2}^{{18}}{\text{O}} + {\text{H}}_{2}^{{16}}{\text{O,}}$(3)
$~3{{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} + 2{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{4}} = 2{{{\text{K}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} + 3{\text{C}}{{{\text{O}}}_{{\text{2}}}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Сухой карбонат калия природного изотопного состава в количестве 50 мг растворяли в 1 мл анализируемой воды. Пробирку с раствором закрывали пробкой и выдерживали в кипящей воде в течение 20 мин. Согласно литературным данным изотопное равновесие в реакции (2) при температуре 373 К устанавливается за 10 мин. Далее раствор охлаждают, помещают его в колбу 1 (рис. 3) и приливают к нему ортофосфорную кислоту из колбы 2. Полученный по реакции (3) углекислый газ анализируют на масс-спектрометре. Расчет концентрации 18О в углекислом газе проводили по уравнению (1). Концентрацию 18О в исходной воде рассчитывали по формуле
где с – концентрация 18О в анализируемой пробе воды, %; $c_{k}^{'}$ – измеренная концентрация 18О в углекислом газе, a – количество кислорода в карбонате, b – количество кислорода в воде, 0.99 – коэффициент, равный отношению равновесных концентраций 18О в воде и карбонате в реакции изотопного обмена (2).РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эксперименты по разделению изотопов кислорода 16О–18О были проведены с использованием описанной выше установки (рис. 1) на двух ректификационных колоннах № 1 и 2 периодического действия, отличающихся диаметром и размером элемента СПН.
Характеристики колонн приведены в табл. 1.
Таблица 1.
Характеристики ректификационных колонн
| Параметр | Колонна № 1 | Колонна № 2 |
|---|---|---|
| Внутренний диаметр, мм | 35 | 50 |
| Высота слоя, м | 6.7 | 6.7 |
| Насадка | СПН 1.5 × 1.5 × 0.2 | СПН 3 × 3 × 0.2 |
| Полный объем куба, л | 9 | 9 |
| Объем воды в кубе, л | 2 | 4 |
| Объем верхней накопительной емкости, л | 0.25 | 0.5 |
Колонна № 1 была заполнена мелкой высокоэффективной насадкой СПН 1.5 × 1.5 × 0.2 мм, имеющей по литературным данным высоту эквивалентной теоретической ступени (ВЭТС) 1.2–1.3 см [1]. Однако пропускная способность насадки мала. Кроме того, данная насадка имеет высокую задержку и гидравлическое сопротивление, которое обуславливает более высокое давление и температуру в кубе и, следовательно, более низкий средний коэффициент разделения в колонне.
Колонна № 2 была заполнена более крупной насадкой СПН 3 × 3 × 0.2 мм. По литературным данным ВЭТС для нее составляет 2.0–2.2 см при относительной нагрузке 0.8 от предельной [1]. Однако при работе с более низкой удельной нагрузкой (0.3–0.6 от предельной) ВЭТС уменьшается. При этом снижается также гидравлическое сопротивление слоя насадки и температура в кубе. Таким образом, средний коэффициент разделения в колонне увеличивается.
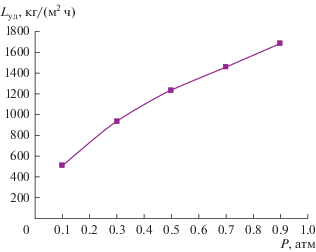
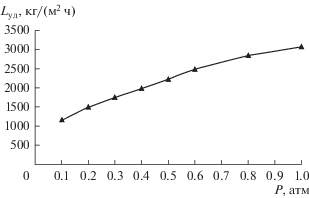
Для определения предельной нагрузки (пропускной способности) были получены зависимости удельного гидравлического сопротивления слоя насадки от удельной нагрузки при различных рабочих давлениях. Эти зависимости приведены на рис. 4 и 5.
Рис. 4.
Зависимость удельного гидравлического сопротивления СПН 1.5 × 1.5 × 0.2 от удельной нагрузки при рабочих давлениях 0.1 (1), 0.3 (2), 0.5 (3), 0.7 (4), 0.9 (5) атм.
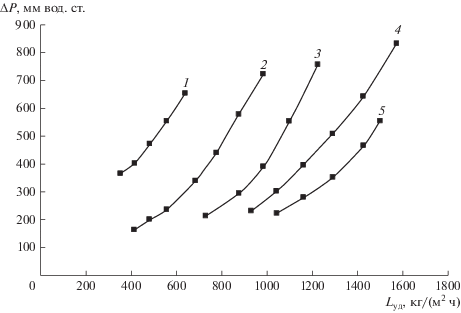
Рис. 5.
Зависимость удельного гидравлического сопротивления СПН 3 × 3 × 0.2 от удельной нагрузки при рабочих давлениях 0.1 (1), 0.2 (2), 0.3 (3), 0.4 (4), 0.5 (5), 0.6 (6), 0.8 (7), 1.0 (8) атм.
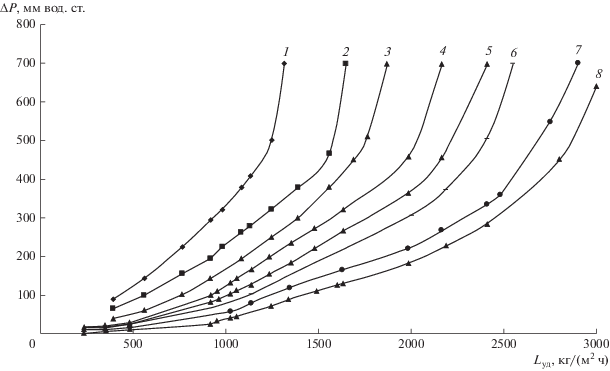
На основании полученных данных были определены зависимости пропускной способности насадок СПН 1.5 × 1.5 × 0.2 и СПН 3 × 3 × 0.2 от давления (рис. 6 и 7).
Таким образом, были определены пропускные способности СПН 1.5 × 1.5 × 0.2 и СПН 3 × 3 × 0.2 при рабочем давлении 0.15 атм. Они составили 620 и 1350 кг/(м2 ч).
В качастве рабочего давления для проведения ректификации воды было выбрано значение 0.15 атм. При этом давлении коэффициент разделения изотопов кислорода составляет 1.0064 при заметной пропускной способности. При давлении 0.15 атм в колонне № 1 поток по колонне установили равным 0.5 кг/ч (0.8 от предельного) и в колонне № 2 – 1.65 кг/ч (0.6 от предельного)
При этих нагрузках были проведены эксперименты по достижению стационарного состояния колонн № 1 и 2. В качестве разделяемой смеси была использована вода, обогащенная по 18О до 70 ат. %
Результаты экспериментов приведены в табл. 2.
Таблица 2.
Результаты экспериментов по достижению стационарного состояния колонн № 1 и 2 при разделении изотопов кислорода
| Параметр | Колонна № 1 | Колонна № 2 |
|---|---|---|
| Мощность нагрева, кВт | 0.35 | 1.1 |
| Поток по колонне, кг/ч | 0.5 | 1.65 |
| Удельная нагрузка, кг/(м2 ч) | 500 | 700 |
| Задержка жидкости, % | 16 | 7.5 |
| Задержка жидкости, л | 1.03 | 0.98 |
| Давление в голове колонны, атм | 0.15 | 0.15 |
| Температура в голове колонны, °C | 54 | 54 |
| α в голове колонны | 1.0064 | 1.0064 |
| Давление в кубе колонны, атм | 0.30 | 0.25 |
| Температура в кубе колонны, °C | 68.5 | 64.6 |
| α в кубе колонны | 1.0056 | 1.0058 |
| Гидравлическое сопротивление, атм | 0.15 | 0.1 |
| α среднее | 1.0060 | 1.0061 |
| Концентрация 18О в кубе колонны (в V1) | 90 | 91 |
| Концентрация 18О в голове колонны (в V2) | 29 | 22.95 |
| k | 22.0 | 33.9 |
| Число теоретических ступеней разделения | 517 | 579 |
| ВЭТС, см | 1.3 | 1.2 |
Видно, что на более крупной насадке 3 × 3 × × 0.2 мм достигается более низкое значение ВЭТС и, соответственно, более высокая степень разделения благодаря работе при уменьшенной удельной нагрузке. При этом величина задержки в колонне существенно меньше, чем для насадки 1.5 × 1.5 × 0.2, что очень важно при разделении изотопов кислорода при высоких концентрациях. Время выхода колонн в стационарное состояние определяется объемами куба и верхней накопительной емкости, потоком рабочего вещества по колонне и задержкой жидкости на насадке.
Кривые изменения концентрации 18О в верхних накопительных емкостях и в кубах колонн № 1 и 2 изображены на рис. 8.
Рис. 8.
Кривые изменения концентрации кислорода-18 в верхних накопительных емкостях и в кубах колонн № 1 и 2: 1, 2 – концентрации кислорода-18 в кубах колонн № 1 и 2; 3, 4 – концентрации кислорода-18 в верхних накопительных емкостях колонн № 1 и 2.
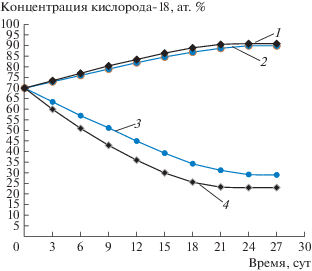
Как видно из рисунка, стационарное состояние достигается в первой колонне через 27 суток, во второй – через 24 суток.
Ввиду высокой эффективности колонн практически весь дейтерий, присутствующий с природной концентрацией в сырьевой воде, остается в кубе колонны. Соответственно, его концентрация в продукте несколько увеличивается по сравнению с исходной от 142 до 160–165 млн–1. Анализ на дейтерий проводили на спектральном жидкостном изотопном анализаторе T-LWIA-45-EP по методике, описанной нами ранее в [6].
ЗАКЛЮЧЕНИЕ
В настоящей работе показана возможность кондиционирования тяжелокислородной воды с использованием одной сравнительно невысокой колонны без необходимости разработки и создания каскада. Кроме того, важным является приемлемое время накопления и выход колонн на стационарный режим. Это позволяет создавать установки на месте, т.е. при ПЭТ-центрах.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 18-13-00475).
ОБОЗНАЧЕНИЯ
| a | количество кислорода в карбонате |
| b | количество кислорода в воде |
| с | концентрация кислорода-18 в анализируемой пробе воды, % |
| $c_{k}^{'}$ | измеренная концентрация кислорода-18 в углекислом газе |
| I44, I46, I48 | величины ионных токов для молекул с массовыми числами 44, 46 и 48 соответственно |
| k | коэффициент усиления |
| Р1 | абсолютное давление ректификации, атм |
| Р2 | давление по манометру, атм |
| Тb | температура кипения жидкого азота, К |
| Тf | температура замерзания углекислого газа, К |
| V1 | объем куба ректификационной колонны, м3 |
| V2 | верхний накопительный объем ректификационной колонны, м3 |
| α | коэффициент разделения 18O–16O |
ИНДЕКСЫ
Список литературы
Andreev B.M., Magomedbekov E.P., Raitman A.A., Rozenkevich M.B., Sakharovsky Yu.A., Khoroshilov A.V. Separation of Isotopes of Biogenic Elements in Two-Phase Systems. Amsterdam: Elsevier, 2007.
Полевой А.С., Полянский М.Н. // Сборник докладов 2-й Всероссийской научной конференции “Физико-химические процессы при селекции атомов и молекул”. М.: ЦНИИАТОМНИНФОРМ, 1997. С. 111.
Li Z., Conti P.S. // Adv. Drug Delivery Rev. 2010. V. 62. P. 1031.
IMV Medical Information Division (2019) PET Imaging Market Summary Report 2019. https://imvinfo.com/product/pet-imaging-market-summary-report-2019. Cited 20 April 2019.
Жаворонкова К.Н., Магомедбеков Э.П., Растунова И.Л., Розенкевич М.Б., Чередниченко С.А. Физико-химические методы анализа изотопов и особо чистых веществ. Лабораторный практикум: учебное пособие. М.: РХТУ им. Д.И. Менделеева, 2015.
Magomedbekov E.P., Rastunova I.L., Selivanenko I.L., Kulov N.N. Distribution of heavy hydrogen and oxygen isotopes in water distillation // Theor. Found. Chem. Eng. 2019. V. 53. № 2. P. 151. [Магомедбеков Э.П., Растунова И.Л., Селиваненко И.Л., Кулов Н.Н. Распределение тяжелых изотопов водорода и кислорода при ректификации воды // Теор. осн. хим. технол. 2019. Т. 53. № 2. С. 123.] https://doi.org/10.1134/S0040579519020118
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии