Теоретические основы химической технологии, 2020, T. 54, № 1, стр. 75-82
Технология очистки промывной воды гальванического производства от ионов кадмия методом мембранного и безмембранного электролиза
Д. Ю. Тураев a, *, В. А. Колесников a, А. Н. Попов a
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: membr_electr@mail.ru
Поступила в редакцию 22.04.2019
После доработки 20.05.2019
Принята к публикации 27.05.2019
Аннотация
Предложена технология удаления токсичных Cd2+ из технологических электролитов и промывной воды гальванического производства, содержащих ${\text{SO}}_{4}^{{2 - }}$ или Cl–. Технология позволяет в обрабатываемых растворах снизить концентрацию Cd2+ до 0.1−0.07 г/л, уменьшить поступление Cd2+ в сточные воды предприятия в 288−366 раз и достигнуть степени извлечения Cd2+ 99.7%. Электролиз в двухкамерной ячейке с анионообменной мембраной позволяет вернуть в производство Cd и раствор H2SO4. Удаление Cd2+ из растворов, содержащих Cl–, рекомендуется проводить методом мембранного электролиза при отделении нерастворимого анода химически стойкой катионообменной мембраной для предотвращения миграции Cl– из католита в анолит и, соответственно, их окисления на нерастворимом аноде с выделением токсичного Cl2.
ВВЕДЕНИЕ
В гальваническом производстве процесс электроосаждения Cd используется для защиты стальных изделий от коррозии при их эксплуатации в морских условиях. Электроосаждение Cd проводят из хлористых электролитов, содержащих 40−50 г/л CdCl2, или сульфатных электролитов, содержащих 40−60 г/л CdSO4. Кроме соединений кадмия, хлористый электролит содержит 200−280 г/л NH4Сl, а сульфатный 140−200 г/л сульфата аммония [1]. При промывке кадмированных деталей образуется большое количество промывной воды, содержащей Cd2+. Электролиты кадмирования часто выходят из строя из-за загрязнения ионами тяжелых металлов, что приводит к их сливу в сточные воды гальванических предприятий. Наличие в составе электролитов кадмирования солей аммония затрудняет реагентную очистку промывной воды от токсичных Cd2+, ПДК которых составляет 0.01 мг/л [1], из-за образования в слабощелочной среде растворимых аммиачных комплексных соединений кадмия. Такая же ситуация происходит, если на одном и том же гальваническом предприятии используется электролит кадмирования, не содержащий ${\text{NH}}_{4}^{ + }$, и другие электролиты, содержащие ${\text{NH}}_{4}^{ + }$ и не содержащие Cd2+. Удалять из раствора одновременно Cd2+ и ${\text{NH}}_{4}^{ + }$ предложено реагентным магний-фосфатным методом, в котором остаточная концентрация Cd2+ составляет 0.73 мг/л [2]. Реагентным методом, в отсутствие веществ, образующих с Cd2+ прочные комплексные растворимые соединения, действием только раствором NaOH при рН 10−11 удалось достигнуть остаточной концентрации Cd2+ 0.001 мг/л [3]. Для удаления Cd2+ из кислых (солянокислых) растворов ионообменным методом использовали жидкую мембрану, импрегнированную Cyanex 923, разбавитель − ксилол. Несмотря на высокую степень извлечения Cd2+ (86%), требуется регенерация мембраны [4]. Аналогично из кислых хлоридных растворов Cd2+ предложено удалять путем их транспортировки через полимер, включающий мембрану с основными носителями: 4-(1'-п-тридецил)пиридин-N-оксид и три-п-октиламин [5]. При удалении Cd2+ из слабокислых сульфатных растворов ионообменным методом с использованием катионита марки КУ-2-8 определены оптимальные параметры: концентрация Cd(II) в водах 1.0 г/л при скорости их пропускания 0.7 м3/(м2 ч), регенерация ионита раствором H2SO4 100 г/л со скоростью его пропускания 0.3−0.5 м3/(м2 ч) до степени регенерации не менее 90% с получением элюатов, содержащих Cd(II) и H2SO4 в количествах не менее 3.0 и около 95.0 г/л соответственно. Обменная емкость и емкость до “проскока” Cd2+ в оптимальных условиях ведения процесса составляли 116 и 91 г/кг ионита [6]. Авторы [6] определили также оптимальные условия электроэкстракции Cd2+ из его сернокислых растворов: iк = 0.3 А/дм2 с выходом по току 44−94%, интенсивное перемешивание раствора, остаточная концентрация Cd(II) не более 1.0 г/л, температура раствора 20 ± 5°С, применение анодов и катодов с соотношением площадей 1 : 1–2 : 1. Удельные затраты электроэнергии 1.8−2.1 (кВт ч)/кг металла при межэлектродном расстоянии 2.5 см и напряжении на электролизере около 3.1 В. При удалении Cd2+ электролизом из растворов, содержащих 0.5 г/л CdSO4 в смеси с 0.5 М Na2SO4, на катоде с высокоразвитой поверхностью из стальной проволоки степень извлечения кадмия равна 30% при iк = 2.5 А/м2 и 99% при iк = 4 А/м2 [7]. Очистка промывной воды от Cd(II) и CN– электродиализом, в котором происходит концентрирование CN– и цианистых соединений кадмия, описана в [8]. Сочетая работу электродиализа, ионообменных смол и локальную блокировку графитовыми электродами приложенного электрического поля, напряжения и тока, удалось снизить концентрацию Cd2+ в промывной воде, содержащей CdSO4, с 0.05 до 0.0001 г/л [9]. Сорбция модифицированными сорбентами марок СВ-1-А2 и СВ-1-А3 ионов кадмия из растворов, содержащих 2.5 × 10–4 М (0.0281 г/л) Cd2+, приводит к получению степени очистки до 98% [10]. Для очистки промывной воды гальванического производства, содержащей низкую концентрацию Cd2+ 7.1 × 10–8 М (0.008 мг/л), предложено использовать сорбцию Cd2+ промышленным активным углем марки АГ-ОВ-1 и его модифицированным вариантом [11]. Степень извлечения Cd2+ из рудничной воды сорбентами − угольной золой и вермикулитом составляет 50−60% [12]. При использовании баромембранного метода с давлением 1−4 МПа определен коэффициент задержания, равный ∼0.95 для растворов с концентрацией Cd2+ 0.2 г/л [13].
Приведенные литературные данные демонстрируют различные методы очистки растворов, содержащих Cd2+. Промывная вода, содержащая крайне малую концентрацию Cd2+, обрабатывается сорбционными и ионообменными методами. При насыщении сорбентов токсичными Cd2+ требуется их регенерация. Реагентный метод удаления Cd2+ эффективен только в отсутствие комплексообразователей. Специально подобранные реагенты более эффективны, однако образуется большое количество осадков, содержащих токсичные соединения кадмия. Баромембранный метод требует энергозатрат на создание большого давления, необходимого для его реализации, кроме того, коэффициент задержания по Cd2+ около 0.95.
Электрохимический метод, использующий электролиз с нерастворимым анодом, для очистки промывной воды, содержащей CdSO4, способен снизить концентрацию Cd2+ до остаточной концентрации 1 г/л [6], однако эта концентрация еще относительно велика, а очищаемая вода остается загрязненной ${\text{SO}}_{4}^{{2 - }}$ и H2SO4. При очистке растворов, содержащих Cd2+ и Cl–, электрохимическим методом необходимо решить проблему предотвращения выделение Cl2 на нерастворимом аноде.
Цель данной работы – усовершенствовать электрохимический метод удаления Cd2+ из растворов, предложить и проверить технологию удаления Cd2+ из растворов электрохимическими методами: безмембранным и мембранным электролизом.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Важным фактом в технологии очистки растворов от Cd2+ методом мембранного и безмембранного электролиза является то, что перенапряжение выделения H2 на Cd велико, поэтому, даже в кислых растворах, электрохимическая реакция восстановления Cd2+ протекает преимущественнее, чем восстановление H+, несмотря на заметные различия в значениях величин стандартного электродного потенциала восстановления Cd2+, $E_{{{\text{C}}{{{\text{d}}}^{{2 + }}}{\text{/Cd}}}}^{0}$ = –0.40 В, и восстановления H+, $E_{{{{{\text{H}}}^{{\text{ + }}}}{\text{/H}}{}_{{\text{2}}}}}^{0}$ = = 0.00 В. Абсолютное значение величины разницы между этими двумя значениями величин стандартных электродных потенциалов довольно значительно и равно ΔE = 0.40 В. При электролизе с нерастворимым анодом из Pt/Ti или Pt/Nb на катоде происходит восстановление ионов Cd2+ и H+:
(1)
${\text{C}}{{{\text{d}}}^{{2 + }}} + 2{{{\text{e}}}^{ - }}~ = \,\,~{\text{Cd}},\,\,\,\,E_{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{/Cd}}}}^{0} = - 0.40\,\,{\text{B,}}$(2)
$2{{{\text{H}}}^{ + }} + 2{{{\text{e}}}^{ - }} = \,\,~{{{\text{H}}}_{2}},\,\,\,\,E_{{{{{\text{H}}}^{{\text{ + }}}}{\text{/H}}{}_{{\text{2}}}}}^{0} = 0.00\,\,{\text{B}}{\text{.}}$На нерастворимом аноде происходит процесс окисления молекул воды:
(3)
$2{{{\text{H}}}_{2}}{\text{O}} - 4{{{\text{e}}}^{ - }}~ = \,\,~4{{{\text{H}}}^{ + }} + {{{\text{O}}}_{2}}.$Суммарная реакция включает в себя сумму двух реакций:
(4)
$2{\text{CdS}}{{{\text{O}}}_{4}} + 2{{{\text{H}}}_{2}}{\text{O}} \pm 4{{{\text{e}}}^{ - }}~ = \,\,~2{\text{Cd}} + 2{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}} + {{{\text{O}}}_{2}},$(5)
$2{{{\text{H}}}_{2}}{\text{O}} \pm 4{{{\text{e}}}^{ - }}~ = ~\,\,2{{{\text{H}}}_{2}} + {{{\text{O}}}_{2}}.$Согласно реакции (4) при электролизе с нерастворимым анодом растворов, содержащих CdSO4, образуется свободная H2SO4, т.е. концентрация и активность H+ увеличивается, а значение рН уменьшается. Используя уравнение Нернста, получим зависимость равновесного электродного потенциала реакции восстановления H+ от величины рН:
(6)
${{E}_{{{\text{р,}}{{{\text{H}}}^{{\text{ + }}}}{\text{/}}{{{\text{H}}}_{{\text{2}}}}}}} = E_{{{{{\text{H}}}^{{\text{ + }}}}{\text{/}}{{{\text{H}}}_{{\text{2}}}}}}^{0} + \frac{{RT}}{{nF}}{\text{ln}}\frac{{a_{{{{{\text{H}}}^{{\text{ + }}}}}}^{{\text{2}}}}}{{{{a}_{{{{{\text{H}}}_{{\text{2}}}}}}}}} = - 0.059\,{\text{pH,}}$При рН 2 ${{E}_{{{\text{р,}}{{{\text{H}}}^{{\text{ + }}}}{\text{/}}{{{\text{H}}}_{{\text{2}}}}}}}$ = –0.118 В, а при рН 0 ${{E}_{{{\text{р,}}{{{\text{H}}}^{{\text{ + }}}}{\text{/}}{{{\text{H}}}_{{\text{2}}}}}}}$ = = 0.000 В, т.е. при увеличении аH+ на 0.99 М смещение ${{E}_{{{\text{р,}}{{{\text{H}}}^{{\text{ + }}}}{\text{/}}{{{\text{H}}}_{{\text{2}}}}}}}$составит 0.118 В.
Аналогично для Cd2+ получим следующее уравнение:
(7)
${{E}_{{{\text{р,C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{/Cd}}}}} = E_{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{/Cd}}}}^{0} + \frac{{RT}}{{nF}}{\text{ln}}\frac{{{{a}_{{{\text{C}}{{{\text{d}}}^{{{\text{2 + }}}}}}}}}}{{{{a}_{{{\text{Cd}}}}}}},$При $a_{{{\text{Cd}}}}^{{2 + }}$ = 0.01 М ${{E}_{{{\text{р,C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{/Cd}}}}}$ = –0.459 В, а при $a_{{{\text{Cd}}}}^{{2 + }}$ = 1 М ${{E}_{{{\text{р,C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{/Cd}}}}}$ = –0.40 В, т.е. при увеличении $a_{{{\text{Cd}}}}^{{2 + }}$ на 0.99 М смещение ${{E}_{{{\text{р,C}}{{{\text{d}}}^{{{\text{2 + }}}}}{\text{/Cd}}}}}$ составит 0.059 В. Следовательно, к началу электролиза с нерастворимым анодом 1 М раствора CdSO4 с рН 2 разница между значениями равновесных потенциалов составит ΔE = –0.118 – (–0.40) = 0.282 В. А к концу электролиза при $a_{{{\text{Cd}}}}^{{2 + }}$ = 0.01 М, поскольку из 1 М раствора CdSO4 получается 1 М раствор H2SO4 согласно формуле (4), то при рН = –lg2 = –0.3 составит ΔE = –0.059(–0.3) – (–0.459) = 0.476 В, т.е. разница увеличится в 0.476/0.282 = 1.69 раза. Следовательно, к концу электролиза, если не удалять накапливающуюся H2SO4, потенциал-определяющие условия восстановления Cd2+ до Cd ухудшатся. Указанные значения диапазона концентраций Cd2+ и H+ описывают большую часть встречающихся на практике составов кислых растворов, содержащих Cd2+.
Удаление H2SO4 можно осуществить реагентным методом − нейтрализуя ее NaOH или Na2CO3 по мере выделения. Однако такой способ не позволяет удалить ${\text{SO}}_{4}^{{2 - }}$, кроме того, очищаемая вода будет дополнительно загрязнена Na+.
Применение мембранного электролиза позволяет удалить ${\text{SO}}_{4}^{{2 - }}$ из обрабатываемого раствора, одновременно удаляя Cd2+. Для этого необходимо отделить катод с раствором, содержащим Cd2+ (католит), анионообменной мембраной от нерастворимого анода из Pt/Ti или Pt/Nb, погруженного в раствор H2SO4 (анолит). Анионообменная мембрана не препятствует миграции ${\text{SO}}_{4}^{{2 - }}$ из католита в анолит и препятствует в определенной степени миграции H+ из анолита в католит. Нужно отметить, что сумма всех долей токов, переносимых всеми видами ионов через анионообменную мембрану, равна 1:
где ti − кажущееся число переноса данного вида ионов (или доля тока, переносимая данным видом ионов) при его миграции через ионообменную мембрану для исследуемых растворов, определенное методом Гитторфа.В рассматриваемом случае (для сернокислых растворов)
где ${{t}_{{{\text{SO}}_{{\text{4}}}^{{2 - }}}}}$ и ${{t}_{{{\text{H}}_{{}}^{{\text{ + }}}}}}$ − значения кажущихся чисел переноса ${\text{SO}}_{4}^{{2 - }}$ и H+ соответственно.Необходимо отметить, что сумма всех катодных выходов по току реакций восстановления на катоде также равна 1:
где ${\text{В}}{{{\text{Т}}}_{{{\text{к}}i}}}$ − катодный выход потоку данной электрохимической реакции.В рассматриваемом случае на катоде
(11)
${\text{В}}{{{\text{Т}}}_{{{\text{к}}{\kern 1pt} {\text{Cd}}}}} + {\text{В}}{{{\text{Т}}}_{{{\text{к}}{\kern 1pt} {{{\text{H}}}_{{\text{2}}}}}}} = 1,$Сочетание уравнений (11) и (9) даст следующую формулу:
(12)
${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}} + {\text{В}}{{Т}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}} = {{t}_{{{\text{SO}}_{{\text{4}}}^{{2 - }}}}} + {{t}_{{{\text{H}}_{{}}^{{\text{ + }}}}}} = 1.$Величины обоих потоков ионов через анионообменную мембрану определяются не только анионообменными свойствами анионообменной мембраны, но и концентрацией соответствующих ионов. Взяв за основу, что при электролизе в католите и в анолите электронейтральность находящихся там растворов должна сохраняться, получим, что для католита будут наблюдаться следующие периоды электролиза: 1) если ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ > ${{t}_{{{\text{SO}}_{{\text{4}}}^{{2 - }}}}}$ и ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ > > ${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$, то в католите будет происходить рост концентрации H2SO4 при одновременном снижении концентрации Cd2+, 2) если ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ = ${{t}_{{{\text{SO}}_{{\text{4}}}^{{2 - }}}}}$ и ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ = = ${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$, то в католите концентрация H2SO4 достигнет максимального значения, снижение концентрации Cd2+ в католите продолжается, 3) если ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ < ${{t}_{{{\text{SO}}_{{\text{4}}}^{{2 - }}}}}$ и ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ < ${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$, то в католите будет происходить уменьшение концентрации H2SO4, снижение концентрации Cd2+ в католите продолжается, 4) если ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ = 0 и ${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$ = 1, cнижение концентрации Cd2+ в католите прекратилось, а скорость удаления ${\text{SO}}_{4}^{{2 - }}$ из католита в анолит (т.е. фактически скорость уменьшения концентрации H2SO4 в католите) будет определяться ${{t}_{{{\text{SO}}_{{\text{4}}}^{{2 - }}}}}$ и ${{t}_{{{\text{H}}_{{}}^{{\text{ + }}}}}}$, причем последняя величина будет определяться концентрацией H2SO4 в анолите.
Для растворов, содержащих Cd2+ и Cl–, использование двухкамерного мембранного электролизера с анионообменной мембраной приведет к миграции Cl– в анодное пространство и далее их миграции к нерастворимому аноду, на котором произойдет окисление Cl– до газообразного токсичного Cl2. Для предотвращения этого процесса необходимо использовать катионообменную мембрану с высокой степенью селективности (препятствования) миграции Cl–. В этом случае рН в католите будет сразу уменьшаться на протяжении практически всего электролиза (в нем будет происходить рост концентрации соляной кислоты), т.к. будет выполняться условие ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ > ${{t}_{{{\text{C}}{{{\text{I}}}^{ - }}}}}$ и ${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$ < ${{t}_{{{\text{H}}_{{}}^{{\text{ + }}}}}}$. Поскольку абсолютное значение ${{t}_{{{\text{C}}{{{\text{I}}}^{ - }}}}}$ мало (сотые−тысячные доли единицы), рост рН в католите, обусловленный ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}} < {{t}_{{{\text{CI}}_{{}}^{ - }}}}$, будет наблюдаться лишь при удалении значительной части Cd2+, когда ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}} \ll {\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}.$
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования использовались модельные и производственные растворы, содержащие Cd2+, а также Cl– или ${\text{SO}}_{4}^{{2 - }}$. Модельные растворы готовились из реактивов квалификации “х. ч.” и дистиллированной воды. Модельный электролит сернокислого кадмирования имеет состав, г/л: CdSO4 ⋅ 8/3H2O 75.3−78.5 + H2SO4 70−71.7, промывная вода имеет состав, г/л: CdSO4 ⋅ 8/3H2O 0.725 + H2SO4 0.70. Номинальный состав производственного хлористо-аммонийного электролита кадмирования, г/л: СdCl2 40−50, NH4Cl 200−280, NaCl 30−40, клей столярный 1−2, тиомочевина 7−10, рН 5.5−6.5. Разбавлением образца производственного хлористо-аммонийного электролита кадмирования, содержащего Cd2+ = 23.1 г/л, водой получали промывную воду.
В качестве катода использовали пластины из никеля, меди и титана, нерастворимого анода − Pt/Ti или Pt/Nb. Для разделения катодного и анодного пространства в двухкамерном мембранном электролизере использовали анионообменную мембрану марки МА-40 (производства Россия) (для растворов, содержащих ${\text{SO}}_{4}^{{2 - }}$) или химически стойкую перфторированную сульфокатионитовую мембрану марки МФ4СК (производства Россия) (для растворов, содержащих CI–).
Анализ на содержание Cd2+ при их концентрации в растворе более 0.5−1 г/л проводили комплексонометрическим титрованием этилендиаминтетраацетатом натрия (ЭДТА) в аммиачной буферной среде (рН 9−10) в присутствии индикатора эриохром черного Т. Концентрацию Cd2+ менее 0.5 г/л определяли атомно-эмиссионным спектральным анализом на приборе КВАНТ ЭФA фирмы “КОРТЭК”, Россия. Концентрацию Cl– − аргентометрическим титрованием в присутствии индикатора − хромат ионов, H+ – рН-метрией (рН-метр марки ЭВ-74, Россия) и ацидометрическим титрованием в присутствии индикатора фенолфталеина и метилового красного. Изменение концентрации Cd2+ в католите рассчитывали также по разности начального содержания Cd2+ в католите и суммарного изменения массы катода.
В качестве источника тока использовали потенциостат ПИ-50-1.1. с программатором ПР-8 в гальваностатическом режиме. Силу тока и напряжение контролировали цифровыми мультиметрами марки DT-830B. Показания силы тока, напряжения и времени записывались и учитывались в дальнейших расчетах.
Выход по току металла рассчитывали по формуле
Расход электроэнергии на получение металла на катоде рассчитывали по формуле
Снижение поступления Cd2+ в сточную воду рассчитывали по формуле
где K – коэффициент снижения поступления Cd2+ в сточную воду, Cт.в и Cв.у – соответственно концентрация Cd2+ в технологической ванне и в ванне улавливания.Степень извлечения Cd2+ из раствора рассчитывали по формуле
где А – степень извлечения Cd2+ из раствора, Cтек и Cнач – соответственно текущая и начальная концентрация Cd2+ в растворе.Значения кажущегося числа переноса иона при его миграции через ионообменную мембрану в исследуемых растворах определяли методом Гитторфа по формуле
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ И ИХ ОБСУЖДЕНИЕ
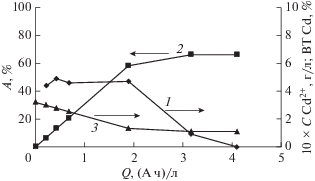
Удаление ионов кадмия из промывной воды ванны улавливания для ванны сернокислого кадмирования безмембранным электролизом с анодом из Pt/Ti. Для исследований был взят раствор состава, г/л: CdSO4 ⋅ 8/3H2O 0.725 + H2SO4 0.70 объемом 0.05 л. Условия электролиза: катод – Ni, Sк = = 0.1 дм2, iк = 10 А/м2, анод – Pt/Ti, Sа = 0.1 дм2, U = 3–4 В. Результаты исследований приведены на рис. 1. По окончании электролиза остаточная концентрация Cd2+ мала и составляет 0.1 г/л, степень извлечения Cd2+ равна 66.0%, коэффициент снижения поступления Cd2+ в проточную воду равен 34.4/0.1 = 344 раз. Выход по току Cd в условиях проведения эксперимента не превышает 5% [14]. Результаты, приведенные на рис. 1, показывают, что безмембранный электролиз пригоден для уменьшения концентрации токсичных Cd2+ в промывной воде ванны улавливания до 0.1 г/л. Для достижения данной концентрации требуется пропустить через обрабатываемый раствор удельное количество электричества не менее 4 (А ч)/л. Минимальный расход электроэнергии равен 33.9 (кВт ч)/кг кадмия, и он был рассчитан, соответственно, для максимального значения выхода по току кадмия.
Рис. 1.
Зависимость от удельного количества пропущенного электричества: 1 – выхода по току кадмия; 2 – степени извлечения ионов кадмия; 3 – концентрации ионов кадмия в растворе.
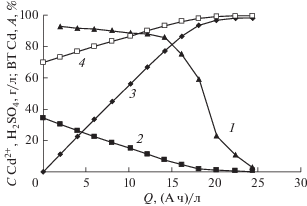
Удаление ионов кадмия из электролита сернокислого кадмирования безмембранным электролизом с анодом из Pt/Ti. Для исследований был взят раствор состава, г/л: CdSO4 ⋅ 8/3H2O 78.5 + H2SO4 70 объемом 0.05 л. Электролиз проводили при следующих условиях: катод – Ni, Sк = 0.1 дм2, iк = = 100 А/м2, анод – Pt/Ti, Sа = 0.1 дм2, U = 3–4 В. При электролизе на катоде первоначально преимущественно восстанавливаются ионы Cd2+ до Cd по реакции (1), поскольку перенапряжение выделения H2 на Cd велико. После значительного снижения концентрации Cd2+ преимущественной катодной реакцией становится восстановление H+ до H2 по реакции (2). Результаты исследований приведены на рис. 2. Необходимо отметить, что на участке 0–15 (А ч)/л выход по току Cd более 80% (кривая 1), и лишь при снижении концентрации Cd2+ в растворе менее 7–5 г/л (кривая 2), выход по току начинает резко уменьшаться. Требуется дополнительно пропустить еще удельное количество электричества, равное 10 (А ч)/л, чтобы концентрация Cd2+ в растворе стала менее 0.5 г/л [14]. Максимальный выход по току Cd достигает 93%, степень извлечения Cd2+ 98.6%, коэффициент снижения поступления Cd2+ в проточную воду равен 34.4/0.47 = 73 раз при остаточной концентрация Cd2+, равной 0.47 г/л, минимальный расход электроэнергии 1.8 (кВт ч)/кг кадмия. Первоначальная концентрация H2SO4 в обрабатываемом растворе и ее последующий рост (кривая 4), согласно реакции (4), слабо влияют на выход по току Cd. Гораздо более сильное влияние оказывает уменьшение концентрации Cd2+ в растворе.
Рис. 2.
Зависимость от удельного количества пропущенного электричества: 1 – выхода по току кадмия; 2 – степени извлечения ионов кадмия; 3 – концентрации ионов кадмия; 4 – концентрации серной кислоты.
Удаление ионов кадмия и сульфат-ионов из электролита сернокислого кадмирования мембранным электролизом с анодом из Pt/Ti. Для исследования процесса одновременного удаления Cd2+ и ${\text{SO}}_{4}^{{2 - }}$ раствор состава CdSO4 ⋅ 8/3H2O (77.1 г/л) + + H2SO4 (71.7 г/л) объемом 0.035 л поместили в катодное пространство двухкамерного мембранного электролизера с анионообменной мембраной марки МА-40. В анодное пространство этого же электролизера поместили раствор H2SO4 концентрацией 50.6 г/л и объемом 0.025 л. Электролиз вели при следующих условиях: катод – Ti, Sк = 0.1 дм2, iк = 100 А/м2, анод – Pt/Nb, Sа = 0.1 дм2, напряжение 2.6–3.2 В. В процессе электролиза ионы Cd2+ восстанавливаются на катоде до Cd. Одновременно с этим процессом ${\text{SO}}_{4}^{{2 - }}$ мигрируют из катодного пространства через анионообменную мембрану в анодное пространство, что приводит к увеличению концентрации H2SO4 в анолите. Подробный ход процесса приведен на рис. 3. Электрохимический процесс восстановления Cd2+ до Cd идет на начальном этапе электролиза с высоким выходом по току ~90%, что приводит к снижению концентрации Cd2+ в католите (кривая 1), несмотря на присутствие H2SO4 (70–85 г/л), что связано с высоким перенапряжением выделения H2 на Cd. Выход по току Cd резко уменьшается, если концентрация Cd2+ составляет единицы г/л. Первоначальный рост концентрации H2SO4 в католите (кривая 2) связан с превышением скорости образования H2SO4 в католите, из-за выделения на катоде Cd из CdSO4, над скоростью миграции ${\text{SO}}_{4}^{{2 - }}$ в анолит ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ > ${{t}_{{{\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}}}}$. Пунктирная вертикальная линия на рис. 3, проходящая через пересечение кривых 4 и 5, пересекает кривую 2 в точке, близкой к точке максимального значения концентрации H2SO4 в католите, что подтверждает, что максимум концентрации H2SO4 в католите будет наблюдаться при ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ = ${{t}_{{{\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}}}}$ и ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ = ${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$. При удалении большей части Cd2+ из католита ${\text{В}}{{{\text{Т}}}_{{{\text{кCd}}}}}$ < ${{t}_{{{\text{SO}}_{{\text{4}}}^{{{\text{2}} - }}}}}$, что приводит к снижению концентрации H2SO4 в католите. Кривая 2 на рис. 3 подтверждает описание изменения концентрации H2SO4 в католите в процессе электролиза, сделанное ранее. В анолите концентрация H2SO4 в течение всего эксперимента непрерывно нарастает. На катоде из Ti металлический кадмий осаждается с минимальным сцеплением с основой, что позволяет механическим путем легко отделить накопившийся слой Cd. Собранный порошок Cd после промывки и сушки переплавляется в слиток для последующего использования в качестве анода в технологической ванне сернокислого кадмирования. Раствор H2SO4 из анолита можно использовать для корректировки применяемых в гальваническом производстве различных растворов и электролитов, содержащих H2SO4.
Рис. 3.
Зависимость от удельного количества пропущенного электричества: 1 – концентрации ионов кадмия в католите; 2 – концентрации серной кислоты в католите; 3 – концентрации серной кислоты в анолите; 4 – выхода по току кадмия; 5 – числа переноса сульфат-ионов. Пунктирная вертикальная линия, проходящая через пересечение кривых 4 и 5, пересекает кривую 2 в точке, близкой к точке максимального значения концентрации серной кислоты в католите.
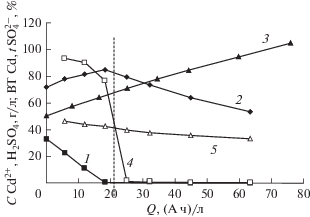
По окончании электролиза остаточная концентрация Cd2+ в католите мала и составляет 0.09 г/л. Максимальный выход по току Cd в условиях проведения эксперимента достигает 92.9%, степень извлечения Cd2+ 99.7%, коэффициент снижения поступления Cd2+ в проточную воду равен 33/0.09 = = 366.6 раз, минимальный расход электроэнергии 1.44 (кВт ч)/кг кадмия. Метод можно использовать для одновременного извлечения Cd2+ и ${\text{SO}}_{4}^{{2 - }}$ из электролита сернокислого кадмирования и соответствующей промывной воды. По аналогии данный метод можно использовать для удаления из сернокислых растворов других ионов тяжелых металлов: меди, никеля, хрома, железа, цинка и т.д.
Исследование процесса извлечения ионов кадмия из солянокислых растворов электролизом с нерастворимым анодом. Для удаления Cd2+ из растворов, содержащих Cl-, и предотвращения выделения токсичного Cl2 на нерастворимом аноде необходимо отделить обрабатываемый раствор от нерастворимого анода, погруженного в раствор H2SO4, при помощи химически стойкой катионной мембраны, т.е. использовать двухкамерный мембранный электролизер с катионообменной мембраной.
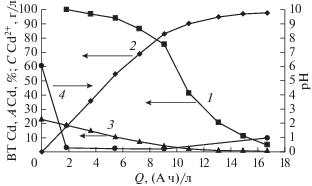
Удаление ионов кадмия из хлористо-аммонийного электролита кадмирования мембранным электролизом с нерастворимым анодом из платинированного титана. Электролит хлористо-аммонийного кадмирования объемом 0.03 л, содержащий 23.1 г/л Cd2+ и 6,28 М Cl– поместили в катодное пространство двухкамерного мембранного электролизера с перфторированной сульфокатионитовой мембраной марки МФ4СК. В анодное пространство поместили 0.035 л 1.06 N раствора H2SO4. Электролиз вели при iк = 50 А/м2. Материал катода медь, нерастворимого анода – Pt/Ti. Результаты исследований приведены на рис. 4. Значительное снижение рН в католите с 6 до 0.2 (кривая 4) после пропускания через католит 2 (А ч)/л является результатом высокой скорости миграции H+ из кислого анолита в католит в сочетании с незначительной скоростью их расхода путем разряда на катоде (${\text{В}}{{{\text{Т}}}_{{{\text{к}}{{{\text{H}}}_{{\text{2}}}}}}}$ ~ 1%). Таким образом, в процессе электролиза в католите происходит постепенная замена Cd2+ на H+ [15]. Превышение скорости расхода H+ в католите над скоростью их поступления из анолита приводит к возрастанию рН католита, которое наблюдается лишь после снижения выхода по току Cd ниже 10%. К концу электролиза концентрация H+ в анолите равна 1.09 N, что позволяет рассчитать кажущееся значение доли тока, переносимой Cl– через катионообменную мембрану в стационарных условиях, равное 5.6%. После окончания электролиза (прохождения через катодную камеру 16.7 (А ч)/л) остаточная концентрация Cd2+ по данным спектрального анализа составила 80 мг/л, степень извлечения Cd2+ 99.6%, коэффициент снижения поступления Cd2+ в проточную воду равен 23.1/0.08 = 288.7 раза.
Рис. 4.
Зависимость от удельного количества пропущенного электричества: 1 – выхода по току кадмия; 2 – степени извлечения ионов кадмия; 3 – концентрации ионов кадмия; 4 – рН католита.
Удаление ионов кадмия из промывной воды хлористо-аммонийного электролита кадмирования мембранным электролизом с анодом из Pt/Ti. Для исследований использовали двухкамерную ячейку с катионообменной мембраной, где католит – электролит хлористо-аммонийного кадмирования, разбавленный в 50 раз водой, анолит – 1 N раствор H2SO4. Материал катода медь, нерастворимого анода – Pt/Ti. Для интенсификации процесса восстановления Cd2+iк увеличили до 100 А/м2. Результаты исследований показали, что выход по току Cd не более 10%. За 2 (А ч)/л удаляется 55% от всех Cd2+, бывших в растворе, до остаточной концентрации 0.12 г/л. При разбавлении хлористо-аммонийного электролита кадмирования в 100 раз 0.1 N раствором соляной кислоты и увеличении iк до 200–500 А/м2 были получены схожие результаты: выход по току Cd ~ 2%, за 16 (А ч)/л удаляется до 70% от всех Cd2+, бывших в растворе, до остаточной концентрации равной 0.07 г/л [15]. Низкий выход по току Cd объясняется в первую очередь низкой концентрацией Cd2+ и повышенной iк. Поскольку при эксплуатации ванны улавливания эти два параметра находятся в известном диапазоне значений, то увеличить выход по току кадмия можно увеличивая рН ванны улавливания.
ЗАКЛЮЧЕНИЕ
Применение мембранной технологии позволяет снизить концентрацию Cd2+ в очищаемых растворах до 0.1–0.07 г/л, уменьшить поступление Cd2+ в сточные воды предприятия в 288–366 раз и достигнуть степени извлечения Cd2+ 99.7%.
Электрохимическая безмембранная технология позволяет вернуть в производство Cd, а мембранная технология – как Cd, так и раствор H2SO4.
ОБОЗНАЧЕНИЯ
| А | степень извлечения, д. ед. или % |
| а | активность, моль/л |
| C | концентрация, г/л |
| с | концентрация, моль/л |
| E0 | стандартный электродный потенциал, В |
| Eр | равновесный электродный потенциал, В |
| ΔE | разность потенциалов, В |
| F | число Фарадея, 96500 Кл/моль-экв |
| I | сила тока, А |
| i | плотность тока, А/м2 |
| K | коэффициент снижения поступления ионов в сточную воду |
| M | молярная масса металла, г/моль |
| Δm | изменение массы катода, г |
| n | число электронов, принимающих участие в электрохимической реакции |
| Q | удельное количество пропущенного электричества, (А ч)/л |
| q | количество пропущенного электричества, Кл |
| R | универсальная газовая постоянная, Дж/(моль К) |
| T | температура, К |
| ti | кажущееся число переноса данного вида ионов, д. ед. или % |
| U | напряжение на электролизере, В |
| V | объем, л |
| W | расход электроэнергии, (Вт ч)/кг |
| τ | время, с |
| ВТi | выход по току данной конкретной электрохимической реакции, д. ед. или % |
ИНДЕКСЫ
Список литературы
Виноградов С.С. Экологически безопасное гальваническое производство. М.: Глобус, 2002.
Перелыгин Ю.П., Флягин А.А., Зуева Т.В., Зорькина О.В. Реагентная технология утилизации высококонцентрированных растворов, содержащих ионы цинка, кадмия, меди и аммония // Рег. архит. строит. 2009. № 1. С. 87.
Смирнова Н.Н., Макарова А.А. Эффективность применения реагентного осаждения в процессах очистки сточных вод гальванических производств от ионов меди(II), цинка(II), никеля(II) и кадмия(II) // Вода: хим. экол. 2018. № 1–3(114). С. 134.
Alguacil F.J., Navarro P. Permeation of cadmium through a supported liquid membrane impregnated with CYANEX 923 // Hydrometallurgy. 2001. V. 61. № 2. P. 137.
Kozlowski C., Apostoluk W., Walkowiak W., Kita A. Removal of Cr(VI), Zn(II) and Cd(II) ions by transport across polymer inclusion membranes with basic ion carriers // Physicochem. Probl. Miner. Process. 2002. V. 36. P. 115.
Давыдов А.Н., Плохов С.В. Ионообменное и электрохимическое извлечение Cd(II) из промывных вод после гальванической металлизации // Изв. высш. учебн. завед. Хим. хим. технол. 2010. Т. 53. № 2. С. 129.
Elsherief A.E. Removal of cadmium from simulated wastewaters by electrodeposition on spiral wound steel electrode // Electrochim. Acta. 2003. V. 48. № 18. P. 2667.
Luciano M., Andréa M.B., Jane Z.F. Cadmium electroplating wastewater treatment using a laboratory-scale electrodialysis system // Sep. Purif. Technol. 2004. V. 37. № 3. P. 247.
Konstantinos D., Achilleas Chr., Despoina P., Anthimos D. Ion and Ionic Current Sinks for Electrodeionization of Simulated Cadmium Plating Rinse Waters // Environ. Prog. Sustainable Energy. 2011. V. 30. № 1. P. 37.
Шачнева Е.Ю., Алыков Н.М., Арчибасова Д.Е. Адсорбция кадмия из водных растворов на модифицированных сорбентах // Тех. технол. пищ. производ. 2012. № 4. С. 171.
Юстратов В.П., Соловьева Ю.В. Разработка адсорбционной технологии очистки сточных вод гальванического производства от ионов тяжелых металлов // Вестн. Кузбасского гос. тех. унив. 2006. № 1. С. 114.
Санжанова С.С., Зонхоева Э.Л. Очистка рудничных вод природными сорбентами // Вода: хим. экол. 2016. № 6 (96). С. 58.
Абоносимов О.А., Лазарев С.И., Стрельников А.Е., Дмитриев В.М., Котенев С.И. Экологическая эффективность электробаромембранного удаления ионов тяжелых металлов из сточных вод агропромышленных предприятий // Наука центр. Росс. 2017. № 5 (29). С. 101.
Тураев Д.Ю., Кругликов С.С. Удаление ионов кадмия из промывной воды в ванне улавливания после операции кадмирования в сернокислом электролите // Усп. хим. хим. технол. Вып. XV. Ч. 5. М.: РХТУ им. Д.И. Менделеева, 2001. С. 59.
Тураев Д.Ю., Сироткин В.И., Кругликов С.С. Удаление ионов кадмия из промывных вод процесса кадмирования. 1. Хлористо-аммонийный электролит // Гальванотех. обраб. поверхн. 2001. Т. 9. № 2. С. 45.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


