Теоретические основы химической технологии, 2020, T. 54, № 3, стр. 304-308
Межфазное распределение Fe(III) и Zn(II) в хлоридных системах с Aliquat 336 в полипропиленгликоле 425
М. И. Федорова a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 21.01.2020
После доработки 27.01.2020
Принята к публикации 27.01.2020
Аннотация
Впервые изучено извлечение ионов железа(III) и цинка(II) в двухфазной водной системе на основе полипропиленгликоля 425 и хлорида натрия с добавлением комплексообразующего агента Aliquat 336. Показано, что данный экстрагент эффективно извлекает исследуемые металлы из солянокислых растворов; варьируя параметры процесса экстракции, можно обеспечить степень извлечения более 95% за одну ступень.
ВВЕДЕНИЕ
Современные методы извлечения ионов цветных металлов из растворов выщелачивания руды [1], химических источников тока [2–4], растворов травления [5], отходов производства магнитов [6] и др. связаны с применением экстракции. На сегодняшний день выделение ионов целевых металлов (Fe, Zn, Co, Ni и др.) проводят с использованием ионообменных (Aliquat 336, ди(2-этилгексил)фосфорная кислота) и нейтральных (три-изо-октиламин, трис(2-этилгексил)амин, трибутилфосфат, метилизобутилкетон) экстрагентов, разбавленных в органическом растворителе (толуол, керосин, ксилол, гексан), из сульфатных [7, 8] и хлоридных [9, 10] сред.
В [11–13] изучена экстракция ионов Zn(II) анионообменными и нейтральными экстрагентами. При использовании в качестве экстрагентов солей аммониевых оснований (Aliquat 336) экстрагируемыми комплексами являются соединения, имеющие состав (R4N)[ZnCl3] или (R4N)2[ZnCl4], при этом ионы Zn(II) извлекаются практически количественно. В [14] извлечение ионов Zn(II) из водного раствора проводили 0.75 М раствором ди(2-этилгексил)фосфорной кислоты в керосине. Авторами статьи был установлен состав экстрагируемого соединения ZnClA · 3HA.
В [15] изучена экстракция ионов Fe(III) из солянокислых сред 0.2 M раствором Aliquat 336 в органическом растворителе (керосин, бензол, циклогексан и др.) и предложен механизм экстракции:
(1)
$\begin{gathered} {\text{Fe}}_{{{\text{вод}}{\text{.ф}}}}^{{3 + }} + 3{\text{Cl}}_{{{\text{вод}}{\text{.ф}}}}^{ - } + {{R}_{4}}{\text{NC}}{{{\text{l}}}_{{{\text{орг}}{\text{.ф}}}}} \Leftrightarrow \\ \Leftrightarrow \,\,\left( {{{R}_{4}}{\text{N}}} \right){{\left[ {{\text{FeC}}{{{\text{l}}}_{4}}} \right]}_{{{\text{орг}}{\text{.ф}}}}}. \\ \end{gathered} $Изучено влияние содержания хлорид-ионов в растворе и кислотности среды на эффективность извлечения ионов Fe(III). По углу наклона логарифмической зависимости коэффициента распределения от концентрации ионов Cl– (наклон = 3) и экстрагента (наклон = 1) было установлено их влияние на переход ионов Fe(III) в органическую фазу. При увеличении концентрации хлорид-ионов коэффициент распределения Fe(III) увеличивается пропорционально кубу концентрации хлорид-ионов, а при увеличении концентрации Aliquat 336 имеет место прямо пропорциональная зависимость. Подобный характер влияния концентрации соляной кислоты (наклон = 0.5) в водной фазе подтверждает, что кислотность среды не влияет на экстракцию ионов железа(III) в органическую фазу.
Количественное извлечение достигается без избытка экстрагента, однако концентрация соляной кислоты в водной фазе оказалась велика и составила 9.2 моль/л. Авторами [15] были также рассчитаны термодинамические характеристики извлечения ионов Fe(III) раствором Aliquat 336 в керосине с концентрацией 0.2 моль/л, которые говорят о том, что экстракция Fe(III) является самопроизвольным и эндотермическим процессом.
Так как органические растворители являются токсичными, пожароопасными и не удовлетворяют принципам “зеленой” химии, необходима замена их на экологически безопасные. Таковыми могут являться экстракционные системы [16–19] на основе водорастворимых полимеров (полиэтиленгликолей и др.). Такие системы стали перспективными для извлечения ряда металлов (Fe, Zn, Cr, Au, Pt и др.) из хлоридных водных растворов [20, 21]. Однако повышение эффективности извлечения в таких системах может быть обеспечено за счет использования добавок традиционных промышленных экстрагентов, данное решение существенно расширяет возможности для практического использования этих экстракционных систем в реальном технологическом процессе [22, 23].
В работе [24] предложена экологически безопасная экстракционная система полипропиленгликоль 425–NaCl–H2O для экстракции ионов металлов (Fe, Zn, Mn) раствором тиоцианата триоктилметиламмония. Полученные количественные характеристики межфазного распределения ионов металлов в предложенной системе показали, что закономерности экстракции ионов металлов сохраняются и замена растворителя не приводит к потере экстракционной способности тиоцианата триоктилметиламмония.
Таким образом, целью данной работы стало изучение межфазного распределения ионов Fe(III) и Zn(II) в двухфазной водной системе полипропиленгликоль 425 (PPG–425)–хлорид натрия–вода с добавлением Aliquat 336 в качестве экстрагента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные растворы хлоридов железа(III) и цинка(II) получали путем растворения в дистиллированной воде точной навески FeCl3 · 6H2O и ZnCl2 квалификации “х. ч.”, взвешенной на аналитических весах AND HR-100AZ.
Двухфазная водная система была приготовлена с использованием полипропиленгликоля со средней молекулярной массой 425 г/моль (Acros Organics) и хлорида натрия квалификации “х. ч”. Во всех экспериментах использовали экстракционную систему состава полипропиленгликоль 425 (30 мас. %)–NaCl (8 мас. %)–H2O за исключением экспериментов по нахождению зависимости эффективности экстракции от количества хлорида натрия. Концентрация соляной кислоты в солевой фазе во всех экспериментах постоянна и равна 0.005 моль/л, что необходимо для подавления гидролиза катионов Fe(III) и Zn(II).
Исходная концентрация ионов Fe(III) и Zn(II) в солевой фазе была постоянна и равна 0.01 моль/л кроме экспериментов по определению зависимости коэффициента распределения иона металла от его исходной концентрации.
Концентрацию ионов Fe(III) и Zn(II) в солевой фазе определяли спектрофотометрическим методом с использованием сульфосалициловой кислоты для Fe(III) при длине волны 420 нм и 4-(2-пиридилазо)резорцина для Zn(II) при длине волны 490 нм. Концентрацию ионов металлов в полимерной фазе рассчитывали по разности между концентрациями в исходном растворе и в солевой фазе после экстракции с учетом соотношения фаз 1 : 3.
Экстракцию ионов Fe(III) и Zn(II) проводили при температуре 25°С в градуированных центрифужных пробирках в термостатированном шейкере Enviro-Genie (Scientific Industries, Inc.) при скорости вращения 30 об./мин до установления термодинамического равновесия.
Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Катионы Zn(II) и Fe(III) в растворе способны образовывать с хлорид-ионами комплексные анионы ${{\left[ {{\text{MeC}}{{{\text{l}}}_{i}}} \right]}^{{n - i}}},$ состав которых зависит от концентрации Cl–. В предложенной нами экстракционной системе полипропиленгликоль 425 (30 мас. %)–NaCl (8 мас. %)–H2O содержание Cl– в нижней фазе составляет 4 моль/л. Такой солевой фон приводит к образованию комплексов состава ${{\left[ {{\text{MeC}}{{{\text{l}}}_{4}}} \right]}^{{n - 4}}}$ [12]. В этом случае экстракция ионов металлов описывается уравнением [20]
(2)
$\begin{gathered} {\text{Me}}_{{{\text{сол}}{\text{.ф}}}}^{{n + }} + n{\text{Cl}}_{{{\text{сол}}{\text{.ф}}}}^{ - } + xPPG - {{425}_{{{\text{пол}}{\text{.ф}}}}} \Leftrightarrow \\ \Leftrightarrow xPPG - 425 \cdot \left[ {{\text{MeC}}{{{\text{l}}}_{n}}} \right]_{{{\text{пол}}{\text{.ф}}}}^{{n - 4}}. \\ \end{gathered} $Экстракция исследуемых ионов металлов раствором Aliquat 336 в предложенной двухфазной водной системе, вероятно, будет протекать аналогично системам с органическим растворителем [15, 25–27]:
(3)
$\begin{gathered} {\text{Me}}_{{{\text{сол}}{\text{.ф}}}}^{{n + }} + n{\text{Cl}}_{{{\text{сол}}{\text{.ф}}}}^{ - } + (4 - n){{R}_{4}}{\text{NC}}{{{\text{l}}}_{{{\text{пол}}{\text{.ф}}}}} \Leftrightarrow \\ \Leftrightarrow {{\left( {{{R}_{4}}{\text{N}}} \right)}_{{(4 - n)}}}{{\left[ {{\text{MeC}}{{{\text{l}}}_{4}}} \right]}_{{{\text{пол}}{\text{.ф}}}}}. \\ \end{gathered} $Константа экстракции по уравнению (3) имеет следующий вид:
(4)
${{K}_{{{\text{Me}}}}} = \frac{{\left[ {{\text{Me}}_{{{\text{пол}}{\text{.ф}}}}^{{n + }}} \right]}}{{\left[ {{\text{Me}}_{{{\text{сол}}{\text{.ф}}}}^{{n + }}} \right]{{{\left[ {{\text{Cl}}_{{{\text{сол}}{\text{.ф}}}}^{ - }} \right]}}^{n}}{{{\left[ {{{R}_{4}}{\text{NC}}{{{\text{l}}}_{{{\text{пол}}{\text{.ф}}}}}} \right]}}^{{(4 - n)}}}}}.$Путем логарифмирования уравнения (4) получим
(5)
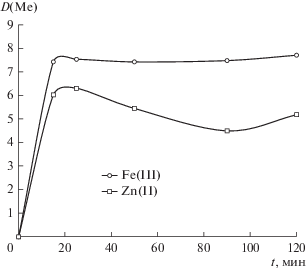
$\begin{gathered} {\text{lg}}{{K}_{{{\text{Me}}}}} = {\text{lg}}D({\text{Me}}) - n{\text{lg}}\left[ {{\text{Cl}}_{{{\text{сол}}{\text{.ф}}}}^{ - }} \right] - \\ - \,\,(4 - n){\text{lg}}\left[ {{{R}_{4}}{\text{NC}}{{{\text{l}}}_{{{\text{пол}}{\text{.ф}}}}}} \right]. \\ \end{gathered} $Экспериментально установлено время наступления термодинамического равновесия при экстракции ионов Fe(III) и Zn(II) из 0.01 М раствора в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия (8 мас. %)–вода в присутствии 0.05 моль/л Aliquat 336 (рис. 1), которое составляет 20 мин.
Рис. 1.
Зависимость коэффициента распределения ионов металлов от времени контакта фаз в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия (8 мас. %)–вода при T = 25°C, С(Aliquat 336) = = 0.05 моль/л, С(Ме)исх = 0.01 моль/л.
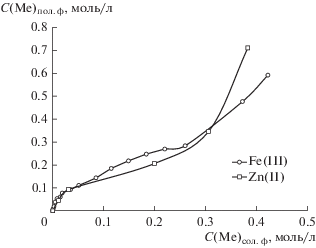
На рис. 2 приведены изотермы экстракции для ионов железа(III) и цинка(II) в диапазоне исходных концентраций от 0.0005 до 0.7 моль/л. Анализ полученных зависимостей показал, что изотермы имеют возрастающий характер, на которых можно выделить три участка. Начальный участок изотермы при С(Ме)сол. ф < 0.07 моль/л является прямолинейным с выходом на плато. Преобладающим механизмом экстракции ионов металлов на этом участке, вероятно, является анионный обмен с солью четвертичного аммониевого основания с выходом на насыщение при соотношении концентрации металла в верхней фазе к исходной концентрации экстрагента, равном 1 : 1. Участок изотермы от 0.07 до 0.25 моль/л также прямолинеен, но имеет меньший, по сравнению с начальным участком, угол наклона, а следовательно, происходит уменьшение коэффициента распределения ионов металлов. При концентрации ионов металла в солевой фазе более 0.25 моль/л значение коэффициента распределения ионов металлов принимает постоянное значение, равное 1.
Рис. 2.
Изотерма экстракции Fe(III) и Zn(II) в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия (8 мас. %)–вода при T = 25°C, С(Aliquat 336) = = 0.07 моль/л.
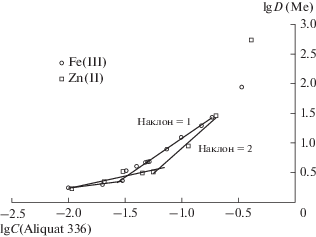
Далее была установлена зависимость степени извлечения ионов металлов от концентрации Aliquat 336 в диапазоне от 0.01 до 0.4 моль/л в исследуемой системе (рис. 3). Для ионов цинка(II) и железа(III) степень извлечения логарифмически возрастает до 92% при концентрации хлорида метилтриоктиламмония в полимерной фазе, равной 0.2 моль/л. На рис. 4 представлена билогарифмическая зависимость коэффициента распределения от концентрации Aliquat 336, из которой видно, что полученные зависимости имеют два прямолинейных участка: при концентрации хлорида метилтриоктиламмония в полимерной фазе менее 0.03 моль/л для железа и 0.05 моль/л для цинка экстракция осуществляется по смешанному механизму (как по уравнению (2), так и по уравнению (3)). При концентрациях соли четвертичного аммониевого основания более 0.03 моль/л для Fe(III) и 0.05 моль/л для Zn(II) экстракция преимущественно происходит по механизму (3) и углы наклона билогарифмических прямых соответствуют уравнению (5) – для цинка он равен 2, а для железа – 1.
Рис. 3.
Зависимость степени извлечения ионов металлов от концентрации Aliquat 336 в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия (8 мас. %)–вода при T = 25°C, С(Ме)исх = 0.01 моль/л.
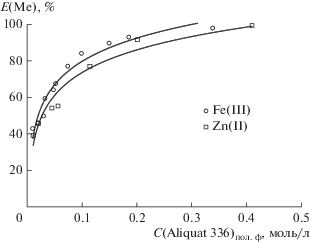
Рис. 4.
Билогарифмическая зависимость коэффициента распределения ионов металлов от концентрации Aliquat 336 в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия (8 мас. %)–вода при T = 25°C, С(Ме)исх = 0.01 моль/л.
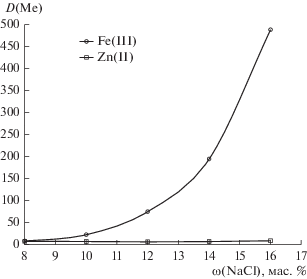
Так как на экстракцию ионов исследуемых металлов, согласно уравнениям (2) и (3), влияет концентрация хлорид-ионов, нами были проведены экспериментальные исследования по варьированию содержания хлорида натрия в системе (рис. 5). Полученные зависимости коэффициентов распределения металлов имеют различный характер: для Fe(III) коэффициент распределения возрастает экспоненциально, для Zn(II) – линейно. Характер зависимости определяется составом экстрагируемого комплекса в соответствии с уравнением (5), а так как для ионов железа и цинка они разные, то коэффициенты распределения железа и цинка будут в разной степени зависеть от концентрации хлорид-ионов. Так, в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия (16 мас. %)–вода D(Fe) = 488, а D(Zn) = 8.39, коэффициент разделения βFe/Zn = 58.
Рис. 5.
Зависимость коэффициента распределения ионов металлов от содержания хлорида натрия в системе полипропиленгликоль 425 (30 мас. %)–хлорид натрия–вода при T = 25°C, С(Aliquat 336) = 0.05 моль/л, С(Ме)исх = = 0.01 моль/л.
Анализ полученных нами результатов и литературных данных [14, 15] показал, что при использовании экстракционной системы полипропиленгликоль 425–NaCl–H2O в качестве растворителя для Aliquat 336 эффективное извлечение ионов железа(III) и цинка(II) наблюдается из слабокислых хлоридных растворов (рН 2.3) при концентрации Aliquat 336 в полимерной фазе в 2 раза меньше, чем в системах с органическими растворителями [14, 15].
ЗАКЛЮЧЕНИЕ
В ходе проведенного исследования было установлено, что система полипропиленгликоль 425–NaCl–H2O может быть использована в качестве растворителя для Aliquat 336. Было рассмотрено влияние таких факторов, как время контакта фаз, концентрация Aliquat 336, исходная концентрация ионов металла, количество высаливателя. Установлено, что количественное извлечение ионов железа(III) и цинка(II) в исследуемой двухфазной водной системе может быть достигнуто в более мягких условиях по сравнению с классическими экстракционными системами.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 18-29-24170.
ОБОЗНАЧЕНИЯ
| C | концентрация, моль/л |
| D | коэффициент распределения |
| E | степень извлечения, % |
| K | константа экстракции |
| T | температура, °C |
| t | время, мин |
| β | коэффициент разделения |
| ω | концентрация, мас. % |
ИНДЕКСЫ
Список литературы
Крылова Л.Н., Панин В.В., Воронин Д.Ю. Способ извлечения металлов из сульфатных растворов, содержащих железо. Пат. 2336346 РФ. 2008.
Andak B., Özduğan E., Türdü S., Bulutcu A. N. Recovery of zinc and manganese from spent zinc-carbon and alkaline battery mixtures via selective leaching and crystallization processes // J. Environ. Chem. Eng. 2019. V. 7. P. 103372.
Sayilgan E., Kukrer T., Yigit N.O., Civelekoglu G., Kitis M. Acidic leaching and precipitation of zinc and manganese from spent battery powders using various reductants // J. Hazard. Mater. 2010. V. 173. P. 137.
Zakhodyaeva Yu.A., Izyumova K.V., Solov’eva M.S., Voshkin A.A. Extraction separation of the components of leach liquors of the batteries // Theor. Found. Chem. Eng. 2017. V. 51. № 5. P. 883.
Sinha M.K., Sahu S.K., Meshram P., Pandey B.D. Solvent extraction and separation of zinc and iron from spent pickle liquor // Hydrometallurgy. 2014. V. 147–148. P. 103.
Yang Y., Lan C., Wang Y., Zhao Z., Li B. Recycling of ultrafine NdFeB waste by the selective precipitation of rare earth and the electrodeposition of iron in hydrofluoric acid // Sep. Purif. Technol. 2020. V. 230. P. 115870.
Principe F., Demopoulos G.P. Comparative study of iron(III) separation from zinc sulphate–sulphuric acid solutions using the organophosphorus extractants, OPAP and D2EHPA: Part I: Extraction // Hydrometallurgy. 2004. V. 74. P. 93.
Kondratyeva E.S., Gubin A.F., Kolesnikov V.A. Study of the extraction of zinc(II) ions from ammonia–sulfate solutions // Theor. Found. Chem. Eng. 2016. V. 50. № 1. P. 83. [Кондратьева Е.С., Губин А.Ф., Колесников В.А. Исследование закономерностей экстракции ионов цинка(II) из аммиачно-сульфатных растворов // Теор. осн. хим. технол. 2016. Т. 50. № 1. С. 86.]
Grzeszczyk A., Regel-Rosocka M. Extraction of zinc(II), iron(II) and iron(III) from chloride media with dibutylbutylphosphonate // Hydrometallurgy. 2007. V. 86. P. 72.
Voshkin A.A., Belova V.V., Khol’kin A.I. Extraction of iron(III) by binary extractants based on quaternary ammonium bases and organic acids // Russ. J. Inorg. Chem. 2003. V. 48. № 4. P. 608. [Вошкин А.А., Белова В.В., Холькин А.И. Экстракция железа(III) бинарными экстрагентами на основе четвертичных аммониевых оснований и органических кислот // Журн. неорг. хим. 2003. Т. 48. № 4. С. 691.]
Dalali N., Yavarizadeh H., Agrawal Y.K. Separation of zinc and cadmium from nickel and cobalt by facilitated transport through bulk liquid membrane using trioctyl methyl ammonium chloride as carrier // J. Ind. Eng. Chem. (Amsterdam, Neth.). 2012. V. 18. P. 1001.
Zhou K., Wu Y., Zhang X., Peng C., Cheng Y., Chen W. Removal of Zn(II) from manganese-zinc chloride waste liquor using ion-exchange with D201 resin // Hydrometallurgy. 2019. V. 190. P. 105171.
Xing W.D., Lee M.S., Senanayake G. Recovery of metals from chloride leach solutions of anode slimes by solvent extraction. Part II: Recovery of silver and copper with LIX 63 and Alamine 336 // Hydrometallurgy. 2018. V. 180. P. 49.
Balesini Aghdam A.A., Yoozbashizadeh H., Moghaddam J. Simple separation method of Zn(II) and Cd(II) from brine solution of zinc plant residue and synthetic chloride media using solvent extraction // Chin. J. Chem. Eng. 2020 (in press).
Mishra R.K., Rout P.C., Sarangi K., Nathsarma K.C. Solvent extraction of Fe(III) from the chloride leach liquor of low grade iron ore tailings using Aliquat 336 // Hydrometallurgy. 2011. V. 108. P. 93.
Binks B.P., Shi H. Phase inversion of silica particle-stabilized water-in-water emulsions // Langmuir. 2019. V. 35. № 11. P. 4046.
Tanimura K., Amau M., Kume R., Suga K., Okamoto Y., Umakoshi H. Characterization of ionic liquid aqueous two-phase systems: phase separation behaviors and the hydrophobicity index between the two phases // J. Phys. Chem. B. 2019. V. 123. № 27. P. 5866.
Rodrigues Barreto C.L., de Sousa Castro S., de Souza Júnior E.C., Veloso C.M., Alcântara Veríssimo L.A., Santos Sampaio V., Ramos Gandolfi O.R., da Costa Ilhéu Fontan R., Oliveira Neves I.C., Ferreira Bonomo R.C. Liquid–liquid equilibrium data and thermodynamic modeling for aqueous two-phase system peg 1500 + sodium sulfate + water at different temperatures // J. Chem. Eng. Data. 2019. V. 64. № 2. P. 810.
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid–liquid equilibrium of aqueous two-phase system composed of poly(ethylene oxide) 1500 and sodium nitrate // J. Chem. Eng. Data. 2019. V. 64. № 3. P. 1250.
Zakhodyaeva Yu.A., Zinovyeva I.V., Tokar E.S., Voshkin A.A. Complex extraction of metals in an aqueous two-phase system based on poly(ethylene oxide) 1500 and sodium nitrate // Molecules. 2019. V. 24. P. 4078.
Zakhodyaeva Yu.A., Zinov’eva I.V., Voshkin A.A. Extraction of iron(III) chloride complexes using the polypropylene glycol 425–NaCl–H2O system // Theor. Found. Chem. Eng. 2019. V. 53. № 5. P. 735. [Заходяева Ю.А., Зиновьева И.В., Вошкин А.А. Экстракция хлоридных комплексов железа(III) в системе полипропиленгликоль 425–NaCl–H2O // Теор. осн. хим. технол. 2019. Т. 53. № 5. С. 510.]
Shkinev V.M., Zakhodyaeva Yu.A., Dzhenloda R.Kh., Mokhodoeva O.B., Voshkin A.A. Synthesis of magnetic iron oxide nanoparticles at the interface of the polyethylene glycol–ammonium sulfate–water extraction system // Mendeleev Commun. 2017. V. 27. № 5. P. 485.
Voshkin A.A., Shkinev V.M., Zakhodyaeva Y.A. A new extraction method for the preparation of zinc oxide nanoparticles in aqueous two-phase systems // Russ. J. Phys. Chem. 2017. V. 91. P. 226.
Федорова М.И., Зиновьева И.В., Заходяева Ю.А., Вошкин А.А. Экстракция Fe(III), Zn(II) и Mn(II) в системе с новым ''зеленым'' растворителем для тиоцианата триоктилметиламмония // Теор. осн. хим. технол. 2020. Т. 54. № 2. С. 1.
Voshkin A.A., Belova V.V., Zakhodyaeva Yu.A. Iron extraction with di(2-ethylhexyl)dithiophosphoric acid and a binary extractant based on it // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 387. [Вошкин А.А., Белова В.В., Заходяева Ю.А. Экстракция железа ди(2-этилгексил)дитиофосфорной кислотой и бинарным экстрагентом на ее основе // Журн. неорг. хим. 2018. Т. 63. № 3. С. 362.]
Voshkin A.A., Zhidkova T.I., Belova V.V., Zhilov V.I., Brenno Yu.Yu., Khol’kin A.I. Extraction of metal salts with trioktylmethylammonium di(2-ethylhexyl)dithiophosphate // Russ. J. Inorg. Chem. 2008. V. 49. № 8. P. 1278. [Вошкин А.А., Жидкова Т.И., Белова В.В., Жилов В.И., Бренно Ю.Ю., Холькин А.И. Экстракция солей металлов ди(2-этилгексил)-дитиофосфатом триоктилметиламмония // Журн. неорг. хим. 2004. Т. 49. № 8. С. 1384.]
Belova V.V., Voshkin A.A., Khol’kin A.I. Liquid-liquid distribution of metals in systems with trioctylmethylammonium dinonyl naphthalenesulfonate // Theor. Found. Chem. Eng. 2011. V. 45. № 5. P. 764.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


