Теоретические основы химической технологии, 2020, T. 54, № 3, стр. 267-275
Фракционирование изотопов воды D/H и 18О/16О в насадочной ректификационной колонне
Н. Н. Кулов a, *, А. В. Полковниченко a, **, Е. В. Лупачев a, И. Л. Растунова b, Э. П. Магомедбеков b
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: kulovnn@mail.ru
** E-mail: anzakhlevniy@rambler.ru
Поступила в редакцию 12.11.2019
После доработки 24.12.2019
Принята к публикации 26.12.2019
Аннотация
Сконструирована экспериментальная ректификационная колонна насадочного типа для изучения процесса разделения изотопов водорода и кислорода воды, в том числе в процессе солевой ректификации. Экспериментально определена скорость захлебывания и зависимость перепада давления в насадочной колонне от нагрузки по пару при работе в режиме полной флегмы. Проведен сравнительный анализ работы колонны для процессов ректификации чистой воды и воды в присутствии солевых разделяющих агентов. Показано, что использование карбамида для разделения изотопов водорода и MgCl2 для изотопов кислорода может на порядок увеличить производительность колонны по целевому компоненту.
ВВЕДЕНИЕ
Ректификация как способ получения воды различного изотопного состава известна давно [1, 2], однако исследования, направленные на совершенствование этого процесса, ведутся и в настоящее время [3–6]. В последние десятилетия тяжелая вода с высоким содержанием дейтерия и легкая, с пониженным его содержанием по сравнению с природной водой, находят все большее применение в исследовательских и медицинских целях. Основным источником тяжелой и легкой воды, а также изотопа кислорода-18 для медицинских целей, служит в настоящее время ректификация природной воды. Этот процесс безопасный, экологически чистый с практически неисчерпаемым запасом целевых компонентов, однако он энергоемкий и в этом отношении требует совершенствования. В настоящей работе предпринята попытка оценить возможное снижение затрат тепла при ректификации воды.
Для работы по проекту Российского научного фонда в области разделения изотопов Инновационно-внедренческим центром “Инжехим” (Казань) была изготовлена и смонтирована в ИОНХ РАН ректификационная автоматизированная колонна для разделения изотопов воды под вакуумом, в том числе в условиях солевой ректификации.
В качестве потенциальных разделяющих агентов нами рассматривались как минеральные, так и органические соли. Воздействие солей на фазовое равновесие жидкость–пар при разделении изотопов в системах протий−дейтерий (H−D) и кислород-16−кислород-18 (16О−18О) в литературе [7–9] объясняется образованием гидратных комплексов. В работах [10–12] обнаружены положительные изотопные эффекты при фракционировании смеси 16О−18О в случае добавления в воду в качестве разделяющего агента соли MgCl2, а в случае фракционирования H−D – при добавлении в воду карбамида. Следует отметить, что в указанных работах изучались однократные изотопные эффекты для решения геохимических задач.
Цель настоящей работы состоит в изучении рабочих характеристик колонны и предварительной оценке эффективности работы ректификационной колонны при фракционировании изотопов водорода и кислорода воды природного состава в условиях солевой ректификации, используя данные для однократного солевого эффекта.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Принципиальная схема колонны представлена на рис. 1. Куб колонны 1 представляет собой быстросъемную емкость, в нижней части которой установлен трубчатый электронагреватель (ТЭН), состоящий из трех независимых нагревательных элементов с номинальной мощностью 1.5 кВт каждый.
Рис. 1.
Принципиальная схема лабораторной ректификационной установки: 1 – куб; 2 – насадочная колонна; 3 – насадка; 4 – глухая отборная тарелка; 5 – распределитель орошения; 6 – смотровое окно; 7 – дефлегматор; 8 – емкость головных фракций; 9 – емкость дистиллята; 10 – кран; 11 – мерное устройство; 12 – солевая емкость; 13 – распределительное устройство; 14 – жиклер; 15 – фильтр; 16 – приемная емкость; 17 – гидрозатвор; 18 – шкаф управления.
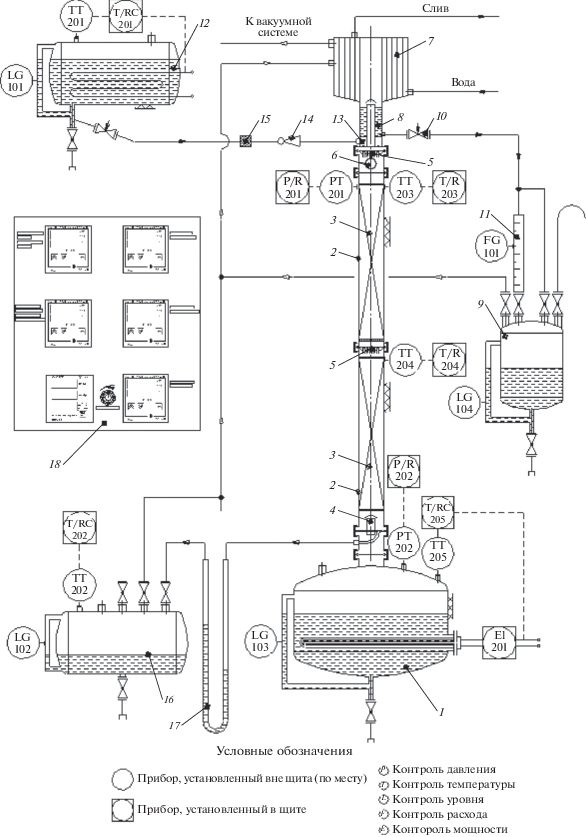
Ректификационная колонна 2 состоит из двух царг высотой 1.1 м каждая, заполненных спирально-призматической насадкой размером 3 × 3 × × 0.2 мм, свитой из проволоки, изготовленной из нержавеющей стали. В нижней части колонны предусмотрена возможность установки глухой отборной тарелки 4, а в верхней части установлен распределитель орошения 5 и смотровое окно 6. Элементы колонны соединяются между собой быстросъемным вакуумным соединением стандарта KF (Kwik-Flange TM). Снаружи куб 1 и колонна 2 теплоизолированы слоем керамического волокнистого материала с внешним покрытием из алюминиевой фольги.
Дефлегматор колонны 7 представляет собой спиральный теплообменник, конструкция которого позволяет обеспечить высокую интенсивность теплообмена, значительную длину пути паров при сравнительно небольшом гидравлическом сопротивлении и компактных размерах теплообменника. Отбор дистиллята производится из емкости головных фракций 8 и далее в емкость дистиллята 9, расход отбора контролируется с помощью мерного устройства 11. Применение такой схемы отбора дистиллята обеспечивает возможность работы установки при различных флегмовых числах, в том числе в режиме бесконечной флегмы, обеспечивающем максимальную разделяющую способность ректификационной колонны.
Подача солевого раствора на верхнюю ступень колонны 2 осуществляется из емкости 12, оборудованной электронагревателем. Раствор в колонну поступает через распределительное устройство 13 при атмосферной разгонке самотеком или за счет перепада давления при вакуумной разгонке. Для контроля расхода солевого раствора устанавливается жиклер 14 в виде калиброванного отверстия. В табл. 1 приведены основные технические и конструктивные характеристики установки.
Таблица 1.
Технические и конструктивные характеристики ректификационной установки
| Наименование характеристики | Значение | |
| Внутренний диаметр колонны dcol × 103, м | 48 | |
| Высота насадочного слоя Hp, м | 2 | |
| Тип насадки | Спирально-призматическая | |
| Диаметр насадки dp × 103, м | 3 | |
| Организация системы отвода тепла | Водоснабжение и канализация | |
| Поверхность теплообмена дефлегматора, м2 | 0.25 | |
| Объем × 103, м3 | кубовой емкости VW | 14 |
| дистиллятной емкости | 3 | |
| емкости солевого раствора | 5 | |
| приемной емкости | 20 | |
| емкости головных фракций VD | 0.1 | |
На этой колонне был проведен ряд экспериментов по определению расхода пара в колонне G и ее гидравлического сопротивления в зависимости от нагрузки на кипятильник Qr при атмосферном давлении. Результаты представлены в табл. 2 и на рис. 2.
Таблица 2.
Тепловые и кинетические характеристики колонны при атмосферном давлении
| Qr, кВт | 0.5 | 0.75 | 1 | 1.25 | 1.5 | 1.65 |
| G × 103, кг/с | 0.0572 | 0.1663 | 0.2682 | 0.3933 | 0.4867 | 0.5238 |
| ∆Р, мм Hg | 5.2 | 14.0 | 22.6 | 33.1 | 40.9 | 44.1 |
| ⱳ0, м/с | 0.053 | 0.154 | 0.248 | 0.364 | 0.451 | 0.485 |
Рис. 2.
Зависимость расхода пара (а) и гидравлического сопротивления (б) колонны от тепловой нагрузки на кипятильник при Р = 0.1 МПа.
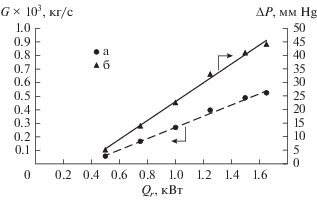
Из рисунка видно, что в исследованном диапазоне мощности нагревательного элемента захлебывание колонны не было достигнуто. Следует отметить, что значение потока пара G = 0.5238 × × 10–3 кг/с при Qr = 1.65 кВт в безотборном режиме соответствует удельной нагрузке по жидкости Lуд = 1042.6 кг/(м2 ч). Исходя из литературных данных, для аналогичной насадки величина предельной пропускной способности при Р = 0.1 МПа составляет 3062 кг/(м2 ч) и не зависит от диаметра колонны [3, 4]. Таким образом, максимальная удельная нагрузка в данном эксперименте не превышала 35% от максимальной.
Расход пара (G, кг/с) от мощности нагрева (Qr, кВт) испарителя может быть определен с погрешностью не более 5% по экспериментально установленной зависимости
ОЦЕНКА ЭФФЕКТИВНОСТИ РАЗДЕЛЕНИЯ НА ОСНОВЕ ЕДИНИЧНОГО ИЗОТОПНОГО ЭФФЕКТА
В настоящее время, благодаря обширному исследованию различных типов насадок [4, 13–17] и процесса экстрактивной ректификации [18, 19], представленные в литературе зависимости позволяют с достаточной точностью оценить массообменные и гидродинамические характеристики процесса. В связи с этим представляется интересным оценить и сопоставить параметры процесса разделения изотопов в описанной установке при использовании ректификации солевых растворов и чистой воды.
Оценка проводилась на примере задачи концентрирования дейтерия и кислорода-18 от природного уровня в колонне с нижним узлом обращения потоков, работающей по “открытой” схеме. Концентрация тяжелых изотопов в питающем потоке была принята равной 140 млн–1 по дейтерию и 1966 млн–1 по кислороду-18 в соответствии с результатами анализа в РХТУ им. Д.И. Менделеева на спектральном жидкостном изотопном анализаторе T-LWIA-45-EP, предназначенном для анализа воды на уровне природного содержания дейтерия и кислорода-18 с погрешностью измерения ±0.0001 ат. % (1 млн–1). Поскольку колонна работает в узком диапазоне концентраций, примем, что рабочая и равновесная линии являются прямыми.
Оценочный расчет эффективности разделения изотопов водорода и кислорода воды методом обычной и солевой ректификации проводили при следующих условиях: коэффициент разделения всех ступеней одинаков и равен однократному разделительному эффекту при температуре 100°С (при P = 0.1 МПа). Разделение изотопов по дейтерию и кислороду-18 рассматривается как два отдельных процесса.
Величина питающего потока (L = 104.76 моль/ч) была принята равной наибольшему достигнутому в настоящей работе потоку пара при мощности нагрева в кубе Qr = 1.65 кВт. При этом скорость потока пара по колонне будет равна w0 = 0.485 м/с.
Значение высоты, эквивалентной теоретической ступени разделения, ВЭТС = 2 см было принято на основе усреднения литературных данных по определению массообменных характеристик спирально-призматической насадкой размером 3 × 3 × 0.2 мм при ректификации воды в условиях, сопоставимых с принятыми для расчета [3, 4, 16, 17]. Тогда в описанной выше колонне при высоте насадочного слоя 2 м содержится N = 100 теоретических ступеней разделения.
Значения коэффициентов разделения определяли по следующим эмпирическим уравнениям, справедливым в диапазоне температур 273–403 К [17, 20]:
(2)
${\text{ln}}{{\alpha }_{{{\text{H}} - {\text{D}}}}} = \frac{{26398.8}}{{{{T}^{2}}}} - \frac{{89.6065}}{T} + 0.075802,$(3)
${\text{ln}}{{\alpha }_{{{}^{{16}}{\text{O}} - {}^{{18}}{\text{O}}}}} = \frac{{{\text{1037}}}}{{{{T}^{2}}}} - \frac{{0.4156}}{T} - 0.00207.$Для расчета параметров колонны использовали следующие уравнения [17]:
(6)
$\gamma = \frac{{B{{x}_{b}}}}{{L{{x}_{f}}}} = {{\gamma }_{m}}\theta = \frac{{\alpha - 1}}{\alpha }\theta ,$(8)
$K = \frac{{{{x}_{b}}\left( {1 - {{x}_{f}}} \right)}}{{{{x}_{f}}\left( {1 - {{x}_{b}}} \right)}},$Оценка времени накопления целевого изотопа (τ) проводилась по уравнению, предложенному С.И. Бабковым и Н.М. Жаворонковым в предположении, что степень приближения к стационарному состоянию в любой момент времени на всех теоретических ступенях разделения одинакова [17]:
(11)
$\begin{gathered} \tau = \frac{\alpha }{{\alpha - {\text{1}}}}\ln \frac{{{{K}_{m}} - 1}}{{{{K}_{m}} - K}} \times \\ \times \,\,\left\{ {\frac{{\Delta H}}{L}\left[ {\frac{{\alpha \left( {{{K}_{m}} - 1} \right)}}{{\alpha - 1}} - N} \right] + \frac{{\Delta {{H}_{{\text{к}}}}}}{L}\left( {{{K}_{m}} - 1} \right)} \right\}, \\ \end{gathered} $Для оценочного расчета принимали, что задержка в кубе составляет ΔHк = 444.44 моль, что соответствует заполнению объема кубовой емкости VW не более чем на 60% (см. табл. 1). На основании литературных данных величина задержки воды на мелкой насадке составляет от 8 до 12% объема насадочного слоя [17]. На основании этого, а также с учетом опыта использования аналогичной насадки в работе [3], для расчета было принято ΔH = 16.08 моль.
В табл. 3 и 4 представлены результаты оценочных расчетов разделительной способности созданной экспериментальной колонны в зависимости от величины относительного отбора для условий ректификации чистой воды.
Таблица 3.
Влияние относительного отбора на параметры процесса разделения изотопов водорода при ректификации воды в колонне с фиксированным числом теоретических ступеней разделения N = 100 при Т = 100°С, Р = = 0.1 МПа, αH–D = 1.026, L = 104.76 моль/ч, xf = 140 млн–1
| θ | 0 | 0.4 | 0.6 | 0.7 | 0.8 | 0.9 |
| K | 13.024 | 7.963 | 5.642 | 4.482 | 3.321 | 2.161 |
| B, моль/ч | 0 | 0.133 | 0.282 | 0.415 | 0.639 | 1.106 |
| xb, млн–1 | 1823.4 | 1115.0 | 789.9 | 627.4 | 465.0 | 302.5 |
| y1, млн–1 | 136.4 | 138.8 | 138.2 | 138.1 | 138.0 | 138.0 |
| λ | 1 | 0.998727 | 0.997305 | 0.996041 | 0.993900 | 0.989443 |
| τ, ч | ∞ | 1762.0 | 993.2 | 695.9 | 436.6 | 206.6 |
Таблица 4.
Влияние относительного отбора на параметры процесса разделения изотопов кислорода при ректификации воды в колонне с фиксированным числом теоретических ступеней разделения N = 100 при Т = 100°С, Р = 0.1 МПа, ${{\alpha }_{{{}^{{16}}{\text{O}} - {}^{{18}}{\text{O}}}}}$ = 1.0043, L = 104.76 моль/ч, xf = 1966 млн–1
| θ | 0 | 0.4 | 0.6 | 0.7 | 0.8 | 0.9 |
| K | 1.536 | 1.321 | 1.214 | 1.160 | 1.106 | 1.053 |
| B, моль/ч | 0 | 0.1358 | 0.2217 | 0.2706 | 0.3242 | 0.3832 |
| xb, млн–1 | 3019.8 | 2596.4 | 2386.2 | 2281.2 | 2176.1 | 2071.1 |
| y1, млн–1 | 1957.6 | 1965.2 | 1965.2 | 1965.2 | 1965.3 | 1965.6 |
| λ | 1 | 0.998703 | 0.997880 | 0.997417 | 0.996905 | 0.996342 |
| τ, ч | ∞ | 492.6 | 274.9 | 192.0 | 120.1 | 56.7 |
Из представленных данных видно, что для колонны с фиксированным числом теоретических ступеней разделения уменьшение относительного отбора θ приводит к росту степени разделения в колонне и, следовательно, концентрации тяжелого изотопа в продукте xb, которые стремятся к своим предельным значениям, соответствующим безотборному режиму при θ = 0. Одновременно с этим происходит резкий рост времени τ, необходимого для достижения стационарного профиля концентраций в разделительной установке. Следует также отметить, что вследствие низких значений коэффициентов разделения в рассматриваемых изотопных системах значения максимальной степени извлечения крайне невысоки и составляют для заданных условий разделения γm ≈ 0.0253 для системы H−D и γm ≈ 0.0043 для системы 16O−18O. В соответствии с зависимостями (2), (3), (6), повысить максимальное извлечение возможно за счет увеличения коэффициента разделения. Вследствие этого обычно разделение изотопов методом ректификации воды проводят при пониженных температурах под вакуумом [1–6, 15–17]. Вторым путем является поиск новых систем, характеризующихся более высоким однократным разделительным изотопным эффектом.
Представляет интерес оценить влияние добавки в качестве разделяющего агента карбамида на эффективность фракционирования изотопов водорода H−D, а также влияние хлорида магния на разделение изотопов 16О−18О воды.
Согласно данным работ [10, 11, 21] карбамид увеличивает коэффициент относительной летучести изотопов водорода воды. Для сравнения изотопного солевого эффекта карбамида воспользуемся данными работы [21]. Для 9 моляльного раствора карбамида функция зависимости изотопного солевого эффекта от температуры имеет вид
где $\Gamma = {{{{\alpha }_{{{\text{salt}}}}}} \mathord{\left/ {\vphantom {{{{\alpha }_{{{\text{salt}}}}}} {{{\alpha }_{{{\text{H}} - {\text{D}}}}}}}} \right. \kern-0em} {{{\alpha }_{{{\text{H}} - {\text{D}}}}}}}.$ Таким образом, рассчитав αH–D по уравнению (2), можно определить значение αsalt.Таблица 5.
Значение коэффициента относительной летучести в присутствии солей в зависимости от температуры
| t, °С | 50 | 60 | 70 | 80 | 90 | 100 |
| H–Durea 9M | 1.08197 | 1.07670 | 1.07229 | 1.06862 | 1.06557 | 1.06306 |
| $^{{16}}{\text{O}}{\kern 1pt} - {{{\kern 1pt} }^{{18}}}{\text{O}}_{{{\text{MgCl}}_{2}^{{}}\,5\,{\text{M}}}}^{{}}$ | 1.01259 | – | 1.01051 | – | – | 1.00877 |
В работе [12] приведены данные по величине изотопного солевого эффекта для пары 16О−18О при различных концентрациях MgCl2 в диапазоне температур от 50 до 100°С. Зависимость изотопного солевого эффекта для изотопов кислорода от моляльности раствора MgCl2 при 50°С экстраполировали по данным работы [12]
(13)
$\Gamma _{{{\text{MgC}}{{{\text{l}}}_{{\text{2}}}}}}^{{50^\circ {\text{C}}}} = \frac{1}{{\exp (1.000227C \times {{{10}}^{{ - 3}}})}},$Данные уравнения (13) экстраполировали для расчета коэффициента относительной летучести изотопов кислорода в 5 М растворе MgCl2 при 50°С.
Зависимость коэффициента относительной летучести изотопов водорода и кислорода воды в присутствии солей (карбамида и MgCl2 соответственно) приведена в табл. 6 и на рис. 3.
Таблица 6.
Влияние относительного отбора на параметры процесса разделения изотопов водорода при ректификации 9 М раствора карбамида в колонне с фиксированным числом теоретических ступеней разделения N = 100 при Т = 100°С, Р = 0.1 МПа, αH–D = 1.0631, L = 104.76 моль/ч, xf = 140 млн–1
| θ | 0 | 0.4 | 0.6 | 0.7 | 0.8 | 0.9 |
| K | 454.4 | 227.3 | 151.9 | 114.2 | 76.4 | 38.7 |
| B, моль/ч | 0 | 0.0109 | 0.0246 | 0.03812 | 0.0651 | 0.1445 |
| xb, млн–1 | 63616 | 31826 | 21264 | 15983 | 10702 | 5421 |
| y1, млн–1 | 131.7 | 136.7 | 135.1 | 134.2 | 133.4 | 132.7 |
| λ | 1 | 0.999895 | 0.999765 | 0.999636 | 0.999379 | 0.998620 |
| τ, ч | ∞ | 22546 | 13193 | 9362 | 5934 | 2832 |
Рис. 3.
Зависимость коэффициента разделения изотопов воды от температуры: (а) – H−D в 9 моляльном растворе карбамида; (б) – 18О−16О в 5 моляльном растворе MgCl2; 1 – чистая вода; 2 – солевой раствор.
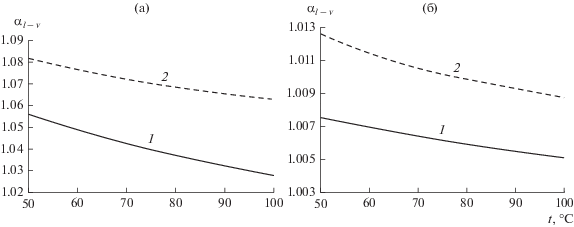
Из анализа рис. 3 и табл. 6 следует, что присутствие солей существенно увеличивает значение α как для разделения в системе H−D в присутствии карбамида, так и для системы 16О−18О в присутствии MgCl2. Величина изотопного солевого эффекта с понижением температуры для MgCl2 возрастает, а для карбамида несколько снижается.
Применение карбамида неэффективно в случае разделения изотопов кислорода, а MgCl2 в случае изотопов водорода, что приводит к необходимости рассматривать фракционирование H−D и 16О−18О по отдельности. При этом однократные изотопные эффекты фракционирования изотопов водорода и кислорода воды в присутствии солей позволяют предположить существенное повышение эффективности процесса разделения. Результаты расчета процессов разделения для данных солевых систем представлены в табл. 6 и 7.
Таблица 7.
Влияние относительного отбора на параметры процесса разделения изотопов кислорода при ректификации 5 М раствора MgCl2 в колонне с фиксированным числом теоретических ступеней разделения N = 100 при Т = 100°С, Р = 0.1 МПа,${{\alpha }_{{{}^{{16}}{\text{O}} - {}^{{18}}{\text{O}}}}}$ = 1.00877, L = 104.76 моль/ч, xf = 1966 млн–1
| θ | 0 | 0.4 | 0.6 | 0.7 | 0.8 | 0.9 |
| K | 2.395 | 1.831 | 1.554 | 1.416 | 1.278 | 1.139 |
| B, моль/ч | 0 | 0.1989 | 0.3516 | 0.4504 | 0.5705 | 0.7199 |
| xb, млн–1 | 4708.6 | 3600.0 | 3055.5 | 2783.1 | 2510.8 | 2238.4 |
| y1, млн–1 | 1948.9 | 1961.9 | 1962.3 | 1962.5 | 1963.0 | 1964.1 |
| λ | 1 | 0.99810 | 0.99664 | 0.99570 | 0.99455 | 0.993128 |
| τ, ч | ∞ | 626.6 | 350.1 | 244.6 | 153.1 | 72.3 |
Совокупность рассчитанных соотношений и проведенных измерений позволяет провести сопоставительную оценку влияния солевого разделяющего агента на эффективность процесса фракционирования изотопов водорода и кислорода воды. Из данных табл. 3 и 6 видно, что проведение ректификации в присутствии 9 М раствора карбамида позволяет увеличить степень разделения более чем в 10 раз по сравнению с ректификацией чистой воды. Введение в ректификационную систему MgCl2 оказало существенно меньшее влияние на эффективность разделения изотопов кислорода, однако позволило увеличить степень разделения колонны до 1.5 раз. При этом следует отметить, что рост разделительной способности колонны привел к значительному увеличению времени накопления. Учитывая, что наибольший вклад в расчетное время достижения стационарного состояния колонны оказывает нижний узел обращения потоков, при проведении экспериментов по изучению массообменных характеристик изотопного обмена при солевой ректификации необходимо использовать возможности данной установки для проведения экспериментов в режиме колонны с независимыми потоками с введением изотопной метки.
ЗАКЛЮЧЕНИЕ
Сконструирована и смонтирована новая экспериментальная установка для разделения изотопов водорода и кислорода воды. Осуществлены предварительные испытания по определению гидродинамических характеристик ректификационной колонны. Проведены оценочные расчеты параметров работы ректификационной колонны в процессе фракционирования изотопов водорода и кислорода воды природного изотопного состава ректификацией воды и водных солевых растворов. Проведенные оценки позволяют сделать вывод, что введение солевых агентов при прочих равных условиях может существенно увеличить эффективность процесса разделения.
Таким образом, подтверждена целесообразность разработки процесса солевой ректификации воды для получения тяжелой и легкой воды, а также концентрированных растворов 18O.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 18-13-00475).
ОБОЗНАЧЕНИЯ
| τ | время накопления целевого изотопа, ч |
| С | моляльность, моль соли/кг Н2О |
| d | диаметр, м |
| G | расход пара, кг/с |
| Hp | высота насадочной части колонны, м |
| ΔH | задержка на насадке колонны, моль |
| ΔHк | задержка в кубе, моль |
| K | степень разделения |
| L | расход жидкости по колонне, кг/с |
| m | масса, кг |
| N | число теоретических ступеней разделения |
| n | количество вещества, моль |
| ∆P | перепад давления, мм Hg |
| Qr | нагрузка на кипятильник, кВт |
| S | площадь сечения колонны, м2 |
| Т | температура, К |
| t | температура, °С |
| U | плотность орошения, м3/(м2 с) |
| V | объем, м3 |
| xi | концентрация тяжелого изотопа в жидкости, млн–1 |
| α | коэффициент относительной летучести компонентов |
| Γ | изотопный солевой эффект |
| w0 = $\frac{{{G \mathord{\left/ {\vphantom {G {{{{\rho }}_{{v}}}}}} \right. \kern-0em} {{{{\rho }}_{{v}}}}}}}{S}$ | приведенная скорость пара в расчете на полное сечение колонны, м/с |
| y | концентрация тяжелого изотопа в паре, млн–1 |
| B | поток концентрата, моль |
| θ | относительный отбор; |
| γ | степень извлечения |
| λ | мольное отношение потоков. |
ИНДЕКСЫ
Список литературы
Жаворонков Н.М., Уваров О.В., Сокольский В.А. Ректификационная колонна для получения тяжелокислородной воды // Хим. пром-сть. 1956. № 7. С. 20.
Жаворонков Н.М., Малюсов В.А., Малафеев Н.А., Ромейков Р.Н. Исследование эффективности регулярных насадок в процессе ректификации воды // Хим. пром-сть. 1962. № 7. С. 53.
Магомедбеков Э.П., Селиваненко И.Л., Кулов Н.Н., Веретенникова Г.В. Кондиционирование тяжелокислородной воды методом ректификации под вакуумом // Теор. осн. хим. технол. 2019. Т. 53. № 5. С. 493.
Магомедбеков Э.П., Белкин Д.Ю., Селиваненко И.Л., Растунова И.Л. Массообменные характеристики спирально-призматической насадки в колоннах изотопного обмена при ректификации воды под вакуумом // Теор. осн. хим. технол. 2016. Т. 50. № 5. С. 502.
Магомедбеков Э.П., Растунова И.Л., Селиванен-ко И.Л., Кулов Н.Н. Распределение тяжелых изотопов водорода и кислорода при ректификации воды // Теор. осн. хим. технол. 2019. Т. 53. № 2. С. 123.
Lashkarboluki R., Mallah M.H. A rate-based dynamic model of multicomponent distillation column for 18O isotope separation // Sep. Purif. Technol. 2019. V. 228. P. 115745.
O'Neil J.R., Truesdell A.H. Oxygen isotope fractionation studies of solute-water interactions // Stable Isotope Geochemistry: A Tribute to Samuel Epstein (The Geochemical Society. Special Publication No. 3) / Eds. Taylor H.P.Jr., O’Neil J.R., Kaplan I.R. Washington, DC: Geochemical Society, 1991. P. 17.
Pradhananga T.M., Matsuo S. D/H Fractionation in Sulfate Hydrate-Water Systems // J. Phys. Chem. 1985. V. 89. P. 1869.
Driesner T., Ha T.-K., Seward T.M. Oxygen and hydrogen isotope fractionation by hydration complexes of Li+, Na+, K+, Mg2+, F–, Cl–, and Br–: A theoretical study // Geochim. Cosmochim. Acta. 2000. V. 64. № 17. P. 3007. https://doi.org/10.1016/S0016-7037(00)00407-5
Kakiuchi M. Distribution of isotopic water molecules, H2O, HDO, and D2O, in vapor and liquid phases in pure water and aqueous solution systems // Geochim. Cosmochim. Acta. 2000. V. 64. № 9. P. 1485.
Kakiuchi M., Matsuo S. Fractionation of hydrogen and oxygen isotopes between hydrated and free water molecules in aqueous urea solution // J. Phys. Chem. 1985. V. 89. P. 4627.
Horita J., Wesolowski D.J., Cole D.R. The activity-composition relationship of oxygen and hydrogen isotopes in aqueous salt solutions: I. Vapor-liquid water equilibration of single salt solutions from 50 to 100°C // Geochim. Cosmochim. Acta. 1993. V. 57. P. 2797.
Сокол Б.А., Чернышев А.К., Баранов Д.А., Беренгартен М.Г., Левин Б.В. Насадки массообменных колонн. М.: ИНФОХИМ, 2009.
Каган А.М., Лаптев А.Г., Пушнов А.С., Фарахов М.И. Контактные насадки промышленных тепломассообменных аппаратов. Казань: Отечество, 2013.
Магомедбеков Э.П., Белкин Д.Ю., Селиваненко И.Л., Растунова И.Л. Массообменные характеристики регулярной рулонной ленточно-винтовой насадки в колоннах изотопного обмена при ректификации воды под вакуумом // Теор. осн. хим. технол. 2016. Т. 50. № 4. С. 408.
Аунг Т.М., Селиваненко И.Л. Эффективность разделения изотопов водорода ректификацией воды в колоннах с пленочным и затопленным режимах работы насадки // Хим. пром-сть сегодня. 2017. № 2. С. 3.
Andreev B.M., Magomedbekov E.P., Raitman A.A., Rozenkevich M.B., Sakharovsky Yu.A., Khoroshilov A.V. Separation of Isotopes of Biogenic Elements in Two-Phase Systems. Amsterdam: Elsevier, 2007.
Lei Z., Li C., Chen B. Extractive Distillation: A Review // Sep. Purif. Rev. 2003. V. 32. № 2. P. 121. https://doi.org/10.1081/SPM-120026627
Иванов И.В., Лотхов В.А., Моисеева К.А., Кулов Н.Н. Массообмен в насадочной колонне экстрактивной ректификации // Теор. осн. хим. технол. 2016. Т. 50. № 5. С. 485.
Van Hook W.A. Vapor pressures of the isotopic waters and ices // J. Phys. Chem. 1968. V. 72. № 2. P. 1234.
Кулов Н.Н., Полковниченко А.В., Лупачев Е.В., Вошкин А.А., Магомедбеков Э.П. Распределение изотопов между фазами при парожидкостном равновесии водных солевых растворов // Теор. осн. хим. технол. 2020. Т. 54. № 1. С. 1.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


