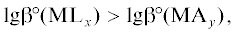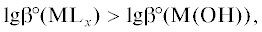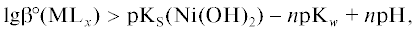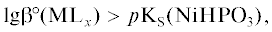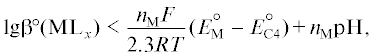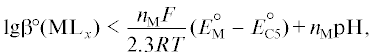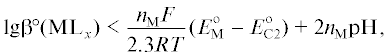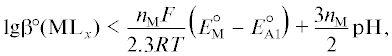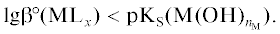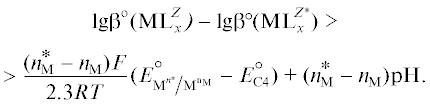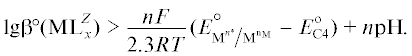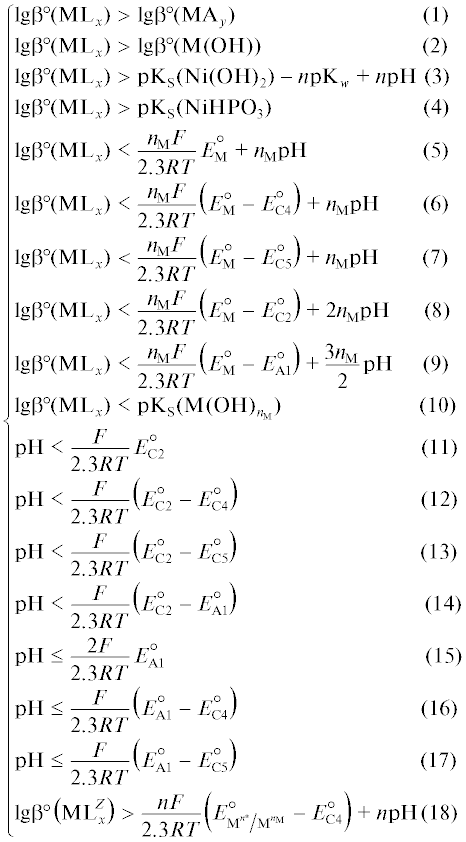Теоретические основы химической технологии, 2020, T. 54, № 3, стр. 354-361
Физико-химическая модель выбора комплексных соединений при химическом осаждении металлических покрытий
Е. Г. Винокуров a, b, *, Г. М. Мухаметова a, Т. Ф. Бурухина a, **, В. Д. Скопинцев c, В. П. Мешалкин a
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Всероссийский институт научной и технической информации РАН
Москва, Россия
c Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Москва, Россия
* E-mail: vin-62@mail.ru
** E-mail: tfburukhina@muctr.ru
Поступила в редакцию 21.01.2020
После доработки 24.01.2020
Принята к публикации 24.01.2020
Аннотация
Предложена физико-химическая модель выбора лиганда при химическом осаждении сплавов металл–фосфор, основанная на определении условий протекания электрохимических реакций, вызывающих формирование сплава, и минимизации возможных побочных реакций, препятствующих качественному проведению процесса осаждения. На основе полученной физико-химической модели был определен оптимальный диапазон значений констант устойчивости и рН при химическом никелировании. Показано, что для интервала рН 7–9, который соответствует максимальным скоростям осаждения, константы устойчивости принимают значения от 5 до 10; проведение процесса в более щелочных растворах требует применения более устойчивых комплексов. Прогностическая способность предложенной модели подтверждена экспериментальными исследованиями процесса химического никелирования из растворов различного лигандного состава.
ВВЕДЕНИЕ
В технике большое значение имеют защитные покрытия, которые не только предохраняют металлическую подложку от коррозии, но и придают поверхности ряд функциональных свойств: повышенные микротвердость, износостойкость, способность к пайке, сопротивление воздействию агрессивных сред и пр. [1–9]. В зависимости от условий получаемые покрытия могут характеризоваться также различными декоративными свойствами [6, 10–12].
Химический способ нанесения металлических покрытий характеризуется равномерностью толщины покрытий по поверхности сложнопрофилированных изделий.
Для химического нанесения металлических покрытий предложены растворы, содержащие соли металлов, восстановитель, стабилизатор и лиганд. Применение лигандов вызвано необходимостью предупреждения реакции в объеме раствора, приводящей к его разложению. Так, в качестве лигандов для ионов никеля применяют цитраты, пирофосфаты, сукцинаты, пропионаты, глицинаты и многие другие [13–18]. Несмотря на то, что в литературе широко описано влияние различных лигандов на скорость осаждения, качество или состав покрытий [16, 18, 19], подбор лигандов в большинстве случаев проводится опытным путем.
В то же время на примере электроосаждения хрома и различных сплавов показана значительная роль комплексных соединений [20–22], в том числе гидроксокомплексов [23], и предложены модели выбора лигандов для разработки новых составов растворов для нанесения покрытий сплавами и многовалентными металлами [24–27]. В ряде работ представлено модельное описание процесса химического никелирования [28, 29], выработаны подходы к построению модели для выбора лиганда для процесса электроосаждения сплавов [30]. Интересной задачей представляется создание модели, позволяющей выбрать лиганд для осаждения покрытий Ni–P. В данной работе, основываясь на методике построения физико-химической модели, представленной в [30], была предпринята попытка теоретически обосновать выбор лиганда для процессов химического осаждения сплавов металл–фосфор, и прежде всего для наиболее распространенного процесса химического никелирования.
Цель настоящей работы – построить модель выбора комплексных соединений (лиганда) для получения химическим осаждением сплава металл–фосфор.
МЕТОДИКА ЭКСПЕРИМЕНТА
Для подтверждения оценки модели проводили химическое осаждение покрытий сплавом Ni–P из растворов следующего состава [29, 31]: сульфат никеля 0.12 М, гипофосфит натрия 0.37 М, ацетат свинца 10–5 М, а также лиганд Х, где Х – концентрация лиганда, обеспечивающая насыщение внутренней координационной сферы комплексного соединения (КС) (NH3Х = 1.44 М; пирофосфат натрия (Na4P2O7) – 0.26 М, аминоуксусная кислота (NH2CH2COOH) – 0.39 М; цитрат натрия (C6H5O7Na3) – 0.15 М; сульфосалициловая кислота (C6H6O6S) – 0.26 М; винная кислота ((СHOH)2(COOH)2) – 0.26 М; янтарная кислота ((СH2COOH)2) – 0.15 М; малоновая кислота (СH2(СOOH)2) – 0.39 М; ацетат натрия (СH3COONa) – 0.26 М; сульфат натрия (Na2SO4) – 0.12 М. Процесс осаждения проводили при комнатной температуре 20–22°С. Для растворов устанавливали значения рН 3–11 с помощью корректировки раствором NaOH или H2SO4. Удельная площадь загрузки составляла 2.5 дм2/л.
Стальные пластины протирали тканью, смоченной керосином, для удаления следов смазки, затем обезжиривали венской известью, промывали проточной водой, а затем дистиллированной водой и сушили на воздухе. Перед началом эксперимента стальную пластину погружали в раствор H2SO4 (10 мас. %) для активирования на 10 с, затем промывали дистиллированной водой.
Скорость осаждения r (мг см–2 ч–1) рассчитывали по следующей формуле:
где m – масса покрытия, мг; S – площадь поверхности образца, см2; t – время осаждения покрытия, ч.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химическая модель выбора лигандов для химического осаждения сплава металл–фосфор. Физико-химическая модель выбора лигандов для химического осаждения сплава металл–фосфор построена на основе термодинамических принципов. При построении модели необходимо рассмотреть возможные электрохимические и химические реакции, протекающие на поверхности подложки и в объеме раствора, и определить условия, при которых происходит формирование сплава металл–фосфор и устраняются возможные побочные реакции, препятствующие качественному проведению процесса осаждения. Общую схему химического осаждения сплава металл–фосфор можно описать следующими уравнениями полуреакций окисления и восстановления, характеризующимися соответствующими стандартными электродными потенциалами (при активностях всех компонентов системы, равных 1).
Катодные реакции, приводящие к восстановлению металла и фосфора:
(C1)
${{{{{\text{[M}}{{{\text{L}}}_{x}}{\text{]}}}}^{{{{Z}_{A}}}}} + {{n}_{{\text{M}}}}{{{\text{e}}}^{ - }} \to M + x{{{\text{L}}}^{{{{Z}_{L}}}}}{\text{,}}}\,\,\,\,E_{{{\text{С1}}}}^{^\circ },$(C2)
${{{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{2}}}^{ - } + {\text{2}}{{{\text{H}}}^{ + }} + {{{\text{e}}}^{ - }} \to P + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}}}\,\,\,\,E_{{{\text{С2}}}}^{^\circ }.$Параллельно с реакциями (C1) и (C2) может происходить восстановление ионов гидроксония и молекул воды
(C3)
${{\text{2}}{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }} + {\text{2}}{{{\text{e}}}^{ - }} \to {{{\text{H}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}},\,\,\,\,E_{{{\text{C3}}}}^{^\circ },$а также растворенного кислорода
(C4)
${{{{\text{O}}}_{{\text{2}}}} + {\text{4}}{{{\text{H}}}^{ + }} + {\text{4}}{{{\text{e}}}^{ - }} \to {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}},\,\,\,\,E_{{{\text{C4}}}}^{^\circ },$(C5)
${{{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}^{ + }} + {\text{2}}{{{\text{e}}}^{ - }} \to {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}},\,\,\,\,E_{{{\text{C5}}}}^{^\circ }.$Накопление ионов ОН– в приэлектродном слое при недостаточной устойчивости КС ионов металла M вызывает образование различных гидроксокомплексов и в пределе гидроксидов металла M, что приводит к торможению или прекращению протекания реакции (C1). Следовательно, скорость восстановления молекул воды не должна превышать некоторого критического значения.
Анодный процесс при химическом восстановлении ионов металла гипофосфит-ионами описывается уравнениями
(A1)
${{\text{HPO}}_{{\text{3}}}^{{{\text{2}} - }} + {\text{2}}{{{\text{H}}}^{ + }} + {\text{2}}{{{\text{e}}}^{ - }} \to {{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{{\text{2}}}^{ - } + {{{\text{H}}}_{{\text{2}}}}{\text{O}}},\,\,\,\,E_{{{\text{A1}}}}^{^\circ }$или
Накопление ${\text{HPO}}_{{\text{3}}}^{{{\text{2}} - }}$-ионов в растворе при недостаточной устойчивости КС ионов металла М вызывает образование малорастворимых фосфитов металла, что приводит к выделению твердой фазы и разложению раствора.
На основании допущений и подходов, описанных в работах [24, 25], сформулированы следующие логические условия выбора лигандов при создании новых составов растворов для химического осаждения сплава М–Р.
Лиганд должен образовывать с ионами металла М КС, константа устойчивости которого:
1) больше константы устойчивости КС ионов металла с анионами (А) соли
2) больше константы устойчивости гидроксокомплекса металла, т.е.
3) обеспечивает такую устойчивость КС ионов металла, которая не позволяет достигать рН гидроксидообразования; так, при химическом никелировании
4) больше константы устойчивости фосфита металла, например, при химическом никелировании
5) обеспечивает такой стандартный электродный потенциал $E_{{{\text{С1}}}}^{^\circ }$ реакции (C1), который будет положительнее электродного потенциала EС3, равного электродному потенциалу восстановления молекул воды или ионов гидроксония $\left( {{{E}_{{{\text{C3}}}}} = - \frac{{{\text{2}}{\text{.3}}RT}}{F}{\text{pH}}} \right),$ т.е.
выразив $E_{{{\text{С1}}}}^{^\circ }$ через стандартный электродный потенциал реакции ${{{\text{M}}}^{{{{n}_{{\text{M}}}}}}}({\text{aq}}) + {{n}_{{\text{M}}}}{{{\text{e}}}^{ - }} \to {\text{M}}$ и константу устойчивости КС, после несложных преобразований получим
(5)
${{\text{lg}}{{{\beta }}^{{\text{o}}}}{\text{(M}}{{{\text{L}}}_{{\text{x}}}}{\text{)}} < \frac{{{{n}_{{\text{M}}}}F}}{{2.3RT}}E_{{\text{M}}}^{{\text{o}}} + {{n}_{{\text{M}}}}{\text{pH,}}}$6) обеспечивает такой стандартный электродный потенциал $E_{{{\text{С1}}}}^{^\circ }$ реакции (C1), который будет положительнее электродного потенциала восстановления молекул растворенного кислорода EС4 реакции (C4) и EС5 реакции (C5), т.е.
после проведения аналогичных преобразований получим
7) обеспечивает такой стандартный электродный потенциал $E_{{{\text{С1}}}}^{^\circ }$ реакции (C1), который будет положительнее электродного потенциала катодной реакции (C2), т.е.
или, выражая $E_{{{\text{С1}}}}^{^\circ }$ через $E_{{\text{M}}}^{^\circ }$ и lgβ°(MLx), получим
8) обеспечивает такой стандартный электродный потенциал $E_{{{\text{С1}}}}^{^\circ }$ реакции (C1), который будет положительнее электродного потенциала анодной реакции (А1), т.е.
или после преобразований получим
9) меньше величины, обратной произведению растворимости (KS) гидроксида металла (это условие обеспечивает выбор такого лиганда, который не ухудшает очистку сточных вод на стадии нейтрализации), т.е.
Подобные термодинамические условия запишем и для реакций восстановления гипофосфит-иона:
10) электродный потенциал реакции (C2) должен быть положительнее электродного потенциала реакций (C3), (C4) и (C5), т.е.
или после преобразований
(12)
${{\text{pH}} < \frac{F}{{2.3RT}}{\text{(}}E_{{{\text{C2}}}}^{^\circ } - E_{{{\text{C4}}}}^{^\circ }{\text{),}}}$(13)
${{\text{pH}} < \frac{F}{{2.3RT}}{\text{(}}E_{{{\text{C2}}}}^{^\circ } - E_{{{\text{C5}}}}^{^\circ }{\text{),}}}$11) электродный потенциал реакции (C2) должен быть положительнее электродного потенциала реакции (А1), т.е.
или
(14)
${{\text{pH}} < \frac{F}{{2.3RT}}\left( {E_{{{\text{C2}}}}^{^\circ } - E_{{{\text{А1}}}}^{^\circ }} \right).}$Для предотвращения (или минимизации) протекания побочных реакций (C3), (C4) и (C5) их электродный потенциал должен быть меньше или равен электродному потенциалу реакции (А1), т.е.
или после преобразований
(15)
${{\text{pH}} \leqslant \frac{{{\text{2}}F}}{{{\text{2}}{\text{.3}}RT}}E_{{{\text{A1}}}}^{^\circ },}$(16)
${\text{pH}} \leqslant \frac{F}{{{\text{2}}{\text{.3}}RT}}\left( {E_{{{\text{A1}}}}^{^\circ } - E_{{{\text{C4}}}}^{^\circ }} \right){\text{,}}$(17)
${{\text{pH}} \leqslant \frac{F}{{{\text{2}}{\text{.3}}RT}}\left( {E_{{{\text{A1}}}}^{^\circ } - E_{{{\text{C5}}}}^{^\circ }} \right).}$Некоторые ионы металлов, например Co2+, Fe2+, Cr2+, могут окисляться растворенным кислородом. Для предотвращения этого процесса необходимо, чтобы стандартный электродный потенциал реакции ${{{\text{[}}{{{\text{M}}}^{{n_{{\text{M}}}^{{\text{*}}}}}}{{{\text{L}}}_{x}}{\text{]}}}^{Z}} \to $ ${{{\text{[}}{{{\text{M}}}^{{{{n}_{{\text{M}}}}}}}{{{\text{L}}}_{x}}{\text{]}}}^{Z}}$ + $\left[ {n_{{\text{M}}}^{*} - {{n}_{{\text{M}}}}} \right]{{{\text{e}}}^{ - }}$ был больше электродного потенциала реакции (C4), т.е.
или
Учитывая, что 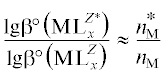 [32], получим
[32], получим
Объединением всех математических выражений (1)–(18) получаем систему неравенств, представляющую математическое описание физико-химической модели выбора комплексных соединений ионов металла (лигандов), которая позволяет по значениям констант устойчивости комплексов металла разработать раствор для химического осаждения покрытий сплавом металл–фосфор:
После подстановки численных значений констант (R, F, n) и температуры, например, равной 298 К, в систему неравенств (19) и ее решения графическим методом в координатах lgβ°–pH получают допустимую область $\Omega $ значений логарифмов констант устойчивости комплексов ионов металлов M и рН раствора, удовлетворяющую всем (или максимально возможному числу) условиям выбора лигандов.
Численное моделирование и сопоставление результатов моделирования с экспериментальными данными. Для верификации прогноза физико-химической модели рассмотрим решение модели (19) на примере химического осаждения никель-фосфорных покрытий. Подставляя численные значения физико-химических характеристик, представленных в табл. 1, в систему (19), получаем набор условий (20):
Таблица 1.
Значения электродных потенциалов электрохимических реакций и констант равновесия с участием никельсодержащих частиц
| Параметр и единицы измерения | Значение | Литература |
|---|---|---|
| $E_{{\text{M}}}^{^\circ }$, В | –0.250 | [33] |
| $E_{{{\text{C2}}}}^{^\circ }$, В | –0.248 | [33] |
| $E_{{{\text{C4}}}}^{^\circ }$, В | +1.229 | [33] |
| $E_{{{\text{C5}}}}^{^\circ }$,В | +0.682 | [33] |
| $E_{{{\text{A1}}}}^{^\circ }$, В | –0.326 | [33] |
| pKS(Ni(OH)2) | 14.70 | [34] |
| pKS(NiHPO3) | 4.6* | – |
| lgβ°(NiOH) | 4.14 | [34] |
| lgβ°(NiSO4) | 2.32 | [34] |
* Значение вычислено по данным о растворимости фосфита никеля [35].
Решая полученную систему графическим методом (рис. 1), выделим область Ω предпочтительных значений логарифмов констант устойчивости КС ионов никеля и рН раствора, соответствующих большинству условий (1)–(18) выбора лиганда и позволяющих проводить химическое осаждение покрытий сплавом Ni–P. Неравенства (11)–(13), (15)–(17) и (18) при поиске решения не учитывались, так как численные значения границ не имеют физического смысла или практически не достижимы.
Рис. 1.
Графическое определение допустимой области Ω значений логарифмов констант устойчивости комплексов Ni(II) и рН растворов, допускающих осаждение покрытий сплавом Ni–P: 1–14 соответствуют обозначениям неравенств системы (19), точки отражают экспериментальные значения логарифмов констант устойчивости комплексов со следующими лигандами: пирофосфат-ион (Р2О7), тартрат-ион (Tart), сукцинат-ион (Suc), цитрат-ион (Cit), сульфосалицилат-ион (Ssal), ацетат-ион (Ac), сульфат-ион (SO4), малонат-ион (Mal), аммиак (NH3). Числа у обозначения лигандов указывают на скорость осаждения покрытий (в мг см–2 ч–1). Для наглядности линейный размер точки соответствует скорости осаждения покрытий.
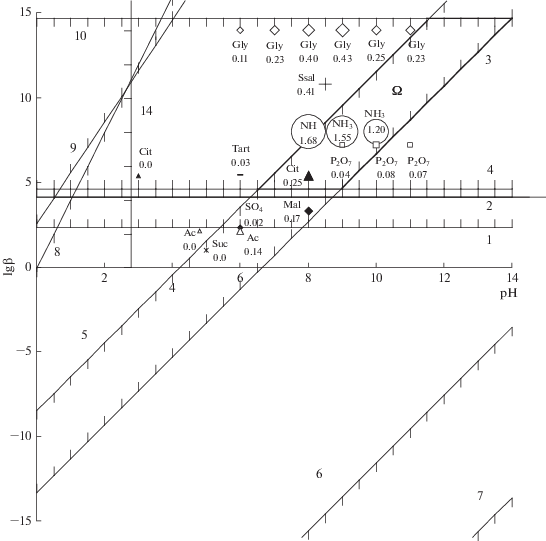
Согласно прогнозу модели предпочтительный диапазон констант устойчивости КС никеля зависит от рН раствора (рис. 1, область Ω, ограниченная полужирными линиями) и лежит в диапазоне значений от 4.6 до 10 при рН 6.5–9.0 и смещается в сторону более устойчивых комплексов при отклонении рН в сторону сильнощелочных растворов.
Сравнение констант устойчивости [34, 36] некоторых комплексов никеля(II) (точки на рис. 1) с прогнозом модели показало, что данные для глицинатных, сульфосалицилатных, аммиакатных, пирофосфатных и цитратных КС находятся в области Ω и рассмотренные КС могут быть использованы для химического нанесения покрытий сплавом никель–фосфор.
Согласно прогнозу модели осаждение сплава Ni–P с заметной скоростью при комнатной температуре невозможно из раствора сульфатных, ацетатных и сукцинатных комплексов никеля. Тем не менее в литературе приводятся составы ацетатного, янтарнокислого [37] растворов (рН 4.5) для осаждения сплава Ni–P. Химическое осаждение сплава из таких растворов с заметной скоростью, вероятно, возможно лишь при повышенных температурах. Однако жизненный цикл этих растворов невелик, так как происходит накопление фосфит-ионов и выделение осадка фосфита никеля, что согласуется с прогнозом модели, в частности с несоблюдением для этой системы условия (4), которое задает необходимую устойчивость КС для предотвращения образования NiHPO3.
Для экспериментального подтверждения прогноза модели определяли скорость осаждения покрытий сплавом Ni–P из растворов сульфата никеля в присутствии различных лигандов в широком диапазоне рН.
Исследование влияния pH раствора на скорость осаждения покрытий из растворов глицинатных, аммиакатных и пирофосфатных комплексов показало (рис. 1), что максимальная скорость достигается соответственно при рН 9, 8 и 10, что соответствует прогнозу модели. Данные по осаждению покрытий из растворов комплексов никеля с анионами гидроксикарбоновых кислот (Cit, Tart) также соответствуют прогнозу модели: при смещении рН этих растворов от 8 в кислую область (рН 6 и 3) происходит значительное уменьшение скорости осаждения покрытий.
Влияние логарифма константы устойчивости КС на скорость осаждения покрытий при постоянном рН, равном 8, также подтверждает прогноз модели, так как наивысшая скорость осаждения покрытий наблюдается из растворов аммиакатных КС никеля, устойчивость которых соответствует области Ω решения модели (рис. 1). Как уменьшение (цитратные, пирофосфатные КС никеля), так и увеличение (сульфосалицилатные и глицинатные КС никеля) устойчивости КС, т.е. приближение или выход за границы области Ω решения модели, приводит к уменьшению скорости осаждения по сравнению с данными для аммиакатных КС никеля.
Оценивая соответствие экспериментальных данных прогнозу модели, помимо устойчивости КС необходимо подчеркнуть роль таких характеристик КС, как их зарядовое число и дентатность лиганда, что нашло отражение в ранее опубликованных авторами результатах [29]: с увеличением дентатности лиганда (пирофосфатные, глицинатные и другие КС) и уменьшением зарядового числа КС (пирофосфатные, цитратные КС) скорость осаждения покрытий снижается. Тем не менее для растворов с каждым из этих комплексных соединений наивысшая скорость осаждения наблюдается в области рН, соответствующей прогнозу физико-химической модели.
ЗАКЛЮЧЕНИЕ
В настоящей работе предложена физико-химическая модель выбора лиганда при химическом осаждении сплавов металл–фосфор, основанная на представлениях о процессе как совокупности электрохимических реакций и устанавливающая связь между константами устойчивости и рН раствора. На основе полученной физико-химической модели был определен оптимальный диапазон значений констант устойчивости и рН при химическом никелировании. Показано, что для интервала рН 7–9, который соответствует максимальным скоростям осаждения, константы устойчивости принимают значения от 5 до 10; проведение процесса в более щелочных растворах требует применения более устойчивых комплексов. Прогностическая способность предложенной модели подтверждена экспериментальными исследованиями процесса химического никелирования из растворов различного лигандного состава.
ОБОЗНАЧЕНИЯ
| E° | стандартный электродный потенциал, В |
| F | постоянная Фарадея, Кл моль–1 |
| m | масса покрытия, г |
| n | количество электронов, участвующих в реакции |
| R | универсальная газовая постоянная, Дж моль–1 К–1 |
| r | скорость осаждения, мг см–2 ч–1 |
| S | площадь покрытия, см2 |
| T | температура, К |
| β | константа устойчивости комплекса |
ИНДЕКСЫ
Список литературы
Encyclopedia of Materials: Science and Technology / Eds. Buschow K.H.J., Cahn R.W.A. Amsterdam: Elsevier, 2001.
Sha W., Wu X., Keong K.G. Electroless Copper and Nickel–Phosphorus Plating: Processing, Characterisation and Modelling. Cambridge: Woodhead, 2011.
Zhang H., Zou J., Lin N., Tang B. Review on Electroless Plating Ni–P Coatings for Improving Surface Performance of Steel // Surf. Rev. Lett. 2014. V. 21. № 4. P. 1430002. https://doi.org/10.1142/s0218625x14300020
Peeters P., Hoorn G.V.D., Daenen T., Kurowski A., Staikov G. Properties of electroless and electroplated Ni–P and its application in microgalvanics // Electrochim. Acta. 2001. V. 47. № 1–2. P. 161. https://doi.org/10.1016/s0013-4686(01)00546-1
Chen B.H., Hong L., Ma Y., Ko T.M. Effects of Surfactants in an Electroless Nickel-Plating Bath on the Properties of Ni−P Alloy Deposits // Ind. Eng. Chem. Res. 2002. V. 41. № 11. P. 2668. https://doi.org/10.1021/ie0105831
Shu X., He Z., Wang Y., Yin L. Mechanical properties of Ni-based coatings fabricated by electroless plating method // Surf. Eng. 2019. P. 1. https://doi.org/10.1080/02670844.2019.1662226
Dervos C.T., Novakovic J., Vassiliou P. Electroless Ni–B and Ni–P coatings with high-fretting resistance for electrical contact applications // Proc. 50th IEEE Holm Conf. on Electric. Cont. and the 22nd Int. Conf. on Electr. Cont. Seattle, 2004. P. 1. https://doi.org/10.1109/holm.2004.1353131
Panja B., Das S.K., Sahoo P. Tribological Behavior of Electroless Ni–P Coatings in Various Corrosive Environments // Surf. Rev. Lett. 2016. V. 23. № 5. P. 1650040. https://doi.org/10.1142/s0218625x16500402
Czagany M., Baumli P., Kaptay G. The influence of the phosphorous content and heat treatment on the nano-micro-structure, thickness and micro-hardness of electroless Ni-P coatings on steel // Appl. Surf. Sci. 2017. V. 423. P. 160. https://doi.org/10.1016/j.apsusc.2017.06.168
Comprehensive Materials Processing / Eds. Hashmi S., Batalha G.F., Van Tyne C.J., Yilbas B.S. Amsterdam: Elsevier, 2014.
McKeen L.W. Fluorinated Coatings and Finishes Handbook: The Definitive User’s Guide (Series in Plastics Design Library). N.Y.: William Andrew, 2006.
Sudagar J., Lian J., Sha W. Electroless nickel, alloy, composite and nano coatings – A critical review // J. Alloys Compd. 2013. V. 571. P. 183. https://doi.org/10.1016/j.jallcom.2013.03.107
Wang X.C., Cai W.B., Wang W.J., Liu H.T., Yu Z.Z. Effects of ligands on electroless Ni–P alloy plating from alkaline citrate–ammonia solution // Surf. Coat. Technol. 2003. V. 168. № 2–3. P. 300. https://doi.org/10.1016/s0257-8972(03)00013-6
Omar R., Aboraia M.S., Oraby E.A., Gubner R., Rizk A.E. The effect of sodium citrate as a complex agent on the corrosion properties of the electroless Ni–P coating // Mater. Res. Express. 2018. V. 5. № 12. P. 126. https://doi.org/10.1088/2053-1591/aae0b9
Ashtiani A.A., Faraji S., Iranagh S.A., Faraji A.H. The study of electroless Ni–P alloys with different complexing agents on Ck45 steel substrate // Arabian J. Chem. 2017. V. 10. P. 1541.
Jin Y., Yu H., Yang D., Sun D. Effects of complexing agents on acidic electroless nickel deposition // Rare Met. (Beijing, China). 2010. V. 29. № 4. P. 401. https://doi.org/10.1007/s12598-010-0138-8
Elhaloui A., Anik T., Ebn Touhami M., Shaim A., Iaych K., Touir R., Sfaira M., Mcharfi M., Hammouti B. Investigation of ammonium acetate effect on electroless Ni–P deposits // J. Mater. Environ. Sci. 2015. V. 6. № 7. P. 2028.
Mayanna S.M., Ramesh L., Sheshadri B.S. Electroless Nickel Plating–Influence of Mixed Ligands // Trans. IMF. 1996. V. 74. № 2. P. 66. https://doi.org/10.1080/00202967.1996.11871097
Тарозайте Р., Гилене О. Регенерируемый цитратный раствор химического никелирования // Технол. констр. электрон. аппар. 2002. № 4–5. С. 43. [Tarozajte R., Gilene O. Regeneriruemyj citratnyj rastvor himicheskogo nikelirovaniya // Tekhnologiya i konstruirovanie v elektronnoj apparature. 2002. № 4–5. P.43.]
Vinokurov E.G., Demidov A.V., Bondar V.V. Logistic model of ligand selection for chromium-plating electrolytes based on Cr(III) complexes // Russ. J. Coord. Chem. 2004. V. 30. № 11. P. 774. [Винокуров Е.Г., Демидов А.В., Бондарь В.В. Логистическая модель выбора лигандов для растворов хромирования на основе соединений Cr(III) // Коорд. хим. 2004. Т. 30. № 11. С. 822.]
Kuznetsov V.V., Golyanin K.E., Ladygina Y.S., Pshenichkina T.V., Lyakhov B.F., Pokholok K.V. Electrodeposition of iron–molybdenum alloy from ammonium–citrate solutions and properties of produced materials // Russ. J. Electrochem. 2015. V. 51. № 8. P. 748. [Кузнецов В.В., Голянин К.Е., Ладыгина Ю.Ш., Пшеничкина Т.В., Ляхов Б.Ф., Похолок К.В. Электроосаждение сплава железо-молибден из аммонийно-цитратных растворов и свойства полученных материалов // Электрохимия. 2015. Т. 51. № 8. С. 846.]
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. Электроосаждение цинк-никелевых покрытий из растворов оксалата аммония // Гальванотех. обраб. поверхн. 2019. Т. 27. № 1. С. 4. [Shekhanov R. F., Gridchin S. N., Balmasov A. V. Electrodeposition of Zn–Ni Coatings from Ammonium Oxalate Bath // Gal’vanotekhnika i obrabotka poverkhnosti. 2019. V. 27. № 1. P. 4.]
Vinokurov E.G., Kuznetsov V.V. Bondar’ V.V. Aqueous solutions of Cr(III) sulfate: Modeling of equilibrium composition and physicochemical properties // Russ. J. Coord. Chem. 2004. V. 30. № 7. P. 496. https://doi.org/10.1023/B:RUCO.0000034791.29424.1b
Vinokurov E.G. Thermodynamic probability model of ligand selection in solutions designed for electrodeposition of alloys and multivalent metals // Prot. Met. Phys. Chem. Surf. 2010. V. 46. № 5. P. 615. [Винокуров Е.Г. Вероятностно-термодинамическая модель выбора лигандов при разработке составов растворов для электроосаждения сплавов и мультивалентных металлов // Физикохим. поверхн. защ. матер. 2010. Т. 46. № 5. С. 543.]
Vinokurov E.G., Demidov A.V., Bondar’ V.V. Physicochemical model for choosing complexes for chromium-plating solutions based on Cr(III) compounds // Russ. J. Coord. Chem. 2005. V. 31. № 1. P. 14. [Винокуров Е.Г., Демидов А.В., Бондарь В.В. Физико-химическая модель выбора комплексов для растворов хромирования на основе соединений Cr(III) // Коорд. хим. 2005. Т. 31. № 1. С. 17.]
Vinokurov E.G., Bondar’ V.V. Logistic model for choosing ligands for alloy electrodeposition // Theor. Found. Chem. Eng. 2007. V. 41. № 4. P. 384. [Винокуров Е.Г., Бондарь В.В. Вероятностная модель выбора лигандов для электроосаждения сплавов // Теор. осн. хим. технол. 2007. Т. 41. № 4. С. 407.]
Vinokurov E.G., Burukhina T.F., Bondar V.V. Mathematical model for choosing the preferable range of concentrations of ligands as components of solutions for alloy electrodeposition // Theor. Found. Chem. Eng. 2012. V. 46. № 4. С. 338. [Винокуров Е.Г., Бурухина Т.Ф., Бондарь В.В. Математическая модель выбора предпочтительной области концентраций лигандов как компонентов растворов для электроосаждения сплавов // Теор. осн. хим. технол. 2012. Т. 46. № 4. С. 396.]
Sotskaya N.V., Aristov I.V., Goncharova L.G., Kravchenko T.A. Simulation of electroless plating of nickel with sodium hypophosphite // Russ. J. Appl. Chem. 1997. V. 70. № 3. P. 407. [Соцкая Н.В., Аристов И.В., Гончарова Л.Г., Кравченко Г.А. Математическое моделирование химического осаждения никеля гипофосфитом натрия // Журн. прикл. хим. 1997. Т. 70. № 3. С. 427.]
Vinokurov E.G., Mukhametova G.M., Vasil’ev V.V., Burukhina T.F., Skopintsev V.D. Influence of Characteristics of Nickel Complex Compounds on the Rate of Chemical Deposition and Composition of Nickel–Phosphorus Alloy // Theor. Found. Chem. Eng. 2019. V. 53. № 4. P. 544. [Винокуров Е.Г., Мухаметова Г.М., Васильев В.В., Бурухина Т.Ф., Скопинцев В.Д. Влияние характеристик комплексных соединений никеля на скорость химического осаждения и состав сплава никель–фосфор // Теор. осн. хим. технол. 2019. Т. 53. № 4. С. 446.]https://doi.org/10.1134/S0040579519040286
Винокуров Е.Г., Бондарь В.В. Модельные представления для описания и прогнозирования электроосаждения сплавов. М.: ВИНИТИ, 2009. [Vinokurov E.G., Bondar’ V.V. Model background for describe and predicting alloys electrodeposition / Modelnye predstavleniya dlya opisaniya i prognozirovaniya elektroosajdeniya splavov. Moscow: VINITI, 2009]
Скопинцев В.Д., Моргунов А.В., Винокуров Е.Г., Невмятуллина Х.А. Повышение производительности процесса химического никелирования // Гальванотех. обраб. поверхн. 2016. Т. 24. № 3. С. 26. [Skopintsev V.D., Morgunov A.V., Vinokurov E.G., Nevmyatullina Kh.A. How to Increase the Productivity of Electroless Nickel Plating Process // Gal’vanotekhnika i obrabotka poverkhnosti. 2016. V. 24. № 3. P. 26.]
Vinokurov E.G., Bondar’ V.V. Prediction of stability constants for Cr(III) and Cr(II) complexes // Russ. J. Coord. Chem. 2003. V. 29. № 1. P. 66. [Винокуров Е.Г., Бондарь В.В. Прогнозирование констант устойчивости комплексов хрома(III) и хрома(II) // Коорд. хим. 2003. Т. 29. № 1. С. 71.]
Сухотин А.М. Справочник по электрохимии. Л.: Химия, 1981. [Sukhotin A.M. Spravochnik po elektrokhimii. Lenningrad: Khimiya, 1971.]
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия: 1971. [Lur’e Y.Y. Spravochnik po analiticheskoj himii. M.: Khimiya, 1971.]
Луняцкас А.М. // Тр. Акад. наук Лит. ССР. Сер.: Хим. хим. технол. 1965. Т. 4. С. 43. [Lunyatskas A.M. // Trudy Akademii nauk Litovskoi SSR. Seriya: Khimiya I khim. Tekhnologiya. 1965. V.4. P.43.]
Perrin D.D. Stability Constants of Metal-Ion Complexes: Part B. Organic Ligands. Oxford: Pergamon, 1983.
Скопинцев В.Д., Винокуров Е.Г. Теоретические и прикладные аспекты автокаталитического формирования покрытий на основе сплава никель-фосфор. М.: ВИНИТИ, 2018. [Skopintsev V.D., Vinokurov E.G. Teoreticheskie b prikladniye aspektiy avtokataliticheskogo formirovaniya pokriytiy na osnove splava nikel-fosfor. Moscow: VINITI, 2018]
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии