Теоретические основы химической технологии, 2020, T. 54, № 4, стр. 399-408
Кинетика нуклеации и роста кристаллов карбоната и сульфата кальция из водных растворов
А. Ю. Тихонов a, *, С. К. Мясников a, Н. Н. Кулов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: Andrey-tih@mail.ru
Поступила в редакцию 02.10.2019
После доработки 11.11.2019
Принята к публикации 18.11.2019
Аннотация
Экспериментально определена зависимость индукционного периода от пересыщения при нуклеации CaCO3 и CaSO4 ∙ 2H2O, получены значения межфазного поверхностного натяжения. С использованием метода постоянной концентрации исследована кинетика роста кристаллов обеих солей, получены зависимости скорости от пересыщения раствора, определен порядок реакций роста. Рассмотрены возможные механизмы нуклеации и роста. Изучена кинетика трансформации твердой фазы в течение всего процесса реагентного осаждения. Полученные эволюционные кривые сопоставлены с результатами расчета по предложенным ранее моделям. Показана возможность использования модельных зависимостей для проверки и коррекции экспериментальных данных.
ВВЕДЕНИЕ
Предыдущая работа [1] была посвящена моделированию кинетики реагентного осаждения малорастворимых солей кальция. В настоящей статье представлены результаты экспериментального исследования кинетики зарождения и роста кристаллов карбоната и дигидрата сульфата кальция и их сопоставления с полученными теоретическими зависимостями.
В научной литературе можно найти многочисленные работы по карбонатам и сульфатам кальция, поскольку они чрезвычайно широко распространены в природе и используются в больших масштабах в промышленности [2–5]. В том числе достаточно много работ по кинетике зарождения и роста их кристаллов из водных растворов. Однако среди них мало таких, где в одних условиях были бы изучены обе стадии и кинетика снятия пересыщения в течение всего процесса.
Реагентное осаждение отличается большими пересыщениями и его сложней исследовать, чем классическую кристаллизацию, поскольку в начале процесса идет конкуренция нескольких стадий с собственной кинетикой (смешение потоков реагентов, химическая реакция, нуклеация). Они проходят одновременно и достаточно быстро, выделить лимитирующую стадию трудно. Кроме того, процессы гомогенной (спонтанной) кристаллизации при высоких пересыщениях чрезвычайно чувствительны к условиям их проведения (вплоть до влияния микропримесей и неконтролируемых случайных факторов). Поэтому процесс нуклеации трудно поддается контролю, а получаемые данные мало подходят для расчета процесса, проводимого в другом аппарате и иных условиях.
Следует также отметить, что траектория процесса кристаллизации может пересекать несколько зон с разными механизмами роста кристаллов (начиная с диффузионного и кончая мононуклеационным) при начальных пересыщениях S выше 8–12 и соответственно разными кинетическими зависимостями скорости роста от времени.
В результате особенностей реагентного осаждения разброс имеющихся экспериментальных данных по скоростям нуклеации и роста кристаллов, их энергетическим характеристикам даже для одной соли чрезвычайно широк.
В литературных источниках энергия поверхностного натяжения для карбоната кальция варьируется в широком диапазоне: 19.5 [6], 37.3 [7], 64 [8], 86 [9], 90 [10], 108 [7], 280 [11] мДж/м2 для гомогенной кристаллизации и 11 [7], 31.1 [8], 40.7 [12] мДж/м2 для гетерогенной кристаллизации. Поверхностное натяжение для дигидрата сульфата кальция, полученное разными авторами, составило 4 [13], 12 [14], 37 [15], 40 [16], 95 [17], 117 [18] мДж/м2 для гомогенной и 7 [19], 14 [16] мДж/м2 для гетерогенной кристаллизации. Значения показателя степени g в уравнении скорости роста кристаллов для карбоната кальция варьируются от 1.29 до 3.11 [2, 20] и для дигидрата сульфата кальция от 1.5 [21] до 3.4 [20, 22, 23].
Причины такого разброса могут быть связаны с различием многих влияющих на процесс факторов, таких как: конструкция кристаллизаторов и гидродинамическая обстановка в них, состав раствора и соответственно его ионная сила, пересыщение раствора и соответственно разный механизм роста кристаллов осаждаемой соли, полиморфный состав (у CaCO3 – кальцит, ватерит, арагонит) и геометрическая форма самих кристаллов, растворимые и нерастворимые загрязнения.
Поэтому для проверки работоспособности предлагаемых моделей необходимо провести в одном аппарате и на одинаковых системах следующие серии экспериментов: 1) кинетика зарождения кристаллов и зависимость ее от пересыщения раствора; 2) кинетика роста кристаллов на одноименной затравке и без нее при различных пересыщениях; 3) кинетика эволюции твердой фазы и соответствующего снятия пересыщения при гомогенной и гетерогенной кристаллизации CaCO3 и CaSO4 ∙ 2H2O.
ОСНОВНАЯ ЧАСТЬ
Эксперименты по определению индукционного периода, скоростей кристаллизации и кинетике снятия пресыщения проводили на модельных растворах с заданным пересыщением, для приготовления которых использовали реактивы СaCl2, Na2CO3, NaHCO3, Na2SO4, KCl марок х. ч. и ч. д. а., а также их 0.1 и 0.2 М растворы. В качестве затравочного материала для кристаллизации карбоната и сульфата кальция использовали соответствующие им по составу зародыши, которые специально были получены методом реагентного осаждения.
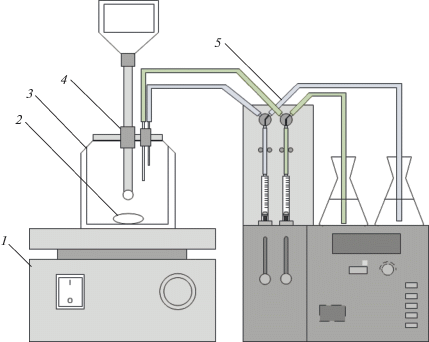
Для проведения экспериментов использовали лабораторный стеклянный реактор-кристаллизатор емкостью до 0.8 л с рубашкой для термостатирования. Схема установки представлена на рис. 1.
Рис. 1.
Экспериментальная установка для изучения процесса кристаллизации: 1 – магнитная мешалка; 2 – якорь для магнитной мешалки; 3 – реактор-кристаллизатор с рубашкой; 4 – электрод рН-метра-иономера; 5 – двухканальный автотитратор.
Модельный раствор с заданными значениями пересыщения карбоната кальция и ионной силы получали путем смешения рабочих 0.1 М растворов CaCl2, Na2CO3, NaHCO3 и сухой навески KCl. Концентрации по каждому компоненту определяли в программе SequentiX WinIAP.
Модельный раствор с заданным пересыщением сульфата кальция получали путем смешения растворов CaCl2 и Na2SO4, полученных при растворении необходимого количества соответствующей соли в дистиллированной воде. Концентрации по каждому компоненту рассчитывали с использованием следующих формул:
(1)
${{K}_{{{\text{sp}}}}} = \left[ {{\text{C}}{{{\text{a}}}^{{2 + }}}} \right]{{{\gamma }}_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}}\left[ {{\text{SO}}_{4}^{{2 - }}} \right]{{{\gamma }}_{{{\text{SO}}_{4}^{{2 - }}}}},$(4)
$\begin{gathered} I = \frac{1}{2}([{\text{C}}{{{\text{a}}}^{{2 + }}}]z_{{{\text{C}}{{{\text{a}}}^{{2 + }}}}}^{2} + [{\text{C}}{{{\text{l}}}^{ - }}]z_{{{\text{C}}{{{\text{l}}}^{ - }}}}^{2} + \\ + \,\,[{\text{SO}}_{4}^{{2 - }}]z_{{{\text{SO}}_{4}^{{2 - }}}}^{2} + [{\text{N}}{{{\text{a}}}^{ + }}]z_{{{\text{N}}{{{\text{a}}}^{ + }}}}^{2}), \\ \end{gathered} $$K_{{{\text{sp}}}}^{0}$ для дигидрата сульфата кальция определяли из температурной зависимости, полученной в работе [24]:
(6)
$\begin{gathered} \lg K_{{{\text{sp}}}}^{0} = 390.9619 - 152.6246\lg T - \hfill \\ - \,\,\frac{{12545.62}}{T} + 0.0818493T. \hfill \\ \end{gathered} $Концентрацию ионов Ca2+ определяли по стандартной методике комплексонометрического титрования c использованием трилона Б, сравнивая с результатами, полученными на рН-метре-иономере ЭКСПЕРТ-001. Изменение оптической плотности раствора, свидетельствующее о конце индукционного периода, измеряли фотоколориметром КФК-2МП. Визуально этот период определяли по началу помутнения раствора за счет образования кристаллов малорастворимых солей.
Определение скорости зарождения кристаллов. Эксперименты по определению индукционного периода tind проводили следующим образом. Готовили два раствора объемом по 150 мл: первый – с ионами хлорида кальция, второй – с ионами карбоната или сульфата натрия. Оба раствора смешивали в реакторе-кристаллизаторе при постоянном перемешивании магнитной мешалкой со скоростью 240–400 об/мин. В режиме реального времени фиксировали изменения рН и рСа. Для определения оптической плотности Dоп раствора отбирали пробы в кювету фотоколориметра через равные промежутки времени. Окончание индукционного времени фиксировали визуально, или по зависимостям рН = f(t), рCa = f(t), Dоп = f(t) (рис. 2).
Рис. 2.
Изменение рН (1) и оптической плотности (2) раствора во времени при определении индукционного периода кристаллизации карбоната кальция.
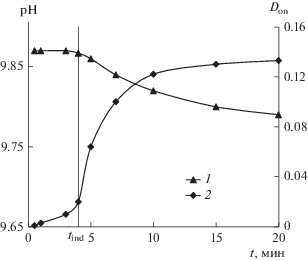
На рис. 2 вертикальной линией отмечено окончание индукционного периода при tind = 4 мин, установленное визуально, свидетельствующее об образовании зародышей карбоната кальция и переходу к активной фазе роста кристаллов, начальное пересыщение в растворе равно 14. Индукционное время обратно пропорционально скорости нуклеации, поэтому это взаимозаменяемые величины. Аналогичным образом Д. Вердос, С. Халеви и др. в своих работах определяли скорости зарождения кристаллов [7, 19].
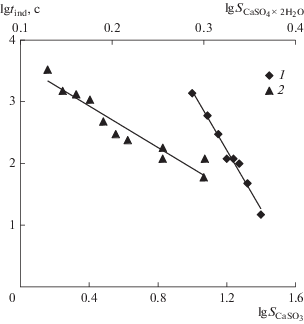
Чтобы подтвердить степенную зависимость скорости зарождения частиц, необходимо по результатам экспериментов построить зависимость индукционного периода от пересыщения раствора tind = f(S). Для карбоната кальция tind определяли при разных значениях S в диапазоне от 10 до 25. Для дигидрата сульфата кальция tind определяли при пересыщениях от 1.35 до 2.0. На рис. 3 представлены полученные результаты в логарифмических координатах lgtind = f(lgS), которые хорошо описываются линейными зависимостями 1 для CaCO3 и 2 для CaSO4 ∙ 2H2O. По тангенсу угла наклона определяли значение показателя степени в зависимостях скоростей зарождения кристаллов карбоната и дигидрата сульфата кальция: tind = 8.9 × 107S–4.8 для CaCO3 и tind = 3.2 × 104S–9.0 для CaSO4 ∙ 2H2O.
Рис. 3.
Зависимость индукционного периода карбоната кальция (1) и дигидрата сульфата кальция (2) от пересыщения раствора.
Так как индукционный период обратно пропорционален скорости нуклеации tind ~ 1/vn и снятие пересыщения в растворе определяется изменением концентрации кальция f(С – С0), полученные результаты подтверждают степенные зависимости скорости зарождения частиц:
или в общем случае
где С – массовая концентрация соли в растворе; С0 – массовая концентрация соли в насыщенном растворе; n – показатель степени в уравнении скорости зародышеобразования; kn – константа скорости зародышеобразования в растворе.На рис. 4 зависимость индукционного периода от пересыщения представлена уравнением
где a – эмпирическая константа, а b можно определить как(10)
$b = \frac{{{\beta }{{{\sigma }}^{3}}V_{m}^{2}{{N}_{{\text{A}}}}f\left( \phi \right)}}{{{{{\left( {2.3R} \right)}}^{3}}{{{v}}^{2}}{{T}^{3}}}},$Рис. 4.
Зависимость продолжительности индукционного периода гомогенной (1) и гетерогенной (2) кристаллизации CaCO3, гомогенной (3) и гетерогенной (4) кристаллизации CaSO4 ∙ 2H2O от пересыщения раствора.
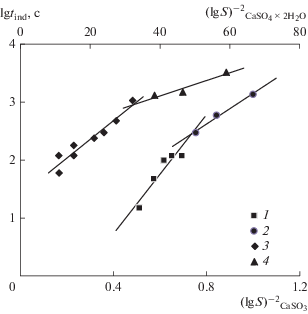
Экспериментальные данные по индукционному периоду карбоната и дигидрата сульфата кальция хорошо описываются линейными зависимостями в координатах lg tind = f(lgS)–2. Тангенс угла наклона позволяет определить величину межфазного натяжения σ для гомогенной и гетерогенной нуклеации, соответствующей диффузионной модели роста кристаллов. Для гомогенной кристаллизации CaCO3 σ = 70.1 мДж/м2 при коэффициенте формы β = 32 для куба (кальцит) и σ = 87 мДж/м2 при коэффициенте формы β = 16π/3 для шара (ватерит), Т = 293 К, молярный объем твердого карбоната кальция Vm = = 36.9 см3/моль, f(ϕ) = 1. При гетерогенной кристаллизации σ = 56.2 мДж/м2 для формы куба и σ = 69.7 мДж/м2 для формы шара. Значения межфазного натяжения при гомогенной кристаллизации не противоречат данным из других источников [8–10, 12].
Для CaSO4 ∙ 2H2O при Т = 293 К, β = 32 (куб) и 50 (параллелепипед), Vm = 74.69 см3/моль и S от 1.35 до 2.0 рассчитанная величина межфазного натяжения при гомогенной кристаллизации составляет 9.2 мДж/м2 для формы куба и 8 мДж/м2 для формы параллелепипеда. В образовавшейся суспензии присутствуют также кристаллы игольчатой формы, но их массовая доля невелика. При гетерогенной кристаллизации σ = 6.9 и 5.9 мДж/м2 соответственно. Такие низкие значения межфазного натяжения свидетельствуют о том, что механизм роста кристаллов отличается от диффузионного. При сравнительно небольших пересыщениях для CaSO4 ∙ 2H2O более вероятна нуклеация, сопровождаемая полинуклеационным ростом. В этом случае уравнение для расчета величины σ принимает следующий вид [25] :
(11)
$\begin{gathered} {{t}_{{{\text{ind}}}}} = {{\left( {\frac{3}{{2{\pi }}}} \right)}^{{\frac{1}{4}}}}{{\left( {\frac{{V_{{\text{m}}}^{{\frac{5}{3}}}}}{{N_{{\text{A}}}^{{\frac{8}{3}}}{{D}^{4}}{{C}_{0}}}}} \right)}^{{\frac{1}{4}}}}{{\left( {\frac{S}{{{{{\left( {S - 1} \right)}}^{2}}}}} \right)}^{{\frac{1}{4}}}} \times \\ \times \,\,{\text{exp}}\left[ {\frac{{{\beta }{{{\sigma }}^{3}}V_{{\text{m}}}^{2}{{N}_{{\text{A}}}}}}{{4{{{\left( {RT} \right)}}^{3}}{{{v}}^{2}}{{{(\ln S)}}^{2}}}} + \frac{{{\beta }{\kern 1pt} {\text{'}}{{{\sigma }}^{2}}V_{{\text{m}}}^{{\frac{4}{3}}}{{N}_{{\text{A}}}}^{{\frac{2}{3}}}}}{{4{{{\left( {RT} \right)}}^{2}}{v}\ln S}}} \right], \\ \end{gathered} $Для гомогенной кристаллизации CaSO4 ∙ 2H2O при D = 5 × 10–9 м2/с и β = 32 межфазное натяжение находится в диапазоне от 21.1 до 29 мДж/м2. Для гетерогенной от 17.5 до 19.9 мДж/м2. При факторе формы β = 50 значения σ составили от 18.3 до 25.1 мДж/м2 и от 15.2 до 17.3 мДж/м2 для гомогенной и гетерогенной кристаллизации соответственно. Полученные величины для гомогенной кристаллизации находятся в диапазоне от 15 до 30 мДж/м2. Эти данные не противоречат значениям межфазного натяжения большинства авторов [5, 14–16].
Определение скорости роста кристаллов. Эксперименты по определению скоростей кристаллизации проводили методом постоянной концентрации, чтобы движущая сила процесса оставалась неизменной на протяжении всего времени проведения эксперимента. Для этого при помощи двухканального автотитратора в реактор-кристаллизатор подавали растворы 0.1 М CaCl2 и Na2CO3 при кристаллизации карбоната кальция и 0.2 М CaCl2 и Na2SO4 при кристаллизации сульфата кальция. Соотношение катионов к анионам малорастворимых солей в растворе поддерживали на уровне 1 к 1. Концентрацию ионов кальция в растворе фиксировали при помощи Са-иономера. Скорость роста кристаллов при постоянном пересыщении определяли по объему раствора хлорида кальция, добавленного за определенный промежуток времени.
Кинетические эксперименты с карбонатом кальция проводили при гетерогенной кристаллизации. Для этого в модельный раствор с заданным пересыщением на 30 с вносили затравочные частицы СаСО3 массой 0.2 г, которые служили центрами кристаллизации. Таким образом мы попытались исключить воздействие первичного зародышеобразования и, соответственно, избежать увеличения количества частиц, способных к росту. По мере выпадения осадка и постоянного добавления титрующих растворов в маточном растворе увеличивается ионная сила, напрямую влияющая на активность ионов и степень пересыщения. Чтобы предотвратить это влияние, ионную силу в модельном растворе изначально доводили до 0.1 М при помощи растворения KCl. Количество ионов хлора и натрия из титрующих растворов, накапливаемое на протяжении всего эксперимента, значительно меньше количества ионов калия и хлора в растворе на начальный момент времени, поэтому изменение ионной силы за весь период времени незначительно.
В [7] также использовали затравку и постоянную ионную силу раствора при изучении процесса кристаллизации, при этом авторами были получены линейные скорости роста кристаллов. Однако количество добавленного титранта с течением времени будет увеличиваться нелинейно и dVt/dt = f(t) ≠ const, так как объемная скорость роста постоянно увеличивается пропорционально поверхности растущих кристаллов. Авторы [13, 20] предложили использовать скорректированный объем титранта Vtc, который соответствует неизменной эффективной поверхности роста кристаллов. Для этого они используют уравнение (12), а величина пространственной ориентации роста кристаллов d позволяет скорректировать зависимость Vtc = f(t) таким образом, чтобы выполнялось равенство dVtс/dt = const. Скорректированный объем позволяет определить линейную зависимость объемной скорости роста кристаллов. Уравнение для определения Vtс при известном реальном объеме титранта в момент времени t представлено выражением
(12)
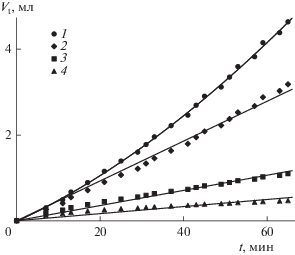
${{V}_{{{\text{tc}}}}} = \frac{{{{{\left( {1 + \frac{{M{{C}_{{\text{t}}}}{{V}_{{\text{t}}}}}}{{{{m}_{0}}}}} \right)}}^{{\left( {1 - d} \right)}}} - 1}}{{\frac{{\left( {1 - d} \right)M{{C}_{{\text{t}}}}}}{{{{m}_{0}}}}}}\,\,\,\,(d \ne 1),$На рис. 5 линией 1 показано изменение объема титранта во времени, полученное экспериментально при пересыщении раствора S = 3.16 и массе затравочных частиц 0.2 г. Линиями 2–4 показаны зависимости скорректированного объема при значении d, равном 0.1, 0.4 и 2/3 соответственно. Так как титрантом служит смесь из двух растворов, CaCl2 и Na2CO3, с концентрациями 0.1 М, то при расчете объема титрующего раствора по ионам Са2+ следует принять концентрацию Ct равной 0.05 М. Для определения зависимости скорости роста от пересыщения нужно использовать концепцию скорректированного объема. Для наших экспериментальных условий кривизна зависимостей Vtc = f(t) меняется незначительно, а в области, где они становятся линейными, наблюдается сильное отклонение от реальных объемов титранта. Это связано с использованием большого количества затравки и значительно меньшим изменением общей массы кристаллов в ходе кристаллизации, чем в [13, 20]. Поэтому в расчетах скоростей роста мы использовали экспериментально полученные значения Vt.
Рис. 5.
Изменение объема титранта во времени: 1 – экспериментальные значения; 2 – скорректированные значения объема при р = 0.1; 3 – при р = 0.4; 4 – при р = 2/3.
Нами получены объемные скорости роста карбоната кальция для пересыщений 2.24, 3.16, 3.87, 5 и 7. На рис. 6 представлена линеаризованная зависимость скорости подачи титранта vt от движущей силы в растворе, выраженная как –lg vt = = f[lg(S – 1)]. Степенная зависимость скорости роста карбоната кальция имеет следующий вид:
где kg – константа скорости роста кристаллов, g = = 2.3 – показатель степени в уравнении скорости роста СаСО3.Рис. 6.
Зависимость скоростей роста кристаллов CaCO3 (1) и CaSO4 ∙ 2H2O (2) от пересыщения раствора.
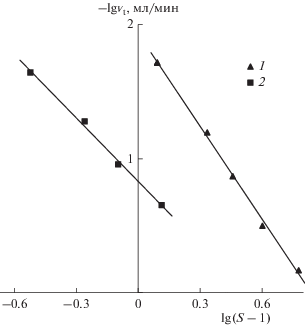
Эксперименты по определению скоростей роста кристаллов дигидрата сульфата кальция отличались от экспериментов с карбонатом кальция. Во-первых, рассматривали процесс гомогенной кристаллизации без использования затравочных частиц. Во-вторых, из-за большей растворимости сульфата кальция ионная сила в растворе изначально больше 0.1 М, поэтому создать такие же условия, как в случае с карбонатом кальция, затруднительно. Значения скорости подачи титрующего раствора фиксировали в интервале времени между окончанием индукционного периода и началом неконтролируемого роста кристаллов. Объемные скорости роста получены для пересыщений 1.3, 1.55, 1.8 и 2.3. На рис. 6 представлены результаты экспериментов, выраженные линейной зависимостью, из которой можно найти значение показателя степени в уравнении скорости роста кристаллов CaSO4 ∙ 2H2O. Таким образом определена величина g = 1.6 для титрующего 0.2 М раствора CaCl2. Полученные значения показателя степени для карбоната и дигидрата сульфата кальция соответствуют полинуклеационной модели со спиральным и/или двумерным послойным ростом кристаллов [20, 22, 26–29].
Кинетика процесса кристаллизации. В предыдущей работе приведена обобщенная модель, описывающая процесс кристаллизации малорастворимых солей из их водных растворов:
(14)
$\frac{{{\text{d}}P}}{{{\text{d}}t}} = {{k}_{{\text{n}}}}{{\left( {{{P}_{{\text{m}}}} - P} \right)}^{n}} + {{k}_{{\text{g}}}}{{\left( {{{P}_{{\text{m}}}} - P} \right)}^{g}}{{P}^{d}},$Чтобы проверить адекватность полученной модели, были проведены эксперименты, основанные на снятии пересыщения из раствора. Опыты проводились в реакторе-кристаллизаторе (рис. 1). Пробы раствора периодически отбирали из него и определяли в них содержание ионов кальция методом комплексонометрического титрования с предварительной фильтрацией исследуемой пробы от кристаллов соли.
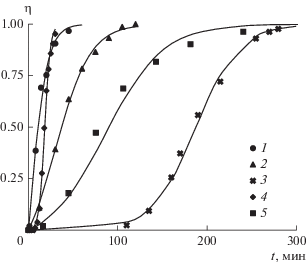
На рис. 7 точками 1 показаны экспериментальные данные изменения доли закристаллизованного карбоната кальция во времени. Исходные параметры раствора: пересыщение – 7; ионная сила – 0.1 моль/л (доводили с помощью растворения KCl); температура – 21°C; рН – 9.5; начальная концентрация кальция – 1.14 × × 10–3 моль/л; отношение ионов [Ca2+]/$\left[ {{\text{CO}}_{3}^{{2 - }}} \right]$ = = 1. Процесс кристаллизации дигидрата сульфата кальция показан точками 2. Начальные параметры раствора: пересыщение – 1.6; концентрация кальция – 6.1 × 10–2 моль/л; ионная сила – 3.66 × × 10–1 моль/л; температура – 25°C; отношение ионов [Ca2+]/$\left[ {{\text{SO}}_{4}^{{2 - }}} \right]$ = 1. Зависимости, обозначенные точками 3, 4 и 5, взяты из работ С. Халеви [19], Т. Рабизадех [30] и П.А. Кекина [31] соответственно.
Рис. 7.
Изменение степени кристаллизации во времени при гомогенной кристаллизации: 1, 2 – собственные данные для CaCO3 и CaSO4 ∙ 2H2O соответственно; 3, 4 – CaSO4 ∙ 2H2O [19] и [30]; 5 – CaCO3 [31].
Дифференциальное уравнение (14) в некоторых случаях можно решить аналитически. Например, если принять n = 1, g = 1 и d = 1, то оно упрощается, и его решение принимает следующий вид:
(15)
$\begin{gathered} P = {{P}_{{\text{m}}}} - \left( {{{P}_{{\text{m}}}} + \frac{{{{k}_{{\text{n}}}}}}{{{{k}_{{\text{g}}}}}}} \right) \times \\ \times \,\,\frac{{{{P}_{{\text{m}}}}}}{{{{P}_{{\text{m}}}} + \frac{{{{k}_{{\text{n}}}}}}{{{{k}_{{\text{g}}}}}}{\text{exp}}\left[ {{{k}_{{\text{g}}}}t\left( {{{P}_{{\text{m}}}} + \frac{{{{k}_{{\text{n}}}}}}{{{{k}_{{\text{g}}}}}}} \right)} \right]}}. \\ \end{gathered} $Степень кристаллизации η выражается как
На рис. 7 линиями показаны теоретические S-образные зависимости доли закристаллизованного карбоната и дигидрата сульфата кальция, полученные по уравнениям (15) и (16) при условии kg$ \gg $ kn. Коэффициенты kg и kn в уравнении (15) для карбоната кальция равны 70 и 5 × 10–2, 18 и 2 × 10–3 для наших экспериментальных данных и данных из работы [31] соответственно. Для зависимости изменения степени кристаллизации дигидрата сульфата кальция во времени kg и kn равны 1.4 и 9 × 10–3, 1.9 и 1.9 × 10–5, 3 × 10–3 и 1 × 10–3 для наших экспериментальных данных и данных из работ [19] и [30] соответственно. Так как все эксперименты проводились при разных условиях и концентрациях, наблюдается значительное расхождение в кинетических коэффициентах, учитывающих скорости нуклеации и роста кристаллов. Если сравнить экспериментальные данные степени кристаллизации CaSO4 ∙ 2H2O на рис. 7, видно, что медленнее всего зарождение кристаллов происходило в работе [19], а быстрее всего в наших экспериментах, что в свою очередь отражается на значениях констант kn в теоретически полученных зависимостях.
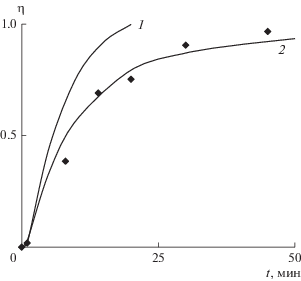
На рис. 8 представлено сопоставление экспериментальных данных для процесса кристаллизации с теоретически рассчитанными зависимостями. Линии 1 и 2 построены расчетным путем на основании экспериментально полученных данных, обозначенных точками. Они учитывают зависимость для скорости роста кристаллов (13), продолжительность процесса и начальную концентрацию ионов кальция в растворе. Принцип расчета следующий.
Рис. 8.
Изменение степени кристаллизации CaCO3 во времени: точки – экспериментальные данные; 1, 2 – теоретические линии, учитывающие экспериментально полученную скорость кристаллизации vt со значением степени g = 2.3 (1) и g = 2.1 (2).
1. Находим массу образовавшихся зародышей в растворе.
2. Вычитаем из начального значения количество кальция, потребовавшееся на образование зародышей во время индукционного периода. Если это изменение очень маленькое, то им в рамках расчета можно пренебречь.
3. Делим время всего процесса кристаллизации на равные промежутки времени.
4. Зная пересыщение в растворе в начале и конце каждого рассматриваемого промежутка времени, рассчитываем скорость роста кристаллов по уравнению (13).
5. По скорости роста находим количество кальция, которое потребуется для роста кристаллов в данном временном интервале. Для этого берем среднюю скорость между началом и концом рассматриваемого промежутка времени.
6. Вычитаем количество кальция, затраченное на рост, из оставшегося количества в растворе на начало рассматриваемого временного интервала.
7. Находим степень кристаллизации на текущем участке времени.
8. Далее повторяем расчет, рассматривая следующий временной интервал.
Входящие в кинетическое уравнение кристаллизации скорости нуклеации и роста получены в разных условиях. Нуклеация протекает при гомогенной кристаллизации, а рост – при гетерогенной. Линия 1 учитывает зависимость скорости кристаллизации СаСО3 от пересыщения со значением показателя степени g = 2.3. Эта величина получена в экспериментах с постоянным пересыщением и достаточно крупными затравочными частицами с шероховатой поверхностью, на которой множество активных центров (дислокаций) для образования зародышей. Для такого случая характерна полинуклеационная и/или спиральная модели роста [7, 20, 26, 28].
Построенная линия 1 находится заметно выше экспериментальных точек. В экспериментах со снятием пересыщения образованные зародыши значительно меньше затравочных частиц, имеют более гладкую и структурированную поверхность. Поэтому значение g может отличаться и его необходимо скорректировать. Теоретическая линия, полученная с использованием скорректированной скорости роста при g = 2.1 (линия 2), удовлетворительно описывает процесс кристаллизации и снятие пересыщения в растворе.
ЗАКЛЮЧЕНИЕ
Проведен анализ экспериментальных работ по кинетике нуклеации и роста кристаллов малорастворимых солей кальция при их осаждении из водных растворов. Показан очень большой разброс литературных данных по энергетическим и кинетическим характеристикам осаждаемых солей. Рассмотрены причины такого расхождения данных. Многие объясняются особенностями реагентного осаждения и связаны с высоким начальным пересыщением и смешением реактивов непосредственно в зоне кристаллизации. Пересыщение оказывает решающее влияние не только на кинетику нуклеации и роста кристаллов, но и на механизм этих процессов (сильно влияет также наличие примесей). В процессе снятия пересыщения и трансформации твердой фазы траектория процесса может пересекать несколько зон с различным механизмом кристаллизации, разной формой кристаллов и соответственно отличающимися кинетическими характеристиками.
При осаждении солей с низкой растворимостью в условиях умеренного перемешивания процесс может начинаться в области, контролируемой объемной диффузией при S > 10, а затем переходить в зону кинетического режима, контролируемую поверхностной реакцией. В этой зоне часто реализуется параболический закон (теоретический порядок реакции g = 2, а в экспериментах близко к 2) с дислокационным (спиральным) и/или полинуклеационным ростом (g > 2). На последней стадии трансформации твердой фазы при снижении пересыщения (или при наличии примесей) возможен послойный двумерный рост c g < 2, и так вплоть до образования мононуклеационного слоя по мере приближения к S = 1.
В настоящей работе из экспериментальных данных для осаждаемых солей были определены значения поверхностной энергии и порядка реакций в уравнениях для скорости нуклеации и роста кристаллов. Полученные значения попадают в диапазон наиболее достоверных и согласуются с данными других исследователей. Методом постоянной концентрации получены степенные зависимости скоростей роста кристаллов карбоната и дигидрата сульфата кальция со значениями показателя степени g = 2.3 и 1.6 соответственно. Такие значения характерны для комбинированных механизмов роста. В случае CaCO3 наиболее вероятен спиральный рост с полинуклеацией, а для CaSO4 ∙ 2H2O – спиральный рост в комбинации с послойным.
С использованием полученной ранее модельной зависимости проведена коррекция экспериментального значения g для карбоната кальция. Расчет с использованием нового значения g = 2.1 удовлетворительно описывает кинетику всего процесса кристаллизации. Модельные S-образные зависимости могут использоваться для проверки, аппроксимации и коррекции экспериментальных данных по кинетике реагентного осаждения. Сопоставление с экспериментальными данными из опубликованных работ разных авторов показало хорошее согласие и подтвердило работоспособность моделей. При наличии кинетических характеристик осаждаемого соединения они позволяют спрогнозировать весь процесс кристаллизации и, в том числе, время его протекания при заданном начальном пересыщении.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований.
ОБОЗНАЧЕНИЯ
| А | температурный коэффициент |
| С | массовая концентрация соли в растворе, кг/м3 |
| С0 | массовая концентрация соли в насыщенном растворе, кг/м3 |
| Ct | концентрация титранта, моль/л |
| сi | молярная концентрация соответствующих ионов, моль/л |
| D | коэффициент диффузии, м2/с |
| Dоп | оптическая плотность раствора |
| d | показатель степени, характеризующий пространственную направленность роста кристаллов |
| f(ϕ) | корректирующий фактор |
| g | показатель степени в уравнении скорости роста кристаллов (13) |
| I | ионная сила раствора, моль/л |
| Ksp | произведение активностей ионов растворенного вещества |
| $K_{{{\text{sp}}}}^{0}$ | произведение активностей ионов в насыщенном растворе |
| kn | константа скорости зародышеобразования в растворе |
| kg | константа скорости роста кристаллов |
| M | молекулярная масса растущих кристаллов, кг/моль |
| m0 | начальная масса затравочных частиц, кг |
| NA | число Авогадро, моль–1 |
| n | показатель степени в уравнении скорости зародышеобразования (7) |
| P | массовая концентрация кристаллического вещества в суспензии, кг/м3 |
| Pm | максимальная массовая концентрация кристаллического вещества в суспензии, кг/м3 |
| R | универсальная газовая постоянная, Дж/(моль К) |
| S | пересыщение раствора |
| T | температура, К |
| t | время процесса кристаллизации, с |
| tind | индукционный период зарождения кристаллов, с |
| Vm | молярный объем для твердого тела, м3/моль |
| Vt | объем титранта, м3 |
| Vtc | скорректированный объем титранта, м3 |
| v | число ионов, из которого состоит твердое тело |
| vn | скорость нуклеации (зародышеобразования), с–1 |
| vg | скорость роста кристаллов, кг/с |
| vt | скорость подачи титрующего раствора, м3/с |
| zi | заряд соответствующего иона |
| β, β' | фактор геометрической формы |
| γ | коэффициент активности |
| η | степень кристаллизации |
| σ | величина межфазного натяжения, мДж/м2 |
ИНДЕКСЫ
Список литературы
Myasnikov S.K., Tikhonov A.Yu., Kulov N.N. Kinetics of Chemical Precipitation: General Evolutionary Patterns in Different Models // Theor. Found. Chem. Eng. 2020. V. 54. №. 2. P. 249. [Мясников С.К., Тихонов А.Ю., Кулов Н.Н. Кинетика реагентного осаждения: общие эволюционные закономерности различных моделей // Теорет. основы хим. технологии. 2020. Т. 54. №. 2. С. 135.]
Sanjuan B., Girard J.P. Review of Kinetic Data on Carbonate Mineral Precipitation. BRGM Report R39062. Orléans: BRGM, 1996.
Morse J.W., Arvidson R.S., Luttge A. Calcium carbonate formation and dissolution // Chem. Rev. 2007. V. 107. P. 342.
Freyer D., Voigt W. Crystallization and phase stability of CaSO4 and CaSO4–Based Salts // Monatsh. Chem. 2003. V. 134. P. 693.
New Perspectives on Mineral Nucleation and Growth: From Solution Precursors to Solid Materials / Eds. Van Driessche A.E.S., Kellermeier M., Benning L.G., Gebauer D. Cham: Springer, 2017.
Wu W., Nancollas G.H. Determination of interfacial tension from crystallization and dissolution data: a comparison with other methods // Adv. Colloid Interface Sci. 1999. V. 79. P. 229.
Verdoes D., Kashchiev D., Rosmalen G.M. Determination of nucleation and growth rates from induction times in seeded and unseeded precipitation of calcium carbonate // J. Cryst. Growth. 1992. V. 118. P. 401.
Lioliou M.G., Paraskeva C.A., Koutsoukos P.G., Payatakes A.C. Heterogeneous nucleation and growth of calcium carbonate on calcite and quartz // J. Colloid Interface Sci. 2007. V. 308. P. 421.
Myasnikov S.K., Chipryakova A.P., Kulov N.N. Kinetics, energy characteristics, and intensification of crystallization processes in chemical precipitation of hardness ions // Theor. Found. Chem. Eng. 2013. V. 47. № 5. P. 505. [Мясников С.К., Чипрякова А.П., Ку-лов Н.Н. Кинетика, энергетические характеристики и интенсификация кристаллизационных процессов при химическом осаждении ионов жесткости // Теор. осн. хим. технол. 2013. Т. 47. № 5. С. 483.]
Nielsen A.E. Electrolyte crystal growth mechanisms // J. Cryst. Growth. 1984. V. 67. P. 289.
Goujon G., Mutaftschiev B. On some energetic and chemical properties of the calcite surface // J. Chim. Phys. 1976. V. 73. P. 351.
Gomez-Moralez J., Torrent-Burgues J., Rodriguez-Clemente R. Nucleation of calcium carbonate at different initial pH conditions // J. Cryst. Growth. 1996. V. 169. P. 331.
Zhang J., Nancollas G.H. Influence of calcium/sulfate molar ratio on the growth rate of calcium sulfate dihydrate at constant supersaturation // J. Cryst. Growth. 1992. V. 118. P. 287.
Тодес О.М., Себало В.А., Гольцикер А.Д. Массовая кристаллизация из растворов. Л.: Химия, 1984.
Lancia A., Musmarra D., Prisciandaro M. Measuring Induction Period for Calcium Sulfate Dihydrate Precipitation // AIChE J. 1999. V. 45. № 2. P. 390.
Alimi F., Elifi H., Gardri A. Kinetics of the precipitation of calcium sulfate dihydrate in a desalination unit // Desalination. 2003. V. 157. P. 9.
Nielsen A.E. Kinetics of Precipitation. N.Y.: Pergamon, 1964.
Nielsen A.E., Sohnel O. Interfacial tensions electrolyte crystal-aqueous solution, from nucleation data // J. Cryst. Growth. 1971. V. 11. P. 233.
Halevy S., Korin E., Gilron J. Kinetics of Gypsum for Designing Interstage Crystallizers for Concentrate in High Recovery Reverse Osmosis // Ind. Eng. Chem. Res. 2013. V. 52. P. 14647.
Hina A., Nancollas G.H. Precipitation and dissolution of alkaline earth sulfates: kinetics and surface energy // Rev. Mineral. Geochem. 2000. V. 40. № 1. P. 277.
Christoffersen M.R., Christoffersen J., Wejnen M.P.C., Van Rosmalen G.M. Crystal growth of calcium sulphate dihydrate at low supersaturation // J. Cryst. Growth. 1982. V. 58. № 3. P. 585.
Linnikov O.D. Investigation of the initial period of sulphate scale formation. Part 2. Kinetics of calcium sulphate crystal growth at its crystallization on a heat-exchange surface // Desalination. 2000. V. 128. P. 35.
Zhang J.W., Nancollas G.H. Mechanisms of growth and dissolution of sparingly soluble salts // Rev. Mineral. 1990. V. 23. № 1. P. 365.
Marshall W.L., Slusher R. Thermodynamics of Calcium Sulfate Dihydrate in Aqueous Sodium Chloride Solutions, 0–110° // J. Phys. Chem. 1966. V. 70. № 12. P. 4015.
Sohnel O., Mullin J.W. Interpretation of Crystallization Induction Periods // J. Colloid Interface Sci. 1988. V. 123. №. 1. P. 43.
Van Rosmalen G.M., Daudey P.J., Marchee W.G.J. An analysis of growth experiments of gypsum crystals in suspension // J. Cryst. Growth. 1981. V. 52. P. 801.
De Yoreo J.J., Vekilov P.G. Principles of crystal nucleation and growth // Rev. Mineral. Geochem. 2003. V. 54. P. 57.
Ларичев Т.А., Сотникова Л.В., Сечкарев Б.А., Бреслав Ю.А., Утехин А.Н. Массовая кристаллизация в неорганических системах. Кемерово: Кузбассвузиздат, 2006.
Bennema P., Kern R., Simon B. Interpretation of deviating points in the relation between the rate of crystal growth and the relative supersaturation // Phys. Status Solidi B. 1967. V. 19. № 1. P. 211.
Rabizadeh T., Stawski T.M., Morgan D.J., Peacock C.L., Benning L.G. The Effects of Inorganic Additives on the Nucleation and Growth Kinetics of Calcium Sulfate Dihydrate Crystals // Cryst. Growth Des. 2017. V. 17. № 2. P. 582.
Кекин П.А. Кристаллизация карбоната кальция в технологических водных системах. Дис. … канд. техн. наук. М.: РХТУ им. Д.И. Менделеева, 2017.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


