Теоретические основы химической технологии, 2021, T. 55, № 1, стр. 126-132
Исследование состава осадка, выпадающего из растворов для синтеза катодных материалов, содержащих марганец и лимонную кислоту
К. В. Нефедова a, *, В. Д. Журавлев a, Ш. М. Халиуллин a, А. П. Тютюнник a, Л. Ю. Булдакова a
a Институт химии твердого тела УрО РАН
Екатеринбург, Россия
* E-mail: nefedova@ihim.uran.ru
Поступила в редакцию 26.08.2019
После доработки 07.08.2020
Принята к публикации 23.09.2020
Аннотация
Катодные материалы литий-ионных аккумуляторов могут быть эффективно и быстро получены методом SCS (solution combustion synthesis) из нитратных растворов d-элементов и лития в присутствии органических комплексующих агентов, таких как глицин и лимонная кислота. Однако при хранении слабокислых азотнокислых растворов марганца, никеля, кобальта после внесения глицина и лимонной кислоты выпадает осадок розового цвета, нарушающий стехиометрию исходного раствора. Методами термического и рентгеноструктурного анализа, а также химического анализа на определение содержания углерода, показано, что осадок представляет собой цитрат марганца состава Mn(НC6H5O7) · H2O. Установлено, что состав цитрата марганца не зависит от соотношения количества лимонной кислоты и нитратов металла в рабочем растворе.
ВВЕДЕНИЕ
Полидентатные цитраты обладают выдающейся способностью создавать новые кластерные топологии в силу своей координационной гибкости [1]. Существуют сотни видов цитратных комплексов металлов различного строения, в том числе содержащие в своем составе катион марганца [2–10]. Важнейшей ролью цитрат-иона является создание растворимых и устойчивых в растворах хелатных соединений с ионами поливалентных металлов, что повышает их биодоступность и последующее поглощение биологическими тканями. Такие ионы включают железо, кальций, магний, цинк, никель и марганец. Марганец идентифицирован как ключевой ион металла, участвующий в активных центрах основных металлоферментов, связанных с физиологическими защитными метаболическими функциями [11, 12]. Широко известны полимеры цитратов марганца {[Mn2+(H2O)6] [Mn2+C6H5O7 (H2O)]2 ∙ 2H2O}n [13] и [MnC6H6O7 H2O)]n [14].
Способность катионов марганца(II) формировать устойчивые растворимые совместные хелатные соединения в среде азотнокислых солей прочих металлов широко используют для синтеза простых и сложных оксидных функциональных соединений через реакции Печини [15–17], в процессах SCS (solution combustion synthesis) [18–22]. Процессы комплексообразования с лимонной кислотой наиболее полно протекают при рН > 3. Так, меньше 20% ионов Ni2+ вступает в реакцию с лимонной кислотой при значениях pH < 3 при соотношении Ni2+/H3Cit = 1 : 1 и ~40% – при соотношении 1 : 2. В обоих случаях преимущественно образуются комплексы NiHCit [23]. Поскольку лимонная кислота содержит донорно-активные группы: три карбоксильных и одну гидроксильную группу, то в зависимости от условий реакции (прежде всего от значения рН) при взаимодействии с катионами металлов лимонная кислота может проявлять свойства моно-, би-, три- и тетрадентатного лиганда. В результате такого взаимодействия формируются различные по составу и структуре соединения (комплексные и неорганические соли). Цитраты марганца при термообработке разлагаются с образованием оксидов Mn3O4, Mn5O8 и Mn2O3 в зависимости от типа атмосферы и температуры прокаливания [24].
В практике использования метода SCS для получения оксидов, в состав которых входят d- и f-элементы, в последние годы широко используют добавление лимонной кислоты в качестве второго восстановителя-комплексона [22, 25]. Как правило, это делают с целью снижения бурного процесса горения и увеличения дисперсности получаемых материалов.
Если комплексы с участием лимонной кислоты и марганца, как правило, хорошо растворимы в широком диапазоне температур и концентраций, то некоторые цитраты марганца являются малорастворимыми соединениями [26]. Например, товарный продукт цитрат марганца состава Mn3(C6H5O7)2 (рег. номер CAS 10024-66-5) мало растворим в воде. Данное исследование возникло из необходимости выяснения причин нестабильности готового технологического раствора для синтеза катодного материала LiNi1/3Mn1/3Co1/3O2. В процессе хранения рабочего раствора нитратов кобальта, никеля, марганца глицин и лимонной кислоты по методу SCS [20] из него выпадал розовый кристаллический осадок, нарушая исходную стехиометрию раствора. Предварительный анализ показал, что он представляет собой соединение марганца. Исследованию и моделированию состава данного осадка и посвящена данная статья.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили двумя способами: 1) взаимодействием марганца углекислого основного MnCO3 ∙ Mn(OH)2 ∙ nH2O c лимонной кислотой C6H8O7 ∙ H2O и 2) путем обменной реакции марганца азотнокислого Mn(NO3)3 с раствором лимонной кислоты. В первом способе в нагретый до 40–50°С раствор лимонной кислоты вносили марганец углекислый и выдерживали при перемешивании при 80–95°С, поддерживая постоянный объем раствора. Выпавший осадок выдерживали под маточным раствором в течение 24 ч для полноты протекания реакции и наступления равновесия, отфильтровывали и промывали дистиллированной водой. Во втором способе в растворе марганца азотнокислого с рН 3–4 растворяли при 40–50°С лимонную кислоту и перемешивали в течение 2 ч. Полученный раствор оставляли на несколько суток. Согласно мезокинетической модели образования твердого вещества, описанной в [27], после внесения реагентов, содержащих катионы марганца, в раствор лимонной кислоты начинали образовываться мелкие кластеры цитратов марганца, соизмеримые с размерами самих молекул. Эти кластеры играли роль первичных зародышей частиц, на которых формировались более крупные агрегаты. При увеличении их массы больше определенного значения они оседали на дно. Выпавший осадок отфильтровывали. В обоих экспериментах осадки сушили в сушильном шкафу при 40–50°С в течение 6–8 ч до постоянной массы.
Соотношение катионов d-металлов и лимонной кислоты при синтезе катодных материалов литий-ионных аккумуляторов (ЛИА) в зависимости от их состава и технологической схемы может изменяться [22]. Следовательно, выпадающий в осадок цитрат марганца мог состоять из смеси цитратов марганца или кристаллизоваться с разным количеством цитрат-ионов. Поэтому синтез образцов был выполнен из реакционных растворов с различным соотношением Mn2+/(Н3C6H5O7) ∙ H2O (табл. 1).
Таблица 1.
Условия синтеза и результаты анализа продукта
| № опыта |
Mn : H3Cit | Состав осадка | Δmexp, % | С, % | Соль марганца |
|---|---|---|---|---|---|
| 1 | 1 : 2 | Mn(НC6H5O7) ∙ H2O | 71.0 | 27.0 | MnCO3 ∙ Mn(OH)2 ∙ nH2O |
| 2 | 1 : 1 | Mn(НC6H5O7) ∙ H2O | 70.5 | 26.7 | MnCO3 ∙ Mn(OH)2 ∙ nH2O |
| 3 | 1 : 1 | Mn(НC6H5O7) ∙ H2O | 69.80 | 27.4 | Mn(NO3)2 |
| 4 | 1 : 1.33 | Mn(НC6H5O7) ∙ H2O | 68.50 | – | Mn(NO3)2 |
Рентгенофазовый анализ оксидов марганца проводили на дифрактометре Shimadzu XRD-7000 (CuKα1-излучение). Определение кристаллической структуры цитрата марганца проводили на образце, полученном при кристаллизации в опыте 4. Дифрактограмма была получена при комнатной температуре на дифрактометре STADI P (Stoe), CuKα1-излучение в диапазоне углов 2θ от 5° до 120° с шагом 0.02°. Поликристаллический кремний (a = 5.43075(5) Å) был использован в качестве внешнего стандарта. Наличие возможных примесных фаз устанавливали путем сравнения их рентгенограмм с данными в базе данных PDF2. Рентгенограмма полученного цитрата марганца была проиндексирована с помощью программы TREOR и сравнена с аналогичной Mn(НC6H5O7) ∙ H2O [14]. Дифференциально-термический анализ (ДТА) образцов проводили на термоанализаторе DTG-60 Shimadzu (Япония) от 30 до 500°C со скоростью нагрева 5°C в минуту. Определение общего количества содержащегося в образцах углерода проводили с помощью экспресс-анализатора “Метавак-СS-30” по методике, описанной в [28].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
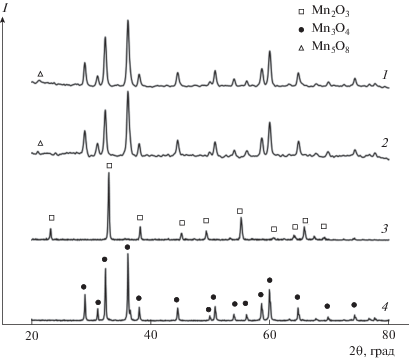
Чтобы определить ориентировочный состав цитрата марганца, выпадающего из концентрированных растворов (~120 г/л ∑Ni, Mn, Co) азотнокислых солей d-металлов, лимонной кислоты с глицином при получении катодных материалов ЛИА, осадки прокаливали при температуре 800°С в течение 5 ч. После такой термообработки они теряли кристаллизационную воду и цитратный анион, переходя в Mn3O4 (PDF 24-0734) тетрагонального типа или в Mn2O3 с орторомбической структурой (PDF 24-0508), близкой к кубической (рис. 1). В образцах, приготовленных из карбоната марганца основного, присутствуют следы Mn5O8 (PDF 39-1218).
Рис. 1.
Дифрактограммы оксидов марганца после прокалки образцов при 800°C: 1 – опыт 1, 2 – опыт 2, 3 – опыт 3, 4 – опыт 4.
В случае образования солей с разным составом цитрат-аниона и количеством кристаллизационной воды расчетные потери массы при прокаливании должны быть различными (табл. 2).
Таблица 2.
Теоретические потери массы образцов цитратов марганца разного состава после прокаливания при 800°С в расчете на получение Mn3O4 или Mn2O3
| № | Состав | M, г/моль | Δmtheor, % (по Mn3O4/Mn2O3) |
Δm(H2O), % | Сtheor, % |
|---|---|---|---|---|---|
| 1 | Mn3O4 | 228.82 | – | – | – |
| 2 | Mn2O3 | 157.88 | – | – | – |
| 3 | Mn3(C6H5O7)2 | 543.04 | 57.86/56.39 | – | 26.5 |
| 4 | Mn3(C6H5O7)2 · 9H2O | 705.22 | 67.55/66.42 | 23.00 | 20.4 |
| 5 | Mn3(C6H5O7)2 · 10H2O | 723.24 | 68.36/67.26 | 24.92 | 19.9 |
| 6 | Mn3(C6H5O7)2 · 11H2O | 741.26 | 69.13/68.05 | 26.74 | 19.4 |
| 7 | Mn3(C6H5O7)2 · 12H2O | 759.28 | 69.86/68.81 | 28.48 | 19.0 |
| 8 | Mn(НC6H5O7) | 245.06 | 68.88/67.79 | – | 29.4 |
| 9 | Mn(НC6H5O7) ∙ H2O | 263.08 | 71.00/70.00 | 6.85 | 27.4 |
| 10 | Mn(НC6H5O7) ∙ 2H2O | 281.10 | 72.87/71.92 | 12.82 | 25.6 |
| 11 | Mn(НC6H5O7) ∙ 3H2O | 299.12 | 74.50/73.61 | 18.07 | 24.1 |
| 12 | Mn(НC6H5O7) ∙ 4H2O | 317.14 | 75.95/75.11 | 22.73 | 22.7 |
| 13 | Mn(НC6H5O7) ∙ 5H2O | 335.16 | 77.24/76.45 | 26.88 | 21.5 |
| 14 | Mn(Н2C6H5O7)2 | 437.20 | 82.55/81.94 | – | 33.0 |
Но все исследованные образцы цитрата марганца после 5 ч прокаливания в муфельной печи при 800°C продемонстрировали практически одинаковую убыль массы: 68.5–71.0% (табл. 1), хотя были получены при различных соотношениях Mn2+ и C6H8O7 ∙ H2O. В табл. 2 представлены теоретические потери массы образцов цитратов марганца после прокаливании до образования Mn2O3 и Mn3O4. Полученные данные указывают на формирование двузамещенного цитрата марганца с содержанием 1 моля кристаллизационной воды Mn(НC6H5O7) ∙ H2O. Небольшой разброс в потере массы может быть связан со следующими факторами: 1) с потерей части кристаллизационной воды при сушке, 2) с процессами гидратации оксидов марганца после прокаливания, 3) с процессами диссоциации оксидов марганца Mn2O3 и Mn3O4 при прокаливании. Диссоциация Mn2O3 и Mn3O4 происходит в соответствии с уравнениями (1) и (2) при условии, что давление кислорода над оксидом превышает парциальное давление кислорода в камерной печи:
(1)
$6{\text{M}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \to 4{\text{M}}{{{\text{n}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} + {{{\text{O}}}_{2}},$(2)
$2{\text{M}}{{{\text{n}}}_{{\text{3}}}}{{{\text{O}}}_{4}} \to 6{\text{MnO}} + {{{\text{O}}}_{2}}.$Парциальное давление кислорода (мм рт. ст.) в логарифмических единицах равно 2.2. А давление кислорода над оксидами при 800°С для Mn2O3 не превышает 1.8, а для Mn3O4 – (–4) [29]. Следовательно, разброс в потере массы в большей степени связан с погрешностями в процессах гидратации и сушки образцов.
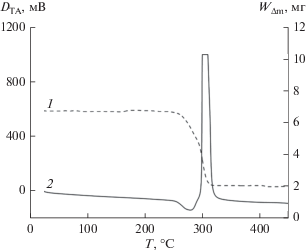
Эти выводы подтверждают результаты дифференциально-термического анализа образца 3 (рис. 2). На термограмме видно, что процесс разложения протекает в два этапа: потеря кристаллизационной воды и начало разложения цитрат-иона (эндотермический процесс). Затем на него накладывается окисление продуктов разложения цитрат-иона (экзотермический процесс). Процесс разложения начинается при 280°С и заканчивается при 302°С. Содержание углерода в образцах составляет 27.0 ± 0.4%, т.е. соответствует выбранному составу цитрата марганца.
Идентичность осадка двузамещенному одноводному цитрату марганца подтверждает и проведенный рентгеноструктурный анализ (рис. 3): соединение кристаллизуется в кристаллической решетке орторомбического типа (табл. 3) и изоструктурно Mn(C6H6O7) (H2O), описанному в [14].
Таблица 3.
Параметры кристаллической структуры Mn(НC6H5O7) ∙ H2O
| Параметры | Mn(C6H6O7) (H2O) [14] | Mn(НC6H5O7) ∙ H2O |
|---|---|---|
| Кристаллическая структура | Орторомбическая | Орторомбическая |
| Пространственная группа | P212121 | P212121 |
| a, Å | 6.030 (1) | 6.03792(6) |
| b, Å | 10.467(1) | 10.46878(15) |
| c, Å | 13.568 (1) | 13.58013(19) |
| V, Å3 | 856.4 (2) | 858.396(19) |
| Z | 4 | 4 |
Проведенные эксперименты показали, что из слабокислых цитратных растворов в интервале соотношения Mn2+/(Н3C6H5O7) ∙ H2O от 1 : 1 до 1 : 2 медленно кристаллизуется малорастворимый осадок цитрата марганца состава Mn(НC6H5O7) ∙ H2O.
ЗАКЛЮЧЕНИЕ
Проведено определение состава осадка, выпадающего из азотнокислых растворов никеля, марганца и кобальта для синтеза в реакциях SCS после введения лимонной кислоты и глицина. Осадок представляет собой одноводный двузамещенный цитрат марганца Mn(НC6H5O7) ∙ H2O, кристаллизующийся в ромбической сингонии и мало растворимый в слабокислых и нейтральных растворах. Выпадение осадка цитрата марганца из рабочих растворов для метода SCS необходимо учитывать, так как оно нарушает стехиометрию получаемых оксидов, меняет сам процесс и условия синтеза. Технологические растворы, в состав которых входит лимонная кислота и марганец азотнокислый, должны иметь рН < 1–2 для предотвращения кристаллизации осадка.
Работа выполнена в соответствии с государственным заданием Института химии твердого тела УрO РАН (темы № АААА-А19-119031890026-6 и АААА-А19-119031890028-0).
ОБОЗНАЧЕНИЯ
| a, b, c | параметры кристаллической решетки, Å |
| С | содержание углерода, % |
| D | тепловой поток, мВ |
| I | интенсивность |
| M | молярная масса, г/моль |
| Δm | убыль массы, г |
| T | температура, °C |
| V | параметр кристаллической решетки, Å3 |
| W | масса образца, мг |
| Z | координационное число |
| θ | угол, град |
ИНДЕКСЫ
Список литературы
Wang W., Zhang X., Chen F., Ma C., Chen C., Liu Q., Liao D., Li L. Homo- and hetero-metallic manganese citrate complexes: Syntheses, crystal structures and magnetic properties // Polyhedron. 2005. V. 24. P. 1656.
Zhou Z., Huang Y., Jiang Y. Synthesis, structure and spectroscopic properties of nickel(II) citrato complexes // Chin. J. Inorg. Chem. 1997. V. 13. P. 385.
Sagatys D.S., Smith G., Bott R.C., Lynch D.E., Kennard C.H.L. Preparation and crystal structure of polymeric ammonium silver(I) citrate hydrate, {NH4[Ag2(C6H5O7)(H2O)]}n // Polyhedron. 1993. V. 12. P. 709.
Tsuji S., Shibata T., Ito Y., Fujii S., Tomita K.I. Structure of zinc(II) (RS)-l-isopropyl citrate tetrahydrate // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 1991. V. 47. P. 528.
Tsaramyrsi M., Kaliva M., Salifoglou A., Raptopoulou C.P., Terzis A., Tangoulis V., Giapintzakis J. Vanadium(IV)−citrate complex interconversions in aqueous solutions. A pH-dependent synthetic, structural, spectroscopic, and magnetic study // Inorg. Chem. 2001. V. 40. P. 5772.
Kakihana M., Tada M., Shiro M., Petrykin V., Osada M., Nakamura Y. Structure and stability of water soluble (NH4)8[Ti4(C6H4O7)4(O2)4] · 8H2O // Inorg. Chem. 2001. V. 40. P. 891.
Feng T.L., Gurian P.L., Healy M.D., Barron A.R. Aluminum citrate: isolation and structural characterization of a stable trinuclear complex // Inorg. Chem. 1990. V. 29. P. 408.
Willey G.R., Somasunderam U., Aris D.R., Errington W. Ge(IV)–citrate complex formation: synthesis and structural characterisation of GeCl4(bipy) and GeCl(bipy)(Hcit) (bipy=2,2'-bipyridine, H4cit=citric acid) // Inorg. Chim. Acta. 2001. V. 315. P. 191.
Asato E., Katsura K., Mikuriya M., Turpeinen U., Mutikainen I., Reedijk J. Synthesis, structure, and spectroscopic properties of bismuth citrate compounds and the bismuth-containing ulcer-healing agent colloidal bismuth subcitrate (CBS). 4. Crystal structure and solution behavior of a unique dodecanuclear cluster (NH4)12[Bi12O8(cit)8](H2O)10// Inorg. Chem. 1995. V. 34. P. 2447.
Bott R.C., Smith G., Sagatys D.S., Lynch D.E., Kennard C.H.L. Group 15 complexes with α-hydroxy carboxylic acids: 7. The preparation and structure determination of sodium (+)-tartrato arsenate(III), [Na8As10(C4H2O6)8(C4H3O6)2(H2O)19]n; silver(I) (+)-tartrato arsenate(III), [Ag9As10(C4H2O6)9(C4H3O6)(H4As2O5) (H2O)10]n and rubidium citrato antimonate(III), [Rb2Sb4(C6H5O7)2(C6H6O7)2(C6H7O7)4(H2O)2] // Aust. J. Chem. 2000. V. 53. P. 917.
Matzapetakis M., Karligiano N., Bino A., Dakanali M., Raptopoulou C.P., Tangoulis V., Terzis A., Giapintzakis J., Salifoglou A. Manganese citrate chemistry: syntheses, spectroscopic studies, and structural characterizations of novel mononuclear, water-soluble manganese citrate complexes // Inorg. Chem. 2000. V. 39. P. 4044.
Deng Y.F., Zhou Z.H. Manganese citrate complexes: syntheses, crystal structures and thermal properties // J. Coord. Chem. 2009.V. 62. № 5. P. 778.
Glusker J.P., Carrell H.L. X-ray crystal analysis of the substrates of aconitase: XI. Manganous citrate decahydrate // J. Mol. Struct. 1973. V. 15. P. 151.
Deng Y.F., Zhou Z.H., Wan H.L., Ng S.W. Δ-Aqua-S-citrato(2-)-manganese(II) // Acta Crystallogr., Sect. E: Struct. Rep. Online. 2003. V. 59. P. m310.
Pechini M.P. Method of preparing lead and alkaline earth titanates and niobates and coating method using the same to form a capacitor. US Patent 3330697. 1967.
Tai L.W., Lessing P.A. Modified resin–intermediate processing of perovskite powders: Part I. Optimization of polymeric precursors // J. Mater. Res. 1992. V. 7. P. 502.
Tai L.W., Lessing P.A. Modified resin–intermediate processing of perovskite powders: Part II. Processing for fine, nonagglomerated Sr-doped lanthanum chromite powders // J. Mater. Res. 1992. V. 7. P. 511.
Behera P.S., Bhattacharyya S., Sarkar R. Effect of citrate to nitrate ratio on the sol-gel synthesis of nanosized α-Al2O3 powder // Ceram. Int. 2017. V. 43. P. 15221.
Singh K.A., Pathak L.C., Roy S.K. Effect of citric acid on the synthesis of nano-crystalline yttria stabilized zirconia powders by nitrate–citrate process // Ceram. Int. 2007. V. 33. P. 1463.
Zhuravlev V.D., Pachuev A.V., Nefedova K.V., Ermakova L.V. Solution-Combustion Synthesis of LiNi1/3Co1/3Mn1/3O2 as a cathode material for Lithium-Ion Batteries // Int. J. Self-Propag. High-Temp. Synth. 2018. V. 27. № 3. P. 154.
Lanina E.V., Zhuravlev V.D., Ermakova L.V., Pet-rov A.N., Pachuev A.V., Sheldeshov N.V. Electrochemical performances of composite cathode materials Li1.2Ni0.17Co0.10Mn0.53O2 and Li1.2Ni0.2Mn0.6O2 // Electrochim. Acta. 2016. V. 212. P. 810.
Журавлев В.Д., Нефедова К.В., Щеколдин С.И., Пачуев А.В. Способ получения катодного материала для литий-ионных аккумуляторов. Пат. 2643164 РФ. 2018.
Hedwig G.R., Liddle J.R., Reeves R.D. Complex formation of nickel(II) ions with citric acid in aqueous solution: a potentiometric and spectroscopic study // Aust. J. Chem. 1980. V. 33. P. 1685.
Sugawara M., Ohno M., Matsuki K. Novel preparation method of manganese(II) manganese(IV) oxide (Mn2Mn3O8, Mn5O8) by citrate process // Chem. Lett. 1991. V. 20. P. 1465.
Vasei V.H., Masoudpanah S.M., Adeli M., Aboutalebi M.R. Photocatalytic properties of solution combustion synthesized ZnO powders using mixture of CTAB and glycine and citric acid fuels // Adv. Powder Technol. 2019. V. 30. P. 284.
Kachhawaha M.S, Bhattacharya A.K. Electrometric study of the system Mn(II)-citrate // Z. Anorg. Allg. Chem. 1962. V. 315. P. 104.
Melikhov I.V., Simonov E.F. A model of an evolutionary route for the preparation of functional materials // Theor. Found. Chem. Eng. 2011. V. 45. № 5. P. 581. [Мелихов И.В., Симонов Е.Ф. Модель эволюционного маршрута создания функциональных материалов // Теор. осн. хим. технол. 2011. Т. 45. № 5. С. 490.]
Zhuravlev V.D., Nefedova K.V., Khaliullin Sh.M., Baklanova I.V., Buldakova L.Yu. Combustion in the Cu(NO3)2– Al(NO3)3–H2O–polyvinyl alcohol system: synthesis of CuO/Al2O3 // Combust., Explos., Shock Waves. 2019. V. 55. № 2. P. 167. [Журавлев В.Д., Нефедова К.В., Халиуллин Ш.М., Бакланова И.В., Булдакова Л.Ю. Процессы горения в системе Cu(NO3)2–Al(NO3)3–H2O–ПВС: синтез нанокомпозитов CuO/Al2O3 // Физ. горения взрыва. 2019. Т. 55. № 2. С. 50.]
Казенас Е.К., Чижиков Д.М. Давление и состав пара над окислами химических элементов. М.: Наука, 1976.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии