Теоретические основы химической технологии, 2021, T. 55, № 1, стр. 110-115
Экстракция молочной кислоты с использованием системы полиэтиленгликоль–сульфат натрия–вода
И. В. Зиновьева a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 25.09.2020
После доработки 30.09.2020
Принята к публикации 05.10.2020
Аннотация
Предложена экстракционная система на основе полиэтиленгликоля 1500 и сульфата натрия для извлечения молочной кислоты из водных растворов. Исследовано влияние времени проведения экстракции, исходной концентрации молочной кислоты, молекулярной массы полимера, содержания полимера и сульфата натрия в системе на извлечение молочной кислоты. На основании полученных экспериментальных данных показана возможность выделения молочной кислоты из растворов ферментации с использованием предложенной экологически безопасной экстракционной системы.
ВВЕДЕНИЕ
Разработка и внедрение “зеленых” методов получения химических веществ в настоящее время является ключевым вопросом в создании экологически безопасных безотходных технологий [1, 2]. Концепция производства необходимых химических продуктов из недорогих возобновляемых материалов (например, биомасса и отходы) при их одновременной утилизации получила широкое признание в промышленности [3, 4]. Одно- и многоатомные спирты, ацетон, карбоновые кислоты (масляная, янтарная, лимонная) и другие соединения с давних времен [5–7] получают с использованием процесса ферментации углеводов (например, моно- и дисахаридов). Одним из наиболее распространенных веществ, которое синтезируется путем ферментации в промышленном масштабе, является молочная кислота. Она широко используется в пищевой, фармацевтической, косметической промышленности, а также как прекурсор для синтеза акриловых полимеров и полиэфиров [8]. В полимерной промышленности из молочной кислоты получают биополимер полилактид – биоразлагаемый полимер, применяемый для изготовления упаковки, одноразовой посуды, средств личной гигиены, домашнего текстиля, детских игрушек и т.д. [9]. В промышленности ~90% молочной кислоты получают микробиологическим методом [3]. Почти все современные технологии получения молочной кислоты основаны на культивировании различных штаммов лактобактерий с последующим выделением синтезируемой кислоты из ферментационной среды.
Традиционным методом извлечения молочной кислоты из раствора ферментации является осаждение лактата кальция, однако он дает низкую чистоту готового продукта и большое количество образующегося гипса. К настоящему времени в литературе описаны различные способы выделения и очистки молочной кислоты из растворов ферментации, включая дистилляцию [10], экстракцию [11], мембранные методы [12], хроматографию [13], комбинацию нанофильтрации и обратного осмоса [14], адсорбцию [15], электродиализ [16] и др. Тем не менее промышленное применение большинства предложенных методов может быть ограничено из-за присущих им недостатков, таких как малая эффективность процесса, высокое энергопотребление, использование дорогостоящих материалов или оборудования [17]. Процесс выделения кислоты из водных сред является самым высокозатратным этапом при ее производстве, в связи с этим применение эффективных и экономически выгодных методов выделения молочной кислоты из раствора ферментации и ее очистки является важной практической задачей. Жидкостная экстракция применяется для выделения и разделения органических кислот с использованием различных экстрагентов [18–20]. Использование органических экстрагентов, таких как триоктиламин, трибутилфосфат, триоктилфосфиноксид в различных растворителях (метилизобутилкетон, 1-октанол, диэтиловый эфир, бензол, 1-гексанол и их смеси) для экстракции молочной кислоты приводит к высоким значениям эффективности извлечения [21–24]. Однако не все экстрагенты можно использовать для извлечения органических кислот из растворов ферментации, так как они могут быть довольно токсичны по отношению к микроорганизмам [25], продуцирующим кислоты, что ограничивает их промышленное применение [26]. К примеру, хлорид три-н-октилметиламмония или диоктиламин являются крайне токсичными, бутилацетат и гексан проявляют умеренную токсичность в отношении жизнеспособности бактерий, а олеиловый спирт может быть пригоден в качестве растворителя для органических экстрагентов [27]. Решение проблем токсичности классических экстрагентов требует создания новых высокоэффективных и экологически безопасных систем.
Альтернативой традиционным экстракционным системам являются системы на основе водорастворимых полимеров [28–33], гидрофильных спиртов [34–36], ионных жидкостей [37, 38], которые обладают целым рядом преимуществ перед традиционными: мягкие условия проведения процесса, легкая утилизация, селективность и доступность. Так, в работе [32] для выделения масляной кислоты из модельного раствора ферментации была предложена экстракционная система полиэтиленгликоль 6000–сульфат натрия–вода. Показано, что предложенная система обладает высокой селективностью по отношению к масляной кислоте, ее выход составляет 91%. Применение двухфазных водных систем в экстракции оправдано не только высокой селективностью и эффективностью извлечения, но и использованием простых и нетоксичных компонентов, что позволяет сохранять жизнеспособность микроорганизмов для повторного применения [39, 40]. Авторами в работах [41, 42] исследовано распределение и рост микробиологических клеток в системах полимер–соль или полимер–полимер и подтверждено, что в таких системах сохраняется их жизнеспособность.
Настоящая работа направлена на изучение экстракции молочной кислоты в двухфазной водной системе на основе полиэтиленгликоля (ПЭГ) и сульфата натрия, а также на оценку влияния различных факторов (содержания полимера и соли в системе, исходной концентрации кислоты, молекулярной массы полимера) на эффективность ее извлечения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения экстракционных экспериментов использовали молочную кислоту марки Acros Organics (90%). Исходный раствор молочной кислоты готовили с концентрацией 0.01 моль/л разбавлением в дистиллированной воде.
Для приготовления двухфазных водных систем использовали полиэтиленгликоли с молекулярными массами 1500, 2000, 3000, 4000 и 6000 и фазообразующий компонент Na2SO4 фирмы Fluka. Исследование экстракционных равновесий проводили при температуре 25°С в градуированных пробирках с пришлифованными пробками в термостатированном шейкере Enviro-Genie (Scientific Industries, Inc.) при скорости перемешивания 40 об./мин. После расслаивания измеряли объемы фаз, разделяли и определяли концентрацию молочной кислоты в полимерной и солевой фазах.
Содержание молочной кислоты в полимерной и солевой фазах, а также в исходном растворе определяли методом высокоэффективной жидкостной хроматографии. Для этого использовали жидкостный хроматограф “Стайер” со спектрофотометрическим детектором UVV 104.1M (Аквилон, Россия). Хроматографическое определение осуществляли с использованием колонки Rezex ROA-Organic acid (Phenomenex, США) 300 × 7.8 и подвижной фазы состава 0.005 н H2SO4. Спектрофотометрическое детектирование проводили в УФ-области при длине волны 210 нм. Управление хроматографом и обработка полученных данных осуществлялись с помощью программного обеспечения “МультиХром” версии 3.1.
Все эксперименты проводились не менее трех раз и обработаны методом математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
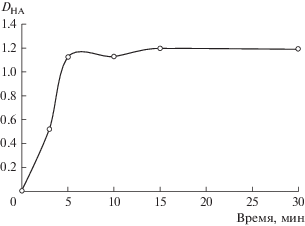
Проведено исследование межфазного распределения молочной кислоты в экстракционной системе полиэтиленгликоль–сульфат натрия–вода. Установлены количественные характеристики экстракции молочной кислоты в системе ПЭГ 1500 (15 мас. %)–Na2SO4 (9 мас. %)–H2O, коэффициент распределения (DHA) и степень извлечения (EHA) составили 1.2 и 55.54% соответственно. На рис. 1 представлены результаты исследования по определению времени установления термодинамического равновесия при экстракции молочной кислоты в системе. Установлено, что 15 мин достаточно для установления равновесия в системе.
Рис. 1.
Зависимость коэффициента распределения молочной кислоты от времени контакта фаз в системе ПЭГ 1500–Na2SO4–H2O при [HA]исх = 0.01 моль/л, T = 25°С, Vпол. ф./Vсол. ф. = 1.
Проведя сравнительный анализ результатов, полученных нами и другими авторами [43, 44], в системах с наиболее часто используемыми экстрагентами (нейтральными и ионообменными кислород-, азот- и фосфорсодержащими органическими соединениями), можно сделать вывод, что по совокупности факторов двухфазная водная система на основе полиэтиленгликоля 1500 в большинстве случаев предпочтительнее традиционных экстрагентов для извлечения молочной кислоты (табл. 1). Как было отмечено выше, использование большинства органических экстрагентов и разбавителей негативно влияет на жизнеспособность микроорганизмов и тем самым на выход готового продукта [45]. В свою очередь, системы на основе полиэтиленгликолей применяются для извлечения биологических соединений (нуклеиновых кислот, клеток, белков) ввиду мягких условий проведения процесса [46, 47].
Таблица 1.
Коэффициенты распределения молочной кислоты в различных экстракционных системах
| Экстрагенты | D | Литературный источник |
|---|---|---|
| Гексан | 0.04 | [48] |
| Гексан–10% гексанол | 0.09 | [48] |
| Толуол | 0.05 | [48] |
| Н-октанол | 0.32 | [23] |
| Н-пентанол | 0.40 | [23] |
| Диэтиловый эфир | 0.10 | [23] |
| Метилизобутилкетон | 0.14 | [23] |
| ТБФ | ~1 | [49] |
| Aliquat 336 | 1.65 | [50] |
| 50% Alamine 336/2-октанол | 2.35 | [50] |
| 40% Alamine 336/метилизобутилкетон | 4.24 | [51] |
| ПЭГ 1500 (15 мас. %)–Na2SO4 (9 мас. %)–H2O | 1.20 | Настоящее исследование |
В зависимости от условий проведения процесса ферментации (температуры, значений рН среды, времени инкубирования и др.), типа используемой культуры и количества углеводов концентрация полученной молочной кислоты может варьироваться. Поэтому для определения влияния исходной концентрации молочной кислоты на эффективность ее извлечения в системе ПЭГ 1500–Na2SO4–H2O была построена изотерма экстракции в диапазоне концентраций от 0.002 до 0.1 моль/л. На рис. 2 представлена экспериментальная изотерма экстракции молочной кислоты, имеющая прямолинейный характер зависимости. В данном случае коэффициент распределения не зависит от исходной концентрации извлекаемой кислоты, что важно при проведении экспериментов на реальных растворах ферментации. Полученные зависимости аналогичны зависимостям для ряда алифатических и ароматических кислот в экстракционной системе на основе ПЭГ 1500 [28, 31]. Наиболее вероятным механизмом экстракции молочной кислоты в исследуемой двухфазной водной системе является ее распределение за счет образования водородных связей с молекулами ПЭГ.
Рис. 2.
Изотерма экстракции молочной кислоты в системе ПЭГ 1500–Na2SO4–H2O при T = 25°С, Vпол. ф./Vсол. ф. = 1.
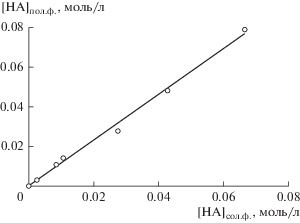
Рис. 3.
Зависимость степени извлечения молочной кислоты от молекулярной массы полиэтиленгликоля при [HA]исх = 0.01 моль/л, T = 25°С.
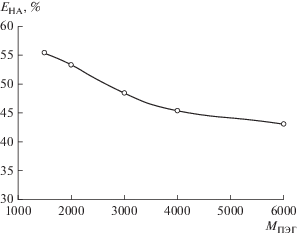
Молекулярная масса полимера оказывает влияние на межфазное распределение органических веществ ввиду изменения гидрофобности фазы или стерических эффектов. Ранее в работе [52] было показано, что при увеличении молекулярной массы полиэтиленгликоля коэффициент распределения клавулановой кислоты уменьшается. Нами изучено влияние молекулярной массы полимера на распределение молочной кислоты в исследуемой системе. Была получена зависимость степени извлечения кислоты от молекулярной массы ПЭГ (рис. 3). Показано, что с увеличением молекулярной массы полимера в системе происходит уменьшение степени извлечения молочной кислоты. Вероятная причина этого заключается в увеличении гидрофобности полимерной фазы, сопровождающейся ростом молекулярной массы полимера, что затрудняет распределение гидрофильной молочной кислоты в ПЭГ-фазу. Кроме того, при увеличении молекулярной массы полимера возрастает вязкость полимерной фазы, затрудняя экстракцию кислоты. Аналогичная зависимость наблюдалась в работе [53] при экстракции фермента полифенолоксидазы в системе, состоящей из 14 мас. % ПЭГ и 14 мас. % фосфата калия.
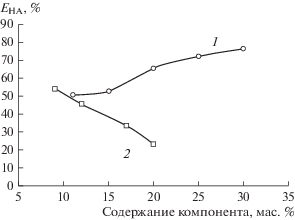
Известно, что жидкие питательные среды для инкубирования молочнокислых бактерий и грибков содержат в своем составе разнообразные неорганические соли: фосфаты, сульфаты, ацетаты, цитраты и др. [54]. Варьирование концентрации как соли, так и полимера в двухфазной водной системе может влиять на экстракцию органических соединений [55]. Таким образом, изучено влияние состава системы на межфазное распределение молочной кислоты. Были проведены исследования с постоянным содержанием ПЭГ 1500 (15 мас. %) при варьировании содержания неорганической соли в системе, и наоборот, варьировали содержание полимера при постоянном содержании Na2SO4 (9 мас. %). Из рис. 4 видно, что степень извлечения молочной кислоты возрастает при увеличении содержания ПЭГ и уменьшении содержания сульфата натрия в системе.
Рис. 4.
Зависимость степени извлечения молочной кислоты от содержания полимера (1) и сульфата натрия (2) в системе ПЭГ 1500–Na2SO4–H2O при [HA]исх = 0.01 моль/л, T = 25°С.
Разработка новых химико-технологических решений для задач извлечения органических кислот из ферментационных растворов и их практическая реализация невозможны без предварительного установления закономерностей процесса экстракции. Полученные нами зависимости позволяют оценить эффективность применения предложенной экстракционной системы на основе ПЭГ 1500 для извлечения молочной кислоты из водных сред. В ходе настоящей работы проведены эксперименты по извлечению молочной кислоты из реального раствора ферментации с использованием системы ПЭГ 1500 (15 мас. %)–Na2SO4 (9 мас. %)–H2O. Подтверждено, что экстракционная система на основе водорастворимого полимера эффективна для решения поставленной задачи выделения кислоты, к тому же, проведенная оценка жизнеспособности микроорганизмов показала возможность их дальнейшего использования. Для разработки полной принципиальной технологической схемы экстракции молочной кислоты из растворов молочнокислого брожения необходимы дальнейшие исследования.
ЗАКЛЮЧЕНИЕ
В настоящей работе предложена экологически безопасная экстракционная система на основе полиэтиленгликоля 1500 и сульфата натрия для извлечения молочной кислоты из водного раствора; получены количественные характеристики экстракции. Установлена возможность эффективного извлечения молочной кислоты в широком диапазоне составов. Полученные данные иллюстрируют возможность успешного использования двухфазных водных систем в качестве конкурентной альтернативы существующим решениям в задачах извлечения молочной кислоты.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований.
ОБОЗНАЧЕНИЯ
ИНДЕКСЫ
Список литературы
Mäki-Arvela P., Simakova I.L., Salmi T., Murzin D.Y. Production of lactic acid/lactates from biomass and their catalytic transformations to commodities // Chem. Rev. 2013. V. 114. № 3. P. 1909.
Ahmad A., Banat F., Taher H. A review on the lactic acid fermentation from low-cost renewable materials: Recent developments and challenges // Environ. Technol. Innovation. 2020. V. 20. Article 101138.
Wang Y., Tashiro Y., Sonomoto K. Fermentative production of lactic acid from renewable materials: Recent achievements, prospects, and limits // J. Biosci. Bioeng. 2015. V. 119. № 1. P. 10.
Eş I., Mousavi Khaneghah A., Barba F.J., Saraiva J.A., Sant’Ana A.S., Hashemi S.M.B. Recent advancements in lactic acid production – a review // Food Res. Int. 2018. V. 107. P. 763.
Northrop J.H., Ashe L.H., Morgan R.R. A fermentation process for the production of acetone and ethyl alcohol // Ind. Eng. Chem. 1919. V. 11. № 8. P. 723.
Abdel-Rahman M.A., Tashiro Y., Sonomoto K. Recent advances in lactic acid production by microbial fermentation processes // Biotechnol. Adv. 2013. V. 31. № 6. P. 877.
Papagianni M. Advances in citric acid fermentation by Aspergillus niger: Biochemical aspects, membrane transport and modeling // Biotechnol. Adv. 2007. V. 25. № 3. P. 244.
Wasewar K.L., Yawalkar A.A., Moulijn J.A., Pangarkar V.G. Fermentation of glucose to lactic acid coupled with reactive extraction: a review // Ind. Eng. Chem. Res. 2004. V. 43. № 19. P. 5969.
Current Developments in Biotechnology and Bioengineering / Eds. Wong J., Tyagi R., Pandey A. Amsterdam: Elsevier, 2017.
Kim J.Y., Kim Y.J., Hong W.H., Wozny G. Recovery process of lactic acid using two distillation columns // Biotechnol. Bioprocess Eng. 2000. V. 5. P. 196.
Zakhodyaeva Y.A., Voshkin A.A., Belova V.V., Kosta-nyan A.E., Khol’kin A.I. Extraction of lactic acid from technological (concentrated) solutions // Theor. Found. Chem. Eng. 2010. V. 44. P. 782.
Gössi A., Burgener F., Kohler D., Urso A., Kolvenbach B.A., Riedl W., Schuur B. In-situ recovery of carboxylic acids from fermentation broths through membrane supported reactive extraction using membrane modules with improved stability // Sep. Purif. Technol. 2020. V. 241. Article 116694.
Arcanjo M.R.A., Fernandes F.A.N., Silva I.J. Separation of lactic acid produced by hydrothermal conversion of glycerol using ion-exchange chromatography // Adsorpt. Sci. Technol. 2015. V. 33. № 2. P. 139.
Li Y., Shahbazi A., Williams K., Wan X. Separate and concentrate lactic acid using combination of nanofiltration and reverse osmosis membranes // Appl. Biochem. Biotechnol. 2008. V. 147. P. 1.
Evangelista R.L., Nikolov Z.L. Recovery and purification of lactic acid from fermentation broth by adsorption // Appl. Biochem. Biotechnol. 1996. V. 57. P. 471.
Hábová V., Melzoch K., Rychtera M., Sekavová B. Electrodialysis as a useful technique for lactic acid separation from a model solution and a fermentation broth // Desalination. 2004. V. 162. P. 361.
Yan L., Sun Y.-Q., Xiu Z.-L. Sugaring-out extraction coupled with fermentation of lactic acid // Sep. Purif. Technol. 2016. V. 161. P. 152.
Zakhodyaeva Y.A., Voshkin A.A., Belova V.V., Khol’kin A.I. Extraction of monocarboxylic acids with binary extracting agents based on amines and quaternary ammonium bases // Theor. Found. Chem. Eng. 2011. V. 45. P. 739.
Zakhodyaeva Y.A., Voshkin A.A., Belova V.V. Khol’kin A.I. Extraction of monocarboxylic acids by trioctylmethylammonium di(2-ethylhexyl)phosphate // Theor. Found. Chem. Eng. 2012. V. 46. P. 413.
Belova V.V., Zakhodyaeva Y.A. Voshkin A.A. Extraction of carboxylic acids with neutral extractants // Theor. Found. Chem. Eng. 2017. V. 51. P. 786.
Tamada J.A., Kertes A.S., King C.J. Extraction of carboxylic acids with amine extractants. 1. Equilibria and law of mass action modeling // Ind. Eng. Chem. Res. 1990. V. 29. P. 1319.
Juang R.-S., Huang R.-H. Equilibrium studies on reactive extraction of lactic acid with an amine extractant // Chem. Eng. J. 1997. V. 65. P. 47.
Djas M., Henczka M. Reactive extraction of carboxylic acids using organic solvents and supercritical fluids: A review // Sep. Purif. Technol. 2018. V. 201. P. 106.
Lan K., Xu S., Li J., Hu C. Recovery of lactic acid from corn stover hemicellulose-derived liquor // ACS Omega. 2019. V. 4. № 6. P. 10571.
Martak J., Sabolova E., Schlosser S., Rosenberg M., Kristofíkova L. Toxicity of organic solvents used in situ in fermentation of lactic acid by Rhizopus arrhizus // Biotechnol. Tech. 1997. V. 11. P. 71.
Meng K., Zhang G., Ding C., Zhang T., Yan H., Zhang D., Fang T., Liu M., You Z., Yang C., Shen J., Jin X. Recent advances on purification of lactic acid // Chem. Rec. 2020. V. 20. P. 1.
Tong Y., Hirata M., Takanashi H., Hano T., Matsumoto M., Miura S. Solvent screening for production of lactic acid by extractive fermentation // Sep. Purif. Technol. 1998. V. 33. № 10. P. 1439.
Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Data on the extraction of benzoic, salicylic and sulfosalicylic acids from dilute solutions using PEG-based aqueous two-phase systems // Data Brief. 2020. V. 28. Article 105033.
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid–liquid equilibrium of aqueous two-phase system composed of poly(ethylene oxide) 1500 and sodium nitrate // J. Chem. Eng. Data. 2019. V. 64. № 3. P. 1250.
Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Interphase distribution of caffeine and coumarin in extraction systems with polyethylene glycol and sodium sulfate // Theor. Found. Chem. Eng. 2019. V. 53. № 6. P. 996.
Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Extraction of monocarboxylic acids from diluted solutions with polyethylene glycol // Theor. Found. Chem. Eng. 2019. V. 53. № 5. P. 871.
Wu X., Li G., Yang H., Zhou H. Study on extraction and separation of butyric acid from clostridium tyrobutyricum fermentation broth in PEG/Na2SO4 aqueous two-phase system // Fluid Phase Equilib. 2015. V. 403. P. 36.
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid–liquid equilibrium in an extraction system based on polyvinylpyrrolidone-3500 and sodium nitrate // Theor. Found. Chem. Eng. 2019. V. 53. № 2. P. 159.
Aydoğan Ö., Bayraktar E., Mehmetoğlu Ü. Aqueous two-phase extraction of lactic acid: optimization by response surface methodology // Sep. Sci. Technol. 2011. V. 46. № 7. P. 1164.
Li Z., Yan L., Zhou J., Wang X., Sun Y., Xiu Z.-L. Two-step salting-out extraction of 1,3-propanediol, butyric acid and acetic acid from fermentation broths // Sep. Purif. Technol. 2019. V. 209. P. 246.
Xu S., Lan K., Li J., He T., Hu C. Separation of lactic acid from synthetic solutions and the mixture directly derived from corn stover by aqueous two-phase extraction // Sep. Purif. Technol. 2018. V. 204. P. 281.
Li Y., Dai J.-Y., Xiu Z.-L. Salting-out extraction of acetoin from fermentation broths using hydroxylammonium ionic liquids as extractants // Sep. Purif. Technol. 2020. V. 240. Article 116584.
Dai J., Wang H., Li Y., Xiu Z.-L. Imidazolium ionic liquids-based salting-out extraction of 2,3-butanediol from fermentation broths // Process Biochem. 2018. V. 71. P. 175.
Rosa P.A.J., Ferreira I.F., Azevedo A.M., Aires-Barros M.R. Aqueous two-phase systems: A viable platform in the manufacturing of biopharmaceuticals // J. Chromatogr. A. 2010. V. 1217. № 16. P. 2296.
Panas P., Lopes C., Cerri M.O., Ventura S.P.M., Santos-Ebinuma V.C., Pereira J.F.B. Purification of clavulanic acid produced by Streptomyces clavuligerus via submerged fermentation using polyethylene glycol/cholinium chloride aqueous two-phase systems // Fluid Phase Equilib. 2017. V. 450. P. 42.
Mastiani, M., Firoozi, N., Petrozzi, N., Seo S., Kim M. Polymer-salt aqueous two-phase system (ATPS) micro-droplets for cell encapsulation // Sci. Rep. 2019. V. 9. Article 15561.
Badhwar P., Kumar P., Dubey K.K. Extractive Fermentation for process integration and amplified pullulan production by A. pullulans in aqueous two-phase systems // Sci. Rep. 2019. V. 9. Article 32.
Yankov D., Molinier J., Albet J., Malmary G., Kyuchoukov G. Lactic acid extraction from aqueous solutions with tri-n-octylamine dissolved in decanol and dodecane // Biochem. Eng. J. 2004. V. 21. № 1. P. 63.
Kyuchoukov G., Yankov D., Albet J., Molinier J. Mechanism of lactic acid extraction with quaternary ammonium chloride (Aliquat 336) // Ind. Eng. Chem. Res. 2005. V. 44. № 15. P. 5733.
Pérez A.D., Gómez V.M., Rodríguez-Barona S., Fontalvo J. Liquid–liquid equilibrium and molecular toxicity of active and inert diluents of the organic mixture tri-iso-octylamine/dodecanol/dodecane as a potential liquid membrane for lactic acid removal // J. Chem. Eng. Data. 2019. V. 64. № 7. P. 3028.
Phong W.N., Show P.L., Chow Y.H., Ling T.C. Recovery of biotechnological products using aqueous two-phase systems // J. Biosci. Bioeng. 2018. V. 126. № 3. P. 273.
Asenjo J.A., Andrews B.A. Aqueous two-phase systems for protein separation: Phase separation and applications // J. Chromatogr. A. 2012. V. 1238. P. 1.
Zakhodyaeva Y.A., Voshkin A.A., Belova V.V., Khol’kin A.I. Extraction of monocarboxylic acids with binary extracting agents based on amines and quaternary ammonium bases // Theor. Found. Chem. Eng. 2011. V. 45. № 5. P. 739.
Marinova M., Kyuchoukov G., Albet J., Molinier J., Malmary G. Separation of tartaric and lactic acids by means of solvent extraction // Sep. Purif. Technol. 2004. V. 37. № 3. P. 199.
Yang S.T., White S.A., Hsu S.T. Extraction of carboxylic acids with tertiary and quaternary amines: effect of pH // Ind. Eng. Chem. Res. 1991. V. 30. № 6. P. 1335.
Wasewar K.L., Pangarkar V.G., Heesink A.B.M., Versteeg G.F. Intensification of enzymatic conversion of glucose to lactic acid by reactive extraction // Chem. Eng. Sci. 2003. V. 58. № 15. P. 3385.
Pereira J.F.B., Santos V.C., Johansson H.-O., Teixeira J.A.C., Pessoa A. A stable liquid–liquid extraction system for clavulanic acid using polymer-based aqueous two-phase systems // Sep. Purif. Technol. 2012. V. 98. P. 441.
Niphadkar S.S., Vetal M.D., Rathod V.K. Purification and characterization of polyphenol oxidase from waste potato peel by aqueous two-phase extraction // Prep. Biochem. Biotechnol. 2015. V. 45. № 7. P. 632.
Chen P.-T., Hong Z.-S., Cheng C.-L., Ng I.-S., Lo Y.-C., Nagarajan D., Chang J.-S. Exploring fermentation strategies for enhanced lactic acid production with polyvinyl alcohol-Immobilized Lactobacillus plantarum 23 using microalgae as feedstock // Bioresour. Technol. 2020. V. 308. Article 123266.
Voshkin A.A., Zakhodyaeva Y.A., Zinov’eva I.V., Shkinev V.M. Interphase distribution of aromatic acids in the polyethylene glycol–sodium sulfate–water system // Theor. Found. Chem. Eng. 2018. V. 52. P. 890.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


