Теоретические основы химической технологии, 2021, T. 55, № 3, стр. 273-285
Дополнительное условие эффективности сверхкритического флюидного экстракционного процесса
Ф. М. Гумеров a, *, В. Ф. Хайрутдинов a, З. И. Зарипов a
a Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: gum@kstu.ru
Поступила в редакцию 10.07.2020
После доработки 30.09.2020
Принята к публикации 14.01.2021
Аннотация
На примере задачи экстракционного извлечения ценных компонентов (метилфенилкарбинол, ацетофенон, этилбензол, фенол, пропиленгликоль) промышленного водного стока процесса совместного получения стирола и оксида пропилена гидропероксидным методом ПАО “Нижнекамскнефтехим” сформулированы и обсуждены предпосылки к повышенной эффективности экстракционного процесса, реализуемого в сверхкритических флюидных условиях за пределами бинодали для систем целевая компонента–экстрагент I и II типов фазового поведения. Экспериментальное подтверждение высказанных предположений осуществлено посредством реализации процессов экстракционного извлечения метилфенилкарбинола и фенола из их водных растворов с использованием в качестве экстрагента диоксида углерода в жидком и сверхкритическом флюидном состояниях, а также сверхкритической пропан/бутановой смеси. Представлены результаты экспериментального исследования фазового равновесия термодинамической системы пропан/бутан–пропиленгликоль, проведенного при температурах 403, 423 и 443 К.
ВВЕДЕНИЕ
Сверхкритические флюидные технологии, окончательно утвердившиеся в своем статусе в 1970-е годы, существенно расширили границы профессионального интереса к такому понятию как растворимость. Если в прежние годы с этим понятием в подавляющем большинстве случаев мы сталкивались лишь в форме равновесной концентрации растворяемого вещества в жидком органическом растворителе, то в обновленных реалиях крайне важных и перспективных сверхкритических флюидных (СКФ) растворителей и экстрагентов (состояние плотного газа) [1–3] с аномальным ростом сжимаемости и иных свойств [4–6] в асимптотической близости к критической точке (на фоне практически несжимаемых растворителей в жидком состоянии) сформировано значимое в размерах научное пространство [7] для изучения, уточнения и расширения классических представлений. Речь идет, прежде всего, о таких подлежащих внимательному рассмотрению вопросах, как: границы применимости традиционных представлений о растворимости в СКФ-условиях применительно к некоторым типам фазовых равновесий в системах “растворяемое–растворитель”; кроссоверное поведение изотерм растворимости веществ в СКФ-растворителях [7]; сопоставительная эффективность экстракционных процессов с жидкофазным и сверхкритическим флюидным состояниями экстрагентов применительно к различным типам фазового равновесия в системах “растворяемое–растворитель” [3]; разработка новых методов описания и обобщения экспериментальных данных по растворимости с поиском прогностических возможностей в рамках обсуждаемого вопроса [7, 8] и, наконец, изучение целесообразности использования СКФ-растворителей иной физико-химической природы (за пределами широко распространенных СО2 и Н2О) [9–11].
Касательно существования вопроса о границах применимости традиционных представлений о растворимости в СКФ-условиях и необходимости увязки этого понятия с многообразием типов фазовых равновесий достаточно остановиться на одном простом примере: в наилучшем с точки зрения охвата веществ, анализа качества экспериментальных данных и объема материала справочнике по растворимости веществ в сверхкритическом диоксиде углерода (СК-СО2) [12] под вышеотмеченный статус введено достаточно большое количество экспериментальных данных, полученных на основе информации по составу для паровой ветви бинодали бинарной системы с диоксидом углерода (I и II типы фазового поведения [13]). Речь, к примеру, идет о таких системах, как “СО2-н-октан”, “СО2-декан”, “СО2-этанол”, “СО2-бутанол”, “СО2-пропанол”, “СО2-изопропанол”, “СО2-1-гексанол”, “СО2-3-гексанол”, “СО2-1-деканол”, “СО2-хлорбензол”, “СО2-уксусная кислота” и др. Казалось бы, легко понять, что лишь вершина бинодали для бинарной системы, полученной для определенной температуры, характеризует критическое давление, а все что предшествует этому и предполагает наличие границы раздела фаз является не сверхкритическим, а докритическим. Даже, если этот казус рассматривать, как условный и определяемый лишь выбором точки отсчета, то, как в этом случае определить (дать определение) и квалифицировать поведение растворимости во всей остальной и более значимой по размерам части термодинамического пространства, подпадающего под классическое определение СКФ-состояния: Т > Тс и Р > Рс? Анализ этого вопроса в литературе отсутствует.
Наличие двухфазного равновесия жидкость–пар и границы раздела фаз применительно к системе растворяемое–растворитель является необходимым условием реализации традиционных методов исследования растворимости веществ в СКФ-растворителях [7, 13], осуществляемых в статическом или динамическом режимах. В бинарных термодинамических системах V и VI типов с разрывной критической кривой по классификации Уильямса [13, 14] именно подобное поведение в широком диапазоне изменения параметров в СКФ-области состояния позволяет успешно исследовать растворимость, которая определяется его основными параметрами (Р, Т) и физико-химической природой растворяемого и растворителя. Однако для бинарных систем I и II типов (с непрерывной критической кривой) в СКФ-области состояния (за пределами бинодали) граница раздела фаз отсутствует. Стало быть, традиционные методы исследования растворимости в этом случае становятся неприменимыми и сразу возникают вопросы: как соотносятся представления о растворимости в этом случае и традиционном, а также какова в этой области растворимость с точки зрения его численного значения?
По факту, а это показывает наблюдение за фазовым состоянием обсуждаемой системы с использованием оптической ячейки высокого давления, граница раздела фаз отсутствует и даже независимо от количества растворяемой субстанции, изначально помещенной в измерительную ячейку. В этом случае растворимость, а возможно уже и “псевдорастворимость”, не являвшаяся никогда предметом обсуждения, в результате осуществления упомянутого метода исследования растворимости в динамическом режиме приобретает численные значения, существенно превосходящие, к примеру, те, что характерны для паровой ветви бинодали бинарной системы “растворяемое–растворитель”. Напомним, что именно динамический режим исследования растворимости по своей сути является аналогом экстракционного процесса.
В работе [15] при исследовании растворимости стирола, метилфенилкарбинола (1-фенилэтанол), ацетофенона и этилбензола в сверхкритическом СО2 (I–II типы фазового поведения) в отсутствие у авторов какой-либо информации по фазовым равновесиям систем и визуализации фазового состояния исследуемых объектов были сделаны ошибочные предположения о том, что гарантированно существует граница раздела фаз, что недостаточное заполнение ячейки (ниже среднего) не обеспечивает достаточного времени контакта фаз для установления равновесия и ведет к заниженным неравновесным значениям, тогда как излишнее заполнение той же экспериментальной ячейки, якобы способствует “поршневому выталкиванию” или капельному уносу растворяемого вещества с получением очевидно завышенных результатов, не имеющих нечего общего с характеристикой, основанной на молекулярном взаимодействии растворяемого и растворителя (основное методическое условие способа измерения растворимости). И, наконец, что где-то, близкая к серединной заливка обеспечивает равновесную концентрацию растворяемого вещества в растворителе. В итоге, авторами работы [15] в рамках динамического метода исследования растворимости на самом деле получены значения “псевдорастворимости”, отвечающие некоему среднему уровню заполнения измерительной ячейки растворяемым веществом.
Таким образом, в сверхкритической флюидной области состояния за пределами бинодали (для бинарных систем, проявляющих I–II тип фазового поведения) отсутствуют ограничения по смешиваемости растворяемого и растворителя, что в принципе может явиться дополнительным условием для существенного увеличения эффективности СКФ-экстракционного процесса. И если это действительно так, то подбор соответствующего растворителя, обеспечивающего I или II типы фазового поведения с растворяемым веществом, и осуществление экстракционного процесса в СКФ-условиях является залогом повышенной эффективности экстракционного процесса!
В случае же V–VI типов фазового равновесия с разрывной критической кривой (наличие границы раздела фаз в широком диапазоне изменения давления, включая область сверхкритических значений для растворителя), а также при достаточно хорошей, но не безграничной, смешиваемости растворяемого и растворителя, казалось бы можно ограничиться лишь жидкостной экстракцией при пониженных давлениях (без необходимости осуществления СКФ-экстракции, традиционно реализуемой при более высоких давлениях). Напомним, что плотность СКФ-растворителя, определяющая его растворяющую способность, достигает плотности жидкости лишь при более высоких и энергозатратных значениях давления, при которых растворяющие способности растворителя в жидком и сверхкритическом флюидном состояниях при прочих равных условиях становятся равными. Однако, склоняясь к подобному выводу, не следует забывать о высокой вероятности противоположной тенденции в части энергозатрат на этапах регенерации экстрагента и выделения экстракта. Важно отметить и то, что подобные рассуждения применительно к системам с V–VI типом фазового поведения вовсе не распространяются на случаи экстракционной и импрегнационной обработки высокопористых твёрдых матриц, так как полноценному осуществлению жидкофазного процесса препятствует имеющий место капиллярный эффект.
Таким образом, выбор в пользу процесса СКФ-экстракции не всегда является однозначным и, тем более произвольным [3, 13]. Вышеизложенное в ее экстракционной части и, в особенности, касательно возможных преимуществ осуществления экстракционного процесса в СКФ-области состояния за пределами бинодали бинарной системы целевая компонента–экстрагент согласуется с представлениями авторов работы [16], которые впервые обратили на это внимание.
Обсужденные выше вопросы термодинамической и экстракционной частей, сформировали предмет настоящего исследования применительно к задаче утилизации молибденсодержащего промышленного водного стока с использованием рабочих сред в сверхкритическом флюидном состоянии.
Утилизация молибденсодержащего стока процесса совместного получения стирола и оксида пропилена гидропероксидным методом, реализованным на ПАО “Нижнекамскнефтехим”, на протяжении достаточно длительного времени является важной, но до конца нерешенной задачей. Содержащиеся в водном стоке компоненты такие, как стирол, фенол, метилфенилкарбинол, ацетофенон, этилбензол, пропиленгликоль, молибден и др. представляют большую ценность для химических производств как исходное сырье. К примеру, по состоянию на момент завершения начального этапа исследований, результаты которых представлены в работах [15, 17], расход молибдена (металлический порошок) для приготовления каталитического комплекса составлял 48 т/год; из которого в процессе разделения и очистки продуктов реакции не менее 90%, переходя в вышеотмеченный сток, безвозвратно терялось. Очень неоправданная роскошь. По результатам ранее проведенных исследований [15, 17] был сделан вывод о том, что в задаче утилизации молибденсодержащего водного стока целесообразен двухстадийный процесс с использованием рабочих сред в СКФ-состоянии. Для выделения основной массы вышеперечисленных компонентов стока за исключением молибдена (первая стадия) был рекомендован сверхкритический флюидный экстракционный процесс. В качестве задач для второй стадии были поставлены окисление остатков компонентов водного стока в СКФ-условиях (СКВО-процесс) и одновременное осаждение неорганической составляющей стока, включающей и подлежащий выделению молибден.
Таким образом, целью настоящего исследования является экспериментальное подтверждение сформулированных выше предпосылок к повышенной эффективности сверхкритического флюидного экстракционного процесса, осуществляемого за пределами бинодали для бинарных систем целевая компонента–экстрагент I–II типа фазового поведения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы. В качестве компонентов термодинамических систем при изучении фазового равновесия и исследовании характеристик экстракционного процесса с экстрагентом (диоксид углерода в жидком и СКФ-состояниях, а также СКФ-пропан/бутановая смесь) использованы:
– пропиленгликоль (1,2-пропандиол) марки ЧДА с содержанием основного вещества не менее 93%;
– пропан/бутановая смесь (ГОСТ 8267-93), содержащая 45.8 мол. % пропана и 54.2 мол. % бутана. Критические параметры пропана и бутана согласно [18] характеризуются следующими значениями: пропан: Tс = 369.82 К (96.67°С), Pс = = 4.247 МПа; бутан Tс = 425 K (151.85°С), Pс = = 3.797 МПа. Согласно [19] вышеприведенный состав пропан/бутановой смеси имеет следующие значения критических параметров: Тс = 394.25 К (~121.1°С); Рс = 4.30 МПа;
– вода дистиллированная;
– метилфенилкарбинол (МФК, альфа-метилбензиловый спирт) марки ЧДА с содержанием основного вещества не менее 98%;
– фенол марки ЧДА производства “Реахим”;
– диоксид углерода (ГОСТ 8050-85) с содержанием основного вещества не менее 99.0%.
Описание установок. Принципиальная схема экспериментальной установки, предназначенной для исследования фазового равновесия жидкость–пар бинарных систем с использованием оптической ячейки высокого давления, приведена на рис. 1. Экспериментальная установка состоит из системы создания, регулирования и измерения давления, системы регулирования и измерения температуры, сосуда равновесия, системы вакуумирования, узла качания и аналитической части.
Рис. 1.
Схема экспериментальной установки для исследования фазового равновесия бинарных систем с использованием оптической ячейки высокого давления: 1 – баллон; 2 – фильтр-осушитель; 3 – насос; 4 – оптическая ячейка высокого давления; 5 –медная рубашка; 6 – термоизоляция; 7 – вентиль для отбора верхней (газовой) фазы; 8 – вентиль для отбора нижней (жидкой) фазы; 9 – пробоотборник; 10 – термостатирующая ванна; 11 – вентиль.
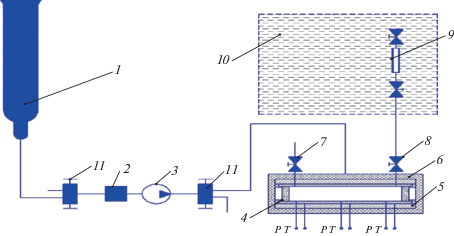
Для проведения статического эксперимента оптическая ячейка на одну треть заполняется исследуемым веществом. Затем, чтобы избавиться от воздуха, вся система с помощью вакуумного насоса вакуумируется. Далее ячейка нагревается до нужной температуры и в нее с помощью насоса высокого давления подается пропан/бутановая смесь до достижения необходимого значения давления. В целях достижения равновесия в двухфазной системе осуществляется интенсивное перемешивание содержимого оптической ячейки. Факт достижения состояния равновесия в термодинамической системе устанавливается одним или двумя контрольными опытами с помощью отбора проб на анализ и/или по изменению давления оптической ячейки.
Принципиальная схема экстракционной установки, позволяющей реализовывать процесс с экстрагентом в жидком и СКФ-состояниях, приведена на рис. 2. Установка включает в себя систему создания и поддержания давления, а также систему регулирования и поддержания температуры. Система создания давления состоит из баллона с экстрагентом (1); холодильного агрегата (2) фирмы Thermo Electronic Corporation (марки Neslab RTE 7), охлаждающего рабочие камеры насоса; плунжерного градиентного насоса фирмы Thar Technology (3) для подачи экстрагента с постоянным объемным расходом в диапазоне от 0.1 до 10.0 мл/мин и регулятора давления фирмы Go-Reg марки ВР66-1А11СJ0151.
Рис. 2.
Принципиальная схема экстракционной установки. 1 – баллон с экстрагентом; 2 – холодильный агрегат; 3 – насос; 4 – ресивер; 5 – теплообменник; 6 – экстрактор; 7 – теплообменник; 8 – клапан регулятор; 9 – обогреваемый сепаратор; 10 – вентиль.
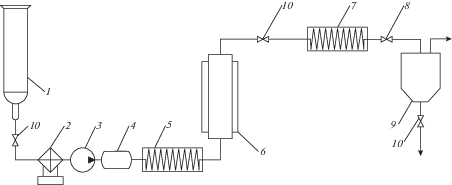
В начальный момент времени экстрагент, находящийся в рабочей камере насоса, охлаждается и конденсируется с помощью холодильного агрегата, и затем выталкивается плунжером насоса в систему. Благодаря тому, что в насосе установлены две камеры, плунжеры которых работают в противофазе, и благодаря наличию ресивера (4), установленного перед входом в систему, достигается равномерная подача экстрагента. После ресивера диоксид углерода или пропан/бутановая смесь по трубкам через теплообменник (5) поступает в экстрактор (6), куда предварительно был залит соответствующий водный раствор. Экстрактор представляет собой сосуд высокого давления объемом 0.001 м3. Выводимый из экстрактора (верхняя часть) раствор экстракта в соответствующем экстрагенте подается в сепаратор (9), где и имеет место выделение целевого продукта. В случае СКФ-экстракционного процесса выделение экстракта происходит благодаря осуществлению декомпрессии, резко снижающей растворяющую способность экстрагента. А при осуществлении экстракционного процесса с экстрагентом в жидком состоянии регенерация экстрагента и выделение экстракта осуществляются за счет увеличения температуры, реализуемого в сепараторе. Соответствующие температурные режимы в экстракторе и сепараторе поддерживаются с помощью электронагревательных рубашек с возможностями ступенчатого регулирования.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Некоторые термодинамические характеристики систем. Растворимость целевой компоненты в экстрагенте (как одна из ключевых характеристик фазового равновесия бинарной системы) в условиях осуществления процесса в значительной степени определяет эффективность экстракционного извлечения. Сама же растворимость определяется физико-химической природой растворяемого и растворителя, а также термодинамическими условиями осуществления процесса растворения.
Рассмотрим фазовое поведение систем целевая компонента–экстрагент применительно к компонентам обсуждаемого водного стока и широко применяемому в качестве СКФ-экстрагента диоксиду углерода.
Фазовое равновесие в системе СО2–стирол широко исследовано многочисленными авторскими коллективами. В работе [20] приведены результаты собственных исследований и представлен своего рода обзор и анализ имеющихся в литературе данных. Ярко выраженные бинодали для соответствующих температур, насыщенные экспериментальными точками, включая и области вблизи их вершин (с положением критической точки), определяют I–II тип фазового поведения с непрерывной критической кривой. В целом, бинодали системы СО2–стирол, исследованные в температурном диапазоне 308–373 К, охватывают интервал давлений до 16.0 МПа.
Аналогичное поведение имеет место и в случаях систем СО2–метилфенилкарбинол [21], СО2–этилбензол [22, 23] и СО2–ацетофенон [24, 25]. Если бинодали системы СО2–метилфенилкарбинол исследованы при температурах 303.15, 313.15 и 323.15 К и укладываются в диапазон давлений до 16.0 МПа, то в случае системы СО2–этилбензол температурному диапазону Т = 308–328 К отвечает область давлений до 8.5 МПа.
Применительно к системе СО2–ацетофенон осуществлено как минимум два подробных исследования фазового равновесия. В работе [24] наличие бинодалей при температурах 313.15, 328.15 и 348.15 К и I–II тип фазового поведения, реализованных в диапазоне давлений до 16.0 МПа, показаны достаточно убедительно. Авторами работы [25] охвачен более высокий диапазон температур. Измерения в этом случае проведены при температурах 313.1, 353.2 и 393.2 К с самыми высокими по факту значениями давления, равными соответственно 7.61, 12.11 и 15.11 МПа, что отвечает мольной доле диоксида углерода на линии насыщенной жидкости, равной соответственно 0.71, 0.59 и 0.52. Если при Т = 313.1 К совместное описание обеих ветвей с высокой вероятностью указывает на вершину бинодали со значением давления в ~8 МПа и I–II тип фазового поведения, то при более высоких температурах такая экстраполяция затруднительна в виду недостаточного количества экспериментальных точек вблизи вершин бинодалей. Тем не менее гипотетические бинодали при температурах 353.2 и 393.2 К авторами исследования прорисованы.
В работе [26] приведены результаты исследования фазового равновесия в системе СО2–фенол. Экспериментальные данные, полученные в диапазоне температур 343–453 К при давлениях до 13.0 МПа, а также результаты исследования растворимости [27] фенола в сверхкритическом диоксиде углерода однозначно указывают на V–VI тип фазового поведения с разрывной критической кривой. И в частности, при температурах 373 и 423 К экспериментальным точкам, полученным при самых высоких давлениях в 10–12 МПа, отвечают мольные доли диоксида углерода на линии насыщенной жидкости даже меньшие 0.3. А если обратиться к весьма ограниченным по объему данным, полученным при температуре Т = 363 К (эксперимент и расчет), то вершине описывающей обе ветви кривой (некое подобие бинодали) отвечает значение давления равное невообразимым 40 МПа в рамках одного подхода и 63 МПа для другого.
Касательно системы СО2–пропиленгликоль необходимо отметить следующее. Согласно результатов экспериментального исследования [28], осуществленного при достаточно высоких температурах Т = 398.2, 423.2 и 453.2 К в диапазоне давлении до 55 МПа это однозначно V–VI тип фазового поведения с разрывной критической кривой. Однако в работе [29], посвященной лишь исследованию зародышеобразования в пересыщенных парах этой же системы вблизи критической линии, авторы утверждают, что эта линия является непрерывной. Справедливости ради необходимо отметить, что подобное утверждение не опирается на результаты предметных экспериментальных исследований фазового равновесия и сформировано лишь с помощью некоторых расчетно-теоретических представлений.
Выше было отмечено, что подбор соответствующего растворителя, обеспечивающего I или II тип фазового поведения с растворяемым веществом, и осуществление экстракционного процесса в СКФ-условиях за пределами бинодали может явиться залогом повышенной эффективности экстракционного процесса. К примеру, замена диоксида углерода на пропан/бутановую смесь в системе с фенолом [30] приводит к смене типа фазового равновесия с V–VI на I–II. Тогда как в случае замены диоксида углерода на этан [24] в системе с ацетофеноном происходит смена уже I–II типа фазового поведения на V–VI. При замене СО2 на пропан/бутановую смесь в системах с ацетофеноном [31] и пропиленгликолем (рис. 3) тип фазового поведения сохраняется.
Рис. 3.
Фазовое равновесие системы пропан/бутан–пропиленгликоль: 1 – Т = 403 К, 2 – 423, 3 – Т = 443 К.
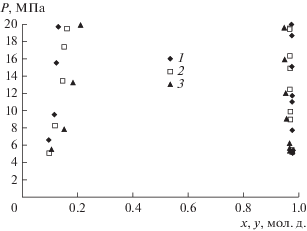
Представляются важными и абсолютные значения таких характеристик, как растворимость каждой из ключевых подлежащих извлечению компонент (стирол, МФК, ацетофенон, этилбензол, фенол и пропиленгликоль) водного стока в потенциальном экстрагенте (СО2), а также коэффициент их фазового распределения в системе вода–целевая компонента–СО2. Рассчитывая применить эти данные в процессе анализа результатов осуществленного в работе [15] СКФ-экстракционного процесса, примем во внимание условия имевшей место реализации: Т = 318 К, Р = 12 МПа.
Лишь две из перечисленных ранее ключевых компонент обсуждаемого водного стока (фенол, пропиленгликоль) формируют с диоксидом углерода (экстрагент) фазовое поведение V–VI типа и, следовательно, можно рассчитывать на наличие литературных данных по растворимости в области высоких давлений СКФ-состояния в рамках традиционных представлений и методов исследования. В остальных случаях: стирол, МФК, ацетофенон и этилбензол формируют с диоксидом углерода I–II тип фазового поведения и, стало быть, мы располагаем лишь численными значениями “растворимости” часто в узком диапазоне изменения термодинамических условий, которое можно получить, опираясь на характеристики паровой ветви бинодали. В табл. 1 приведены соответствующие литературные данные.
Таблица 1.
Растворимость ключевых компонент водного стока в СО2
| Вещество | Т, К | Р, МПа | Y × 106, мол. д. | Источник |
|---|---|---|---|---|
| Метилфенилкарбинол | 313.15 | 11.9 | 23 800 | [21] |
| Метилфенилкарбинол | 313.15 | 12.2 | 24 400 | [21] |
| Метилфенилкарбинол | 323.15 | 12.0 | 14 200 | [21] |
| Метилфенилкарбинол | 323.15 | 13.2 | 17 000 | [21] |
| Ацетофенон | 313.15 | 7.5 | 1260 | [24] |
| Ацетофенон | 313.15 | 8.1 | 1860 | [24] |
| Ацетофенон | 328.15 | 11.0 | 26 900 | [24] |
| Ацетофенон | 328.15 | 11.5 | 34 700 | [24] |
| Этилбензол | 308 | 7.1 | 3700 | [22] |
| Этилбензол | 318 | 7.7 | 4700 | [22] |
| Этилбензол | 318 | 8.3 | 6500 | [22] |
| Этилбензол | 328 | 8.2 | 6600 | [22] |
| Фенол | 309.15 | 11.8 | 13 670 | [32] |
| Фенол | 309.15 | 12.2 | 13 900 | [32] |
| Фенол | 333.15 | 11.2 | 6496 | [32] |
| Фенол | 333.15 | 12.5 | 12 330 | [32] |
| Пропиленгликоль | 318 | 8.4 | 360 | [12] |
| Пропиленгликоль | 328 | 8.0 | 341 | [12] |
| Пропиленгликоль | 318 | 12.0 | 2500 | [15] |
| Вода | 313 | 10.26 | 4140 | [33] |
| Вода | 313 | 12.36 | 4500 | [33] |
| Вода | 323 | 10.34 | 7170 | [33] |
| Вода | 323 | 14.19 | 8510 | [33] |
В части значений коэффициента фазового распределения (КФР) обсуждаемых компонентов водного стока в системе вода–целевая компонента–СО2 удалось установить лишь литературные данные применительно к фенолу. И, в частности, значения КФР для системы Н2О–фенол–СО2 при Т = 323 К и давлениях, равных 12 и 24 МПа, составляют соответственно 0.3 и 6.0 [3]. Интересным представляется то, что КФР этой системы в присутствии пропиленгликоля кратно возрастает и при той же температуре, и тех же давлениях уже составляет 0.8 и 11.0 соответственно.
Сверхкритическая флюидная экстракция. В табл. 2 представлены результаты СК-СО2-экстракционной обработки обсуждаемого водного стока, осуществленной в работе [15]. При этом необходимо напомнить, что проблемы молибдена и его выделения не являются предметом настоящей статьи и, как следствие, обсуждаться не будут. Соответственно, в табл. 2 не будут представлены количественные характеристики присутствия металлоорганического комплекса на основе молибдена, как в исходном стоке, так и в экстракте СК-СО2-экстракционного процесса.
Таблица 2.
Состав водного стока и СК-СО2-экстракта, полученного в процессе, осуществленном при Т = 318 К и Р = 12.0 МПа [15]
| Компоненты стока |
Фазовое равновесие с СО2 |
Состав исходного стока, г | Состав СК-СО2-экстракта, г |
Степень извлечения, мас. % |
|---|---|---|---|---|
| МФК | I-II тип | 6.99 | 6.62 | 94.7 |
| Ацетофенон | I-II тип | 0.70 | 0.63 | 90.0 |
| Этилбензол | I-II тип | 2.39 | 0.13 | 5.4 |
| Фенол | V-VI тип | 3.23 | 3.14 | 97.2 |
| Пропиленгликоль | V-VI тип | 11.50 | 0.07 | 0.6 |
| Вода (и прочие) | V тип | 69.30 | 1.11 | 1.6 |
Даже, несмотря на то, что вероятность взаимного влияния компонентов стока велика и в анализе это почти не учитывается, содержание табл. 1 может достаточно качественно объяснить результаты осуществления СК-СО2 экстракционного процесса, представленные в табл. 2. А именно: низкие значения растворимости воды, пропиленгликоля и этилбензола в диоксиде углерода в условиях эксперимента определили низкую степень их извлечения в экстракционном процессе. Высокая растворимость метилфенилкарбинола, ацетофенона и фенола в диоксиде углерода определила и высокую степень их извлечения. При этом, выше приведенные данные по коэффициенту фазового распределения фенола между водой и диоксидом углерода в присутствии пропиленгликоля с большой вероятностью указывают на то, что именно присутствие пропиленгликоля в стоке обеспечивает абсолютный максимум извлечения в случае фенола, даже несмотря на то, что ее растворимость в СО2 кратно уступает растворимости МФК и ацетофенона в диоксиде углерода (табл. 1).
И в первом и во втором случаях группы веществ и диоксид углерода формируют различные типы фазового поведения [13, 34–36]. Как следствие, для подтверждения вышеотмеченных представлений о дополнительном условии эффективности СКФ-экстракционного процесса необходима реализация экстракционных процессов с жидкофазным и сверхкритическим флюидным экстрагентами и, в том числе различной физико-химической природы, на модельных системах. И такие эксперименты реализованы с использованием экстракционной установки, схема которой приведена на рисунке 2. В качестве исследуемых растворов выбраны водные растворы МФК (5.0 об. %) и фенола (1.5 об. %), целевые компоненты которых (МФК и фенол) формируют с диоксидом углерода I–II и V–VI типы фазового поведения, соответственно [13], тогда как замена СО2 на пропан/бутановую смесь в системе с фенолом меняет тип фазового поведения с V–VI на I–II. Концентрации МФК и фенола в водных растворах близки к значениям, имеющим место в промышленном водном стоке процесса эпоксидирования пропилена ПАО “Нижнекамскнефтехим”. Характеристики и результаты осуществления экстракционного процесса с экстрагентами в жидком и сверхкритическом флюидном состояниях приведены в табл. 3 и 4.
Таблица 3.
Характеристики процесса экстракционного извлечения МФК из его водного 5 об. % раствора (ХПК = 1325.5, рН 7.78) с использованием СО2 в качестве экстрагента (СО2-МФК I-II тип фазового поведения)
| Характеристики | 1 | 2 | 3 |
|---|---|---|---|
| Температура в процессе, К | 300 | 318 | 318 |
| Давление в процессе, МПа | 12 | 18 | 25 |
| Плотность экстрагента, г/см3 [45] | 0.833 | 0.790 | 0.857 |
| Фазовое состояние экстрагента | жидкость | СКФ | СКФ |
| Масса экстрагента в процессе, г | 1371 | 1265 | 1262 |
| Длительность процесса, мин. | 80 | 180 | 135 |
| Масса раствора исходная, г | 96.00 | 103.54 | 195.00 |
| Масса рафината, г | 90.15 | 96.33 | 184.42 |
| Масса экстракта, г | 5.85 | 7.21 | 10.58 |
| ХПК рафината, мг О2/л | 123.5 | 65.3 | 38.3 |
| рН рафината | 7.50 | 7.08 | 5.15 |
Таблица 4.
Характеристики процесса экстракционного извлечения фенола из его водного 1.5 об. % раствора (ХПК = 1755, рН 7.85; СО2-фенол V–VI тип фазового поведения; пропан/бутан-фенол I-II тип фазового поведения)
| Характеристики | 1 | 2 | 3 |
|---|---|---|---|
| Экстрагент | СО2 | СО2 | С3Н8/C4H10 |
| Температура в процессе, К | 300 | 318 | 403.2 |
| Приведенная температура Т/Тс | 0.986 | 1.046 | 1.046 |
| Давление в процессе, МПа | 12.0 | 18.0 | 10.5 |
| Приведенное давление Р/Рс | 1.626 | 2.440 | 2.440 |
| Плотность экстрагента, г/см3 | 0.833 | 0.790 | 0.417 |
| Фазовое состояние экстрагента | жидкость | СКФ | СКФ |
| Масса экстрагента в процессе, г | 1320 | 1290 | 1300 |
| Длительность процесса, мин. | 135 | 135 | 135 |
| Масса раствора исходная, г | 121.70 | 120.00 | 124.95 |
| Масса рафината, г | 118.12 | 114.13 | 79.06 |
| Масса экстракта, г | 3.58 | 5.87 | 45.89 |
| ХПК рафината, мг О2/л | 95.5 | 76.5 | 60.5 |
| рН рафината | 6.83 | 6.60 | 6.20 |
При этом, необходимо отметить, что в отличие от практически неисследованной системы Н2О–МФК–СО2 система Н2О–фенол–СО2 и связанные с ней жидкостной и сверхкритический флюидный СО2 экстракционные процессы неоднократно становились объектом внимания и исследования многочисленных исследовательских групп [3, 37–44].
Применительно к табл. 3 и процессу СО2-экстракционной обработки водного раствора метилфенилкарбинола (МФК) приведем следующие комментарии: 1) Охвачены жидкое и два сверхкритических флюидных состояния экстрагента, причем, если давление во втором режиме (Р = 18 МПа) осуществления процесса достаточно близко к аналогичному значению для вершины бинодали, ограничивающей двухфазное состояние бинарной системы СО2–МФК при Т = 318 К [21], то давление в третьем режиме (Р = 25 МПа) при той же температуре позволяет говорить о значимой удаленности от двухфазной области состояния и гарантирует развитое СКФ-поведение системы по сути. 2) Плотность экстрагента, определяющая его растворяющую способность, варьируется в достаточно узком диапазоне изменения значений от 0.790 до 0.857 г/см3. 3). Близкие значения массы экстрагента в режимах процесса, изменяющиеся в диапазоне 1262–1371 г, в совокупности с вышеотмеченной близостью значений плотности указывают с одной стороны на близкий по величине растворяющий потенциал экстрагента во всех случаях, а с другой на право говорить о “прочих равных условиях” за пределами лишь возможностей в данном случае фазового состояния экстрагента. 4) СКФ-экстракционный процесс на примере двух осуществленных режимов в сопоставлении с жидкостным экстракционным, как и следовало ожидать [46–54], более эффективен.
Учитывая, что именно растворимость извлекаемой компоненты в экстрагенте главным образом определяет эффективность экстракционного процесса и то, что СК-СО2-экстракционный процесс извлечения МФК из его водного раствора реализован в СКФ-условиях за пределами бинодали, попытаемся порассуждать на тему о “псевдорастворимости” и, в том числе МФК в СК-СО2 в обсуждаемых условиях. К примеру, можно предположить, что “псевдорастворимость”, включает в себя в качестве слагаемых регулярную составляющую, отвечающую вершине паровой ветви бинодали [f(T, Pс)] бинарной системы растворяемое–растворитель и избыточную составляющую, определяемую, в том числе, безграничной смешиваемостью растворяемого и растворителя, имеющей место за пределами бинодали. Опять-таки можно предположить, что второе слагаемое по величине превосходит первое и, тем не менее, интересно, как же они соотносятся? Вначале обратимся к табл. 1, где применительно к МФК, ацетофенону и этилбензолу, формирующим с СО2 I–II типы фазового поведения, приведены данные по растворимости, полученные на основе характеристик для паровой ветви бинодали, а для фенола, пропиленгликоля и воды (V–VI типы фазового поведения с СО2) представлены значения растворимости, полученные в рамках традиционно принятого эксперимента с растворителем в СКФ-состоянии. В большинстве случаев обсуждаемая характеристика на основе параметров для паровой ветви бинодали в схожих термодинамических условиях превосходит ту, что установлена в рамках прямого исследования растворимости в сверхкритическом диоксиде углерода. Однако не факт, что это является общим правилом, и можно допустить, что величины, к примеру, сопоставимы. А теперь обратимся к работе [15], относительно которой во вводной части этой статьи было отмечено, что там для МФК, ацетофенона и этилбензола (системы с I–II типами фазового поведения) были получены данные не по растворимости, а именно по их “псевдорастворимости” в СК-СО2, отвечающие серединной заливке измерительной ячейки растворяемым веществом. Каковы же численные значения “псевдорастворимости” в условиях этого эксперимента? Максимальное значение для МФК, полученное при Т = 328 К и Р = 24 МПа, составляет 0.09 мол. д. (Y* × 106 = 90 000 мол. д.). Максимальное значение для ацетофенона, полученное в тех же условиях, составляет 0.12 мол. д. (Y* × 106 = 120 000 мол. д.). Максимальное значение для этилбензола, полученное при Т = 338 К и Р = 30 МПа, составляет 0.07 мол. д. (Y* × 106 = = 70 000 мол. д.). Превышение этих численных значений над теми, что представлены в таблице 1, от ~4-кратного для МФК и ацетофенона до ~10-кратного для этилбензола. По сути, именно, повышенные значения, пусть даже “псевдорастворимости”, создают предпосылки и обуславливают повышенную эффективность СКФ-экстракционного процесса за пределами бинодали для систем I–II типа фазового поведения.
И, наконец, в табл. 4 приведены характеристики процесса экстракционного извлечения фенола из его водного 1.5 об. % раствора с использованием в качестве экстрагента диоксида углерода (СО2–фенол V–VI тип фазового поведения) в жидком (реж.1) и СКФ (реж.2) состояниях, а также пропан/бутановой смеси (С3Н8/С4Н10–фенол I–II тип фазового поведения) в СКФ-состоянии (реж.3). При этом, для корректности сопоставления возможностей диоксида углерода и пропан/бутановой смеси, использованных в качестве экстрагента в СКФ-состоянии, приняты единые условия осуществления экстракционных процессов, согласно закона соответственных состояний выраженные в одинаковых значениях приведенных параметров (π = Р/Pс = 2.44; τ = T/Tс = 1.046). Комментарии к табл. 4 следующие:
– процесс СКФ-экстракции с диоксидом углерода в сопоставлении с жидкостным более эффективен и это даже при том, что плотность СК-СО2 в условиях эксперимента, пусть незначительно, но уступает плотности жидкого СО2 и результат получен меньшим количеством сверхкритического диоксида углерода;
– эффективность процесса СКФ-экстракции с экстрагентом (пропан/бутановая смесь), обеспечивающим I–II типы фазового поведения с извлекаемой компонентой раствора, как и предполагалось, существенным образом (в ~7.8 раза) превосходит показатели той же СКФ-экстракции, но с экстрагентом, определяющим V–VI типы фазового поведения; и это, при том, что плотность пропан/бутановой смеси (как впрочем и любого экстрагента), традиционно определяющая ее растворяющую способность, в два и более раза уступает плотности диоксида углерода в жидкостном и СКФ-процессах; и это указывает на то, что для систем I–II типа фазового поведения, именно роль неограниченной смешиваемости компонентов бинарного раствора за пределами бинодали в СКФ-области состояния становится особенно значимой; аналогичный результат (~4-кратное превышение эффективности) получен авторами настоящей статьи и применительно к СКФ-экстракционной технологии утилизации отработанных древесных железнодорожных шпал, где также осуществлена замена диоксида углерода на пропан/бутановую смесь, обеспечивающую желаемое изменение типа фазового поведения применительно к таким компонентам материала пропитки (каменноугольное масло), как фенол, антрацен и нафталин.; при этом, энергозатратность, связанная с более высокими температурами в пропан/бутановом процессе, в значительной степени нивелируется благодаря существенно более низким значениям давления.
Анализ обсужденных экстракционных процессов будет неполным, если не охарактеризовать взаимодействие максимально представленной в растворах воды с использованными в качестве экстрагентов диоксидом углерода и пропан/бутановой смесью. Растворимость воды в СКФ-условиях кратно уступает растворимости МФК и фенола в соответствующих экстрагентах и, в том числе, потому, что в обоих случаях системы СО2–вода и пропан/бутан–вода демонстрируют невыгодный с точки зрения эффективности СКФ-экстракционного процесса V тип фазового поведения с разрывной критической кривой (т.е. в ячейке исследования растворимости и реализации СКФ-экстракционного процесса присутствуют как жидкая, так и паровая фазы с четкой границей раздела фаз), тогда как, именно системы СО2–МФК и пропан/бутан–фенол в СКФ-условиях демонстрируют наиболее выгодный I–II тип фазового поведения с безграничной смешиваемостью компонентов за пределами бинодали, отсутствием границы раздела фаз и непрерывной критической кривой (т.е. если вода в этих условиях представлена по-прежнему как в жидкой, так и в паровой фазах, то целевая компонента водного раствора, имея с экстрагентами I–II тип фазового поведения, стремится в полном объеме перейти в СКФ-фазу. И препятствием этому являются лишь несовершенство массообменного устройства и предельная степень извлечения, определяемая значением равновесного коэффициента распределения целевой компоненты в системе вода–целевая компонента–экстрагент в соответствующих термодинамических условиях.
СКФ-экстракционный процесс с пропан/бутановым экстрагентом в перспективе может быть реализован и в промышленном варианте. И в этой связи возникает вопрос о сохранности состава пропан/бутановой смеси после осуществления элементарного цикла непрерывного (многоцикличного) экстракционного процесса. В рамках ранее проведенных исследований СКФ-экстракционного процесса с тем же экстрагентом применительно к задаче извлечения нефтепродукта из нефтеносных песков [10] посредством анализа состава пропан/бутановой смеси до и после этапа восстановления экстракта и регенерации экстрагента установлено следующее: снижение содержания пропана до ~6 мас. %; увеличение содержания бутана до ~9 мас. %; содержание таких компонентов, как метан, этан-этилен и изобутан, представленных незначительными количествами, не претерпело существенных изменений. Касательно представленных в статье результатов необходимо отметить, что фактор возможного изменения состава экстрагента, крайне важный для промышленной реализации, существенно менее важен в части его влияния на приведенные в статье результаты и качество их анализа. Последнее связано с тем, что в лабораторных исследованиях экстракционный цикл не был замкнутым и после каждого цикла на этапе сепарации экстрагент выбрасывался в атмосферу, а новый цикл начинался со свежей порции пропан/бутановой смеси исходного состава.
Когда мы говорим о химическом сродстве, которое способствует более успешному протеканию тех или иных процессов, то, прежде всего, подразумеваем влияние особого и предпочтительного характера межмолекулярных взаимодействий, которое в рамках настоящего исследования формализовано через особенности фазовых состояний тех или иных систем, которые, по сути, определяются той же природой межмолекулярных взаимодействий.
ЗАКЛЮЧЕНИЕ
Сформулированы и обсуждены предпосылки, а также экспериментально подтверждено, что подбор соответствующей физико-химической природы экстрагента, обеспечивающего I или II типы фазового поведения с извлекаемым компонентом, и осуществление экстракционного процесса в СКФ-условиях за пределами бинодали является залогом существенно более высокой эффективности экстракционного процесса!
В рамках экспериментального исследования фазового равновесия установлено, что система пропан/бутан–пропиленгликоль проявляет V–VI тип фазового поведения с разрывной критической кривой.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-29-06041).
ОБОЗНАЧЕНИЯ
| f | функция |
| Р | давление, Па |
| Т | температура, К |
| х | мольная доля пропан/бутана в жидкой фазе, мол. д. |
| Y | растворимость, мол. д. |
| Y* | “псевдорастворимость”, мол. д. |
| у | мольная доля пропан/бутана в паровой фазе, мол. д. |
| π | безразмерное давление |
| τ | безразмерная температура |
ИНДЕКСЫ
Список литературы
Жузе Т.П. Сжатые газы как растворители. М.: Наука, 1974.
Жузе Т.П. Роль сжатых газов как растворителей. М.: Недра, 1981.
Гумеров Ф.М. Сверхкритические флюидные технологии. Экономическая целесообразность. Казань: АН РТ, 2019.
Gumerov F.M., Amirchanov D.G., Usmanov A.G., Le Neindre B. The thermal diffusivity of argon in the critical region // Int. J. Thermophys. 1991. V. 12. № 1. P. 67.
Le Neindre B., Garrabos Y., Gumerov F., Sabirzianov A. Measurements of the thermal conductivity of HFC-134a in the supercritical region // J. Chem. Eng. Data. 2009. V. 54. P. 2678.
Shamsetdinov F.N., Zaripov Z.I., Abdulagatov I.M., Huber M.L., Gumerov F.M., Gabitov F.R., Kazakov A.F. Experimental study of the thermal conductivity of ammonia + water refrigerant mixtures at temperatures from 278K to 356K and at pressures up to 20 MPa // Int. J. Refrigeration. 2013. V. 36. P. 1347.
Гумеров Ф.М., Сагдеев А.А., Амирханов Д.Г. Растворимость веществ в сверхкритических флюидных средах. Saarbrucken: LAP LAMBERT Academic Publishing GmbH & Co. KG, 2016.
Bilalov T.R., Gumerov F.M. Computation of the solubility of aromatic hydrocarbons in supercritical media based on the entropic method of similarity theory // Theor. Found. Chem. Eng. 2019. V. 53. № 4. Р. 487. [Билалов Т.Р., Гумеров Ф.М. Расчет растворимости ароматических углеводородов в сверхкритических средах на основе энтропийного метода теории подобия // Теорет. основы хим. технологии. 2019. Т. 53. № 4. С. 387.]
Khairutdinov V.F., Akhmetzyanov T.R., Gabitov F.R., Zaripov Z.I., Farakhov M.I., Mukhutdinov A.V., Gumerov F.M., Yarullin R.S. Extraction of oil-products from oil sludge with the use of liquid and supercritical fluid extraction processes with propane-butane extractant // Petroleum Science and Technology. 2016. V. 34. № 4, P. 372.
Khairutdinov V.F., Akhmetzyanov T.R., Gumerov F.M., Khabriev I.Sh., Farakhov M.I. Supercritical fluid propane-butane extraction treatment of oil-bearing sands // Theor. Found. Chem. Eng. 2017. V. 51. № 3, Р. 299. [Хайрутдинов В.Ф., Ахметзянов Т.Р., Гумеров Ф.М., Хабриев И.Ш., Фарахов М.И. Сверхкритическая флюидная пропан-бутановая экстракционная обработка нефтеносных песков // Теорет. основы хим. технологии. 2017. Т. 51. № 3. С. 288.]
Khairutdinov V.F., Gabitova A.R., Gumerov F.M., Gabitov R.F., Kurdyukov A.I. Extraction of petroleum products and asphaltene-resin mixtures from highly watered oil sludge with supercritical fluid method // Russ. J. Phys. Chem. В. 2019. V. 13. № 7. Р. 1128. [Хайрутдинов В.Ф., Габитова А.Р., Гумеров Ф.М., Габитов Р.Ф., Курдюков А.И. Извлечение нефтепродуктов и смолоасфальтеновых смесей из высокообводненных нефтяных шламов методом сверхкритической флюидной экстракции // Сверхкритические флюиды: теория и практика. 2018. Т. 13. № 3. С. 97.]
Gupta R.B., Shim J.-J. Solubility in supercritical carbon dioxide. CRC Press. Taylor & Francis Group, 2007.
Гумеров Ф.М., Сабирзянов А.Н., Гумерова Г.И. Суб- и cверхкритические флюиды в процессах переработки полимеров. Казань: ФЭН, 2000.
Williams D.F. Extraction with supercritical gases // Chem. Eng. Science. 1981. V. 36. № 11. P. 1769.
Каюмов Р.А., Галимова А.Т., Сагдеев А.А., Петухов А.А., Гумеров Ф.М. Экстракция компонентов отхода процесса эпоксидирования пропилена сверхкритическим СО2 // Сверхкритические флюиды. Теория и практика. 2012. Т. 7. № 1. С. 3.
Kazunari O., Takashi K. Verfahren zur herstellung eines extraktes. Patentschrift DE 34 24 614 C2. 1984.
Gumerov F.M., Kayumov R.A., Usmanov R.A., Sagdeev A.A., Abdullin I.Sh., Sharafeev R.F. Waste management in propylene epoxidation process with the use of supercritical fluid media // Amer. J. Anal. Chem. 2012, V. 3. Iss. 12A. P. 950.
Kay W.B. Vapor-liquid equilibrium relations of binary systems. The propane-n-alkane systems. n-Butane and n-pentane // J. Chem. Eng. Data, 1970. V. 15. P. 46.
Juntarachat N, Bello S., Privat R., Jaubert J.-N. Validation of a new apparatus using the dynamic for determining the critical properties of binary gas/gas mixtutes // J. Chem. Eng. Data. 2013. V. 58. P. 671.
Peper S., Haverkamp V., Dohrn R. Measurement of phase equilibria of the systems CO2 + styrene and CO2 + + vinyl acetate using different experimental methods // J. Supercritical Fluids. 2010. V. 55. P. 537.
Gamse T., Marr R. Phase equilibrium properties of the 1-phenylethanol-carbon dioxide and 2-octanol-carbon dioxide binary systems at 303.15 K, 313.15 K and 323.15 K // J. Chem. Eng. Data. 2001. V. 46. P. 117.
Tan C.-S., Yarn S.-J., Hsu J.-H. Vapor-liquid equilibria for the systems carbon dioxide-ethylbenzene and carbon dioxide-styrene // J. Chem. Eng. Data. 1991. V. 36. P. 23.
Zhang J., Gao L., Zhang X., Zong B., Jiang T., Han B. Phase behaviors, density and isothermal compressibility of styrene-CO2, ethylbenzene-CO2, ethylbenzene-styrene-CO2 systems // J. Chem. Eng. Data. 2005. V. 50. P. 1818.
Weng W.-l., Lee M.-J. Vapor-liquid equilibrium for binary systems containing a heavy liquid and a dense fluid // Ind. Eng. Chem. Res. 1992. V. 31. P. 2769.
Bamberger A., Maurer G. High-pressure vapor-liquid equilibriain binary mixtures of carbon dioxide and aromatic hydrocarbons experimental data and correlayion for CO2 + acetophenone, CO2 + 1-chlornaphthalene, CO2 + methyl benzoate and CO2 + n-propylbenzene // J. Supercritical Fluids. 1994. V. 7. P. 115.
Margon V., Agarwal U.S., Peters C.J., de Wit G., van Kasteren J.M.N., Lemstra P.J. Phase equilibria of carbon dioxide with phenol and diphenyl carbonate // J. Supercritical Fluids. 2003. V. 27. P. 25.
Garcia-Gonzalez J., Molina M.J., Rodriguez F., Mirada F. Solubilities of phenol and pyrocatechol in supercritical carbon dioxide // J. Chem. Eng. Data. 2001. V. 46. P. 918.
Skerget M., Cucek D., Knez Z. Phase equilibria of the propylene glycol/CO2 and propylene glycol/ethanol/CO2 systems // J. Supercritical Fluids. 2014. V. 95. P. 129.
Anisimov M.P., Koropchak J.A., Nasibullin A.G., Timoshina L.V. 1,2-propane-diol and 1,3-propanediol homogeneous nucleation rates and phase transitions in the new phase critical embryos // J. Chem. Phys. 2000. V. 112. № 22. P. 9917.
Хайрутдинов В.Ф. Термодинамические основы и технологические закономерности процессов диспергирования, экстракции и пропитки с использованием сверхкритических флюидных сред применительно к задачам полимерной химии, фармацевтики и нефтехимии. Диссертация на соискание ученой степени докт. техн. наук. Казань: Казанский национальный исследовательский технологический университет, 2019.
Khairutdinov V.F., Gumerov F.M., Gabitov F.R., Zaripov Z.I., Khabriev I.Sh., Akhmetzyanov T.R., Abdulagatov I.M. New design of the high-pressure optical cell for VLE veasurements. Supercritical binary mixture (propane/n-butane) + acetophenone // J. Chem. Eng. Data. 2020. https://doi.org/10.1021/acs.jced.0c00104
Van Leer R.A., Paulaltis M.E. Solubilities of phenol and chlorinated phenol in supercritical carbon dioxide // J. Chem. Eng. Data. 1980. V. 25. P. 257.
Sabirzyanov A.N., Il’in A.P., Akhunov A.R., Gumerov F.M. Solubility of water in supercritical carbon dioxide // High Temperature. 2002. V. 40. № 2. P. 203.
Уэйлес С. Фазовые равновесия в химической технологии. Т. 1. М.: Мир, 1989.
Кричевский И.Р. Термодинамика критических бесконечно разбавленных растворов. М.: Химия, 1975.
Краткая химическая энциклопедия. Т. 4 / Под ред. Кнунянца И.Л. М.: Советская энциклопедия, 1965.
Roop R.K., Hess R.K., Akgerman A. Supercritical extraction of pollutans from water and soil / Supercritical Fluid Science and Technology. Am. Chem. Soc., 1989. Ch. 29. P. 468.
Ghonasgi D., Gupta S., Dooley K.M., Knopf F.C. Measurement and modeling of supercritical carbon dioxide extraction of phenol from water // J. Supercritical Fluids. 1991. V. 4. № 1. P. 53.
Sabirzyanov A.N., Il’in A.P., Akhunov A.R., Gumerov F.M. Distribution coefficient of impurities in the liquid-supercritical fluid system // Theor. Found. Chem. Eng. 2001. V. 35. № 5. Р. 492. [Сабирзянов А.Н., Ильин А.П., Ахунов А.Р., Гумеров Ф.М. Коэффициент фазового распределения примесей в системе жидкость–сверхкритический флюид // Теорет. основы хим. технологии. 2001. Т.35. № 5, С. 492.]
Sabirzyanov A.N., Gumerov F.M., Maksudov R.N., Gabitov F.R. Phase equilibrium in the system phenol (aqueous solution) – supercritical carbon dioxide // Russ. J. Phys. Chem. 2004. V. 78. № 8. Р. 1260. [Сабирзянов А.Н., Гумеров Ф.М., Максудов Р.Н., Габитов Ф.Р. Фазовое равновесие в системе водный раствор фенола – сверхкритический диоксид углерода // Журн. физическая химии. 2004. Т. 78. № 8. С. 1438.]
Combs M.T., Ashraf-Khorassani M., Taylor L.T. PH-effects on the direct supercritical fluid extraction of phenols from aqueous matrices // J. Supercritical Fluid. 1996. V. 9. № 2. P. 122.
Brudi K., Dahmen N., Schmieder H. Partition coefficients of organic substances in two – phase mixtures of water and carbon dioxide at pressures of 8 to 30 MPa and temperatures of 313 to 333 K // J. Supercritical Fluid. 1996. V. 9. № 3. P. 146.
Wagner K.D., Brudi K., Dahmen N., Schmieder H. Partition coefficients of aromatic organic substances in two – phase mixtures of water and carbon dioxide at pressures from 8 to 30 MPa and at temperatures of 313 to 333 K. Part II // J. Supercritical Fluids. 1999. V. 15. P. 109.
Sengupta S., Gupta S., Dooley K.M., Knopf F.C. Measurement and modeling of extraction of chlorinated hydrocarbons from water with supercritical carbon dioxide // J. Supercritical Fluids. 1994. V. 7. № 3. P. 201.
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. М.: Наука, 1972.
Taylor L.T. Supercritical Fluid Extraction. Wiley. Interscience, 1996.
Kiran E., Debenedetti P.G., Peters C.Y. Supercritical Fluids Fundamentals and Applications. Kluwer Academic Publisher, 2000.
Mukhopadhyay M. Natural Extracts Using Supercritical Carbon Dioxide. CRC Press, 2000.
Brunner G. Gas Fxtraction: An Introduction to Fundamentals of Supercritical Fluids and the Applications to Separation Processes. Springer Verlag, 1994.
Cansell F., Petitet J.-P. Fluides Supercritiques et materiaux. LIMHP CNRS, 1995.
Mc.Hugh M.A., Krukonis V.J. Supercritical Fluids Extraction: Principles and Practice. Sec. Edit. Butterworth-Heinemann, 1994.
Tadanoki A. Design of plant for supercritical extraction // Kagaky Kogaky. 1988. V. 52. № 7. P. 502.
Eggers R., Sievers U. Current state of extraction of natural materials with supercritical fluids and developmental trends / Supercritical Fluid Science and technology. Am. Chem. Soc., 1989. Ch 30. P. 478.
Bohm F., Heinisch R., Peter S., Weinder E. Design, construction and operation of a multipurpose plant for commercial supercritical gas extraction // Supercritical Fluid Science and Technology. Am. Chem. Soc., 1989. Ch. 31. P. 499.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


