Теоретические основы химической технологии, 2021, T. 55, № 6, стр. 723-735
Математическое моделирование биотехнологического процесса непрерывной ферментации получения молочной кислоты. Обзор
Е. Л. Гордеева a, *, Л. В. Равичев a, А. Г. Бородкин a, Ю. Л. Гордеева b
a Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
b Московская государственная академия ветеринарной медицины и биотехнологии – МВА им. К.И. Скрябина
Москва, Россия
* E-mail: l.s.gordeev@yandex.ru
Поступила в редакцию 23.02.2021
После доработки 08.07.2021
Принята к публикации 12.07.2021
Аннотация
Приведены результаты анализа математических моделей процесса непрерывной ферментации молочной кислоты. Математические модели представлены уравнениями следующих типов: уравнения с кинетикой образования молочной кислоты штаммами, потребляющими только основной субстрат (чаще всего глюкозу) и не образующими побочных продуктов; штаммами, образующими побочные продукты; штаммами, потребляющими кроме основного субстрата еще и субстрат, образуемый в процессе синтеза из соответствующего компонента сырья; штаммами, использующими как субстрат из компонента, образуемого в процессе синтеза, так и одновременно образующими побочный продукт в достаточно больших количествах. Кинетические соотношения учитывают ингибирование биомассой (X), субстратом (S) и продуктом (P). Приведены результирующие соотношения для концентраций получаемых продуктов (в общем случае X, S, P, B), а также, что наиболее важно, получены оценки входных показателей (в общем случае D, S0, M0), обеспечивающих реальное осуществление технологии. Приведены расчетные соотношения и алгоритмы вычисления показателей в различных вариантах постановки задач. В большинстве решений отмечена возможность получения показателей, обеспечивающих множество реализующих технологий. Приведен ряд данных по сырьевым источникам, использованных в опубликованных научных работах. Приведена таблица алгоритмов вычисления показателей стационарных состояний с численными примерами вычисления показателей стационарных состояний.
ВВЕДЕНИЕ
Исследование кинетики биотехнологического процесса получения молочной кислоты и анализ периодического способа ферментации [1, 2] показали большой интерес исследователей к процессу синтеза с использованием штаммов, продуцирующих молочную кислоту.
В работе [3] отмечается, что молочная кислота рассматривается как один из наиболее полезных продуктов, используемых в пищевой промышленности, текстильной и фармацевтической, в химической в качестве сырьевого материала для производства пропиленгликоля, акриловой кислоты, ацетальдегида и др. Интерес к молочной кислоте возрос из-за возможности ее использования в качестве мономера для получения биоразлагаемых полимеров (PLA).
В работе [4] показана потенциальная возможность использования молочной кислоты для производства различных продуктов.
Обширное исследование по достижениям в области производства молочной кислоты микробиологической ферментацией приведено в [5]. Статья содержит 326 научных ссылок. Ниже приведем содержание основных разделов статьи: 1. Введение. 2. Микроорганизмы, продуцирующие молочную кислоту. 3. Альтернативные виды субстратов для получения молочной кислоты. 4. Достижения в процессах ферментации для увеличения производства молочной кислоты. 5. Улучшенные ферментации с высокой плотностью клеток.
Естественно, ключевым элементом, определяющим биотехнологию процесса, является подбор микроорганизмов. В работе [6] приведен перечень микроорганизмов, продуцирующих молочную кислоту. Перечень достаточно впечатляющий (61 наименование). Здесь же приведены типы субстратов, потребляемых микроорганизмами. Однако, как будет показано ниже, естественно, не все обозначенные микроорганизмы привлекли внимание с целью разработки биотехнологии.
Обеспечение возможности разработки биотехнологического процесса получения молочной кислоты связано с подбором сырьевых источников с относительно невысокой стоимостью последних. В табл. 1 [3] обозначены относительно дешевые сырьевые компоненты для получения молочной кислоты. В этой же таблице приведены данные по продуктивности, достигаемой при культивировании на различных видах сырья. Естественно, табл. 1 не исчерпывает весь список возможных сырьевых материалов для получения молочной кислоты.
Таблица 1.
Литературные данные по сырьевым материалам для получения молочной кислоты
| Сырье | Микроорганизм | P, г/л | QP, г/(л ч) | Литературный источник |
|---|---|---|---|---|
| Меласса | Lactobacillus delbrueckii NCJMB 8130 | 90.0 | 3.8 | [7] |
| Enteroccocus faecalis RKY1 | 95.7 | 4.0 | [8] | |
| Рожь | Lactobacillus paracasei № 8 | 84.5 | 2.4 | [9] |
| Сладкое сорго | Lactobacillus paracasei № 8 | 81.5 | 2.7 | [9] |
| Lactobacillus paracasei № 8 | 106.0 | 3.5 | [10] | |
| Пшеница | Lactoccocus lactiss ssp. lactiss ATCC 19435 | 106.0 | 1.0 | [11] |
| Enteroccocus faecalis RKY1 | 102.0 | 4.8 | [12] | |
| Зерно | Enteroccocus faecalis RKY1 | 63.5 | 0.5 | [12] |
| Lactobacillus amylovorus ATCC 33620 | 10.1 | 0.8 | [13] | |
| Таниока | Lactobacillus amylovorus ATCC 33620 | 4.8 | 0.2 | [13] |
| Картофель | Lactobacillus amylovorus ATCC 33620 | 4.2 | 0.1 | [14] |
| Рис | Lactobacillus sp. RKY2 | 129.0 | 2.9 | [14] |
| Ячмень | Lactobacillus casei NRRL B-441 | 162.0 | 3.4 | [15] |
| Lactobacillus amylophilus GV6 | 27.3 | 0.3 | [16] | |
| Целлюлоза | Lactobacillus coryniformis ssp. torquens ATCC 25600 | 24.0 | 0.5 | [17] |
| Кукуруза | Rhizopus sp. MK-96-1196 | 24.0 | 0.3 | [18] |
| Отходы бумаги | Lactobacillus coryniformis ssp. torquens ATCC 25600 | 23.1 | 0.5 | [19] |
| Rhizopus oryzae NRRL 395 | 49.1 | 0.7 | [20] | |
| Древесина | Lactobacillus delbrueckii NRRL B-441 | 108.0 | 0.9 | [21] |
| Enteroccocus faecalis RKY1 | 93.0 | 1.7 | [22] | |
| Сыворотка | Lactobacillus helveticus R211 | 66.0 | 1.4 | [23] |
| Lactobacillus casei NRRL B-441 | 46.0 | 4.0 | [24] |
Важным компонентом для разработки технологии процесса является формирование уравнений кинетики процесса, определяющей скорость развития популяции микроорганизмов и, как следствие, интенсивность образования молочной кислоты. Кинетические соотношения приведены в обзоре [1] и отдельно в данной публикации не рассматриваются. Отметим только, что вид кинетических соотношений чаще всего определяет и математические выражения конкретной математической модели непрерывного процесса, так как в различных кинетических соотношениях учитываются или не учитываются условия ингибирования для конкретного штамма микроорганизмов.
Математические модели процессов непрерывного ферментирования условно можно представить тремя группами, определяемыми видами штаммов. Группа математических моделей, которая ориентирована на штаммы микроорганизмов, потребляющих только основной субстрат (чаще всего глюкозу) и не образующих побочных продуктов (или их незначительное количество); группа штаммов микроорганизмов, образующих побочный продукт в достаточно большом количестве и иногда весьма ценного; группа штаммов микроорганизмов, использующих кроме основного субстрата компоненты сырья, воспроизводящего основной субстрат в процессе синтеза (образующие или не образующие побочные продукты).
Отметим еще некоторые особенности при математическом моделировании непрерывной ферментации. Это, прежде всего, необходимость получения оценок входных показателей, обеспечивающих возможность реального осуществления процесса. И еще одна особенность заключается в том, что результаты моделировании дают возможность получить множество оценок входных показателей для одного и того же значения продуктивности по молочной кислоте QP, г/(л ч), где QP = PD; P – концентрация молочной кислоты, г/л; D – величина протока, ч–1. Имеется возможность получить оценки для оптимальных условий: maxQP и др.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ПРОЦЕССА НЕПРЕРЫВНОЙ ФЕРМЕНТАЦИИ
Система уравнений математической модели процесса, относящейся к первой группе для штаммов микроорганизмов, потребляющих только основной субстрат и не образующих побочных продуктов, имеет следующий вид:
(2)
$D\left( {{{S}_{f}} - S} \right) - \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\mu X = 0{\kern 1pt} ;$Система (1)–(3) представлена в нескольких публикациях, приведенных ниже.
Вычисление показателей технологического процесса по решению (1)–(3) зависит от вида выражения для удельной скорости роста μ. Достаточно полный обзор по видам кинетических соотношений для μ приведен в публикациях [1, 2] и здесь не приводится, за исключением тех вариантов, которые используются в настоящем обзоре. Практически первое соотношение для μ получено в работе [25] и имеет вид
Более сложное соотношение использовано в работе [26]:
(5)
$\mu = {{\mu }_{{{\text{max}}}}}\frac{S}{{{{K}_{S}} + S + {{{{S}^{2}}} \mathord{\left/ {\vphantom {{{{S}^{2}}} {{{K}_{i}}}}} \right. \kern-0em} {{{K}_{i}}}}}}.$Однако, так же как и (4), выражение (5) учитывает ингибирование только концентрацией субстрата S и для моделирования непрерывного процесса используется крайне редко.
Наиболее часто при моделировании используется уравнение для удельной скорости роста в виде
(6)
$\mu = {{\mu }_{{{\text{max}}}}}\left( {1 - \frac{P}{{{{P}_{{{\text{max}}}}}}}} \right)\frac{S}{{{{K}_{S}} + S + {{{{S}^{2}}} \mathord{\left/ {\vphantom {{{{S}^{2}}} {{{K}_{i}}}}} \right. \kern-0em} {{{K}_{i}}}}}},$в котором учитывается ингибирование концентрацией субстрата S и продукта P (молочной кислоты).
В табл. 2 приведен перечень констант с числовыми значениями [27, 28], которые использованы в большинстве численных расчетов при моделировании.
СТАЦИОНАРНЫЕ СОСТОЯНИЯ
В публикациях [29–31] приведено аналитическое решение системы (1)−(3), (6). В этих же публикациях сформированы блок-схемы алгоритмов для вычисления показателей стационарных состояний в различных вариантах постановок задач. В обобщенной форме эти алгоритмы приведены в табл. 3.
Таблица 3.
Алгоритмы вычисления показателей стационарного состояния для системы (1)–(3), (6)
| Литературный источник | Алгоритм | Исходные данные | Результат |
|---|---|---|---|
| [29] | Алгоритм 3 | Sf, г/л, D, ч–1 | S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке; QP, г/(л ч) – продуктивность |
| Алгоритм 4 | Sfmin, г/л, Sfmax, г/л, D, ч–1 | S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке при maxQP, г/(л ч); Smax, г/л – концентрация Sf, г/л, для обеспечения maxQP, г/(л ч); maxQP, г/(л ч) – продуктивность | |
| [30] | Алгоритм 1 | D, ч–1 | Sf, г/л – концентрация в поступающем потоке; S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке; QP, г/(л ч) – продуктивность |
| Алгоритм 2 | Sf, г/л | D, ч–1 – величина протока; S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке; QP, г/(л ч) – продуктивность |
|
| [31] | Алгоритм 1 | Sf, г/л, D, ч–1 | S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке; QP, г/(л ч) – продуктивность |
| Алгоритм 2 | Sfmin, г/л, Sfmax, г/л, D, ч–1 | S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке при maxQP, г/(л ч); Smax, г/л – концентрация Sf, г/л, для обеспечения maxQP, г/(л ч); maxQP, г/(л ч) – продуктивность | |
| Алгоритм 3 | Dmin, ч–1, Dmax, ч–1, Sf, г/л | S, г/л, X, г/л, P, г/л – концентрации компонентов в выходном потоке при maxQP, г/(л ч); D, ч–1 – величина протока, обеспечивающая maxQP, г/(л ч); maxQP, г/(л ч) – продуктивность |
В алгоритмах табл. 3 кроме исходных данных использованы константы табл. 2. В публикациях [29–31] приведены численные примеры реализации алгоритмов.
Графическая интерпретация стационарных состояний приведена в работах [29, 31–35].
Отражены следующие особенности:
экстремальный характер зависимости продуктивности QP, г/(л ч) от Sf при заданном D и от D при заданном Sf, а также концентрации P, г/л от Sf при заданном D;
наличие множественности стационарных состояний для одного и того же значения QP;
ограниченное значение величины протока D = = Dпред, ч–1, определяемое величиной скорости вымывания субстрата, “не успевшего” вступить в процесс синтеза.
Это подчеркивает наличие ограниченности области значений входных показателей Sf и D, обеспечивающих реальные условия существования технологии.
Два показателя относятся к формированию области реального обеспечения технологии и являются очень важными для оценки возможностей технологического процесса – Dпред и QP.
Вычисления Dпред приведены в публикациях [32, 33] по формуле
(7)
${{D}^{{{\text{пред}}}}} = {{\mu }_{m}}\frac{{{{K}_{i}}{{S}_{f}}}}{{{{K}_{i}}{{K}_{S}} + {{K}_{i}}{{S}_{f}} + {{S}_{f}}}},$т.е. такое значение D, при котором субстрат вымывается из ферментера, “не успев” вступить в синтез. В этом случае X = 0; P = 0; S = Sf.
В этих же публикациях приведено максимально возможное Dпред:
(8)
${\text{max}}{{D}^{{{\text{пред}}}}} = \frac{{{{\mu }_{m}}}}{{1 + 2{{{\left( {\frac{{{{K}_{m}}}}{{{{K}_{i}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}},$которое определяется только значениями кинетических констант. Для maxDпред получено значение Sf = (KmKi)1/2.
Очевидно, что реальное значение D в технологии должно удовлетворять условию
Второй показатель maxQP приведен в [32] и вычисляется по формуле
(10)
${\text{max}}{{Q}_{P}} = \frac{{{{\mu }_{m}}{{P}_{m}}}}{{4\left[ {1 + 2{{{\left( {\frac{{{{K}_{m}}}}{{{{K}_{i}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right]}}.$В работе [32] приведены также формулы вычисления показателей процесса: Xopt, Sopt, Popt, $S_{f}^{{{\text{opt}}}}$, Dopt для maxQP. Общая постановка задачи оптимизации приведена в работе [36].
Область для оценки исходных показателей Sfи D формируется в виде зависимости для заданного QP < maxQP:
(11)
${{S}_{{{{f}_{{1,2}}}}}} = \frac{{B\left( D \right)}}{2}\left[ {1 \pm \sqrt {1 - \frac{{4{{K}_{m}}{{K}_{i}}}}{{{{B}^{2}}\left( D \right)}}} } \right] + \frac{{{{Q}_{P}}}}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}\left( {\alpha D + \beta } \right)}};$(12)
$B\left( D \right) = {{K}_{i}}\left[ {\frac{{{{\mu }_{m}}\left( {D{{P}_{m}} - {{Q}_{P}}} \right)}}{{{{P}_{m}}{{D}^{2}}}} - 1} \right].$Соотношения (11)–(12) получены в [37]. В этой же публикации приведены координаты так называемых особых точек, ограничивающих область значений D и область значений Sf. Значения D1 – минимальное значение D для обоих уравнений (11) и (12); D2 – максимальное значение D для обоих уравнений (11) и (12):
(13)
$\begin{gathered} {{D}_{{1,2}}} = \\ = \,\,\frac{{{{\mu }_{m}}}}{{2\left[ {1 + 2{{{\left( {\frac{{{{K}_{m}}}}{{{{K}_{i}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right]}}\left[ {1 \mp \sqrt {\frac{{4{{Q}_{P}}}}{{{{P}_{m}}{{\mu }_{m}}}}\left[ {1 + 2{{{\left( {\frac{{{{K}_{m}}}}{{{{K}_{i}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right]} } \right]. \\ \end{gathered} $Приведен расчет значений Sf: Sf(D1) и Sf(D2).
Еще две особые точки для области допустимых значений $S_{f}^{{{\text{max}}}}$ и $S_{f}^{{{\text{min}}}}$вычислялись, используя необходимое условие по D:
(14)
${\text{для}}\,\,S_{f}^{{{\text{max}}}}:\frac{{d{{S}_{{{{f}_{1}}}}}}}{{dD}} = 0;\,\,\,\,{\text{для}}\,\,S_{f}^{{{\text{min}}}}:\frac{{d{{S}_{{{{f}_{2}}}}}}}{{dD}} = 0.$Вычислены значения D для $S_{1}^{{{\text{max}}}}$ и D для $S_{2}^{{{\text{min}}}}$. Таким образом, определили портрет допустимых значений Sf и D для любого QP < maxQP.
В работах [37–39] приведены соотношения, обосновывающие существование множественности стационарных состояний для рассматриваемого процесса. Более подробно этот вопрос рассмотрен в работах [33, 39]. В работе [33] приведены расчетные соотношения, по которым при заданном значении D в реальной технологии определяются два значения Sf, обеспечивающие одно и то же значение QP, т.е. существуют два технологических процесса. Приведены алгоритмы расчета показателей процесса в условиях множественности. Дан пример результатов численного расчета для двух стационарных состояний.
Более сложная задача решалась в [37], где в качестве исходного значения принималось Sfи вычислялись значения D, обеспечивающие одно и то же значение QP. В данном варианте область допустимых значений [37] разделяется на три части, для каждой из которых по заданному Sf используются свои расчетные соотношения. Однако, так же как и в [33], по каждому значению Sf получают два значения D, т.е. формируется два стационарных состояния для одного и того же значения QP. Приведены примеры численных расчетов для каждой из частей.
В работе [40] показано, что учет ингибирования в выражении для удельной скорости роста концентрацией биомассы и концентрацией продукта может быть выражен в более общей форме:
(15)
$\mu = {{\mu }_{m}}\frac{S}{{{{K}_{S}} + S}}{{\left( {1 - \frac{X}{{{{X}_{m}}}}} \right)}^{f}}{{\left( {1 - \frac{P}{{{{P}_{m}}}}} \right)}^{h}}.$В этой же работе получены оценки для f и h при обработке шести экспериментов с различной концентрацией лактозы штамма Lactobacillus casei. Значения f и h по всем экспериментам были равными 0.5. И только один опыт показал f = 0.7 при h = 0.5.
В последующем эти данные использовались при моделировании в процессах с другими штаммами микроорганизмов.
В работах [41, 42] при моделировании стационарных состояний рассматривалась возможность использования в технологии сырья, воспроизводящего основной субстрат в процессе синтеза [41], и использование штаммов микроорганизмов, образующих побочный продукт в достаточно больших количествах [42].
В работе [41] рассматривался и моделировался процесс получения молочной кислоты из пшеничной муки. В качестве компонента, воспроизводящего основной субстрат, использовалась мальтоза, в процессе гидролиза которой образовывался основной субстрат (глюкоза). Приведены расчетные соотношения для показателей стационарного процесса X, P, S, M0 по решению уравнений модели вида
где M0 – концентрация мальтозы в поступающем потоке, г/л; S0 – концентрация глюкозы в поступающем потоке, г/л.Удельная скорость роста микроорганизмов μ использовалась в виде
(20)
$\mu = {{\mu }_{m}}\frac{S}{{{{K}_{S}} + S}}{{\left( {1 - \frac{P}{{{{P}_{m}}}}} \right)}^{h}},$т.е. учитывалось ингибирование субстратом и продуктом.
Экспериментальные исследования выполнены в двух вариантах: 1) S0 = 125 г/л; M0 = 60 г/л; 2) S0 = 115 г/л; M0 = 70 г/л.
Получены оценки констант для (16)–(20), значения которых приведены в табл. 4 [41].
Таблица 4.
Идентифицированные величины параметров модели
| Параметр | Значение |
|---|---|
| μmax, ч–1 | 0.28 |
| Pmax, г/л | 98.6 |
| YX, г(клеток)/г(глюкозы) | 0.053 |
| YP, г(продукта)/г(клеток) | 0.82 |
| KM, ч–1 | 0.035 |
| KS , г/л | 0.5 |
| n | 3 |
Приведены численные значения показателей стационарных процессов, в том числе и оптимального (maxQP).
В работе [42] приведены соотношения для расчета показателей процесса получения молочной кислоты с использованием штамма Lactococcus lactis ssp. lactis ATCC 19435. Особенность процесса заключалась в том, что в отличие от стандартных условий при температуре выше 30°C образуется побочный продукт. Таким образом, удельная скорость роста использована в виде
(21)
${{r}_{X}} = \frac{{{{\mu }_{m}}{{S}_{g}}X}}{{{{S}_{g}} + {{K}_{S}} + {{S_{g}^{2}} \mathord{\left/ {\vphantom {{S_{g}^{2}} {{{K}_{i}}}}} \right. \kern-0em} {{{K}_{i}}}}}}{{\left( {1 - {{K}_{P}}P{\text{*}}} \right)}^{n}}.$Скорость образования продукта rP:
Скорость образования побочного продукта rP2:
При стандартных условиях (pH 6.0 и 30°C) побочный продукт не образуется. Для этих условий n = 2.06; α = 13.2; β = 6.45 × 10–2.
Зависимость параметров процесса от температуры принята в форме
(24)
${\text{параметр}} = {{A}_{1}}{{e}^{{ - \frac{{{{E}_{1}}}}{{RT}}}}} + {{A}_{2}}{{e}^{{ - \frac{{{{E}_{2}}}}{{RT}}}}}.$Значения для αa: A1 = 2.88; E1 = 53.9. Для βa: A1 = = 2.97 × 10–2; E1 = 543; A2, E2 не указаны.
Температурная зависимость изучалась в области температур от 30 до 37°C.
В публикации [43] разработана более сложная математическая модель для описания стационарного состояния в ферментере с использованием штамма Lactococcus lactis NZ133.
Сложность математической модели заключается в том, что она включает большое число констант. Уравнения модели:
(25)
$\begin{gathered} {{\mu }_{m}}\left( {\frac{S}{{{{K}_{{SX}}} + S}}} \right)\left( {1 - \frac{{P - {{P}_{{iX}}}}}{{{{P}_{{mX}}} - {{P}_{{iX}}}}}} \right) \times \\ \times \,\,\left( {\frac{{{{K}_{{iX}}}}}{{{{K}_{{iX}}} + S}}} \right)X - DX = 0; \\ \end{gathered} $(26)
$\begin{gathered} {{q}_{{P{\text{max}}}}}\left( {\frac{S}{{{{K}_{{SP}}} + S}}} \right)\left( {1 - \frac{{P - {{P}_{{iP}}}}}{{{{P}_{{mP}}} - {{P}_{{iP}}}}}} \right) \times \\ \times \,\,\left( {\frac{{{{K}_{{iP}}}}}{{{{K}_{{iP}}} + S}}} \right)X - DP = 0; \\ \end{gathered} $(27)
$\begin{gathered} D\left( {{{S}_{0}} - S} \right) - {{q}_{{S{\text{max}}}}}\left( {\frac{S}{{{{K}_{{SS}}} + S}}} \right) \times \\ \times \,\,\left( {1 - \frac{{P - {{P}_{{iS}}}}}{{{{P}_{{mS}}} - {{P}_{{iS}}}}}} \right)\left( {\frac{{{{K}_{{iS}}}}}{{{{K}_{{iS}}} + S}}} \right)X = 0. \\ \end{gathered} $Значения констант определялись по экспериментальным данным в условиях периодического культивирования.
С использованием математической модели [43] в работе [44] разработан и численно реализован алгоритм расчета показателей процесса X, S, P и QP для различных значений входных показателей Sfи D.
Численная реализация алгоритма выполнена с использованием констант [43]. Важным показателем является наличие экстремальной зависимости продуктивности QP от D при значениях Sf= = 40 г/л и Sf = 60 г/л. Экстремальная зависимость подчеркивает наличие множественности стационарных состояний для технологии с данным штаммом.
В публикациях [45–47] с использованием (25)–(27) приведены соотношения для оптимальных условий, а так же расчетные соотношения оценки множественности показателей для стационарных процессов по заданному значению протока D и значению концентрации субстрата Sf.
В работе [45] показано, что величина продуктивности определяется двумя показателями: значением концентрации субстрата S и величиной протока D, т.е. QP= QP(S, D).
Условие экстремума формировалось двумя соотношениями
(28)
$\frac{{\partial {{Q}_{P}}}}{{\partial S}} = 0\,\,\,\,{\text{и}}\,\,\,\,\frac{{\partial {{Q}_{P}}}}{{\partial D}} = 0.$при ограничениях на входные показатели Sf и D.
Получено выражение для максимальной продуктивности:
(29)
${\text{max}}{{Q}_{P}} = {{\mu }_{m}}\frac{{P_{{mX}}^{2}}}{{4\left( {{{P}_{{mX}}} - {{P}_{{iX}}}} \right)}}\frac{{{{K}_{{iX}}}}}{{{{{\left( {K_{{SX}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}} - K_{{iX}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}} \right)}}^{2}}}}.$Описаны и численно реализованы три алгоритма, основной из которых решает задачу определения Sf и D, доставляющих maхQP.
В работе [46] представлена последовательность оценки показателя Sf по заданному значению D при условии QP < maxQP. Предварительно определяется область возможных значений D, не противоречащая уравнениям материального баланса (25)–(27). Задается значение D и вычисляется два значения Sf. Таким образом, определяются два стационарных состояния при одном D. Приведен алгоритм вычислений и численный расчет по константам [43].
Более сложный вариант оценки множества стационарных состояний по заданному Sfпри QP < < maxQP описан в работе [47]. Значение Sf по уравнениям материального баланса может задаваться в трех различных вариантах:
вариант 1: Sf1 ≤ Sf < maxSf;
вариант 2: Sf2 < Sf < Sf1;
вариант 3: minSf < Sf≤ Sf2.
Расчетные соотношения вычисления D для каждого варианта различны. Поскольку значения D ограничены для условий практической реализации технологии D1 < D < D2, значения ${{S}_{{f1}}} = {{S}_{f}}$ при D1; ${{S}_{{f2}}}$ при D2; maxSf и minSf – предельные значения Sf для данного штамма микроорганизмов.
Приведена последовательность вычисления D при задании Sf по каждому из вариантов, для этих же вариантов рассчитаны численно по два значения D для каждого Sf, т.е. определены по два стационарных состояния. Численные расчеты выполнены по константам [43].
В работе [48] сформирована более общая математическая модель, учитывающая образование побочного продукта B (совокупность всех побочных продуктов) и использование компонентов сырья, воспроизводящего основной субстрат в процессе синтеза, M0.
Математическая модель имеет следующий вид:
(35)
$\mu = {{\mu }_{{{\text{max}}}}}{{\left( {1 - \frac{X}{{{{X}_{{{\text{max}}}}}}}} \right)}^{{{{n}_{1}}}}}{{\left( {1 - \frac{P}{{{{P}_{{{\text{max}}}}}}}} \right)}^{{{{n}_{2}}}}}\frac{S}{{{{K}_{m}} + S + {{{{S}^{2}}} \mathord{\left/ {\vphantom {{{{S}^{2}}} {{{K}_{i}}}}} \right. \kern-0em} {{{K}_{i}}}}}}.$Математическая модель содержит элементы, учитывающие возможность ингибирования, включенные в соотношение кинетики: ингибирование биомассой (Xmax, n1), продуктом (Pmax, n2), субстратом (Ki).
Результаты преобразования системы (30)–(35) приведены в приложении (формулы (П.1)−(П.11)), которые необходимы для решения поставленной задачи.
В публикации [48] приведена последовательность решения задачи оптимизации при maxQP. Особенность решения заключается в возможности получения множества значений показателей процесса $S_{0}^{{{\text{opt}}}}$ и $M_{0}^{{{\text{opt}}}}$ для одного и того же значения maxQP. Приведены результаты численных расчетов с использованием констант по литературным источникам.
Подробный анализ обобщенной математической модели с позиций оценки стационарных состояний приведен в работе [49].
Расчетные соотношения приведены для трех вариантов постановки задачи. Наиболее интересным из них является третий – наиболее общий.
Для всех вариантов приведена формула вычисления максимального значения Dпред (при отсутствии подпитки, т.е. M0 = 0). Формируется область значений D по уравнению
(36)
$0 < {{D}^{{{\text{пред}}}}} < \frac{{{{\mu }_{m}}}}{{1 + 2{{{\left( {\frac{{{{K}_{m}}}}{{{{K}_{i}}}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}.$Условия варианта 3: значение S с использованием математической модели
(37)
$S = {{S}_{0}} + \frac{{{{k}_{M}}{{M}_{0}}}}{{D + {{k}_{M}}}} - \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{P}{{\left( {\alpha + {\beta \mathord{\left/ {\vphantom {\beta D}} \right. \kern-0em} D}} \right)}}.$Приведен алгоритм решения задачи оценки X, S, P, B, M, QP с численными значениями по константам уравнений приведены в [49].
В работе [50] приведены расчетные соотношения оценки показателей стационарного состояния в условиях задания величины протока D, которые определяются как крайние значения D1 и D2, т.е. D может быть задано по условию
Приведены расчетные соотношения для D1 и D2.
Множественность формируется при задании D по (37) и вычисляется по формулам для $S_{1}^{'}\left( D \right)$ и $S_{2}^{'}\left( D \right)$ (формулы (П.2), (П.6) и (П.7) из приложения).
В публикациях [51, 52] с использованием уравнений математической модели (30)–(35) получены соотношения для формирования множества стационарных состояний, реально обеспечивающих получение молочной кислоты.
В работе [51] оценка показателей множественности производится по условию задания S0 в допустимых пределах и определяются M0 и D при заданном значении продуктивности при QP < maxQP.
Отмечена область возможного задания S0. Определение области производится по совместному решению уравнений (П.6) и (П.7) с использованием (П.2). В (П.6) и (П.7) $S_{1}^{'} = {{S}_{0}}$ и $S_{2}^{'} = {{S}_{0}}$ при M0 = 0. Область ограничена координатами особых точек. Особые точки 1 и 2 получены по решению (П.8) с последующей оценкой S0 для D1 и D2. Еще две особые точки 3 и 4 определены как максимальное значение S0 по (П.6) (точка 3) и минимальное значение S0 по (П.7) (точка 4), точка 5 – точка экстремума.
При задании S0 по каждой из особых точек стационарное состояние всегда единственное, т.е. множества не существует.
Вся область возможного задания S0 разделена на три части. Последнее объясняется необходимостью вычислений показателей множественности по различным соотношениям для каждой части:
(39)
${\text{часть}}\,\,{\text{I}}{\kern 1pt} :{{S}_{1}}\left( {{{D}_{1}}} \right) < {{S}_{0}} < {{S}_{3}}\left( {{{D}_{3}}} \right);$(40)
${\text{часть}}\,\,{\text{II}}\,:{{S}_{2}}\left( {{{D}_{2}}} \right) < {{S}_{0}} < {{S}_{1}}\left( {{{D}_{1}}} \right);$(41)
${\text{часть}}\,\,{\text{III}}{\kern 1pt} :{{S}_{4}}\left( {{{D}_{4}}} \right) < {{S}_{0}} < {{S}_{2}}\left( {{{D}_{2}}} \right),$Показано, что $S_{1}^{'} > S_{2}^{'}$. Отдельно для каждой из частей рассмотрено формирование множеств стационарных состояний для принятого QP.
Получена и приведена таблица формул для вычислений M0 и D по заданному S0 для каждой части. Даны результаты численных расчетов по каждой из частей, т.е. определены значения координат особых точек с использованием констант, приведенных в публикации для принятого значения QP, сформированы показатели множеств Мн1*, Мн2* и Мн3* по каждой части соответственно.
На рис. 1 показан портрет зависимости S0 от D для QP = 6.0 г/(л ч) с обозначением частей расчета.
Рис. 1.
Портрет S0 от D при QP = 6 г/(л ч): 1–4 – положение особых точек; 5 – положение точки экстремума.

В работе [52] приведены показатели оценки множественности по заданной концентрации компонента, воспроизводящего основной субстрат в процессе синтеза, M0. Так же как и в [51], определяется область задания M0 в доступных пределах и соответствующих значений S0 и D при заданном значении QP < maxQP.
Определена область возможных заданий M0 по совместному решению (П.6) и (П.7) с использованием (П.2). Здесь в (П.6) и (П.7) значение $S{\kern 1pt} '$ по (П.4) при S0 = 0.
Таким образом, получаем два уравнения:
используя (П.6):
(42)
$\begin{gathered} {{M}_{0}} = \left[ {\frac{{D + {{k}_{M}}}}{{{{k}_{M}}}}} \right]\left[ {\frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha D + \beta } \right)}} + \frac{{{{K}_{i}}}}{2}\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]} \right. + \\ \left. { + \,\,\sqrt {{{{\left( {\frac{{{{K}_{i}}}}{2}} \right)}}^{2}}{{{\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]}}^{2}} - {{K}_{m}}{{K}_{i}}} } \right]; \\ \end{gathered} $используя (П.7):
(43)
$\begin{gathered} {{M}_{0}} = \left[ {\frac{{D + {{k}_{M}}}}{{{{k}_{M}}}}} \right]\left[ {\frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha D + \beta } \right)}} + } \right. \\ + \,\,\frac{{{{K}_{i}}}}{2}\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right] - \\ \left. { - \,\,\sqrt {{{{\left( {\frac{{{{K}_{i}}}}{2}} \right)}}^{2}}{{{\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]}}^{2}} - {{K}_{m}}{{K}_{i}}} } \right]. \\ \end{gathered} $Область ограничена координатами особых точек. Особые точки 1 и 2 вычисляются по решению (П.8), откуда получаем D1 и D2. Для D1 и D2 вычисляются значения M0:
(44)
$\begin{gathered} {\text{для}}\,\,{{D}_{1}}:{{M}_{0}}\left( {{{D}_{1}}} \right) = \\ = \frac{{{{D}_{1}} + {{k}_{M}}}}{{{{k}_{M}}}}\left[ {\frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha {{D}_{1}} + \beta } \right)}} + {{{\left( {{{K}_{m}}{{K}_{i}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right]; \\ \end{gathered} $(45)
$\begin{gathered} {\text{для}}\,\,{{D}_{2}}:{{M}_{0}}\left( {{{D}_{2}}} \right) = \\ = \frac{{{{D}_{1}} + {{k}_{M}}}}{{{{k}_{M}}}}\left[ {\frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha {{D}_{2}} + \beta } \right)}} + {{{\left( {{{K}_{m}}{{K}_{i}}} \right)}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}} \right]. \\ \end{gathered} $Еще две особые точки 3 и 4 вычисляются как максимальное значение M0 по (42) (точка 3) и минимальное по (43) (точка 4). Значение М0 для точки 3 вычисляется по (42) при D = D3; значение M0 для точки 4 – по (43) при D = D4.
В результате область выделенных значений для M0 разделена на три части:
(46)
${\text{часть}}\,\,{\text{I}}\,:{{M}_{0}}\left( {{{D}_{2}}} \right) < {{M}_{0}} < {{M}_{0}}\left( {{{D}_{3}}} \right);$(47)
${\text{часть}}\,\,{\text{II}}\,:\,{{M}_{0}}\left( {{{D}_{1}}} \right) < {{M}_{0}} < {{M}_{0}}\left( {{{D}_{2}}} \right);$(48)
${\text{часть}}\,\,{\text{III}}\,:\,{{M}_{0}}\left( {{{D}_{4}}} \right) < {{M}_{0}} < {{M}_{0}}\left( {{{D}_{1}}} \right),$Раздельно для каждой из частей рассмотрено формирование множеств стационарных состояний для принятого QP.
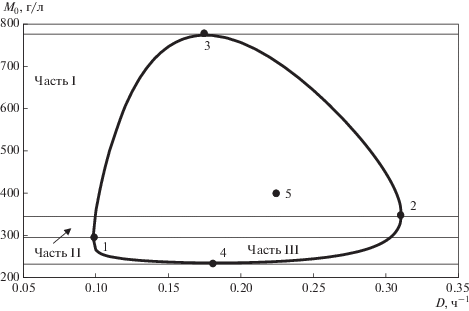
Получена и приведена таблица формул для вычисления S0 и D по заданному M0 по каждой части. Приведены результаты численных расчетов по каждой из частей, сформированы показатели множеств Мн1**, Мн2**, Мн3**. На рис. 2 показан портрет зависимости M0 от D с обозначением особых точек и обозначением частей I, II и III. Портрет построен для QP= 6.0 г/(л ч) по константам таблицы [52]; точка 5 – точка экстремума.
Рис. 2.
Портрет M0 от D при QP = 6 г/(л ч): 1–4 – положение особых точек; 5 – положение точки экстремума.
Завершая эту часть обзора, приведем еще одну публикацию [53], которая выпадает из общей схемы обзора, так как в ней описан специальный прибор (аппарат) для получения молочной кислоты. Сам аппарат представляет собой трубку диаметром 10 мм и длиной 400 мм с биопленкой. Описано моделирование (экспериментальное) непрерывного процесса и приведены результаты опытов. Количественных оценок (уравнений материальных балансов) в публикации нет, однако, судя по заключению, аппарат имеет перспективу использования.
ЗАКЛЮЧЕНИЕ
В заключение приведем две публикации [54, 55], в которых отсутствуют расчеты показателей стационарных состояний получения молочной кислоты и, более того, сами являются обзорными публикациями. Публикация [54] содержит 63 литературных ссылок, [55] – 35 литературных ссылок.
Публикация [54] представляет собой обзор текущих разработок непрерывной ферментации молочной кислоты и обстоятельное изучение утилизации недорогих сырьевых материалов. Приведен перечень микроорганизмов с основными показателями их культивирования в непрерывной ферментации, в том числе с клеточным рециклом. Описаны возможности использования альтернативных субстратов и даны общие экономические оценки процессов непрерывной ферментации. Отметим, что большинство публикаций в обзоре относятся к 2016 году и ранее.
Интерес к публикации [55] связан с тем, что этот обзор фактически в какой-то степени расширяет обзор публикации [3] по разделу пищевая промышленность. В частности, отмечена роль ферментации в обеспечении пищей, т.е. подчеркивается, какие свойства пищи улучшают молочнокислые бактерии (LAB): аромат, сохранение свойств, предотвращение отравления, антибиотические свойства.
Приведен перечень LAB для пищевой отрасли – приготовление творога, йогуртов, хлебной продукции и т.п. Следует отметить, что количественных показателей в публикации не приводится и, таким образом, имеем чисто литературный обзор с обоснованием заключений по ссылкам на публикации.
ПРИЛОЖЕНИЕ
(П.1)
$\frac{D}{{{{\mu }_{{{\text{max}}}}}}} = A\left( D \right)\frac{{{{K}_{i}}S}}{{{{K}_{m}}{{K}_{i}} + {{K}_{i}}S + {{S}^{2}}}},$(П.2)
$\begin{gathered} A\left( D \right) = {{\left( {1 - \frac{{{{Q}_{P}}}}{{{{X}_{{\max }}}\left( {\alpha D + \beta } \right)}}} \right)}^{{{{n}_{1}}}}} \times \\ \times \,\,{{\left( {1 - \frac{{{{Q}_{P}}}}{{{{P}_{{\max }}}\left( {\alpha D + \beta } \right)}}} \right)}^{{{{n}_{2}}}}}, \\ \end{gathered} $(П.3)
$S = S{\kern 1pt} '\,\, - \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha D + \beta } \right)}},$(П.5)
$\begin{gathered} S = \frac{{{{K}_{i}}}}{2}\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right] \pm \\ \pm \,\,\sqrt {{{{\left( {\frac{{{{K}_{i}}}}{2}} \right)}}^{2}}{{{\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]}}^{2}} - {{K}_{m}}{{K}_{i}}} , \\ \end{gathered} $(П.6)
$\begin{gathered} {{{S'}}_{1}} = \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha D + \beta } \right)}} + \frac{{{{K}_{i}}}}{2}\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right] + \hfill \\ + \,\,\sqrt {{{{\left( {\frac{{{{K}_{i}}}}{2}} \right)}}^{2}}{{{\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]}}^{2}} - {{K}_{m}}{{K}_{i}}} {\kern 1pt} , \hfill \\ \end{gathered} $(П.7)
$\begin{gathered} {{{S'}}_{2}} = \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{{{Q}_{P}}}}{{\left( {\alpha D + \beta } \right)}} + \frac{{{{K}_{i}}}}{2}\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right] - \\ - \,\,\sqrt {{{{\left( {\frac{{{{K}_{i}}}}{2}} \right)}}^{2}}{{{\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]}}^{2}} - {{K}_{m}}{{K}_{i}}} . \\ \end{gathered} $Уравнения для вычисления maxQP (максимального значения QP) и соответствующего ему значения протока Dopt:
(П.8)
${{\left( {\frac{{{{K}_{i}}}}{2}} \right)}^{2}}{{\left[ {A\left( D \right)\frac{{{{\mu }_{{\max }}}}}{D} - 1} \right]}^{2}} - {{K}_{m}}{{K}_{i}} = 0,$(П.9)
$S_{{{\text{opt}}}}^{'} = \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{{\max {{Q}_{P}}}}{{\left( {\alpha {{D}^{{{\text{opt}}}}} + \beta } \right)}} + {{({{K}_{m}}{{K}_{i}})}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$(П.10)
$S_{{{\text{opt}}}}^{'} = S_{0}^{{{\text{opt}}}} + \frac{{{{k}_{M}}M_{0}^{{{\text{opt}}}}}}{{{{D}^{{{\text{opt}}}}} + {{k}_{M}}}},$(П.11)
$\left\{ \begin{gathered} P = \frac{{{{Q}_{P}}}}{D};\,\,X{\kern 1pt} = \frac{P}{{\alpha + {\beta \mathord{\left/ {\vphantom {\beta D}} \right. \kern-0em} D}}}; \hfill \\ B = \left( {{{\alpha }_{B}}{\kern 1pt} + {{{{\beta }_{B}}} \mathord{\left/ {\vphantom {{{{\beta }_{B}}} D}} \right. \kern-0em} D}} \right)\frac{P}{{\alpha + {\beta \mathord{\left/ {\vphantom {\beta D}} \right. \kern-0em} D}}} \hfill \\ S = {{S}_{0}} + \frac{{{{k}_{M}}{{M}_{0}}}}{{D + {{k}_{M}}}} - \frac{1}{{{{Y}_{{{X \mathord{\left/ {\vphantom {X S}} \right. \kern-0em} S}}}}}}\frac{P}{{\alpha + {\beta \mathord{\left/ {\vphantom {\beta D}} \right. \kern-0em} D}}};\,\,M = \frac{{D{{M}_{0}}}}{{D + {{k}_{M}}}}. \hfill \\ \end{gathered} \right.$ОБОЗНАЧЕНИЯ
| B | концентрация суммарного количества побочных продуктов, г/л |
| D | величина протока, ч–1 |
| Ki | константа ингибирования, г/л |
| Km | константа насыщения субстрата, г/л |
| kM | константа, определяющая количество воспроизведенного субстрата, ч–1 |
| M | концентрация сырья, дополнительно воспроизводящего субстрат, г/л |
| P | концентрация продукта, г/л |
| QP | продуктивность, г/(л ч) |
| S | концентрация субстрата, г/л |
| X | концентрация биомассы, г/л |
| YX/S | стехиометрический коэффициент, г/г |
| α, αB, β, βB | константы |
| µ | удельная скорость роста микроорганизмов, ч–1 |
ИНДЕКСЫ
Список литературы
Gordeev L.S., Koznov A.V., Skichko A.S., Gordeeva Y.L. Unstructured mathematical models of lactic acid biosynthesis kinetics: a review // Theor. Found. Chem. Eng. 2017. V. 51. № 2. P. 175. [Гордеев Л.С., Кознов А.В., Скичко А.С., Гордеева Ю.Л. Неструктурированные математические модели кинетики биосинтеза молочной кислоты. Обзор // Теор. осн. хим. технол. 2017. Т. 51. № 2. С. 8.]
Gordeeva Yu.L., Rudakovskaya E.G., Gordeeva E.L., Borodkin A.G. Mathematical modeling of biotechnological process of lactic acid production by batch fermentation: A review // Theor. Found. Chem. Eng. 2017. V. 51. № 3. P. 282. [Гордеева Ю.Л., Рудаковская Е.Г., Гордеева Е.Л., Бородкин А.Г. Математическое моделирование биотехнологического процесса периодической ферментации получения молочной кислоты. Обзор // Теор. осн. хим. технол. 2017. Т. 51. № 3. С. 270.]
Wee Y.J., Kim J.N., Ryu H.W. Biotechnological production of lactic acid and its recent applications // Food Technol. Biotechnol. 2006. V. 44. № 2. P. 163.
Datta R., Henry M. Lactic acid: recent advances in products, processes and technologies – a review // J. Chem. Technol. Biotechnol. 2006. V. 81. P. 1119.
Abdel-Rahman M.A., Tashiro Y., Sonomoto K. Recent advances in lactic acid production by microbial fermentation processes // Biotechnol. Adv. 2013. V. 31. № 6. P. 877.
Hofvendahl K., Hahn-Hӓgerdal B. Factors affecting the fermentative lactic acid production from renewable resources // Enzyme Microb. Technol. 2000. V. 26. № 2–4. P. 87.
Kotzamanidis Ch., Roukas T., Skaracis G. Optimization of lactic acid production from beet molasses by Lactobacillus delbrueckii NCIMB 8130 // World J. Microbiol. Biotechnol. 2002. V. 18. № 5. P. 441.
Wee Y.J., Kim J.N., Yun J.S., Ryu H.W. Utilization of sugar molasses for economical L(+)-lactic acid production by batch fermentation of Enterococcus faecalis // Enzyme Microb. Technol. 2004. V. 35. № 6–7. P. 568.
Richter K., Berthold C. Biotechnological conversion of sugar and starchy crops into lactic acid // J. Agric. Eng. Res. 1998. V. 71. № 2. P. 181.
Richter K., Trӓger A. L(+)-lactic acid from sweet sorghum by submerged and solid-state fermentations // Acta Biotechnol. 1994. V. 14. P. 367.
Hofvendahl K., Hahn-Hӓgerdal B. L-lactic acid production from whole wheat flour hydrolysate using strains of Lactobacilli and Lactococci // Enzyme Microb. Technol. 1997. V. 20. № 4. P. 301.
Oh H., Wee Y.J., Yun J.S., Han S.H., Jung S., Ryu H.W. Lactic acid production from agricultural resources as cheap raw materials // Bioresour. Technol. 2005. V. 96. № 13. P. 1492.
Xiaodong W., Xuan G., Rakshit S.K. Direct fermentative production of lactic acid on cassava and other starch substrates // Biotechnol. Lett. 1997. V. 19. № 9. P. 841.
Yun J.S., Wee Y.J., Kim J.N., Ryu H.W. Fermentative production of DL-lactic acid from amylase-treated rice and wheat brans hydrolyzate by a novel lactic acid bacterium, Lactobacillus sp. // Biotechnol. Lett. 2004. V. 26. № 20. P. 1613.
Linko Y.Y., Javanainen P. Simultaneous liquefaction, saccharification, and lactic acid fermentation on barley starch // Enzyme Microb. Technol. 1996. V. 19. № 2. P. 118.
Vishnu C., Seenayya G., Reddy G. Direct fermentation of various pure and crude starchy substrates to L(+)-lactic acid using Lactobacillus amylophilus GV6 // World J. Microbiol. Biotechnol. 2002. V. 18. № 5. P. 429.
Yáñez R., Moldes A.B., Alonso J.L., Parajó J.C. Production of D(–)-lactic acid from cellulose by simultaneous saccharification and fermentation using Lactobacillus coryniformis subsp. torquens // Biotechnol. Lett. 2003. V. 25. № 14. P. 1161.
Miura S., Arimura T., Itoda N., Dwiarti L., Feng J.B., Bin C.H., Okabe M. Production of L-lactic acid from corncob // J. Biosci. Bioeng. 2004. V. 97. № 3. P. 153.
Yáñez R., Alonso J.L., Parajó J.C. D-lactic acid production from waste cardboard // J. Chem. Technol. Biotechnol. 2005. V. 80. № 1. P. 76.
Park E.Y., Anh P.N., Okuda N. Bioconversion of waste office paper to L(+)-lactic acid by the filamentous fungus Rhizopus oryzae // Bioresour. Technol. 2004. V. 93. № 1. P. 77.
Moldes A.B., Alonso J.L., Parajó J.C. Strategies to improve the bioconversion of processed wood into lactic acid by simultaneous saccharification and fermentation // J. Chem. Technol. Biotechnol. 2001. V. 76. № 3. P. 279.
Wee Y.J., Yun J.S., Park D.H., Ryu H.W. Biotechnological production of L(+)-lactic acid from wood hydrolyzate by batch fermentation of Enterococcus faecalis // Biotechnol. Lett. 2004. V. 26. № 1. P. 71.
Schepers A.W., Thibault J., Lacroix C. Lactobacillus helveticus growth and lactic acid production during pH-controlled batch cultures in whey permeate/yeast extract medium. Part II: kinetic modeling and model validation // Enzyme Microb. Technol. 2002. V. 30. № 2. P. 187.
Büyükkileci A.O., Harsa S. Batch production of L(+)-lactic acid from whey by Lactobacillus casei (NRRL B-441) // J. Chem. Technol. Biotechnol. 2004. V. 79. № 9. P. 1036.
Monod J. Recherches sur la croissance des cultures bactériennes. Paris: Hermann & Cie, 1942.
Agrawal P., Koshy G., Ramseier M. An algorithm for operating a fed-batch fermentor at optimum specific-growth rate // Biotechnol. Bioeng. 1989. V. 33. № 1. P. 115.
Henson M.A., Seborg D.E. Nonlinear control strategies for continuous fermenters // Chem. Eng. Sci. 1992. V. 47. № 4. P. 821.
Kumar P., Subrahmanya J.V.K., Chidambaram M. Periodic operation of a bioreactor with input multiplicities // Can. J. Chem. Eng. 1993. V. 71. P. 766.
Гордеева Ю.Л., Ивашкин Ю.А., Гордеев Л.С., Глебов М.Б. Моделирование процессов микробиологического синтеза с нелинейной кинетикой роста микроорганизмов. М.: РХТУ им. Д.И. Менделеева, 2011.
Гордеева Ю.Л., Комиссаров Ю.А., Бородкин А.Г. Алгоритмы расчета показателей процесса микробиологического синтеза с нелинейной кинетикой роста микроорганизмов // Вестн. Астрах. гос. тех. унив. Сер.: Упр., вычисл. тех. инф. 2014. № 2. С. 128.
Гордеева Ю.Л. Алгоритмы оценки показателей процесса биосинтеза // Програм. прод. сист. 2012. № 2. С. 94.
Gordeeva Y.L., Gordeev L.S. Optimization of continuous microbiological synthesis processes with nonlinear microbial growth kinetics // Theor. Found. Chem. Eng. 2015. V. 49. № 6. P. 829. [Гордеева Ю.Л., Гордеев Л.С. Оптимизация непрерывных процессов с нелинейной кинетикой роста микроорганизмов // Теор. осн. хим. технол. 2015. Т. 49. № 6. С. 651.]
Гордеева Ю.Л., Меньшутина Н.В., Гордеева Е.Л., Комиссаров Ю.А. Алгоритмы обеспечения реальных условий множественности в процессах микробиологического синтеза при заданной величине протока // Вестн. Астрах. гос. тех. унив. Сер.: Упр., вычисл. тех. инф. 2016. № 2. С. 60.
Гордеева Ю.Л., Щербинин М.Ю., Гордеев Л.С. Стационарные состояния биотехнологических процессов с нелинейной кинетикой роста микроорганизмов. Множественность при заданной величине протока // Энцикл. инж.-хим. 2012. № 8. С. 23.
Gordeeva E.L., Glebov M.B., Borodkin A.G., Gordeeva Y.L. Evaluating the real conditions that provide multiplicity in processes of microbial synthesis at a given substrate concentration // Theor. Found. Chem. Eng. 2016. V. 50. № 4. P. 476. [Гордеева Е.Л., Глебов М.Б., Бородкин А.Г., Гордеева Ю.Л. Оценка реальных условий обеспечения множественности в процессах микробиологического синтеза при заданной концентрации субстрата // Теор. осн. хим. технол. 2016. Т. 50. № 4. С. 480.]
Saha P., Patwardhan S.C., Ramachandra Rao V.S. Maximizing productivity of a continuous fermenter using nonlinear adaptive optimizing control // Bioprocess Eng. 1999. V. 20. P. 15.
Гордеева Ю.Л., Щербинин М.Ю., Гордеев Л.С., Комиссаров Ю.А. Стационарные состояния биотехнологических процессов с нелинейной кинетикой роста микроорганизмов. Множественность при заданной величине концентрации субстрата в поступающем потоке // Вестн. Астрах. гос. тех. унив. Сер.: Упр., вычисл. тех. инф. 2013. № 1. С. 21.
Гордеева Ю.Л., Понкратова С.А., Гордеев Л.С. Информационные системы в биотехнологии. Множественность стационарных состояний // Вестн. Казан. технол. унив. 2011. Т. 14. № 18. С. 137.
Гордеева Ю.Л., Гордеев Л.С. Алгоритмы оценки множественности стационарных состояний биотехнологического процесса получения молочной кислоты // Вестн. Астрах. гос. тех. унив. Сер.: Упр., вычисл. тех. инф. 2014. № 1. С. 7.
Altiok D., Tocatli F., Harsa S. Kinetic modelling of lactic acid production from whey by L. casei (NRRL B-441) // J. Chem. Technol. Biotechnol. 2006. V. 81. P. 1190.
Gonzalez K., Tebbani S., Lopes F., Thorigne A., Givry S., Dumur D., Pareau D. Modeling the continuous lactic acid production process from wheat flour // Appl. Microbiol. Biotechnol. 2016. V. 100. № 1. P. 147.
Åkerberg C., Hofvendahl K., Zacchi G., Hahn-Hӓgerdal B. Modelling the influence of pH, temperature, glucose and lactic acid concentrations on the kinetics of lactic acid production by Lactococcus lactis ssp. lactis ATCC 19435 in whole-wheat flour // Appl. Microbiol. Biotechnol. 1998. V. 49. № 6. P. 682.
Boonmee M., Leksawasdi N., Bridge W., Rogers P.L. Batch and continuous culture of Lactococcus lactis NZ133: experimental date and model development // Biochem. Eng. J. 2003. № 14. P. 127.
Gordeeva Yu.L., Ivashkin Yu.A., Gordeev L.S. Modeling Continuous Biotechnological Process of Lactic-Acid Production // Theor. Found. Chem. Eng. 2012. V. 46. № 3. P. 279. [Гордеева Ю.Л., Ивашкин Ю.А., Гордеев Л.С. Моделирование непрерывного процесса получения молочной кислоты // Теор. осн. хим. технол. 2012. Т. 46. № 3. С. 324.]
Гордеева Ю.Л., Ивашкин Ю.А., Гордеев Л.С. Алгоритмы оптимизации непрерывного процесса биосинтеза молочной кислоты // Програм. прод. сист. 2012. № 3(99). С. 244.
Gordeeva Yu.L., Ivashkin Yu.A., Gordeev L.S. Steady states of a biotechnological process for producing lactic acid at a given dilution rate // Theor. Found. Chem. Eng. 2013. V. 47. № 2. P. 149. [Гордеева Ю.Л., Ивашкин Ю.А., Гордеев Л.С. Стационарные состояния биотехнологического процесса получения молочной кислоты при заданной величине протока // Теор. осн. хим. технол. 2013. Т. 47. № 2. С. 196.]
Gordeeva Yu.L., Gordeev L.S. Steady States of a Biotechnological Process for Producing Lactic Acid at a Given Substrate Concentration in the Inlet Stream // Theor. Found. Chem. Eng. 2014. V. 48. № 3. P. 262. [Гордеева Ю.Л., Гордеев Л.С. Стационарные состояния биотехнологического процесса получения молочной кислоты при заданной концентрации субстрата в поступающем потоке // Теор. осн. хим. технол. 2014. Т. 48. № 3. С. 282.]
Gordeeva Y.L., Borodkin A.G., Gordeev L.S. Optimal process parameters of the synthesis of lactic acid by continuous fermentation // Theor. Found. Chem. Eng. 2018. V. 52. № 3. P. 386. [Гордеева Ю.Л., Бородкин А.Г., Гордеев Л.С. Оптимальные технологические показатели процесса получения молочной кислоты непрерывной ферментацией // Теор. осн. хим. технол. 2018. Т. 52. № 3. С. 334.]
Gordeeva Y.L., Borodkin A.G., Gordeeva E.L., Rudakovskaya E.G. Mathematical modeling of continuous fermentation in lactic acid production // Theor. Found. Chem. Eng. 2019. V. 53. № 4. P. 501. [Гордеева Ю.Л., Бородкин А.Г., Гордеева Е.Л., Рудаковская Е.Г. Математическое моделирование процесса непрерывной ферментации при получении молочной кислоты // Теор. осн. хим. технол. 2019. Т. 53. № 4. С. 402.]
Gordeeva Y.L., Borodkin A.G., Gordeeva E.L. Steady states of a continuous fermentation process for lactic acid production: the multiplicity for a given dilution rate // Theor. Found. Chem. Eng. 2020. V. 54. № 3. P. 482. [Гордеева Ю.Л., Бородкин А.Г., Гордеева Е.Л. Стационарные состояния непрерывного процесса ферментативного получения молочной кислоты. Множественность по заданной величине протока // Теор. осн. хим. технол. 2020. Т. 54. № 3. С. 362.]
Gordeeva E.L., Ravichev L.V., Gordeeva Yu.L. Steady states of a fermentation process for lactic acid production at a given concentration of the main substrate // Theor. Found. Chem. Eng. 2020. V. 54. № 4. P. 569. [Гордеева Е.Л., Равичев Л.В., Гордеева Ю.Л. Стационарные состояния ферментативного процесса получения молочной кислоты по заданной концентрации основного субстрата // Теор. осн. хим. технол. 2020. Т. 54. № 4. С. 440.]
Gordeeva Yu.L., Ravichev L.V., Gordeeva E.L. Estimating the multiplicity of the steady states of a fermentation process for lactic acid production at a given concentration of the component producing the main substrate // Theor. Found. Chem. Eng. 2020. V. 54. № 6. P. 1256. [Гордеева Ю.Л., Равичев Л.В., Гордеева Е.Л. Оценка множественности стационарных состояний ферментативного процесса получения молочной кислоты по заданной концентрации компонента, воспроизводящего основной субстрат // Теор. осн. хим. технол. 2020. Т. 54. № 6. С. 747.]
Cuny L., Pfaff D., Luther J., Ranzinger F., Ödman P., Gescher J., Guthausen G., Horn H., Hille-Reichel A. Evaluation of Productive Biofilms for Continuous Lactic Acid Production // Biotechnol. Bioeng. 2019. V. 116. № 14. P. 2687.
López-Gómez J.P., Alexandri M., Schneider R., Venus J. A review on the current developments in continuous lactic acid fermentations and case studies utilising inexpensive raw materials // Process Biochem. 2019. V. 79. P. 1.
Admassie M. A Review on Food Fermentation and the Biotechnology of Lactic Acid Bacteria // World J. Food Sci. Technol. 2018. V. 2. № 1. P. 19.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


