Теоретические основы химической технологии, 2022, T. 56, № 2, стр. 183-196
Самоподдерживающиеся процессы умягчения-опреснения воды: хлоридно-сульфатные системы
Р. Х. Хамизов a, *, И. В. Комарова a, Н. К. Галкина a, А. Г. Прудковский a
a Институт геохимии и аналитической химии им. В.И. Вернадского РАН
Москва, Россия
* E-mail: khamiz@mail.ru
Поступила в редакцию 13.07.2021
После доработки 07.10.2021
Принята к публикации 08.12.2021
- EDN: IBWNOQ
- DOI: 10.31857/S0040357122020099
Аннотация
Методом численного эксперимента исследована возможность организации стационарных самоподдерживающихся (СМП) процессов умягчения–опреснения солоноватых вод на примере многокомпонентных модельных растворов, содержащих хлориды и сульфаты натрия и кальция. В СМП процессах умягченная с помощью катионита вода подвергается опреснению, а образующийся при этом рассол, без добавления каких-либо дополнительных химических реагентов, используется для регенерации катионита в повторяющихся циклах сорбции–десорбции. Интерес к самоподдерживающимся процессам связан с новыми технологическими возможностями создания систем водоподготовки нового поколения, например мобильных автономных установок или систем с высокой степенью извлечения пресной воды. Проведены расчеты динамики ионного обмена для многих десятков последовательных циклов умягчения–опреснения при изменении варьируемых параметров, в частности, соотношения компонентов в исходном растворе и состава опресненной воды. Показаны условия, при которых формируются или не достигаются стационарные режимы. На основании результатов численных экспериментов предложено критериальное соотношение для предварительной оценки реализуемости самоподдерживающихся процессов.
ВВЕДЕНИЕ
Самоподдерживающиеся (СМП) процессы умягчения-опреснения соленых вод были предсказаны почти полвека назад, что было весьма актуально в связи с растущей индустрией опреснения морских и других природных соленых вод [1]. Суть СМП процесса легко пояснить с помощью простейшей схемы, представленной на рис. 1а.
Рис. 1.
Самоподдерживающиеся процессы умягчения-опреснения в хлоридных (а) и хлоридно-сульфатных системах (б). Процессы: I – Na-катионирование; II – опреснение; III –удаление сульфата. Потоки: 1 – исходная соленая вода; 2 – умягченная соленая вода; 3 – опресненная вода; 4 – рассол без ионов жесткости; 5 – рассол после регенерации.
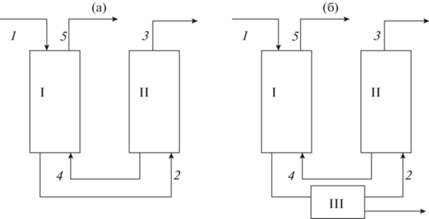
В повторяющемся циклическом процессе через колонну с катионитом в Na-форме пропускается соленая вода, и ионы жесткости, например, кальция, сорбируются в результате реакции ионного обмена, умягченная вода подвергается глубокому опреснению без опасности образования отложений слаборастворимых веществ, рассол, содержащий только соли натрия, накапливается и возвращается на регенерацию катионита после его отработки для вытеснения катионов жесткости и обратного перевода катионита в Na-форму. При использовании двух колонн, работающих в противофазе, можно организовать процесс, в котором непрерывно осуществляются умягчение и регенерация. Интерес к теории СМП-процессов [2–4] связан с технологическими возможностями создания систем водоподготовки нового поколения, например, не требующих привозных реагентов мобильных автономных установок опреснения соленых или солоноватых вод или систем с высокой степенью извлечения пресной воды и концентрирования рассола. В связи с новыми возможностями, которые открывает создание самоподдерживающихся процессов, или просто процессов умягчения-опреснения с рециркуляцией рассолов для частичной или полной регенерации катионита, интенсивно проводятся практические исследования в этой области [6–8]. В работах [3, 5] была показана реализуемость таких процессов для морской воды с использованием специальных неорганических ионообменников, получаемых пока в лабораторных масштабах. В работе [4], посвященной анализу возможности осуществления СМП-процессов для хлоридных растворов с меньшей минерализацией, были рассмотрены фундаментальные основы самоподдерживающихся (СМП)-процессов и показано, что возможность таких процессов связана с явлением электроселективности в ионном обмене и с нелинейными эффектами формирования концентрационных фронтов при обмене разнозарядных ионов. Были представлены результаты моделирования большого количества последовательных циклов умягчения-опреснения водных растворов смесей хлоридов кальция и натрия. Численные эксперименты показали осуществимость стационарных (повторяющихся) самоподдерживающихся процессов с использованием промышленного сильнокислотного катионита. Было показано влияние различных факторов на возможность осуществления и характеристики циклических самоподдерживающихся процессов на стадиях сорбции и регенерации: соотношения концентраций одно- и двухзарядных ионов в исходном растворе, суммарной концентрации этих растворов, степени концентрирования возвратных рассолов по сравнению с исходными растворами, потерь однозарядных ионов, “уносимых” с опресненной водой.
В настоящей работе рассматриваются сульфатсодержащие системы, более близкие к реальным природным соленым и солоноватым водам. По сравнению с двухкомпонентной смесью хлоридов натрия и кальция сульфатсодержащие системы имеют некоторые особенности:
1) комплексообразование (образование молекул сульфата кальция) влияет на ионообменные свойства катионита на стадии сорбционного умягчения;
2) в процессе сорбции идет накопление кальция к фазе катионита, что приводит к опасности осадкообразования при пропускании через кальциевую форму ионита исходного раствора с повышенным содержанием сульфата;
3) процесс опреснения раствора, содержащего ионы кальция и сульфата, может осложняться отложением гипса на теплопроводящих поверхностях или мембранах в зависимости от типа опреснителя;
4) десорбция кальция и регенерация натриевой формы катионита невозможны сульфатсодержащим концентратом после опреснения из-за образования осадка гипса в колонне с катионитом.
Проблемы 3) и 4) могут быть решены, если проводить извлечение сульфата из умягченной воды перед ее опреснением, как это показано на рис. 1б. Такое удаление может быть сделано ионообменным способом на анионите в хлоридной форме, что требует регенерации, например, хлоридом натрия, и что автоматически выводит такой процесс из класса самоподдерживающихся процессов. В данной работе рассмотрено удаление сульфата с помощью метода нанофильтрации, позволяющей разделять двух и однозарядные анионы в процессах, практически аналогичных рассматриваемым [9, 10].
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
В работе [3] для проведения динамических расчетов в циклических процессах на МЦА была использована общая модель многокомпонентного ионного обмена с линейными кинетическими уравнениями разностного типа. Авторы [11] предложили более сложную модель расчета катионирования на цеолитах, учитывающую конвективные процессы продольной дисперсии. В данной работе мы используем т. н. послойную (тарельчатую) модель динамики ионного обмена, которая, с одной стороны, лучше всего апробирована для процессов ионообменной сорбции и регенерации в поточном и противоточном режимах на сильнокислотном катионите [4, 12], с другой стороны, она обеспечивает быстрый счет большого количества последовательных циклов с изменяющимися характеристиками (до выхода на стационарный режим).
Решается задача о прохождении элюента через сорбционную колонну заданной длины L и сечения S, равномерно наполненной сорбентом. Предполагается, что раствор движется по колонне с постоянной скоростью v. Обозначим через ${{\bar {c}}_{i}}(x,t)$ концентрации (моль-экв/л) веществ в сорбенте, традиционно рассчитывающиеся на единицу объема колонны, а через ${{c}_{i}}(x,t)$ концентрации веществ в растворе, движение которых описываемые уравнениями переноса:
(1)
$\frac{{\partial {{c}_{i}}}}{{\partial t}} + v\frac{{\partial {{c}_{i}}}}{{\partial x}} + \frac{1}{\varepsilon }\frac{{\partial {{{\bar {c}}}_{i}}}}{{\partial t}} = {{D}_{{Li}}}\frac{{{{\partial }^{2}}{{c}_{i}}}}{{\partial {{x}^{2}}}}$с граничными условиями первого рода на входе ci(0, t) = fi(t), условиями второго рода на выходе из колонны $\frac{{\partial {{c}_{i}}(L,t)}}{{\partial x}} = 0$ и некоторыми начальными условиями при t = 0: ${{c}_{i}}(x,0) = {{c}_{{i0}}}(x);$ ${{\bar {c}}_{i}}(x,0) = {{\bar {c}}_{{i0}}}(x).$ Обмен ионов между раствором и неподвижным сорбентом описывается в приближении квазистационарности:
(2)
$\frac{{{{{\bar {c}}}_{i}}}}{{{{c}_{i}}}} = K_{{\text{H}}}^{{Cat,i}}{{\left( {\frac{{{{{\bar {c}}}_{{\text{H}}}}}}{{{{c}_{{\text{H}}}}}}} \right)}^{{{{z}_{i}}}}},$(3)
${{c}_{{{\text{OH}}}}} + \sum\limits_{j = 1}^m {{{c}_{j}}} = {{c}_{{\text{H}}}} + \sum\limits_{i = 1}^n {{{c}_{i}}} ,$(4)
${{\bar {c}}_{{\text{H}}}} + \sum\limits_{i = 1}^n {{{{\bar {c}}}_{i}}} = {{\bar {c}}_{\Sigma }},$Молекулярные комплексы
В рассматриваемых в данной работе системах присутствуют ионы Ca2+ и ${\text{SO}}_{4}^{{2 - }},$ а также молекулярные комплексы, образуемые в соответствии с равновесиями: ${\text{CaS}}{{{\text{O}}}_{4}} \leftrightarrow {\text{C}}{{{\text{a}}}^{{2 + }}} + {\text{SO}}_{4}^{{2 - }},$ характеризующимися концентрационными константами устойчивости.
(6)
$\frac{{{{c}_{{{\text{CaS}}{{{\text{O}}}_{{\text{4}}}}}}}}}{{c_{{{\text{Ca}}}}^{{2 + }} \cdot c_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{{2 - }}}} = {{K}_{{{\text{CaS}}{{{\text{O}}}_{{\text{4}}}}}}}\,\,\,({1 \mathord{\left/ {\vphantom {1 {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}).$Табличные значения соответствующей константы устойчивости [13]:
Из (6) получаем систему уравнений относительно $x = {{c}_{{{\text{CaS}}{{{\text{O}}}_{{\text{4}}}}}}}{\text{:}}$
(7)
$\begin{gathered} xK_{{{\text{CaS}}{{{\text{O}}}_{{\text{4}}}}}}^{{ - 1}} = \left( {{{c}_{{{\text{Ca}}}}} - x} \right)\left( {{{c}_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} - x} \right) \Rightarrow x = \\ = \frac{{{{c}_{{{\text{Ca}}}}} + {{c}_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} + K_{S}^{{ - 1}}}}{2} - \sqrt {{{{\left( {\frac{{{{c}_{{{\text{Ca}}}}} + {{c}_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} + K_{S}^{{ - 1}}}}{2}} \right)}}^{2}} - {{c}_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}}{{c}_{{{\text{Ca}}}}}} . \\ \end{gathered} $Концентрацию ионов кальция и сульфата можно теперь рассчитать по формулам:
(8)
$c_{{{\text{Ca}}}}^{ + } = {{c}_{{{\text{Ca}}}}} - x;\,\,\,\,c_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}^{ - } = {{c}_{{{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} - x.$Для расчета ионообменных процессов были модифицированы разработанные нами ранее математическая модель и созданная на ее основе программа “Createscheme” [4, 14], базирующаяся на решении дифференциальных уравнений, описывающих эти процессы в приближении квазистационарности. Решение системы (2)–(5) совместно с уравнениями (6), (7) производится с помощью метода последовательных приближений при каждом акте сорбции на каждом шаге программы. Отличительной особенностью представленной здесь задачи является учет концентраций комплекса CaSO4, которые не участвуют в процессах ионного обмена, но могут снижать эффективность умягчения, способствуя переносу двухзарядных ионов в слое катионита.
Нанофильтрация
Процесс удаления сульфата с помощью нанофильтрации (НФ) также требует учета концентрации незаряженного комплекса CaSO4, который проходит свободно сквозь наномембрану и не участвуeт в процессах фильтрации. Фильтрацию оставшихся ионов можно моделировать с помощью приведенного далее несложного алгоритма.
Основным параметрoм НФ являeтся: степень концентрирования:
(9)
${{Q}_{N}} = {{{{V}_{{KN}}}} \mathord{\left/ {\vphantom {{{{V}_{{KN}}}} {{{V}_{S}}}}} \right. \kern-0em} {{{V}_{S}}}};\,\,\,\,{{V}_{S}} = {{V}_{{KN}}} + {{V}_{{PN}}},$(10)
${{R}_{{N,i}}} = {{({{c}_{{S,i}}} - {{c}_{{PN,i}}})} \mathord{\left/ {\vphantom {{({{c}_{{S,i}}} - {{c}_{{PN,i}}})} {{{c}_{{S,i}}},}}} \right. \kern-0em} {{{c}_{{S,i}}},}}$Для каждого из компонентов раствора выпишем соотношения баланса (выраженные в моль-экв):
Используя (12), можно установить формулу связи концентрационного (10) и массового (11) коэффициентов селективности мембраны:
С учетом высокой селективности многих НФ-мембран к двухзарядным ионам и практического отсутствия у них селективности к простым однозарядным ионам [15, 16] для концентраций катионов и анионов, задерживаемых наномембраной, получим:
(14)
${{c}_{{PN,i}}} = {{c}_{{S,i}}}\left( {1 - {{R}_{{N,i}}}} \right);\,\,\,\,{{c}_{{KN,i}}} = \frac{{{{c}_{{S,i}}}{{V}_{S}} - {{c}_{{PN,i}}}{{V}_{{PN}}}}}{{{{V}_{{KN}}}}}.$В нашем случае наномембрана определяет концентрации двухзарядного иона SO4 и двухзарядного иона Ca, при этом однозарядные ионы Cl и ионы Na проходят сквозь мембрану практически свободно. В связи с тем, что при катионировании концентрации анионов не изменяются в умягченной воде, поступающей на наномембрану, суммарная концентрация ионов кальция много меньше концентрации сульфат-иона, поэтому заряд вещества, задержанного при фильтрации, будет отрицательным и может быть скомпенсирован только положительными ионами натрия. Откуда следует, что концентрации хлорид ионов, свободно проходящих сквозь наномембрану, не меняются ${{c}_{{PN,{\text{Cl}}}}} = {{c}_{{KN{\text{,Cl}}}}} = {{c}_{{S,{\text{Cl}}}}} = {{c}_{{0,{\text{Cl}}}}}.$ А концентрации ионов натрия, компенсирующих отрицательный заряд вещества, задержанного наномембраной и пропущенного сквозь нее, можно найти из соотношений электронейтральности:
(15)
$\begin{gathered} {{c}_{{PN,{\text{Na}}}}} = {{c}_{{PN,{\text{Cl}}}}} + {{c}_{{PN,{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} - {{c}_{{PN,{\text{Ca}}}}}, \\ {{c}_{{KN,{\text{Na}}}}} = {{c}_{{S,{\text{Cl}}}}} + {{c}_{{KN,{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} - {{c}_{{KN,{\text{Ca}}}}}. \\ \end{gathered} $Учитывая, что в пермеате концентрации сульфата и кальция малы, справедлива оценка:
В данной работе моделируется стационарные режимы работы системы, при которых состояние системы стабильно повторяется от цикла к циклу. Такие стабильные режимы полностью определяются граничными условиями и практически не зависят от начальных условий. Соответственно, такие режимы слабо реагируют на случайные ошибки, возвращая систему в прежний режим через несколько циклов. Таким образом, несмотря на длительность счета, накопления ошибок не происходит, что также показано в работе [4], где эта проблема исследована путем введения в процесс искусственных однократных возмущений. Однако, в случае повторяющихся (из цикла в цикл) однотипных малых возмущений такое воздействие может быть существенным, что следует учитывать в будущих исследованиях.
УСЛОВИЯ ПРОВЕДЕНИЯ ЧИСЛЕННЫХ ЭКСПЕРИМЕНТОВ
Для расчетов выбраны следующие параметры: диаметр слоя катионита в колонне – 0.5 м (площадь сечения – 0.196 м2); высота слоя – 1 м; объем слоя сорбента – 0.196 м3; скорость пропускания растворов на стадиях сорбции – 5 колоночных объемов в час (0.980 м3/ч); скорость пропускания растворов на стадиях регенерации – 1 колоночный объем в час (0.196 м3/ч).
Предполагается, что катионит загружен в колонну так, что отсутствует жидкость вне слоя. Свободный объем жидкости определяется только порозностью (межзерновым пространством) стационарного слоя.
Виртуальный циклический процесс осуществляется в соответствии со схемой, показанной на рис. 2.
Рис. 2.
Схема виртуальной установки для численных экспериментов по СМП-процессу. Модули: 1 – Na-катионирования, 2 – нанофильтрации, 3 – опреснения; 4–6 – емкости: 4 – умягченной воды, 5 – регенерирующего раствора, 6 – раствора, вытесняемого из слоя катионита. Потоки: I – исходная вода, II –вытесняемый из слоя раствор, III – умягченная вода, IV – опресненная вода, V – концентрат после опреснителя; VI – регенерирующий раствор, VII – сброс, VIII – концентрат нанофильтрации, IX – добавка раствора NaCl.
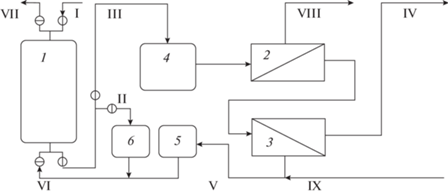
В каждом цикле стадия сорбции начинается с вытеснения рассола, который остался в межзерновом пространстве слоя катионита после предыдущего цикла регенерации. Также в каждом цикле стадия регенерации начинается с т. н. частичной регенерации с использованием этого рассола, полученного после указанной выше операции вытеснения при сорбции. Циклы удобнее описывать по цепочке: вытеснение (и частичная сорбция) – основная сорбция – частичная регенерация – основная регенерация.
Нулевой цикл. Катионит находится в исходной Na – форме. Исходная вода заданного состава $\left( {{{c}_{\Sigma }} = \sum {{{c}_{{0,i}}}} } \right)$ поступает сверху вниз в колонну 1 с катионитом, и умягченная вода собирается в емкости 4. Стадия умягчения заканчивается в момент заданного проскока кальция на выходе из колонны. Весь объем умягченной воды VS из емкости 4 подается в нанофильтрационный модуль 2. Задаются два параметра нанофильтрации: степень концентрирования QN и селективность мембран RN,i, RM,i в соответствии с формулами (9–11).
Концентрат после нанофильтрации, представляющий собой сульфат натрия или смесь сульфата натрия с небольшой примесью хлорида натрия, является побочным продуктом и удаляется из процесса. Пермеат нанофильтрации объемом VPN, практически не содержащий двухзарядных ионов и представляющий собой раствор хлорида натрия, поступает на опреснительный модуль 3. На схеме он приведен так, как обычно рисуют обратно-осмотический модуль. На самом деле, может быть использован опреснитель любого, в том числе дистилляционного типа. Задаются концентрации регенерационного раствора cR, Na и потери натрия с опресненной водой cW, Na; определяются: степень концентрирования рассола после опреснителя (используемого в качестве регенерационного раствора для катионита) kR = cR,Na/cPN,Na, учитывая, что в силу (16) cPN, Na = c0, Cl имеем kR = cR,Na/c0, Cl, а коэффициент kW = cW,Na/c0, Cl определяет потери натрия с опресненной водой, тогда объем раствора на регенерацию VR будет равен:
(17)
${{V}_{R}} = {{V}_{{PN}}}{{Q}_{R}};\,\,\,{{Q}_{R}} = {{(1 - {{k}_{W}})} \mathord{\left/ {\vphantom {{(1 - {{k}_{W}})} {({{k}_{R}} - {{k}_{W}}),}}} \right. \kern-0em} {({{k}_{R}} - {{k}_{W}}),}}$Первый и последующие циклы проводятся по иному алгоритму, включающему вытеснение и частичную сорбцию: на стадии сорбции, по достижению заданной концентрации ионов натрия на выходе, завершается процесс вытеснения рассола в емкость 6, и поток умягченной воды собирается в 4, откуда подается в нананофильтрационный модуль 2 для получения побочного продукта – концентрата и пермеата, который поступает в опреснитель 3 для получения основного продукта – пресной воды и рассола для регенерации, собираемого в емкости 5. Во всех циклах на стадии регенерации частичная регенерация проводится вытесненным рассолом из 6, а основная – рассолом после опреснения из 5. Для осуществления циклического процесса в случаe, когда в численном эксперименте с определенным количеством циклов не удается получить стабильный и повторяющийся СМП-процесс, проводится виртуальная операция по добавлению в емкость 5 определенного дополнительного количества раствора хлорида натрия той же концентрации, что и в 5 для завершения процесса регенерации катионита. Такой процесс не считается самоподдерживающимся.
В численных экспериментах были использованы следующие равновесные параметры – характеристики сульфокатионита КУ-2 (полученные экспериментально и апробированные ранее в расчетах [12]), полная обменная емкость (ПОЕ): ${{\bar {c}}_{\Sigma }}$ = 2 моль-экв/л. Константы равновесия ионного обмена: $K_{{\text{H}}}^{{{\text{Na}}}} = 1.2;$ $K_{{\text{H}}}^{{{\text{Ca}}}} = 5.3.$
Были использованы следующие критерии окончания различных стадий: критерий завершения стадии сорбции – проскок ионов Ca2+ = = 0.005 моль-экв/л. Критерий завершения процесса вытеснения – проскок ионов Na+ = = 0.15 моль-экв/л.
Завершением стадии регенерации считалось пропускание всего объема рассола из емкости 5 через колонну снизу вверх. Накопление концентрата, полученного после регенерации, и дальнейшая его переработка не рассматривались в рамках настоящих численных экспериментов.
Были использованы количественные характеристики нанофильтрационных мембран и процессов с их использованием, опубликованные в работах [15, 16]. В соответствии с этими работами, большинство промышленных НФ мембран характеризуется процентом удерживания двухзарядных ионов (Retention percentage) в диапазоне 89–98%. Для расчетов выбирали среднее значение коэффициента, рассчитываемого по формуле (10), равным: RN,i = 0.938. При оценке по массам, а не концентрациям двухзарядных ионов, это значение в соответствии с (13) соответствует коэффициенту селективности RM,i = 0.95.
В табл. 1 представлены составы модельных растворов, использованные в численных экспериментах.
Таблица 1.
Составы модельных растворов, моль-экв/л
| Ионы | Na+– 0.025 Ca2+ – 0.025 |
Na+– 0.04 Ca2+– 0.01 |
Na+– 0.01 Ca2+– 0.04 |
Na+– 0.045 Ca2+– 0.005 |
|---|---|---|---|---|
| Cl– – 0.025 ${\text{SO}}_{4}^{{2 - }}$ – 0.025 |
K1A1 | K2A1 | K3A1 | K4A1 |
| Cl– – 0.04 ${\text{SO}}_{4}^{{2 - }}$ – 0.01 |
K1A2 | K2A2 | K3A2 | K4A2 |
| Cl– – 0.01 ${\text{SO}}_{4}^{{2 - }}$ – 0.04 |
K1A3 | K2A3 | K3A3 | K4A3 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реализуемость СМП-процессов для 4-х компонентных растворов
На рис. 3 приведены зависимости количества умягченной воды (в единицах колоночных объемов) в циклическом процессе сорбции-регенерации в зависимости от номера цикла для исходного раствора К4А1 (табл. 1). Эти зависимости рассчитаны для циклических процессов умягчения – опреснения, в которых часть хлорида натрия “теряется” с опресненной водой, в данном случае – для 0.01 М концентрации в ней соли. Кривая 1 соответствует самоподдерживающемуся процессу, в ходе формирования которого наблюдается уменьшение объема умягченной воды от цикла к циклу, а затем процесс полностью стабилизируется.
Рис. 3.
Зависимость числа колоночных объемов умягченной воды от номера цикла для раствора К4А1 с исходным содержанием компонентов (моль-экв/л): c0, Ca (Ca2+ + CaSO4) – 0.005, c0, Na – 0.045, c0, Cl – 0.025, ${{c}_{{{\text{0,S}}{{{\text{O}}}_{{\text{4}}}}}}}$ (${\text{SO}}_{4}^{{2 - }}$ + CaSO4) – 0.025. Добавка 1 М раствора NaCl к такому же раствору, возвращаемому на регенерацию в СМП- процессе (%): 1 – 0; 2 – 50; 3 – 100.

Кривые 2 и 3 соответствуют процессам, в которых в каждом цикле в растворы, возвращаемые на регенерацию, дополнительно добавляются разные количества раствора хлорида натрия. Эти процессы, в частности, процесс описываемый зависимостью 2, также являются реагент-сберегающими по сравнению с традиционными ионообменными процессами умягчения, однако они не являются самоподдерживающимися.
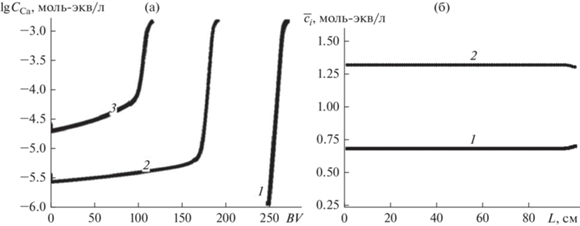
На рис. 4а приведены несколько выходных кривых стадии умягчения (сорбции кальция) для процессов, переходящих в самоподдерживающийся и описываемых рассмотренной выше зависимостью 1. Кривые рассчитаны для предельного “проскока” кальция, равного 1.2 × 10–3 моль-экв/л. Видно, что в стабилизированном процессе по сравнению с процессами в нулевом и первом циклах не только уменьшается емкость слоя катионита по кальцию, но и изменяется качество умягченной воды. Расчеты показывают, что для стабилизированного СМП-процесса усредненная концентрация кальция в объеме умягченной воды становится равной 1.5 × 10–4 моль-экв/л кальция (3 мг/л), что составляет 3% от его содержания в исходной воде. Зависимости для распределения ионов кальция и натрия вдоль слоя катионита после стадий сорбции, приведенные на рис. 4б, показывают, что во всех циклах эти распределения повторяются с высокой точностью и кроме конечных сечений слоя определяются только равновесием между фазами ионита и исходного раствора независимо от распределения компонентов перед сорбцией.
Рис. 4.
Характеристики стадий сорбции для модельного раствора К4А1. а – Выходные кривые кальция в нулевом (1), первом (2) и тридцатом (3) циклах. б – Распределение ионов Ca2+ (1) и Na+ (2) вдоль слоя в нулевом, первом и тридцатом (стабильном) циклах.
В связи с тем, что лишь часть полной обменной емкости слоя катионита “работает” и участвует в Na+ ↔ Ca2+ – обмене в самоподдерживающемся циклическом процессе, в ходе стабилизации СМП-процесса устанавливается существенно меньший расход регенерирующего (в нашем случае – 1 М раствора NaCl) по сравнению с его расходом в начальных циклах. Это хорошо видно на зависимости 1, приведенной на рис. 5. Зависимости 2 и 3 соответствуют зависимостям с такими же номерами для процессов сорбции, проиллюстрированных на рис. 3.
Рис. 5.
Зависимость числа колоночных объемов регенеранта от номера цикла переработки раствора К4А1. Добавка 1 М раствора NaCl (%): 1 – 0; 2 – 50; 3 – 100.

Выходные кривые десорбции кальция и регенерации катионита для некоторых циклов – нескольких точек зависимости 1 приведены на рис. 6.
Рис. 6.
Характеристики стадий регенерации для модельного раствора К4А1. а – выходные кривые компонентов в нулевом, первом, и в тридцатом циклах, соответственно: для кальция – 2, 4, 6; для натрия – 1, 3, 5; б – распределение ионов вдоль слоя катионита в нулевом, первом и тридцатом (стабильном) циклах, соответственно: 2, 4, 6 для Ca2+ и 1, 3, 5 для Na+.

Выходные кривые регенерации (рис. 6а) 4.6 и 3.5 на начальном этапе совпадают, однако имеют разную продолжительность циклов выходные кривые первого цикла 2.58 колоночных объемов, а стабильного цикла 1.59 объемов.
Отличительная особенность стабилизированного СМП-процесса по сравнению с процессами в начальных циклах состоит в том, что концентрация катионных компонентов в первых фракциях выходящего из колонны концентрата резко возрастает. На рис. 6б приведены кривые распределения компонентов вдоль слоя колонны после стадии регенерации для различных циклов. При сравнении однотипных рис. 4б и 6б, следует иметь ввиду, что координата длины слоя L = 0 – это его верхнее сечение, что соответствует входу потока воды в слой для стадии сорбции и выходу из него жидкого концентрата для стадии регенерации. На рис. 6б видно, что в установившемся самоподдерживающемся процессе, например, в 30-ом цикле, как и в начальных циклах, внизу слоя, т.е. на входе в него регенерирующего раствора хлорида натрия, концентрация кальция становится равной нулю, но толщина части слоя с нулевой концентрацией кальция становится ничтожной.
В результате проведения численных экспериментов получено, что самоподдерживающийся процесс реализуется из рассмотренных двенадцати модельных растворов только для шести: K4A1, K4A2, K4A3, K2A2, K2A1, K1A2 (табл. 2).
Таблица 2.
Зависимость количества умягченной воды (в колоночных объемах) от потерь натрия с опресненной водой при стабилизации
| Раствор | Потери натрия с опресненной водой, моль-экв/л | |||
|---|---|---|---|---|
| 0 | 0.005 | 0.01 | 0.015 | |
| K4A1 | 246 | 200 | 116 | 54 |
| K4A2 | 287 | 278 | 263 | 241 |
| K4A3 | 62 | 31.5 | 0.46 | – |
| K2A2 | 129 | 119 | 105 | 86 |
| K2A1 | 76 | 30 | – | – |
| K1A2 | 25 | 8 | – | – |
Причем, для модельных растворов K4A1, K4A2, K2A2 самоподдерживающийся режим осуществляется при всех значениях потерь натрия с опресненной водой. Для модельных растворов K2A1 и K1A2 СМП процесс реализуется только при нулевых потерях и при потерях, равных 0.005 моль-экв/л. Для модельного раствора K4A3 СМП процесс реализуется только при нулевых потерях (табл. 2).
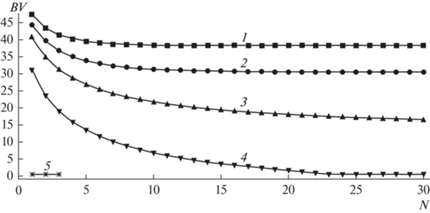
Среди факторов, влияющих на возможность осуществления самоподдерживающегося процесса, наиболее важными являются соотношение компонентов в исходном растворе и величина “уноса” (потерь) ионов натрия из системы вместе с опресненной водой. Влияние последнего фактора видно при сравнении приведенных на рис. 7 зависимости количества умягченной воды (в колоночных объемах) от потерь натрия с опресненной водой для растворов разного состава, а на рис. 8 зависимостей, рассчитанных для раствора К2А1 (табл. 1).
Рис. 7.
Зависимость количества умягченной воды (в колоночных объемах) от потерь натрия с опресненной водой для растворов разного состава: 1 – K4A1, 2 – K4A2, 3 – K4A3, 4 – K2A2, 5 – K2A1, 6 – K1A2.
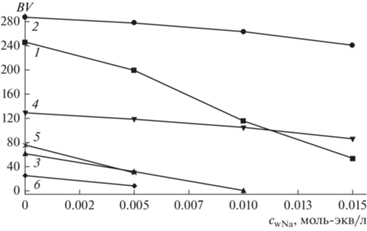
Рис. 8.
Зависимость числа колоночных объемов умягченной воды от номера цикла для раствора К2А1 с исходным содержанием компонентов (моль-экв/л): с0, Ca = 0.01, c0, Na = 0.04, c0, Cl = 0.025, ${{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}$ = 0.025. Концентрация Na+ в опресненной воде (моль-экв/л): 1 – 0; 2 – 0.005.
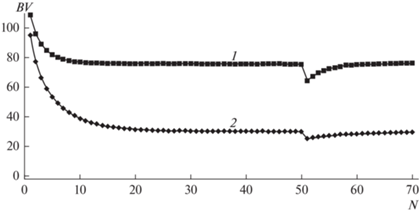
Потери ионов натрия с опресненной водой резко снижают объем раствора, который может быть умягчен в стабилизированном цикле, что очевидно связано со степенью регенерации катионита.
Соотношение компонентов в исходном растворе является существенно более сильным фактором. Его влияние на СМП-процесс можно увидеть, если сравнить зависимости, приведенные на рис. 3 (кривая 1) и рис. 8 (кривая 2).
Увеличение соотношения c0, Ca/c0, Na от значения 0.005/0.045 = 1/9 (рис. 1) до 0.01/0.04 = 1/4 в стабилизированном процессе, показанном на рис. 8, многократно уменьшает объем раствора, который может быть умягчен в одном цикле, при том, что потери Na+ c опресненной водой в этом процессе в два раза меньше.
Изломы на зависимостях, показанных на рис. 8, являются результатом специальных возмущений, вносимых в расчеты для последовательных циклов с целью установления истинности эффекта стабилизации. В этом случае, процессы самопроизвольно восстанавливаются, как показано на рисунке.
Дальнейшее увеличение соотношения c0, Ca/c0, Na может привести к невозможности осуществления самоподдерживающегося процесса. Такой пример показан на рис. 9, где представлены зависимости для исходного раствора К1А1 (табл. 1) с равной эквивалентной концентрацией этих компонентов.
Рис. 9.
Зависимость числа колоночных объемов умягченной воды от номера цикла для раствора К1А1 с исходным содержанием компонентов (моль-экв/л): с0, Ca = 0.025, c0, Na = 0.025, c0, Cl = 0.025, ${{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}$ = 0.025, потери натрия с опресненной водой 0.015 моль-экв/л, регенерирующий раствор 1.5 M NaCl. Добавка 1.5 М раствора NaCl к раствору, возвращаемому на регенерацию в СМП-процессе (%): 1 – 100; 2 – 87.5; 3 – 75; 4 – 50; 5 – 0.
Как видно из представленных результатов, для раствора такого состава не реализуется не только СМП-процесс, но и стабильный процесс сорбции-регенерации при малых добавках раствора соли (менее 87.5%) к оборотному регенерационному раствору.
Как показано ниже, влияние остальных параметров, в том числе, исходного содержания сульфата в перерабатываемом растворе, имеет более сложный характер.
Критерий реализуемости СМП-процессов
Представляет интерес априорная оценка возможности осуществления самоподдерживающегося процесса, исходя из известных данных по составу перерабатываемой воды и значений варьируемых параметров. Очевидно, что смысл такого приближенного количественного критерия, достаточного для инженерных расчетов, должен состоять в достижении какого-то критического значения соотношения количеств ионов натрия и кальция в замкнутом цикле сорбции– регенерации.
Вывод критерия осуществимости стабилизированного СМП-процесса с повторяющимися циклами может быть сделан на основе оценок материального баланса в цикле сорбции–регенерации.
1. Поступающая в умягченный раствор масса ионов натрия в одном цикле (в моль-экв):
– из исходной воды: c0, NaVS, где VS – объем умягченной воды;
– из сорбента: ${{\bar {c}}_{{S,{\text{Na}}}}}{{\bar {V}}_{b}} = {{c}_{{0,{\text{Ca}}}}}{{V}_{S}};$ где ${{\bar {c}}_{{S,{\text{Na}}}}}$ – концентрация натрия в слое катионита перед умягчением, ${{\bar {V}}_{b}}$ – объем слоя ионита;
2. Потери натрия в одном цикле (в моль-экв):
– потери с сульфатом при нанофильтрации (все количество анионов сульфата, которое задерживается при нанофильтрации, находится в виде натриевой соли): ${{R}_{M}}{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}{{V}_{S}};$ где, например, RM = = 0.95 – коэффициент селективности НФ-мембраны;
– потери с хлоридом при нанофильтрации (концентрация хлорида (и эквивалентная ему часть концентрации натрия) примерно одинаковая в пермеате и концентрате НФ): ${{c}_{{0,{\text{Cl}}}}}{{V}_{{k,N}}},$ где Vk,N – объем концентрата нанофильтрации;
– потери ионов натрия с опресненной водой (в моль-экв):
– ${{c}_{{w,{\text{Na}}}}}{{V}_{w}},$ где ${{c}_{{w,{\text{Na}}}}}$ – концентрация натрия в опресненной воде, Vw – объем опресненной воды в цикле.
Общая масса ионов натрия (в моль-экв), которой можно пользоваться в одном цикле для десорбции кальция и регенерации катионита:
(18)
$\begin{gathered} {{M}_{{{\text{Na}}}}} = {{c}_{{0,{\text{Na}}}}}{{V}_{S}} + {{c}_{{0,{\text{Na}}}}}{{V}_{S}} - {{R}_{M}}{{c}_{{0,{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}}{{V}_{S}} - \\ - \,\,{{c}_{{0,{\text{Cl}}}}}{{V}_{{k,{\text{N}}}}} - {{c}_{{w,{\text{Na}}}}}{{V}_{w}}. \\ \end{gathered} $Общая масса ионов кальция (в моль-экв), которую необходимо десорбировать в одном цикле:
Формулу критерия удобно представить в виде:
(20)
$\begin{gathered} Rc = \frac{{{{M}_{{{\text{Na}}}}}}}{{{{M}_{{{\text{Ca}}}}}}} = \frac{{{{c}_{{0,{\text{Na}}}}}{{V}_{S}} + {{c}_{{0,{\text{Ca}}}}}{{V}_{S}} - {{R}_{M}}{{c}_{{0,{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}}{{V}_{S}} - {{c}_{{0,{\text{Cl}}}}}{{V}_{{k,N}}} - {{c}_{{w,{\text{Na}}}}}{{V}_{w}}}}{{{{c}_{{0,{\text{Ca}}}}}{{V}_{S}}}} = \\ = \,\,\frac{{{{c}_{\Sigma }} - {{R}_{M}}{{c}_{{0,{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} - {{{{c}_{{0,{\text{Cl}}}}}{{V}_{{k,N}}}} \mathord{\left/ {\vphantom {{{{c}_{{0,{\text{Cl}}}}}{{V}_{{k,N}}}} {{{V}_{S}} - {{{{c}_{{w,{\text{Na}}}}}{{V}_{w}}} \mathord{\left/ {\vphantom {{{{c}_{{w,{\text{Na}}}}}{{V}_{w}}} {{{V}_{S}}}}} \right. \kern-0em} {{{V}_{S}}}}}}} \right. \kern-0em} {{{V}_{S}} - {{{{c}_{{w,{\text{Na}}}}}{{V}_{w}}} \mathord{\left/ {\vphantom {{{{c}_{{w,{\text{Na}}}}}{{V}_{w}}} {{{V}_{S}}}}} \right. \kern-0em} {{{V}_{S}}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}, \\ \end{gathered} $Рассмотрим параметры: ${{{{V}_{{k,N}}}} \mathord{\left/ {\vphantom {{{{V}_{{k,N}}}} {{{V}_{S}}}}} \right. \kern-0em} {{{V}_{S}}}}$ и ${{{{V}_{w}}} \mathord{\left/ {\vphantom {{{{V}_{w}}} {{{V}_{S}}}}} \right. \kern-0em} {{{V}_{S}}}}.$ Первый представляет собой величину степени концентрирования при нанофильтрации (QN). Этот параметр подбирается, исходя из состава умягченного раствора, свойств НФ мембран и рациональных условий нанофильтрации. В наших расчетах он выбирался практически равным: QN = 0.192. Второй параметр QR рассчитывается в соответствии с формулой (17) и зависит от соотношения концентраций NaCl при разделении раствора на опресненную воду и регенерационный раствор:
С учетом этого можно записать:
(21)
$\begin{gathered} Rc = \\ = \,\,\frac{{{{c}_{\Sigma }}\, - {{R}_{M}}{{c}_{{0,{\text{S}}{{{\text{O}}}_{{\text{4}}}}}}} - {{Q}_{N}}{{c}_{{0,{\text{Cl}}}}}\, - (1 - {{Q}_{N}})(1 - {{Q}_{R}}){{c}_{{w,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}. \\ \end{gathered} $При использовании критерия (21) задаются исходные концентрации компонентов в перерабатываемой воде и расчет проводится для различных предполагаемых параметров: cw, Na = 0, 0.005, 0.01, 0.015, ${{c}_{{R,{\text{Na}}}}} = 1.$ В силу (16) ${{c}_{{PN,{\text{Na}}}}} \approx {{c}_{{0,{\text{Cl}}}}},$ ${{k}_{R}} = \frac{{{{c}_{{R,{\text{Na}}}}}}}{{{{c}_{{PN,{\text{Na}}}}}}} = \frac{1}{{{{c}_{{0,{\text{Cl}}}}}}}$ и ${{k}_{w}} = \frac{{{{c}_{{w,{\text{Na}}}}}}}{{{{c}_{{PN,{\text{Na}}}}}}} = \frac{{{{c}_{{w,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Cl}}}}}}},$ в соответствии с (17) имеем формулу для критерия QR:
Однако, для того, чтобы знать, при каких значениях критерия Rc реализуется самоподдерживающийся процесс, оценим его значение, используя результаты проведенных численных экспериментов, которые сведены в табл. 2 для случаев, когда такой процесс стабилен – табл. 3 и нестабилен – табл. 4.
Таблица 3.
Исходные данные и результаты численных экспериментов для стационарных СМП-процессов
| Растворы ${{C}_{\Sigma }}$ = 0.05 | Потери с водой ${{c}_{{w,{\text{Na}}}}}$ | Объемы на разных стадиях цикла в колоночных объемах (объем колонны 0.196 м3) | QR | (1 – QN) (1 –QR) | Rc | |||
|---|---|---|---|---|---|---|---|---|
| VS | ${{V}_{{k,{\text{N}}}}}$ | ${{V}_{w}}$ | ||||||
| K4A1 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 9 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 1 |
0 | 246 | 47 | 193 | 0.025 | 0.788 | 4.29 |
| 0.005 | 200 | 38 | 158 | 0.02 | 0.792 | 3.5 | ||
| 0.010 | 116 | 22 | 92 | 0.015 | 0.796 | 2.7 | ||
| 0.015 | 54 | 10 | 43 | 0.01 | 0.8 | 1.89 | ||
| K2A2 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{C}}}}}}}$ = 4 $\frac{{{{c}_{{0,{\text{C}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 4 |
0 | 130 | 25 | 101 | 0.04 | 0.775 | 3.28 |
| 0.005 | 119 | 23 | 92 | 0.035 | 0.779 | 2.89 | ||
| 0.010 | 105 | 20 | 82 | 0.03 | 0.783 | 2.50 | ||
| 0.015 | 86 | 16 | 68 | 0.025 | 0.787 | 2.10 | ||
| K2A1 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 4 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 1 |
0 | 76 | 14.6 | 60 | 0.025 | 0.788 | 2.14 |
| 0.005 | 29 | 5.6 | 23 | 0.02 | 0.796 | 1.75 | ||
| K1A2 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 1 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 4 |
0 | 24 | 4.7 | 19 | 0.025 | 0.776 | 1.31 |
| K4A2 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 9 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 4 |
0 | 287 | 55 | 222 | 0.04 | 0.776 | 6.56 |
| 0.005 | 277 | 53 | 216 | 0.035 | 0.78 | 5.78 | ||
| 0.01 | 262 | 50 | 205 | 0.03 | 0.784 | 5.0 | ||
| 0.015 | 240 | 50 | 190 | 0.025 | 0.787 | 4.2 | ||
| K4A3 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 9 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}} = \frac{1}{4}$ |
0 | 62 | 12 | 50 | 0.01 | 0.8 | 2.02 |
| 0.005 | 31 | 6 | 25 | 0.0005 | 0.804 | 1.21 | ||
Таблица 4.
Расчет значений критерия Rc по исходным составам растворов и при задаваемых параметрах QN = = 0.192 для случаев, когда не реализуются СМП-процессы
| Растворы cΣ = 0.05 | Потери | QR | (1 – QN)(1 – QR) | Rc | |
|---|---|---|---|---|---|
| K1A1 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 1 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 1 |
0 | 0.025 | 0.788 | 0.86 |
| 0.005 | 0.02 | 0.792 | 0.70 | ||
| 0.01 | 0.015 | 0.796 | 0.54 | ||
| 0.015 | 0.01 | 0.8 | 0.38 | ||
| K1A3 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 1 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}} = \frac{1}{4}$ |
0 | 0.01 | 0.8 | 0.40 |
| 0.005 | 0.0005 | 0.8 | 0.24 | ||
| 0.01 | |||||
| K2A3 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}}$ = 4 $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}} = \frac{1}{4}$ |
0 | 0.01 | 0.8 | 1.00 |
| 0.005 | 0.0005 | 0.8 | 0.60 | ||
| 0.01 | 0 | 0.81 | 0.2 | ||
| K3A1 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}} = \frac{1}{4}$ $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 1 |
0 | 0.025 | 0.788 | 0.54 |
| 0.005 | 0.02 | 0.792 | 0.44 | ||
| 0.01 | 0.015 | 0.796 | 0.34 | ||
| 0.015 | 0.01 | 0.8 | 0.24 | ||
| K3A2 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}} = \frac{1}{4}$ $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}}$ = 4 |
0 | 0.04 | 0.776 | 0.82 |
| 0.005 | 0.035 | 0.78 | 0.72 | ||
| 0.01 | 0.03 | 0.784 | 0.63 | ||
| 0.015 | 0.025 | 0.787 | 0.53 | ||
| K3A3 | $\frac{{{{c}_{{0,{\text{Na}}}}}}}{{{{c}_{{0,{\text{Ca}}}}}}} = \frac{1}{4}$ $\frac{{{{c}_{{0,{\text{Cl}}}}}}}{{{{c}_{{0,{\text{S}}{{{\text{O}}}_{4}}}}}}} = \frac{1}{4}$ |
0 | 0.01 | 0.8 | 0.25 |
| 0.005 | 0.0005 | 0.8 | 0.15 | ||
| 0.01 | 0 | 0.81 | 0.05 | ||
Минимальное значение критерия Rc = 1.21 соответствует наименьшему объему умягченной воды, получаемой в одном повторяющемся цикле СМП-процесса: VS = 31 колоночных объемов. При этом исходный раствор имеет состав, приведенный в последней строке таблицы, а опресненная вода содержит 0.005 моль-экв/л (292.5 мг/л) хлорида натрия.
В табл. 4 приведены данные для случаев, когда численные эксперименты показывают невозможность реализации самоподдерживающихся процессов. Значения параметров QN, QR и cw, Na при этом заданы такими же, как для стационарных СМП-процессов.
Как видно из представленных данных, для всех рассмотренных примеров значения критерия: Rc < 1.
Полученные результаты показывают возможность проведения приближенных инженерных расчетов для априорной оценки реализуемости самоподдерживающихся процессов умягчения- опреснения.
ЗАКЛЮЧЕНИЕ
Проведенные численные эксперименты на примере модельных растворов хлоридов и сульфатов натрия и кальция и анализ полученных результатов показывает осуществимость на практике стационарных циклических самоподдерживающихся процессов умягчения–опреснения с использованием сильнокислотного катионита, в которых регенерация катионита в каждом цикле осуществляется только за счет возвратного рассола, получаемого при опреснении умягченной воды.
Для реализации СМП-процессов переработки сульфатсодержащих растворов необходимо разделение сульфатов и хлоридов в умягченной воде, направляемой на опреснение с одновременным получением рассола для регенерации катионита. Для такого разделения можно использовать метод нанофильтрации.
Численные эксперименты показывают, что наличие сульфата в растворе резко сужает диапазон составов соленых вод и условий для осуществления СМП-процессов по сравнению с хлоридными системами, изученными ранее [4].
Численные эксперименты для исследования большого количества последовательных циклов умягчения-опреснения, трудноосуществимые обычными экспериментальными методами, позволяют увидеть распределение катионов в слое катионита и выходные кривые компонентов на любой стадии процессов. Показано, что на характеристики самоподдерживающихся процессов, а именно количество циклов до выхода на стационарный режим, а также продолжительность этих циклов на стадиях сорбции и регенерации, оказывают влияние: соотношение концентраций двух- и однозарядных ионов в исходном растворе, а также относительные потери однозарядных ионов, “уносимые” с опресненной водой.
На основе анализа результатов большого количества составов модельных растворов солоноватых вод при изменении варьируемых условий предложено критериальное соотношение для инженерных расчетов с целью априорной оценки реализуемости СМП-процессов.
Проведенный анализ показывает методологию расчетов рациональных условий организации СМП-процессов в реальных условиях переработки природных и техногенных вод. Это дает возможность заложить технологические основы для создания автономных стационарных и передвижных систем водоподготовки при использовании СМП-процесса для переработки подземных солоноватых, а также сточных вод, не требующих привозных реагентов и, соответственно, вспомогательных устройств для хранения реагентов и приготовления регенерационных растворов.
ОБОЗНАЧЕНИЯ
| А, В | компоненты раствора, участвующие в ионном обмене |
| BV | колоночный объем (в наших примерах 0.196 м3) |
| c | концентрация в растворе (моль-экв/л) |
| $\bar {с}$ | концентрации в фазе ионита на объем слоя (моль-экв/л) |
| ${{\hat {с}}_{i}}$ | средняя концентрация i-ого компонента в сечении слоя катионита (моль-экв/л) (с учетом жидкой и твердой фазы) |
| D | коэффициент диффузии (см2/с) |
| K | концентрационная константа (коэффициент) равновесия ионного обмена |
| kR, kW | степень концентрирования при разделении на регенерационный раствор и опресненную воду |
| L | высота слоя катионита (см) |
| N | номер сорбционного цикла |
| QN, QR | объемные критерии концентрирования при фильтрации и опреснении |
| ${{R}_{{N,i}}}{{R}_{{M,i}}}$ | селективность наномембраны по концентрациям и по массе |
| Rc | критерий реализуемости СМП-процесса |
| S | площадь сечения слоя катионита, (м2) |
| t | время, мин (с, ч) |
| V | объемы на разных стадиях цикла (л) |
| $v$ | линейная скорость, (см/мин) |
| X | координата точки концентрационного фронта вдоль слоя катионита |
| x | координата по высоте колонны, отсчитываемая от точки входа раствора |
| W | объемная скорость раствора (м3/ч) |
| z | заряд иона |
| ε | порозность (доля межзернового пространства в слое катионита) |
ИНДЕКСЫ
Список литературы
Klein G., Vermeulen T. Cyclic performance of layered beds for binary ion exchange// AIChESymp. Ser. 1975. V. 71. № 152. P. 69.
Barba D., Brandani V., Foscolo P.U. A method based on equilibrium theory for a current choice of cationic resin in sea water softening // Desalination. 1983. V. 48. № 2. P. 133.
Tokmachev M.G., Tikhonov N.A., Khamizov R.Kh. Investigation of cyclic self-sustaining ion exchange process for softening water solutions on the basis of mathematical modeling // React. Funct. Polym. 2008. V. 68. P. 1245.
Хамизов Р.Х., Комарова И.В., Галкина Н.К., Прудковский А.Г. Самоподдерживающиеся процессы умягчения-опреснения воды. Простые двухкомпонентные системы // Теор. основы хим. технологии. 2020. Т. 54. № 5. С. 649.
MuravievD.N., Khamizov R.Kh., Tikhonov N.A., Morales J.G. Clean (“Green”) IonExchangeTechnologies. IV. High-Ca-selectivityion-exchange material for self-sustaining decalcification of mineralized waters process // Ind. Eng. Chem. Res. 2004. V. 43. № 8. P. 1868.
US Patent Appl.Publ. 2011/0278225.Method for purifying water by cyclic ionic exchange // Boodo F., Publ. Nov. 17, 2011.
Flodman H.R., Dvorak B.I. Brine reuse in ion-exchange softening: salt discharge, hardness leakage, and capacity tradeoffs // Water Environm.Res. 2012. V. 84. № 6. P. 535.
Патент РФ 2 686 147 Способ переработки природных солоноватых вод на ионитах с получением растворов сложных минеральных удобрений и установка для его осуществления (варианты) // Хамизов Р.Х., Хамизов С.Х. – опубл. 24.04.2019, Бюлл. № 12.
Tang S., Brinchak L, Cohen Y., Lahav O. Selective separation of divalent ions from seawater using an integrated ion-exchange/nanofiltration approach // Chem. Eng.Proc.-Proc.Inetens. 2018. V. 126. P. 8.
Brinchak L., Keller O., Tang S., Fridman-Bishop N., Lahav O. A membrane-based recycling process for minimizing environmental effects inflicted by ion-exchange softening applications // Sep. Purific. Technol. 2019. V. 223. P. 23.
Safonyk A., Prysiazhniuk I., Prysiazhniuk O., Naumchuk O. Mathematical modeling singularly perturbed processes of water softening on sodium-cationite filters // IAPGOS. 2019. № 1. P. 37.
Комарова И.В., Галкина Н.К., Прудковский А.Г. Вычислительный эксперимент как способ оценки эффективности работы водоподготовительных установок при поточной и противоточной регенерации ионообменных фильтров // Сорбц. Хроматограф. Процессы. 2018. Т. 18. № 5. С. 776.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989. С. 448.
Комарова И.В., Галкина Н.К., Прудковский А.Г., Хамизов Р.Х. Математическое моделирование и расчет процесса деминерализации воды в промышленном фильтре Сообщение 1. Гидродинамика регенерации и отмывки промышленного фильтра // Сорбционные и хроматографические процессы. 2017. Т. 17. № 1. С. 10.
Amir Abbas Izadpanah, Asghar Javidnia. The Abilityofa Nanofiltration Membraneto Remove Hardnessand Ionsfrom Diluted Seawater // Water. 2012. V. 4. P. 283.
Bargeman G., Steensma M., ten Kate A., Westerink J.B., Demmer R.L.M., Bakkenes H., Manuhutu C.F.H. Nanofiltration as energy-efficient solution for sulfate waste in vacuum salt production // Desalination. 2009. V. 245. P. 460.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


