Теоретические основы химической технологии, 2022, T. 56, № 4, стр. 418-433
Вопросы разработки эффективной биотехнологии синтеза ценных компонентов из биомассы микроводорослей
Д. С. Дворецкий a, *, М. С. Темнов a, И. В. Маркин a, Я. В. Устинская a, М. А. Еськова a
a ФГБОУ ВО “Тамбовский государственный технический университет”
Тамбов, Россия
* E-mail: dvoretsky@yahoo.com
Поступила в редакцию 07.06.2021
После доработки 02.07.2021
Принята к публикации 30.07.2021
- EDN: CHHSOQ
- DOI: 10.31857/S0040357122040029
Аннотация
В последние десятилетия активно проводится поиск альтернативных источников возобновляемого сырья для производства ценных для человека компонентов. Отличаясь гибким метаболизмом, микроводоросли обладают большим потенциалом для организации различных производств полезных веществ для областей применения: фармацевтики, производств пищевых добавок, кормовых добавок для животных и рыб, материалов и биоудобрений, биотоплива. Несмотря на большое число научных публикаций, отражающих особенности реализации отдельных стадий технологий получения полезных веществ из микроводорослей, актуальной задачей является системный анализ тенденций развития этого сектора биоэкономики. В обзоре представлен анализ ключевых стадий получения полезных веществ из микроводорослей, особенности их реализации. Обсуждаются вопросы повышения эффективности таких производств с использованием средств компьютерного моделирования.
ВВЕДЕНИЕ
Принцип рационального и устойчивого развития человечества, сформулированный Всемирной комиссией по окружающей среде и развитию в 1987 г., постулировал необходимость стремления к удовлетворению потребностей нынешнего поколения без ущерба для возможности будущих поколений удовлетворять свои собственные потребности [1]. Этому принципу в полной мере соответствует активно строящаяся в развитых странах экономика замкнутого цикла, призванная изменить классическую линейную модель производства (создание, пользование, захоронение отходов), концентрируясь на создании технологий и производств, которые минимизируют отходы и другие виды загрязнений. Одним из активно развивающихся в последние десятилетия направлением, потенциально соответствующим требованиям экономики замкнутого цикла, является разработка технологий получения и использования микроводорослей для решения широкого круга задач хозяйственной деятельности человека.
Микроводоросли – микроскопические водные организмы, трансформирующие световую энергию, воду и диоксид углерода в биохимическую энергию, необходимую для их роста через фотосинтез и хемосинтез [2]. Клетки микроводорослей способны накапливать значительное количество белка, углеводы, полярные и нейтральные липиды с богатым набором жирных кислот (ЖК), включая незаменимые ω-3 полиненасыщенные ЖК [3]. Эти организмы также способны синтезировать пигменты разных классов (каротиноиды, хлорофилл), витамины, стерины, антибиотики и токсины.
При этом они имеют более высокую эффективность фотосинтеза по сравнению с высшими растениями и гибкий метаболизм [4, 5]. Поэтому в последнее десятилетие резко возрос интерес ученых к исследованию возможностей использования микроводорослей для надежного и прогнозируемого получения различных пищевых красителей, пищевых и кормовых добавок, компонентов для косметических продуктов, фармацевтических препаратов, биотоплива (биодизель, биоэтанол, биометан, авиатопливо [6], водород [7], синтез-газ [8]), биопластика, биосмазок, биоудобрений, а также их использования для очистки сточных вод и регенерации воздуха [9]. Учитывая, что в чистом виде исследователям доступно около 4600 видов микроводорослей, а промышленно культивируется лишь несколько десятков штаммов, биотехнологический потенциал микроводорослей остается еще в значительной степени не исследованным [10]. Этот интерес подтверждается количеством публикаций в ведущих рецензируемых научных журналах. Так, при запросе о поиске статей с ключевым словом “микроводоросли” в библиографической базе данных Scopus [11] за период с 2010 по 2021 год выдается ссылка более чем на 27000 статей, при этом число публикаций за год выросло с 665 до 3939. Несмотря на большое число работ, посвященных вопросам поиска эффективных способов организации процессов получения ценных компонентов из микроводорослей, потенциал для их совершенствования остается значительным.
Большинство технологий получения ценных компонентов из микроводорослей включают следующие стадии: культивирование и концентрирование биомассы, разрушение клеточных стенок, извлечение (экстракция/экстрагирование) целевых компонентов. При поиске оптимальных путей организации этих стадий важно учитывать биологические особенности микроводорослей: характеристики органелл клетки конкретного штамма, интенсивность биохимических реакций и динамику их изменения при различных сочетаниях компонентов питательной среды и условий культивирования, тип ответной реакции на различные стрессовые воздействия и способность адаптации к ним, устойчивость к вредному влиянию посторонних микроорганизмов. Хорошее понимание взаимосвязанности перечисленных особенностей имеет определяющее влияние на успешность поиска условий реализации последовательности технологических стадий и их масштабирование. Их количественный анализ целесообразно выполнять с использованием компьютерного моделирования, которое является мощным системным инструментом, повышающим эффективность процесса разработки технологических цепочек производства ценных компонентов из микроводорослей, область использования которого непрерывно расширяется [12]. Его корректное использование позволит более полно исследовать и использовать потенциал микроводорослей, сократить время разработки и оценки экономической эффективности новых технологий, а также будет способствовать их более широкому распространению.
Цель данной обзорной статьи заключается в анализе особенностей, тенденций развития и обзоре современных подходов к реализации процессов основных стадий получения ценных продуктов из биомассы микроводорослей.
ПРОДУКТЫ ИЗ МИКРОВОДОРОСЛЕЙ
Микроводоросли обладают большим потенциалом для организации производств полезных веществ для различных областей применения: фармацевтики, производств пищевых добавок, кормовых добавок для животных и рыб, материалов и биоудобрений, биотоплива. Для этого используют различные виды микроводорослей (табл. 1), исследованию которых посвящено наибольшее количество работ.
Таблица 1.
Области применения микроводорослей.
| Вид микроводо-рослей | Фармацевтика | Косметика | Пища | Материалы | Корм | Удобрения | Биотопливо | Источники |
|---|---|---|---|---|---|---|---|---|
| Nannochloropsis | + | – | – | – | + | + | – | [13, 14] |
| Chlorella | + | + | + | + | + | + | + | [15] |
| Dunaliella | + | – | – | – | + | – | – | [16] |
| Isochrysis | + | – | – | – | + | – | – | [17, 18] |
| Phaeodactylum | + | – | – | – | – | – | – | [19] |
| Haematococcus | + | – | – | – | + | – | – | [20] |
| Crypthecodinium | + | – | – | – | – | – | – | [21] |
| Scenedesmus | + | – | – | + | – | + | – | [13, 14, 22] |
| Muriellopsis | + | – | – | – | – | – | – | [15] |
| Neochloris | – | – | – | + | – | – | – | [23] |
| Spirulina | + | + | + | + | + | + | – | [24–27] |
| Cyanothece | – | + | – | – | – | – | – | [26] |
| Schizochytrium | – | – | – | – | + | – | – | [14] |
| Chlamydomonas | – | – | – | – | + | – | – | [25] |
| Pavlova | – | – | + | – | – | – | – | [28] |
| Tetraselmis | – | – | + | – | – | – | – | [3] |
| Stichococcus | – | – | + | – | – | – | – | [3] |
Клетки микроводорослей содержат белки, витамины группы B, липиды, полисахариды, пигменты (табл. 2). Белки микроводорослей содержат все незаменимые аминокислоты. Как источник белка и витаминов микроводоросли используются в производстве пищевых добавок, кормах, а также в качестве удобрений и стимуляторов роста растений [29, 30].
Таблица 2.
Содержание ценных компонентов в биомассе микроводорослей.
| Вид продуктов | Вид микроводорослей | Концентрация | Источники |
|---|---|---|---|
| Фармацевтические продукты | % от сухой биомассы | ||
| Эйкозопентаеновая кислота (ЭПК) | Nannochloropsis | 12.74 ± 1.84 | [31] |
| Isochrysis | 12.74 ± 1.84 | [31] | |
| Phaeodactylum | от 22.4 ± 1.7 до 31.4 ± 1.7 | [32] | |
| Докозагексаеновая кислота (ДГК) | Thraustrochytrium | 48.3–58.2 | [33] |
| Crypthecodinium | до 43.5 | [34] | |
| Бета-каротин | Chlorella | 0.1–2 | [35] |
| Chlamydomonas | 0.1–2 | [36] | |
| Dunaliella | до 14 | [37] | |
| Астаксантин | Haematococcus | 3.8 | [29] |
| Chlorococcum | 0.2 | [26, 30] | |
| Neochloris | 0.6 | [26, 30] | |
| Косметические продукты | г/л культуральной среды | – | |
| Полисахариды | Chlorella | 1.8 г/л | [26] |
| Cyanothece sp. | до 22.3 г/л | [26] | |
| Botryococcus | до 1.8 г/л | [26] | |
| Пищевые добавки | % от сухой биомассы | ||
| Белки | Chlorella | 51–58 | [38] |
| Spirulina | 60–71 | [38] | |
| Фикобилипротеины | Spirulina | до 20 | [27, 28] |
| Витамины | мг / кг сухого веса | ||
| Рибофлавин (B2) | Pavlova | до 50 | [29] |
| Пантотеновая кислота (B5) | Tetraselmis | 37.7 | [29] |
| Пиридоксин (B6) | Stichococcus | 17 | [29] |
| Кобаламин (В12) | Chlorella | 0.6 | [30] |
| Dunaliella | 0.7 | [30] | |
Липиды, содержащие омега-3 полиненасыщенные жирные кислоты, применяются в качестве нутрицевтиков и являются одним из основных ингредиентов в рационе питания человека [3]. Жирные кислоты используются для производства биодизеля [19, 38], а также при производстве альтернативного реактивного топлива из биомассы водорослей [3].
Полисахариды микроводорослей находят применение в качестве косметических средств для ухода за кожей (экзополисахариды), для производства биоэтанола (внутриклеточный крахмал) [23].
Каротиноиды (β-каротин, астаксантин, лютеин) используются в качестве нутрицевтиков, в составе косметических средств, для обогащения кормов для животных [39].
При производстве биометана из микроводорослей сбраживаются практически все макромолекулы, входящие в состав клетки (белки, липиды и углеводы) [26]. Природные полимеры (углеводы, белки), а также небольшие молекулы (дисахариды, жирные кислоты) микроводорослей являются исходным сырьем для производства биопластиков [22]. Клетки микроводорослей могут синтезировать водород в процессе биологического расщепления воды. Высокотемпературная газификация биомассы микроводорослей проводится для получения синтез-газа [19].
ТЕХНОЛОГИИ МИКРОВОДОРОСЛЕЙ
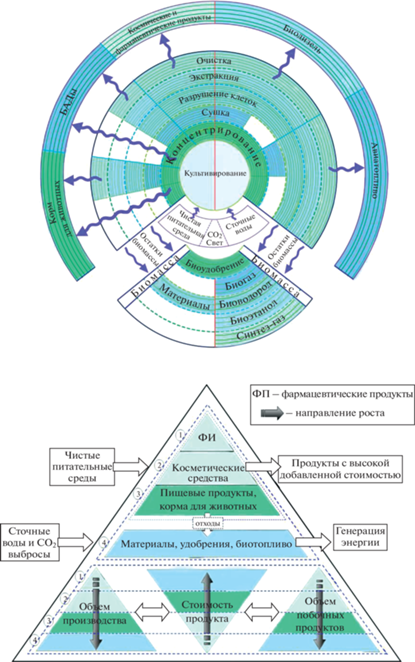
Для достижения экономической эффективности, процессы промышленного производства продуктов из биомассы микроводорослей должны быть устойчивыми, гибкими, иметь низкие энергетические затраты и быть легко адаптируемыми к большому разнообразию исходных характеристик клеток микроводорослей. Перспективной целью является интеграция всех цепочек различных технологий биопереработки в непрерывную структуру (рис. 1), направленную на производство спектра продуктов, позволяющей извлечь максимальную прибыль от реализации всех ценных компонентов, находящихся в биомассе.
На настоящем этапе развития отрасли большинство предприятий по биопереработке водорослей, как правило, сосредоточены на получении одного конкретного компонента из биомассы [40]. Вследствие этого, разрабатываются технологии, оптимизированные для получения максимальной прибыли от реализации лишь этого вещества. При этом в базовой постановке задачи по разработке технологий целесообразно рассматривать вопрос о выращивании биомассы с таким соотношением целевых компонентов, которые можно эффективно извлечь современными методами в порядке убывания их стоимости. Интеграция нескольких смежных технологий в одном биокластере позволила бы более полно перерабатывать вторичные потоки производств продуктов с высокой добавленной стоимостью в технологиях нижних уровней, а также более эффективно использовать периодически работающее оборудование и снизить капитальные и энергетические затраты. При этом в зависимости от поставленных целей для культивирования можно использовать как чистые питательные среды (для компактных производств продуктов с высокой добавленной стоимостью – блоки 1, 2, 3), так и различного вида отходы (для крупнотоннажных производств биотоплив, биоудобрений и пр. – блок 4). Стоимость продуктов из микроводорослей в большой степени будет зависеть от химического состава, количества нежелательных примесей и вида конечного продукта (суспензия, паста, порошок, гранулы) [41].
При разработке технологии производства ценных веществ из микроводорослей, позволяющей обеспечить достижение максимальной прибыли, необходимо учитывать особенности конкретного штамма: строение клеточной стенки, характеристики органелл, интенсивность биохимических реакций и динамику их изменения при различных сочетаниях компонентов питательной среды и условий культивирования, тип ответной реакции на различные стрессовые воздействия и способность адаптации к ним, устойчивость к вредному влиянию посторонних микроорганизмов. Только учитывая эти особенности, можно обоснованно выбрать наилучшие способы реализации ключевых стадий: культивирование и концентрирование биомассы, разрушение клеточных стенок, извлечение (экстракция/экстрагирование) целевых компонентов.
КЛЕТКА МИКРОВОДОРОСЛИ, КАК ОБЪЕКТ УПРАВЛЕНИЯ
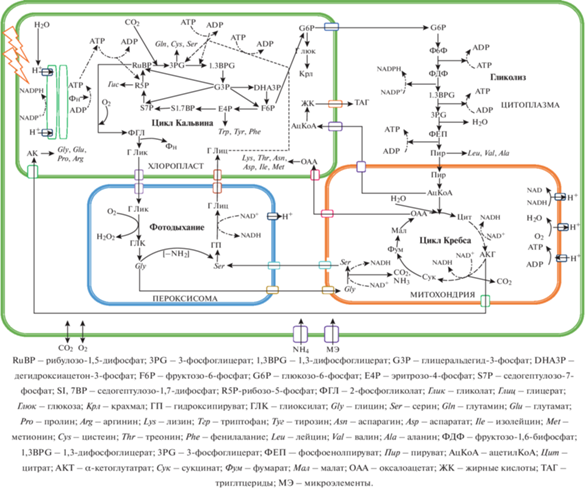
Одноклеточные микроводоросли можно сравнить с микрофабриками, производящими в разные периоды своей жизни с разной степенью интенсивности многие ценные компоненты. Для этого необходимо обеспечить доступ к клетке всех элементов питательной среды, света и отвод продуктов метаболизма. При этом важно найти компромисс между возможностями клеток синтезировать полезные для человека вещества и их потребностями при разных условиях. Для жизнедеятельности клеток микроводорослей необходимо устойчивое протекание взаимосвязанных метаболических процессов (рис. 2).
Их интенсивность зависит от комбинации различных условий роста клеток: температуры, интенсивности и длины световых волн, состава и количества питательных веществ.
Температура рассматривается как один из критических факторов для роста микроорганизмов и биохимического состава клетки. При повышенных и пониженных относительно оптимальной температурах наблюдается снижение физиологической активности за счет изменения вязкости цитоплазмы, текучести и проницаемости мембран, ферментативной активности, ингибирования процессов репликации, транскрипции и трансляции [42].
Свет является решающим фактором для роста клеток и накопления метаболитов в микроводорослях. В условиях высокой освещенности основную массу клеток составляют липиды и углеводы [42, 43]. Содержание каротиноидов так же значительно повышается в условиях высокой освещенности при одновременном понижении температуры [5].
Углерод является основным элементом большинства метаболитов микроводорослей. При автотрофном культивировании источником углерода является CO2. При высокой концентрации CO2 увеличивается содержание липидов за счет уменьшения содержания белков и углеводов [44].
Азот в основном потребляется микроводорослями в виде катионов аммония или нитрат-анионов. Накопление белков увеличивается при достаточном содержании азота, в то время как содержание углеводов, липидов, каротиноидов увеличивается при истощении питательной среды азотом.
В качестве источника фосфора микроводоросли способны потреблять ионы ортофосфатов. При его недостатке наблюдаются замедление ассимиляции других компонентов питательной среды.
Сера потребляется микроводорослями в виде сульфатов. При недостаточном количестве данного элемента уменьшается содержание внутриклеточного белка, витаминов (тиамин и биотин).
Качественный и количественный состав потенциально-ценных продуктов (углеводов, белков, липидов и пигментов) зависит от особенностей генома, способа культивирования микроводорослей, а также фазы роста клеток.
Выделяют три способа культивирования микроводорослей: автотрофный (в качестве источника углерода используется CO2), гетеротрофный (с добавлением источников органического углерода), миксотрофный (в дополнение к барботированию CO2 в среду добавляют источник органического углерода) [9]. При автотрофном культивировании биосинтез углеводов инициируется фиксацией СО2 через цикл Кальвина рибулозо-1,5-бисфосфаткарбоксилазой оксигеназой (Рубиско). Первый продукт фотосинтеза глицеральдегид-3-фосфат (G3P) впоследствии превращается в моносахариды (глюкоза), которые затем превращаются в полисахариды (целлюлоза и крахмал) [45]. При гетеротрофном и миксотрофном культивировании путь образования G3P зависит от источника органического углерода. При использовании в качестве сырья глюкозы, G3P образуется в процессе гликолиза.
Аминокислоты, основной компонент белков, синтезируются из пяти промежуточных продуктов гликолиза и цикла лимонной кислоты. G3P действует как исходный субстрат для 20 аминокислот, синтезируемых в цитоплазме, хлоропластах, митохондриях и пероксисомах. Впоследствии 3-фосфоглицериновая кислота превращается в серин, цистеин и глицин, фосфоенолпируват – в фенилаланин, триптофан и тирозин, пируват – аланин, валин и лейцин, оксалоацетат – в аспартат, аспарагин, лизин, метионин, треонин и изолейцин, α-кетоглутарат – в глутамат, глутамин, гистидин, пролин и аргинин. Белки синтезируются на рибосомах и составляют 42–58% сухой биомассы клетки, из которых около 20% входят в состав клеточной стенки, 50% – ферменты, а оставшиеся 30% секретируются во внеклеточную среду [46].
Первой стадией биосинтеза липидов является синтез жирных кислот из ацетил-КоА, полученного из пирувата (продукт G3P). Позже свободные жирные кислоты превращаются в триацилглицерин в эндоплазматическом ретикулуме или хлоропластах [43]. Биосинтез каротиноидов инициируется изопентенилпирофосфатом (ИПП) и его изомером диметилаллилдифосфатом [47].
Жирные кислоты, полисахариды, белковые соединения и каротиноиды, выделяемые микроводорослями в процессе культивирования, обладают антибиотическим действием [48, 49].
КОНЦЕНТРИРОВАНИЕ КЛЕТОК БИОМАССЫ МИКРОВОДОРОСЛЕЙ
Суспензия микроводорослей, полученная в результате культивирования, содержит 0.05–0.5% (0.5–2 г/л) сухого вещества. Для повышения эффективности последующих стадий, проводится ее концентрирование до пасты с содержанием сухих веществ 15–35% [50]. При отделении биомассы необходимо учитывать маленький размер клеток (1–20 мкм), форму, строение клеточных стенок, а также свойства поверхности клеток (заряд, гидрофобность) [51]. Эти параметры будут сильно зависеть от условий культивирования и влиять на подбор оптимального способа концентрирования [52].
Методы концентрирования суспензии клеток микроводорослей можно разделить на следующие группы: 1) флокуляция (солями металлов, полимерами, био- и автофлокуляция, электрокоагуляция); 2) гравитационные технологии (гравитационное осаждение, центрифугирование, флотация); 3) технологии на основе фильтрования (грохочение, мембранное фильтрование) [30].
Принцип флокуляции основан на нейтрализации поверхностного заряда клеток и их объединение в более крупные частицы – флокулы под действием сил Ван-дер-Ваальса. Для нейтрализации поверхностного заряда клеток микроводорослей применяются: электрокоагуляция, соли цинка, алюминия и железа, полимерные флокулянты, биофлокулянты, изменение уровня рН культуральной жидкости [53, 54]. Метод перспективен как для самостоятельного применения, так и в сочетании с другими методами, в крупнотоннажных технологиях производствах биотоплива, удобрений. К недостатку метода относится загрязнение биомассы флокулянтами.
Отстаивание – метод концентрирования биомассы, основанный на осаждении клеток под действием собственной силы тяжести. Концентрирование биомассы этим методом перспективный вариант, поскольку он не требует затрат большого количества энергии. Однако, осаждение под действием силы тяжести – относительно медленный процесс (скорость осаждения (10–20 мм/сут)), и требует контроля, меняющегося во времени содержания веществ в биомассе. Седиментация клеток под действием силы тяжести может быть использована в технологиях получения пищевых добавок, кормов для сельскохозяйственных животных, биотоплива, удобрений [51]
Центрифугирование – самый распространенный метод концентрирования биомассы микроводорослей. Осаждение клеток происходит под действием центробежных сил [51]. Центрифугирование позволяет получить продукт с высоким содержанием сухого вещества (до 50%). Ключевым достоинством метода концентрирования клеток является высокая эффективность (осаждение до 99% биомассы из суспензии) при факторе разделения 1000–1500 в течение 5–7 мин и чистота получаемой биомассы [53]. Недостатком центрифугирования является высокое потребление энергии, что сказывается на себестоимости целевого продукта.
Фильтрование относится к механическому процессу отделения клеток от культуральной жидкости путем установки сеток, фильтровальной ткани и проницаемых мембран, удерживающих твердые частицы. Основной движущей силой процесса является перепад давления через барьер, создаваемый за счет вакуума, давления или силы тяжести [55].
При концентрировании с использованием мембран разделяют макрофильтрацию (размер пор >10 мкм), микрофильтрацию (0.1–10 мкм) и ультрафильтрацию (0.001–0.10 мкм). Макрофильтрация подходит для крупных клеток микроводорослей или флокулированной биомассы водорослей [55]. Для концентрирования микроводорослей чаще используются микро- и ультрафильтрация. Этот метод концентрирования перспективен в технологиях производства чистых продуктов с высокой добавленной стоимостью.
Выбор метода концентрирования клеток или их комбинации будет зависеть от того, в каком производстве используется биомасса в качестве сырья (требования к целевому продукту, производительность). Разработка дешевого и эффективного метода концентрирования клеток микроводорослей для крупномасштабных биотехнологических производств позволит значительно повысить экономическую привлекательность использования микроводорослей для производства полезных для человека продуктов (табл. 3).
Таблица 3.
Области применения методов концентрирования микроводорослей.
| Метод концентрирования | Биотопливо | Удобрения | Пищевые добавки | Корм | Фармацев-тика | Источники |
|---|---|---|---|---|---|---|
| Электрокоагуляция | + | + | – | + | – | [30, 51, 53] |
| Флокуляция с использованием солей металлов | + | + | – | + | – | |
| Автофлокуляция | + | + | – | + | – | |
| Флокуляция с использованием полимерных флокулянтов | + | + | – | + | – | |
| Биофлокуляция | + | + | – | + | – | |
| Осаждение под действием силы тяжести | + | + | + | + | – | [30, 51] |
| Флотация | – | – | + | + | + | [12, 51, 56] |
| Центрифугирование | + | + | + | + | – | [30, 51, 53] |
| Фильтрование | – | – | + | – | + | [30, 55] |
ИЗВЛЕЧЕНИЕ ЦЕННЫХ ВЕЩЕСТВ ИЗ БИОМАССЫ МИКРОВОДОРОСЛЕЙ
Следующей за концентрированием биомассы энергозатратной стадией является экстракция/экстрагирование ценных компонентов из клеток микроводорослей. На ее долю приходится до 40–60% от общей себестоимости конечного продукта [57].
Способы дезинтеграции и экстракции биомолекул из клеток микроводорослей. Микроводоросли подразделяются на виды без клеточной стенки, виды с целлюлозосодержащими клеточными стенками и виды с многослойными клеточными стенками (табл. 4).
Таблица 4.
Особенности строения клеточных стенок
| № | Микроводоросли | Размер, нм | Строение оболочек | Ссылка |
|---|---|---|---|---|
| 1 | Dunaliella | – | Отсутствует жесткая клеточная стенка, клетка окружена тонкой плазматической мембраной, состоящей из гликокаликсоподобного покрытия | [23] |
| 2 | Haematococcus | 30–35 | Алгаенан – фибриллярный слой (манноза и целлюлоза) – третичный слой (манноза-целлюлоза) – цитоплазматическая мембрана | [58] |
| 3 | Chlorella | 20–40 | Алгаенан – фибриллярный слой (манноза и хитиноподобный полисахарид) – цитоплазматическая мембрана | [54] |
| 4 | Chlamydomonas | 80 | Микрофибриллярный слой без целлюлозы польностью состоящий из гликопротеинов, которые связаны со смесью гетероолигосахаридов, состоящей из арабинозы и галактозы | [59] |
| 5 | Scenedesmus | 40 | Пектиновый слой – алгаенан – фибриллярный слой - цитоплазматическая мембрана | [54] |
| 6 | Spirulina | 60 | Внешняя мембрана – фибриллярный слой – пептидогликановый слой – фибриллярный слой – цитоплазматическая мембрана | [54] |
| 7 | Nannochloropsis | 20–50 | Аморфный слизистый слой – алгаенан – целлюлозный слой – спорополленин– цитоплазматическая мембрана | [54] |
Для повышения эффективности экстракции/ экстрагирования эндометаболитов из клеток микроводорослей необходимо повысить степень гомогенности среды тем самым увеличив поверхность взаимодействия “растворитель – целевое вещество”, что достигается путем разрушения оболочек клеток и органелл. Наиболее часто для этого используют физические, химические и биохимические методы.
Физические методы. Паста микроводорослей, содержащая после концентрирования 15–35% сухих веществ, может быть высушена до содержания сухих веществ 80–85% в естественных условиях, либо с применением распылительной или лиофильной сушки [60]. Обезвоживание биомассы приводит к появлению трещин в клеточной стенке или полному ее разрыву, что облегчает дальнейшее извлечение целевых внутриклеточных продуктов, однако получение сухой биомассы требует значительных энергозатрат (до 85% от общего потребления энергии) [61]. Аналогичный эффект может быть достигнут путем организации процедуры замораживания/оттаивания клеток биомассы, которая приводит к образованию внутриклеточных кристалликов льда и разрыву клетки изнутри [62]. К преимуществам данного подхода можно отнести возможность извлечения термолабильных компонентов. Недостатком метода является высокое энергопотребление. Этот метод используется для разрушения клеток без клеточной стенки (Dunaliella) или при наличии фибриллярной (целлюлозной) клеточной стенки (Chlamydomonas, Chlorella, и Spirulina) для избирательного извлечения целевых биомолекул.
Методы в основе которых лежит явление гидродинамической кавитации (высокоскоростная гомогенизация, гомогенизация под высоким давлением, ультразвуковая обработка) считаются высокоэффективными, легко масштабируемыми (кроме метода высокоскоростной гомогенизации). Эти методы применимы в технологиях производства биотоплива, удобрений, а также при целевом извлечении чистых веществ для получения косметических средств, пищевых добавок и фармацевтических препаратов.
Методы в основе которых лежит процесс трения (СВЧ-обработка, гомогенизация с применением мелющих тел). При СВЧ-обработке начинается вращение полярных молекул под действием переменного электромагнитного поля. В результате взаимного трения полярных молекул возникают локальные перегревы, в клетках образуется водяной пар, разрывающий клетки. Преимуществами метода можно считать короткое время обработки суспензий, возможность масштабируемости технологии, высокая эффективность дезинтеграции, невысокий уровень потребления энергии [63]. При гомогенизации с применением мелющих тел дезинтеграция клеточных стенок осуществляется между шариками из стекла, керамики или стали при их перемешивании [64]. Такой способ дезинтеграции клеток считается высокоэффективным, но энергоемким и его трудно масштабировать [65]. Этот метод подходит для дезинтеграции высококонцентрированных суспензий, которые легко разделяются или фракционируются после разрушения [66] и наиболее часто используется для разрушения клеток с прочными клеточными стенками, например Nannochloropsis и Chlorella.
Дезинтеграция импульсным электрическим полем подразумевает воздействие на суспензии клетки микроводорослей электрических импульсов высокого напряжения в течение коротких периодов (микросекунд), что вызывает электропорацию фосфолипидного бислоя. Этот метод легко масштабируется и может быть использован в комбинации с другими, его недостатком считается необходимость деионизации растворов [62]. Импульсное электрическое поле может быть применимо в качестве метода дезинтеграции при производстве биотоплива, удобрений, косметических средств, пищевых добавок и фармацевтических препаратов.
Химические методы. Для дезинтеграции клеток микроводорослей могут быть применимы следующие вещества: растворители, кислоты, щелочи, ацетон, метанол или диметилсульфоксид, смесь оксида железа (II, III) и пероксида водорода, хлорид натрия [67]. Большинство из этих соединений разрушают связи между мономерами клеточных стенок, вызывают денатурацию белков фосфолипидных мембран. К преимуществам этого метода можно отнести низкие затраты энергии и хорошую масштабируемость процесса [68]. Недостатком является потенциальная угроза деградации целевых компонентов [68]. Химические методы дезинтеграции перспективны при промышленном получении биотоплива (биоэтанола, биобутанола, биодизельного топлива), основ питательных сред, удобрений.
Биохимические методы. При создании биотехнологических производств, предполагающих одновременное получение нескольких ценных продуктов необходимо целенаправленное разрушение клеточных стенок с минимальным воздействием на другие компоненты клеток. Данный подход может быть реализован с применением альгицидных микроорганизмов (цианобактерий, бактерий, вирусов и микроводорослей, которые разрушают клеточные стенки промышленных штаммов микроводорослей) или ферментативного гидролиза (протеазы, карбогидразы, липазы/фосфолипазы) [69]. Преимуществами биохимических методов является высокая селективность процесса, мягкие условия проведения процесса (комнатная температура, нейтральный уровень pH) [70]. К недостаткам можно отнести необходимость тщательного отбора микроорганизмов (альгицидный лизис), высокая стоимость коммерческих ферментов, необходимость удаления или инактивации ферментов после дезинтеграции клеток микроводорослей [63]. Одна из главных проблем при поиске оптимальных способов подготовки биомассы для извлечения целевых компонентов заключается в выборе последовательности комбинаций известных методов (табл. 5), обеспечивающих минимальную деградацию ценных веществ при оптимальных затратах энергии и времени.
Таблица 5.
Области применения методов дезинтеграции клеток микроводорослей
| Биотопливо | Удобрения | Пищевые добавки | Корм | Фармацевтика | Косметика | Источники | |
|---|---|---|---|---|---|---|---|
| Высокоскоростная гомогенизация, гомогенизация под высоким давлением, ультразвуковая обработка | + | + | + | + | + | – | [63, 64] |
| СВЧ-обработка, гомогенизация с применением мелющих тел | – | – | + | – | + | + | [63] |
| Дезинтеграция импульсным электрическим полем | + | + | + | – | + | + | [63] |
| Ферментные препараты (карбогидразы, протеазы, липазы/фосфолипазы) |
– | – | + | – | + | + | [67, 68] |
| Химические вещества (растворители различного типа, кислоты, щелочи, ацетон, метанол или ДМСО (диметилсульфоксид), смесь оксида железа (II, III) и пероксида водорода, хлорид натрия (осмотический шок) |
+ | – | – | – | – | – | [67, 68] |
Экстракция метаболитов из клеток микроводорослей. В результате процесса разрушения клеток образуется гетерогенная система, состоящая из полярных и неполярных веществ, находящихся в твердой и жидкой фазах. При полном разрушении клеток и органелл целевые продукты окажутся в смеси межклеточной воды и растворителей. В этом случае эффективность экстракции будет зависеть от характеристик растворителей и условий реализации процесса.
Часть клеток после стадии дезинтеграции останутся живыми (5–20%), либо погибнут, но сохранят свою форму и клеточную оболочку (до 80%) [71]. В этом случае процесс экстракции будет дополнительно лимитироваться скоростью диффузии растворителей внутрь клетки и растворенных веществ наружу.
Как правило, температура экстракции будет варьироваться от 30 до 70°С в зависимости от химических свойств используемых растворителей и целевых биомолекул, большинство из которых являются термолабильными. Для экстракции белков, витаминов группы А, В, С, РР и др., ростовых факторов, углеводов, липидов используются следующие полярные и неполярные растворители – вода, спирты (изопропанол, этанол или метанол и др.), ацетон, уксусная кислота, диметилсульфоксид, ионные жидкости, углеводороды, такие как гексан или более эффективные, но токсичные растворители, такие как хлороформ [72]. Альтернативой химическим растворителям являются “зеленые” экстрагенты: терпены, CO2 в до- и сверхкритическом состоянии [73]. Осуществить предварительный расчет эффективности экстрагентов для извлечения эндометаболитов из клеток микроводорослей возможно с помощью методики Ч. Хансена [73]. Сложность применения этой методики заключается в том, что внутри клетки эндометаболиты присутствуют как в чистом виде, так и в составе сложных многокомпонентных соединений, что требует экспериментального определения характеристик смесей.
Важно также учитывать качество получаемого продукта, что существенно снижает спектр подходящих экстрагентов: при получении чистых продуктов с высокой добавленной стоимостью используются нетоксичные экологически чистые экстрагенты. При получении продуктов непищевого назначения, например липидов для биотоплива, возможно применение традиционных растворителей – смеси со-растворителей, например петролейного эфира или гексана, а также метанола или этанола.
Подход, основанный на совмещении стадий культивирования, разрушения и экстракции/экстрагирования в одной технологической системе (установке), может серьезно сократить капитальные и эксплуатационные затраты [40]. Однако, такая система должна быть полностью автоматизирована, а настройки системы управления должны быть выполнены с использованием математических моделей реализуемых процессов.
КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ ПРОЦЕССОВ С ИСПОЛЬЗОВАНИЕМ МИКРОВОДОРОСЛЕЙ
Несмотря на привлекательность использования микроводорослей для производства полезных продуктов их потенциал в значительной мере остается нераскрытым. Привлекательным подходом при поиске экономически эффективных способов организации и ускорения процесса разработки таких производств является использование средств компьютерного моделирования на всех стадиях: предварительных научных исследований в лабораторных условиях, масштабирования процессов при проведении опытно-конструкторских и проектных работ.
Использование информационных ресурсов и программных средств ускоряет и повышает эффективность принятия решений при создании современных технологий на основе микроводорослей. Геномы ряда штаммов микроводорослей были секвенированы и размещены в общедоступных базах данных: UniProt (Universal Protein Resource) [74] BRENDA (Braunschweig Enzyme Database) [75], NCBI (National Center for Biotechnology Information) [76], ExPASy database [77]. Ресурс AlgaeBase [78] содержит обширную информацию о более чем 160 000 разновидностях водорослей и постоянно расширяет свое наполнение. Распознание аминокислотных последовательностей может быть выполнено с использованием таких ресурсов как BLAST, HMMER, InterProScan и др.
Метаболические модели, основанные на геноме (англ. Genome-scale metabolic models – GSMs) являются математическим представлением всей доступной биохимической и геномной информации о конкретном микроорганизме [79, 80]. GSMs широко использовались для моделирования биохимических процессов при поиске оптимальных вариантов модификации штаммов. Разработаны различной степени полноты метаболические модели для таких родов микроводорослей, как Chlamydomonas [81], Chlorella [79], Nannochloropsis [82], Synechocystis [83], Tetraselmis [84], Monoraphidium [85], Ostreococcus [86], Tisochrysis [87] и Phaeodactylum [88]. Они позволили получить ключевую информацию о центральном углеродном обмене, интенсивности реакций в различных органеллах этих организмов в зависимости от условий культивирования.
Математическое моделирование метаболических потоков в клетках микроводорослей все чаще используется при поиске оптимальных режимов культивирования и оценке потенциала штаммов для синтеза целевого набора ценных компонентов [12, 89, 90]. Это стало возможным благодаря созданию и наполнению открытых баз данных, позволяющих на основе данных генома секвенированных штаммов реконструировать стехиометрическую матрицу и анализировать интенсивность биохимических реакций, протекающих в клетке при разных условиях. Наиболее крупными ресурсами, которые содержат необходимую при решении таких задач информацию, являются KEGG, MetaCyc, GenBank, EMBL-Database, DNA-Database of Japan (DDBJ) [91–94].
Метаболические модели учитывают три типа ограничений: 1) физико-химические, которые основаны на законах сохранения массы и энергии, зависимости скорости реакции от биохимических циклов и термодинамики; 2) связь с окружающими клетку условиями, такими как доступность питательных веществ, акцепторов электронов и других внешних условий (например, поглощение фотонов); 3) регуляторные, к которым относятся состав и активность ферментов, которые помогают согласовать данные об экспрессии и точные взаимосвязи в цепочке “ген–белок–связанные реакции” [95]. У фототрофных организмов часть физико-химических ограничений принимается исходя из термодинамических условий относительно направления, обратимости или необратимости реакций, которые определяются путем расчета свободной энергии Гиббса. Учет связи с окружающими клетку условиями обычно основан на измеренных экспериментальных значениях освещенности, интенсивности поглощения питательных веществ.
На сегодняшний день наиболее часто для получения GSMs используют метод анализа метаболических потоков (англ. Flux Balance Analysis – FBA) [92], реализованный в ряде программных продуктов (COBRA toolbox для Matlab, OptFlux, FASIMU). Для создания FBA-модели осуществляется аннотация генома клетки с последующей расшифровкой сети метаболических реакций, устанавливаются ограничения модели и выбирается целевая функция для оптимизации. После этого формулируется задача линейного программирования для анализа балансов потоков метаболитов [78]. Вполне обоснованно принимается допущение о том, что все клетки достаточно выросли, чтобы полноценно функционировать и синхронно работают в стационарном режиме. В качестве ограничений для FBA-анализа задаются значения концентраций метаболитов или диапазоны их возможного изменения при биосинтезе целевых продуктов в стационарных условиях. Ограничения определяют диапазон скоростей, с которыми каждый метаболит потребляется или производится в результате биохимических реакций [97]. В качестве целевых функций используются: максимизация роста биомассы [98], минимизация производства ATP [99–101], минимизация поглощения питательных веществ, максимизация производства метаболитов, максимизация производства биомассы и метаболитов [102]. Результаты, полученные с использованием FBA-анализа, могут быть применены для определения стационарных метаболических потоков [103–106]. Так же FBA-анализ можно использовать для прогнозирования выхода важных кофакторов, таких как ATP, NADН или NADPН [107]. К недостаткам FBA-анализа можно отнести то, что данный подход требует адаптации под каждый конкретный организм (необходима уникальная метаболическая карта организма) и не может быть использован для моделирования динамики процесса биосинтеза [108]. FBA доказал свою эффективность для количественного анализа метаболитов, синтезируемых клетками, находящимися в стационарных лабораторных условиях.
Снятие допущения стандартного FBA о стационарности процессов необходимо для моделирования динамики жизнедеятельности фотосинтетических микроорганизмов [79, 109]. Эти организмы эволюционировали под циклический режим смены световой и темновой фаз, сопровождающийся переключением между разными фенотипическими состояниями. В периоды световой фазы неорганический углерод фиксируется в углеродных соединениях (углеводы и липиды), которые потребляются в период темновой фазы для осуществления жизненно важных для клеток функций. Такие особенности фотосинтетиков приводят к постоянно меняющемуся составу биомассы, что ограничивает применимость FBA для решения широкого круга задач. При исключении этого предположения, для описания процессов, проходящих в клетках, возникает необходимость получать систему дифференциально-алгебраических уравнений. Такой подход получил название динамический FBA. Для решения подобных задач предлагается использование либо подхода, основанного на решении динамической задачи оптимизации, либо на решении статической задачи оптимизации [110].
При решении динамической задачи оптимизации рассчитываются временные профили потоков и концентрации метаболитов за весь интересующий промежуток времени, при этом расчет выполняется только один раз. При решении задачи статической оптимизации исследуемый временной интервал разбивается на отрезки и для каждого интервала находится оптимальное значение. Для получения общей картины проводится дополнительная обработка полученных оптимальных значений концентраций метаболитов. Сложность использования описанных подходов для решения текущих инженерных задач заключается в необходимости получения экспериментальных данных для расчета кинетических коэффициентов реакций с участием конкретного микроорганизма при разных условиях осуществления реакций в биореакторе. Поэтому исследования, направленные на разработку методик получения таких данных, имеют большую степень актуальности.
Другой важной проблемой, эффективное решение которой может значительно увеличить экономическую привлекательность использования микроводорослей, является разработка конструкций промышленных биореакторных систем, способных обеспечить культивирование больших объемов биомассы в одинаковых оптимальных условиях, определенных на стадии предварительных лабораторных исследований. Проблема масштабного перехода от лабораторного объема биореактора (обычно 1–10 л) до промышленного (десятки и сотни м3) появляется вследствие усиливающегося влияния, вызываемого градиентом изменения технологических переменных (например pH, концентрациями растворенного кислорода, СО2, компонентов субстрата, экзометаболитов, количеством света и др.) на интенсивность и направленность метаболических реакций и, как следствие, соотношение ценных компонентов в клетках [111–113]. Стремительное развитие вычислительной техники, измерительных приборов и программного обеспечения позволило активнее использовать методы вычислительной гидродинамики (англ. Computational Fluid Dynamiсs – CFD) для расчета и проектирования фотобиореакторов. Использование CFD, путем решения уравнения Навье-Стокса, позволяет рассчитать гидродинамику потоков в фотобиореакторах и с использованием моделей кинетики роста микроводорослей перейти к прогнозу содержания в клетках метаболитов. Исходными данными для проведения таких расчетов являются геометрия фотобиореактора, тип рассекателя подаваемого газового потока, наличие дополнительного перемешивающего устройства и характеристики находящихся в реакторе фаз. Совместное использование методов FBA и CFD для проектирования фотобиореакторов позволило бы перейти на новый уровень энерго- и ресурсосбережения, однако для широкого использования этих подходов требуется систематизация процедур идентификации коэффициентов математических моделей и разработки быстродействующих алгоритмов решения их уравнений.
ЗАКЛЮЧЕНИЕ
Учитывая спрос на продукты натурального происхождения на потребительском рынке, вещества, полученные из микроводорослей, обладают хорошим рыночным потенциалом. Микроводоросли являются перспективными источниками сырья для устойчивого производства ценных веществ для применения в фармацевтике, производствах пищевых добавок, кормовых добавок для животных и рыб, материалов, биоудобрений, биотоплива. При организации эффективной биотехнологии синтеза ценных компонентов из биомассы микроводорослей необходимо учитывать генетические и морфологические особенности штамма. При оценке потенциальной привлекательности штамма и способов организации накопления и извлечения целевого набора ценных компонентов необходимо учитывать состав и прочность клеточной стенки, и локализацию продукта в органеллах. Для сохранения функциональности продуктов, содержащихся в клетках, необходимо использовать способы извлечения, обеспечивающие их минимальную трансформацию. Эффективность поиска экономически привлекательных способов организации и ускорения процесса разработки производств может быть повышена с использованием средств компьютерного информационного анализа и моделирования на стадиях предварительных лабораторных исследований, масштабирования процессов, проведения опытно-конструкторских и проектных работ. При этом перспективной целью является интеграция всех цепочек технологий в непрерывную структуру биопереработки микроводорослей, направленную на промышленное производство спектра продуктов и позволяющую извлечь максимальную прибыль от реализации всех ценных компонентов, находящихся в биомассе.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 20-18-50229).
ОБОЗНАЧЕНИЯ
| G3P | Глицеральдегид-3-фосфат |
| GSMs | Метаболические модели, основанные на геноме (англ. Genome-scale metabolic models) |
| FBA | Метод анализа метаболических потоков (англ. Flux Balance Analysis) |
| CFD | Метод вычислительной гидродинамики (англ. Computational Fluid Dynamiсs) |
| ATP | Аденозинтрифосфат |
| NADН | Никотинамидадениндинуклеотид (восстановленная форма) |
| NADPН | Никотинамидадениндинуклеотидфосфат (восстановленная форма) |
Список литературы
Брутланд Г.Х. Наше общее будущее // Тез. докл. Комиссии ООН по окружающей среде и развитию. М.: Прогресс, 1988. С. 50.
Bekirogullari M., Figueroa-Torres G.M., Pittman J.K., Theodoropoulos C. Optimising microalgal cultivation for biofuels production: the biorefinery paradigm // Biotechnology Advances. 2020. V. 44.
Alam M.A., Xu J., Wang Z. Microalgae biotechnology for food, health and high value products. Gateway: Springer Nature Singapore Pte Ltd, 2020.
Chisti Y. Constraints to commercialization of algal fuels // J. Biotechnol. 2013. V. 167. P. 201.
Цоглин Л.Н., Пронина Н.А. Биотехнология микроводорослей. М: Научный мир, 2012.
Bwapwa J.K., Mutanda T., Anandraj A.A Sustainable Approach for Bioenergy and Biofuel Production from Microalgae. Abingdon-on-Thames: CRC Press, Taylor & Francis Group, 2019.
Benemann J.R. Hydrogen production by microalgae // J. Appl. Phycol. 2000.
Liu G., Liao Y., Wu Y., Ma X. Synthesis gas production from microalgae gasification in the presence of Fe2O3 oxygen carrier and CaO additive // Applied Energy. 2018. V. 212. P. 955.
Gifuni I., Pollio A., Safi C., Marzocchella A., Olivieri G. Current Bottlenecks and Challenges of the Microalgal Biorefinery // Trends in Biotechnol. 2019. V. 37. P. 242.
Sinetova M.A., Sidorov R.A., Starikov A.Y., Voronkov A.S., Medvedeva A.S., Krivova Z.V., Pakholkova M.S., Bachin D., Bedbenov V.S., Gabrielyan D., Zayadan B.K., Bolatkhan K., Los D.A. Assessment of the Biotechnological Potential of Cyanobacterial and Microalgal Strains from IPPAS Culture Collection // Applied Biochemistry and Microbiology. 2020. V.56. № 7. P. 794.
Scopus. https://www.scopus.com/. Accessed May 24, 2021.
Teng S.Y., Yew G.Y., Sukačová K., Show P.L., Máša V., Chang, J. Microalgae with artificial intelligence: A digitalized perspective on genetics, systems and products // Biotechnology Advances. 2020. V.44.
Sathasivam R., Radhakrishnan R., Hashem A., Elsayed F., Allah E.F. Microalgae metabolites: A rich source for food and medicine // Saudi Journal of Biological Sciences. 2019. V. 26. P. 709.
Dineshkumar R., Ahamed Rasheeq A., Arumugam A., Nathiga Nambi K.S., Sampathkumar P. Microalgae as Bio-fertilizers for Rice Growth and Seed Yield Productivity // Waste Biomass Valor. 2018. V. 9(5). P. 793.
Oliver L., Dietrich T, Marañón I., Villarán M.C., Barrio R.J. Producing Omega-3 Polyunsaturated Fatty Acids: A Review of Sustainable Sources and Future Trends for the EPA and DHA Market // Resources. 2020, V. 9. P. 148.
Rastogi R.P., Datta M., Pandey A. Book: Algal green chemistry—Recent progress in biotechnology. Amsterdam: Elsevier, 2017.
Market Watch. Beta carotene market size, share 2019. Global Beta Carotene Market Report, 2019.
Señoráns M., Castejón N., Señoráns F.J. Advanced Extraction of Lipids with DHA from Isochrysis galbana with Enzymatic Pre-Treatment Combined with Pressurized Liquids and Ultrasound Assisted Extractions // Molecules. 2020. V. 25(14).
Bwapwa J.K., Anandraj A., Trois C. Possibilities for conversion of microalgae oil into aviation fuel: A review // Renewable and Sustainable Energy Reviews. 2017. V. 80. P. 1345.
Yoon B.K., Jackman J.A., Valle-González E.R., Cho N.-J. Antibacterial Free Fatty Acids and Monoglycerides: Biological Activities, Experimental Testing, and Therapeutic Applications // Int. J. Mol. Sci. 2018. V. 19. № 1114.
McWilliams A. The global market for carotenoids. FOD025F. 2018. BCC research report overview. Wellesley, MA: BCC Publishing.
Cinar S.O., Chong Z.K., Kucuker M.A., Wieczorek N., Cengiz U., Kuchta K. Bioplastic production from microalgae: a Review // Int. J. Environ. Res. Public Health. 2020. V. 17.
Dixon C., Wilken L.R. Green microalgae biomolecule separations and recovery // Bioresour. Bioprocess. 2018. V. 5.
Gunes S., Tamburaci S., Dalay M.C., Gurhanb I.D. In vitro evaluation of Spirulina platensis extract incorporated skin cream with its wound healing and antioxidant activities // Pharm Biol. 2017. V. 55. P. 1824.
Ronga D., Biazzi E., Parati K., Carminati D., Carminati E., Tava A. Microalgal biostimulants and biofertilisers in crop productions // Agronomy. 2019. V. 9. P. 192.
Pierre G., Delattre C., Dubessay P., Jubeau S., Vialleix C., Probert I., Michaud P. What Is in Store for EPS Microalgae in the Next Decade? // Molecules. 2019. V. 24. P. 4296.
Stanic-Vucinic D., Minic S., Nikolic M.R., Velickovic T.C. Spirulina Phycobiliproteins as Food Components and Complements // Microalgal Biotechnology. 2018.
Soares A.T., Marques Júnior J.G., Lopes R.G., Derner R.B., Antoniosi Filho N.R. mprovement of the extraction process for high commercial value pigments from Desmodesmus sp. Microalgae // Journal of the Brazilian Chemical Society. 2016. V. 27. P. 1083.
Ambati R.R., Gogisetty D., Aswathanarayana R.G., Ravi S., Bikkina P.N., Bo L., Yuepeng S. Industrial potential of carotenoid pigments from microalgae: Current trends and future prospects // Critical Reviews in Food Science and Nutrition. 2018. P. 1.
de Jesús Paniagua-Michel J., Morales-Guerrero E., Soto J.O. Microalgal biotechnology: Biofuels and bioproducts. Berlin: Springer-Verlag, 2015.
Ryckebosch E., Bruneel C., Termote-Verhalle R., Goiris K., Muylaert K., Foubert I. Nutritional evaluation of microalgae oils rich in omega-3 long chain polyunsaturated fatty acids as an alternative for fish oil // Food Chem. 2014. V. 160. P. 393.
Hamilton M.L., Warwick J., Terry A., Allen M.J., Napier J.A., Sayanova O. Towards the Industrial Production of Omega-3 Long Chain Polyunsaturated Fatty Acids from a Genetically Modified Diatom Phaeodactylum tricornutum // PLoS ONE. 2015. V. 14.
Lee Chang K.J., Nichols C.M., Blackburn S.I., Dunstan G.A., Koutoulis A., Nichols P.D. Comparison of thraustochytrids Aurantiochytrium sp., Schizochytrium sp., Thraustochytrium sp., and Ulkenia sp. for production of biodiesel, long-chain omega-3 oils, and exopolysaccharide // Mar. Biotechnol. 2014. V. 16. P. 396.
Paz A., Karnaouri A., Templis C.C., Papayannakos N., Topakas E. Valorization of exhausted olive pomace for the production of omega-3 fatty acids by Crypthecodinium cohnii // Waste Manag. 2020. V. 118. P. 435.
Berman J., Zorrilla-López U., Farré G., Zhu C., Sandmann G., Twyman R., Capell T., Christou P. Nutritionally important carotenoids as consumer products // Phytochemistry Reviews. 2014. V. 14. P. 727.
El-Mekkawi S.A., Hussein H.S., Abo El-Enin S.A., El-Ibiari N.N. Assessment of stress conditions for carotenoids accumulation in Chlamydomonas reinhardtii as added-value algal products // Bulletin of the National Research Centre. 2019. V. 43.
BGG. (2016). Health beneits and production methods of natural astaxanthin. bggworld.com
Andrade L.M., Andrade C.J., Dias M., Nascimento Claudio A.O., Mendes Maria A. Chlorella and spirulina microalgae as sources of functional foods, nutraceuticals, and food supplements; an overview // MOJ Food Process Technol. 2018. V. 6. P.45.
Madeira M.S., Cardoso C., Lopes P.A., Coelho D., Afonso C., Bandarra N.M., Prates J.A.M. Microalgae as feed ingredients for livestock production and meat quality: A review // Livestock Science. 2017. V. 205. P. 111.
Eppink M.H.M., Olivieri G., Reith H., van den Berg C., Barbosa M.J., Wijffels R.H. From current algae products to future biorefinery practices: A review // Advances in Biochemical Engineering/Biotechnology. 2019. V. 166. P. 99.
Voort M.P.J. van der Vulsteke E., de Visser C.L.M. Macro-economics of algae products. Public Output report of the En Algae project. Swansea. June 2015. P. 47.
Minhas A.K., Hodgson P., Barrow C.J., Adholeya A. A Review on the Assessment of Stress Conditions for Simultaneous Production of Microalgal Lipids and Carotenoids // Front Microbiol. 2016. V. 7.
Dvoretsky D., Dvoretsky S., Temnov M., Akulinin E., Markin I., Ustinskaya Y., Yeskova M., Meronyuk K. Research into the influence of cultivation conditions on the fatty acid composition of lipids of chlorella vulgaris microalgae // Chemical Engineering Transactions. 2020. V. 79. P. 31.
Huang A., Wu S., Gu W., Li Y., Xie X., Wang G. Provision of carbon skeleton for lipid synthesis from the breakdown of intracellular protein and soluble sugar in Phaeodactylum tricornutum under high CO2 // BMC Biotechnol. 2019. V. 19.
Ruijuan Ma, Wang B., Chua E.T., Zhao X., Lu K., Ho S.-H., Liu L., Xie Y., Shi X., Lu Y. et al. Comprehensive Utilization of Marine Microalgae for Enhanced Co-Production of Multiple Compounds // Mar Drugs. 2020. V. 18.
Coronado-Reyes J.A., Salazar-Torres J.A., Juárez-Campos B., Gonzalez-Hernandez J.C. Chlorella vulgaris, a microalgae important to be used in Biotechnology: a review // Food Science and Technology. 2020.
Minhas A.K., Hodgson P., Barrow C.J., Adholeya A. A Review on the Assessment of Stress Conditions for Simultaneous Production of Microalgal Lipids and Carotenoids // Front Microbiol. 2016 V. 7.
Dvoretsky D., Dvoretsky S., Temnov M., Markin I., Akulinin E., Golubyatnikov O., Ustinskaya Y., Eskova M. Experimental research into the antibiotic properties of Chlorella vulgaris algal exometabolites // Chemical Engineering Transactions. V. 74. 2019. P. 1429.
Alsenani F., Tupally K.R., Chuac E.T., Eltanahy E., Alsufyani H., Parekh H.S., Schenk P.M. Evaluation of microalgae and cyanobacteria as potential sources of antimicrobial compounds // Saudi Pharmaceutical J. 2020. V. 28(12). P. 1834.
Eldridge R.J., Hill D.R.A., Gladman B.R. A comparative study of the coagulation behavior of marine microalgae // J. Appl. Phycol. 2012. V. 24. P. 1667.
Muylaert K., Bastiaens L., Vandamme D., Gouveia L. Harvesting of microalgae: overview of process options and their strengths and drawbacks // Microalgae-based biofuels and bioproducts. 2017. P. 113.
Vandamme D., Beuckels A., Vadelius E., Depraetere O., Noppe W., Dutta A., Foubert I.L.L., Muylaert K. Inhibition of alkaline flocculation by algal organic matter for Chlorella vulgaris // Water Res. 2016. V. 88. P. 301.
Дворецкий Д.С., Дворецкий С.И., Темнов М.С. и др Технология получения липидов из микроводорослей: монография. Тамбов: ТГТУ, 2015.
Baudelet P.-H., Ricochon G., Linder M., Muniglia. A. New Insight into Cell Walls of Chlorophyta // Algal Research. 2017. V. 25. P. 333.
Al Hattab M., Ghaly A., Hammoud A. Microalgae Harvesting Methods for Industrial Production of Biodiesel: Critical Review and Comparative Analysis // J. Fundam Renew Energy Appl. 2015.
Xia L., Li Y., Huang R., Song S. Effective harvesting of microalgae by coagulation–flotation // Society Open Science. 2017. V. 4. № 11.
Molina-Grima E., Belarbi E., Acien G., Robles A., Chisti Y. Recovery of microalgal biomass and metabolites: process options and economics // Biotechnology advances. 2003. V. 20. P. 491.
Lee S.Y., Cho J.M., Chang Y.K., Oh Y.K. Cell disruption and lipid extraction for microalgal biorefineries: A review // Bioresour. Technol. 2017. V. 244. P. 1317.
Cronmiller E., Toor D., Shao N.C., Kariyawasam T., Wang M.H., Lee J.H. Cell wall integrity signaling regulates cell wall regeneration via transcriptional activation in Chlamydomonas reinhardtii // Sci Rep. 2019. V. 21.
Jegathese S.J.P., Farid M. Microalgae as a Renewable Source of Energy: A Niche Opportunity // J. Renew Energy. 2014. P. 1.
Lardon L., Helias A., Sialve B., Steyer J.P., Bernard O. Life-Cycle Assessment of Biodiesel Production from Microalgae // Environ. Sci. Technol. 2009. V. 43. P. 6475.
Lee A.K., Lewis D.M., Ashman P.J. Disruption of microalgal cells for the extraction of lipids for biofuels: Processes and specific energy requirements // Biomass Bioenergy. 2012. V. 46. P. 89.
Günerken E., Dhondt E., Eppink M., Garcia-Gonzalez L., Elst K., Wijffels R.H. Cell disruption for microalgae biorefineries // Biotechnol. Adv. V. 33. P. 243.
Roux J-M., Lamotte H. An Overview of Microalgae Lipid Extraction in a Biorefinery Framework // Energy Procedia. 2017. V. 112. P. 680.
Dong T., Knoshaug E.P., Pienkos P.T., Laurens M.L.M. Lipid recovery from wet oleaginous microbial biomass for biofuel production: A critical review // Appl. Energy. 2016. V. 177. P. 879.
Show K.Y., Lee D.J., Tay J.H., Lee T.M., Chang J.S. Microalgal drying and cell disruption–recent advances // Bioresour. Technol. 2015. V. 184. P. 258.
Drira N., Dhouibi N., Hammami S., Piras A., Rosa A., Porcedda S., Dhaouadi H. Fatty acids from high rate algal pond’s microalgal biomass and osmotic stress effects // Bioresour. Technol. 2017. V. 244. P. 860–864.
Kim J., Yoo G., Lee H., Lim J., Kim K., Kim C.W., Park M.S., Yang J.W. Methods of downstream processing for the production of biodiesel from microalgae // Biotechnology Advances. 2013. V. 31. P. 862.
Lenneman E.M., Wang P., Barney B.M. Potential application of algicidal bacteria for improved lipid recovery with specific algae // FEMS Microbol Lett. 2014. V. 354. P. 102.
Demuez M., González-Fernández C., Ballesteros M. Algicidal microorganisms and secreted algicides: New tools to induce microalgal cell disruption // Biotechnol. Adv. 2015. V. 33. P. 1615.
Dvoretsky D., Dvoretsky S., Temnov M., Tugolukov E., Akulinin E., Golubyatnikov O., Ustinskaya Y., Eskova M. The Study of the Lipid Extraction Process for the Production of Third-generation Biofuel from the Pre-treated Microalgae Chlorella Vulgaris Biomass // Chemical Engineering Transactions. 2019. V. 74. P. 73.
Ferreira F., Pinto G.&R., Rubens L.&F., Fregolente L. A review on lipid production from microalgae: Association between cultivation using waste streams and fatty acid profiles // Renewable and Sustainable Energy Reviews. 2019. V. 109. P. 448.
Halim R., Danquah M.K., Webley P.A. Extraction of oil from microalgae for biodiesel production: A review // Biotechnol Adv. 2012. V. 30. P. 709.
UniProt. https://www.uniprot.org/. Accessed May 24, 2021.
Enzyme Database – BRENDA. https://www.brenda-enzymes.org/. Accessed May 24, 2021.
NCBI (National Center for Biotechnology Information Search database) – https://www.ncbi.nlm.nih.gov/. Accessed May 24, 2021.
Expasy: Swiss Bioinformatics Resource Portal. https://www.expasy.org/. Accessed May 24, 2021.
AlgaeBase is a global algal database of taxonomic, nomenclatural and distributional information. https:// www.algaebase.org/. Accessed May 24, 2021.
Zuciga C., Levering J., Antoniewicz M.R., Guarnieri M.T., Betenbaugh M.J., Zengler K. Predicting Dynamic Metabolic Demands in the Photosynthetic Eukaryote Chlorella vulgaris // Plant Physiol. 2017. V. 176. P. 450.
Terzer M., Maynard N.D., Covert M.W., Stelling J. Genome-scale metabolic networks. Wiley Interdiscip Rev. // Syst. Biol. Med. 2009. V. 1. P. 285.
Boyle N.R., Sengupta N., Morgan J.A. Metabolic flux analysis of heterotrophic growth in Chlamydomonas reinhardtii // PLoS ONE. 2017. V. 12.
Shah A.R., Ahmad A., Srivastava S., Jaffar Ali B.M. Reconstruction and analysis of a genome-scale metabolic model of Nannochloropsis gaditana // Algal Res. 2017. V. 26 P. 354.
Yoshikawa K., Kojima Y., Nakajima T., Furusawa C., Hirasawa T., Shimizu H. Reconstruction and verification of a genome-scale metabolic model for Synechocystis sp. PCC6803 // Appl Microbiol Biotechnol. 2011. V. 92. P. 347.
David K.Y. Lim, Schuhmann H., Thomas-Hall S.R., Chan K.C.K., Wass T.J., Aguilera F., Adarme-Vega T.C., Dal’Molin C.G.O., Thorpe G.J., Batley J. et al. RNA-Seq and metabolic flux analysis of Tetraselmis sp. M8 during nitrogen starvation reveals a two-stage lipid accumulation mechanism // Bioresour Technol. 2017. V. 244. P. 1281.
Bogen C., Al-Dilaimi A., Albersmeier A., Wichmann J., Grundmann M., Rupp O., Lauersen K.J., Blifernez-Klassen O., Kalinowski J., Goesmann A. et al. Reconstruction of the lipid metabolism for the microalga Monoraphidium neglectum from its genome sequence reveals characteristics suitable for biofuel production. // BMC Genomics. 2013. V. 14. № 926.
Krumholz E.W., Yang H., Weisenhorn P., Henry C.S., Libourel I.G.L. Genome-wide metabolic network reconstruction of the picoalga Ostreococcus. // J. Exp. Bot. 2012. V. 63. P. 2353.
Baroukh C., Mucoz-Tamayo R., Steyer J.P., Bernard O. DRUM: A New Framework for Metabolic Modeling under Non-Balanced Growth. Application to the Carbon Metabolism of Unicellular Microalgae // PLoS ONE. 2013. V. 12.
Levering J., Broddrick J., Dupont C.L., Peers G., Beeri K., Mayers J., Gallina A.A., Allen A.E., Palsson B.O., Zengler K. Genome-scale model reveals metabolic basis of biomass partitioning in a model diatom // PLoS ONE. 2016. V. 11. P. 1.
Tibocha-Bonilla J.D., Zuñiga C., Godoy-Silva R.D., Zengler K. Advances in metabolic modeling of oleaginous microalgae // Biotechnol. Biofuels. 2018. V. 11. P. 1.
Шевцов А.А., Лыткина Л.И., Антипов С.Т., Остриков А.Н., Шенцова Е.С., Дранников А.В., Коптев Д.В. Математическое моделирование процесса культивирования светозависимых микроорганизмов в пленочном аппарате с противоточным движением фаз // Теоретические основы химической технологии. 2016. Т. 50(3). С. 344.
GenBank Overview – NCBI – NIH. https://www.ncbi.nlm.nih.gov/genbank/. Accessed May 24, 2021.
MetaCyc: Metabolic Pathways From all Domains of Life. https://metacyc.org/. Accessed May 24, 2021.
The European Bioinformatics Institute < EMBL-EBI. https://www.ebi.ac.uk/. Accessed May 24, 2021.
DDBJ. https://www.ddbj.nig.ac.jp/. Accessed May 24, 2021.
Chen K., Gao Y., Mih N., O’Brien E.J., Yang L., Palsson B.O. Thermosensitivity of Growth Is Determined by Chaperone-Mediated Proteome Reallocation // Proc Natl Acad Sci. 2017. V. 114. P. 11548.
Singh D., Lercher M.J. Network reduction methods for genome-scale metabolic models // Cellular and Molecular Life Sciences. 2020. V. 77. P. 481.
Orth D.J., Thiele I., Palsson Ø.B. What is flux balance analysis? // Nature Biotechnology. 2010. V. 28. P. 245.
Flassig R.J., Fachet M., Höffner K., Barton P.I., Sundmacher K. Dynamic flux balance modeling to increase the production of high-value compounds in green microalgae // Biotechnol. Biofuels. 2016. V. 9.
Raman K., Chandra N. Flux balance analysis of biological systems: applications and challenges // Briefings in Bioinformatics. 2009. V. 10(4). P. 435.
Brunner J.D., Chia N. Minimizing the number of optimizations for efficient community dynamic flux balance analysis / PLOS Computational biology. 2020. V. 29. https://doi.org/10.1101/2020.03.12.988592
Martínez V.S., Buchsteiner M., Gray P., Nielsen L.K., Quek L.-E. Dynamic metabolic flux analysis using B-splines to study the effects of temperature shift on CHO cell metabolism // Metab. Eng. Commun. 2015. V. 2. P. 46.
Miyawaki A., Sriydthsak K., Hirai M.Y., Shiraishi F. Dynamic Flux Balance Analysis to Evaluate the Strain Production Performance on Shikimic Acid Production in Escherichia coli // Math. Biosci. 2016. V. 282.
Tourigny D.S., Goldberg A.P., Karr J.R. Simulating single-cell metabolism using a stochastic flux-balance analysis algorithm // The Preprint server for biology. 2020.
Rowe E., Palsson B.O., King Z.A. Escher-FBA: A web application for interactive flux balance analysis // BMC Syst. Biol. 2018. V. 12. https://doi.org/10.1186/s12918-018-0607-5
Heirendt L. et al. Creation and analysis of biochemical constraint-based models: Creation and analysis of biochemical constraint-based models using the COBRA Toolbox v.3.0 // Nature Research. 2019. V. 14. P. 639.
Qian X., Kim M.K., Kumaraswamy G.K., Agarwal A., Lun D.S., Dismukes G.C. Flux balance analysis of photoautotrophic metabolism: Uncovering new biological details of subsystems involved in cyanobacterial photosynthesis // Biochimica et Biophysica Acta (BBA) – Bioenergetics. V. 1858(4). 2017. P. 276.
Vitkin E., Gillis A., Polikovsky M., Bender B., Golberg A., Yakhini Z. Distributed flux balance analysis simulations of serial biomass fermentation by two organisms // Plos One. 2020.
Gerstl M.P., Ruckerbauer D.E., Mattanovich D., Jungreuthmayer C., Zanghellini J. Metabolomics integrated elementary flux mode analysis in large metabolic networks // Sci. Rep. 2015. V. 5.
Loira N., Mendoza S., Paz Cortйs M., Rojas N., Travisany D., Di Genova A. et al. Reconstruction of the microalga Nannochloropsis salina genome-scale metabolic model with applications to lipid production // BMC Syst Biol. 2017.
Mahadevan R., Edwards J.S., Doyle F.J. Dynamic flux balance analysis of diauxic growth in Escherichia coli // Biophys J. 2002. V. 83. P. 1331.
Nadal-Rey G., McClure D.D., Kavanagh J.M., Cornelissen S., Fletcher D.F., Gernaey K.V. Development of dynamic compartment models for industrial aerobic fed-batch fermentation processes // Biotechnology Adv. 2021. V. 46.
Bitog J.P., Lee I.B., Lee C.G., Kim K.S., Hwang H.S., Hong S.W., Seo I.H., Kwon K.S., Mostafa E. Application of computational fluid dynamics for modeling and designing photobioreactors for microalgae production: a review // Comput. Electron. Agric. 2011. https://doi.org/10.1016/j.compag.2011.01.015
Crater J.S., Lievense J.C. Scale-up of industrial microbial processes // FEMS Microbiol. Lett. 2018. V. 365(13). https://doi.org/10.1093/femsle/fny138
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии