Теоретические основы химической технологии, 2022, T. 56, № 4, стр. 410-417
Равновесие жидкость–жидкость и экстракционная способность системы ППГ 425–NaNO3–H2O
И. В. Зиновьева a, *, А. В. Кожевникова a, Н. А. Милевский a, Ю. А. Заходяева a, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский просп., 31, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 02.04.2022
После доработки 15.04.2022
Принята к публикации 21.04.2022
- EDN: EXMGTO
- DOI: 10.31857/S004035712204008X
Аннотация
В настоящей работе изучено фазовое равновесие жидкость–жидкость для новой экстракционной системы c полипропиленгликолем 425 (ППГ 425) и нитратом натрия в зависимости от концентрации HCl при температуре 298.15 К. Представлены экспериментальные и расчетные бинодальные данные. Проведена корреляция экспериментальных равновесных и расчетных данных нод жидкость–жидкость. Изучено межфазное распределение ионов Fe(III), Zn(II) и Cu(II), содержащихся в большом количестве в электронных отходах, в системе ППГ 425–NaNO3–H2O. Установлены зависимости количественных характеристик экстракции Fe(III), Zn(II) и Cu(II) от концентрации NaCl, HCl и исходной концентрации металла. Показана возможность эффективного разделения ионов Fe(III), Zn(II) и Cu(II) в предложенной экстракционной системе.
ВВЕДЕНИЕ
Печатные платы являются неотъемлемым компонентом любого электронного устройства и составляют до 10% от массы этих устройств. Развитие технологий производства электронных компонентов и устаревание ранее произведенной электроники влечет за собой образование большого количества электронных отходов, содержащих печатные платы. Переработка электронных отходов крайне необходима, поскольку происходит быстрое накопление такого сырья на мусорных полигонах. При этом продукты их переработки являются ценными материалами и могут быть использованы повторно при производстве новых компонентов. Состав печатных плат крайне разнообразен, однако, наиболее высокое содержание в них таких элементов, как железо, цинк и медь [1]. Извлечение и разделение данных элементов с дальнейшим их концентрированием является первостепенной задачей при переработке печатных плат. При этом важно не только достигать высокой эффективности процесса, но и использовать методы с низкой нагрузкой на экологию.
Одним из наиболее перспективных методов для решения проблемы разделения и очистки веществ является жидкостная экстракция. Данный метод обладает рядом важных преимуществ: низкие энергозатраты, малый расход экстрагента, ввиду его регенерации, простота используемого технологического оборудования. Однако органические растворители, например, толуол и керосин, используемые в экстракции, ядовиты, легко воспламеняются, обладают канцерогенными свойствами и вредны для окружающей среды. В связи с этим существует задача по разработке и внедрению в промышленность более совершенных экстракционных систем, отвечающих современным требованиям по безопасности. Перспективный класс экстракционных систем – двухфазные водные системы – лишен вышеописанных недостатков. Они успешно используются для разделения, очистки и анализа биологически активных [2–4] и органических [5, 6] веществ, а также ионов металлов [7–9]. Для использования таких систем в процессах переработки металлсодержащих отходов необходимо комплексно исследовать их физико-химические и экстракционные свойства. Как правило, ионы металлов хорошо экстрагируются в полимерную фазу в виде анионных комплексов, по этой причине возникает ряд факторов, от которых зависит эффективность экстракции в данных системах: молекулярная масса полимера [10], природа фазообразующей соли [11], соотношение полимера и соли [12]. Межфазное распределение металлов зависит также от значений рН среды, поскольку кислотность влияет как на состав извлекаемых соединений металлов [12, 13], так и на фазовое равновесие в таких системах [10]. Влияние добавления различных ионов и кислотности среды на фазовые равновесия в двухфазных водных системах изучалось в работах [14–18]: увеличение концентрации неорганических и органических солей [14, 15], как и увеличение рН [16–18], расширяет гетерогенную область. При этом, в связи со значительным влиянием состава двухфазной водной системы на фазовое равновесие, исследование фазовых диаграмм и установление составов фаз является ключевым требованием к предлагаемым системам. К настоящему моменту в литературе описан большой массив данных по фазовым равновесиям двухфазных водных систем. Тем не менее, важным ограничением для применения двухфазных водных систем для переработки растворов выщелачивания остается их малая стабильность при высоких концентрациях кислот, которые возникают в процессе растворения печатных плат. В настоящее время в литературе отсутствуют упоминания двухфазных водных систем с концентрацией минеральных кислот выше 2 моль/л.
Таким образом, данная работа посвящена изучению новой двухфазной водной системы на основе полипропиленгликоля 425 и NaNO3 и изучению ее экстракционной способности на примере ионов Fe(III), Zn(II) и Cu(II) при высокой концентрации минеральной кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления двухфазной водной системы использовали полипропиленгликоль со средней молекулярной массой 425 г/моль “Acros Organics” и нитрат натрия квалификации “х. ч.”. Экспериментальное исследование фазовых равновесий в многокомпонентной системе проводили в стеклянном сосуде объемом 50 мл с использованием термостатированного шейкера “Enviro-Genie SI-1202, Scientific Industries, Inc.” при скорости вращения 35 об/мин. Определение положения бинодальной кривой осуществлялось известным методом титрования [19]. Раствор полимера известной концентрации титровали раствором соли известной концентрации или наоборот до точки помутнения, указывающей на образование двух несмешивающихся жидких фаз. Эксперименты проводили при температуре 298.15 К и атмосферном давлении 100 ± 1 кПа. Состав смеси был рассчитан на основе масс каждого компонента в системе. Для построения нод жидкость–жидкость были приготовлены системы с известным содержанием полимера, соли и воды. Образцы перемешивали в термостатированном шейкере в течение 30 мин и затем оставляли на 24 ч для достижения термодинамического равновесия.
После разделения фаз концентрацию соли в верхней и нижней фазах определяли методом спектрофотометрии в УФ-области (λ = 301 нм) относительно воды в кварцевых кюветах l = 10 мм. Для этого готовили серию калибровочных растворов NaNO3 точной концентрации от 0.2 до 1 мас. % и измеряли оптическую плотность приготовленных растворов на приборе “Экросхим ПЭ-5400УФ”. По полученным данным строили градуировочный график в виде зависимости оптической плотности от концентрации NaNO3. В данном диапазоне концентраций наблюдалась линейная зависимость, которая в дальнейшем была использована для определения содержания NaNO3 в исследуемых фазах. Концентрацию полимера в обеих фазах определяли путем измерения показателя преломления с помощью рефрактометра “Anton Paar Abbemat 3200” с точностью измерения ±0.0001.
Связь между показателем преломления смеси $~n_{{\text{D}}}^{{{\text{СМ}}}}$ и массовыми долями полимера ${{{{\omega }}}^{{\text{П}}}}$ и соли ${{{{\omega }}}^{{\text{С}}}}$ определяется в соответствии с правилом аддитивности:
(1)
$~n_{{\text{D}}}^{{{\text{СМ}}}}~~ = \,\,~n_{{\text{D}}}^{{\text{В}}}~\,\, + \,\,~{{a}^{{\text{П}}}}{{w}^{{\text{П}}}} + \,\,~{{a}^{{\text{С}}}}{{w}^{{\text{С}}}},$причем
где ${{w}^{{\text{В}}}}~$– массовая доля воды в смеси, $n_{{\text{D}}}^{{\text{В}}}$ – показатель преломления воды.Однако уравнение (1) справедливо только для разбавленных растворов. Поэтому для измерения показателя преломления было выполнено разбавление образцов. Затем были построены калибровочные графики для показателя преломления полимера в диапазоне его концентраций от 0 до 10 мас. % и для соли в диапазоне ее концентраций от 0 до 5 мас. %, по которым были определены значения коэффициентов ${{a}^{{\text{П}}}}$ и ${{a}^{{\text{С}}}}$ для полимера и соли, соответственно. Значения коэффициентов $n_{{\text{D}}}^{{\text{В}}}$, ${{a}^{{\text{П}}}}$ и ${{a}^{{\text{С}}}}$ приведены в табл. 1.
Таблица 1.
Значения параметров уравнения (1) для для системы ППГ 425–NaNO3–H2O при 298.15 К
| $n_{{\text{D}}}^{{\text{B}}}$ | aП | aС |
|---|---|---|
| 1.3325 | 0.001293 | 0.001129 |
Во всех экспериментах по экстракции ионов Fe(III), Zn(II) и Cu(II) использовали систему состава полипропиленгликоль 425 (30 мас. %)– нитрат натрия (16 мас. %)–вода. Для изучения экстракции исследуемых металлов исходные водные растворы готовили растворением в дистиллированной воде точных навесок FeCl3·6H2O, ZnCl2, CuCl2·2H2O квалификации “ч”, взвешенных на аналитических весах “AND HR-100AZ”. В экспериментах по исследованию влияния содержания NaCl и HCl на извлечение ионов металлов были использованы реактивы со степенью чистоты >99% “Химмед”.
Исследование экстракционных равновесий проводили при температуре 298.15 К и атмосферном давлении 100 ± 1 кПа в градуированных центрифужных пробирках с использованием термостатированного шейкера со скоростью вращения 35 об/мин в течение 20 мин. Содержание ионов Zn(II) и Cu(II) в исходном растворе, в солевой и полимерной фазах после экстракции определяли спектрофотометрическим методом с использованием 4-(2-пиридилазо)резорцина [20], образующего комплексы с металлами, которые поглощают в видимой области спектра (λ = 493 и 508 нм, соответственно). Концентрацию ионов Fe(III) определяли методом спектрофотометрии в видимой области (λ = 427 нм) с использованием в качестве индикатора сульфосалициловой кислоты относительно воды.
Все представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Данные о равновесии жидкость–жидкость являются важными для разработки новой двухфазной водной системы, поскольку на их основании подбирается дальнейший состав экстракционной системы. Полученные бинодальные данные для системы ППГ 425–NaNO3–H2O в зависимости от концентрации HCl, а также данные о составах равновесных жидких фаз системы без НCl при 298.15 К (рис. 1). Из рисунка видно, что с увеличением содержания соляной кислоты бинодаль смещается в сторону меньших концентраций NaNO3.
Рис. 1.
Влияние концентрации HCl на положение бинодали двухфазной водной системы ППГ 425–NaNO3–H2O при 298.15 K (точки – эксперимент, линии – расчетные данные) и равновесные данные для системы ППГ 425–NaNO3–H2O при 298.15 K (точки – эксперимент, пунктирная линия – расчетные данные). С(HCl): 1 – 0 моль/л, 2 – 1 моль/л, 3 – 2 моль/л, 4 – 3 моль/л, 5 – 4 моль/л.

Для корреляции экспериментальных бинодальных данных с расчетными было использовано следующее эмпирическое уравнение:
(3)
$100{{w}^{{\text{П}}}}{\text{ }} = \,\,~a\,\,~ + \,\,~b100{{w}^{{\text{С}}}}^{{0.5}}~ + \,\,~c100{{w}^{{{\text{С\;}}}}}.$Коэффициенты a, b и c уравнения (3) и рассчитанное стандартное отклонение sd1 для исследованной системы приведены в табл. 2.
Таблица 2.
Значения параметров уравнения (3) и стандартное отклонение для системы ППГ 425–NaNO3–H2O в зависимости от концентрации HCl
| Бинодаль | a | b | c | sd1 |
|---|---|---|---|---|
| 1 | 189.077 | –60.26 | 4.833 | 0.03 |
| 2 | 114.163 | –37.592 | 3.004 | 0.61 |
| 3 | 121.629 | –44.851 | 4.089 | 0.42 |
| 4 | 130.389 | –49.954 | 4.743 | 0.27 |
| 5 | 115.115 | –39.616 | 3.066 | 0.47 |
С помощью уравнения (3) были определены расчетные значения бинодальных кривых. На основании полученного стандартного отклонения был сделан вывод, что данное уравнение может быть использовано для корреляции бинодальных данных исследуемой системы. Расчетные бинодальные данные приведены в табл. 2.
Исследуемая область фазового равновесия жидкость–жидкость в данной системе имеет достаточно широкие границы, в которых одновременно существует только двухфазная область жидкость–жидкость, при выходе за пределы которой либо образуется твердая фаза, либо формируется единственная жидкая фаза.
Согласованность полученных экспериментальных данных может быть проверена с помощью методики Отмера–Тобиаса [21], основанной на эмпирическом уравнении:
(4)
$\ln [{{(1 - w_{{\text{Н}}}^{{\text{C}}})} \mathord{\left/ {\vphantom {{(1 - w_{{\text{Н}}}^{{\text{C}}})} {w_{{\text{Н}}}^{{\text{C}}}}}} \right. \kern-0em} {w_{{\text{Н}}}^{{\text{C}}}}}] = A + B\ln [{{(1 - w_{{\text{В}}}^{{\text{П}}}~)} \mathord{\left/ {\vphantom {{(1 - w_{{\text{В}}}^{{\text{П}}}~)} {w_{{\text{В}}}^{{\text{П}}}}}} \right. \kern-0em} {w_{{\text{В}}}^{{\text{П}}}}}],$На основании полученного коэффициента детерминации R2 можно сделать вывод, что уравнение (4) может быть использовано для корреляции данных равновесия исследуемой системы.
Одним из параметров, который необходим для описания данных систем, является длина нод жидкость–жидкость (tie-line length, TLL). TLL выражается как разница между концентрациями компонентов системы, присутствующих в фазах и рассчитывается по уравнению 5:
(5)
${\text{TLL}} = {{[{{(w_{{\text{В}}}^{{\text{П}}} - w_{{\text{Н}}}^{{\text{П}}})}^{2}} + {{\left( {w_{{\text{В}}}^{{\text{C}}} - w_{{\text{Н}}}^{{\text{C}}}} \right)}^{2}}]}^{{0.5}}}.$Рассчитанные значения представлены в табл. 4. Из полученных данных видно, что с увеличением исходного состава системы значения TLL возрастают, что указывает на разделение компонентов системы. Стоит отметить, что для образования данной системы необходимо меньшее количество реагентов по сравнению с ранее описанными двухфазными водными системами на основе полиэтиленгликоля [22].
Таблица 4.
Равновесные составы фаз и значения параметров TLL для системы ППГ 425–NaNO3–H2O при 298.15 К
| Нода жидкость–жидкость |
Нижняя фаза | Верхняя фаза | TLL | ||
|---|---|---|---|---|---|
| ${{w}^{{\text{П}}}}$ | ${{w}^{{\text{С}}}}$ | ${{w}^{{\text{П}}}}$ | ${{w}^{{\text{С}}}}$ | ||
| 1 | 19.63 | 19.05 | 74.47 | 5.37 | 56.52 |
| 2 | 10.66 | 23.01 | 78.18 | 5.49 | 69.76 |
| 3 | 4.42 | 31.36 | 84.67 | 5.48 | 84.32 |
| 4 | 3.22 | 36.14 | 86.62 | 5.48 | 88.85 |
В качестве альтернативной экологически безопасной экстракционной системы для извлечения ионов Fe(III), Zn (II) и Cu(II) из солянокислых водных растворов нами была предложена изученная система на основе полипропиленгликоля 425 и нитрата натрия. В процессах гидрометаллургии исследуемые металлы зачастую содержатся в солянокислых растворах выщелачивания, где содержание HCl может варьироваться в широком диапазоне в зависимости от условий проведения процесса. Принципиальным отличием предложенной экстракционной системы на основе ППГ 425 и NaNO3 от существующих является возможность ее образования при введении в систему высоких концентраций HCl (до 4 моль/л).
Были получены зависимости степени извлечения металлов от времени контакта фаз в диапазоне от 5 до 60 мин для определения времени установления экстракционного равновесия при извлечении ионов Fe(III), Zn (II) и Cu(II) в системе ППГ 425–NaNO3–H2O. Исходя из полученных результатов установлено, что постоянное значение степени извлечения достигается в промежутке от 15 до 20 мин. Таким образом, время перемешивания в течении 20 мин было выбрано для изучения межфазного распределения исследуемых ионов металлов в системе ППГ 425–NaNO3–H2O.
Содержание металлов в растворе выщелачивания компонентов электронных устройств может варьироваться в широком диапазоне. Изучено влияние исходной концентрации Fe(III), Zn(II) и Cu(II) в диапазоне концентраций от 0.01 до 0.5 моль/л (рис. 2).
Рис. 2.
Изотермы экстракции Fe(III), Zn(II) и Cu(II) в системе ППГ 425 (30 мас. %)–NaNO3 (16 мас. %)– H2O; СHCl = 2 моль/л.

На рис. 1 представлены изотермы экстракции металлов в системе ППГ 425 (30 мас. %)–NaNO3 (16 мас. %)–H2O. Прямолинейный характер полученных зависимостей свидетельствует о том, что коэффициент распределения постоянен и не зависит от исходной концентрации металлов в растворе, что важно для моделирования и реализации технологического процесса. Угол наклона изотермы экстракции, при этом, соответствует коэффициенту распределения металла.
Как было упомянуто выше, растворы выщелачивания – это, в основном, водные растворы с высокой концентрацией соляной кислоты (более 1 моль/л). К тому же концентрация Cl– является не только определяющим фактором в образовании преобладающих анионных комплексов металлов в растворе, но и влияет на распределение фазообразующей соли и полимера в двухфазной водной системе. На рис. 3 представлена зависимость степени извлечения Fe(III), Zn(II), Cu(II) от исходной концентрации HCl в диапазоне от 0.1 до 4 моль/л.
Рис. 3.
Зависимость степени извлечения Fe(III), Zn(II) и Cu(II) от содержания соляной кислоты в системе ППГ 425 (30 мас. %)–NaNO3 (16 мас. %)–H2O; С(Me)исх. = 0.01 моль/л.
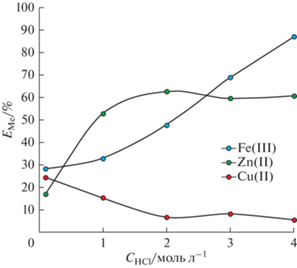
Из полученных результатов видно, что увеличение содержания HCl в системе приводит к возрастанию степени извлечения Fe(III) и Zn(II). При этом в случае Zn(II) максимальная степень извлечения 62.5% достигается при концентрации HCl 2 моль/л. Похожий эффект наблюдался при экстракции Zn(II) аминами и солями четвертичных аммониевых оснований [23]. При этом извлечение Cu(II) снижается с увеличением концентрации HCl, что позволяет селективно извлекать Fe(III) и Zn(II) из солянокислых растворов в системе ППГ 425–NaNO3–H2O без введения дополнительных экстрагентов.
Проведены исследования экстракции Fe(III), Zn(II) и Cu(II) в системе ППГ 425 (30 мас. %)– NaNO3 (16 мас. %)–H2O с добавлением хлорида натрия в диапазоне его концентраций от 0.1 до 3 моль/л (рис. 4).
Рис. 4.
Зависимость степени извлечения Fe(III), Zn(II) и Cu(II) от содержания хлорида натрия в системе ППГ 425 (30 мас. %)–NaNO3 (16 мас. %)–H2O; С(Me)исх. = 0.01 моль/л.
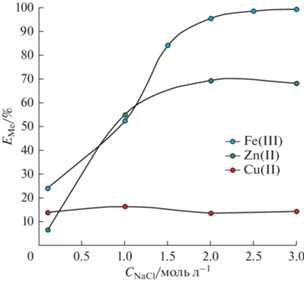
Из полученных данных установлено, что увеличение содержания NaCl приводит к увеличению степени извлечения ионов Fe(III) и Zn(II), а в случае Cu(II) показатели экстракции практически не изменяются. По результатам табл. 5 видно, что при извлечении ионов металлов из 3 М раствора хлорида натрия с использованием системы на основе ППГ 425 и нитрата натрия, коэффициенты разделения для Fe(III) и Zn(II) от Cu(II) составляют 956.65 и 14.60, соответственно. Такая экстракционная система потенциально может быть использована для задач разделения ионов Fe(III) и Zn(II) от Cu(II) из хлоридного раствора при совместном их присутствии.
Таблица 5.
Количественные характеристики экстракции Fe(III), Zn(II) и Cu(II) в системе ППГ 425 (30 мас. %)–NaNO3 (16 мас. %)–H2O при разных содержаниях NaCl
| Концентрация NaCl, моль/л | Коэффициент распределения | Коэффициент разделения | |||
|---|---|---|---|---|---|
| Fe | Zn | Cu | Fe/Cu | Zn/Cu | |
| 0.1 | 0.97 | 0.60 | 0.37 | 2.60 | 1.60 |
| 1.0 | 7.95 | 2.39 | 0.32 | 25.02 | 7.52 |
| 2.0 | 32.65 | 4.30 | 0.24 | 133.62 | 17.60 |
| 3.0 | 262.50 | 4.01 | 0.27 | 956.65 | 14.60 |
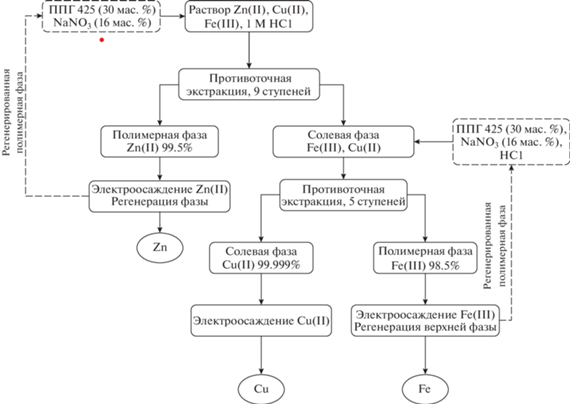
На основании вышеприведенных данных предложена схема разделения смеси ионов металлов Fe(III), Cu(II) и Zn(II) в качестве модельного состава раствора выщелачивания печатных плат с использованием системы ППГ 425–NaNO3–H2O (рис. 5). Схема включает в себя последовательные стадии экстракции и реэкстракции ионов металлов при изменении концентрации соляной кислоты, которые могут быть успешно осуществлены с помощью каскада смесителей-отстойников. Солянокислый раствор выщелачивания подается на первую ступень каскада, состоящую из 9 экстракторов, работающих в режиме противоточной экстракции. Условия проведения экстракции соответствуют 1 М HCl, 16 мас. % NaNO3, 30 мас. % ППГ 425. Полимерная фаза после экстракции содержит Zn(II) c чистотой 99.5%, солевая фаза – ионы Fe(III) и Cu(II). Далее концентрацию HCl в солевой фазе увеличивают до 4 М для повышения βFe/Cu в предложенной двухфазной водной системе. Раствор подается на разделение во вторую часть каскада, состоящую из 5 ступеней, что приводит к выделению меди с чистотой 99.999%. При этом полимерная фаза насыщена Fe(III) с чистотой 98.5%. Все фазы, содержащие очищенные металлы, являются водными, соответственно, не требуется стадия реэкстракции. В дальнейшем металлы могут быть выделены простым осаждением, а регенерированные фазы повторно направлены в экстракционный каскад.
ЗАКЛЮЧЕНИЕ
Предложена и охарактеризована новая экстракционная система на основе полипропиленгликоля 425 и нитрата натрия. Изучено фазовое равновесие жидкость–жидкость в зависимости от концентрации HCl при температуре 298.15 К. На основании полученных данных была предложена система с составом ППГ 425 (30 мас. %)–NaNO3 (16 мас. %) для изучения экстракционных свойств. Были изучены количественные характеристики экстракции ионов Fe(III), Zn(II) и Cu(II) в зависимости от концентраций HCl и NaCl с данным составом. На основании полученных данных была предложена технологическая схема разделения ионов Fe(III), Zn(II) и Cu(II) из солянокислых растворов. Разработанная схема позволяет выделить все металлы с высокой чистотой на каскаде смесителей-отстойников, состоящем из 14 ступеней, работающих в режиме противоточной экстракции.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-24170.
Список литературы
Li H., Eksteen J., Oraby E. Hydrometallurgical recovery of metals from waste printed circuit boards (WPCBs): Current status and perspectives – A review. Resources, Conservation and Recycling 2018, 139, 122–139. https://doi.org/10.1016/j.resconrec.2018.08.007
da Silva N.R., Ferreira L.A., Teixeira J.A., Uversky V.N., Zaslavsky B.Y. Effects of sodium chloride and sodium perchlorate on properties and partition behavior of solutes in aqueous dextranpolyethylene glycol and polyethylene glycol-sodium sulfate two-phase systems // J. Chromatography A 2019, 1583, 28−38. https://doi.org/10.1016/j.chroma.2018.11.015
Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Interphase Distribution of Caffeine and Coumarin in Extraction Systems with Polyethylene Glycol and Sodium Sulfate. Theoretical Foundations of Chemical Engineering 2019, 53, 996−100. https://doi.org/10.1134/S0040579519060174
Teixeira A.G., Agarwal R., Ko K.R., Grant-Burt J., Leung B.M., Frampton J.P. Emerging biotechnology applications of aqueous two-phase systems. Advanced Healthcare Materials 2018, 7, 1701036. https://doi.org/10.1002/adhm.201701036
Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Extraction of Monocarboxylic Acids from Diluted Solutions with Polyethylene Glycol. Theoretical Foundations of Chemical Engineering 2019, 53, 871−874. https://doi.org/10.31044/1684-5811-2018-19-7-303-307
Zinov’eva I.V., Zakhodyaeva Y.A., Voshkin A.A. Data on the extraction of benzoic, salicylic and sulfosalicylic acids from dilute solutions using PEG-based aqueous two-phase systems. Data in Brief 2020, 28, 105033. https://doi.org/10.1016/j.dib.2019.105033
Patrício P.R., Mesquita M.C., Mendes da Silva L.H., Hespanhol da Silva M.C. Application of aqueous two-phase systems for the development of a new method of cobalt(II), iron(III) and nickel(II) extraction: A green chemistry approach. Journal of Hazardous Materials 2011, 193, 311−318. https://doi.org/10.1016/j.jhazmat.2011.07.062
Milevskiy N.A., Boryagina I.V., Karpukhina E.A., Kuznetsov V.N., Kabanova E.G., Effect of sodium chloride and pH on the composition of the equilibrium phases and the partition of palladium(II) in the aqueous two-phase system PEG1500–Na2SO4–water // J. Chemical & Engineering Data, 2021, 66, 1021–1031. https://doi.org/10.1021/acs.jced.0c00832
Bulgariu L., Bulgariu D. Extraction of gold(III) from chloride media in aqueous polyethyleneglycol-based two-phase system. Separation and Purification Technology 2011, 80, 620−625. https://doi.org/10.1016/j.seppur.2011.06.018
Bulgariu L., Bulgariu D. Extraction of metal ions in aqueous polyethylene glycol-inorganic salt two-phase systems in the presence of inorganic extractants: correlation between extraction behavior and stability constants of extracted species. Journal Chromatography A 2008, 1196−1197, 117−124. https://doi.org/10.1016/j.chroma.2008.03.054
Yu P., Huang K., Zhang C., Xie K., He X., Liu H. One-Step Separation of Platinum, Palladium, and Rhodium: A Three-Liquid-Phase Extraction Approach. Industrial & Engineering Chemistry Research 2011, 50, 9368−9376. https://doi.org/10.1021/ie200883u
Zakhodyaeva Y.A., Zinov’eva I.V., Voshkin A.A. Extraction of Iron(III) Chloride Complexes Using the Polypropylene Glycol 425–NaCl–H2O System. Theoretical Foundations of Chemical Engineering 2019, 53, 735–740. https://doi.org/10.1134/S0040579519050373
Zakhodyaeva Y.A., Zinov’eva I.V., Tokar E.S., Voshkin A.A. Complex extraction of metals in an aqueous two-phase system based on poly(ethylene oxide) 1500 and sodium nitrate. Molecules 2019, 24, 4078. https://doi.org/10.3390/molecules24224078
Ferreira L.A., Teixeira J.A., Mikheeva L.M., Chait A., Zaslavsky B.Y. Effect of salt additives on partition of nonionic solutes in aqueous PEG−sodium sulfate two-phase system // J. Chromatography A 2011, 1218, 5031−5039. https://doi.org/10.1016/j.chroma.2011.05.068
Pirdashti M., Movagharnejad K., Rostami A.A., Bakh-shi H., Mobalegholeslam P. Liquid−liquid equilibria, electrical conductivity, and refractive indices of Poly(ethylene glycol) + sodium sulfate + guanidine hydrochloride aqueous two-phase system: Correlation and thermodynamic modeling. Fluid Phase Equilibria 2016, 417, 29−40. https://doi.org/10.1016/J.FLUID.2016.02.019
Shahbazinasab M.-K., Rahimpour F. Liquid−Liquid Equilibrium Data for Aqueous Two-Phase Systems Containing PPG725 and Salts at Various pH Values // J. Chemical & Engineering Data 2012, 57, 1867−1874. https://doi.org/10.1021/je300266r
Nascimento R.G., Fontan R.d.C.I., Ferreira Bonomo R.C., Veloso C.M., Castro S.d.S., Santos L.S. Liquid−Liquid Equilibrium of Two-Phase Aqueous Systems Composed of PEG 400, Na2SO4, and Water at Different Temperatures and pH Values: Correlation and Thermodynamic Modeling // J. Chemical & Engineering Data 2018, 63, 1352−1362. https://doi.org/10.1021/ACS.JCED.7B00947
Barbosa A.A., Bonomo R.C.F., Martins C.V., Fontan R.C.I., Junior E.C.S., Minim L.A., Pignata M.C. Equilibrium Data and ́ Physical Properties of Aqueous Two Phase Systems Formed by PEG (1500 and 4000) g mol–1 + + Sodium Sulfate + Water at Different Temperatures and pH 2. Journal of Chemical & Engineering Data 2016, 61, 3−11. https://doi.org/10.1021/JE5008586
Liu Y., Feng Y., Zhao Y. Liquid-Liquid Equilibrium of various Aqueous Two-Phase Systems: Experiment and correlation // J. Chemical & Engineering Data 2013, 58, 400−453. https://doi.org/10.1021/je400453b
Ivanov A.V., Figurovskaya V.N., Ivanov V.M. Molecular absorption spectroscopy of 4-(2-pyridilazo)resorcinol complexes as alternative for the atomic absorption spectroscopy. Moscow University Chemical Bulletin 1992, 33, 570–574.
Othmer D.F., Tobias P.E. Liquid-Liquid Extraction Data – The Line Correlation. Industrial & Engineering Chemistry 1942, 34, 693. https://doi.org/10.1021/IE50390A600
Zakhodyaeva Y.A., Rudakov D.G., Solov’ev V.O., Voshkin A.A., Timoshenko A.V. Liquid–Liquid Equilibrium of Aqueous Two-Phase System Composed of Poly(Ethylene Oxide) 1500 and Sodium Nitrate // J. Chemical & Engineering Data 2019, 64, 3, 1250–1255. https://doi.org/10.1021/acs.jced.8b01138
Singh O., Tandon S. Extraction of cadmium as chloride by high molecular weight amines and quaternary ammonium salt // J. Inorganic and Nuclear Chemistry 1975, 37, 609–612. https://doi.org/10.1016/0022-1902(75)80396-4
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии