Теоретические основы химической технологии, 2023, T. 57, № 2, стр. 218-227
Концентрационное распределение молекул и частиц в модельной системе: Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции
З. К. Маймеков a, *, Д. А. Самбаева b, Ж. Б. Изаков a, Н. Т. Шайкиева a, М. Долаз a, М. Кобья a
a Кыргызско-Турецкий Университет “Манас”
Бишкек, Кыргызская Республика
b Кыргызский государственный технический университет им. И. Раззакова
Бишкек, Кыргызская Республика
* E-mail: zarlyk.maymekov@manas.edu.kg
Поступила в редакцию 27.01.2023
После доработки 30.01.2023
Принята к публикации 01.02.2023
- EDN: EIYWAT
- DOI: 10.31857/S0040357123020069
Аннотация
В практических условиях одним из возможных решений проблемы очистки сероводородсодержащих промышленных сточных вод является электрохимическое окисление сульфидов. С учетом этих обстоятельств, в работе рассмотрена модельная система Fe–NaCl–Na2S–H2SO4–H2O, собрана экспериментальная установка и изучен процесс электрокоагуляции в широких пределах изменения температуры (288–308 К) водного раствора сероводорода. Выявлены оптимальные соотношения исходных компонентов в системе. Определены экспериментальные и расчетные водородные показатели раствора (pH). Осуществлено термодинамическое моделирование системы при минимизации энергии Гиббса и установлено концентрационное распределение отдельных молекул и частиц (катионы, анионы) в растворе. Составлены возможные химические реакции, протекающие в системе Fe–NaCl–Na2S–H2SO4–H2O при электрокоагуляции сероводородсодержащей сточной воды. Построены диаграммы Eh–pH для сравнения величины окислительного-восстановительного потенциала системы: Fe–H2O, Fe–H2O–S и Fe–NaCl–Na2S–H2SO4–H2O на основе установленных концентраций железо и серосодержащих частиц в растворе. Получена расчетная формула для определения величины окислительного-восстановительного потенциала (Eh) системы.
ВВЕДЕНИЕ
Сероводород (Н2S) токсичный, плохо растворимый газ в воде (4.47 г Н2S на 1 л Н2О или 0.13 моль/л), вопреки этому он обнаруживается в сточных водах многих промышленных производств [1–4]. Например, Н2S в сточных водах составляет (мг/л) [5, 6]: в заводах по переработке нефти – до 60 000; в предприятиях цветной металлургии от 10 до1500; в черной металлургии при грануляции доменного шлака – 30; в производстве синтетических жирных кислот – 40; в производстве искусственного волокна – 20; в дренажных и пластовых вод при разработке серных руд, при выплавке серы от 50 до 200. Соответственно, требуется удаление из воды сероводорода на основе различных физико-химических методов путем осуществления химической диагностики и анализа концепций наилучших доступных технологий и зеленой химии [7]. Исходя из этих положений выявлено, что выделение из воды молекулярного сероводорода обусловлено за счет пленочной и вакуумной дегазации, а также термической деаэрации. При этом одним из возможных решений проблемы очистки серосодержащих вод в практических условиях является электрохимическое окисление сульфидов [4], научные основы которых приведены в работе Гаррелса и Криста [8], где рассмотрены растворы, минералы и их равновесные характеристики. В работе Биерната и Робинса [9] рассмотрены двух- и трехкомпонентные системы: железо–вода, железо–вода–сера в пределах изменения температуры от 298 до 673 К и построены их диаграммы в виде Eh–pH. Равновесное состояние многокомпонентных солевых систем, а также межфазное распределение ионов в массообменных процессах изучены в работах [10–18]. Отмечено, что концентрационное распределение молекул, простых и сложных ионов в пятикомпонентной системе: Fe–NaCl–Na2S–H2SO4–H2O обусловленная с протеканием процесса электрокоагуляции остаются открытыми.
С учетом изложенных выше обстоятельств, в настоящей работе определены основные цели и задачи исследования: изучение процесса электрокоагуляции в модельной системе: Fe–NaCl–Na2S–H2SO4–H2O; экспериментальное определение оптимальных соотношений исходных компонентов и водородного показателя раствора; осуществление термодинамического моделирования системы при минимуме энергии Гиббса и расчет физико-химических и термодинамических параметров системы; установление концентрационного распределения молекул, катионов и анионов в сероводородсодержащем водном растворе; сравнение величины pH, Eh системы: Fe–NaCl–Na2S–H2SO4–H2O; Fe–H2O и Fe–H2O–S [9] по диаграмме Eh–pH.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
C целью изучения процесса электрокоагуляции в модельной системе: Fe–NaCl–Na2S–H2SO4–H2O собрана экспериментальная установка, которая состоит из электролитической ячейки (рис. 1). В качестве анода служила железная пластина, а катода – нержавеющая стальная пластина. Электролитическая ячейка (реактор) изготовлена из цилиндрического оргстекла высотой 0.11 м и диаметром 0.095 м. Расстояние между электродами для всех тестов составляло 0.015 м. Электроды подключены к источнику питания постоянного тока (GW Instek, модель SPS-606, 0-6 А, 0-60 В). Ячейка заполнена водным раствором сульфида натрия с концентрацией 500 млн–1 приготовленного растворением Na2S в ультра дистиллированной воде. Перемешивание раствора осуществлено магнитной мешалкой.
Рис. 1.
Экспериментальная установка для изучения модельной системы: Fe–NaCl–Na2S–H2SO4–H2O и осуществления электрокоагуляции сероводород-содержащей сточной воды: (а) – начальный период опыта; (б) – в момент электрокоагуляции раствора.

Отмечено, что источником сероводорода в растворе служил сульфид натрия. Следует отметить, что в водах, где водородный показатель больше 8.5, сероводород встречается в виде сульфида и гидросульфида, поэтому с целью перевода его в H2S с последующей его дегазации необходимо подкисление воды с технической кислотой, в частности соляной или серной. Поэтому, в модельную систему включена серная кислота. В процессе электрокоагуляции модельных сульфидных сточных вод водородный показатель (рН 7.5) регулярно контролировался на основе 0.1 н. раствора H2SO4 и 0.1 н. NaOH. Оптимальная концентрация фонового электролита достигнута при добавлении 3 г NaCl к 500 мл сероводородсодержащей сточной воды. Опыты проводились при комнатной температуре (298 К). Перед каждым экспериментом электроды тщательно очищались. Пробы отбирались из ячейки с интервалами 5 и 10 мин. В ходе эксперимента пробы, отобранные через определенные промежутки времени из реактора электрокоагуляции, фильтровали с помощью мембранного фильтра. Аналитическое определение сульфида в пробах проведено по стандартной йодометрической методике [19]. Эффективность удаления (${{R}_{e}}$, %) сульфид-иона из сточной воды рассчитана по (1) формуле и составила 99%:
где Co и C – начальная (500 мг/л) и конечная (0.01 мг/л) концентрации сульфид-иона в растворе.На основании экспериментальных данных определено оптимальное соотношение компонентов в 1 кг водном растворе, т.е. в химической матрице расчета системы содержались (г): Fe – 2.15; NaCl – 3.0; Na2S – 2.62; H2SO4 – 3.99.
С использованием экспериментально определенной химической матрицы осуществлено термодинамическое моделирование системы. В расчетных экспериментах температура раствора изменялась в широких пределах от 288 до 308 К, а давление составило 0.1 МПа. Равновесные концентрации молекул и частиц в системе рассчитаны при минимизации энергии Гиббса [20, 21], где сначала составлен банк термодинамических данных (Н, S, U, G) для каждого вещества: Fe, NaCl, Na2S, H2SO4, H2O, катионов и анионов [22, 23] и для их возможных соединений в отдельных фазах исходя из: водного раствора (a_sprons98.DB); газа (g_sprons98.DB); жидкости (I_reid.DB); твердых частиц (s_sprons98.DB и s_Yokokawa.DB [15]). В расчетах использован программный комплекс “Селектор” [20, 21].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В экспериментальных исследованиях хлористый натрий использовался в качестве электролита, Na2S для получения сероводорода, а серная кислота для регулирования pH раствора. Оптимальное соотношение компонентов в водном растворе (1 кг) при котором pH 7.5, как отмечено выше найдено экспериментальным путем и составило (г): Fe (2.15)–NaCl (3.0)–Na2S (2.62)–H2SO4 (3.99)–H2O (1000). В процессе электрокоагуляции отмечено образование сульфида железа в виде осадка черного цвета (рис. 1б). Концентрационное распределение элементов в отдельных фазах и ионов (катионов, анионов) в растворе, а также величины физико-химических (V, М, ρ, Eh, I, TDS, Cp) и термодинамических параметров (G, H, S, U) рассчитаны при минимизации энергии Гиббса [20, 21, 24] в широких пределах изменения температуры (288–308 К) и давлении 0.1 МПа (табл. 1).
Таблица 1.
Физико-химические и термодинамические параметры системы: Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции. Водный раствор: V = 0.001 м3, М = 1.0091 кг, ρ = 1.01 × 103 кг/м3, TDS = 8413.1 мг/кг растворе; вес: 99.73% Н2О + 0.27% FeS при P = 0.1 МПа
| T | Eh | pH | I | G | H | S | U | Cp |
|---|---|---|---|---|---|---|---|---|
| (K) | (В) | (–) | (–) | (мДж) | (мДж) | (мДж/K) | (мДж) | (гДж) |
| 288 | –0.238 | 8.10 | 0.1372 | –13.20 | –15.99 | 3.77 | –15.78 | 997.04 |
| 293 | –0.234 | 7.94 | 0.1371 | –13.22 | –15.97 | 3.84 | –15.76 | 997.38 |
| 298 | –0.229 | 7.77 | 0.1370 | –13.24 | –15.95 | 3.91 | –15.74 | 998.82 |
| 303 | –0.225 | 7.62 | 0.1369 | –13.26 | –15.93 | 3.98 | –15.72 | 998.15 |
| 308 | –0.221 | 7.47 | 0.1367 | –13.26 | –15.91 | 4.05 | –15.70 | 998.34 |
Получена формула для расчета величины окислительного-восстановительного потенциала (Eh, В) системы: Fe–NaCl–Na2S–H2SO4–H2O в зависимости от водородного показателя раствора (pH) (табл. 1, рис. 2):
Рис. 2.
Зависимости окислительного-восстановительного потенциала (Eh, В) от водородного показателя (pH) для системы: Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции.

Из формулы (2) видно, что окислительно-восстановительный потенциал (Eh) системы: Fe–NaCl–Na2S–H2SO4–H2O имеет отрицательное значение (Eh < 0) и с возрастанием температуры раствора от 288 до 308 К увеличивается от –0.238 В до –0.221 В. Среда реакции восстановительная (Eh < 0), и возможно образование сульфидов железо типа FeS и FeS2 на основе восстановленной серы в растворе. Водородный показатель (pH) системы с увеличением температуры раствора от 288 до 308 К изменяется в пределах от 8.1 до 7.5. Среднее расчетное значение pH составляет 7.77 при оптимальных соотношениях исходных компонентов в растворе (г): Fe(2.15)–NaCl (3.0)–Na2S (2.62)–H2SO4 (3.99)–H2O (1000) и практически соответствует экспериментальным значениям pH 7.5. Разница pHexp и pHcalc составляет 3.3%. Из характеристик фаз также следует эквивалентность (100%), где водный раствор составляет 99.73 вес. %, а количество сульфида железо равно 0.27%. Протекание и направление процесса электрокоагуляции в системе Fe–NaCl–Na2S–H2SO4–H2O подтверждено знаками термодинамических величин, таких как энергия Гиббса (G), энтальпии (H) и внутренней энергии (U), где они отрицательные, и с увеличением температуры раствора от 288 до 308 К величина H, U растет, а G уменьшается; ионная сила раствора (I) незначительно уменьшается (табл. 1). Энтропия (S) и теплоемкость (Cp) с увеличением температуры растет (от 3.77 до 4.05 мДж/K и 997.04 до 998.34 гДж, соответственно). Концентрационное распределение элементов в системе (при P = 0.1 МПа): Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции представлено в табл. 2.
Таблица 2.
Концентрационное распределение элементов в системе: Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции. P = 0.1 МПа
| Элементы | Fe | Cl | Na | S | H | O |
|---|---|---|---|---|---|---|
| Состав | 0.038 | 0.051 | 0.118 | 0.074 | 111.09 | 55.67 |
| кол. молей | 1.61 × 10–2 | 5.13 × 10–2 | 1.18 × 10–1 | 2.95 × 10–2 | 8.06 × 10–3 | 1.26 × 10–1 |
| мг/кг раствор | 9 × 102 | 1.82 × 103 | 2.72 × 103 | 9.47 × 102 | 8.12 | 2.02 × 103 |
Из табл. 2 видно, что содержание элементов в 1 кг раствора составляет (мг): Fe – 900; Cl – 1820; Na – 2720; S – 947; H – 8.12; O – 2020. Количество железа и серы достаточно для образования осадка в виде сульфидов в растворе (FeS, FeS2) за счет окислительно-восстанавительных сред, обусловленный присутствием Cl, O и H. Концентрационное распределение: Fe, Na, S, H, O, Cl содержащих катионов и анионов представлено в табл. 3.
Таблица 3.
Концентрационное распределение анионов и катионов в водном растворе системы: Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции. P = 0.1 МПа
| Анионы | Cl– | HFe2O– | HS– | ${\text{HSO}}_{3}^{ - }$ | ${\text{HSO}}_{4}^{ - }$ | |
| кол.молей | 5.07 × 10–2 | 8.06 × 10–3 | 8.09 × 10–8 | 3.42 × 10–15 | 7.27 × 10–9 | |
| мг/кг раствора | 1.8 × 103 | 1.04 × 103 | 2.67 × 10–3 | 2.77 × 10–10 | 7.05 × 10–4 | |
| Анионы | ${\text{NaSO}}_{4}^{ - }$ | ${\text{S}}_{2}^{{2 - }}$ | ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{{2 - }}$ | ${\text{SO}}_{3}^{{2 - }}$ | ${\text{HSO}}_{3}^{ - }$ | OH– |
| кол.молей | 5.07 × 10–3 | 1.04 × 10–16 | 1.0 × 10–12 | 5.67 × 10–14 | 2.45 × 10–2 | 6.4 × 10–7 |
| мг/кг раствора | 6.03 × 102 | 6.65 × 10–12 | 1.13 × 10–7 | 4.54 × 10–9 | 2.35 × 103 | 1.09 × 10–2 |
| Катионы | Fe2+ | FeOH+ | Na+ | H+ | ||
| кол.молей | 9.0 × 10–12 | 1.1 × 10–13 | 1.1 × 10–1 | 1.0 × 10–8 | ||
| мг/кг раствор | 5.0 × 10–7 | 8.5 × 10–9 | 2.5 × 103 | 1.1 × 10–5 | ||
Из табл. 3 видно, что в растворе содержание серосодержащих анионов (HS–, ${\text{HSO}}_{3}^{ - }$, ${\text{HSO}}_{4}^{ - }$, ${\text{NaSO}}_{4}^{ - }$, ${\text{S}}_{2}^{{2 - }}$, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{{2 - }}$, ${\text{SO}}_{3}^{{2 - }}$, ${\text{SO}}_{4}^{{2 - }}$) значительное. Из них ${\text{SO}}_{4}^{{2 - }}$ содержится 2.35 × 103 мг в кг растворе. Возможность протекания реакции типа: H2S + O2 + + H2O = ${\text{SO}}_{4}^{{2 - }}$ + Н+ наиболее вероятное. Результаты показали, что с ростом температуры от 288 до 308 К концентрация катионов и анионов остаются постоянными, т.е. влияние температуры не наблюдается. Напротив, концентрации отдельных молекул, в том числе газов: FeO, H2, H2S, HCl, HFeO2, NaCl, NaOH с ростом температуры в водном растворе изменяются значительно (табл. 4).
Таблица 4.
Концентрационное распределение отдельных молекул и газов в водном растворе системы: Fe–NaCl–Na2S–H2SO4–H2O при различных температурах процесса электрокоагуляции. P = 0.1 МПа
| FeO | |||||
|---|---|---|---|---|---|
| Температура, K | 288 | 293 | 298 | 303 | 308 |
| кол.молей | 3.84 × 10–17 | 8.18 × 10–17 | 1.72 × 10–16 | 3.49 × 10–16 | 6.82 × 10–16 |
| мг/кг раствора | 2.76 × 10–12 | 5.88 × 10–12 | 1.24 × 10–11 | 2.51 × 10–11 | 4.90 × 10–11 |
| H2 | |||||
| кол.молей | 7.12 × 10–12 | 9.92 × 10–12 | 1.36 × 10–11 | 1.85 × 10–11 | 2.51 × 10–11 |
| мг/кг раствора | 1.44 × 10–8 | 2.00 × 10–8 | 2.74 × 10–8 | 3.72 × 10–8 | 5.07 × 10–6 |
| H2S | |||||
| кол.молей | 7.51 × 10–9 | 9.52 × 10–9 | 1.19 × 10–8 | 1.48 × 10–8 | 1.86 × 10–8 |
| мг/кг раствора | 2.56 × 10–4 | 3.24 × 10–4 | 4.04 × 10–4 | 5.04 × 10–4 | 6.32 × 10–4 |
| HCl | |||||
| кол.молей | 8.46 × 10–11 | 1.14 × 10–10 | 1.54 × 10–10 | 2.05 × 10–10 | 2.68 × 10–10 |
| мг/кг раствора | 3.08 × 10–6 | 4.15 × 10–6 | 5.01 × 10–6 | 7.46 × 10–6 | 9.77 × 10–6 |
| HFeO2 | |||||
| кол.молей | 3.91 × 10–18 | 1.13 × 10–17 | 3.15 × 10–17 | 8.28 × 10–17 | 2.05 × 10–16 |
| мг/кг раствора | 3.47 × 10–13 | 1.0 × 10–12 | 2.80 × 10–12 | 7.35 × 10–12 | 1.82 × 10–11 |
| NaCl | |||||
| кол.молей | 5.84 × 10–4 | 5.96 × 10–4 | 6.09 × 10–4 | 6.23 × 10–4 | 6.39 × 10–4 |
| мг/кг раствора | 3.41 × 101 | 3.48 × 101 | 3.56 × 101 | 3.64 × 101 | 3.73 × 101 |
| NaOH | |||||
| кол.молей | 2.99 × 10–8 | 3.06 × 10–8 | 3.09 × 10–8 | 3.13 × 10–8 | 3.20 × 10–8 |
| мг/кг раствора | 1.20 × 10–3 | 1.22 × 10–3 | 1.24 × 10–3 | 1.25 × 10–3 | 1.28 × 10–3 |
| FeS2 (s) | |||||
| кол.молей | – | 2.24 × 10–2 | – | – | – |
| мг/кг раствора | – | 100 | – | – | – |
| Н2 | |||||
| Температура, K | 288 | 293 | 298 | 303 | 308 |
| Парциальное давление, МПа | 8.52 × 10–9 | 1.23 × 10–8 | – | – | – |
| H2S | |||||
| Парциальное давление, МПа | 5.70 × 10–8 | 8.30 × 10–8 | 1.18 × 10–7 | 1.66 × 10–7 | 2.30 × 10–7 |
| O2 | |||||
| Парциальное давление, МПа | 1.00 × 10–70 | 1.04 × 10–69 | 2.66 × 10–68 | 6.10 × 10–67 | 1.20 × 10–65 |
| H2O | |||||
| Парциальное давление, МПа | 1.42 × 10–2 | 1.94 × 10–2 | 2.63 × 10–2 | 3.52 × 10–2 | 4.67 × 10–2 |
| SO2 | |||||
| Парциальное давление, МПа | 6.07 × 10–22 | 2.41 × 10–21 | 9.31 × 10–21 | 3.41 × 10–20 | 1.10 × 10–19 |
С ростом температуры (288–308 К) количество FeO, HFeO2 значительно увеличивается, а H2S меняется от 2.56 × 10–4 мг/кг (288 К) до 6.32 × 10–4 мг/кг (308 К). Результаты, приведенные в табл. 4 подтверждают образование сульфида железа в процессе электрокоагуляции сероводородсодержащей сточной воды. В процессе электрокоагуляции в системе Fe–NaCl–Na2S–H2SO4–H2O выделяется газовая фаза, состоящая из H2, H2S, O2, паров воды и диоксида серы (табл. 4). Парциальное давление газов с ростом температуры повышается, например, для диоксида серы от 6.07 × 10–22 до 1.19 × 10–19 МПа, что и обусловливает связывание Na2S в FeS, FeS2. Таким образом, концентрационное распределение молекул и частиц в системе Fe–NaCl–Na2S–H2SO4–H2O в процессе электрокоагуляции показали разложение Na2S в водном растворе с образованием сероводорода (H2S), и связывание Na2S в виде FeS и FeS2, затем в Fe(OH)3 с выделением элементарной серы в среде кислорода и серной кислоты по реакции: H2S + NaOCl → → S0 + NaCl + H2O, H2S + 4NaOCl → H2SO4 + NaCl, где в дальнейшем серу можно направить на утилизацию.
Результаты проведенных исследований позволяют прогнозировать концентрационное распределение катионов и анионов, отдельных молекул и твердых частиц образующиеся в процессе электрокоагуляции сложной системы, включающие серусодержащих веществ типа: Fe–NaCl–Na2S–H2SO4–H2O. Установлено, что оптимальной концентрацией серной кислоты, которая поддерживает водородный показатель раствора в пределах pH 7.77, является 0.081 н, т.е. 3.99 г в системе Fe–NaCl–Na2S–H2SO4–H2O.
Концентрации частиц и молекул (мг/кг): Fe2+ = 5.0 × 10–7; FeOH+ = 8.5 × 10–9; Н+ = 1.1 × 10–5; FeO = 1.24 × 10–11; HFeO2 = 2.8 × 10–12; H2S(aq) = = 4.04 × 10–4; HS- = 2.67 × 10–3; ${\text{HSO}}_{4}^{ - }$ = 7.05 × 10–4; ${\text{SO}}_{4}^{{2 - }}$ = 2.35 × 103 полученные в системе Fe–NaCl–Na2S–H2SO4–H2O при Т = 298 К, pH 7.77 в дальнейшем использованы для расчета и сравнения окислительного-восстановительного потенциала (Eh, В) системы Fe–H2O (табл. 5) и Fe–H2O–S (табл. 6) по диаграмме Eh–pH [9]. Здесь следует отметить, что в табл. 5 и 6 приведены номера расчетов (6а–26h), уравнение химических реакций и формулы в соответствии с данными работы Биерната и Робинса [9]. В процессах сравнения: в формулы 6а–26h [9] поставлены значения: Fe2+; FeOH+; Н+; FeO; HFeO2; H2S(aq); HS–; ${\text{HSO}}_{4}^{ - }$; ${\text{SO}}_{4}^{{2 - }}$; Fe2+ полученные в настоящей работе и вычислены значение окислительного-восстановительного потенциала (Eh) при Т = 298 К, pH 7.77 с последующим нанесением их на диаграмму Eh–pH (рис. 3 и 4).
Таблица 5.
Система Fe–H2O [9]. Расчет Eh при Т = 298 К, pH 7.77, концентрации (мг/кг): Fe2+ = 5.0 × 10–7; FeOH+ = 8.5 × 10–9; Н+ = 1.1 × 10–5; FeO = 1.24 × 10–11; HFeO2 = 2.8 × 10–12
| № | Химическая реакция | Формула | Eh, В |
|---|---|---|---|
| 6а | FeO + 2H+ + 2e– → Fe + H2O | Eh = –0.045 – 0.0591pH | –0.504 |
| 6b | Fe3O4 + 8H+ + 8e– →3Fe + 4H2O | Eh = –0.086 – 0.0591pH | –0.545 |
| 6с | Fe2O3 + 6H+ + 6e– → 2Fe + 3H2O | Eh = –0.053 – 0.0591pH | –0.512 |
| 7а | Fe3O4 + 2H+ + 2e– → 3FeО + H2O | Eh = –0.212 –0.0591pH | –0.671 |
| 7b | Fe2O3 + 2H+ + 2e– → 2FeО + H2O | Eh = –0.069 – 0.0591pH | –0.528 |
| 7с | 3Fe2O3 + 2H+ + 2e– → 2Fe3О4 + H2O | Eh = 0.214 – 0.0591pH | –0.245 |
| 8а | Fe(OН)2 + 2H+ + 2e– → Fe + 2H2O | Eh = –0.063 – 0.0591pH | –0.522 |
| 8б | FeOОН + 3H+ + 3e– → Fe + 2H2O | Eh = –0.052 – 0.0591pH | –0.511 |
| 8с | Fe(OН)3 + 3H+ + 3e– → Fe + 3H2O | Eh = 0.051 – 0.0591pH | –0.408 |
| 9а | FeОOН + H+ + e– → Fe(OН)2 | Eh = –0.030 – 0.0591pH | –0.489 |
| 9b | Fe(OН)3 + H+ + e– → Fe(OН)3 + H2O | Eh = 0.281 – 0.0591pH | –0.178 |
| 10а | 3FeOОН + H+ + e– → Fe3О4 + 2H2O | Eh = 0.220 – 0.0591pH | –0.239 |
| 10b | 3Fe(OН)3 + H+ + e– → Fe3O4 + 5H2O | Eh = 1.155 – 0.0591pH | 0.695 |
| 15b | FeOН+ + H+ + 2e– → Fe + H2O | Eh = –0.213 – 0.0296pH + 0.0296 lg [FeOH+] | –0.546 |
| 16a | Fe3O4 + 8H+ + 2e– 3Fe2+ + 4H2O | Eh = 0.880 –0.2365pH–0.0296 lg [Fe2+]3 | –0.715 |
| 16b | Fe3O4 + 5H+ + 2e– → 3FeOH+ + H2O | Eh = 0.292 – 0.148pH–0.0292 lg [FeOH+]3 | –0.551 |
| 16d | Fe2O3 + 6H+ + 2e– → 2Fe2+ + 3H2O | Eh = 0.658 – 0.177pH–0.0296 lg ([Fe2+]2) | –0.555 |
| 16e | Fe2O3 + 4H+ + 2e– → 2FeOH+ + H2O | Eh = 0.266 – 0.118pH–0.0296 lg [FeOH+]2 | –0.444 |
| 17a | Fe(OН)3 + 3H+ + e– → Fe2+ + 3H2O | Eh = 0.972 – 0.177pH – 0.0591 lg [Fe2+] | –0.242 |
| 17b | Fe(OН)3 + 2H+ + e– → FeОН+ + 2H2O | Eh = 0.580 – 0.118pH 0.0591 lg [FeОН+] | –0.130 |
| 17d | FeOОН + 3H+ + e– → Fe2+ + 2H2O | Eh = 0.660 – 0.177pH – 0.0591 lg [Fe2+] | –0.554 |
| 17е | FeОOН + 2H+ + e– → FeОН+ + H2O | Eh = 0.268 – 0.118pH –0.0591lg[FeОН+] | –0.442 |
| * | Fe–NaCl–Na2S–H2SO4–H2O | Eh = –0.0176 – 0.0272pH | –0.222 |
Таблица 6.
Система Fe–H2O–S [9]. Расчет Eh при Т = 298 К, pH = 7.77, концентрации (мг/кг): H2S(aq) = 4.04 × 10–4; HS–= 2.67 × 10–3; ${\text{HSO}}_{4}^{ - }$ = 7.05 × 10–4 ; ${\text{SO}}_{4}^{{2 - }}$ = 2.35 × 103; Fe2+ = 5.0 × 10–7
| № | Химическая реакция | Формула | Eh, В |
|---|---|---|---|
| 20а | FeS + 2H+ + 2e– → Fe + H2S | Eh = –0.376 – 0.059pH – 0.0296 lg [H2S(aq)] | –0.791 |
| 20b | FeS + H+ + 2e– → Fe + HS– | Eh = –0.583 – 0.0296pH – 0.0296 lg [HS–] | 0.386 |
| 21a | Fe3O4 + 3H2S + 2H+ + 2e– → 3FeS + 4H2O | Eh = 0.782 – 0.059pH + 0.0296 lg [H2S(aq)]3 | 0.197 |
| 21b | Fe3O4 + 3HS + 5H+ + 2e– → 3FeS + 4H2O | Eh = 1.402 – 0.148pH + 0.0296 lg [HS–]3 | 0.164 |
| 22a | FeS2 + 2H+ + 2e– → FeS + H2S | Eh = 0.165 – 0.059pH – 0.0296 lg [H2S(aq)] | –0.333 |
| 22b | FeS2 + H++ 2e– → FeS + HS– | Eh = –0.372 – 0.029pH – 0.0296 lg [HS–] | –0.562 |
| 23а | FeS2 + 4H++ 2e– → Fe2+ + 2H2S | Eh = –0.133 – 0.118pH – 0.0296 lg ([Fe2+][H2S(aq)]2) | –0.349 |
| 24a | Fe2+ + 2S + 2e– → FeS2 | Eh = 0.421 + 0.0296 lg [Fe2+] | 0.340 |
| 25a | Fe2+ + 2${\text{SO}}_{4}^{{2 - }}$ + 16H+ + 14e– → FeS2 + 8 H2O | Eh = 0.362 – 0.068 pH + 0.0042 lg ([Fe2+][${\text{SO}}_{4}^{{2 - }}$]2) | –0.161 |
| 25c | Fe2+ + 2${\text{HSO}}_{4}^{ - }$ + 14H+ + 14e–→ FeS2 + 8 H2O | Eh = 0.345 – 0.059pH + 0.0042 lg([Fe2+][${\text{HSO}}_{4}^{ - }$]2) | –0.136 |
| 25e | Fe(OН)2 + 2${\text{SO}}_{4}^{{2 - }}$ + 18H+ + 14e– → FeS2 + 10H2O | Eh = 0.412 – 0.076pH + 0.0042 lg [${\text{SO}}_{4}^{{2 - }}$]2 | –0.190 |
| 25f | Fe(OН)2 + 2${\text{HSO}}_{4}^{ - }$ + 16H+ + 14e– → FeS2 + 10H2O | Eh = 0.395 – 0.068pH + 0.0042lg [${\text{HSO}}_{4}^{ - }$]2 | –0.145 |
| 26a | Fe3O4 + 6${\text{HSO}}_{4}^{ - }$ + 50H+ + 44e– → 3FeS2 + 28H2O | Eh = 0.386 – 0.075pH + 0.0013 lg [${\text{SO}}_{4}^{{2 - }}$]6 | –0.185 |
| 26b | Fe3O4 + 6${\text{SO}}_{4}^{{2 - }}$ + 56H+ + 44e– → 3FeS2 + 28H2O | Eh = 0.370 – 0.067 pH + 0.0013 lg [${\text{HSO}}_{4}^{ - }$]6 | –0.161 |
| 26c | Fe(OН)3 + 2${\text{SO}}_{4}^{{2 - }}$ + 19H+ + 15e– → FeS2 + 11H2O | Eh = 0.403 – 0.075 pH + 0.0039 lg[${\text{SO}}_{4}^{{2 - }}$]2 | –0.168 |
| 26d | Fe(OН)3 + ${\text{HSO}}_{4}^{ - }$ + 17H+ + 15e– → FeS2 + 11H2O | Eh = 0.387 – 0.067 pH + 0.0039 lg ([${\text{HSO}}_{4}^{ - }$]2) | –0.144 |
| 26e | Fe2O3 + 4${\text{SO}}_{4}^{{2 - }}$ + 38H+ + 30e– → FeS2 + 19H2O | Eh = 0.383 – 0.075 pH + 0.0020 lg [${\text{SO}}_{4}^{{2 - }}$]4 | –0.188 |
| 26f | Fe3O4 + 4${\text{HSO}}_{4}^{ - }$ + 34H+ + 30e– → 2FeS2 + 19H2O | Eh = 0.367 – 0.067 pH + 0.0020 lg [${\text{HSO}}_{4}^{ - }$]4 | –0.164 |
| 26g | FeOOН + 2${\text{SO}}_{4}^{{2 - }}$ + 19H+ + 15e– → FeS2 + 10H2O | Eh = 0.382 – 0.075 pH + 0.0039 lg [${\text{SO}}_{4}^{{2 - }}$]2 | –0.189 |
| 26h | FeOOН + 2${\text{HSO}}_{4}^{ - }$+ 17H+ + 15e– → FeS2 + 10H2O | Eh = 0.367 – 0.067pH + 0.0039 lg [${\text{HSO}}_{4}^{ - }$]2 | –0.164 |
| * | Fe–NaCl–Na2S–H2SO4–H2O | Eh = –0.0176 – 0.0272pH | –0.222 |
Рис. 3.
Диаграмма системы Fe–H2O при Т = 298 К [9] (линии: сплошные – с участием твердых частиц Fe; пунктирные – растворенные формы Fe; пунктирные с точкой – вода А и В); крестик – результаты настоящей работы при Т = 298 К, pH 7.77, кружок – по формуле Eh = – 0.0176 – 0.0272 pH.

Рис. 4.
Диаграмма системы Fe–H2O–S при Т = 298 К [9] (линии: сплошные – с участием твердых частиц Fe; тонкие сплошные – система S–H2O; пунктирные – растворенные формы Fe; пунктирные с точкой – вода А и В); кружок – результаты настоящей работы при Т = 298 К, pH 7.77, квадрат – по формуле Eh = – 0.0176 – 0.0272pH.
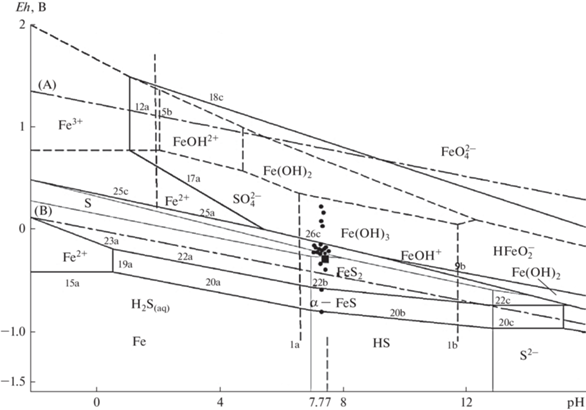
Результаты представленные в табл. 5 и 6 свидетельствуют о протекании сложных окислительно-восстановительных реакций в системе Fe–NaCl–Na2S–H2SO4–H2O с образованием сульфидов железа.
Таким образом, результаты исследований системы: Fe–NaCl–Na2S–H2SO4–H2O методом минимизации свободной энергии Гиббса и полученные концентрационные распределения молекул и частиц (мг/кг): Fe2+ = 5.0 × 10–7; FeOH+ = = 8.5 × 10–9; Н+ = 1.1 × 10–5; FeO = 1.24 × 10–11; HFeO2 = 2.8 × 10–12; H2S(aq) = 4.04 × 10–4; HS– = = 2.67 × 10–3; HSO4- = 7.05 × 10–4; ${\text{SO}}_{4}^{{2 - }}$ = 2.35 × 103 и рассчитанные на их основе Eh и pH (табл. 5 и 6) согласуются с литературными данными, в частности работы [8, 9].
ЗАКЛЮЧЕНИЕ
Процесс электрокоагуляции в многокомпонентной модельной системе: Fe–NaCl–Na2S–H2SO4–H2O протекает сложным концентрационным распределением железо и серосодержащих молекул и частиц в растворе: Fe2+, FeOH+, Н+, FeO, HFeO2, H2S, HS-, HSO4, ${\text{SO}}_{4}^{{2 - }}$, соответственно с увеличением температуры раствора величины окислительного-восстановительного потенциала (Eh) растет от –0.238 до –0.221 В. При этом среда реакции восстановительная (Eh < 0), и возможно образование сульфидов железо типа FeS и FeS2, которые могут перейти в Fe(OH)3 c образованием элементарной серы в среде кислорода и серной кислоты, что и позволило утилизировать серы из сточной воды. Подчеркнуто, что термодинамическое моделирование при минимизации энергии Гиббса, позволило определить распределение молекул и ионов в растворе, и тем самым исключено использование в аналитических целях метода ионной хроматографии в процессе электрокоагуляции.
ОБОЗНАЧЕНИЯ
| Сp | теплоемкость, Дж/К |
| Eh | окислительно-восстановительный потенциал, В |
| G | энергия Гиббса, Дж |
| Н | энтальпия, Дж/кг |
| I | ионная сила раствора |
| М | масса, кг |
| P | давление, Па |
| pH | водородный показатель раствора |
| ${{R}_{e}}$ | эффективность удаления сульфид иона, % |
| r2 | величина достоверности аппроксимации |
| S | энтропия, Дж/К |
| T | температура, К |
| TDS | общее количество растворенных веществ в растворе, мг/кг |
| U | внутренняя энергия, Дж |
| V | объем, м3 |
| ρ | плотность, кг/м3 |
ИНДЕКСЫ
Список литературы
Lin H.W., Kustermans C., Vaiopoulou E., Prevoteau A., Rabaey Yuan K., Pikaar I. Electrochemical oxidation of iron and alkalinity generation for efficient sulfide control in sewers // Water Res. 2017. V. 118. P. 114.
Murugananthan M., Raju G.B., Prabhakar S. Removal of sulfide, sulfate and sulfite ions by electrocoagulation // J. Hazard. Mater. 2004. V. 109. № 1–3. P. 37.
Pikaar I., Rozendal R.A., Yuan Z., Keller J., Rabaey K. Electrochemical sulfide removal from synthetic and real domestic wastewater at high current densities // Water Res. 2011. V. 45. № 6. P. 2281.
Omwene P.I., Celen M., Oncel M.S., Kobya M. Arsenic removal from naturally arsenic contaminated ground water by packed-bed electrocoagulator using Al and Fe scrap anodes // Process Saf. Environ. Prot. 2019. V. 121. P. 20.
Фесенко Л.Н., Черкесов А.Ю., Игнатенко С.И. Методы удаления сероводорода из производственных сточных вод и пути их развития // Вода Magazine. 2016. Т. 102. № 2. С. 22.
Фесенко Л.Н. Очистка воды от сероводорода с использованием электрохимических процессов. Ростов-на-Дону: СКНЦ ВШ, 2001.
Meshalkin V.P. Current Theoretical and Applied Research on Energy- and Resource-Saving Highly Reliable Chemical Process Systems Engineering // Theor. Found. Chem. Eng. 2021. V. 55. № 4. P. 563. [Мешалкин В.П. Актуальные теоретические и прикладные исследования по инжинирингу энергоресурсосберегающих высоконадежных химико-технологических систем // Теор. осн. хим. технол. 2021. Т. 55. № 4. С. 399 ]
Garrels R.M., Christ C.L. Solutions, minerals, and equilibria. New York: Harper & Row, 1965.
Biernat R.J., Robins R.G. High-temperature potential/pH diagrams for the iron-water and iron-water-sulphur systems // Electrochim. Acta. 1972. V. 17. № 7. P. 1261.
Wilhelm E., Battino R. Enthalpy and Internal Energy: Liquids, Solutions and Vapours / Eds. Wilhelm E., Letcher T.M. Royal Society of Chemistry, 2017.
Чудненко К.В. Теория и программное обеспечение метода минимизации термодинамических потенциалов для решения геохимических задач. Дис. … докт. геол.-мин. наук. – Иркутск: Инст. геохимии им А.П. Виноградова СО РАН, 2007.
Чудненко К.В. Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения / Под ред. Шарапова В.Н. Новосибирск: Академ. Изд. Гео, 2010
Авченко О.В., Чудненко К.В., Александров И.А. Физико-химическое моделирование минеральных систем: монография. Москва: Юрайт, 2018.
Musov O., Savchenko M., Levchuk I., Frolova L. Thermodynamic modeling of oxygen dissolvation in water // Proc. of ONPU. 2022. V. 65. № 1. P. 90.
Yokokawa H. Tables of thermodynamic properties of inorganic compounds // J. Natl. Chem. Lab. Ind. 1988. V. 305. P. 27.
Thermodderm. Thermochemical and Mineralogical Tables for Geochemical Modeling. Available online: https://thermoddem.brgm.fr (accessed on 1 July 2020).
Palyanova G.A., Chudnenko K.V., Zhuravkova T.V. Thermodynamic properties of solid solutions in the Ag2S–Ag2Se system // Thermochim. Acta. 2014. V. 575. P 90.
Zinov’eva I.V., Kozhevnikova A.V., Milevskii N.A., Zakhodyaev Yu.A., Voshkin A.A. Liquid–Liquid Equilibrium And Extraction Capacity of the PPG 425–NaNO3–H2O System // Theor. Found. Chem. Eng. 2022. V. 56. № 4. P.417. [Зиновьева И.В., Кожевникова А.В., Милевский Н.А., Заходяева Ю.А., Вошкин А.А. Равновесие жидкость–жидкость и экстракционная способность системы ППГ425–NaNO3–H2O // Теор. осн. хим. технол. 2022. Т. 56. № 4. С. 410]
Standard Methods for the Examination of Water and Wastewater. 21st Edition / Eds. Eaton A.D., Clesceri L.S., Rice E.W., Greenberg A.E., Franson M.A.H. Washington DC: Amer. Public. Health Assn. 2005.
Karpov I.K., Chudnenko K.V., Kulik D.A., Bychinski V.A. The convex programming minimization of five thermodynamic potentials other than Gibbs energy in geochemical modeling // Am. J. Sci. 2002. V. 302. № 4. P. 281.
Karpov I.K., Chudnenko K.V., Kulik D.A. Modeling chemical mass transfer in geochemical processes; thermodynamic relations, conditions of equilibria and numerical algorithms // Am. J. Sci. 1997. V. 297. № 8. P. 767.
Kulov N.N., Ochkin A.V. Method for Calculating the Density of Mixed Solutions of Strong Electrolytes // Theor. Found. Chem. Eng. 2020. V. 54. № 6. P. 1223. [Кулов Н.Н., Очкин А.В. Метод расчета плотности смешанных растворов сильных электролитов // Теор. осн. хим. технол. 2020. Т. 54. № 6. С. 714]
Ochkin A.V., Kulov N.N. Comparison of the Molar Volumes of Some Electrolytes // Theor. Found. Chem. Eng. 2022. V. 56. № 5. P. 644. [Очкин А.В., Кулов Н.Н. Сравнение мольных объемов некоторых электролитов // Теор. осн. хим. технол. 2022. Т. 56. № 5. С. 512].
Sambaeva D., Izakov J., Maymekov T., Kemelov K., Shaykieva N., Ukeleeva A., Maymekov Z. The Impact of road salts on groundwater and estimation of the chlorine ions by hydrogen index // Pol. J. Environ. Stud. 2022. V. 31. № 2. P. 1327.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии


