Теоретические основы химической технологии, 2023, T. 57, № 3, стр. 249-251
Изотопные эффекты воды в равновесиях жидкость–пар при переходе к водно-неэлектролитному растворителю
А. К. Лященко a, *, А. В. Полковниченко a, **, Н. Н. Кулов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: aklyas@mail.ru
** E-mail: anzakhlevniy@rambler.ru
Поступила в редакцию 03.03.2023
После доработки 14.03.2023
Принята к публикации 15.03.2023
- EDN: RPGNOS
- DOI: 10.31857/S0040357123030107
Аннотация
В растворах неэлектролитов присутствует единая сетка водородных связей, включающая молекулы растворенных веществ, связанную воду, объемную воду и гидратные оболочки молекул в растворе. При определенных условиях должны существовать корреляции объемных свойств жидкой смеси и коэффициента разделения изотопных форм воды между жидкой и паровой фазами. Смещение изотопного равновесия в системе жидкость–паровая фаза для воды при переходе от воды к растворам неэлектролитов связано с нарушением степени связанности и структурированности воды смешенного растворителя. На примере растворов мочевины показано, что этот эффект может быть одним из основных и может определять увеличение коэффициентов разделения изотопных форм воды при переходе от воды к раствору.
ВВЕДЕНИЕ
Выбор смешенного растворителя составляет важную часть процессов очистки веществ, получения материалов или полупродуктов синтеза с заданными свойствами. Большинство работ в области разделения изотопов с использованием дополнительных веществ посвящено прямому определению изотопных эффектов и только в некоторых из них затронуты проблемы гидратации. Используемые при этом физико-химические критерии разделения веществ базируются на эффектах высаливания и всаливания. Если для водных растворов электролитов подобные грубые ограничения часто позволяют все же отразить реальный механизм процесса, то для водных растворов неэлетролитов вопрос должен быть поставлен шире. Водные системы имеют специфику, связанную с существованием исходной или преобразованной структуры воды в растворах довольно широкой области концентраций [1]. В первую очередь она определяется разным влиянием полярных или неполярных групп второго компонента, определяющим его гидрофильную или гидрофобную гидратацию.
ОСНОВНАЯ ЧАСТЬ
Влияние полярных групп второго компонента смешанного водно-неэлектролитного растворителя с разными водородными связями достаточно сильно отличается между собой. В случае растворов с примесями третьего компонента, для которых рассматривается его распределение между жидкой и паровой фазой, присутствуют две главных гидратационных составляющих. Первый эффект определяется заменой единичных связей метки третьего компонента с водой на более сильные или более слабые связи с другими молекулами. Второй эффект отражает структурно-кинетические изменения самой воды в исходных двойных системах, реализующиеся в процессе гидратации [2]. Нарушение исходной сетки водородных связей молекул воды в таких системах должно приводить к усилению взаимодействий молекул воды с неэквивалентными частицами. Такой добавочный гидратационный процесс в растворе должен увеличивать коэффициент распределения третьего компонента с паровой фазой.
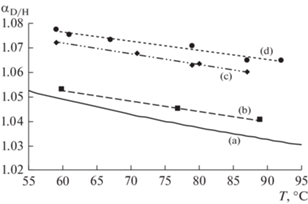
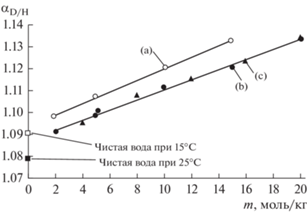
Предельный вариант указанных изменений может быть рассмотрен на примере растворов, где в качестве третьего компонента выступают дейтероаналоги воды. Это соответствует минимальному собственному воздействию на структуру воды. Исходный коэффициент распределения этих форм при переходе в паровую фазу должен меняться в смешанных растворителях. Характерный пример отличий представляют растворы мочевины. Здесь присутствуют два эффекта. Первый из указанных эффектов определяется более прочными связями при замене связей с водой на связи с молекулами мочевины (достаточно общий случай изотопных эффектов). Второй возможный случай отражает структурно-кинетические изменения самой воды в растворах мочевины. Как известно, молекулы мочевины представляют один из самых сильных нарушителей структуры воды [3, 4]. Эти нарушения исходной сетки связей должны приводить к усилению связей молекул воды с молекулами третьего компонента. Такой добавочный гидратационный процесс должен приводить к увеличению коэффициента распределения метки с паровой фазой. В работах [5–10] экспериментально были изучены распределения изотопов воды между жидкой и паровой фазами в тройной системе с молекулами мочевины. Они растут при переходе от воды к раствору. При этом растворы мочевины явно отличаются от других систем и представляют максимальные эффекты. Можно ожидать, что в этом случае реализуется добавочный вариант гидратационных изменений, когда замещенные изотопные формы увеличивают свою гидратацию в растворе за счет нарушения исходной сетки водородных связей в системе вода–вода. Этот эффект должен увеличиваться при понижении температуры, когда структура исходной воды и нарушающий эффект мочевины более выражены. Или, фактор структурно кинетических изменений воды под действием мочевины с ростом температуры пропадает, что соответствует с общей изложенной теорией. Как видно из рис. 1 и рис. 2, это действительно так. Коэффициент разделения пары дейтерий (D)–протий (H) падает с увеличением температуры [6] и растет с увеличением концентрации мочевины [5, 6, 9].
Рис. 2.
Зависимость коэффициента разделения изотопов водорода воды между паровой и жидкой фазами αD/H от моляльности m раствора карбамида при 15 и 25°С. (a) – при 15°С по данным работы [9]; (b) – при 25°С по данным работы [9]; (c) – при 25°С по данным работы [5]; αD/H для чистой воды из работы [11].
Насколько сильно указанная структурно-кинетическая составляющая задействована в процессах разделения могло бы быть выделено в рядах подобранных водно-неэлектролитных систем, в разной степени изменяющих исходную структуру воды в растворе. К сожалению, такие систематические измерения пока отсутствуют. В то же время ясно, что наличие гидрофобной гидратации за счет неполярных групп молекул должно снижать процесс разделения. Полярные взаимодействия второго компонента будут определять изменения сходные с растворами мочевины (возможно в меньшей степени). В результате возможны эффекты, определяющие направленное изменение системы и регулирующие процесс разделения через воздействие на структурно-кинетические свойства воды растворов.
ЗАКЛЮЧЕНИЕ
Приведенные выше соображения основываются на том, что при рассмотрении процесса перехода необходимо учитывать структуру воды в растворе. Можно выделить случаи, когда на изотопные эффекты будет преобладать влияние либо собственное гидратационное взаимодействие, либо структуры объемной жидкой фазы. Чем больше гидратация в растворе и меньше структурированность (или связанность) воды, тем больше должен быть эффект, оказываемый на величину коэффициента распределения изотопов между паровой и жидкой фазами. Это приводит к изменению характера гетерогенных равновесий.
Таким образом, для описания определяющих физико-химических критериев нужно принять во внимание следующие важнейшие предпосылки. Во-первых, следует учесть различие в гидратации и динамике растворенных веществ в гидратных оболочках молекул; во-вторых, различие в изменении состояния молекул растворенных веществ в результате образования новых молекулярных связей и новых пространственно-энергетических соответствий.
Работа выполнена при финансовой поддержке Минобрнауки России в рамках государственного задания ИОНХ РАН (This work was supported by the Ministry of Science and Higher Education of the Russian Federation as part of the State Assignment of the Kurnakov Institute of General and Inorganic Chemistry of the Russian Academy of Sciences).
СПИСОК ОБОЗНАЧЕНИЙ
Список литературы
Lyashchenko A.K. Structure and Structure-Sensitive Properties of Aqueous Solutions of Electrolytes and Nonelectrolytes. In: Advances in Chemical Physics, W. Coffey (Ed.). 2007. P. 379–426
Лященко А.К., Серебренников Г.М., Тараненко Н.П. Температурная зависимость сокристаллизации солей из водных растворов // Журн. неорганической химии. 1982. Т. 27. С. 1895–1902
Frank H.S., Franks F. Structural Approach to the Solvent Power of Water for Hydrocarbons; Urea as a Structure Breaker // J. Chem. Phys. 1968. V. 48. P. 4746–4757. https://doi.org/10.1063/1.1668057
Lyashchenko A.K., Dunyashev V.S., Zasetsky A.Yu. Effects of concentration on the microwave dielectric spectra of aqueous urea solutions // Russian J. Physical Chemistry A. 2017. V. 91. P. 887–893. https://doi.org/10.1134/S0036024417050168
Kakiuchi M. Distribution of isotopic water molecules, H2O, HDO, and D2O, in vapor and liquid phases in pure water and aqueous solution systems // Geochim. Cosmochim. Acta. 200. V. 64. P. 1485–1492. https://doi.org/10.1016/S0016-7037(99)00281-1
Kulov N.N., Polkovnichenko A.V., Lupachev E.V., Voshkin A.A., Magomedbekov E.P. Distribution of Hydrogen Isotopes between Phases at Vapor–Liquid Equilibrium in Aqueous Salt Solutions // Theoretical Foundations of Chemical Engineering. 2020. V. 54. P. 132–138. [Кулов Н.Н., Полковниченко А.В., Лупачев Е.В., Вошкин А.А., Магомедбеков Э.П. распределение изотопов водорода между фазами при парожидкостном равновесии водных солевых растворов // Теорет. основы хим. техн. 2020. Т. 54. № 1. С. 3–9]https://doi.org/10.1134/S0040579520010108
Kulov N.N., Polkovnichenko A.V., Lupachev E.V., Kisel’ A.V., Voshkin A.A., Magomedbekov E.P. Studying the Kinetics of Mass Transfer in the Distillation of Water Hydrogen Isotopes in the Presence of Urea // Theoretical Foundations of Chemical Engineering. 2021. V. 55. P. 207–214. [Кулов Н.Н., Полковниченко А.В., Лупачев Е.В., Кисель А.В., Вошкин А.А., Магомедбеков Э.П. Исследование кинетики процесса массообмена при ректификации изотопов водорода воды в присутствии карбамида // Теорет. основы хим. техн. 2021. Т. 55. № 2. С. 135–142]https://doi.org/10.1134/S0040579521020044
Pokalchuk V.S., Magomedbekov E.P., Rastunova I.L., Chebotov A.Yu., Kulov N.N. Estimation of the Separation Coefficient of Oxygen Isotopes in Aqueous Salt Solutions // Theoretical Foundations of Chemical Engineering. 2020. V. 54. P. 1127–1130. [Покальчук В.С., Магомедбеков Э.П., Растунова И.Л., Чеботов А.Ю., Кулов Н.Н. Оценка величины коэффициента разделения изотопов кислорода в водных солевых растворах // Теорет. основы хим. техн. 2020. Т. 54. № 6. С. 663–667.]https://doi.org/10.1134/S0040579520060184
Kakiuchi M., Matsuo S. Fractionation of hydrogen and oxygen isotopes between hydrated and free water molecules in aqueous urea solution // J. Phys. Chem. 1985. V. 89. P. 4627–4632. https://doi.org/10.1021/j100267a043
Jakli G., van Hook W.A. Isotope effects in aqueous systems. 12. Thermodynamics of urea-h4/water and urea-d4/water-d2 solutions // J. Phys. Chem. 1981. V. 85. P. 3480–3493. https://doi.org/10.1021/j150623a025
Horita J., Wesolowski D.J. Liquid-vapor fractionation of oxygen and hydrogen isotopes of water from the freezing to the critical temperature // Geochim. Cosmochim. Acta. 1994. V. 58. P. 3425–3437. https://doi.org/https://doi.org/10.1016/0016-7037(94) 90096-5
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии