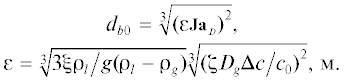Теоретические основы химической технологии, 2023, T. 57, № 5, стр. 545-552
Теория гетерогенной реакции твердое–жидкость с появлением газовой фазы
В. П. Мешалкин a, В. А. Орехов b, А. А. Быков b, В. И. Бобков b, *, А. И. Шинкевич c
a Российский химико-технологический университет имени Д.И. Менделеева,
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
b Национальный исследовательский университет “МЭИ”
г. Смоленске, Россия
c Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: vovabobkoff@mail.ru
Поступила в редакцию 21.07.2023
После доработки 23.07.2023
Принята к публикации 27.07.2023
- EDN: MGGPGP
- DOI: 10.31857/S0040357123050159
Аннотация
Представлена аналитическая модель гетерогенной реакции твердое–жидкость с возникновением газообразной фазы базирующаяся на анализе основных параметров, оказывающих наиболее существенное воздействие на интенсивность происходящей реакции. Показано наличие газожидкостных диссипативных структур в виде чередующихся потоков реагирующих фаз, совершающих релаксационные пульсации. Приведено описание процессов формирования пузырьков, их отрыва, движения, имеющих удовлетворительную адекватность. Описана динамика и условия формирования пузырька газа на твердой поверхности реагирования. Получены соотношения для оценки коэффициентов массообмена, коррелирующие с экспериментальными данными. Разработанная аналитическая модель гетерогенной реакции позволит лучше понимать сущность протекания процессов плавления в рудотермических печах, что даст возможность вносить изменения в технологический процесс данных установок, опирающиеся на качественно новые параметры характерных для них реакций. Анализ гидродинамики с формированием газовой фазы аналитическими и численными методами позволил получить соображение о форме протекания жидкой фазы. Типичным является присутствие гидродинамических структур, определяющих упорядоченное движение жидкой фазы при разнообразных методах подачи газовой фазы. Определены значения критических параметров массопереноса. В отличие от процесса кипения наличие кризисного режима при гетерогенной реакции невыполнимо из-за экранирования поверхности реакции.
ВВЕДЕНИЕ
Принципы гетерогенного реагирования с появлением газовой фазы на основе пузырьков характерны для процессов восстановления, происходящих в системах химической электротермии, например при получении карбида кальция или фосфора, в процессах растворения, а также при переработке различных цветных металлов и расплавов. В процессах кипения и барботажа задачи тепломассообмена рассмотрены в работах российских и зарубежных исследователей.
Необходимость рассмотрения процесса взаимодействия жидкости и газа возрастает из-за особенностей поведения таких систем и ростом сферы их применения. Данная реакция характерна при функционировании рудотермических печей. Получение аналитической модели гетерогенной реакции позволяет лучше понимать природу происходящих процессов в данных печах, а, следовательно, и разрабатывать более оптимальные методы их модернизации.
Образование газовой фазы в происходящей реакции ускоряет тепломассообмен за счет активного смешивания. Но в тоже время сдерживает выход жидкой составляющей на поверхность, формируя механизм экранирования. Возникающий механизм нужно исследовать для более правильного описания гетерогенной реакции. Экспериментально процесс экранирования в обычном кипении широко представлен в трудах японских ученых Т. Ямадзаки и К. Торикай [1]. В процессе проведенных ими экспериментов было установлено, что часть поверхности реагирования занимает газовая фаза, но учитывая механизм ее образования, она оказалась незначительной. Механизмы образования периодических областей пузырьков в процессах кипения и барботажа рассмотрены также в трудах российских ученых [2].
В гетерогенных реакциях процесс тепломасообмена традиционно сравнивается с механизмами кипения и барботажа. Перенос энергии в них происходит не за счет испарения, а в результате перемешивания пузырьков газовой фазы и жидкости [3, 5]. В результате при анализе большинства явлений в данных процессах используется гидродинамический подход, что приводит к совпадению основных параметров энергообмена. В гетерогенных реакциях процесс массопереноса порой именуют “химическим кипением”.
ПРОЦЕСС ГЕТЕРОГЕННОГО РЕАГИРОВАНИЯ И ФОРМИРОВАНИЕ УСТОЙЧИВОЙ СТРУКТУРЫ ГАЗОЖИДКОСТНОЙ СИСТЕМЫ
В основе рассмотрения процесса и его анализа будем базироваться на системе уравнений, предложенных Панченко С.В. и Мешалкиным В.П. в работах [4, 13, 14]. Газообразная фаза реагирования замедляет процесс протекания реакции, создавая ситуацию экранирования, но при этом одновременно способствует подъему жидкой фазы к поверхности, создавая необходимый механизм перемешивания.
Баланс массы жидкой и газовой составляющих реагирования можно отобразить в безразмерной форме на основе системы дифференциальных уравнений:
(1)
${{dc} \mathord{\left/ {\vphantom {{dc} {dt}}} \right. \kern-0em} {dt}} = {{{{S}_{0}}} \mathord{\left/ {\vphantom {{{{S}_{0}}} V}} \right. \kern-0em} V}\left( {{{\beta }_{l}}S(1 - c) - kSc{{\gamma }_{m}}} \right),$(2)
${{dS} \mathord{\left/ {\vphantom {{dS} {dt}}} \right. \kern-0em} {dt}} = \rho _{g}^{{ - 1}}\left( {{{j}_{g}}\chi (1 - S) - k{{\gamma }_{g}}\chi {{c}_{{l0}}}Sc} \right),$Используем для анализа метод возмущений. Преобразуем систему уравнений с объединением сомножителей
(3)
${{dc} \mathord{\left/ {\vphantom {{dc} {dt}}} \right. \kern-0em} {dt}} = {{\beta }_{l}}\left( {{{{{S}_{0}}} \mathord{\left/ {\vphantom {{{{S}_{0}}} V}} \right. \kern-0em} V}} \right)S - ({{\beta }_{l}} + k{{\gamma }_{m}})\left( {{{{{S}_{0}}} \mathord{\left/ {\vphantom {{{{S}_{0}}} V}} \right. \kern-0em} V}} \right)Sc,$(4)
${{dS} \mathord{\left/ {\vphantom {{dS} {dt}}} \right. \kern-0em} {dt}} = {{j}_{g}}\rho _{g}^{{ - 1}}\chi - {{j}_{g}}\rho _{g}^{{ - 1}}\chi S - \rho _{g}^{{ - 1}}k{{\gamma }_{g}}\chi {{c}_{{l0}}}Sc.$Представим концентрацию и доступную поверхность реагирования в виде суммы переменных в равновесном состоянии и малых возмущений.
После подставки этих выражений в (3), (4) и вычитания из полученных соотношений исходных уравнений в равновесном состоянии с пренебрежением членами второго порядка, получим уравнения для малых приращений уравнений системы:
(6)
$\begin{gathered} {{d{{x}_{1}}} \mathord{\left/ {\vphantom {{d{{x}_{1}}} {dt}}} \right. \kern-0em} {dt}} = - \left( {{{\beta }_{l}} + k{{\gamma }_{m}}} \right)\left( {{{{{S}_{0}}} \mathord{\left/ {\vphantom {{{{S}_{0}}} V}} \right. \kern-0em} V}} \right){{S}_{e}}{{x}_{1}} + \\ + \,\,\left( {{{\beta }_{l}}\left( {{{{{S}_{0}}} \mathord{\left/ {\vphantom {{{{S}_{0}}} V}} \right. \kern-0em} V}} \right) + \left( {{{\beta }_{l}} + k{{\gamma }_{m}}} \right)\left( {{{{{S}_{0}}} \mathord{\left/ {\vphantom {{{{S}_{0}}} V}} \right. \kern-0em} V}} \right){{c}_{e}}} \right){{x}_{2}}, \\ \end{gathered} $(7)
$\begin{gathered} {{d{{x}_{2}}} \mathord{\left/ {\vphantom {{d{{x}_{2}}} {dt}}} \right. \kern-0em} {dt}} = - \rho _{g}^{{ - 1}}k{{\gamma }_{g}}\chi {{c}_{{l0}}}{{S}_{e}}{{x}_{1}} - \\ - \,\,\left( {{{j}_{g}}\rho _{g}^{{ - 1}}\chi + \rho _{g}^{{ - 1}}k{{\gamma }_{g}}\chi {{c}_{{l0}}}{{c}_{e}}} \right){{x}_{2}} \\ \end{gathered} $(8)
${{d{{x}_{1}}} \mathord{\left/ {\vphantom {{d{{x}_{1}}} {dt}}} \right. \kern-0em} {dt}} = {{a}_{{11}}}{{x}_{1}} + {{a}_{{12}}}{{x}_{2}},$(9)
${{d{{x}_{2}}} \mathord{\left/ {\vphantom {{d{{x}_{2}}} {dt}}} \right. \kern-0em} {dt}} = {{a}_{{21}}}{{x}_{1}} + {{a}_{{22}}}{{x}_{2}},$Рассмотрение системы уравнений на устойчивость заключается в анализе возмущенной системы уравнений. Определение вида устойчивости, исходя из теоретических представлений, можно сделать, выполнив анализ характеристического многочлена, не рассматривая при этом решение самой системы уравнений.
Рассмотрев уравнения в безразмерном виде при малом отклонении от равновесного состояния, можно получить возможность аналитического подхода к динамике поведения концентрации реагента и реакционной доступной поверхности.
Для получения дифференциального уравнения, описывающего колебания концентрации и величины поверхности реагирования систему (8), (9) можно преобразовать к уравнениям второго порядка. Например, для концентрации реагента преобразование дает:
(10)
$\begin{gathered} {{{{d}^{2}}{{x}_{1}}} \mathord{\left/ {\vphantom {{{{d}^{2}}{{x}_{1}}} {d{{t}^{2}}}}} \right. \kern-0em} {d{{t}^{2}}}} - ({{a}_{{11}}} + {{a}_{{22}}}){{d{{x}_{1}}} \mathord{\left/ {\vphantom {{d{{x}_{1}}} {dt}}} \right. \kern-0em} {dt}} + \\ + \,\,({{a}_{{11}}}{{a}_{{22}}} - {{a}_{{12}}}{{a}_{{21}}}){{x}_{1}} = 0. \\ \end{gathered} $Уравнение для возмущения концентрации сведено к стандартному уравнению для затухающих колебаний:
(11)
${{{{d}^{2}}{{x}_{1}}} \mathord{\left/ {\vphantom {{{{d}^{2}}{{x}_{1}}} {d{{t}^{2}}}}} \right. \kern-0em} {d{{t}^{2}}}} + 2{{\beta }}{{d{{x}_{1}}} \mathord{\left/ {\vphantom {{d{{x}_{1}}} {dt}}} \right. \kern-0em} {dt}} + {{{{\omega }}}^{2}}{{x}_{1}} = 0,$При ${{\omega }}_{0}^{2} > {{{{\beta }}}^{2}}$ частота затухающих колебаний ω будет величиной вещественной, и решением дифференциального уравнения (11) является функция вида: $x(t) = {{A}_{0}}{{e}^{{ - {{\beta }}t}}}\cos ({{\omega }}t + {{\varphi }})$.
Величину концентрации реагента и поверхности взаимодействия при стационарном протекании реакции можно представить с помощью следующих выражений :
(12)
$\begin{gathered} {{c}_{l}} = {{{{{{\beta }}}_{l}}{{c}_{{l0}}}} \mathord{\left/ {\vphantom {{{{{{\beta }}}_{l}}{{c}_{{l0}}}} {{{{{\beta }}}_{l}} + k{{{{\gamma }}}_{m}}}}} \right. \kern-0em} {{{{{\beta }}}_{l}} + k{{{{\gamma }}}_{m}}}}, \\ S = {{{{j}_{g}}} \mathord{\left/ {\vphantom {{{{j}_{g}}} {{{j}_{g}} + {{k{{{{\gamma }}}_{g}}{{{{\beta }}}_{l}}{{c}_{{l0}}}} \mathord{\left/ {\vphantom {{k{{{{\gamma }}}_{g}}{{{{\beta }}}_{l}}{{c}_{{l0}}}} {({{{{\beta }}}_{l}} + k{{{{\gamma }}}_{m}})}}} \right. \kern-0em} {({{{{\beta }}}_{l}} + k{{{{\gamma }}}_{m}})}}}}} \right. \kern-0em} {{{j}_{g}} + {{k{{{{\gamma }}}_{g}}{{{{\beta }}}_{l}}{{c}_{{l0}}}} \mathord{\left/ {\vphantom {{k{{{{\gamma }}}_{g}}{{{{\beta }}}_{l}}{{c}_{{l0}}}} {({{{{\beta }}}_{l}} + k{{{{\gamma }}}_{m}})}}} \right. \kern-0em} {({{{{\beta }}}_{l}} + k{{{{\gamma }}}_{m}})}}}} = \\ = {{{{j}_{g}}} \mathord{\left/ {\vphantom {{{{j}_{g}}} {{{j}_{g}} + {{{{{{\gamma }}}_{g}}{{c}_{{l0}}}} \mathord{\left/ {\vphantom {{{{{{\gamma }}}_{g}}{{c}_{{l0}}}} {{{R}_{d}}}}} \right. \kern-0em} {{{R}_{d}}}}}}} \right. \kern-0em} {{{j}_{g}} + {{{{{{\gamma }}}_{g}}{{c}_{{l0}}}} \mathord{\left/ {\vphantom {{{{{{\gamma }}}_{g}}{{c}_{{l0}}}} {{{R}_{d}}}}} \right. \kern-0em} {{{R}_{d}}}}}}. \\ \end{gathered} $${{R}_{d}} = {{k}^{{ - 1}}} + {{({{{{\gamma }}}_{m}}{{{{\beta }}}_{l}})}^{{ - 1}}}$ – диффузионное сопротивление.
Асимптотические значения при массовом обмене определяются соотношением:
(13)
${{{{\beta }}}_{l}} \to \infty ;\,\;{{c}_{l}} \to {{c}_{{l0}}};\,\;S \to {{{{j}_{g}}} \mathord{\left/ {\vphantom {{{{j}_{g}}} {({{j}_{g}} + k{{{{\gamma }}}_{g}}{{c}_{{l0}}})}}} \right. \kern-0em} {({{j}_{g}} + k{{{{\gamma }}}_{g}}{{c}_{{l0}}})}}.$Таким образом, если коэффициент массового обмена стремится к бесконечности, доступная поверхность замедляется кинетикой газовой фазы и задается концентрацией реагента в области реакции.
Быстрота взаимодействия при стационарном протекании реакции определяется выражением:
(14)
${{\omega }_{r}} = kSc = {{k{{\beta }_{l}}{{c}_{{l0}}}{{j}_{g}}} \mathord{\left/ {\vphantom {{k{{\beta }_{l}}{{c}_{{l0}}}{{j}_{g}}} {({{j}_{g}}k{{\gamma }_{m}} + {{\beta }_{l}}({{j}_{g}} + k{{\gamma }_{g}}{{c}_{{l0}}})}}} \right. \kern-0em} {({{j}_{g}}k{{\gamma }_{m}} + {{\beta }_{l}}({{j}_{g}} + k{{\gamma }_{g}}{{c}_{{l0}}})}}).$Асимптоты:
(15)
$\begin{gathered} {{\beta }_{l}} \to \infty ,\,\,\,\,{{\omega }_{r}} \to {{{{j}_{g}}k{{c}_{{l0}}}} \mathord{\left/ {\vphantom {{{{j}_{g}}k{{c}_{{l0}}}} {({{j}_{g}} + {{\gamma }_{g}}k{{c}_{{l0}}})}}} \right. \kern-0em} {({{j}_{g}} + {{\gamma }_{g}}k{{c}_{{l0}}})}}, \\ {{\omega }_{r}} \to {{{{j}_{g}}} \mathord{\left/ {\vphantom {{{{j}_{g}}} {{{\gamma }_{g}}}}} \right. \kern-0em} {{{\gamma }_{g}}}},\,\,\,{{c}_{{l0}}} \to \infty . \\ \end{gathered} $С увеличением коэффициента массопереноса интенсивность взаимодействия значительно возрастает.
ОЦЕНКА ПЛОТНОСТИ ПОТОКА ГАЗА ОТ ПОВЕРХНОСТИ РЕАКЦИИ
Рассматривая устойчивость фазы газа в виде газового слоя из пузырьков, появившегося на горизонтальной, направленной вверх, протяженной поверхности реакции, плотность потока газа соответственно определяется следующим выражением:
(16)
$j = {{{{\rho }_{g}}{{V}_{b}}f} \mathord{\left/ {\vphantom {{{{\rho }_{g}}{{V}_{b}}f} {{{S}_{0}}}}} \right. \kern-0em} {{{S}_{0}}}} = {{\pi {{\rho }_{g}}(f{{d}_{{b0}}}){{d}_{{b0}}}^{2}} \mathord{\left/ {\vphantom {{\pi {{\rho }_{g}}(f{{d}_{{b0}}}){{d}_{{b0}}}^{2}} {6{{S}_{0}}}}} \right. \kern-0em} {6{{S}_{0}}}}.$На этой поверхности образуются колонны пузырьков газа, расположенные равновероятно в пучностях волн на разделе фаз, неустойчивость которой определяется механизмом Тейлора. При этом длина волн находится в пределах, установленных формулами для критической длины и длины волны наибольшего роста, т. е. $2\pi \leqslant \lambda l_{\sigma }^{{ - 1}} < 2\pi \sqrt 3 $.
В соответствии с наблюдаемой картиной появления пузырьков диаметр газовых колонн будет равен ${{d}_{b}} \approx {{{\lambda }} \mathord{\left/ {\vphantom {{{\lambda }} 2}} \right. \kern-0em} 2}$, тогда при дистанции между колоннами, равном λ, в одной ячейке сечения доля газа в газожидкостной смеси будет равна ${{\varphi }_{g}} = {\pi \mathord{\left/ {\vphantom {\pi 6}} \right. \kern-0em} 6}$.
На базе условия наличия пленки газа над рассматриваемой поверхностью можно записать:
(17)
$\lambda = 2\pi {{l}_{\sigma }} = 2\pi \sqrt {{\sigma \mathord{\left/ {\vphantom {\sigma {g\left( {{{\rho }_{l}} - {{\rho }_{g}}} \right)}}} \right. \kern-0em} {g\left( {{{\rho }_{l}} - {{\rho }_{g}}} \right)}}} .$При условии постоянства массы считаем, что
(18)
${{\rho }_{g}}{{\upsilon }_{g}}{{\varphi }_{g}} = - {{\rho }_{l}}{{\upsilon }_{l}}(1 - {{\varphi }_{g}}).$Полагаем ${{\lambda }_{v}} \approx \pi {{d}_{b}} \approx ({\pi \mathord{\left/ {\vphantom {\pi 2}} \right. \kern-0em} 2})\lambda $, где ${{{{\lambda }}}_{v}}$ — длина неустойчивости Гельмгольца для вертикальных волн.
В соответствии с трудами Маленкова И.Г. и Зубера Н. возмущение жидкой фазы со скоростью υ происходит в результате образования пузырьков определенных размеров. Причем перемещение пузырьков создает волны с длиной волны ${{\lambda }_{v}} = \pi {{d}_{b}}$. Анализ данного выражения показал, что при всевозможных условиях реагирования дистанция между элементами газовой фазы не меняется и остается пропорциональной их размеру [6, 7].
На основании условия, что $f{{\lambda }_{v}} = {{v}_{b}}$, где ${{v}_{b}}$ – скорость подъема элементов газовой фазы, можно получить:
Исходя из данных представлений, частоту отрыва пузырьков от поверхности протекания реакции можно определить как
где ${{{{\tau }}}_{p}}$ – время роста пузырька; ${{{{\tau }}}_{0}}$ – время омывания жидкостью поверхности между отрывом одного пузырька и появлением нового.(21)
$f{{d}_{{b0}}} = {{{{{{\tau }}}_{0}}{{\upsilon }_{b}}} \mathord{\left/ {\vphantom {{{{{{\tau }}}_{0}}{{\upsilon }_{b}}} {\left( {{{{{\tau }}}_{p}} + {{{{\tau }}}_{0}}} \right)}}} \right. \kern-0em} {\left( {{{{{\tau }}}_{p}} + {{{{\tau }}}_{0}}} \right)}}.$В предположении Якоба ${{{{\tau }}}_{p}}{\text{ = }}{{{{\tau }}}_{0}}$ получается соотношение, аналогичное полученному ранее [11, 12].
Из выражения для плотности потока газа следует также необходимость определения отрывного диаметра. Рассмотрим динамику образования пузырьков в процессе реагирования.
ДИНАМИКА ФОРМИРОВАНИЯ ПУЗЫРЬКА ГАЗА НА ТВЕРДОЙ ПОВЕРХНОСТИ РЕАГИРОВАНИЯ
При гетерогенном взаимодействии твердое–жидкость с появлением газообразной фазы, необходимо обязательное соприкосновение компонентов реагирования друг с другом. Образование пузырьков газа в процессе взаимодействия приводит к экранированию твердой фазы, что значительно усложняет механизм реакции. Кроме того, к основанию пузырька должен подводиться реагент, что является также обязательным условием протекания реакции. Опираясь на труды по изучению процесса испарения [10, 13, 15], представим аналитическую модель образования пузырька при взаимодействии твердого восстановителя и жидкого окислителя. Д.А. Лабунцовым теоретически исследовано данное явление для процесса кипения [17], а также обнаружено в ходе сложных экспериментов [18, 19] и других исследований.
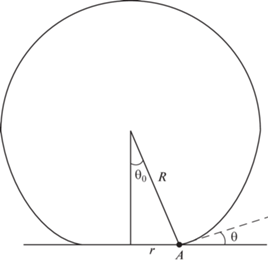
Необходимым условием протекания реакции является повод реагента к основанию пузырька. На основе процесса парообразования проанализируем модель появления пузырька при реакции жидкого окисла и твердого восстановителя. Данный эффект теоретически разобран Д.А. Лабунцовым для кипения и обнаружен в результате сложных экспериментов. Анализ процесса кипения демонстрирует формирование тонкого слоя жидкости между твердой и газообразной фазами реагирования [16, 17]. На рис. 1 представлена схема появления данного слоя при формировании пузырька.
Протекание реакции, как уже отмечалось, характеризуется наличием тонкого слоя жидкой фазы величиной порядка ${{{{{{\gamma }}}_{g}}{{D}_{1}}{{\Delta }}c} \mathord{\left/ {\vphantom {{{{{{\gamma }}}_{g}}{{D}_{1}}{{\Delta }}c} {{{j}_{g}}}}} \right. \kern-0em} {{{j}_{g}}}}$. Увеличение элемента газовой фазы в области взаимодействия происходит за счет подхода через слой жидкости продуктов реакции. Таким образом, анализируемый поток газовой фазы, можно задать следующим выражением:
(22)
${{j}_{g}} = {{{{\gamma }_{g}}{{D}_{l}}\Delta c} \mathord{\left/ {\vphantom {{{{\gamma }_{g}}{{D}_{l}}\Delta c} y}} \right. \kern-0em} y},$Поток массы газа определяется выражением:
(23)
${{J}_{g}} = \int {{{j}_{g}}d{{s}_{A}}} = 2\pi R\cos \left( {{{{{\theta }_{0}}} \mathord{\left/ {\vphantom {{{{\theta }_{0}}} 2}} \right. \kern-0em} 2}} \right){{\gamma }_{g}}{{D}_{l}}\Delta c\int\limits_{{{y}_{A}}}^\delta {{{y}^{{ - 1}}}dy} ,$На основании проведенной замены интеграл будет равен:
(24)
${{J}_{g}} = 2\pi R\cos \frac{{{{\theta }_{0}}}}{2}{{\gamma }_{g}}{{D}_{l}}\Delta c\ln \frac{\delta }{{{{y}_{A}}}}.$Используя уравнение баланса массы получаем:
(25)
${{\rho }_{g}}{{dV} \mathord{\left/ {\vphantom {{dV} {d\tau }}} \right. \kern-0em} {d\tau }} = \int\limits_S {{{j}_{g}}d{{s}_{A}}} .$Т.к.
(26)
${{dR} \mathord{\left/ {\vphantom {{dR} {d\tau }}} \right. \kern-0em} {d\tau }} = {{\zeta {{\gamma }_{g}}{{D}_{l}}\Delta c} \mathord{\left/ {\vphantom {{\zeta {{\gamma }_{g}}{{D}_{l}}\Delta c} {{{\rho }_{g}}R}}} \right. \kern-0em} {{{\rho }_{g}}R}},\,\,\,\tau = 0,\,\,\,R = 0,$(27)
$\zeta = \frac{{2\cos ({{{{\theta }_{0}}} \mathord{\left/ {\vphantom {{{{\theta }_{0}}} 2}} \right. \kern-0em} 2})}}{{{{{\left( {l + \cos {{\theta }_{0}}} \right)}}^{2}}\left( {2 - {\text{ }}\cos {{\theta }_{0}}} \right)}}\ln \frac{\delta }{{{{y}_{A}}}},$Используя начальные условия $\tau = 0,R = 0$ интегрирование уравнения (26) дает следующий результат:
(28)
$\begin{gathered} R = \sqrt {2{{{({{\rho }_{g}})}}^{{ - 1}}}\zeta {{\gamma }_{g}}{{D}_{l}}\Delta c\tau } = \sqrt {{{с}_{b}}\tau } , \\ {{c}_{b}} = \sqrt {2{{{({{{{\rho }}}_{g}})}}^{{ - 1}}}{{\zeta }}{{{{\gamma }}}_{g}}{{D}_{l}}{{\Delta }}c} . \\ \end{gathered} $Разработанная модель точно описывает главные закономерности появления и роста элемента газовой фазы.
Опираясь на критерий Якоба, произведем преобразование (26):
(29)
$\begin{gathered} {{dR} \mathord{\left/ {\vphantom {{dR} {d{{\tau }}}}} \right. \kern-0em} {d{{\tau }}}} = {{R}^{{ - 1}}}({{{{\zeta }}{{D}_{g}}{{\Delta }}c} \mathord{\left/ {\vphantom {{{{\zeta }}{{D}_{g}}{{\Delta }}c} {{{c}_{0}}}}} \right. \kern-0em} {{{c}_{0}}}})({{{{\gamma }_{g}}{{c}_{0}}{{D}_{l}}} \mathord{\left/ {\vphantom {{{{\gamma }_{g}}{{c}_{0}}{{D}_{l}}} {{{\rho }_{g}}{{D}_{g}}}}} \right. \kern-0em} {{{\rho }_{g}}{{D}_{g}}}}) = \\ = {{R}^{{ - 1}}}c_{0}^{{ - 1}}{{\zeta }}{{D}_{g}}{{\Delta }}c{\mathbf{J}}{{{\mathbf{a}}}_{D}}, \\ \end{gathered} $АНАЛИЗ СООТНОШЕНИЯ АНАЛИТИЧЕСКОЙ МОДЕЛИ ДАННЫМ ЭКСПЕРИМЕНТА
Одним из критериев правильности разработанной модели является соответствие экспериментальным данным соотношение для диаметра пузырька, при котором происходит его отрыв. Данное соотношение получается исходя из условия равновесия сил, при котором происходит отделение его от нагреваемой поверхности. В настоящее время до сих пор нет классического решения вопроса роста пузырька с учетом всех сил, возникающих в данной системе.
В момент отрывы условие равновесия сил пузырька можно представить на основе следующего уравнения:
(30)
$\begin{gathered} \frac{\pi }{6}d_{{b0}}^{3}g({{\rho }_{l}} - {{\rho }_{g}}) = \frac{\pi }{8}\xi d_{{b0}}^{2}{{\rho }_{l}}\left( {\frac{{dR}}{{d\tau }}} \right)_{{{{R}_{0}}}}^{2} + \varphi (\theta )\pi d_{{b0}}^{{}}\sigma + \\ + \,\,\frac{1}{6}\pi d_{{b0}}^{3}\left( {{{\rho }_{g}} + \frac{1}{2}{{\rho }_{l}}} \right)\frac{{{{d}^{2}}R}}{{d{{\tau }^{2}}}}, \\ \end{gathered} $Исходя из уравнения (30) получаем:
Опираясь на критерий Якоба, необходимо сравнить результаты эксперимента со значениями диаметра отрыва, полученными на основе разработанной модели.
Для значений величин $({\text{Mg}} + {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}},{{{\text{H}}}_{2}})$: (${{\xi }} = 0.5;\,\,{{{{\rho }}}_{g}} = 0.09$ ${{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}$; ${{\rho }_{l}} = 1830$${{{\text{кг}}} \mathord{\left/ {\vphantom {{{\text{кг}}} {{{{\text{м}}}^{{\text{3}}}}}}} \right. \kern-0em} {{{{\text{м}}}^{{\text{3}}}}}}$; ${{D}_{g}} = 7.2 \times {{10}^{{ - 9}}}$ м2/с;) результаты сравнения эксперимента и теоретической модели изображены на рис. 2.
Рис. 2.
Соответствие критерию Якоба диаметра отрыва газовой фазы. Линия – данные аналитической модели; * – результаты эксперимента.
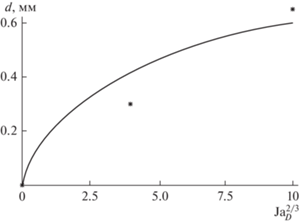
Графическое представление сравнения результатов показывает, что разногласие результатов является незначительным, поэтому данная модель воспроизводит для гетерогенных реакций с появлением газовой фазы важнейшие гидродинамические закономерности.
Скорость смешивания соразмерна объему и числу пузырьков, образующихся на поверхности реакции. В соответствии с моделью, разработанной С.С. Кутателадзе и А.И. Леонтьевым [5, 18] скорость теплообмена в кипении, обуславливается циркуляцией жидкого реагента в центрах парообразования. Опираясь на выводы данной модели, в рассматриваемой гетерогенной реакции у стены печи существенная масса жидкой фазы увлекается газообразной фазой и подымается к взаимодействующей области реагирования. В результате происходит рост массоотдачи, поскольку происходит подвод новых порций жидкости, вызывая тем самым насыщенную циркуляцию жидкости. Порядок реагирующей жидкости определяется следующим выражением:
где ${{\varsigma }}$ – коэффициент, определяющий массу циркулирующей жидкости; ${{j}_{g}}$ – реагирующий поток массы газа.Опираясь на массовый баланс получаем:
(33)
${{\upsilon }_{l}} = ({{{{j}_{g}}} \mathord{\left/ {\vphantom {{{{j}_{g}}} {{{\rho }_{l}}}}} \right. \kern-0em} {{{\rho }_{l}}}})\frac{{(1 + \varsigma )}}{{1 - {{\varphi }_{g}}}},$В окрестности лобовой точки в результате конвекции массообмен определяется уравнением:
(34)
${\text{S}}{{{\text{h}}}_{l}}~\,\, = {{{{\beta }_{l}}{{d}_{p}}} \mathord{\left/ {\vphantom {{{{\beta }_{l}}{{d}_{p}}} {{{D}_{l}}}}} \right. \kern-0em} {{{D}_{l}}}} = 0.68~\sqrt {{{{\operatorname{Re} }}_{1}}} \sqrt[3]{{{\text{Sc}}}}{{,}^{~}}$Рассматривая только диффузное реагирование в жидком слое, процесс взаимодействия можно представить с помощью представленной ниже пенетрационной модели [21, 22].
На базе данной модели для полуограниченной области рассмотрим решение диффузного уравнения:
(35)
${{\partial c} \mathord{\left/ {\vphantom {{\partial c} {\partial \tau }}} \right. \kern-0em} {\partial \tau }} = D({{{{\partial }^{2}}c} \mathord{\left/ {\vphantom {{{{\partial }^{2}}c} {\partial {{x}^{2}})}}} \right. \kern-0em} {\partial {{x}^{2}})}}.$Исходя из преобразований Лапласа, искомое решение можно представить следующим образом:
(36)
$с - {{с}_{1}} = ({{с}_{0}} - с{}_{1}){\text{erf}}\left( {\frac{x}{{2\sqrt {D\tau } }}} \right),$Реагирующий поток:
Градиент концентрации:
С учетом омывания τ среднее значение взаимодействующего потока:
Интервал взаимодействия определяется периодом обтекания рассматриваемой поверхности ${{\tau }_{0}} = {{{{d}_{p}}} \mathord{\left/ {\vphantom {{{{d}_{p}}} {{{\upsilon }_{l}}}}} \right. \kern-0em} {{{\upsilon }_{l}}}}$.
Исходя из теоретической формулы коэффициента массообмена: ${{\beta }_{l}} = {{\bar {j}}_{c}}{{({{с}_{1}} - {{с}_{0}})}^{{ - 1}}}$, получаем:
Таким образом искомое уравнение массообмена имеет вид:
(37)
$\begin{gathered} {{{{\beta }_{l}}{{d}_{p}}} \mathord{\left/ {\vphantom {{{{\beta }_{l}}{{d}_{p}}} {{{D}_{l}}}}} \right. \kern-0em} {{{D}_{l}}}} = 2\sqrt {{{{{\upsilon }_{l}}{{d}_{p}}} \mathord{\left/ {\vphantom {{{{\upsilon }_{l}}{{d}_{p}}} {\pi {{\nu }_{l}}}}} \right. \kern-0em} {\pi {{\nu }_{l}}}}} \sqrt {{{\nu }_{l}}{{D}_{l}}^{{ - 1}}} , \\ {\text{S}}{{{\text{h}}}_{l}} = 1.13\sqrt {\operatorname{Re} } \sqrt {{\text{Sc}}} , \\ \end{gathered} $На основе экспериментальных работ [8, 17, 18] была получена, мало чем отличающаяся от полуэмпирической и теоретической, зависимость:
(38)
${\text{S}}{{{\text{h}}}_{l}}{\text{ }} = {\text{N}}{{{\text{u}}}_{d}} = 3.1\sqrt {{{{\operatorname{Re} }}_{1}}} \sqrt {{\text{Sc}}} ,{\text{ }}({\text{Sc}} = 300{\kern 1pt} - {\kern 1pt} 12\,000),$ОЦЕНКА СООТВЕТСТВИЯ РАССЧИТАННОЙ АНАЛИТИЧЕСКИ КРИТЕРИАЛЬНОЙ ЗАВИСИМОСТИ
При оценке полученных зависимостей экспериментальные данные коэффициента массоотдачи были взяты из [9, 19, 20], а теоретические параметры определены на основе аналитической зависимости (37). В критериальных зависимостях не указано, что экспериментальные значения достигают определенного максимума. Полуэмпирическая модель позволила получить значения, не отличающиеся от эксперимента [23, 24].
Сравнение аналитических и экспериментальных данных изображено на рис. 3.
Рис. 3.
Сравнение аналитических и экспериментальных данных коэффициента массоотдачи от концентрации реагента. линия – данные аналитической модели; * – результаты эксперимента.
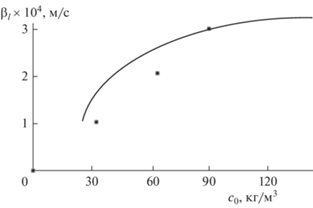
Соответствие полученных параметров, как показано графически, достаточно приемлемо в системах, включающих несколько фаз в области взаимодействия.
ЗАКЛЮЧЕНИЕ
Предложена система уравнений, описывающая массовый баланс реагирующих компонентов, позволяющая выявить закономерности пульсационного изменения параметров реакции и образования структур в газо-жидкостной системе, имеющей тенденции к устойчивому состоянию. Под действием внешних возмущений система совершает колебания и релаксирует к равновесию. Осуществлен анализ процессов гетерогенной реакции с появлением газовой фазы в форме пузырьков, раскрывающий механизм протекания реакции. Сравнительный анализ с проведенными экспериментами позволил сделать вывод, что представленная модель достаточно точно определяет аналитические зависимости основных критериев газовой фазы. Аналитическая модель описания газовой фазы демонстрирует приемлемое соответствие количественных и качественных характеристик процесса взаимодействия.
Модель показала математически обоснованное формирование структурированных газожидкостных образований при учете критерия неравномерности поверхности взаимодействия, что также соответствует экспериментальным данным.
В процессе моделирования на основе неустойчивости фаз (неустойчивость Тейлора) был разобран механизм гетерогенной реакции с появлением пузырьков, создающих препятствие доставки к области взаимодействия жидкого реагента. В результате чередования областей газовой и жидкой фазы формируется незначительная часть экранирования поверхности.
Системы уравнений баланса массы представленной модели позволили описать пульсационное поведение концентрации жидкого реагента и доли доступной свободной поверхности.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
На русском:
Работа выполнена в рамках государственного задания, проект № FSWF-2023-0012.
ОБОЗНАЧЕНИЯ
| ${\text{J}}{{{\text{a}}}_{D}}$ | число Якоба для диффузионных процессов |
| ${\text{S}}{{{\text{h}}}_{l}}$ | число Шервуда |
| ${\text{R}}{{{\text{e}}}_{l}}$ | число Рейнольдса для жидкости |
| ${\text{N}}{{{\text{u}}}_{d}}$ | диффузионное число Нуссельта |
| ${\text{Sc}}$ | число Шмидта |
| ${{D}_{l}}$ | коэффициент диффузии жидкого реагента |
| ${{D}_{g}}$ | коэффициент диффузии газа в жидком реагенте |
| ${{\beta }_{l}}$ | коэффициент массообмена |
| ξ | гидродинамический коэффициент сопротивления |
| ${{\rho }_{l}}$ | плотность жидкости |
| ${{j}_{g}}$ | поток массы фазы газа с единицы поверхности в секунду |
| ${{\chi }}$ | коэффициент преобразования в площадь сечения объема газа |
| ${{\gamma }_{m}}$ | стехиометрический коэффициент жидкой фазы |
| ${{\gamma }_{g}}$ | стехиометрический коэффициент газовой фазы |
| R | радиус пузырька в рассматриваемый интервал времени |
| ${{\rho }_{g}}$ | плотность газа |
| $k$ | действительная константа интенсивности химической реакции |
| ${{S}_{0}}$ | площадь твердого реактива |
| y | величина слоя жидкой фазы |
ИНДЕКСЫ
Список литературы
Panchenko S.V., Shirokikh T.V. Thermal hydraulics of moving dispersive layer of process units // Theor. Found. Chem. Eng. 2016. V. 50. № 2. P. 217. [Панченко С.В., Широких Т.В. Теплогидравлика движущегося дисперсного слоя технологических агрегатов // Теор. осн. хим. технол. 2016. Т. 50. № 2. С. 223.].
Meshalkin V.P., Bobkov V.I., Dli M.I., Orekhov V.A., Garabadzhiu A.V. Heat Conductivity of a Composite Phosphate Ore Material with Reacting Carbonate Inclusions // Theoretical Foundations of Chemical Engineering. 2022. V. 56. № 6. P. 971–977.
Meshalkin V., Bobkov V., Dli M., Dovì V. Optimization of energy and resource efficiency in a multistage drying process of phosphate pellets // Energies. 2019. T. 12. № 17. C. 3376.
Meshalkin V.P., Kulov N.N., Panchenko S.V., Dli M.I., Bobkov V.I., Chernovalova M.V. Hydrodynamic aspects of heterogeneous reduction and dissolution reactions with the evolution of gas bubbles // Theoretical Foundations of Chemical Engineering. 2021. Т. 55. № 4. P. 594. [Мешалкин В.П., Кулов Н.Н., Панченко С.В., Дли М.И., Бобков В.И., Черновалова М.В. Гидродинамические аспекты гетерогенных реакций восстановления и растворения с выделением пузырьков газа // Теорет. основы хим. технологии. 2021. Т. 55. № 4. С. 428].
Кутателадзе С.С., Накоряков В.Е. Тепломассообмен и волны в газожидкостных системах. Новосибирск: Наука, 1984.
Keil F.J. Process intensification // Reviews in Chemical Engineering. 2018. V. 34. № 2. P. 135.
Zhenga Z., Chena Y., Zhana X., Gaoa M., Wang Z. Mass transfer intensification in a novel airlift reactor assembly with helical sieve plates // The Chemical Engineering Journal. 2018. V. 342. P. 61.
Zhang X., Guo K., Qi W., Zhang T., Liu C. Gas Holdup, Bubble Behaviour, and Mass Transfer Characteristics in a Two-Stage Internal Loop Airlift Reactor with Different Screens// The Canadian journal of chemical engineering. 2017. V. 95. P. 1202.
Utikar R.P., Ranade V.V. Intensifying Multiphase Reactions and Reactors: Strategies and Examples // ACS Sustainable Chem. Eng.2017. V. 5. № 5. P. 3607.
Räsänen M., Eerikäinen T., Ojamo H. Characterization and hydrodynamics of a novel helix airlift reactor // Chemical Engineering and Processing: Process Intensification. 2016. V. 108. P. 44.
Wang, S., Guo, Y., Zheng, F., Chen, F., Yang, L. Improvement of roasting and metallurgical properties of fluorine-bearing iron concentrate pellets // Powder Technology. 2020. 376. P. 126–135.
Елизаров Д.В., Шавалеев Р.Р., Елизаров В.И. Математическое моделирование и управление процессом массопереноса в аппаратах с непрерывным контактом фаз // Теорет. основы хим. технологии. 2018. Т. 52. № 3. С. 260.
Лаптев А.Г., Карпеев С.В., Лаптева Е.А. Моделирование и модернизация тарельчатых колонн при проведении реакционно-массообменных процессов // Теорет. основы хим. технологии. 2018. Т. 52. № 1. С. 3.
Пучков А.Ю., Лобанева Е.И., Култыгин О.П. Алгоритм прогнозирования параметров системы переработки отходов апатит-нефелиновых руд // Прикладная информатика. 2022. Т. 17. № 1(97). С. 55–68.
Цирлин А.М., Гагарина Л.Г., Балунов А.И. Синтез теплообменных систем, интегрированных с технологическим процессом // Теоретические основы химической технологии. 2021. Т. 55. № 3. С. 347–358.
Ming Yan, Xinnan Song, Jin Tian, Xuebin Lv, Ze Zhang, Xiaoyan Yu, Shuting Zhang. Construction of a new type of coal moisture control device based on the characteristic of indirect drying process of coking coal // Energies. 2020. 13(16), 4162.
Деревянко М.С., Кондратьев А.В. Исследование фазовых превращений и термодинамических свойств оксидных систем // Известия высших учебных заведений. Черная металлургия. 2022. Т. 65. № 3. С. 188–189.
Лабунцов Д.А. Физические основы энергетики. Избранные труды по теплообмену, гидродинамике, термодинамике. М.: Изд-во МЭИ, 2000.
Теория тепломассообмена / Под ред. А.И. Леонтьева. М.: МГТУ, 2018.
Аксельруд Г.А., Гумницкий Я.М., Маллиc С. Исследование химического кипения в области пузырькового режима // Инженерно-физический журн. 1987. Т.53. № 2. С. 205.
Nayak D., Ray N., Dash N., (…), Pati S., De P.S. Induration aspects of low-grade ilmenite pellets: Optimization of oxidation parameters and characterization for direct reduction application // Powder Technology. 2021. 380. P. 408–420.
Пучков А.Ю., Соколов А.М., Федотов В.В. Нейросетевой метод анализа процессов термической обработки окомкованного фосфатного рудного сырья // Прикладная информатика. 2022. Т. 17. № 5. С. 62–76.
Пучков А.Ю., Дли М.И., Прокимнов Н.Н., Шутова Д.Ю. Многоуровневые алгоритмы оценки и принятия решений по оптимальному управлению комплексной системой переработки мелкодисперсного рудного сырья // Прикладная информатика. 2022. Т. 17. № 6. С. 102–121.
Belyakov N.V., Nikolina N.V. Plant protection technologies: From advanced to innovative // J. Physics: Conference Series. 2021. 1942(1), 012072.
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии