Теоретические основы химической технологии, 2023, T. 57, № 6, стр. 697-707
Экстрактивная ректификация азеотропной смеси этилацетат–этанол–вода в присутствии аминоэфира борной кислоты
А. В. Клинов a, *, А. Р. Хайруллина a, А. В. Малыгин a, И. М. Давлетбаева a
a Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: alklin@kstu.ru
Поступила в редакцию 12.01.2023
После доработки 28.06.2023
Принята к публикации 02.10.2023
- EDN: HGBSXV
- DOI: 10.31857/S0040357123060118
Аннотация
Изучено влияние аминоэфира борной кислоты, полученного на основе триэтаноламина, борной кислоты и триэтиленгликоля, на условия парожидкостного равновесия в азеотропных бинарных смесях этилацетат–этанол, этилацетат–изопропанол и трехкомпонентной смеси этилацетат–этанол–вода. Исследования проводились как экспериментальными методами открытого испарения на эбулиометре Свентославского, так и моделированием с использованием метода UNIFAC. Определены отсутствующие в литературе параметры взаимодействия группы CСОО (в составе этилацетата) с группой бора В. Предложена схема разделения азеотропной смеси этилацетат–этанол–вода экстрактивной ректификацией.
ВВЕДЕНИЕ
Этилацетат (ЭА) является важным химическим соединением, имеющим широкий спектр промышленного применения, например, в качестве растворителя эфиров целюллозы, при производстве красок, клеящих материалов, ароматизаторов. ЭА используется также в качестве экстрагента, в фармацевтической и других областях промышленности [1]. Применение этилацетата быстро возрастает из-за его низкой токсичности [2, 3] и его ежегодное производство составляет около 1.2 млн тонн [4]. Основной способ промышленного производства этилацетата связан со взаимодействием уксусной кислоты, этанола и серной кислоты в присутствии воды [5]. Как известно, смесь этилацетата, этанола и воды имеет область расслаивания и образует тройной азеотроп с температурой кипения 70.2°С, содержанием 82.6 мас. % эфира, 8.4 мас. % этанола и 9 мас. % воды. Все бинарные смеси, состоящие из этих трех компонентов, так же образуют азеотропы, два из которых гомогенные (этанол–вода, азеотроп, кипящий при 78.2°С и содержащий 96 мас. % этанола; этилацетат–этанол, азеотроп, кипящий при 71.8°С и содержащий 69.2 мас. % этилацетата) [6] и гетерогенный азеотроп (этилацетат–вода, кипящий при 70.38°С и содержащий 8.47 мас. % воды) [7–9].
Этанол так же широко применяется во многих областях промышленности и является одним из наиболее часто используемых видов биотоплива. Производство безводного этанола стало одним из важнейших вопросов во многих странах мира из-за больших усилий, направленных на использование биотоплива и уменьшения загрязнения и воздействия на окружающую среду [10]. Следовательно, выделение этилацетата и этанола из их водных смесей является важной задачей для топливной и химической промышленности.
Для разделения жидких смесей в основном используется метод дистилляции. Однако разделение азеотропных смесей обычной дистилляцией невозможно. Это обстоятельство ведет к необходимости использования специальных видов разделения, таких как экстрактивная или азеотропная дистилляция [11–15], экстракция, мембранное процессы и т.д. [16–18].
В случае экстрактивной ректификации к азеотропной смеси добавляется экстрагент, который увеличивает относительную летучесть компонентов [19, 20]. В работах [21–23] нами представлены исследования свойств аминоэфиров борной кислоты, синтезированных с использованием борной кислоты, триэтаноламина и различных гликолей и триолов, в которых показана эффективность использования аминоэфиров борной кислоты в качестве экстрагента для экстрактивной ректификации водных растворов.
В данной работе проведены исследования влияния аминоэфиров борной кислоты на условия равновесия пар–жидкость в смесях этилацетат–изопропанол и этилацетат–этанол–вода с целью использования аминоэфиров борной кислоты в качестве экстрагентов для разделения этих азеотропных смесей. Все экспериментальные исследования в данной работе проводились с использованием аминоэфира борной кислоты (АЭБК), синтезированного на основе триэтиленгликоля. Характеристики парожидкостного равновесия для тройной системы этилацетат + изопропанол + + АЭБК были получены при атмосферном давлении (101.32 кПа). По полученным экспериментальным TPXY данным для смеси этилацетат–изопрапонол были опрелелены неизвестные ранее параметры модели UNIFAC, что позволит моделировать условия равновесия пар–жидкость в растворах этилацетат–этанол–вода в присутствии аминоэфиров борной кислоты, синтезированных с использованием различных гликолей и триолов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы исследования фазового равновесия. В работе использовались два метода экспериментального изучения условий фазового равновесия пар–жидкость: метод открытого испарения и метод измерения на эбулиометре типа Свентославского. Метод открытого испарения является менее трудоемким и достаточно быстро позволяет качественно и количественно оценить влияние добавления разделяющего агента на условия фазового равновесия в азеотропной смеси в определенном интервале концентраций [24]. В том случае, когда этот метод показывал необходимую степень влияния на относительную летучесть компонентов смеси, исследования условий паро-жидкостного равновесия на эбулиометре проводились для конкретного концентрационного состава.
Экспериментальные исследования фазового равновесия пар–жидкость по методу открытого испарения подробно описаны в предыдущих работах [21–23]. Результаты эксперимента по данному методу испарения обрабатывались с использованием уравнения материального баланса. Масса i-й порции дистиллята Pi и его состав yi, измеренные в ходе эксперимента, позволяют определить зависимость изменения состава кипящей смеси xi от ее массы Li (кривые остаточных концентраций) согласно уравнениям материального баланса:
(1)
${{x}_{{i + 1}}} = \frac{{{{L}_{i}}{{x}_{i}} - {{P}_{{i + 1}}}{{y}_{{i + 1}}}}}{{{{L}_{i}} - {{P}_{{i + 1}}}}};\,\,\,\,\,i = 0 \ldots n - 1,$Для измерения равновесных составов паровой и жидкой фаз в работе использовался эбулиометр Свентославского [25] (ПАО “Химлаборприбор”), схема которого представлена на рис. 1.
Рис. 1.
Эбулиометр Свентославского: 1 – куб, 2 – насос Коттреля, 3 –карман для термометра, 4 – сепарационное пространство, 5 – холодильник, 6 – счетчик капель, 7 – переточная труба, 8, 9 – пробоотборный кран дистиллята и кубового остатка.
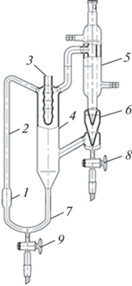
Методика проведения измерения равновесных составов паровой и жидкой фаз, а также достоверность получаемых на эбулиометре Свентославского результатов, подробно описаны в предыдущих работах [21–23].
Методы и оборудование для измерения составов. Приготовление исходных смесей и определение массы, отобранных в ходе эксперимента проб дистиллята, проводилось на весах ShincoADJ с погрешностью измерения ±0.0001 г.
Содержание воды в исходных реагентах и в отобранных пробах дистиллята определялось на волюметрическом титраторе фирмы MettlerToledo “V20 Compact Karl Fischer Volumetric” по методу Карла Фишера (с относительной погрешностью измерения ±3%).
Покомпонентный состав смеси определялся на лабораторном хроматографе “Кристалл 5000” (ЗАО СКБ “Хроматэк”) с детектором по теплопроводности. При проведении исследований использовалась капиллярная колонка ZB-FFAP 50 × 0.32 × 0.50 в режиме контроля температуры 75 °С, газ–носитель–гелий, температура детектора 220°С.
Моделирование условий фазового равновесия пар–жидкость. При невысоких давлениях связь между равновесными концентрациями компонента i в паровой yi и жидкой фазах xi определяется следующим соотношением:
здесь ${{\gamma }_{i}}$ коэффициент активности, $P_{i}^{S}$ давление насыщенных паров чистого компонента i; Р – давление в системе. Основную сложность в выражении (3) представляет расчет коэффициентов активности. Для исследуемых в данной работе систем коэффициенты активности определялись на основе метода групповых составляющих UNIFAC (UNIquac Functional-group Activity Coefficients) [26], который часто используется для предсказательных расчетов фазовых равновесий жидкость–пар, жидкость–жидкость, в том числе для целей ректификационного и экстракционного разделения веществ [27]. В основе метода UNIFAC лежит концепция группового вклада, т.е. взаимодействие между двумя молекулами представляется в виде взаимодействий между атомами или группами атомов составляющих молекулу. Предполагается, что характеристики межгруппового взаимодействия будут не сильно зависеть от принадлежности групп различным молекулам, т.е. от их атомного окружения в молекуле. Несмотря на то, что это предположение не всегда справедливо, число параметров, необходимых для описания коэффициентов активности разных веществ и их смесей, оказывается несоизмеримо меньше самого количества веществ. Кроме того, важным достоинством модели UNIFAC является ее предсказательные способности в условиях отсутствия каких-либо экспериментальных данных для веществ, входящих в рассматриваемую систему (состоят из атомов (групп) параметры взаимодействия для которых известны).В модели UNIFAC различают основные группы и подгруппы. Подгруппы основной группы энергетически идентичны, то есть они имеют одни и те же энергетические параметры взаимодействия с другими группами и различаются только геометрическими характеристиками. Например, в одну основную группу CH2 включаются подгруппы CH3, CH2, CH, С алифатических углеводородов и так далее.
При разбиении молекул на группы следует учитывать взаимное влияние близко расположенных полярных групп. Именно поэтому самостоятельной считается сложноэфирная группа COO и ее нельзя заменить простой суммой карбонильной CO- и эфирной -O-групп и т.д. [27]. В рамках модели UNIFAC для молекул воды и различных спиртов такое разбиение уже предложено в работе [28], а детали разбиения молекулы АЭБК, полученной с использованием триэтиленгликоля, показаны в [21–23]. Предлагается разбиение молекул АЭБК на следующие группы: B – группа бора, СН2 – группа алканов, CH2O – эфирная группа, CH2N – аминогруппа, OH – группа спирта. Таким образом, АЭБК состоит из 35 – СН2, 42 – OCH2, 6 – B, 9 – OH и 1 – NCH2 групп. Этилацетат состоит из 1 – СН3, 1 – СН2, 1 – СH3COO групп.
Отсутствующие в литературе данные по параметрам взаимодействия групп СН2, OCH2, NCH2, ОН, H2O с группой B ранее были определены в работе [22]. В данном исследовании по полученным экспериментальным данным были определены параметры взаимодействия группы CCОО (в составе этилацетата) с группой бора B. Анализ базы данных UNIFAC Matrix 2020 по параметрам группового взаимодействия для модели UNIFAC, представленной в Dortmund Data Bank (DDB) [29], показал отсутствие значений этих параметров. Группа ССОО является основной для многих сложных эфиров, поэтому идентификация ее энергетических параметров с группой бора позволит выполнять предсказательные расчеты коэффициентов активности различных эфиров в смесях с АЭБК.
Очевидно, что использование модели UNIFAC для описания условий фазового равновесия пар–жидкость, оказывается эффективным для растворов АЭБК. Так как молекулы АЭБК, синтезированные на основе различных гликолей, будут отличаться только количеством функциональных групп, это дает возможность предсказательного моделирования влияния АЭБК различного строения на относительную летучесть компонентов исследуемой смеси.
Коэффициенты активности в модели UNIFAC представляют в виде:
Первое слагаемое называют комбинаторным вкладом, а второе – остаточным. Для определения комбинаторного вклада в коэффициент активности требуются данные по параметрам группового объема R и групповой поверхности Q, которые связаны по значениям Ван-дер-Ваальсовского группового объема Vωk и площади поверхности Аωk (van der Waals group volume and surface areas) [30, 31]:
Для группы бора B были взяты величины Rk = = 0.9371, Qk = 0.9809 [22], для остальных групп использовались стандартные значения геометрических параметров [32].
Остаточная (энергетическая) часть коэффициента активности в групповых моделях представляется суммой вкладов групп, которые характеризуются параметром группового взаимодействия amn:
Для каждого взаимодействия между группами n и m используется два параметра amn и anm.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В задачи проведенных исследований входило экспериментальное подтверждение влияния АЭБК на относительную летучесть компонентов исследуемых смесей и получение достаточного количества экспериментальных данных по условиям фазового равновесия пар–жидкость (TPXY-данных), позволяющих определить значения неизвестных энергетических параметров эфирной группы CCОО с группой бора B. В работе [22] было показано, что для определения параметров модели UNIFAC достаточно экспериментальных данных, полученных для АЭБК с одним типом гликоля, например АЭБК. Эти параметры будут обеспечивать удовлетворительную точность расчета фазового равновесия в рассматриваемых системах при замене АЭБК на АЭБК, полученных с использованием других гликолей.
Для корректного анализа влияния АЭБК на относительную летучесть компонентов исследуемой в работе смеси и определения адекватных значений неизвестных параметров по TPXY данным, необходимо, чтобы модель UNIFAC адекватно описывала условия фазового равновесия в бинарных смесях этилацетат–этанол, этилацетат–изопропанол, этанол–вода, этилацетат–вода. Удовлетворительная точность описания TPXY данных моделью UNIFAC для системы этанол–вода была показана в работе [22]. Здесь была проверена точность описания моделью UNIFAC TPXY данных для остальных бинарных смесей и тройной смеси этилацетат–этанол–вода (табл. 1).
Таблица 1.
Точность расчета условий фазового равновесия пар–жидкость по модели UNIFAC
| Азеотропная смесь | Средняя ошибка по температуре | Средняя ошибка по концентрации | Азеотроп расчет |
Азеотроп эксперимент |
|---|---|---|---|---|
| этилацетат–этанол | 0.15 | 3.35 | Гомогенный Т = 71.19°С 68.60 мас. % этилацетата |
Гомогенный Т = 71.8°С 69.2 мас. % этилацетата [6–9] |
| этилацетат–изопропанол | 0.74 | 5.75 | Гомогенный Т = 73.94°С 72.50 мас. % этилацетата |
Гомогенный Т = 75.3°С 75 мас. % этилацетата [6–9] |
| этилацетат–вода | 1.38 | 4.59 | Гетерогенный Т = 70.89°С 91.4 мас. % этилацетата |
Гетерогенный Т = 70.4°С 91.9 мас. % этилацетата [6–9] |
| этанол –вода | 0.21 | 0.38 | Гомогенный Т = 78.05°С 95.6 мас. % этанола |
Гомогенный Т = 78.2°С 9 мас. % этанола [6–9] |
| этилацетат–этанол–вода | Гомогенный Т = 70.46°С 84.1 мас. % эфира, 8.6 мас. % этанола и 7.3 мас. % воды |
Гомогенный Т = 70.3°С 83.2 мас. % эфира, 9 мас. % этанола и 7.8 мас. % воды [6–9] |
Средняя ошибка рассчитывалась по формуле:
Из табл. 1 видно удовлетворительное описание моделью UNFAC концентраций, температур и азеотропных точек.
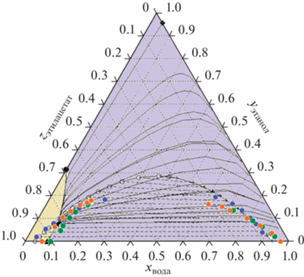
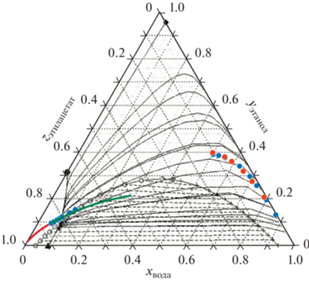
Для проверки адекватность модели UNIFAC по описанию области расслоения результаты расчета сравнивались с литературными данными [33–35] при температурах 20–25°С в тройной системе этилацетат–этанол–вода. В тройных системах этилацетат–этанол–вода расслоение происходит из-за ограниченной растворимости воды и эфира.
Результаты сравнения расчета и экспериментальных данных по области расслоения приведены на рис. 2, согласно которому результаты расчета по модели UNIFAC достаточно хорошо согласуются с экспериментальными данными.
На рис. 2 так же показаны рассчитанные с использованием модели UNIFAC линии остаточных концентраций. Видно, что трехкомпонентная смесь этилацетат–этанол–вода относится к классу 1.0-1.a по классификации Серафимова, которая включает 25 классов допустимых топологических структур диаграмм по парожидкостному равновесию для тройных смесей [36, 37]. Она содержит четыре особые точки, три бинарных азеотропа и один тройной, который разбивает диаграмму на две области дистилляции, разделенные линиями, соединяющими точку тройного азеотропа и бинарных азеотропов этилацетат–вода и этилацетат–этанол. Во второй дистилляционной области поведение дистилляционных линий не имеет особенностей и соответствует распределению чистых компонентов по летучестям (этилацетат–этанол–вода). Поэтому для надежной оценки влияния АЭБК на условия парожидкостного равновесия в исследуемой смеси по процессу открытого испарения был взят начальный состав, принадлежащий первой дистилляционной области: 0.8504 мас. доли этилацетата, 0.0966 мас. доли этанола, 0.053 мас. доли воды.
На основе метода открытого испарения была выполнена оценка влияния АЭБК на относительную летучесть выбранной смеси этилацетат–этанол–вода. На рис. 3–4 представлены линии остаточных концентраций, полученных для данной смеси при добавлении АЭБК в количестве 60 мас. %.
Рис. 3.
Кривые остаточных концентраций для смеси этилацетат–этанол–вода–АЭБК: геометрические фигуры – экспериментальные данные (синие круги – этанол, красные круги – вода); расчет по модели UNIFAC (табл. 3): для смеси без АЭБК – сплошные линии, с добавлением АЭБК 60 мас. % – пунктирные линии.
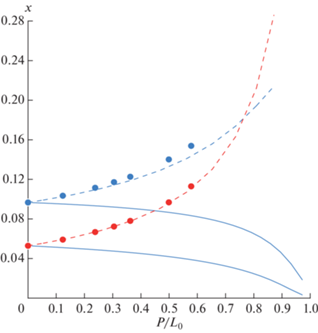
Рис. 4.
Кривые остаточных концентраций для смеси этилацетат–этанол–вода–АЭБК: геометрические фигуры – экспериментальные данные (этилацетат), расчет по модели UNIFAC (табл. 3); для смеси без АЭБК – сплошные линии, с добавлением АЭБК 60 мас. % – пунктирные линии.
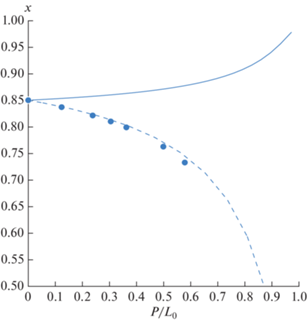
Как видно из представленных рисунков, добавление АЭБК в смесь этилацетат–этанол–вода уменьшает относительную летучесть этанола и воды (рис. 3) и увеличивает относительную летучесть этилацетата (рис. 4), что приводит к его более быстрому истощению в кубе. Такое поведение линий открытого испарения является следствием исчезновения азеотропной точки в присутствии АЭБК.
Для определения энергетических параметров группы CCОО с группой бора B необходимы данные по парожидкостному равновесию для растворов, в которых присутствуют этилацетат и АЭБК. Так как АЭБК по сравнению с этилацетатом можно считать не летучим, TPXY-данные для бинарной смеси этилацетат – АЭБК являются недостаточно информативными для надежного определения параметров. Поэтому были использованы TPXY-данные для трехкомпонентных смесей. При этом принимались во внимание следующие факторы: бинарная смесь этилацетат–вода расслаивается, что затрудняет экспериментальные исследования; этанол высокой чистоты является труднодоступным. Вследствие этого неизвестные параметры модели UNIFAC были определены по TPXY данным для смеси этилацетат–изопропанол–АЭБК, так как изопропанол высокой чистоты является более доступным по сравнению с этанолом, а его групповой состав (по виду групп) не отличается от этанола.
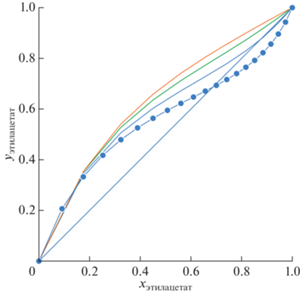
Измерение условий фазового равновесия пар–жидкость в трехкомпонентной системе этилацетат–изопропанол–АЭБК осуществлялось на эбулиометре при атмосферном давлении. Эксперимент проводился для двух концентраций АЭБК (20 и 60 мас. %). Для каждой из этих концентраций было измерено порядка 8–9 точек с различным соотношением этилацетат–изопропанол. Результаты проведенных экспериментов приведены на рис. 5–6 и в табличном виде (табл. 2). Из рис. 5–6 видно, что добавление АЭБК в систему этилацетат–изопропанол увеличивает концентрацию этилацетата в паровой фазе. Азеотропная точка пропадает при содержании АЭБК более 20 мас. %.
Рис. 5.
Диаграмма TXY для системы этилацетат–изопропанол–АЭБК: сплошная линия – АЭБК 0%, синие круги – АЭБК 20 мас. %, оранжевые круги – АЭБК 60 мас. %).
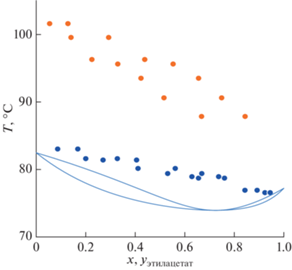
Рис. 6.
YX диаграмма для смеси этилацетат–изопропанол–АЭБК: сплошная линия – бинарная смесь АЭБК 0%, оранжевые круги – АЭБК 20 мас. %, синие круги – АЭБК 60 мас. %.
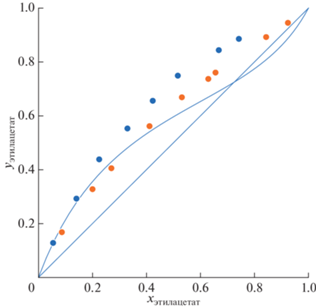
Таблица 2.
Экспериментальные TPXY-данные для смеси этилацетат–изопропанол–АЭБК
| Т, °С | Р мм рт. ст. | XIPA | XЭЦ мас. дол | YIPA | YЭЦ мас. дол |
|---|---|---|---|---|---|
| АЭБК 0.6 мас. дол | |||||
| 84.98 | 760 | 0.09 | 0.25 | 0.11 | 0.88 |
| 87.85 | 760 | 0.11 | 0.23 | 0.15 | 0.84 |
| 90.61 | 760 | 0.16 | 0.18 | 0.25 | 0.75 |
| 93.52 | 760 | 0.21 | 0.15 | 0.34 | 0.65 |
| 95.62 | 760 | 0.23 | 0.11 | 0.45 | 0.55 |
| 96.29 | 760 | 0.27 | 0.08 | 0.56 | 0.44 |
| 99.56 | 760 | 0.30 | 0.05 | 0.70 | 0.30 |
| 101.61 | 760 | 0.33 | 0.02 | 0.87 | 0.13 |
| АЭБК 0.2 мас. дол | |||||
| 76.56 | 760 | 0.06 | 0.71 | 0.05 | 0.94 |
| 76.91 | 760 | 0.12 | 0.65 | 0.11 | 0.89 |
| 78.71 | 760 | 0.26 | 0.49 | 0.24 | 0.76 |
| 78.93 | 760 | 0.28 | 0.48 | 0.26 | 0.74 |
| 79.39 | 760 | 0.36 | 0.41 | 0.33 | 0.67 |
| 80.14 | 760 | 0.45 | 0.31 | 0.44 | 0.56 |
| 81.39 | 760 | 0.56 | 0.20 | 0.60 | 0.40 |
| 81.60 | 760 | 0.62 | 0.15 | 0.67 | 0.32 |
| 83.03 | 760 | 0.71 | 0.06 | 0.83 | 0.17 |
По полученным экспериментальным TPXY данным (табл. 2) определялись энергетические параметры модели UNIFAC взаимодействия групп B с эфирной группой CCOO. Эти параметры отражают межмолекулярное взаимодействие этилацетата с АЭБК. Для определения параметров взаимодействия группы B с эфирной группой CCOO использовался метод наименьших квадратов. Средняя ошибка по температуре составила 2.8 мас. %, по концентрации 4.5 мас. %. Полученные значения параметров приведены в табл. 3.
Таблица 3.
Энергетические параметры взаимодействия групп
| Group-m | Group-n | amn | anm |
|---|---|---|---|
| B | CCOO | –176.49 | 981.00 |
Расчетным путем проверялось влияние АЭБК на бинарную смесь этилацетат–этанол. На рис. 7 представлены результаты моделирования фазового равновесия пар–жидкость для системы этилацетат–этанол в присутствии АЭБК. Видно, что в системе этилацетат–этанол азеотроп исчезает при добавлении АЭБК порядка 60 мас. %. Этилацетат в присутствии АЭБК становится легколетучим компонентом во всем диапазоне концентраций смеси.
Таким образом, добавление АЭБК в бинарные смеси этилацетат–изопропанол, этилацетат–этанол делает этилацетат в этих смесях легколетучим компонентом. Можно надеяться, что добавление АЭБК в трехкомпонентную систему этилацетат–этанол–вода даст возможность убрать все азеотропы и разделять эту смесь с использованием экстрактивной ректификации.
Адекватность определенных параметров модели UNIFAC (табл. 3) проверялась путем сравнения рассчитанных и экспериментальных линий остаточных концентраций для смеси этилацетат–этанол–вода в присутствии АЭБК, результаты которого представлены на рис. 3–4. Рассчитанные значения были получены путем решения уравнения открытого испарения [24]. Как видно из рисунка, экспериментальные и расчетные данные хорошо согласуются.
Далее, используя математическое моделирование, было исследовано влияние АЭБК на трехкомпонентную смесь этилацетат–этанол–вода. На рис. 8 приведены рассчитанные кривые остаточных концентраций для смеси этилацетат–этанол–вода при добавлении АЭБК 60 мас. %. Согласно рис. 8, без АЭБК дистилляционные линии стремятся к чистому этилацетату, а при добавлении АЭБК линии стремятся в противоположном направлении. Следовательно, добавление АЭБК в тройную смесь этилацетат–этанол–вода приводит к разрушению трех бинарных азеотропов и тройного азеотропа соответственно, что говорит об эффективности применения АЭБК в качестве экстрагента. При этом, легколетучим компонентом становится этилацетат, труднолетучим – вода, а этанол занимает среднее положение по летучести.
Рис. 8.
Кривые остаточных концентраций для смеси этилацетат–этанол–вода. Линии АЭБК 0 мас. %, точки – АЭБК 60 мас. %.
Технологическая схема для разделения смеси этилацетат–этанол–вода с использованием АЭБК. На рис. 9 представлена классическая технологическая схема разделения трехкомпонентной смеси этилацетат–этанол–вода с использованием в качестве экстрагента АЭБК. В первой ректификационной колонне К-I из разделяемой смеси выделяется этилацетат, который уходит с дистиллятом. Из куба колонны К-I удаляется смесь этанола с водой и экстрагентом. Далее эта трехкомпонентная смесь подается в ректификационную колонну К-II, где происходит отделение этанола, который концентрируется в дистилляте. Смесь экстрагента с водой из куба колонны К-II удаляется и направляется в аппарат простой перегонки K-III, где при пониженном давлении регенерируется АЭБК, а с дистиллятом уходит вода. Поток регенерированного АЭБК разделяется на два для подачи на первые тарелки в колонн К-I и К-II.
Рис. 9.
Технологическая схема получения этилацетата с малым содержанием воды и последующей регенерацией экстрагента АЭБК.
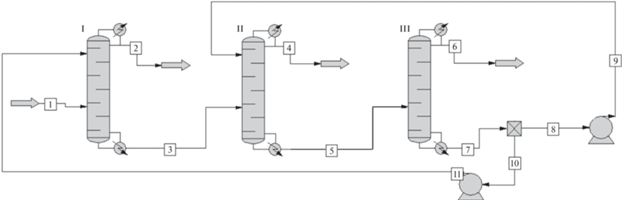
Моделирование данной технологической схемы проводилось в среде ChemCad 6.5. Процесс ректификации в колонне рассчитывался по модели теоретической тарелки, допущение о постоянстве мольных потоков пара и жидкости не использовалось. Условия фазового равновесия пар–жидкость описывались моделью UNIFAC. Отсутствующие в базе параметры группы бора брались из работы [22] и табл. 3. Условиями моделирования было получение этилацетата, этанола и воды чистотой не менее 99%. В расчетах варьировалось число тарелок в колонне, тарелка питания и флегмовое число. Соотношение экстрагента к питанию в первой колонне было принято 1.25 : 1, что обеспечивало концентрацию АЭБК в жидкой фазе порядка 60 мас. %.
Результаты расчета основных параметров технологической схемы (рис. 9) представлены в табл. 4.
Таблица 4.
Результаты расчета основных параметров технологической схемы разделения смеси этилацетат–этанол–вода
| Поток | Этилацетат, мас. дол | Этанол, мас. дол | Вода, мас. дол | АЭБК, мас. дол | Т, °С | Р, бар | Расход, кг/ч |
|---|---|---|---|---|---|---|---|
| 1 | 0.85 | 0.1 | 0.05 | 0 | 75 | 1 | 100 |
| 2 | 0.9916 | 0.0046 | 0.0038 | 0 | 70.334 | 1 | 85.71 |
| 3 | 0.00005 | 0.0583 | 0.0467 | 0.89495 | 131.61 | 1 | 164.45 |
| 4 | 0.00085 | 0.99525 | 0.0039 | 0 | 77.902 | 1 | 9.62 |
| 5 | 0 | 0.0001 | 0.0476 | 0.9523 | 160.337 | 1 | 164.3 |
| 6 | 0 | 0.0041 | 0.9959 | 0 | 45.395 | 0.1 | 4.66 |
| 7 | 0 | 0 | 0.02 | 0.98 | 117.138 | 0.1 | 159.63 |
| 8 | 0 | 0 | 0.02 | 0.98 | 117.138 | 0.1 | 9.57 |
| 9 | 0 | 0 | 0.02 | 0.98 | 117.33 | 1 | 9.57 |
| 10 | 0 | 0 | 0.02 | 0.98 | 117.138 | 0.1 | 150.06 |
| 11 | 0 | 0 | 0.02 | 0.98 | 117.33 | 1 | 150.16 |
Согласно данных, представленных в табл. 4, полученные результаты свидетельствуют об эффективности предлагаемого метода разделения в трехкомпонентной смеси этилацетат–этанол–вода с используемым в качестве экстрагента АЭБК(ТЭГ). Показатели чистоты выделяемых компонентов: этилацетат – 99.16 мас. % (поток 2), этанол – 99.53 мас. % (поток 4), вода – 99.59 мас. % (поток 6).
ВЫВОДЫ
Проведенные исследования показали, что АЭБК является перспективным экстрагентом для дистилляционного разделения бинарных и трехкомпонентных смесей, состоящих из этилацетата, этанола и воды. К достоинствам АЭБК можно отнести чрезвычайно малую летучесть, возможность молекулярной модификации за счет использования в синтезе различных гликолей, а также высокую степень влияния на относительную летучесть компонентов исследуемой смеси. Было показано, что бинарные и тройные азеотропы в этой системе исчезают при добавлении АЭБК.
Для моделирования условий фазового равновесия пар–жидкость по собственным экспериментальным данным определены неизвестные ранее энергетические параметры модели UNIFAC, описывающие взаимодействия групп B с эфирной группой ССОО. Сравнение результатов моделирования с экспериментальными TPXY данными и кривыми остаточных концентраций показали удовлетворительное согласие.
С учетом данных, представленных в наших предыдущих работах [22, 23], полученная матрица параметров UNIFAC позволяет с удовлетворительной точностью рассчитывать и прогнозировать коэффициенты активности рассматриваемых компонентов в смеси с АЭБК различного молекулярного строения. Это дало возможность использовать модель UNIFAC для расчета и поиска оптимальных схем экстрактивной ректификации смеси этилацетат–этанол–вода.
Предложена технологическая схема разделения трехкомпонентной смеси этилацетат–этанол–вода экстрактивной ректификацией с последующей регенерацией экстрагента. Показано, что требуемое содержание этилацетата и спирта ≥99 мас. % в дистилляте, может быть получено при содержании экстрагента 60 мас. %. Это говорит о высокой разделительной способности АЭБК по отношению к смесям состоящих из этилацетата, этанола и воды.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации, грант № 075-01261-22-00 “Энергосберегающие процессы разделения жидких смесей для регенерации промышленных растворителей”.
ОБОЗНАЧЕНИЯ
| yi | состав дистиллята |
| xi | состава кипящей смеси |
| Pi | масса дистиллята |
| Li | масса кипящей смеси |
| L0 | исходное количество смеси |
| n | количество отобранных проб дистиллята |
| γ | коэффициент активности |
| PS | давление насыщенных паров чистого компонента |
| Р | давление в системе |
| R | параметр группового объема |
| Q | параметр групповой поверхности |
| Vωk | групповой объем Ван-дер-Ваальса |
| Аωk | площадь поверхности Ван-дер-Ваальса |
| amn, anm | параметры энергетического взаимодействия |
| Т | температура |
Список литературы
Wang J., Liu W.B., Tan S.Y. Present situation and trend of technology of ethyl acetate // Applied Science and Technology. 2003. V. 3. P. 51.
Hu W.W., Zhang X.H., Zhang Q.G., Liu Q.L., Zhu A.M. Pervaporation dehydration of water/ethanol/ethyl acetate mixtures using poly (vinyl alcohol)–silica hybrid membranes // J. Applied Polymer Science. 2012. V. 126. № 2. P. 778. https://doi.org/10.1002/app.36962
Zhang X.H., Qing L.L., Ying X., Zhu A.M., Chen Yu, Zhang Q.G. Pervaporation dehydration of ethyl acetate/ethanol/water azeotrope using chitosan/poly (vinyl pyrrolidone) blend membranes // J. Membrane Science. 2009. 327. № 1–2. P.274. https://doi.org/10.1016/j.memsci.2008.11.034
Otera J., Nishikido J. Esterification: methods, reactions, and applications. 2nd completely rev. and enl. ed. Weinheim: Wiley-VCH, 2010. P. 374.
Справочник нефтехимика. Т. 1 / Под ред. Огородникова С.К. Л.: Химия, 1978.
Lange’s Handbook of Chemistry, 10th ed. NY: McGraw-Hill, 1923. P. 1919.
Bruno Thomas J., Haynes, William M., Lide David R., CRC Handbook of Chemistry and Physics, 44th ed. Город: издательство. Год. P. 2643.
Огородников С.К., Лестева Т.М., Коган В.Б. Азеотропные смеси. Справочник / Под ред. Когана В.Б. Л.: Химия, 1971. С. 848.
Gmehling J., Menke J., Krafczyk J., Fischer K. Azeotropic Data. N.Y.: Wiley-VCH Verlag GmbH & Co. KGaA: Weinheim, 1994.
Bastidas P.A., Gil I.D., Rodríguez G. Comparison of the main ethanol dehydration technologies through process simulation // European Symposium on Computer Aided Process Engineering, 20th. 2010.
Lei L. A combined process of salt extraction with azeotropic distillation for separation of acetic acid−water mixture // A Novel Process for Purification of Ethyl Acetate Petrochem. Technol. 1990. V. 11. P. 749.
Zhang Z., Zhang W., Yang Z., Cui X. Solvent for separating ethyl acetate-ethanol by extractive distillation // J. Chemical industry and engineering-China-. 2004. V. 55. № 2. P. 226.
Xu X.E. Advance in Catalytic Distillation // Petrochem. Technol. 1989. V. 18. P. 642.
Lei Z., Li C., Chen B. Extractive Distillation: A Review // Sep. Purif. ReV. 2003. V. 32. P. 121.
Gu Z., Zhi H., Ma Z., Yao H. Study on composite extractive distillation of ethyl acetate-ethanol-water // Computers and applied chemistry. 2005. V. 22. № 6. P. 466.
Zhang D.L., Deng Y.F., Li C.B., Chen J. Separation of Ethyl Acetate-Ethanol Azeotropic Mixture Using Hydrophilic Ionic Liquids // Ind. Eng. Chem. Res. 2008. V. 47. P. 1995. https://doi.org/10.1021/ie070658m
Chen J., Deng Y.F., Zhang D.L. Method for extracting and separating ethyl acetate-ethanol system using ion liquid. Patent 1962571 A. Китай. 2007.
Hasanoğlu A., Salt Y., Keleşer S., Özkan S., Dinçer S. Pervaporation separation of ethyl acetate–ethanol binary mixtures using polydimethylsiloxane membranes // Chemical Engineering and Processing: Process Intensification. 2005. V. 44. №. 3. P. 375. https://doi.org/10.1016/j.cep.2004.06.001
Gerbaud V., Rodriguez-Donis I., Hegely L., Lang P., Denes F., You X. Review of extractive distillation. Process design, operation, optimization and control // Chemical Engineering Research and Design. 2019. V. 141. P. 229. https://doi.org/10.1016/j.cherd.2018.09.020
Lei Z. et al. Extractive distillation with ionic liquids: a review // AIChE J. 2014. V. 60. № 9. P. 3312. https://doi.org/10.1002/aic.14537
Davletbaeva I.M., Klinov A.V., Khayrullina A.R., Malygin A.V., Dulmaev S.E., Davletbaeva A.R., Mukhametzyanov T.A. Organoboron ionic liquids as extractants for distillation process of binary ethanol + + water mixtures // Processes. 2020. V. 8. №. 5. P. 628. https://doi.org/10.3390/pr8050628
Klinov A.V., Malygin A.V., Khayrullina A.R., Dulmaev S.E., Davletbaeva I.M. Alcohol Dehydration by Extractive Distillation with Use of Aminoethers of Boric Acid // Processes. 2020. V. 8. № 11. P. 1466. https://doi.org/10.3390/pr8111466
Davletbaeva I.M., Klinov A.V., Khayrullina A.R., Malygin A.V., Madaminov N.V. Vapor–Liquid Equilibrium in Binary and Ternary Azeotropic Solutions Acetonitrile-Ethanol-Water with the Addition of Amino Esters of Boric Acid // Processes. 2022. V. 10. № 10. P. 2125. https://doi.org/10.3390/pr10102125
Gmehling J., Kleiber М., Kolbe В., Rarey J. Chemical Thermodynamics for Process Simulation / Weinheim, Germany: WILEY-VCH. 2019. P. 808.
Swietoslawski W. Azeotropy and Polyazeotropy. NY: Macmillan Company, 1963.
Fredenslund A., Jones R.L., Prausnitz J.M. Group–contribution estimation of activity coefficients in nonideal liquid mixtures // AIChE J. 1975. V. 21. №. 6. P. 1086. https://doi.org/10.1002/aic.690210607
Морачевский А.Г., Куранов Г.Л., Балашова И.М., Пиотровская Е.М., Пукинский И.Б.. Алексеева М.В., Викторов А.И., Смирнова Н.А., Термодинамика равновесия жидкость–пар. Л.: Химия. 1989.
Li Z. et al. Prediction of phase equilibria in tributyl phosphate extraction system using the unifac group contribution method // Thermochimica acta. 1990. V. 169. P. 287. https://doi.org/10.1016/0040-6031(90)80155-r
http://ddbonline.ddbst.com/DDBSearch/onlined-dboverview.exe
Reid R.C., Prausnitz J.M., Poling B.E. The Properties of Gases and Liquids. McGraw-Hill, 1987. P. 753 ISBN 10:0070517991.
Abrams D.S., Prausnitz J.M. Statistical thermodynamics of liquid mixtures: a new expression for the excess Gibbs energy of partly or completely miscible systems // AIChE j. 1975. V. 21. № 1. P. 116. https://doi.org/10.1002/aic.690210115
Bondi A. Van der Waals Volumes and Radii // The J. Physical Chemistry. 1964. V. 68. № 3. P. 441.
Arce A., Alonso L., Vidal I. Liquid-liquid equilibria of the systems ethyl acetate + ethanol+ water, butyl acetate + ethanol + water, and ethyl acetate + butyl acetate + + water // J. Chemical Engineering of Japan. 1999. V. 32. № 4. P. 440. https://doi.org/10.1252/jcej.32.440
Beech D.G., Glasstone S. Solubility influences. Part V. The influence of aliphatic alcohols on the solubility of ethyl acetate in water // J. Chemical Society. 1938. P. 67.
Lin H., Yeh Ch., Hong G., Lee M. Enhancement of liquid phase splitting of water + ethanol + ethyl acetate mixtures in the presence of a hydrophilic agent or an electrolyte substance // Fluid phase equilibria. 2005. V. 237. № 1–2. P. 21. https://doi.org/10.1016/j.fluid.2005.08.009
Serafimov L.A., Zharov V.T., Timofeev V.S. // Acta chim. Hungar. 1971. V. 69. P. 383.
Kiva V.N., Hilmen E.K., Skogestad S. Azeotropic phase equilibrium diagrams: a survey // Chemical engineering science. 2003. V. 58. № 10. P. 1903. https://doi.org/10.1016/S0009-2509(03)00018-6
Qunsheng Li, Jiguo Zhang, Zhigang Lei, Jiujuan Zhu, and Fengying Xing. Isobaric Vapor-Liquid Equilibrium for Ethyl Acetate + Ethanol + 1-Ethyl-3-methylimidazolium Tetrafluoroborate // J. Chem. Eng. Data 2009. V. 54. № 2. P. 193.https://doi.org/10.1021/je800175s
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии