Теоретические основы химической технологии, 2023, T. 57, № 6, стр. 631-637
Экстракция ионов Ti(IV) из хлоридных растворов гидрофобным глубоким эвтектическим растворителем Aliquat 336/ментол
А. В. Кожевникова a, Е. С. Уварова a, b, Д. В. Лобович a, Н. А. Милевский a, Ю. А. Заходяева a, *, А. А. Вошкин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: yz@igic.ras.ru
Поступила в редакцию 25.09.2023
После доработки 27.09.2023
Принята к публикации 29.09.2023
- EDN: HGEDXD
- DOI: 10.31857/S004035712306012X
Аннотация
Гидрометаллургические методы остаются одними из самых перспективных для переработки литий-ионных батарей, а жидкость-жидкостная экстракция служит ключевым этапом разделения сложной смеси элементов, входящих в состав анода и катода. Развитие и усложнение состава элементов питания, в частности активное производство литий-титанатных анодов, требует дополнительных исследований по экстракции. В работе подробно изучена экстракция ионов Ti(IV) гидрофобным глубоким эвтектическим растворителем Aliquat 336/ментол, который ранее успешно применялся для разделения элементов из растворов выщелачивания катодов типа NMC (LiNiMnCoO2). Были получены данные по экстракции ионов титана(IV) в зависимости от кислотности среды, концентрации хлорид-ионов, а также концентрации экстрагента в глубоком эвтектическом растворителе. На основании этих данных был предложен механизм экстракции ионов титана(IV). В завершение была предложена система для эффективной регенерации экстрагента. Результат этой работы может быть использован для создания экстракционной схемы разделения растворов выщелачивания литий-ионных батарей с литий-титанатным анодом.
ВВЕДЕНИЕ
Быстро растущий спрос на аккумуляторы для автомобильной, стационарной и мобильной техники делает производство литий-ионных аккумуляторов (ЛИА) активно развивающейся отраслью [1]. В зависимости от типа ЛИА в них содержится 47–79 мас. % различных ценных металлов, включая Li, Co, Ni и другие [2, 3]. С увеличением спроса на новые аккумуляторы также увеличивается и количество отработанных, что представляет собой потенциально ограничивающий фактор для их дальнейшего внедрения. Так, например, к 2025 г. объем собранных отходов ЛИА от электромобилей оценивается в 600 тыс. тонн [4, 5].
С момента появления литий-ионных аккумуляторов химический состав катодных и анодных материалов время от времени менялся. В последнее время материал анода из литий-титаната (LTO, Li4Ti5O12) привлекает внимание из-за большей площади поверхности (100 м2/г), чем у обычного анода из графита (3 м2/г). Анод LTO способствует более быстрой транспортировке электронов, чем графитный аналог. Более того, значение окислительно-восстановительного потенциала интеркаляции Li+ в оксиды титана выше, чем у графитового анода, что делает быструю зарядку более безопасной, поскольку позволяет избежать образования дендритов лития [6]. Поэтому разработка новой стратегии переработки такого типа батарей, в частности для борьбы с отработанными ячейками, крайне необходима.
Чаще всего в состав катодного материала батарей LTO входят оксиды переходных металлов, для которых процесс переработки может быть выполнен пиро- или гидрометаллургическим путем. Однако в результате высоких энергозатрат, газообразных выбросов и потерь лития в шлаке применение пирометаллургического процесса плавки невыгодно. Напротив, изучение гидрометаллургической переработки катодов, например, LCO (LiCoO2), NMC, LMO (LiMnO2) и т.д., из отработанных ЛИА показывает большую эффективность и экономическую целесообразность [7, 8]. Зачастую при гидрометаллургическом способе катодные и анодные материалы первостепенно выщелачивают растворами минеральных кислот, а затем из полученных растворов ступенчато извлекают металлы с использованием различных методов, например, жидкостной экстракцией [9].
На сегодняшний день наиболее перспективными экстрагентами для извлечения ионов металлов являются глубокие эвтектические растворители (deep eutectic solvents, DES). Благодаря простому процессу приготовления и зачастую низкой стоимости глубокие эвтектические растворители признаны хорошей заменой органических растворителей и ионных жидкостей [10]. В свою очередь гидрофобные глубокие эвтектические растворители (HDES) привлекают все больше внимания, поскольку преодолевают ограничения традиционных гидрофильных DES, что расширяет область их применения. HDES были впервые получены в 2015 г. путем смешения длинноцепочечных солей четвертичных аммониевых оснований с различными карбоновыми кислотами [11]. В результате смешивания HDES с водой происходит образование стабильной гетерогенной системы, что позволяет проводить экстракцию различных соединений из водных сред. Кроме того, важным преимуществом HDES является широкий выбор составляющих компонентов, благодаря чему возникает возможность управлять процессом экстракции [12].
Например, в работе [13] показано, что гидрофобный глубокий эвтектический растворитель на основе ментола в качестве акцептора водородных связей и октановой, декановой или лауриновой кислот в качестве доноров водородных связей позволяет добиться высокой степени извлечения ионов лития – 80.69%. Также было показано, что, используя в качестве HDES смесь Д2ЭГФК/ментол, степень извлечения Al(III) достигает 99.93%, Ni(II) – 25.92%, а Cu(II) – 62.48% [14].
Фосфорорганические экстрагенты показывают хорошую эффективность экстракции титана. Среди наиболее используемых нейтральных фосфорорганических экстрагентов самым эффективным является триоктилфосфиноксид, в системе с которым экстракция происходит при концентрации хлорид-ионов ниже 2 моль/л. Cyanex 923 представляет собой экстрагент Ti(IV) средней силы, а ТБФ является самым слабым экстрагентом Ti(IV), его экстракция происходит только при концентрации хлорид-ионов более 5 моль/л [15]. Однако предполагается, что кислые фосфорорганические экстрагенты не пригодны для экстракции Ti(IV) из хлоридных растворов из-за их медленной кинетики, плохой селективности и сложности реэкстракции. В работе [16] были проведены исследования по экстракции Ti(IV) из его водных солянокислых растворов в органической системе Аламин 336 – м-ксилол. Эксперимент проводился при различной концентрации соляной кислоты, в результате чего было показано, что эффективность экстракции ионов Ti(IV) увеличивается с возрастанием концентрации кислоты. Была изучена экстракция титана смесью первичных аминов N1923 (С19–С23) в керосине из раствора сернокислого выщелачивания. В результате проведенных испытаний было показано, что степень извлечения титана достигает 98.8% при концентрации экстрагента 30 об. % и соотношении фаз О : В = 2 : 1, а время перемешивания составляет 10 мин. Кислотность среды и рабочая температура не оказывают влияния на эффективность экстракции [17].
Экстракция титана гидрофобными глубокими эвтектическими растворителями достаточно слабо изучена. Однако HDES на основе деканола оказался весьма эффективен для экстракции титана при концентрациях соляной кислоты до 10 моль/л [18]. В настоящей работе в качестве донора водородной связи в HDES был выбран природный компонент – ментол, а в качестве акцептора – перспективный промышленный экстрагент Aliquat 336. Данный HDES ранее был успешно применен для разделения ионов металлов из реальных растворов выщелачивания [19].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Химические вещества, используемые в данной работе перечислены в табл. 1. Все реактивы использовались без дополнительной очистки. Исходный раствор титана готовили растворением взвешенной на аналитических весах OHAUS Explorer (Швейцария) навески TiOSO4 в 1М растворе HCl. Растворы LiCl готовили путем растворения взвешенной на аналитических весах навески соли в дистиллированной воде. Концентрацию LiCl в растворах уточняли аргентометрическим титрованием раствором AgNO3 с индикатором K2CrO4.
Таблица 1.
Используемые в работе реактивы
| Компонент | Поставщик | Номер CAS | Чистота, мас. % |
|---|---|---|---|
| Aliquat 336 | Acros | 63393-96-4 | 98 |
| L-Ментол | Acros | 2216-51-5 | 99 |
| LiCl | Химмед | 7447-41-8 | 98 |
| H2SO4 | Химмед | 7664-93-9 | 96 |
| H2O2 | Химмед | 7722-84-1 | 37 |
| TiOSO4 | Macklin | 13825-74-6 | >95 |
| HCl | Химмед | 7647-01-0 | 37 |
| Дистиллированная вода | – | – | – |
Методика приготовления HDES, используемая в данной работе, представлена в работе [20]. Эксперименты по экстракции проводили при температуре окружающей среды 25°C и атмосферном давлении ~100 кПа. Экстракцию проводили путем смешения чистого HDES с водным раствором Ti(IV) с различной концентрацией LiCl и HCl. Реэкстракцию проводили путем смешения обогащенной Ti(IV) фазы HDES с раствором H2SO4, который выступал в качестве реэкстрагента. Для интенсивного перемешивания фаз пробирки помещали в шейкер SIA ELMI RM-1L (Латвия), где в течении 30 мин и вращении 35 об/мин система достигала термодинамического равновесия. После перемешивания пробирки помещали в центрифугу SIA ELMI CM-6MT (Латвия), где при 2500 об/мин в течении 5 мин эмульсию центрифугировали до полного расслаивания фаз и после разделяли в делительных воронках. Концентрацию ионов Ti(IV) в водной фазе после экстракции определяли спектрофотометрическим методом анализа в видимой области при длине волны 400 нм с H2O2 в качестве индикатора [21] на спектрофотометре Экросхим ПЭ-5400УФ (Россия) в стеклянных кюветах с длинной оптического пути 10 мм. Концентрацию ионов Ti(IV) в органической фазе после экстракции рассчитывали по материальному балансу.
Степень извлечения E(%) Ti(IV), коэффициент распределения D и степень реэкстракции S(%) рассчитывали по формулам:
(2)
$D~\,\, = \frac{{\left[ {{\text{Ti}}\left( {{\text{IV}}} \right)} \right]_{{{\text{HDES}}}}^{{}}}}{{\left[ {{\text{Ti}}\left( {{\text{IV}}} \right)} \right]_{{\text{в}}}^{{}}}},$Представленные экспериментальные данные являются результатом серии экспериментов и обработаны методами математической статистики.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
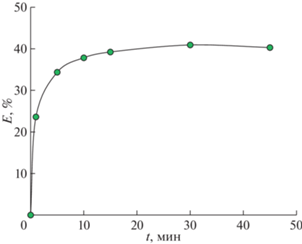
Влияние времени контакта фаз
Одним из ключевых параметров экстракционного процесса является время достижения термодинамического равновесия. Влияние времени контакта фаз при экстракционном извлечении Ti(IV) из хлоридных растворов в системе с гидрофобным глубоким эвтектическим растворителем Aliquat 336/ментол исследовали в диапазоне 1–45 мин. Результаты, представленные на рис. 1, показали, что для достижения термодинамического равновесия достаточно 30 мин, при дальнейшем увеличении времени контакта фаз степень извлечения Ti(IV) не менялась.
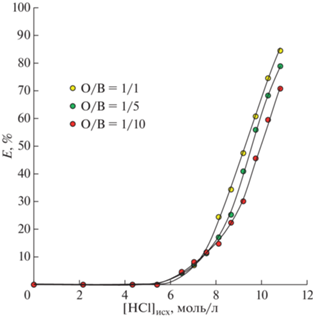
Влияние концентрации HCl
Для изучения влияния кислотности среды была построена зависимость степени извлечения ионов Ti(IV) при различном соотношении органической и водной фаз от исходной концентрации HCl в водной фазе (рис. 2). Можно заметить, что при увеличении объема органической фазы относительно водной степень извлечения возрастает, ионы Ti(IV) начинают экстрагироваться при концентрации HCl ~ 6 моль/л. Это связано с тем, что концентрация соляной кислоты влияет на форму существования ионов Ti(IV) в водном растворе, так как с повышением концентрации хлорид-ионов образуются анионные комплексы с различным координационным числом: ${\text{TiCl}}_{5}^{--}$ и ${\text{TiCl}}_{6}^{{2--}}$ и пр. [22]. При этом Aliquat 336, входящий в состав исследуемого глубокого эвтектического растворителя, является экстрагентом, извлекающим ионы металлов в виде анионных комплексов. Совокупность данных факторов говорит о том, что при увеличении концентрации HCl происходит экстракция в органическую фазу именно анионных комплексов титана.
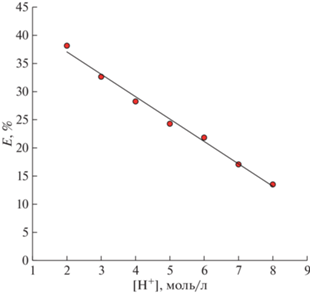
Влияние кислотности среды
Изучено влияние концентрации H+ при постоянной концентрации Cl– на извлечение ионов Ti(IV) (рис. 3). Постоянное количество хлорид-ионов поддерживали добавлением LiCl. Исходя из предполагаемого механизма анионообменной экстракции, концентрация протона никак не должна влиять на эффективность извлечения анионных комплексов, поскольку их образование зависит только от концентрации ионов хлора. Однако, как видно на рис. 3, при увеличении концентрации H+ степень извлечения ионов Ti(IV) снижается. Данный характер зависимости может быть связан с тем, что соляная кислота может экстрагироваться Aliquat 336 [23]. При этом увеличение концентрации HCl негативно сказывается на равновесной концентрации Cl– ввиду ее извлечения в фазу HDES. Как следствие, степень извлечения ионов Ti(IV) снижается, так как экстракция, по всей видимости, напрямую зависит именно от концентрации хлорид-ионов. Похожий эффект наблюдался при экстракции ионов Fe(III) [24]. При увеличении концентрации H+ выше 3.8 моль/л степень извлечения снижалась, при этом авторы [24] говорят о том, что ионы H+ не принимают участия в образовании экстрагируемого соединения.
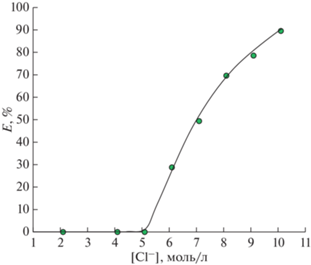
Влияние концентрации Cl–
Для изучения влияния концентрации хлорид-ионов на эффективность экстракции ионов титана(IV) при постоянной кислотности среды была построена соответствующая зависимость (рис. 4). С увеличением концентрации хлорид-ионов степень извлечения ионов Ti(IV) возрастает. Таким образом, предположение о влиянии хлорид-ионов на экстракцию ионов Ti(IV) подтверждается.
Механизм экстракции
Экстракция ионов металлов HDES на основе Aliquat 336 проходит по анионообменному механизму [22, 24, 25], уравнение которого можно записать следующим образом:
(4)
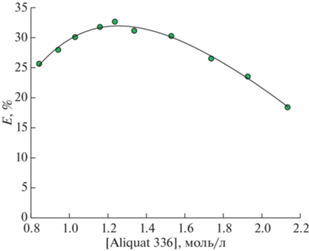
$\begin{gathered} \text{[}{\text{MeC}}{{{\text{l}}}_{n}}]_{{{\text{(в)}}}}^{{m - }} + m{\text{R}}{\kern 1pt} '{{{\text{R}}}_{3}}{{{\text{N}}}^{ + }}{\text{Cl}}_{{{\text{(o)}}}}^{ - } \leftrightarrow \\ \leftrightarrow {{({\text{R}}{\kern 1pt} '{{{\text{R}}}_{3}}{{{\text{N}}}^{ + }})}_{m}}{\text{MeC}}{{{\text{l}}}_{{n{\text{(o)}}}}} + m{\text{Cl}}_{{{\text{(в)}}}}^{ - }, \\ \end{gathered} $Поскольку, как было указано выше, из литературных данных [16, 22] известно, что при повышении концентрации Cl– ионы Ti(IV) образуют комплексные анионы ${\text{TiCl}}_{5}^{ - }$ и ${\text{TiCl}}_{6}^{{2 - }}$, то для определения коэффициента m в уравнении (4) была изучена зависимость экстракции титана от концентрации Aliquat 336 (рис. 5) в диапазоне концентраций 0.84–2.12 моль/л (Aliquat 336/ментол = = 1.5/8.5–8/2) при постоянной концентрации HCl. Результаты, представленные на рис. 5, показали, что увеличение концентрации Aliquat 336 до 1.24 моль/л улучшает экстракцию ионов Ti(IV), однако, ее дальнейшее увеличение наоборот ухудшает экстракцию, что предположительно связано с параллельно идущим процессом – экстракцией HCl [26]. При этом, при повышении концентрации Aliquat 336 экстракция HCl также увеличивается. Таким образом, эвтектический состав Aliquat 336/ментол = 3/7 (1.16 моль/л Aliquat 336) [20] является удовлетворительным для проведения дальнейших экспериментов по экстракции.
Рис. 5.
Зависимость степени извлечения ионов Ti(IV) от концентрации Aliquat 336 в фазе HDES; О/В = 1/5, [HCl] = 9 моль/л.
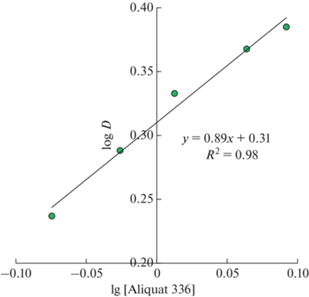
Из анализа экспериментальных данных возрастающего участка, приведенных в билогарифмическом виде, (рис. 6) следует, что в экстрагируемом комплексе одна молекула титана связывается с одной молекулой Aliquat 336 в фазе HDES.
Рис. 6.
Билогарифмическая зависимость коэффициента распределения ионов Ti(IV) от концентрации Aliquat 336 в HDES.
Таким образом, можно предположить следующий механизм экстракции ионов Ti(IV) из хлоридных растворов в системе с HDES на основе Aliquat 336:
(5)
${\text{TiCl}}_{{5\left( {\text{в}} \right)}}^{ - } + {\text{R}}{\kern 1pt} '{{{\text{R}}}_{{\text{3}}}}{{{\text{N}}}^{{\text{ + }}}}{\text{Cl}}_{{\left( {\text{о}} \right)}}^{ - }\, \leftrightarrow \,{\text{R}}{\kern 1pt} '{{{\text{R}}}_{3}}{{{\text{N}}}^{ + }}{\text{TiCl}}_{{5\left( {\text{о}} \right)}}^{ - } + {\text{Cl}}_{{\left( {\text{в}} \right)}}^{ - },$Реэкстракция
В качестве реэкстрагента был выбран раствор H2SO4 с концентрациями 1 и 2 моль/л в соотношениях О/В = 1/1 и 1/2. Полученные данные приведены в табл. 2. Во всех четырех случаях степень реэкстракции практически не различалась и достигала >99% за 3 ступени. Таким образом, наиболее подходящими условиями для реэкстракции являются: 1 моль/л H2SO4 и О/В = 1/1.
ЗАКЛЮЧЕНИЕ
В данной работе для экстракции ионов Ti(IV) впервые предложен гидрофобный глубокий эвтектический растворитель Aliquat 336/ментол. Показано, что данный экстрагент может эффективно извлекать титан при концентрации соляной кислоты от 6 до 10 моль/л даже при десятикратном избытке водной фазы. Анализ билогарифмической зависимости коэффициента распределения титана от концентрации Aliquat 336 показал, что для экстракции хлоридного комплекса титана необходима всего одна молекула четвертичного аммониевого основания. Исходя из предложенного механизма, протон не принимает участие в процессе экстракции, однако, на соответствующем графике степень извлечения снижалась при увеличении концентрации ионов H+, что, вероятно, связано с параллельной экстракцией соляной кислоты четвертичным аммонийным основанием. Возможность извлечения титана(IV) из слабокислых хлоридных растворов позволяет использовать данный экстрагент для экономически целесообразных технологических процессов. Возможность эффективно реэкстрагировать ионы титана(IV) раствором серной кислоты позволяет повторно использовать экстрагент, что также в значительной степени подчеркивает экономическую эффективность исследуемого экстрагента.
Исследование выполнено за счет гранта Российского научного фонда № 20-13-00387, https://rscf.ru/project/20-13-00387/.
Список литературы
Mohr M., Peters J.F., Baumann M., Weil M. Toward a Cell-chemistry Specific Life Cycle Assessment of Lithium-ion Battery Recycling Processes // J. Ind. Ecol. 2020. V. 24. P. 1310–1322. https://doi.org/10.1111/jiec.13021
Zen X., Li J., Singh N. Recycling of Spent Lithium-Ion Battery: A Critical Review // Crit. Rev. Environ. Sci. Technol. 2014. V. 44. P. 1129–1165.https://doi.org/10.1080/10643389.2013.763578
Winslow K.M., Laux S.J., Townsend T.G. A Review on the Growing Concern and Potential Management Strategies of Waste Lithium-Ion Batteries // Resour. Conserv. Recycl. 2018. V. 129. P. 263–277. https://doi.org/10.1016/j.resconrec.2017.11.001
Vaalma C., Buchholz D., Weil M., Passerini S. A Cost and Resource Analysis of Sodium-Ion Batteries // Nat. Rev. Mater. 2018. V. 3. P. 18013. https://doi.org/10.1038/natrevmats.2018.13
Ferg E.E., Schuldt F., Schmidt J. The Challenges of a Li-Ion Starter Lighting and Ignition Battery: A Review from Cradle to Grave // J. Power. Sources. 2019. V. 423. P. 380–403. https://doi.org/10.1016/j.jpowsour.2019.03.063
Kumar B., Srivastava R.R., Barik S.P. Hydrometallurgical Recycling of Lithium-Titanate Anode Batteries: Leaching Kinetics and Mechanisms, and Life Cycle Impact Assessment // Miner. Eng. 2023. V. 202. P. 108289. https://doi.org/10.1016/j.mineng.2023.108289
Barik S.P., Prabaharan G., Kumar L. Leaching and Separation of Co and Mn from Electrode Materials of Spent Lithium-Ion Batteries Using Hydrochloric Acid: Laboratory and Pilot Scale Study // J. Clean. Prod. 2017. V. 147. P. 37–43.https://doi.org/10.1016/j.jclepro.2017.01.095
Barik S.P., Prabaharan G., Kumar B. An Innovative Approach to Recover the Metal Values from Spent Lithium-Ion Batteries // Waste. Management. 2016. V. 51. P. 222–226.https://doi.org/10.1016/j.wasman.2015.11.004
Gao W., Song J., Cao H., Lin X., Zhang X., Zheng X., Zhang Y., Sun Z. Selective Recovery of Valuable Metals from Spent Lithium-Ion Batteries – Process Development and Kinetics Evaluation // J. Clean. Prod. 2018. V. 178. P. 833–845.https://doi.org/10.1016/j.jclepro.2018.01.040
Cao J., Su E. Hydrophobic Deep Eutectic Solvents: The New Generation of Green Solvents for Diversified and Colorful Applications in Green Chemistry // J. Clean. Prod. 2021. V. 314. P. 127965.https://doi.org/10.1016/j.jclepro.2021.127965
van Osch D.J.G.P., Zubeir L.F., van den Bruinhorst A., Rocha M.A.A., Kroon M.C. Hydrophobic Deep Eutectic Solvents as Water-Immiscible Extractants // Green Chemistry. 2015. V. 17. P. 4518–4521. https://doi.org/10.1039/C5GC01451D
Milevskii N.A., Zinov’eva I.V., Kozhevnikova A.V., Zakhodyaeva Y.A., Voshkin A.A. Sm/Co Magnetic Materials: A Recycling Strategy Using Modifiable Hydrophobic Deep Eutectic Solvents Based on Trioctylphosphine Oxide // Int. J. Mol. Sci. 2023. V. 24. P. 14032. https://doi.org/10.3390/ijms241814032
Xue K., Fan D., Wang X., Dong Z., Zhu Z., Cui P., Meng F., Wang Y., Qi J. Lithium Extraction from Aqueous Medium Using Hydrophobic Deep Eutectic Solvents // J. Environ. Chem. Eng. 2023. V. 11. P. 110490. https://doi.org/10.1016/j.jece.2023.110490
Zinov’eva I.V., Kozhevnikova A.V., Milevskii N.A., Zakhodyaeva Yu.A., Voshkin A.A. Extraction of Cu(II), Ni(II), and Al(III) with the Deep Eutectic Solvent D2EHPA/Menthol // Theoretical Foundations of Chemical Engineering. 2022. V. 56. P. 221–229. https://doi.org/10.1134/S0040579522020178
Zhu Z., Zhang W., Cheng C.Y. A Literature Review of Titanium Solvent Extraction in Chloride Media // Hydrometallurgy. 2011. V. 105. P. 304–313. https://doi.org/10.1016/j.hydromet.2010.11.006
Filiz M., Sayar A.A. Extraction of Titanium(IV) from Aqueous Hydrochloric Acid Solutions Into Alamine 336-M-XYLene Mixtures // Chem. Eng. Commun. 2006. V. 193. P. 1127–1141. https://doi.org/10.1080/00986440500354457
Tang W., Chen X., Zhou T., Duan H., Chen Y., Wang J. Recovery of Ti and Li from Spent Lithium Titanate Cathodes by a Hydrometallurgical Process // Hydrometallurgy. 2014. V. 147–148. P. 210–216. https://doi.org/10.1016/j.hydromet.2014.05.013
Zhu K., Wei Q., Liu K., Li H., Ren X. Design and Combination of Magnetic Ionic Liquids and Hydrophobic Deep Eutectic Solvents for Safer Extraction of Titanium: Physicochemical Properties and Toxicity Studies // Green. Chemistry. 2022. V. 24. P. 7481–7491. https://doi.org/10.1039/D2GC01874H
Kozhevnikova A.V., Zinov’eva I.V., Zakhodyaeva Y.A., Baranovskaya V.B., Voshkin A.A. Application of Hydrophobic Deep Eutectic Solvents in Extraction of Metals from Real Solutions Obtained by Leaching Cathodes from End-of-Life Li-Ion Batteries // Processes. 2022. V. 10. P. 2671. https://doi.org/10.3390/pr10122671
Milevskii N.A., Zinov’eva I.V., Zakhodyaeva Yu.A., Voshkin A.A. Separation of Li(I), Co(II), Ni(II), Mn(II), and Fe(III) from Hydrochloric Acid Solution Using a Menthol-Based Hydrophobic Deep Eutectic Solvent // Hydrometallurgy. 2022. V. 207. P. 105777. https://doi.org/10.1016/j.hydromet.2021.105777
Коростелев П.П. Фотометрический и Комплексометрический Анализ в Металлургии; Москва, 1984.
Kislik V., Eyal A. Acidity Dependence of Ti(IV) Extraction: A critical Analysis // Solvent Extraction and Ion Exchange. 1993. V. 11. P. 259–283. https://doi.org/10.1080/07366299308918155
Sarangi K., Padhan E., Sarma P.V.R.B., Park K.H., Das R.P. Removal/Recovery of Hydrochloric Acid Using Alamine 336, Aliquat 336, TBP and Cyanex 923. Hydrometallurgy. 2006. V. 84. P. 125–129. https://doi.org/10.1016/j.hydromet.2006.03.063
Mishra R.K., Rout P.C., Sarangi K., Nathsarma K.C. Solvent Extraction of Fe(III) from the Chloride Leach Liquor of Low Grade Iron Ore Tailings Using Aliquat 336 // Hydrometallurgy. 2011. V. 108. P. 93–99. https://doi.org/10.1016/j.hydromet.2011.03.003
Good M.L., Bryan S.E. Extraction of Group VIII Metals by Long Chain Alkyl Amines—II // J. Inorganic and Nuclear Chemistry. 1961. V. 20. P. 140–146. https://doi.org/10.1016/0022-1902(61)80471-5
Sarangi K., Padhan E., Sarma P.V.R.B., Park K.H., Das R.P. Removal/Recovery of Hydrochloric Acid Using Alamine 336, Aliquat 336, TBP and Cyanex 923 // Hydrometallurgy. 2006. V. 84. P. 125–129. https://doi.org/10.1016/j.hydromet.2006.03.063
Дополнительные материалы отсутствуют.
Инструменты
Теоретические основы химической технологии