Успехи современной биологии, 2019, T. 139, № 3, стр. 280-291
Влияние дефицита цинка на физиологические процессы и продуктивность культурных злаков
Н. М. Казнина 1, *, А. Ф. Титов 1
1 Институт биологии КарНЦ РАН, ФИЦ “Карельский научный центр РАН”
Петрозаводск, Россия
* E-mail: kaznina@krc.karelia.ru
Поступила в редакцию 29.10.2018
После доработки 23.11.2018
Принята к публикации 28.11.2018
Аннотация
Представлен обзор литературных данных, касающихся влияния дефицита цинка на основные физиологические процессы и продуктивность культурных злаков. Подчеркнута важная роль цинка в клеточном метаболизме, названы основные причины, вызывающие его дефицит. Проанализированы результаты исследований влияния недостатка цинка на рост, развитие, фотосинтез и водный обмен растений. Обсуждаются современные данные о возможных механизмах устойчивости к дефициту металла так называемых цинк-эффективных видов (сортов, генотипов) злаков. Делается вывод о том, что в основе негативных эффектов недостатка цинка на физиологические процессы у растений, в первую очередь, лежит снижение активности ферментов, в состав которых входит этот микроэлемент или в активации которых он участвует, и транскрипционных факторов, содержащих в своем составе домен “цинковые пальцы”. Предложена гипотетическая схема событий, происходящих в растениях при дефиците цинка и приводящих в конечном итоге к снижению их продуктивности.
ВВЕДЕНИЕ
Дефицит микроэлементов в почвах, используемых в хозяйственных целях, является серьезной проблемой для многих регионов и стран, поскольку он приводит к существенным потерям урожая сельскохозяйственных культур, а также к ухудшению качества получаемой продукции, что в свою очередь может негативно отражаться на здоровье человека и животных. Наиболее опасным в этом плане считается дефицит цинка, что связано с его чрезвычайно важной и многоплановой ролью в клеточном метаболизме (Marschner, 1995; Hänsch, Mendel, 2009). Например, недостаток цинка в организме человека приводит к ухудшению работы иммунной системы, ослаблению памяти, отрицательно сказывается на внутриутробном развитии ребенка. По последним данным, более 3 млрд человек в мире в той или иной степени испытывают дефицит цинка, причем, как оказалось, особенно широко это распространено в районах, где значительную часть рациона питания населения составляют злаки (Hafeez et al., 2013). Поэтому вопросам поглощения и накопления этого элемента в органах культурных злаков, в том числе в зерне, а также влияния недостатка микроэлемента на их продуктивность, уделяется самое серьезное внимание.
У высших растений дефицит цинка впервые был выявлен у риса Oryza sativa L. при его выращивании на известковых почвах Индии (Nene, 1966; Yoshida, Tanaka, 1969: цит. по Wissuwa et al., 2006). В дальнейшем симптомы дефицита цинка были обнаружены и у других злаков. Как оказалось, дефицит металла обусловлен двумя основными причинами: его недостатком в почве и/или его низкой доступностью из-за высокого содержания СаСО3, характерного для известковых почв с кислым рН, или из-за пониженной температуры почвы (Graham, Welch, 1996; Cakmak et al., 1998; Alloway, 2004; Cakmak, 2008).
Как следует из многочисленных работ, сильное влияние дефицита цинка на жизнедеятельность растений связано с многообразием функций, которые он выполняет. Этот микроэлемент входит в состав или является активатором более 300 ферментов, относящихся ко всем 6 классам (Auld, 2001). Он играет важную роль в защите клеточных мембран от перекисного окисления липидов (ПОЛ) и белков, что связано с его способностью взаимодействовать с фосфолипидами и SH-группами мембранных белков, обеспечивая поддержание структурной и функциональной целостности мембран (Marschner, 1995; Cakmak, 2011; Ghanepour et al., 2015). Цинк участвует в синтезе триптофана, который является предшественником одного из наиболее важных гормонов роста – индолилуксусной кислоты (ИУК) (Wang, Jin, 2005). Доказана необходимость этого микроэлемента для процесса деградации белков, поскольку некоторые протеазы представляют собой Zn-зависимые белки. Наконец, цинк является компонентом ДНК-связывающего домена под названием “цинковые пальцы”, который входит в состав целой группы транскрипционных факторов, играющих ключевую роль в различных внутриклеточных процессах, включая связывание ДНК и РНК, белок-белковые и РНК-белковые взаимодействия, регуляцию апоптоза и др. (Alloway, 2004). Если учитывать столь многоплановую роль цинка, то становится неудивительным то, что его дефицит оказывает сильное негативное воздействие на растения: у них замедляется рост, снижается накопление биомассы, а у злаков резко уменьшается (иногда до 80%) семенная продуктивность (Fageria, 2002; Cakmak, 2011; Lombi et al., 2011; Lu et al., 2013).
До настоящего времени недостаток цинка обычно восполняли внесением высоких доз цинксодержащих минеральных удобрений. Однако это нередко приводит к увеличению содержания металла в почве и в растениях до токсичных значений. Поэтому проводится поиск других путей решения проблемы дефицита цинка у растений, в том числе у злаков. Например, ведется селекция, направленная на создание новых сортов, обладающих способностью даже в условиях значительного дефицита цинка в почве и в растениях осуществлять нормальную жизнедеятельность и давать высокие урожаи за счет усиленного поглощения этого микроэлемента и/или его активной метаболизации и более эффективного использования в обмене веществ. Тем не менее, приходится констатировать, что пока эти исследования не привели к ощутимым результатам, что в немалой степени связано с недостаточностью знаний о нарушениях физиологических процессов у растений, обусловленных дефицитом цинка, а также о механизмах их устойчивости к этому виду стрессового воздействия.
Исходя из вышеизложенного, задачей настоящего обзора явилось обобщение имеющихся литературных данных о влиянии дефицита цинка на основные физиологические процессы и продуктивность культурных злаков.
ВЛИЯНИЕ ДЕФИЦИТА ЦИНКА НА ОСНОВНЫЕ ФИЗИОЛОГИЧЕСКИЕ ПРОЦЕССЫ У ЗЛАКОВ
Симптомы дефицита цинка у злаков сравнительно легко выявляются визуально: у растений тормозится рост, наблюдается потеря листьями тургора, уменьшается их площадь, изменяется окраска (бронзовость листьев), а у молодых листьев обнаруживается межжилковый хлороз (Broadley et al., 2007). Указанные нарушения отмечены у ячменя (Genc et al., 2003; Lombnaes, Singh, 2003), пшеницы (Rengel, Graham, 1995; Cakmak et al., 1996; Cakmak, Braun, 2001), кукурузы (Wang, Jin, 2005), риса (Chen et al., 2008; Hajiboland, Beiramzaden, 2008; Frei et al., 2010). Однако, как отмечают авторы, они проявляются только при довольно сильном недостатке цинка, тогда как при более слабом его дефиците негативный эффект может выявляться лишь на уровне физиолого-биохимических процессов (Alloway, 2004; Höller et al., 2014).
Рост. Влияние недостатка цинка на рост культурных злаков сравнительно хорошо изучено. Установлено, что при дефиците металла замедляется рост корневой системы у риса (Gao et al., 2005; Hajiboland, Beiramzaden, 2008), кукурузы (Wang, Jin, 2005), ячменя (Hajiboland, Beiramzaden, 2008), у твердой и мягкой пшеницы разных генотипов (Cakmak et al., 1996, 1997, 1998). При этом у растений уменьшаются длина наиболее развитого корня и биомасса корней, диаметр корней (истончение корней) и количество корневых волосков (Genc et al., 2003; Broadley et al., 2007; Ricachenevsky, 2015). При недостатке цинка задерживается также рост надземных органов. В результате растения характеризуются меньшей высотой побега, длиной междоузлий, размерами листа, значительно уменьшается и их надземная биомасса (табл. 1).
Таблица 1.
Влияние дефицита цинка на биомассу побегов у злаков
| Вид, сорт (генотип) | Содержание Zn2+ в надземной биомассе, мг/г сухой массы | Биомасса побегов,
% по отношению к контролю* |
Источник |
|---|---|---|---|
| Avena sativa | |||
| сорт Garry | 6.3 | 32 | Cakmak et al., 1998 |
| Hordeum vulgare | |||
| сорт Yesevi | 7.6 | 67 | Cakmak et al., 1998 |
| сорт BRRI 33 | 7.7 | 83 | Kabir et al., 2017 |
| генотип К150 | 7.8 | 50 | Gao et al., 2005 |
| генотип Jalmagna | 10.0 | 32 | Wissuwa et al., 2006 |
| генотип IR 74 | 14.8 | 63 | Höller et al., 2014 |
| генотип IR 74 | 17.0 | 64 | Frei et al., 2010 |
| генотип Dashti | – | 31 | Hajiboland, Beiramzadeh, 2008 |
| Oryza sativa | |||
| генотип Erjiufeng | 18.6 | 71 | Chen et al., 2008 |
| Secale sereale | |||
| сорт Aslim | 9.3 | 76 | Cakmak et al., 1998 |
| Sorghum bicolor | |||
| cорт BTx623 | 8.0 | 75 | Li et al., 2013 |
| Triticale | |||
| сорт Presto | 7.3 | 73 | Cakmak et al., 1998 |
| Triticum aestivum | |||
| сорт Bezostaja-1 | 6.7 | 66 | Cakmak et al., 1998 |
| cорт Excalibur | 7.0 | 38 | Rengel, Graham, 1995 |
| сорт Xinmai13 | 12.0 | 31 | Mai et al., 2011 |
| генотип Vatan | 20.0 | 33 | Maqsood et al., 2011 |
| Triticum durum | |||
| cорт Kunduru-1149 | 6.1 | 40 | Cakmak et al., 1998 |
| Zea mays | |||
| сорт Zhongdan 9409 | 16.1 | 56 | Wang et al., 2009 |
Примечание: * – здесь и в табл. 2–4 за контроль принимался вариант опыта с оптимальным содержанием цинка; прочерк – не измерялось.
Анализ литературы показывает, что торможение роста растений при недостатке металла является следствием целого ряда структурно-функциональных изменений и нарушений. В частности, обнаружено, что недостаток металла негативно отражается на активности меристематических клеток, подавляя в 2–3 раза скорость их деления, а также нарушая растяжение и дифференциацию (Hossian et al., 1997). Отчасти это может быть связано со снижением активности цинк-зависимых ферментов, участвующих в дыхании (глицер-альдегид-3-фосфатдегидрогеназа, альдолаза), поскольку в период активного деления клеток повышается запрос на энергетические и пластические ресурсы, образуемые в ходе этого процесса (Marschner, 1995; Hacisalihoglu et al., 2003; Li et al., 2013). Показано также, что недостаток цинка вызывает, например, у кукурузы, нарушения в биосинтезе РНК (Удрис, Нейланд, 1983). Замедление растяжения клеток в этих условиях может являться следствием снижения поступления в них воды из-за уменьшения размеров корневой системы.
Основные события, происходящие в растениях при дефиците цинка и приводящие к снижению их продуктивности.
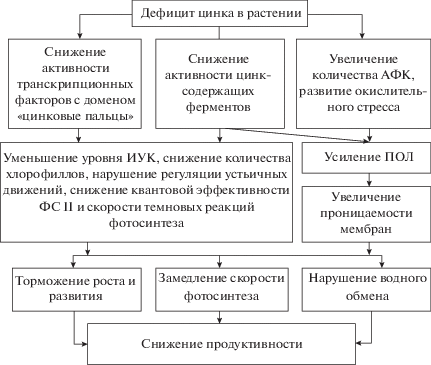
Помимо этого, при дефиците цинка снижается уровень ИУК. Предполагается, что это обусловлено уменьшением количества триптофана (предшественника ИУК), синтез которого в отсутствие металла заметно тормозится в результате снижения активности триптофансинтетазы – одного из ферментов, участвующих в процессе его образования на заключительном этапе (Broadley et al., 2007). Кроме того, при дефиците цинка уменьшается активность транскрипционного фактора miRl66 (содержащего домен “цинковые пальцы”), который участвует в регуляции синтеза ИУК (Boualem et al., 2008; Ilegems et al., 2010; Li et al., 2013). Нельзя не отметить и то, что цинк входит в состав активного центра рецептора ауксина – белка ABP1 (auxin-binding protein 1), который при связывании ауксина запускает экспрессию всех ауксин-регулируемых генов. Считают, что утрата функции этого белка, в том числе при отсутствии цинка в клетках, приводит к потере жизнеспособности растения (Лутова и др., 2011).
Помимо причин, указанных выше, отрицательное воздействие дефицита цинка на рост растений обусловлено также его участием в поддержании структурной целостности мембран клетки, о чем уже упоминалось. При его недостатке повышается уровень ПОЛ, увеличивается проницаемость мембран, что в конечном итоге негативно отражается на ростовых процессах.
Наконец, рост злаков при дефиците цинка может замедляться вследствие изменений и/или нарушений других физиологических процессов. Так, обнаружено, что недостаток этого микроэлемента приводит к нарушениям в минеральном питании растений, вызывая дисбаланс между макро- и микроэлементами (Hafeez et al., 2013). В частности, в надземных органах уменьшается содержание фосфора, калия, кальция, магния и натрия (Huang et al., 2000; Zhu et al., 2001), тогда как поступление ряда других элементов, таких, например, как медь, магний или железо, наоборот, увеличивается до избыточных значений (Wissuwa et al., 2006). Помимо этого, торможению роста злаков в условиях недостатка цинка способствуют также снижение фотосинтетической активности и нарушение водного режима, о чем речь пойдет ниже.
Развитие. Наряду с торможением роста недостаток цинка приводит к задержке развития злаков. В частности, обнаружено, что цинк играет важную роль в индукции процессов перехода от вегетативной фазы развития к генеративной (Pandey et al., 2010), и при недостатке этого микроэлемента у злаков задерживается наступление фаз выхода в трубку и колошения, замедляется формирование репродуктивных органов (Römheld, Marschnar, 1991; Hacisalihoglu, Kochian, 2003; Broadley et al., 2007). Полагают, что подобный эффект во многом связан с уменьшением активности белков с доменом “цинковые пальцы” (в том числе ряда транскрипционных факторов), участвующих в процессе формирования репродуктивной меристемы из вегетативной (Colasanti et al., 1998), поскольку таких белков довольно много. Например, у риса во время перехода растений к репродуктивному развитию обнаружено увеличение уровня экспрессии 39 генов транскрипционных факторов, имеющих этот домен (Agarwal et al., 2007).
Необходимо указать и на отмеченную рядом авторов задержку наступления у цинк-дефицитных растений фазы созревания семян, которая включает многочисленные биохимические процессы, в том числе связанные с ассимиляцией углерода и азота и с синтезом различных белков и липидов в зерне. Обнаружено, что на ранних стадиях созревания семян цинк аккумулируется в больших количествах в вакуолях эндосперма в виде фитата, однако на более поздних фазах развития семени он полностью исчезает (Otegui et al., 2002). Отсюда сделан вывод о том, что цинк необходим в фазе созревания cемян, однако в каких конкретно процессах, происходящих в это время в семени, он участвует, пока не ясно.
Фотосинтез. Хорошо известно, что снижение продуктивности растений в неблагоприятных условиях во многом связано с уменьшением активности их фотосинтетического аппарата (ФСА). В целом ряде исследований было обнаружено, что при недостатке цинка у злаков значительно тормозится скорость фотосинтеза (табл. 2), что является следствием многочисленных изменений и/или нарушений в ФСА. В первую очередь отмечают уменьшение в этих условиях содержания хлорофиллов, визуально выявляемое по хлорозу листьев (Wang, Jin, 2005; Chen et al., 2008; Hajiboland, Beiramzadeh, 2008). Подобный эффект связывают со снижением активности некоторых ферментов, участвующих в биосинтезе зеленых пигментов (Balashouri, 1995). Кроме того, обнаружено, что дефицит металла вызывает у злаков различные изменения в ультраструктуре хлоропластов: деформацию пластид, нарушение структуры внешней мембраны (Chen et al., 2008) и мембран тилакоидов (Sasaki et al., 1998; Chen et al., 2008), деградацию ламелл, а в некоторых случаях наблюдали даже полное разрушение ультраструктуры хлоропластов (Chen et al., 2008).
Таблица 2.
Влияние дефицита цинка на интенсивность фотосинтеза у злаков
| Вид, сорт (генотип) | Интенсивность фотосинтеза, % по отношению к контролю |
Источник |
|---|---|---|
| Oryza sativa | ||
| генотип Erjiufeng | 13 | Chen et al., 2008 |
| генотип Dashti | 45 | Hajiboland, Beiramzadeh, 2008 |
| Sorghum bicolor | ||
| сорт BTx623 | 22 | Li et al., 2013 |
| Triticum aestivum | ||
| cорт Московская 39 | 65 | Kaznina, Titov, 2017 |
| Zea mays | ||
| сорт L 41 | 18 | Munirah et al., 2015 |
| сорт Zhongdan 9409 | 17 | Wang et al., 2009 |
| cорт Yuzhou County | 42 | Liu et al., 2016 |
| cорт не указан | 68 | Salama et al., 2012 |
Некоторые авторы связывают замедление скорости фотосинтеза при дефиците цинка с изменениями, затрагивающими световую фазу этого процесса. В частности, обнаружено, что при недостатке металла у кукурузы (Wang, Jin, 2005) и пшеницы (Römheld, Marschnar, 1991) замедляется фотосинтетический транспорт электронов, а у мягкой пшеницы (Wang, Jin, 2005) и риса (Chen et al., 2008) снижается потенциальная и реальная квантовая эффективность фотосистемы II (ФС II). По последним данным это может быть связано, по крайней мере отчасти, со снижением активности цинксодержащего фермента – карбоангидразы (КА), разные формы которой обнаружены во многих клеточных органеллах растений, в том числе и в хлоропластах (Руденко и др., 2015). По мнению авторов, влияние КА, обнаруженной в люмене тилакоидов (а именно, βКА), на световые реакции фотосинтеза может быть связано с ее участием в процессах, происходящих в системе окисления воды.
Необходимо также отметить важную роль КА (в частности, αКА) для темновых реакций фотосинтеза, а именно для обеспечения рибулозобисфосфаткарбоксилазы (РУБИСКО) молекулами СО2 (Руденко и др., 2015; Ignatova et al., 2011). Оказалось, что у цинк-дефицитных растений снижение активности КА приводит к подавлению карбоксилазной активности РУБИСКО, что отрицательно отражается на скорости фотосинтеза. Кроме того, некоторые КА (αКА1 и βКА4) участвуют в контроле газообмена между растением и атмосферой за счет регуляции движения устьиц (Hu et al., 2010). Возможно, нарушением движения устьиц вследствие снижения активности КА и можно объяснить наблюдаемое при дефиците цинка уменьшение устьичной проводимости у злаков: риса (Chen et al., 2008; Hajiboland, Beiramzadeh, 2008), кукурузы (Wang et al., 2009) и тритикале (Arough et al., 2016), что корреспондировало со снижением скорости фотосинтеза.
Еще одной причиной замедления скорости фотосинтеза у злаков в условиях недостатка цинка является развитие в клетке окислительного стресса. Цинк, как известно, играет заметную роль в регуляции генерации активных форм кислорода (АФК) и в предотвращении нарушений клеточных мембран различными АФК (Cakmak, 2000), что связано с его функцией сохранения структурной целостности мембран (Höller et al., 2014; Ma et al., 2017). Однако, помимо этого, цинк влияет на активность ряда антиоксидантных ферментов (Cakmak, 2000), например, Cu/Zn-супероксиддисмутазу (Cu/ZnСОД) – один из ключевых ферментов антиоксидантной защиты, в состав которого входит этот металл. Обнаружено, что при дефиците цинка активность Cu/ZnСОД у ржи снижается в 2–3 раза по сравнению с вариантом, где его содержание было оптимальным (Cakmak et al., 1998; Hajiboland, Beiramzadeh, 2008), а у твердой пшеницы – более чем в 5 раз (Cakmak et al., 1998). Помимо этого, в условиях недостатка цинка зафиксировано снижение активности и других антиоксидантных ферментов, а также неферментативных компонентов антиоксидантной системы (АОС) (табл. 3). Снижение активности АОС в условиях дефицита цинка приводит к увеличению содержания АФК в клетках и развитию в них окислительного стресса, что в свою очередь вызывает структурные и функциональные нарушения в клеточных мембранах, негативно отражаясь на процессе фотосинтеза. По мнению ряда авторов, именно нарушение окислительно-восстановительных процессов у растений при недостатке цинка служит основной причиной его отрицательного влияния на фотосинтез (Sharma et al., 2004; Höller et al., 2014).
Таблица 3.
Влияние дефицита цинка на активность компонентов АОС у злаков
| Вид, сорт (генотип) | Компонент АОС | Изменение активности (содержания),
% по отношению к контролю |
Источник |
|---|---|---|---|
| Ферменты АОС | |||
| Oryza sativa сорт BRRI 33 |
КАТ | 73 | Kabir et al., 2017 |
| ПОД | 42 | Kabir et al., 2017 | |
| генотип Dashti | СОД | 47 | Hajiboland, Beiramzadeh, 2008 |
| Secale sereale | |||
| сорт Aslim | СОД | 34 | Cakmak et al., 1998 |
| Triticum aestivum | |||
| сорт Bezostaja-1 | СОД | 29 | Cakmak et al., 1998 |
| генотип BDME | Cu/Zn СОД | 32 | Hacisalihoglu et al., 2003 |
| сорт Yumai 49-198 | CОД | 74 | Ma et al., 2017 |
| ГР | 68 | Ma et al., 2017 | |
| КАТ | 63 | Ma et al., 2017 | |
| АПО | 52 | Ma et al., 2017 | |
| Triticum durum | |||
| cорт Kunduru-1149 | CОД | 20 | Cakmak et al., 1998 |
| Zea mays | |||
| сорт Zhongdan 9409 | СОД | 66 | Wang, Jin, 2005 |
| сорт Zhongdan 9409 | ПОД | 75 | Wang, Jin, 2007 |
| Неферментативные компоненты АОС | |||
| Oryza sativa | |||
| генотип IR 74 | Аскорбат | 62 | Frei et al., 2010 |
| генотип IR 74 | Аскорбат | 62 | Höller et al., 2014 |
| Triticum aestivum | Общее содержание фенолов | 86 | Ma et al., 2017 |
| сорт Yumai 49-198 | Общее содержание флаваноидов | 89 | Ma et al., 2017 |
Водный обмен. Одним из наиболее ярко выраженных внешних симптомов дефицита цинка у растений является потеря тургора листьями и их завядание. Тем не менее до сих пор роль этого микроэлемента в водном обмене остается слабо изученной. В основном указывается, что у цинк-дефицитных растений замедлена интенсивность транспирации (Hajiboland, Beiramzadeh, 2008; Wang et al., 2009; Hajiboland, Amirazad, 2010), что в значительной степени связано с частичным закрытием устьичной щели. Полагают, что сильный стресс, вызванный недостатком этого микроэлемента, приводит к снижению содержания калия в замыкающих клетках и, как следствие, к нарушению регуляции открытия устьиц (Sharma et al., 1995). В свою очередь, увеличение оттока калия из клеток в этих условиях связано с нарушением целостности мембран (Khan et al., 2004), а также с уменьшением содержания ИУК, которая обеспечивает поступление калия в замыкающие клетки (Мейчик, Балнокин, 2005).
Как известно, в условиях умеренного стресса снижение интенсивности транспирации может являться адаптивной реакцией растений, направленной на поддержание необходимого уровня оводненности тканей. Вместе с тем, как обнаружено в ряде исследований, у злаков при недостатке цинка уменьшается содержание воды в тканях корня и побега, вызывая падение тургора листьев (Hafeez et al., 2013; Munirah et al., 2015). Предполагается, что это является, с одной стороны, следствием замедления роста корня и уменьшения площади поглощающей поверхности, а с другой – ухудшением транспорта воды в надземные органы, возможно, из-за участия этого металла в формировании проводящих сосудов ксилемы (Hafeez et al., 2013). Но в целом, можно сделать вывод, что нарушение водного обмена растений наблюдается лишь при довольно сильном или длительном стрессе, вызванном дефицитом цинка.
СЕМЕННАЯ ПРОДУКТИВНОСТЬ ЗЛАКОВ В УСЛОВИЯХ ДЕФИЦИТА ЦИНКА
Одним из наиболее важных последствий негативного воздействия дефицита цинка на растения злаков является значительное снижение их семенной продуктивности (табл. 4). При этом помимо уменьшения общего урожая семян наблюдается отрицательное влияние и на отдельные компоненты семенной продуктивности. В частности, обнаружено уменьшение числа репродуктивных побегов, размеров колоса, количества колосков и зерен в колосе, массы зерновки и 1000 семян. Например, у гибрида кукурузы Pioneer-32F при недостатке цинка почти в 2 раза уменьшалось число зерен в колосе (Ehsanullah et al., 2015), а у сорта Xundan N 29 уменьшались длина початка и масса 1000 семян (Liu et al., 2016). У мягкой пшеницы сорта Yumai 49-198 при дефиците цинка меньше, чем при его оптимальном содержании, – зерен в колосе и масса семени (Ma et al., 2017), а у сорта Siran 2008 – масса 1000 семян (Khattak et al., 2015). Как показывает анализ литературы, такого рода изменения являются следствием, с одной стороны, нарушений в физиолого-биохимических процессах, а с другой – отрицательного эффекта недостатка цинка на формирование органов цветка, процессы опыления и оплодотворения растений. В частности, при дефиците металла происходит нарушение микроспорогенеза и гаметогенеза (Marschner, 1995; Mousavi, 2011), выявлены изменения морфологии органов цветка, а именно, уменьшение размеров пестика (Pandey et al., 2006), тычиночной нити и пыльников (Sharma et al., 1987); обнаружена задержка формирования пыльцевой трубки и уменьшение фертильности пыльцы (Outten, o’Halloran, 2001; Pandey et al., 2006), а также нарушение формирования пыльцевых зерен (Sharma et al., 1987; Pandey et al., 2010). Вопрос о причинах указанных изменений пока остается открытым. Предположительно, они могут быть связаны с торможением митоза, с уменьшением активности факторов транскрипции с доменом “цинковые пальцы”, которые участвуют в развитии и функционировании пыльников и пыльцевых зерен (Agarwal et al., 2007), и со снижением активности эстеразы – фермента, участвующего в прорастании пыльцы (Pandey et al., 2010).
Таблица 4.
Влияние дефицита цинка на семенную продуктивность злаков
| Вид, сорт (генотип) | Cнижение урожая зерна, % по отношению к контролю | Источник |
|---|---|---|
| Triticale | ||
| сорт Presto | 57 | Cakmak et al., 1997 |
| сорт Joanilo | 69 | Arough et al., 2016 |
| Triticum aestivum | ||
| сорт Siran 2008 | 55 | Khattak et al., 2015 |
| сорт Faisalabad-2008 | 74 | Chattha et al., 2017 |
| сорт Yumai 49-198 | 87 | Ma et al., 2017 |
| Triticum durum | ||
| генотип Gediz-75 | 69 | Abdoli, Esfandiari, 2017 |
| генотип Ozbek | 64 | Abdoli, Esfandiari, 2017 |
| Zea mays | ||
| сорт L 41 | 75 | Munirah et al., 2015 |
| сорт Xundan N 29 | 87 | Liu et al., 2016 |
| гибрид Pioneer-32F10 | 68 | Ehsanullah et al., 2015 |
ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ ЦИНКА РАСТЕНИЯМИ
В настоящее время в зарубежной литературе, посвященной недостатку цинка в растениях, широко используется понятие “zinc efficiency”, что можно перевести как эффективность использования растением цинка (ЭЦ). Установлено, что цинк-эффективные растения, в отличие от цинк-неэффективных, способны поддерживать высокие темпы роста и давать высокие урожаи семян даже при низком содержании металла в почве и в органах. При этом они характеризуются более активным поглощением металла корнями в условиях дефицита этого элемента, а также более активным транспортом ионов в надземные органы (Graham, Rengel, 1993), что, по крайней мере отчасти, достигается изменением морфологии корневой системы (Rengel et al., 1998; Chen et al., 2009), а также способностью растений лучше сохранять стабильность клеточных мембран в этих условиях (Rengel et al., 1995). Кроме того, у цинк-эффективных растений при недостатке металла в почве в гораздо большей степени увеличивается концентрация фитосидерофоров – производных мугеновых кислот, которые, связывая двухвалентные катионы металлов, в том числе цинка, обеспечивают лучшее их поглощение корнями (Carmak et al., 1996; Suzuki et al., 2006; Arnold et al., 2010). Это зафиксировано у некоторых генотипов мягкой пшеницы (Genc et al., 2003), ячменя и риса (Suzuki et al., 2006). Необходимо отметить и обнаруженное у цинк-эффективных растений усиление в условиях дефицита металла экспрессии генов ряда транспортных белков и увеличение их активности, что обеспечивает более активный транспорт цинка из внешней среды в клетки корня и далее из корней в надземные органы (Чен и др., 2008; Cakmak et al., 1996; Rengel et al., 1998; Cakmak, Braun, 2001).
Однако отметим, что существует и другая точка зрения (Cakmak, Engels, 1999; Hacisalihoglu et al., 2003; Sinclair, Krämer, 2012), согласно которой гораздо более важны в этом плане физиолого-биохимические процессы, происходящие в надземных органах. В частности, изменения во внутриклеточной компартментации цинка, позволяющие повысить уровень металла в цитоплазме клеток листа, что может способствовать более эффективному его использованию в тех процессах, где этот металл необходим (Hacisalihoglu, Kochian, 2003). Близки к этому пониманию также те авторы, которые объясняют высокую ЭЦ более эффективной метаболизацией цинка. Так, у цинк-эффективных генотипов пшеницы, ячменя и риса активность ферментов СОД и карбоангидразы, содержащих в своем составе этот элемент, заметно выше, чем у цинк-неэффективных, при практически равных концентрациях металла в листьях (Rengel, Graham, 1995; Cakmak et al., 1997; Hacisalihoglu, Kochian, 2003).
ЗАКЛЮЧЕНИЕ
Как отмечено во введении, дефицит цинка у злаков был выявлен еще в 1960-х гг., однако ясное понимание причин его негативного влияния на растения, в том числе на физиологические процессы, до сих пор отсутствует. На наш взгляд, это объясняется рядом причин. Во-первых, крайне сложно провести сравнительную оценку устойчивости к недостатку цинка отдельных физиологических процессов растений из-за недостаточной изученности некоторых из них, в частности, водного режима и процесса развития. Во-вторых, весьма затруднен анализ имеющихся в литературе данных, поскольку во многих работах отсутствуют сведения относительно содержания цинка в подземных и надземных органах. В результате практически невозможно объективно оценить уровень стрессового воздействия, которое испытывают растения при дефиците цинка в том или ином случае. Хотя известно, что концентрации металла в органах, вызывающие четко выраженные симптомы его дефицита, различны у разных видов. Например, по некоторым данным для риса эта концентрация составляет 15 мг/кг сухой массы листьев, для пшеницы – 20 мг/кг, а для кукурузы – 22 мг/кг (Zinc…, 2001). Наконец, весьма ограничено число изученных с этой точки зрения видов злаков (сортов, генотипов), проявляющих высокую ЭЦ, вследствие чего не вполне ясно, чем она обеспечивается.
Тем не менее, исходя из анализа литературы можно сделать вывод, что в основе негативных эффектов недостатка цинка на физиологические процессы у растений, в первую очередь, лежит снижение активности большого количества ферментов, в состав которых входит этот микроэлемент или в активации которых он участвует, и транскрипционных факторов, содержащих в своем составе домен “цинковые пальцы”. Это приводит к целому ряду изменений в клеточном метаболизме, включая нарушение гормонального баланса (уменьшение содержания ИУК), снижение содержания фотосинтетических пигментов и квантовой эффективности ФС II, подавление скорости темновых реакций фотосинтеза, а также отток калия из замыкающих клеток устьиц, приводящий к нарушению регуляции устьичных движений. При сильном дефиците цинка в клетках резко возрастает количество АФК и развивается окислительный стресс, одним из следствий которого является увеличение проницаемости клеточных мембран. Указанные изменения отрицательно сказываются на основных физиологических процессах: у растений тормозится рост и развитие, замедляется скорость фотосинтеза, нарушается водный обмен, и как результат – заметно снижается их продуктивность, что отражено на схеме (рисунок).
Вполне понятно, что предложенная нами схема влияния дефицита цинка на растения довольно условна и в дальнейшем требует доработки. Однако для этого необходимо продолжать изучение влияния дефицита цинка на основные физиологические процессы у растений, в том числе с целью выявления основных причин снижения у них семенной продуктивности. Кроме того, представляется важным уделить особое внимание изучению цинк-эффективных видов (сортов, генотипов) культурных растений, и прежде всего злаков, и выявить механизмы, которые позволяют им даже при значительном дефиците цинка поддерживать на высоком уровне активность основных физиологических процессов и давать высокие урожаи семян при сохранении качества получаемой продукции.
Список литературы
Лутова Л.А., Ежова Т.А., Додуева И.Е., Осипова М.А. Генетика развития растений. СПб: Наука, 2011. 432 с.
Мейчик Н.Р., Балнокин Ю.В. Вода в жизни растений // Физиология растений / Ред. И.П. Ермаков. М.: Академия, 2005. С. 276–305.
Руденко Н.Н., Игнатова Л.К., Федорчук Т.П., Иванов Б.Н. Карбоангидразы фотосинтезирующих клеток высших растений // Биохимия. 2015. Т. 80. Вып. 6. С. 798–813.
Удрис Г.А., Нейланд Я.Н. Биологическая роль цинка. Рига: Зинатне, 1981. 180 с.
Чен В.Р., Фен И., Чао И.Э., Ян С.Э. Геномный анализ и специфичность экспрессии генов OSZIP1, OSZIP3 и OSZIP4 у двух сортов риса с различной эффективностью усвоения цинка // Физиол. раст. 2008. Т. 55. С. 441–452.
Abdoli M., Esfandiari E. Assessment of genetic variation and zinc deficient tolerance in spring durum wheat (Triticum durum Desf.) genotypes in calcareous soil with zinc deficiency // J. Genet. Res. 2017. V. 3 (1). P. 7–17.
Agarwal P., Arora R., Ray S. et al. Genome-wide identification of C2H2 zinc-finger gene family in rice and their phylogeny and expression analysis // Plant Mol. Biol. 2007. V. 65. P. 467–485. https://doi.org/10.1007/s11103-007-9199-y
Alloway B.J. Zinc in soil and crop nutrition. Brussels, Paris: IZA and IFA, 2004. 116 p.
Arnold T., Kirk G.J., Wissuwa M. et al. Evidence for the mechanisms of zinc uptake by rice using isotope fractionation // Plant Cell Env. 2010. V. 33. № 3. P. 370–381. https://doi.org/10.1111/j.1365-3040.2009.02085x
Arough Y.K., Seyed S.R., Seyed S.R. Bio fertilizers and zinc effects on some physiological parameters of triticale under water-limitation condition // J. Plant Interact. 2016. V. 11. № 1. P. 167–177. https://doi.org/10.1080/17429145.2016.1262914
Auld D.S. Zinc coordination sphere in biochemical zinc sites // Biometals. 2001. № 14. V. 3–4. P. 271–313.
Balashouri P. Effect of zinc on germination, growth and pigment content and phytomass of Vigna radiata and Sorghum bicolor // J. Ecobiol. 1995. V. 7. P. 109–114.
Boualem A., Laporte P., Jovanovic M. et al. MicroRNA 166 controls root and nodule development in Medicago truncatula // Plant J. 2008. № 54. P. 876–887.
Broadley M.R., White P.J., Hammond J.P. et al. Zinc in plants // New Phytologist. 2007. V. 173. P. 677–702.
Cakmak I. Possible roles of zinc in protecting plant cells from damage by reactive oxygen species // New Phytol. 2000. V. 146. P. 185–205.
Cakmak I. Enrichment of cereal grains with zinc: agronomic or genetic biofortification? // Plant Soil. 2008. V. 302. P. 1–17.
Cakmak I. Zinc plays critical role in plant growth. 2011. Available: http:// www.zinc.org/crops/resourceserve/zinc_plays_critical_role_in_plant_growth.
Cakmak I., Engels C. Role of mineral nutrients in photosynthesis and yeld formation // Mineral nutrition of crops / Ed. Z. Rengel. N.Y.: Haworth Press, 1999. P. 141–168.
Cakmak I., Braun H.J. Genotypic variation for zinc efficiency // Application of physiology in wheat breeding / Eds M.P. Reynolds, J.I. Ortiz-Monasterio, A. McNab. Mexico: D.F. CIMMYT, 2001. P. 183–199.
Cakmak I., Ekiz H., Yilmaz A. et al. Differential response of rye, triticale, bread and durum wheats to zinc deficiency in calcareous soils // Plant Soil. 1997. V. 188. P. 1–10.
Cakmak I., Sari N., Marschner H. et al. Dry matter production and distribution of zinc in bread and durum wheat genotypes differing in zinc efficiency // Plant Soil. 1996. V. 180. P. 173–181.
Cakmak I., Torun B., Erenoglu B. et al. Morphological and physiological differences in the response of cereals to zinc deficiency // Euphytica. 1998. V. 100. P. 349–357.
Chattha M.U., Hassan M.U., Khan I. et al. Biofortification of wheat cultivars to combat zinc deficiency // Front. Plant Science. 2017. V. 8. P. 1–8.
Chen W., Yang X., He Z. et al. Differential changes in photosynthetic capacity, 77 K chlorophyll fluorescence and chloroplast ultrastructure between Zn-efficient and Zn-inefficient rice genotypes (Oryza sativa) under low zinc stress // Physiol. Plantarum. 2008. V. 132. P. 89–101.
Chen W.R., He Z.L., Yang X.E., Feng Y. Zinc efficiency is correlated with root morphology, ultrastructure, and antioxidative enzymes in rice // J. Plant Nutr. 2009. V. 32. P. 287–305.https://doi.org/10.1080/01904160802608627
Colasanti J., Yuan Z., Sundaresan V. The indeterminate gene encodes a zinc finger protein and regulates a leaf-generated signal required for the transition to flowering in maize // Cell. 1998. V. 93. P. 593–603.
Ehsanullah, Tariq A., Randhawa M.A. et al. Exploring the role of zinc in Maize (Zea mays L.) through soil and foliar application // Univ. J. Agricul. Res. 2015. V. 3(3). P. 69–75.
Fageria N.K. Influence of micronutrients on dry matter yield and interaction with other nutrients in annual crops // Pesq. Agropec. Bras. 2002. V. 37. P. 1765–1772.
Frei M., Wang Y., Ismail A.M., Wissuwa M. Biochemical factors conferring shoot tolerance to oxidative stress in rice grown in low zinc soil // Func. Plant Biol. 2010. V. 37. P. 74–84.
Gao X., Zou C., Zhang F. et al. Tolerance to zinc deficiency in rice correlates with zinc uptake and translocation // Plant Soil. 2005. V. 278. P. 253–261.
Genc Y., Shepherd K.W., McDonald G.K., Graham R.D. Inheritance of tolerance to zinc deficiency in barley // Plant Breeding. 2003. V. 122. P. 283–284.
Ghanepour S., Shakiba M.-R., Toorchi M., Oustan S. Role of Zn nutrition in membrane stability, leaf hydration status, and growth of common bean grown under soil moisture stress // J. Bio. Env. Sci. 2015. V. 6. № 4. P. 9–20.
Graham R.D., Rengel Z. Genotypic variation in zinc uptake and utilization by plants // Zinc in soil and plants / Ed. A.D. Robson. Dordrecht: Kluwer Academic Publishers, 1993. P. 107–114.
Graham R.D., Welch R.M. Breeding for staple food crops with high micronutrient density. Agricultural strategies for micronutrients // Work. Pap. 1996. № 3. P. 1–72.
Hacisalihoglu G., Kochian L.V. How do some plants tolerate low levels of soil zinc? Mechanisms of zinc efficiency in crop plants // New Phytol. 2003. № 159. P. 341–350.
Hacisalihoglu G., Hart J.J., Wang Y.-H. et al. Zinc efficiency is correlated with enhanced expression and activity of zinc-requiring enzymes in wheat // Plant Physiol. 2003. V. 131. P. 595–602.
Hafeez B., Khanif Y.M., Saleem M. Role of zinc in plant nutrition – a review // Am. J. Exp. Agricul. 2013. V. 3. № 2. P. 374–391.
Hajiboland R., Beiramzadeh N. Growth, gas exchange and function of antioxidant defense system in two contrasting rice genotypes under Zn and Fe deficiency and hypoxia // Acta Biol. Szeged. 2008. V. 52. № 2. P. 283–294.
Hajiboland R., Amirazad F. Growth, photosynthesis and antioxidant defense system in Zn-deficient red cabbage plants // Plant Soil Environ. 2010. V. 56. № 5. P. 209–217.
Hänsch R., Mendel R.R. Physiological functions of mineral micronutrients (Cu, Zn, Mn, Fe, Ni, Mo, B, Cl) // Curr. Opin. Plant Biol. 2009. V. 12. P. 259–266.
Höller S., Meyer A., Frei M. Zinc deficiency differentially affects redox homeostasis of rice genotypes contrasting in ascorbate level // J. Plant Physiol. 2014. V. 171. P. 1748–1756.
Hossian B., Hirata N., Nagatomo Y. et al. Internal zinc accumulation is correlated with increased growth in rice suspension culture // J. Plant Growth Reg. 1997. V. 16. P. 239–243.
Hu H., Boisson-Dernier A., Israelsson-Nordström M. et al. Carbonic anhydrases are upstream regulators of CO2 – controlled stomatal movements in guard cells // Nat. Cell Biol. 2010. V. 12. P. 87–93.
Huang C., Barker S.J., Langridge P. et al. Zinc deficiency up-regulates expression of high-affinity phosphate transporter genes in both phosphate-sufficient and –deficient barley roots // Plant Physiol. 2000. V. 124. P. 415–422.
Ignatova L.K., Rudenco N.N., Mudric V.A. et al. Carbonic anhydrase activity in Arabidopsis thaliana thylakoid membrane and fragments enriched with PSI or PSII // Photosynth. Res. 2011. V. 110. Iss. 2. P. 89–98. https://doi.org/10.1007/s11120-011-9699-0
Ilegems M., Douet V., Meylan-Bettex M. et al. Interplay of auxin, KANADI and class III HD-ZIP transcription factors in vascular tissue formation // Development. 2010. V. 137. P. 975–984.
Kabir A.H., Hossain M.M., Khatun M.A. et al. Biochemical and molecular mechanisms associated with Zn deficiency tolerance and signaling in rice (Oryza sativa L.) // J. Plant Interac. V. 12. № 1. P. 447–456. https://doi.org/10.1080/17429145.2017.1392626
Kaznina N.M., Titov A.F. Effect of zinc deficiency and excess on the growth and photosynthesis of winter wheat // J. Stress Physiol. Biochem. 2017. V. 13. № 4. P. 88–94.
Khan H.R., McDonald G.K., Rengel Z. Zn fertilization and water stress affects plant water relations, stomatal conductance and osmotic adjustment in chickpea (Cicer arientinum L.) // Plant Soil. 2004. V. 267. P. 271–284.
Khattak S.G., Dominy P.J., Ahmad W. Effect of Zn as soil and foliar application on yield and protein content of wheat in alkaline soil // J. Nat. Sci. 2015. V. 43. № 4. P. 303–312.
Li Y., Zhang Y., Shi D. et al. Spatial-temporal analysis of zinc homeostasis reveals the response mechanisms to acute zinc deficiency in Sorghum bicolor // New Phytologist. 2013. V. 200. P. 1102–1115.
Liu H., Gan W., Rengel Z., Zhao P. Effects of zinc fertilizer rate and application method on photosynthetic characteristics and grain yield of summer maize // J. Soil Sci. Plant Nutr. 2016. V. 16. № 2. P. 550–662.
Lombi E., Smith E., Hansen T. et al. Megapixel imaging of (micro)nutrients in mature barley grains // J. Exp. Bot. 2011. V. 62. P. 273–282. https://doi.org/10.1093/jxb/erq270
Lombnaes P., Singh B.R. Effect of free manganese activity on yield and uptake of micronutrient cations by barley and oat grown in chelator-buffered nutrient solution // Acta Agr. Scand. Sect. B. 2003. V. 53. № 4. P. 161–167.
Lu L., Tian S., Liao H. et al. Analysis of metal element distributions in rice (Oryza sativa L.) seeds and relocation during germination based on X-ray fluorescence imaging of Zn, Fe, K, Ca, and Mn // PLoS One. 2013. V. 8. P. e57360. https://doi.org/10.1371/journal.pone.0057360
Ma D., Sun D., Wang C. et al. Physiological responses and yield of wheat plants in zinc-mediated alleviation of drought stress // Front. Plant Sci. 2017. V. 8. P. 1–12.
Mai W., Tian X., Gale W.J. et al. Tolerance to Zn deficiency and P-Zn interaction in wheat seedlings cultured in chelator-buffered solutions // J. Arid Land. 2011. V. 3. № 3. P. 206–213.
Maqsood M.A., Hussain S., Aziz T., Ashraf M. Wheat-exuded organic acids influence zinc release from calcareous soils // Pedosphere. 2011. V. 21. № 5. P. 657–665.
Marschner H. Mineral nutrition of higher plants. London: Acad. Press, 1995. 889 p.
Mousavi S.R. Zinc in crop production and interaction with phosphorus // Austral. J. Basic Appl. Sci. 2011. V. 5. P. 1503–1509.
Munirah N., Khairi M., Nozulaidi M., Jahan M. The effects of zinc application on physiology and production of corn plants // Austral. J. Basic App. Sci. 2015. V. 9. № 2. P. 362–367.
Otegui M.S., Capp R., Staehelin L.A. Development seeds of Arabidopsis store different minerals of two types on vacuoles and in the endosperm reticulum // Plant Cell. 2002. V. 14. P. 1311–1327.
Outten C.E., O’Halloran T.V. Femtomolar sensitivity of metalloregulatory proteins controlling Zn homeostasis // Science. 2001. №. 292. P. 2488–2492.
Pandey N., Pathak G., Sharma C.P. Zinc is critically required for pollen function and fertilization in lentil // J. Trace Elem. Med. Biol. 2006. V. 20. P. 89–96. https://doi.org/10.1016/j.jtemb.2005.09.006
Pandey N., Pathak G.C., Singh A.K. Differential sensitivity of maize to zinc and high light intensity // Plant Stress. 2010. V. 4. P. 18–24.
Rengel Z., Graham R.D. Importance of seed Zn content for wheat growth on Zn-deficient soil. I. Vegetative growth // Plant Soil. 1995. V. 173. P. 259–266.
Rengel Z., Romheld V., Marschner H. Uptake of zinc and iron by wheat genotypes differing in tolerance to zinc deficiency // J. Plant Physiol. 1998. V. 152. P. 433–438.
Ricachenevsky F.K., Menguer P.K., Sperotto R.A., Fett J.P. Got to hide your Zn away: molecular control of Zn accumulation and biotechnological applications // Plant Sci. 2015. V. 236. P. 1–17. https://doi.org/10.1016/j.plantsci
Römheld V., Marschner H. Function of micronutrients in plants // Micronutrients in agriculture / Eds J.J. Mortdvedt, F.R. Cox, L.M. Shuman, R.M. Welch. SSSA Book Series. № 4. Madison: Soil Science Society of America, 1991. P. 297–328.
Salama H.M.H. Effects of silver nanoparticles in some crop plants, common bean (Phaseolus vulgaris L.) and corn (Zea mays L.) // Intern. Res. J. Biotech. 2012. V. 3. P. 190–197.
Sasaki H., Hirose T., Watanabe Y., Ohsuki R. Carbonic anhydrase activity and CO2-transfer resistance in Zn-deficient rice leaves // Plant Physiol. 1998. V. 118. P. 929–934.
Sharma P.N., Tripathi A., Bisht S.S. Zinc requirement for stomatal opening in cauliflower // Plant Physiol. 1995. V. 107. P. 751–756.https://doi.org/10.1104/pp.107.3.751
Sharma P.N., Kumar P., Tewari R.K. Early sign of oxidative stress in wheat plants subjected to zinc deficiency // J. Plant Nutr. 2004. V. 27. P. 451–463.
Sharma P.N., Sharma C.P., Chatterjee C., Agarwala S.C. Zinc deficiency and anther development in maize // Plant Cell Physiol. 1987. V. 28. № 1. P. 11–18. https://doi.org/10.1093/oxfordjournals.pcp.a077265
Sinclair S.A., Krämer U. The zinc homeostasis network of land plants // Biochim. Biophys. Acta. 2012. V. 1823. № 9. P. 1553–1567. https://doi.org/10.1016/j.bbamcr.2012.05.016.
Suzuki M., Takahashi M., Tsukamoto T. et al. Biosynthesis and secretion of mugineic acid family phytosiderophores in zinc-deficient barley // Plant J. 2006.V. 48. P. 85–97. https://doi.org/10.1111/j.1365-313X.2006.02853.x
Wang H., Jin J.Y. Photosynthetic rate, chlorophyll fluorescence parameters, and lipid peroxidation of maize leaves as affected by zinc deficiency // Photosynthetica. 2005. V. 43. № 4. P. 591–596.
Wang H., Jin J.Y. Effects of zinc deficiency and drought on plant growth and metabolism of reactive oxygen species in maize (Zea mays L.) // Agric. Sci. China. 2007. № 6. P. 988–995. https://doi.org/10.1016/s1671-2927(07)60138-2
Wang H., Liu R.L., Jin J.Y. Effects of zinc and soil moisture on photosynthetic rate and chlorophyll fluorescence parameters of maize // Biol. Plantarum. 2009. V. 53. № 1. P. 191–194.
Wissuwa M., Ismail A.M., Yanagihara S. Effects of zinc deficiency on rise growth and genetic factors contributing to tolerance // Plant Physiol. 2006. V. 142. P. 731–741.
Zhu Y.G., Smith S.E., Smith F.A. Zinc (Zn)–phosphorus (P) interactions in two cultivars of spring wheat (Triticum aestivum L.) differing in P uptake efficiency // Ann. Bot. 2001. V. 88. P. 941–945.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


