Успехи современной биологии, 2019, T. 139, № 3, стр. 267-279
Нейробиология цинка
1 Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова
Санкт-Петербург, Россия
2 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: jakim2010@gmail.com
Поступила в редакцию 29.11.2018
После доработки 08.12.2018
Принята к публикации 10.12.2018
Аннотация
Представлен обзор результатов исследований, направленных на понимание роли цинка в мембранных и синаптических процессах жизнедеятельности нервной клетки. Анализируется эволюция представлений о цинке как о значимом для живого организма эссенциальном микроэлементе через доказательство его роли в каталитических, обменных и структурных функциях, к установлению регуляторных функций цинка на уровне внутри- и межнейронных взаимоотношений. Оцениваются сведения, накопленные за последние десятилетия, свидетельствующие об особой роли цинка в деятельности нейрона, не только в регуляции возбуждения и торможения, но и в обеспечении ряда тонких мембранных процессов нервной клетки. Рассмотрена функциональная связь цинка с медиаторными системами мозга и, прежде всего, с глутаматергической системой. Проводится анализ сведений о процессах везикулирования цинка в нейроне и его потенциал-зависимого поступления в синаптическую щель. Описаны процессы с участием цинка, происходящие на пре- и постсинаптической мембранах синапса. Оцениваются научно-теоретические позиции и гипотезы, расширяющие взгляды на цинк как сигнальную молекулу. Обращается внимание на ряд спорных положений и нерешенных аспектов нейробиологии цинка. На примере ядер неостриатума развивается гипотеза о вовлечении везикулированного цинка в регуляцию баланса эфферентных систем этого подкоркового образования – прямого и непрямого путей, значимых для реализации нормального двигательного поведения и для предупреждения нейромоторных дисфункций.
ВВЕДЕНИЕ
История изучения цинка в биологии и в прикладных областях знаний (в экологии, диетологии, медицине и проч.) насчитывает многие десятилетия и при принятии определенной точки отсчета приближается к столетнему юбилею (King et al., 2016). Пройден большой путь от признания цинка эссенциальным микроэлементом – металлом, значимым для живого организма, через доказательство его роли (в составе металлопротеинов) в каталитических и структурных функциях к установлению его роли в регуляторных, сигнальных функциях на уровне внутри- и межклеточных взаимоотношений (Maret, 2013). Особую значимость приобрело понимание роли цинка в деятельности нервной клетки. Многие лаборатории мира вовлечены в изучение нейронального цинка, но именно в его нейробиологии обнаруживаются пробелы, заполнение которых значимо не только для собственно “цинкологии”, но и для раскрытия новых аспектов деятельности мозга.
Функции цинка, общие для всех органов и тканей организма, включая нервную систему, можно свести к трем взаимосвязанным группам функций (Kambe et al., 2015; King et al., 2016). Первая обозначает цинк участником деятельности примерно тысячи металлоферментов с преимущественно каталитическими свойствами. Во всех шести классах энзимов обнаруживаются цинксодержащие белковые молекулы; наибольшее число – среди гидролаз (около 400) и лигаз (более 300). Вторая описывает цинк как структурно-функциональный элемент, значимый, прежде всего, для пролиферации и дифференциации тканей. Третья группа функций цинка обозначается как генетически транскрипционная, развертывающаяся в экспрессии генов. Цинк выступает структурным элементом примерно 8% генов, входящих в геном человека. Кроме этого, известно несколько сотен белков, содержащих сайты к цинку, с пока еще с неустановленными функциями (Maret, 2013).
В приложении к мозгу, свободный внепротеиновый цинк рассматриваeтся как модулятор синаптической передачи, как активный участник внутринейрональной трансдукции сигнала. Регуляция цинком медиаторной синаптической передачи многогранна; кроме прямого влияния на потенциал- и лиганд-зависимые ионные каналы, на сайты субъединиц рецепторов постсинаптической мембраны, описаны его влияния на терминаль нейрона и на процессы, происходящие в синаптической щели и околосинаптическом пространстве.
КРАТКИЕ СВЕДЕНИЯ ОБ ОБМЕНЕ ЦИНКА
Цинк не имеет неактивной формы хранения и его избыток не может сконцентрироваться в депо. В плазме крови существует его подвижный пул в виде металлопротеинов, а в клетках тканей – в форме металлотионеинов (King et al., 2016). На металлотионеины приходится 5–15% цитозольного цинка; у человека они представлены 12 видами, их структура и функция описаны достаточно подробно (Kambe et al., 2015). Большинство из них находится под контролем экспрессии гена MTF-1. Металлотионеины состоят из 62–68 аминокислот, содержат 20–21 остаток цистеина, сгруппированных в два кластера; первый – на N-терминали – содержит 9 цистеинов с 3 ионами цинка, второй – на С-терминали – 11 цистеинов с 4 ионами цинка. Металлотионеины создают химический пул стабилизированного цинка в противоположность цинку подвижному, перемещающемуся по каналам различной принадлежности, в том числе и в составе везикул с медиатором и ионов цинка, уже поступивших в синаптическую щель и околосинаптическое пространство.
Пассивный транспорт цинка через плазматические мембраны невозможен. Обмен цинка между клеткой и межтканевой жидкостью (а в клетке – между ее органоидами) носит активный и регулируемый характер, зависимый от двух систем переносчиков: трансмембранных белков SLC39/ZIP и SLC30/ZnT (Fukada et al., 2011; Kambe et al., 2015; King et al., 2016). ZIP-белки расположены в плазматической мембране и образуют канал из восьми трансмембранных доменов. Функция трансмембранных белков ZIP в упрощенном виде сводится к выведению цинка из нейрона и предохранению последнего от избытка металла. В нейрон цинк проводится посредством транспортеров ZnТ-1 и ZnТ-4, которые, несомненно, играют здесь ведущую роль. Цинк проникает в нейрон и по другим каналам: через цинк/протонный обменник (антипорт в теле и аксоне нейрона), через натрий/калиевый обменник (симпорт в варикозах), через потенциал-зависимые кальциевые каналы (в варикозах) и, наконец, через каналы NMDA- и AMPA-рецепторов глутамата (реаптейк цинка в терминаль) (Smart et al., 2004).
Главный и уникальный для нейрона процесс – везикулирование цинка, обеспечивается ZnТ-3-транспортной системой (Cole et al., 1999). Наличие в нейроне ZnТ-3-транспортера служит своеобразной меткой на везикулированный цинк, хотя не все везикулы, на мембранах которых есть Т-3-транспортеры (данные по нейронам гиппокампа мышей), содержат цинк (Wenzel et al., 1997; Wang, Dahlstrom, 2008).
Нервную систему нельзя отнести к числу тканей, насыщенных цинком. На ЦНС (головной и спинной мозг) приходится меньше 1% всего цинка организма человека. Для сравнения: на костный аппарат приходится около 30% цинка, скелетная мускулатура аккумулирует больше половины всего цинка организма. Усредненное содержание цинка в головном мозге – около 150 мкМ. Но очевидно, что количественные параметры – не главное в понимании нейробиологической роли цинка. Примером могут служить итоги исследований на крысах с применением технологии меченых атомов, с распределением в организме наночастиц цинка, введенного перорально (Котенко и др., 2011). Они показали, что в головном мозге прирост микроэлемента был меньше, чем в висцеральных органах (печень, почки, селезенка и проч.), но именно в ткани мозга цинк долго удерживался в повышенных концентрациях, в то время как в висцеральных органах он возвращался к исходному уровню через 3–4 сут после введения. Цинк оказался эссенциальным микроэлементом, не менее значимым для мозга, чем кальций, так как он связан с обеспечением ряда ключевых процессов в жизнедеятельности нейрона, прежде всего синаптических. Накопленные нейронаукой сведения обоснованно позволяют обозначить цинк “кальцием XXI века” (Frederickson et al., 2005).
ЦИНК И НЕЙРОТРАНСМИТТЕРНЫЕ СИСТЕМЫ МОЗГА
В 1964 г. были получены первые данные о содержании цинка в синаптических образованиях гиппокампа (Haug, 1967). Два десятилетия спустя в терминалях нейронов переднего мозга крыс, формирующих ассиметричные синапсы (отличаются высокими функциональными свойствами), был обнаружен везикулированный цинк (Perez-Clausell, Danscher, 1985). И, наконец, была доказана связь импульсной активности нейронов с появлением в ткани гиппокампа активного экстраклеточного цинка (Assaf, Chung, 1984). Так началось формирование представлений о синаптической роли цинка (Huang, 1997), не завершенное и по сей день.
Медиаторной системой, использующей ионизированный цинк в синаптической активности, оказалась одна из ведущих возбуждающих медиаторных систем мозга – глутаматергическая. Метка на цинк (а вместе с ней и метка на транспортер ZnТ-3) обнаружена в глутаматергических терминалях нескольких проекционных систем гиппокампа. Главная из них представлена мшистыми волокнами – проекциями из гранулярных клеток зубчатой извилины (фасции) на пирамидные нейроны СА3 зоны гиппокампа. Вторая – проекции из СА3 на СА1-зону. Третья – из энторинальной коры на наружный молекулярный слой зубчатой извилины. Четвертая – из СА1-зоны на субикулюм. Описаны особенности локализации меток на цинк и Т-3-транспортер в указанных системах у грызунов (мыши) и обезьян (макаки) (Wenzel et al., 1997).
Ионизированный цинк обнаружен и в глутаматергической кортико-стриарной системе (Howell et al., 1989; Frederickson et al., 2000). Распределение метки на ионизированный цинк в коре больших полушарий мозга крыс картирует серое вещество и совпадает со слоями неокортекса, где локализованы глутаматергические нейроны. Их терминали оканчиваются в ядрах базальных ганглиев – в хвостатом ядре и скорлупе (полосатое тело, неостриатум). В самом неостриатуме метка на цинк обнаружена в варикозах глутаматергических терминалей (Frederickson et al., 2000). Метка на везикулированный цинк обнаружена, пусть и в меньшей плотности, в других участках мозга, содержащих глутаматергические нейроны: в ядрах миндалевидного комплекса, в септальных ядрах, в коре мозжечка, в обонятельном бугорке.
Представлен ли цинк в нейронах другой медиаторной принадлежности, известно меньше, и данные по этому вопросу носят отрывочный и часто противоречивый характер. Так, по мнению одних авторов, цинк в ГАМК-ергических нейронах структур переднего мозга крыс не содержится (Slomianka, Ernst, 1997); другие исследователи обнаруживают в ГАМК-терминалях СА3-зоны гиппокампа крыс метку на ионизированный (но не визикулированный!) цинк (Ruiz et al., 2004). Методом аутометаллографии в терминалях ГАМК-ергических нейронов спинного мозга мышей вместе с глутаматдекарбоксилазой были обнаружены метки на транспортер ZnТ-3 и ионизированный цинк (Wang et al., 2001).
В образованиях периферической нервной системы, в симпатических ганглиях мышей, у 3–5% адренергических нейронов верхнего шейного узла, поясничных сплетений и в ганглии седалищного нерва была обнаружена метка на ZnТ-3-транспортеры и селеновая метка на ионизированный цинк (Wang, Dalhstrom, 2008). Обращает на себя внимание тот факт, что метка на ZnТ-3 обнаруживалась не в терминалях адренергических нейронов, а в их теле, в перенуклеарном комплексе Гольджи. В цитируемой публикации эти метки обнаружены и у единичных ацетилхолинергических нейронов, точнее – содержащих иммунную метку на везикулярный переносчик ацетилхолина. Аналогичных фактов для головного мозга в доступной литературе не обнаружено. Метка на везикулированный цинк обнаружена в некоторых нейронах, использующих пептиды-медиаторы (модуляторы), в частности пептид Y (Wang, Dalhstrom, 2008).
Итак, глутаматергическая медиаторная система является, если не единственной, то ведущей в нейробиологии цинка. Показательно, что везикулированный цинк никогда не обнаруживается во всех везикулах конкретной терминали, и содержится он не у всех терминалей нейронального пула. Так, например, он выявлен только в 60–80% глутаматергических нейронов изучаемой области гиппокампа (Wenzel et al., 1997). Это послужило толчком к идее выделить особые цинк-глутаматергические нейроны (Bitanihirwe, Cunningham, 2009).
ЦИНК И ПРОЦЕССЫ В СИНАПСЕ
Факты об активном потенциал-зависимом поступлении цинка в синаптическую щель и о модуляции им возбуждения, создаваемого на субсинаптической мембране глутаматом, очевидны. Но, по мнению некоторых исследователей (Li et al., 2001), цинк не просто модулирует возбуждение – он критически значим для его возникновения. Он, как предполагается, не только влияет на параметры ВПСП (возбуждающего постсинаптического потенциала), но и ответствен за длительную потенциацию постсинаптической мембраны. Глутамат же обеспечивает проникновение цинка в постсинаптическую мембрану через свои каналы ионотропных рецепторов. Еще одни ворота для цинка – потенциал-зависимые кальциевые каналы и натриевые обменники. Показана зависимость величины и устойчивости деполяризации от концентрации цинка в синаптической щели (Li et al., 2001).
Другая группа исследователей (Kay, 2003; Kay, Toth, 2006, 2008) высказывает сомнение в том, что потенциал-зависимая экзоцитозная активность везикулированного цинка является для него единственной формой нейрональной активности. Предполагается существование и других механизмов участия нейронального цинка в работе синапса. Проведя флюометрические исследования на срезах СА1-зоны гиппокампа и неокортекса с использованием хелаторов цинка и различных меток на цинк (основной из них – FluoZin-3), исследователи обнаружили концентрационные и временные несоответствия превращения внутринейронального везикулированного цинка во внеклеточный, синаптический. Сформулировано предположение о том, что цинк везикул терминали глутаматергического нейрона играет в их мембранах некую структурную роль, а после экзацитоза в синапс он образует своеобразный налет на пресинаптической мембране (Sensi et al., 2011). Более того, попадание цинка в синаптическую щель и затем – в экстраклеточное пространство рассматривается как побочный процесс в деятельности нейрона. Разработана гипотеза о двух принципиально различных механизмах поступления цинка в синаптическую щель – о фазическом (потенциал-зависимом) и о тоническом (потенциал-независимом или зависимом частично). Предполагается, что во втором случае интенсивность выделения зависит от высвобождения цинка из комплекса с некими макромолекулами (Кау, Toth, 2006; Кау et al., 2006), и предлагается заменить здесь термин “выделение” цинка, на его “экстернализацию”. Развитие этих представлений привело к гипотезе об участии цинка в процессах объемной синаптической передачи: нейроны, участвующие в такой передаче, работают единым пулом, и цинк, способный выходить за пределы синаптической щели, активно влияет на рядом расположенные синаптические образования, в том числе и с другой медиаторной принадлежностью. Работа, проведенная на срезах латеральной миндалины крыс (Kodirov et al., 2006), где оканчиваются терминали глутаматергических нейронов слуховой коры (конвергируют вместе с ГАМК-ергическими терминалями на нейроны амигдалярного комплекса), показала, что благодаря этим процессам цинк, во-первых, в меньшей степени зависим от импульсной активности конкретного нейрона и, во-вторых, способен блокировать соседний ГАМК-ергический нейрон, помогая “своему” глутамату в генерации возбуждения.
Требует дополнительного изучения и химическое состояние цинка в везикулах терминали глутаматергического нейрона (Maret, 2013). Используемый еще с 1990-х гг. прошлого века термин “гистохимически активный ионизированный цинк” уже недостаточен и требует расшифровки. Не следует отбрасывать и предположение о том, что цинк везикул может быть структурным элементом их мембран, и главная его роль – стабилизация медиатора в везикулах – наподобие той, что описана для цинка в отношении инсулина в клетках внутренней секреции поджелудочной железы (Haug, 1967). Везикулированный цинк, как указывалось выше, может быть и в комплексе с макромолекулами (Кау, Toth, 2006; Кау et al., 2006). Заметим здесь, что активно обсуждаемая в 1980–1990-х гг. возможность наличия в терминали нейрона отдельных от медиатора цинксодержащих везикул, не подтвердилась (Wenzel et al., 1997).
Цинк активно захватывается глутаматергическими нейронами, но процессы биогенеза, лежащие в основе его везикулирования, как и процессы формирования самих пузырьков, до конца не исследованы и, по-видимому, содержат более сложный, многогранный механизм, чем это представлялось ранее. Для нейронов гиппокампа доказана роль адаптора АР-3, который формирует везикулы из эндосомальных комплексов по APF1-зависимому механизму перемещения и упаковки пептидов в мембрану везикул (Salazar et al., 2004). Особенностью и итогом этих процессов является формирование везикул, различных по составу, по комбинации белков мембраны и, следовательно, по везикулированию цинка с помощью ZnТ-3-транспортера. Авторы высказывают предположение о том, что такая морфофункциональная гетерогенность везикул обнаруживается не только у нейронов одного пула, но и у разных везикул одной нервной клетки. В конечном счете это сказывается на различиях в деятельности синапсов, в том числе и топически близких.
Доказана со-локализация ZnТ-3-транспортеров и Vglu1-транспортеров глутамата на везикулах и, шире, на одних и тех же органоидах клетки – по крайней мере в 60% клеток культуры (Salazar et al., 2005). Не менее важно доказательство функционального взаимодействия этих транспортеров: у нейронов, везикулы которых содержат метки на оба транспортера, индекс везикулирования медиатора выше, а насыщенность глутаматом в полтора раза больше.
Оценка состояния цинка, динамически изменяющейся величины его присутствия, концентрации в средах мозга (в теле и варикозном расширении нейрона, в синаптической щели и за ее пределами) – безусловно важный для понимания нейробиологии цинка вопрос. Усиление выброса в синаптическое пространство при активации цинкергических нейронов сопровождается и усилением его захвата нейроном (Colvin et al., 2000). Свободный хелатированный цинк составляет десятую часть от всего цинка головного мозга, остальное – цинк в составе белковых молекул. Связанный цинк цитозоля измеряется в мкМ, свободный цинк в органоидах клетки (в эндоплазматическом ретикулюме, митохондриях и аппарате Гольджи) – в пкМ (Maret, 2013). Концентрация цинка в везикулах достигает 2–30 мМ, а в синапсе – в широком диапазоне от 10 нМ до 300 мкМ (Cohen-Kfir et al., 2005). Следует указать, что концентрация цинка в клетке, точнее взаимосвязь его концентрации и функциональной активности – на несколько порядков ниже, чем у внутриклеточного кальция и, тем более – магния, измеряемого в мМ. Особое значение для ионного гомеостазиса клетки имеет не только концентрация цинка, но и диапазон флюктуации этих колебаний. Хелатирование цинка в синаптической щели (а значит, и его инактивация) носит сложный двухфазный характер (Li et al., 2001).
ЦИНК И РЕЦЕПТОРНЫЕ СИСТЕМЫ МЕДИАТОРОВ МОЗГА
Значимым событием в нейробиологии цинка стало доказательство его прямого ингибирующего влияния на ионотропные рецепторы глутамата (Peters et al., 1987; Smart et al., 2004). Первоначально предполагалось, что цинк ослабляет или полностью ликвидирует только NMDA-опосредованный компонент возбуждения нейрона, вызываемого глутаматом. В дальнейшем было показано его влияние на другие типы ионотропных глутаматных рецепторов, но NMDA-компонент в действии цинка остается ведущим.
Цинк избирательно и обратимо тормозит активность (предположительно, инактивируя воротный механизм кальциевого ионного канала) NMDA-рецепторов за счет аллостерической инактивации двух сайтов гетеромера, отдаленных от активного сайта лиганда (Paoletti et al., 1997; Smart et al., 2004). На первый высокоаффинный NR2A-сайт, локализованный на внеклеточной части N-терминали субъединицы, цинк влияет потенциал-независимо в низких наномолярных концентрациях. На этот сайт приходится до 80% блокирующего эффекта цинка. На второй сайт – низкоаффинный внутриклеточный и потенциал-зависимый NR1A – цинк влияет в более высоких микромолярных концентрациях. Существенной особенностью этого сайта является его чувствительность к ионам магния, в то время как сайт NR2A чувствителен к ионам никеля. На другие сайты N-концевой терминали NMDA-рецептора (прежде всего на сайт NR2В) цинк не влияет или влияет слабо и только в высоких микромолярных концентрациях (Rachline et al., 2005), по-видимому, не воспроизводимых в реалиях целостного мозга.
Эффективность ингибирующего влияния цинка на NMDA-рецепторы зависит от целого ряда дополнительных факторов. Так, для влияния цинка на низкоаффинные сайты значима концентрация протонов в данном участке мозга. Очевидно, что при фоновой тонической активности нейрона, при относительно небольшом совместном поступлении медиатора и цинка в синапс, тормозное воздействие последнего реализуется через высокоаффинный сайт рецептора, а при интенсивной импульсной фазической активности нейрона – через низкоаффинный сайт. Во втором случае цинк, выходя за пределы синапса, может воздействовать на рядом расположенные глутаматергические синапсы, в том числе и не выделяющие цинк, а также на нейрональные структуры другой медиаторной принадлежности (Rachline et al., 2005).
В исследованиях на срезах СА3-зоны гиппокампа продемонстрирована способность цинка понижать активность нейронов через ингибирование каинатных рецепторов глутамата (Mott et al., 2008). Это влияние зависит не только от концентрации металла (эффективны только миллимолярные концентрации), но и от концентрации лиганда и протонов водорода; особенно это критично при воздействии на второй тип каинатных рецепторов, в наибольшей степени представленных в терминалях мшистых волокон гиппокампа. Если учесть, что сами протоны являются прямыми регуляторами активности каинатных рецепторов, то эффективность цинка в отношении данных нейронных структур должна быть признана в большей степени зависимой (чем влияния на NMDA-рецепторы) от кислотности в данном участке ткани мозга.
В отличие от ингибирующего влияния на NMDA- и каинатные рецепторы, воздействие цинка на АМРА-рецепторы глутамата активирующее (Lin et al., 2001). Но, во-первых, оно обнаруживается лишь у части нейронов, например только у половины нейронов СА3-зоны гиппокампа. Во-вторых, вклад цинка в АМРА-опосредованную деполяризацию нейрона составляет не более 10% от величины ВПСП. В-третьих, влияния цинка реализуются в условиях достаточно ограниченного концентрационного диапазона металла – 100–200 мкМ; повышение концентрации цинка приводит к смене его влияния на АМРА-рецепторы на ингибирующее, сходное с таковым у ионов магния (Dorofeeva et al., 2005). И, наконец, эффект характеризуется быстрой, в течение 1 мс, десенситизацией. Получены сведения о том, что цинк влияет на АМРА-рецепторы через постсинаптические комплексы “опорных” белков семейства Shank, их второго и третьего (но не первого) типов (Arons et al., 2016). С-терминаль альфа-субъединицы Shank-3 содержит сайт цинка, через который он в микромолярных концентрациях усиливает активность постсинаптического ансамбля АМРА-комплекса. Концентрация цинка ниже 10 мкМ тормозит активность АМРА-рецепторов и даже способствует олигомеризации белкового комплекса.
Таким образом, у цинка обнаруживаются достаточно сложные и разнонаправленные влияния на рецепторный синаптический аппарат глутаматной медиаторной системы. Знак воздействия зависит от целого ряда факторов, в первую очередь, от концентрации цинка в синаптическом пространстве. Закономерно появление гипотезы не столько о влиянии цинка на возбуждение как таковое – его усиление или ослабление, сколько о его способности изменять баланс активности подтипов рецепторных систем глутаматергической системы, имеющих для нейронных групп разное физиологическое значение (Smart et al., 2004).
Нет информации о способности цинка влиять на принципиально иной рецепторный субстрат глутаматергической системы мозга – на метаботропные рецепторы. Существует работа, выполненная на срезах гиппокампа крыс (Matias et al., 2014), в которой показано, что антагонист II типа метаботропных рецепторов глутамата блокирует влияния цинка на электрическую активность нейронов СА3-зоны. Авторы исследования считают, что полученный эффект связан с угнетением экзоцитоза цинка в синапсе. Так или иначе, но у цинка имеются метаботропные влияния на нейрон, адресующиеся к внутринейрональному кальциевому гомеостазису – через комплекс GPR39. В 1997 г. GPR39 был описан как система мембранных белков, формирующих семейство рецепторов к достаточно широкому набору биологически активных веществ пептидной природы: к нейротензину, мотилину, гормону роста, грелину и др. (Popovics, Stewart, 2011; Sato et al., 2016). Спустя десять лет была продемонстрирована его функциональная связь с ионами цинка (Holst et al., 2007), и GPR39 стал рассматриваться как физиологический сенсор, реагирующий на повышение внутриклеточной концентрации цинка, а сам цинк – как его природный лиганд, его позитивный аллостерический модулятор. Было доказано, что через данную мембранную структуру цинк дозозависимо повышает продукцию фосфорсодержащих соединений, вторичных посредников – цАМФ и инозитол-3-фосфата (Holst et al., 2007). На срезах СА3-зоны гиппокампа продемонстрирована способность цинка через GPR39 потенцировать систему протеинкиназ (митоген активированную протеинкиназу – МАРК и Са-кальмодулин-протеинкиназу), запускать киназный каскад и вызывать мобилизацию кальция (Besser et al., 2009), то есть воспроизводится эффект, сходный с таковым у метаботропных рецепторов глутамата. К этому следует добавить, что цинк, подвергшийся обратному захвату в терминаль нейрона (обсуждается наличие транспортеров, обеспечивающих его реаптейк), не только проходит повторное везикулирование, но и тормозит тирозин фосфатазу, ингибируя этим дефосфорилирование протеинкиназ, способствующих его везикулированию (Mott, Dingledine, 2011). В исследовании (Evstratova, Toth, 2011) прямого влияния на кальций эндоплазматического ретикулюма СА3-зоны гиппокампа у цинка не обнаружено. И, наконец, есть сведения о способности цинка активировать через GPR39 транспортер КСС2, значимый для поддержания концентрационного градиента хлора в клетке, а значит, и для способности ГАМК гиперполяризировать нейрон (Chorin et al., 2011). Описываются все новые лиганды к GPR39, действие которых потенцирует влияния цинка на нейрон и у которых есть определенные клинические перспективы (Sato et al., 2016).
Доказано ингибирующее влияние цинка на конкурентную по отношению к глутамату тормозную ГАМК-ергическую систему мозга, точнее, на аппарат ее ГАМК-А-рецепторной системы (Smart et al., 2004). Влияние реализуется аллостерически, неконкурентно и только при высоких микромолярных концентрациях микроэлемента (Barberis et al., 2000). Итогом является сокращение времени открытости ионного хлорного канала, его деятельность не столько блокируется, сколько десинхронизируется (Guyon et al., 1999). Эффективность цинка зависит от определенного набора изоформ субъединиц рецептора: она максимальна при сочетании двух альфа- и трех бета-субъединиц (Horenstein, Akabas, 1998). Влияние цинка, напротив, минимизируется при наличии в ансамбле ГАМК-А-рецептора дельта- (Storustovu, Ebert, 2006) и гамма- субъединиц, встречаемость которых в различных отделах мозга существенно варьирует (Матухно и др., 2014; Sieghart, Sperk, 2002). Гамма-субъединица широко представлена (а значит, эффективность цинка снижена) в ГАМК-А-рецепторах синапсов СА1- и СА3-зон гиппокампа и бледного шара, в меньшей степени – у нейронов зубчатой извилины – и обнаруживается не более чем у четверти ГАМК-А-рецепторов неостриатума (Fujiyama et al., 2000). Без гамма-изоформы субъединицы чаще всего обходятся и внесинаптические ГАМК-А-рецепторы, в частности среднешипиковых нейронов стриатума и нейронов зубчатой извилины гиппокампа (но не его пирамидных нейронов) (Brickley, Mody, 2011). Цинк оказывает на них выраженное угнетающее влияние, в том числе и конкурируя с нейростероидами (Carver et al., 2016). Через эти внесинаптические рецепторы цинк способен влиять на вызываемое ГАМК тоническое торможение нейрона (Belelli et al., 2009).
Таким образом, влияние цинка на ГАМК-ергический нейрон не ограничивается аппаратом, локализованным на его постсинаптической мембране. Обнаружено влияние цинка на терминаль ГАМК-ергического нейрона: под его влиянием, по-видимому, синхронизируется выделение медиатора. Доказана способность цинка тормозить активность 4-го типа транспортера ГАМК, проводящего медиатор в нейрон из астроцитарной глии (Cohen-Kfir et al., 2005). Деятельность именно этого типа транспортера характерна для СА1- и СА3-зон гиппокампа. Предполагается, что при повышении нейрональной активности в системе мшистых волокон и при интенсивном выделении цинка одновременно с влиянием на глутаматергические нейроны СА3-зоны гиппокампа цинк ослабляет и ГАМК-ергические. Если учесть, что в той же микромолярной концентрации цинк тормозит возврат глутамата в терминаль за счет блокады EAAT1-транспортера возбуждающих аминокислот-медиаторов (Vanderberg et al., 1998) (аналог у нейронов крыс – GlAsT), то здесь следует ожидать поддержания эффективной концентрации глутамата в синапсе.
Следует отметить существование работ, в которых оспаривается значимость вклада глутамат- и ГАМК-А-рецепторов в эффектах цинка в отношении возбудительных процессов в нейроне. Так, в работе, исследующей феномен долговременной потенциации нейронов СА1-зоны гиппокампа крыс, не выявлено влияния на нее инактивации цинком ни глутаматных (NMDA, АМРА), ни ГАМК-А-рецепторов (тестировались концентрации биоэлемента в диапазоне 5–50 мкМ) (Lorca et al., 2011).
Цинк в широком диапазоне концентрации тормозит активность глициновых рецепторов (сайтов). В низких концентрациях (около 10 нМ) цинк замедляет диссоциацию глицина и рецептора, удлиняя тем самым гиперполяризующее действие лиганда на мембрану нейрона (Ju et al., 2004). Показана способность цинка снижать активность транспортера глицина, причем это действие реализуется независимо от влияния металла на глициновый сайт. Хроническое внутрибрюшинное введение аспартата цинка (65 мг/кг) приводило во фронтальных отделах неокортекса крыс к почти двукратному снижению аффинности глицинового сайта к лиганду (Cichy et al., 2009).
Актуальным (в том числе и для практической медицины) является вопрос о влиянии цинка на рецепторные структуры биогенных аминов. Показано, что цинк способен вытеснять метку, конкурировать с антагонистами D1- и D2-рецепторов дофамина (Schetz, Sibley, 1997), но это свойство не является уникальным – такие же возможности обнаружены у других дивалентных катионов – у меди и кадмия, а также у железа и алюминия. Существуют сведения о влиянии цинка на дофаминергическую терминаль нейрона: показано положительное действие цинка на дофамин-зависимую деполяризацию мембраны, а через ингибирование транспортера дофамина, обеспечивающего его обратный захват в терминаль, – поддержание его концентрации в синаптической щели (Norregaard et al., 1998; Meinild et al., 2004). Цинк влияет на этот транспортер (ко-субстратом реаптейка служат натрий и хлор) неконкурентно через высокоаффинный сайт, чувствительный к ионам никеля и, в меньшей степени, кобальта. Вместе с тем, исследователи указывают, что эти влияния цинка зависимы от ряда других факторов, например от концентрации натрия (Li et al., 2015). Кроме того, у цинка обнаружена, в том числе и в экспериментах на срезах стриатума крыс, способность потенцировать выброс дофамина в синапс, вызываемый амфетамином (Scholze et al., 2002; Meinild et al., 2004; Li et al., 2015), что актуально для клинической психофармакологии. Следует добавить, что на транспортеры других моноаминов-медиаторов мозга – норадреналина и серотонина – цинк влияния не оказывает (Scholze et al., 2002). Но у цинка обнаружено влияние (потенцирующее в низких концентрациях и ингибирующее – в высоких) на А-1-тип рецепторов серотонина (Barrondo, Salles, 2009), что коррелирует с результатами нейрофармакологической части проведенных комплексных исследований (Satala et al., 2016) и раскрывает механизмы антидепрессивных эффектов цинка (Tena-Campos et al., 2016). Двухнедельное внутрибрюшинное введение цинка увеличивало плотность А-1-типа рецепторов серотонина (в меньшей степени А-2-типа) в гиппокампе и фронтальных отделах неокортекса (Cichy et al., 2009).
Есть сведения (Swaminat et al., 2002) о наличии двух участков у бета-2-адренорецепторов, чувствительных к цинку: через один сайт цинк в концентрациях 1–20 мкМ усиливает аффинность лиганда, через другой в больших концентрациях – понижает эффективность бета-адреноблокаторов, осуществляя тем самым положительную модуляцию адренергической системы.
В исследованиях на химерных конструкциях мембран ооцитов показана принципиальная возможность влияния цинка на ионотропный никотиновый рецептор ацетилхолина (Hsiao et al., 2001). Знак воздействия (тормозный или потенциирующий) зависит не только от концентрации цинка, но и от комбинации субъединиц рецептора. Наиболее чувствителен к потенцирующему влиянию цинка рецептор, содержащий 4 альфа- и 4 бета-субъединицы (чувствителен и к ионам кадмия, но не чувствителен к ионам никеля), при комбинации субъединиц 3 альфа- и 2 бета- в сочетании с концентрацией цинка выше 100 мкМ – эффект цинка становится ингибирующим (Hsiao et al., 2001). Авторы исследования описывают соответствующие цинковые сайты субъединиц и проводят мысль об их сходстве и конструктивной идентичности с таковыми у ГАМК-А-рецептора, его бензодиазепинового сайта. Других работ, связанных с изучением влияния цинка на ацетилхолиновую систему мозга (например, на срезах мозга) в доступной литературе обнаружить не удалось.
ЦИНК В МЕЖНЕЙРОННЫХ ВЗАИМООТНОШЕНИЯХ НЕОСТРИАТУМА
Функциональная значимость везикулированного цинка не может быть сведена (как это представляется авторами многих обзорных работ) только к регуляции тормозных и возбудительных процессов в нейроне. Накопленные нейробиологией сведения позволяют раскрыть вклад цинка в деятельность нейрональных систем, в их активность и взаимоотношения в конкретных структурах мозга. В качестве примера рассмотрим регуляторную роль цинка в деятельности подкоркового образования мозга – полосатого тела, неостриатума.
Неостриатум (хвостатое ядро и скорлупа) – подкорковый центр экстрапирамидной двигательной системы. Являясь неотъемлемой частью стриа-таламо-кортикальной петли и обеспечивая сенсомоторную интеграцию, он участвует в реализации когнитивных функций мозга (Суворов, Шуваев, 2002; Шаповалова, 2015; Graybiel, 2000). Морфофункциональную основу неостриатума составляют проекционные ГАМК-ергические нейроны, имеющие средние размеры тела и широкое дендритное дерево, плотно покрытое шипиками; отсюда их название – среднешипиковые нейроны. Их длинные аксоны, выходя за пределы неостриатума обеспечивают мощную тормозную эфферентацию к сегментам бледного шара и ретикулярной части черной субстанции среднего мозга (Yelnik, 2002; Tepper, Lee, 2007). В самом неостриатуме они формируют большое количество коллатералей на соседние нейроны, посредством которых осуществляется сложный механизм дезингибирования тормозных нейронов. Но и сами проекционные нейроны являются мишенями для афферентных систем неостриатума: на одних и тех же дендритах среднешипиковых нейронов конвергируют глутаматергические входы из отделов неокортекса, дофаминергические афференты из компактной зоны черной субстанции, а из зрительного бугра – глутамат- и ацетилхолинергические (Yelnik, 2002). По итогам конкурентных влияний трех указанных источников, борьбы тормозных и активирующих воздействий, формируется функциональное состояние этих проекционных неостриарных нейронов.
Сформировано представление (имеющее серьезные подтверждения и из клинической неврологии) о значимости баланса так называемых прямого и непрямого эфферентных путей из стриатума (DeLong, 1990; Smith et al., 1998; Graybiel, 2000). Прямой путь (рисунок, а) идет от нейронов неостриатума к ГАМК-ергическим нейронам внутреннего сегмента бледного шара и далее через ядра таламуса к неокортексу. Непрямой путь (рисунок, б) организован сложнее: от нейронов неостриатума он идет к наружному сегменту бледного шара, ГАМК-ергические нейроны которого проецируются на субталамическое ядро, а возбуждающие нейроны субталамического ядра, в свою очередь, посылают аксоны к ГАМК-ергическим клеткам внутреннего сегмента бледного шара, отростки которых идут к ядрам таламуса и далее – к неокортексу. Таким образом, две эфферентные системы неостриатума обладают разнонаправленными эффектами на выходные ядра-мишени (прежде всего на сетчатую часть черной субстанции) и, соответственно, на таламические и кортикальные центры. Предполагается, что баланс двух потоков импульсации, их выделение и сравнение, по-видимому, лежат в основе специфической интегративной функции лобных долей, формирующих общие программы поведения. Дисбаланс двух эфферентных неостриарных потоков приводит к возникновению моторной дисфункции: гипокинетической (паркинсонический синдром) или гиперкинетической (хорея).
Схема, отражающая различия в организации двух эфферентных систем неостриатума – прямого (а) и непрямого (б) пути (по Graybiel, 2000, с модификациями), поясняющая гипотезу о способности везикулированного нейронального цинка влиять на баланс этих систем за счет различий в чувствительности к нему типов глутаматных и дофаминовых рецепторов и их плотности на среднешипиковых нейронах неостриатума. Условные обозначения: неокортекс – кора больших полушарий; НС сшн – среднешипиковые ГАМК-ергические нейроны неостриатума; БШ – бледный шар, внутренний и внешний сегмент; Таламус – зрительный бугор; Субталам. я. – субталамическое ядро; ЧС – компактная зона черной субстанции среднего мозга; Глу – глутамат; ГАМК – гамма-аминомаслянная кислота; ДА – дофамин; D1, D2 – 1-й и 2-й тип рецепторов дофамина; NR2B, NR2A – субъединицы НМДА рецепторов глутамата; (–) и (+) – обозначение тормозного и возбуждающего эффектов медиаторов.
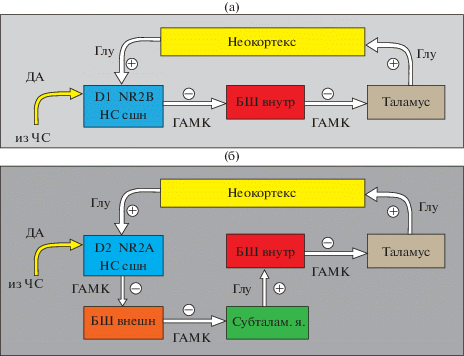
Как цинк становится участником указанных нейродинамических процессов в неостриатуме? В исследованиях на кортико-стриарных срезах мозга крыс было показано (Vastagh et al., 2012), что чувствительные к цинку NR2A-субъединицы содержатся в синапсах, обеспечивающих кортикальные воздействия на неостриатум. Цинк способен вмешиваться в эти синаптические процессы и регулировать функциональное состояние эфферентов неостриатума. Показано, в том числе и методом прижизненного диализа ткани мозга (Fantin et al., 2007; Mabrouk et al., 2013), что NR2A-субъединицы NMDA-рецепторов глутамата расположены преимущественно на нейронах, создающих непрямой путь из неостриатума, а NR2В-субъединицы – на нейронах, начинающих прямой путь (рисунок). В первом случае глутамат осуществляет тоническую активацию, во втором – тоническое ингибирование эфферентов. При усилении кортикальных глутаматных посылок возникает дисбаланс с преобладанием непрямых эфферентов неостриатума к наружному сегменту бледного шара. Это может привести к дисфункции стриа-паллидарной системы, в частности к двигательным дискинезиям (Mabrouk et al., 2013). Можно предположить, что цинк, избирательно тормозя NR2A-рецепторы, способен предотвратить дисбаланс эфферентов неостриатума и предупредить развитие моторных и когнитивных нарушений. Недостаток цинка, напротив, может способствовать возникновению патологии. Наши исследования с многократным введением цинка непосредственно в ростральный неостриатум крыс подтверждают данную гипотезу: цинк предотвращал возникновение или существенно снижал проявления хореомиоклонического гиперкинеза (аналог – хорея Гентингтона у человека), вызванного блокадой ГАМК-А-рецепторов пикротоксином (Якимовский, Крыжановская, 2015а,б).
Кроме того, известно (Ade et al., 2008), что в синапсах проекционных нейронов неостриатума, создающих прямой путь к черной субстанции преобладают D1-рецепторы дофамина (рисунок, а), а на нейронах непрямого пути к наружному сегменту бледного шара – D2-рецепторы (рисунок, б). И, наконец, цинк может служить фактором баланса глутаматергических подсистем: ингибируя NMDA- и активируя АМРА-рецепторы глутамата, он функционально выделяет АМРА-зависимую быструю нейротрансмиссию (Galvan et al., 2006) на среднешипиковые нейроны неостриатума.
Увеличение концентрации цинка во внесинаптическом пространстве усиливает его ингибирующее влияние на ГАМК-А-рецепторы, тем более что в неостриатуме (в отличие от рецепторов ГАМК в бледном шаре) отмечается низкая встречаемость гамма-субъединиц, снижающая чувствительность к цинку (Fujiyama et al., 2000; Sieghart, Sperk, 2002). Возрастание внесинаптического цинка сказывается и на состоянии экстрасинаптических ГАМК-А-рецепторов, также отличающихся отсутствием гамма-субъединиц в ансамбле рецепторов (Brickley, Mody, 2011). В итоге, за счет ослабления внесинаптического тонического торможения (Матухно и др., 2014; Belelli et al., 2009) может повыситься активность ГАМК-ергических интернейронов неостриатума, усилиться процесс дезингибирования.
Таким образом, везикулированный цинк, обслуживая кортико-стриарные глутаматергические проекции, через влияние на чувствительный к нему субстрат, может выполнять переключательную функцию стрелочника, обеспечивать баланс эфферентаций в системе корково-подкорковых взаимоотношений, предупреждая развитие экстрапирамидной нейромоторной патологии.
ЗАКЛЮЧЕНИЕ
Современная биологическая наука оперирует фактами, описывающими процессы в живом организме на субклеточном мембранном и молекулярном уровнях, и основные достижения здесь связаны с изучением соответствующих ультратонких механизмов регуляции. Именно в этом направлении развивается и нейробиология цинка, раскрывающая его участие в жизнедеятельности нервной клетки. Но несмотря на усилия многочисленных коллективов исследователей и внушительный архив знаний, в них еще обнаруживаются очевидные пробелы; многие вопросы остаются вне дискурса и потому без ответа. Например: почему не все глутаматергические нейроны (тракты, пулы) ЦНС содержат и используют в своей деятельности тандем ZnТ-3 – везикулированный цинк? Даже в структурах мозга, насыщенных цинкергическими нейронами (например, в СА1-, СА3-зонах гиппокампа), обнаруживаются глутаматергические терминали без этих тандемов. Почему в ряде случаев транспортер ZnТ-3 обнаруживается только в телах нейронов, но не в терминалях, содержащих везикулы с цинком? Эти и ряд других формально частных вопросов не менее важны, чем рассуждения о нейрональном цинке как медиаторе – модуляторе – сигнальной молекуле.
Цинк, в отличие от близких ему биоэлементов – кальция и магния, активен в нейроне в концентрациях на несколько порядков ниже, и в каждом конкретном случае для эффективного контакта с рецепторным воспринимающим аппаратом нейрона требуется его определенный концентрационный диапазон. Изменение концентрации цинка способно поменять знак его воздействия на противоположный. При фоновой активности нейрона, когда цинк в синаптическом (и тем более в околосинаптическом) пространстве содержится в наномолярных концентрациях, глутаматные NMDA-рецепторы тормозятся через высокоаффинные NR2A-субъединицы. При фазической активности нейрона, когда цинк достигает микромолярных концентраций, срабатывает принципиально иной субстрат – NR1А-субъединицы, АМРА-рецепторы глутамата активируются, а конкурентные ГАМК-А-рецепторы тормозятся.
Кроме концентрационной зависимости, важно химическое состояние цинка. Химизм нейронального везикулированного цинка и цинка, поступившего в синаптическую щель, в околосинаптическое пространство, существенно различается, не говоря уже о состоянии и свойствах металла, интегрированного в мембрану нейрона. Более того, в везикулах терминали тоже может быть разный цинк. В связи с этим, представляется, что сигнальные способности и регуляторные возможности цинка сложнее тех, которыми оперирует нейробиология.
Исследователь, посвятивший свое научное творчество изучению тонких молекулярных процессов, не должен забывать, что, так или иначе, получаемые им сведения направлены на познание системного, организменного уровня функционирования. В связи с этим, представляется перспективным проекция молекулярно-клеточных, мембранных свойств цинка в отношении нейрона на системный уровень. Получение сведений о способности цинка влиять на межнейрональные связи в конкретных структурах мозга с соответствующими сдвигами в межъядерных отношениях позволит обнаружить новые закономерности в деятельности целостного мозга.
Список литературы
Котенко К.В., Беляев И.К., Бузулуков Ю.П. и др. Экспериментальное исследование биокинетики наночастиц оксида цинка у крыс после однократного перорального введения с использованием технологии меченых атомов // Мед. радиол. радиац. безопасность. 2011. Т. 56. № 2. С. 5–10.
Матухно А.Е., Сухов А.Г., Кирой В.Н. ГАМК-ергическая рецепторная система и ее роль в системной деятельности мозга // Успехи физиол. наук. 2014. Т. 45. № 3. С. 79–96.
Суворов Н.Ф., Шуваев В.Т. Участие базальных ганглиев в организации поведения // Рос. физиол. журн. им. И.М. Сеченова. 2002. Т. 88. № 10. С. 1233–1240.
Шаповалова К.Б. Неостриатум и регуляция произвольного движения. СПб.: Наука, 2015. 155 с.
Якимовский А.Ф., Крыжановская С.Ю. Влияние внутристриарных введений ацетата цинка на нормальное и патологическое двигательное поведение крыс // Мед. акад. журн. 2015а. Т. 15. № 2. С. 50–54.
Якимовский А.Ф., Крыжановская С.Ю. Хлорид и ацетат цинка, введенные в неостриатум, разнонаправлено влияют на двигательное поведение крыс // Бюл. эксперим. биол. мед. 2015б. Т. 160. № 8. С. 252–254.
Ade K.K., Janssen M.J., Ortinski P.I., Vicini S. Differential tonic GABA conductances in striatal medium spiny neurons // J. Neurosci. 2008. V. 28. № 5. P. 1185–1197.
Arons M.H., Lee K., Thynne Ch.J. et al. Shank3 is part of a zinc-sensitive signaling system that regulates excitatory synaptic strength // J. Neurosci. 2016. V. 36. № 35. P. 9124–9134.
Assaf S.Y., Chung S.H. Release of endogenous Zn2+ from brain tissue during activity // Nature. 1984. V. 308. P. 734–736.
Barberis A., Cherubini E., Mozrzymas J.W. Zinc inhibits miniature GABAergic currents by allosteric modulation of GABA-A receptor gating // J. Neurosci. 2000. V. 20. № 23. P. 8618–8627.
Barrondo S., Salles J. Allosteric modulation of 5-HT1A receptors by zinc: binding studies // Neuropharmacology. 2009. V. 56. № 2. P. 455–462.
Belelli D., Harrison N.L., Maguire J. et al. Extrasynaptic GABAA receptors: form, pharmacology, and function // J. Neurosci. 2009. V. 29. № 41. P.12757–12763.
Besser L., Chorin E., Sekler I. et al. Synaptically released zinc triggers metabotropic signaling via a zinc-sensing receptor in the hippocampus // J. Neurosci. 2009. V. 29. № 9. P. 2890–2901.
Bitanihirwe B.K., Cunningham M.G. Zinc: the brain’s dark horse // Synapse. 2009. V. 63. № 11. P. 1029–1049.
Brickley S.G., Mody I. Extrasynaptic GABAA receptors: their function in the CNS and implications for disease // Neuron. 2012. V. 73. № 1. P. 23–34.
Carver Ch.M., Chuang Sh.-H., Reddy D.S. Zinc selectively blocks neurosteroid-sensitive extrasynaptic delta-GABA-A receptors in the hippocampus // J. Neurosci. 2016. V. 36. № 31. P. 8070–8077.
Chorin E., Vinograd O., Fleidervish I. et al. Upregulation of KCC2 activity by zinc-mediated neurotransmission via the mZnR/GPR39 receptor // J. Neurosci. 2011. V. 31. № 36. P. 12916–12926.
Cichy A., Sowa-Kućma M., Legutko B. et al. Zinc-induced adaptive changes in NMDA/glutamatergic and serotonergic receptors // Pharmacol. Rep. 2009. V. 61. № 6. P. 1184–1191.
Cohen-Kfir E., Lee W., Eskandari S., Nelson N. Zinc inhibition of gamma-aminobutyric acid transporter 4 (GAT4) reveals a link between excitatory and inhibitory neurotransmission // PNAS USA. 2005. V. 102. № 17. P. 6154–6159.
Cole T.B., Wenzel H.J., Kafer K.E. et al. Elimination of zinc from synaptic vesicles in the intact mouse brain by disruption of the ZnT3 gene // PNAS USA. 1999. V. 96. № 4. P. 1716–1721.
Colvin R.A., Davis N., Nipper R.W., Carter Ph.A. Zinc transport in the brain: routes of zinc influx and efflux in neurons // J. Nutr. 2000. V. 130. № 5. P. 1484S–1487S.
DeLong M.R. Primate models of movement disorders of basal ganglia origin // Trends Neurosci. 1990. V. 13. № 7. P. 281–285.
Dorofeeva N.A., Tikhonov D.B., Barygin O.I. et al. Action of extracellular divalent cations on native alpha-amino-3-hydroxy-5-methylisoxazole-4-propionate (AMPA) receptors // J. Neurochem. 2005. V. 95. № 6. P. 1704–1712.
Evstratova A., Toth K. Synaptically evoked Ca2+ release from intracellular stores is not influenced by vesicular zinc in CA3 hippocampal pyramidal neurons // J. Physiol. 2011. V. 589. № 23. P. 5677–5689.
Fantin M., Marti M., Auberson Y.P., Morari M. NR2A and NR2B subunit containing NMDA receptors differentially regulate striatal output pathways // J. Neurochem. 2007. V. 103. № 6. P. 2200–2211.
Frederickson C.J., Suh S.W., Thompson R.D. et al. Importance of zinc in the central nervous system: the zinc-containing neuron // J. Nutr. 2000. V. 130. № 5. P. 1471S–1483S.
Frederickson C.J., Koh J.Y., Bush A.I. The neurobiology of zinc in health and disease // Nat. Rev. Neurosci. 2005. V. 6. № 6. P. 449–462.
Fujiyama F., Fritschy J.-M., Stephenson F.A., Bolam J.P. Synaptic localization of GABA-A receptor subunits in the striatum of the rat // J. Comp. Neurol. 2000. V. 416. № 2. P. 158–172.
Fukada T., Yamasaki S., Nishida K. et al. Zinc homeostasis and signaling in health and diseases: zinc signaling // J. Biol. Inorg. Chem. 2011. V. 16. № 7. P. 1123–1134.
Galvan A., Kuwajima M., Smith Y. Glutamate and GABA receptors and transporters in the basal ganglia: what does their subsynaptic localization reveal about their function? // Neuroscience. 2006. V. 143. № 2. P. 351–375.
Graybiel A.M. The basal ganglia // Curr. Biol. 2000. V. 10. № 14. P. 813–876.
Guyon A., Laurent S., Paupardin-Tritsch D. et al. Incremental conductance levels of GABAA receptors in dopaminergic neurones of the rat substantia nigra pars compacta // J. Physiol. 1999. V. 516. № 3. P. 719–737.
Haug F.M. Electron microscopical localization of the zinc in hippocampal mossy fibre synapses by a modified sulfide silver procedure// Histochem. 1967. V. 8. № 4. P. 355–368.
Holst B., Egerod K.L., Schild E. et al. GPR39 signaling is stimulated by zinc ions but not by obestatin // Endocrinology. 2007. V. 148. № 1. P. 13–20.
Horenstein J., Akabas M.H. Location of a high affinity Zn2+ binding site in the channel of alpha1beta1 gamma-aminobutyric acid A receptors // Mol. Pharmacol. 1998. V. 53. № 5. P. 870–877.
Howell G., Mandava P., Christensen M., Frederickson C.J. Identification of zinc-containing efferents to the neostriatum by retrograde transport of zinc selenid // Soc. Neurosci. Abstr. 1989. V. 15. P. 903.
Hsiao B., Dweck D., Luetje Ch.W. Subunit-dependent modulation of neuronal nicotinic receptors by zinc // J. Neurosci. 2001. V. 21. № 6. P. 1848–1856.
Huang E.P. Metal ions and synaptic transmission: think zinc // PNAS USA. 1997. V. 94. № 25. P. 13386–13387.
Ju P., Aubrey K.R., Vandenberg R.J. Zn2+ inhibits glycine transport by glycine transporter subtype 1b // J. Biol. Chem. 2004. V. 279. № 22. P. 22983–22991.
Kambe T., Tsuji T., Hashimoto A., Itsumura N. The physiological, biochemical and molecular roles of zinc transporters in zinc homeostasis and metabolism // Physiol. Rev. 2015. V. 95. № 3. P. 749–784.
Kay A.R. Evidence for chelatable zinc in the extracellular space of the hippocampus, but little evidence for synaptic release of Zn // J. Neurosci. 2003. V. 23. № 17. P. 6847–6855.
Kay A.R., Toth K. Influence of location of a fluorescent zinc probe in brain slices on its response to synaptic activation // J. Neurophysiol. 2006. V. 95. № 3. P. 1949–1956.
Kay A.R., Toth K. Is zinc a modulator? // Sci. signal. 2008. V. 1. № 19. P. 1–7.
Kay A.R., Neyton J., Paoletti P. A startling role for synaptic zinc // Neuron. 2006. V. 52. № 4. P. 572–574.
King J.C., Brown K.H., Gibson R.S. et al. Biomarkers of nutrition for development (BOND) – zinc review // J. Nutr. 2016. V. 146. № 4. P. 858S–885S.
Kodirov S.A., Takizawa S., Joseph J. et al. Synaptically released zinc gates long-term potentiation in fear conditioning pathways // PNAS USA. 2006. V. 103. № 41. P. 15218–15223.
Lorca R.A., Rozas C., Loyola S. et al. Zinc enhances long-term potentiation through P2X receptor modulation in the hippocampal CA1 region // Eur. J. Neurosci. 2011. V. 33. № 4. P. 1175–1185.
Li Y., Hough Ch.J., Frederickson Ch.J., Sarvey J.M. Induction of mossy fiber CA3 long-term potentiation requires translocation of synaptically released Zn2+ // J. Neurosci. 2001. V. 21. № 20. P. 8015–8025.
Li Y., Hasenhuetl P.S., Schicker K. et al. Dual action of Zn2+ on the transport cycle of the dopamine transporter // J. Biochem. 2015. V. 290. № 52. P. 31069–31076.
Lin D.D., Cohen A.S., Coulter D.A. Zinc-induced augmentation of excitatory synaptic currents and glutamate receptor responses in hippocampal CA3 neurons // J. Neurophys. 2001. V. 85. № 3. P. 1185–1196.
Mabrouk O.S., Mela F., Calcagno M. et al. GluN2A and GluN2B NMDA receptor subunits differentially modulate striatal output pathways and contribute to levodopa-induced abnormal involuntary movements in dyskinetic rats // ACS Chem. Neurosci. 2013. V. 4. № 5. P. 808–816.
Maret W. Zinc biochemistry: from a single zinc enzyme to a key element of life // Adv. Nutr. 2013. V. 4. № 1. P. 82–91.
Matias C.M., Dionísio J.C., Saggau P., Quinta-Ferreira M.E. Activation of group II metabotropic glutamate receptors blocks zinc release from hippocampal mossy fibers // Biol. Res. 2014. V. 47. Art. 73.
Meinild A.-K., Sitte H.H., Gether U. Zinc potentiates an uncoupled anion conductance associated with the dopamine transporter // J. Biochem. 2004. V. 279. № 48. P. 49671–49679.
Mott D.D., Dingledine R. Unraveling the role of zinc in memory // PNAS USA. 2011. V. 108. № 8. P. 3103–3104.
Mott D.D., Benveniste M., Dingledine R. pH-dependent inhibition of kainate receptors by zinc // J. Nurosci. 2008. V. 28. № 7. P. 1659–1671.
Norregaard L., Frederiksen D., Nielsen E.O., Gether U. Delineation of an endogenous zinc-binding site in the human dopamine transporter // EMBO J. 1998. V. 17. № 15. P. 4266–4273.
Paoletti P., Ascher P., Neyton J. High-affinity zinc inhibition of NMDA NR1–NR2A receptors // J. Neurosci. 1997. V. 17. № 15. P. 5711–5725.
Perez-Clausell J., Danscher G. Intravesicular localization of zinc in rat telencephalic boutons. A histochemical study // Brain Res. 1985. V. 337. № 1. P. 91–98.
Peters S., Koh J., Choi D.W. Zinc selectively blocks the action of N-methyl-D-aspartate on cortical neurons // Science. 1987. V. 236. № 4801. P. 589–593.
Popovics P., Stewart A.J. GPR39: a Zn2+-activated G protein-coupled receptor that regulates pancreatic, gastrointestinal and neuronal functions // Cell. Mol. Life Sci. 2011. V. 68. № 1. P. 85–95.
Rachline J., Perin-Dureau F., Le Goff A. et al. The micromolar zinc-binding domain on the NMDA receptor subunit NR2B // J. Neurosci. 2005. V. 25. № 2. P. 308–317.
Ruiz A., Walker M.C., Fabian-Fine R., Kullmann D.M. Endogenous zinc inhibits GABA-A receptors in a hippocampal pathway // J. Neurophysiol. 2004. V. 91. № 2. P. 1091–1096.
Salazar G., Craige B., Love R. et al. Vglut1 and ZnT3 co-targeting mechanisms regulate vesicular zinc stores in PC12 cells // J. Cell Sci. 2005. V. 118. № 2. P. 1911–1921.
Salazar G., Love R., Werner E. et al. The zinc transporter ZnT3 interacts with AP-3 and it is preferentially targeted to a distinct synaptic vesicle subpopulation // Mol. Biol. Cell. 2004. V. 15. № 2. P. 575–587.
Satala G., Duszynska B., Stachowicz K. et al. Concentration-dependent dual mode of Zn action at serotonin 5-HT1A receptors: in vitro and in vivo studies // Mol. Neurobiol. 2016. V. 53. № 10. P. 6869–6881.
Sato S., Huang X.-P., Kroeze W.K., Roth B.L. Discovery and characterization of novel GPR39 agonists allosterically modulated by zinc // Mol. Pharmacol. 2016. V. 90. № 6. P. 726–737.
Schetz J.A., Sibley D.R. Zinc allosterically modulates antagonist binding to cloned D1 and D2 dopamine receptors // J. Neurochem. 1997. V. 68. №5. P. 1990–1997.
Scholze P., Norregaard L., Singer E.A. et al. The role of zinc ions in reverse transport mediated by monoamine transporters // J. Biochem. 2002. V. 277. № 24. P. 21505–21513.
Sensi S.L., Paoletti P., Koh J.-Y. et al. The neurophysiology and pathology of brain zinc // J. Neurosci. 2011. V. 31. № 45. P. 16076–16085.
Sieghart W., Sperk G. Subunit composition, distribution and function of GABA(A) receptor subtypes // Curr. Top. Med. Chem. 2002. V. 2. № 8. P. 795–816.
Slomianka L., Ernst E. Zinc-containing neurons are distinct from GABAergic neurons in the telencephalon of the rat // Anat. Embriol. 1997. V. 195. № 2. P. 165–174.
Smart T.G., Hosie A.M., Miller P.S. Zn2+ ions: modulators of excitatory and inhibitory synaptic activity // Neurosci. 2004. V. 10. № 5. 432–442.
Smith Y., Bevan M.D., Shink E., Bolam J.P. Microcircuitry of the direct and indirect pathways of the basal ganglia // Neuroscience. 1998. V. 86. № 2. P. 353–387.
Storustovu S., Ebert B. Pharmacological characterization of agonists at δ-containing GABA-A receptors: functional selectivity for extrasynaptic receptors is dependent on the absence of γ2 // J. Pharmacol. Experim. Therap. 2006. V. 316. № 3. P. 1351–1359.
Swaminat G., Steenhuis J., Kobilka B., Lee T.W. Allosteric modulation of beta2-adrenergic receptor by Zn2+// Mol. Pharmacol. 2002. V. 61. № 1. P. 65–72.
Tena-Campos M., Ramon E., Lupala C.S. et al. Zinc is involved in depression by modulating G-protein-coupled receptor heterodimerization // Mol. Neurobiol. 2016. V. 53. № 3. P. 2003–2015.
Tepper J., Lee C. GABA-ergic control of substantia nigra dopaminergic neurons // Prog. Brain Res. 2007. V. 160. P. 189–208.
Vanderberg R.J., Mitrovic A.D., Johnson G.A.R. Molecular basis for differential inhibition of glutamate transporter subtypes by zinc ions // Mol. Pharmacol. 1998. V. 54. № 1. P. 189–196.
Vastagh C., Gardoni F., Bagetta V. et al. N-methyl-D-aspartate (NMDA) receptor composition modulates dendritic spine morphology in striatal medium spiny neurons // J. Biol. Chem. 2012. V. 287. № 22. P. 18103–18114.
Wang Z., Dahlstrom A. Axonal transport of zinc transporter 3 and zinc containing organelles in the rodent adrenergic system // Neurochem. Res. 2008. V. 33. № 12. P. 2472–2479.
Wang Z., Li J.Y., Dahlstrom A., Danscher G. Zinc-enriched GABAergic terminals in mouse spinal cord // Brain Res. 2001. V. 92. № 1–2. P. 165–172.
Wenzel J., Cole T.B., Born D.T. et al. Ultrastructural localization of zinc transporter-3 (ZnT-3) to synaptic vesicle membranes within mossy fiber boutons in the hippocampus of mouse and monkey // PNAS USA. 1997. V. 94. № 23. P. 12676–12681.
Yelnik J. Functional anatomy of the basal ganglia // Mov. Disord. 2002. V. 17. Suppl. 3. P. 15–21.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


