Успехи современной биологии, 2019, T. 139, № 3, стр. 254-266
Низкомолекулярные антиоксиданты в клетках цианобактерий и растений
Н. Л. Радюкина 1, Л. Е. Михеева 1, Е. А. Карбышева 1, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: karbisheva@mail.ru
Поступила в редакцию 25.11.2018
После доработки 25.11.2018
Принята к публикации 28.11.2018
Аннотация
Оксигенный фотосинтез является одним из основных источников активных форм кислорода (АФК). В клетках фотосинтезирующих организмов механизм поддержания баланса между окислительными и антиокислительными процессами включает как энзиматические, так и неэнзиматические защитные системы, сложившиеся уже в прокариотических клетках. Приведены современные данные об основных механизмах образования АФК в клетках цианобактерий и растений. Проведен сравнительный анализ основных групп низкомолекулярных антиоксидантов (аскорбиновая кислота, глутатион, токоферолы, каротиноиды, антоцианы, полиамины и др.) и их вклада в детоксикацию АФК и в обеспечение защиты клеток от окислительного стресса.
ВВЕДЕНИЕ
Геохимические и палеонтологические данные свидетельствуют о том, что жизнь на Земле началась в бескислородной среде, и только спустя многие миллионы лет в атмосфере появился кислород. Согласно современным гипотезам резкое повышение содержания кислорода в атмосфере Земли – Великое кислородное событие – наблюдалось на рубеже архея и протерозоя около 2.4 млрд лет назад (Bekker et al., 2004). Несмотря на то, что последние исследования могут отодвинуть дату начала оксигенации атмосферы до 3.2 млрд лет (Satkoski et al., 2015), именно процесс оксигенного фотосинтеза в клетках цианобактерий рассматривается как основной источник кислорода как в древней атмосфере планеты, так и в современной биоcфере (Tomitani et al., 2006). Длительная параллельная эволюция систем оксигенного фотосинтеза и аэробного дыхания у цианобактерий и цианобактериальная природа происхождения хлоропластов водорослей и растений во многом определили формирование сходных антиоксидантных защитных механизмов в клетках всех организмов, способных к оксигенному фотосинтезу.
Кислород стал мощным катализатором метаболических процессов для живых организмов с одной стороны, но с другой стороны принес опасность в виде АФК. К АФК относят пероксидный и гидроксильный радикалы; супероксидный, синглетный кислород; ионы: гидроксид-, супероксид- и нитрит-; молекулы воды, кислорода, пероксида водорода.
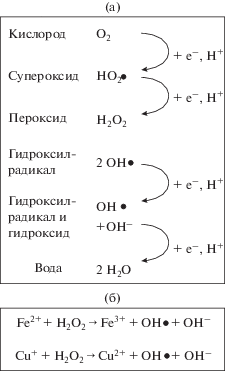
В клетках организмов, осуществляющих процесс оксигенного фотосинтеза, существенная часть АФК образуется при фотохимических процессах, связанных с поглощением и передачей энергии квантов света по фотосинтетической цепи переноса электронов. В то же время значительную роль могут играть окислительно-восстановительные реакции с пероксидами и гидропероксидами, которые протекают с помощью ионов тяжелых металлов в качестве катализаторов, служат источниками свободных радикалов и инициируют цепные реакции с образованием АФК (рис. 1).
Рис. 1.
Схема некоторых путей образования активных форм кислорода (по Matysik et al., 2002, с модификациями). (а) – в реакциях последовательного восстановления молекулы кислорода; (б) – в реакциях окисления ионов металлов.
Негативные последствия избыточного образования АФК в клетках живых организмов связывают с перекисным окислением жирных кислот липидов мембран, повреждением структуры белков и ДНК. Кроме того, считается, что эти процессы могут приводить к запуску механизма программируемой смерти клетки и, в конечном счете, всего организма. Несмотря на то, что традиционно АФК рассматриваются, в первую очередь, как радикалы, повреждающие клеточные структуры, АФК как высокореактивные соединения могут влиять и на ряд клеточных процессов. Поскольку радикалы – это атомы или группы атомов, содержащие неспаренные электроны, они могут участвовать в активации сигнальных каскадов и/или в образовании реакционно-способных соединений и других радикалов (Foyer, Noctor, 2005; Halliwell, 2006; Jimenez-Del-Rio, Velez-Pardo, 2012). В настоящее время считается, что определенный уровень АФК необходим в нормальных условиях для процессов лигнификации клеточных стенок, передачи стрессовых сигналов, формирования иммунного ответа и для процессов старения и программируемой гибели клеток (Gechev et al., 2006; Cheeseman, 2007; Jimenez-Del-Rio, Velez-Pardo, 2012; Gross et al., 2013).
У всех организмов эволюционно сформировалась разветвленная сеть антиоксидантной системы защиты. Эта система включает как антиоксидантные ферменты, так и низкомолекулярные антиоксиданты. Набор антиоксидантных ферментов не так велик, и их структура и функция достаточно консервативны и схожи у большинства организмов (Blokhina at al., 2003; Latifi et al., 2009; Foyer, Noctor, 2011). Низкомолекулярные антиоксиданты чрезвычайно разнообразны и относятся к различным классам химических соединений. И в растениях, и в бактериях, в том числе цианобактериях, широк спектр низкомолекулярных антиоксидантов. Кроме того, в настоящее время антиоксидантные свойства обнаружены у некоторых метаболитов, ранее с этой точки зрения не исследованных. В связи с вышесказанным, возникает необходимость обратить особое внимание на разнообразие низкомолекулярных антиоксидантов и на их роль в защитном ответе, возникающем в клетках растений и цианобактерий при действии различных стрессовых факторов.
ПРИЧИНЫ ОБРАЗОВАНИЯ АФК В НОРМЕ И В СТРЕССОВЫХ УСЛОВИЯХ
Изучение процессов образования АФК началось еще в прошлом веке (Scandalias, 1990; Foyer et al., 1994). Не вызывает сомнения, что АФК образуются в клетках и в процессе нормальной жизнедеятельности организмов. В клетках цианобактерий и растений основными источниками АФК служат процессы фотосинтеза и фотодыхания (Полесская, 2007; Foyer, Noctor, 2005; Gross et al., 2013). У цианобактерий в качестве главного источника АФК выступает фотоингибирование, связанное с нарушением функционирования фотосистемы II в условиях интенсивного освещения или действия UV-B (280–320 нм) радиации. Было показано также, что в клетках цианобактерий супероксид-радикал и пероксид водорода являются главными ингибиторами трансляции белков D1 и D2, связанных с фотосистемой II (Nishiyama, Murata, 2014). Кроме того, у цианобактерий АФК повреждают фикобилисомы, нарушая их целостность (Kirilovsky, Kerfeld, 2012). В клетках растений, наряду с процессом фотоингибирования в тилакоидах хлоропластов, ощутимый вклад в изменение окислительно-восстановительного баланса клетки в нормальных условиях вносят процессы окисления низкомолекулярных субстратов в митохондриях и белков в цитоплазме и других органеллах. В клетках растений существуют механизмы образования АФК, связанные с работой ферментов липоксигеназы, пероксидазы, НАДФН-оксидазы, ксантиноксидазы (Blokhina et al., 2003; Mittova et al., 2003; Gechev et al., 2006). Действие стрессовых факторов различной природы (засоление, UV-В-радиация, гипоксия, низкие и высокие температуры, избыток тяжелых металлов) служит детонатором развития окислительного стресса как в клетках растений, так и в клетках цианобактерий (He, Häder, 2002; Blokhina et al., 2003; Foyer, Noctor, 2005; Abogadallah, 2010; Miura, Tada, 2014; Shah et al., 2017; Fryzova et al., 2018).
НИЗКОМОЛЕКУЛЯРНЫЕ АНТИОКСИДАНТЫ
Стресс-индуцируемый синтез низкомолекулярных антиоксидантов как один из защитных механизмов наблюдается и в растениях, и в цианобактериях (Полесская, 2007; Dat et al., 2000; Alonso et al., 2001; Fu, Huang, 2001; Sheo et al., 2004; Bartoli et al., 2006; Latifi et al., 2009; Radyukina et al., 2011). Считается, что низкомолекулярные метаболиты – более эффективные компоненты защитных систем клетки, так как в определенных стрессовых условиях антиоксидантные ферментные системы могут ингибироваться.
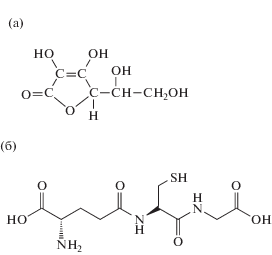
Аскорбиновая кислота (аскорбат) (рис. 2а) – наиболее распространенный низкомолекулярный антиоксидант в растениях и цианобактериях. В клетках растений аскорбат присутствует в органеллах и апопласте, синтезируется в митохондриях и транспортируется в другие компартменты по электрохимическому градиенту или путем диффузии. Его концентрация в растениях может достигать 20 мМ в хлоропластах, но и в других компартментах его содержание может быть высоким. У цианобактерий концентрация этого антиоксиданта ниже, чем в хлоропластах во много раз. Однако и в этих концентрациях он активно участвует в защите цианобактерий от UV-B-радиации, тяжелых металлов и гербицидов (Tichy, Vermaas, 1999; Deniz et al., 2011; Sheeba et al., 2011). Это соединение служит донором электронов во многих биохимических реакциях. Однако главная функция аскорбата как низкомолекулярного антиоксиданта – его участие в аскорбат-глутатионовом цикле (Blokhina et al., 2003; Foyer, Noctor, 2005). В последнее время получены данные, что аскорбат обладает способностью реагировать и с гидроксил-радикалами, анион-радикалами, синглетным кислородом. Аскорбат участвует также в реакциях регенерации токоферола и окисленных каротиноидов. И наиболее активно это соединение в процессах детоксикации вторичных продуктов окислительно-восстановительных реакций (Foyer, Noctor, 2005).
Наиболее хорошо изученным путем биосинтеза аскорбата является синтез из L-галактозы, катализируемый ГДФ-L-галактозфосфорилазой. Для ГДФ-L-галактозфосфорилазы в настоящее время известно два гена VTC1 и VTC2. Исследование растений Arabidopsis thaliana, мутантных по каждому из этих генов, показало, что синтез из L-галактозы является основным путем образования аскорбата. Еще один путь синтеза – через галактоуроновую кислоту, L-глюкозу и миоинозитол (Szarka et al., 2012). Этот путь играет минорную роль.
Глутатион – трипептид – γ-глутамил-цистеинил-глицин (рис. 2б) – также присутствует во всех компартментах растительных клеток: цитоплазме, хлоропластах, эндоплазматическом ретикулуме, вакуолях и митохондриях (Foyer, Noctor, 2011). В клетках цианобактерий глутатион содержится в миллимолярных концентрациях. Глутатион – главный источник тиоловых групп в большинстве клеток. Нуклеофильные свойства, обусловленные содержанием тиоловых групп, делают глутатион незаменимым участником широкого спектра биохимических реакций. Он реагирует с металлами с образованием меркаптидных связей, а также с электрофильными соединениями различных классов. Глутатион принимает участие в детоксикации H2O2, превращаясь в окисленный глутатион. Изменение соотношения между восстановленной и окисленной формой глутатиона служит характеристикой окислительно-восстановительного состояния клетки. При действии тяжелых металлов и UV-B-облучения отмечается изменение соотношения “глутатион окисленный/глутатион восстановленный” в клетках растений и цианобактерий (Foyer, Noctor, 2011; Fahey, 2013).
Все рассмотренные выше метаболиты-антиоксиданты являются участниками аскорбат-глутатионового цикла, в котором две молекулы аскорбата используются аскорбат-пероксидазой для восстановления H2O2 до воды с образованием монодегидроаскорбата. Этот цикл играет ведущую роль в детоксикации АФК у растений и у цианобактерий (Latifi et al., 2009; Singh et al., 2012).
Фенольные соединения – обширная группа веществ ароматической природы, которые содержат одну или несколько гидроксильных групп, связанных с атомами углерода ароматического кольца. Для растительных клеток и для цианобактерий характерно высокое содержание фенольных соединений. Следует также отметить, что большинство вторичных метаболитов, к которым относятся фенольные соединения и алкалоиды, являются основой биологически активного действия лекарственных растений (Kumar et al., 2010; Singh et al., 2012; Nakabayashi et al., 2014; Rodríguez-Pérez et al., 2017; Singh et al., 2017). Фенольные соединения – глоекапсин и скитонемин обнаружены у цианобактерий, вместе с экзополисахаридом они находятся в капсиде морских и пресноводных видов (Storme et al., 2015).
Вторичные метаболиты – флавоноиды, антоцианы и другие пигменты – накапливаются в растениях и цианобактериях при UV-B-облучении, их накопление является линейной функцией длительности и интенсивности облучения (Радюкина и др., 2008; Li et al., 1993; Larcher, 2003; Storme et al., 2015). Главным образом, в качестве UV-B-абсорбирующих соединений выступают фенилпропаноиды, флавоны, флавонолы, эфиры антоцианов и коричной кислоты (Kumar, Pandey, 2013; Nakabayashi et al., 2014; Xue, He, 2015). Известны четыре основные группы фотозащитных фенольных соединений – пигментов: микоспоринподобные аминокислоты, фенольные соединения (фенольные кислоты, флавоноиды, антоцианы), беталаины и экстратилакоидные каротиноиды. Накопление соединений, поглощающих в UV-области спектра, например, микоспоринподобных аминокислот у цианобактерий и фенольных соединений у высших растений, относится к универсальным механизмам фотоадаптации и защиты от фотоповреждения, сформированным на ранних этапах эволюции фотоавтотрофных организмов (Latifi et al., 2009). Полученные к настоящему времени сведения позволяют полагать, что фотозащитные соединения обладают высокой фотостабильностью. После формирования фотозащитного экрана для поддержания его функционирования достаточно минимальных затрат энергии и ценных для клетки метаболитов, чтобы обеспечить длительную защиту от фотоповреждения. В то же время первоначальное накопление фотозащитных соединений требует существенных затрат энергетических ресурсов, а индукция синтеза и накопления пигментов в количествах, достаточных для выполнения фотозащитной функции, занимает сравнительно продолжительное время. Поэтому подобные механизмы не всегда оказываются целесообразными, они существенны при защите от длительных воздействий стрессовых факторов и играют важную роль в долговременной адаптации за счет активации специфических ферментных систем (Соловченко, Мерзляк, 2008; Nakabayashi et al., 2014). Показано, например, что UV стимулирует синтез фенольных соединений путем регуляции экспрессии генов, кодирующих ферменты их биосинтеза у растений и цианобактерий (Chen et al., 2013; Nakabayashi et al., 2014; Storme et al., 2015).
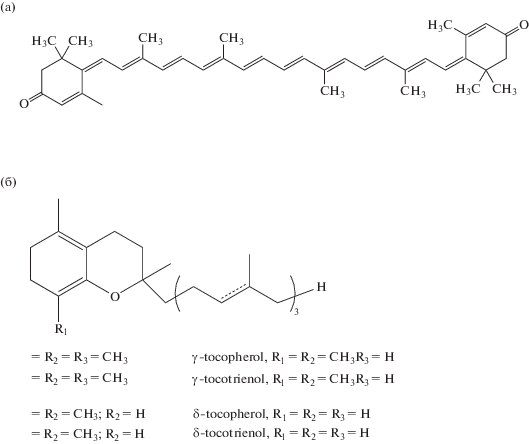
Каротиноиды являются вспомогательными фотосинтетическими пигментами, присутствующими у всех фотоавтотрофных организмов и выполняющими защитную и структурную функции (рис. 3а). По своей структуре каротиноиды представляют терпеноидные соединения – тетратерпены и тетратерпеноиды, образующиеся в результате конденсации восьми изопреноидных единиц. Формально они являются продуктами гидрирования, дегидрирования, циклизации, окисления (или комбинации всех этих процессов) ациклического предшественника – Ψ,Ψкаротина (ликопина) (Бриттон, 1986; Kerfeld et al., 2017). По наличию заместителей их подразделяют на две группы: простые углеводородные соединения – каротины и их окисленные производные – ксантофиллы, содержащие окси-, эпокси- и кетогруппы. Все соединения окрашены в желтый, оранжевый или красный цвет. Фотозащитная функция каротиноидов заключается в способности этих молекул эффективно ловить возбужденные электроны с молекул хлорофилла и кислорода. В процессе антиоксидантной защиты участвуют устойчивые к фотодеструкции формы каротиноидов (Miret, MunnéBosch, 2015). В клетках цианобактерий существует неферментативный механизм поглощения избытка возбужденных электронов светособирающим комплексом фотосистемы II. Ключевую роль в этом процессе играет процесс превращения каротиноида виолоксантина в зеаксантин, который лучше захватывает возбужденные электроны (Kerfeld et al., 2017). Показано также, что генетически модифицированные штаммы Synechoccocus PCC 7962 с повышенным образованием зеаксантина более устойчивы к UV-B-излучению по сравнению с исходным штаммом (Gotz et al., 1999). Мутант Synechoccocus PCC 6803 с дефицитом зеаксантина, наоборот, менее устойчив к UV-B-излучению. В условиях интенсивного освещения (светового стресса) в клетках цианобактерий также наблюдается повышение содержания каротиноидов и, в первую очередь, зеаксантина. Количество и спектр каротиноидов в цианобактериях очень широк, он включает в себя и такие уникальные соединения как каротиноид-гликозиды – миксоксантофиллы. Эти ненасыщенные соединения очень эффективно нейтрализуют возбужденные электроны и, вероятно, являются наиболее эффективными фотопротекторами в клетках цианобактерий (Schagerl, Muller, 2006).
Токоферолы – метилированные фенолы, в совокупности называемые витамином Е (рис. 3б). Токоферолы встречаются у всех фотосинтезирующих организмов, в том числе у цианобактерий. Соединения этой группы относятся к уникальным биологически активным молекулам, проявляющим, в том числе, и антиоксидантные свойства. Они играют существенную роль в защите мембран от перекисного окисления липидов, поскольку являются жирорастворимыми веществами. Механизм защитного действия связан с двумя реакциями: образованием под действием АФК токоферил-радикала и превращением синглетного кислорода в пероксид. Многочисленные данные свидетельствуют о высокой устойчивости растений и цианобактерий к действию различных стрессовых факторов при повышенном содержании токоферола и фенольных соединений (Miret, MunnéBosch, 2015; Leisso et al., 2015; Storme et al., 2015). В то же время у токоферол-дефицитных мутантов Synechoccocus PCC 6803 не наблюдалось заметного снижения устойчивости к сильному свету и UV-B-облучению, что может быть связано с неспецифичностью токоферолов как антиоксидантов у данной цианобактерии (Maeda et al., 2005).
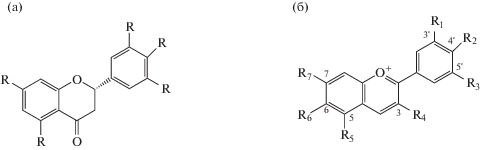
Флавоноиды. Эти низкомолекулярные соединения участвуют в защитном ответе клеток растений и цианобактерий не только как UV-абсорбирующие вещества при действии UV-B-излучения, но и как антиоксиданты при детоксикации АФК (Nakabayashi et al., 2014). Флавоноиды – это соединения, состоящие из четырех конденсированных ароматических колец (A, B, C, D) и подразделяющиеся на несколько подгрупп: флавоны (рис. 4а), флавонолы, флавононы и флавононолы. Примерами таких соединений являются кверцитин (флавонол) и лютеолин (флавон). Все эти соединения различаются по характеру заместителей в конденсированных кольцах и по электрофоретической подвижности на специальных носителях. У растений накопление флавоноидов происходит преимущественно в вакуолях эпидермальных клеток листа, что препятствует проникновению излучения в нижележащие ткани (Mackerness, 2000; Mpoloka, 2008). Эпидермис листа поглощает от 95 до 99% падающей UV-В-радиации (Stapleton, Valbot, 1994). Исследования мутантных растений, дефицитных по синтезу флавоноидов или с повышенным конститутивным уровнем синтеза UV-В-поглощающих пигментов (флавоноиды, производные синапового спирта), подтвердили важную роль этих соединений в устойчивости растений к UV-В-облучению (Mackerness, 2000; Bieza, Lois, 2001). Защитное действие флавоноидов основано на их эффективной абсорбции света в диапазоне 220–380 нм и на их фотостабильности. Однако вклад различных фенольных соединений в защиту растений от действия UV-B-излучения изучен недостаточно. В настоящее время проводятся исследования растений, мутантных по биосинтезу различных фенольных соединений, с целью определения вклада индивидуальных веществ в защиту от UV-B-излучения. Растения делят на две основные группы по способности к аккумуляции флавоноидных соединений в различных тканях: двудольные аккумулируют флавоноиды в эпидермисе, однодольные – в эпидермисе и в мезофилле. Они локализуются в вакуолях и способны также нейтрализовать АФК и пероксинитрит (Kumar, Pandey, 2013). Кроме этого, данные метаболиты участвуют в регуляции ростовых процессов у растений.
Участие ряда наиболее изученных флавоноидов в ответе на стрессовые факторы в клетках цианобактерий продемонстрировано, в частности, на примере солевого стресса, в результате которого в клетках ряда цианобактерий происходит существенное повышение уровня большинства флавоноидов параллельно с повышением активности антиоксидантных систем, нейтрализующих свободные радикалы (Singh et al., 2014).
Основные группы флавоноидов синтезируются в клетках цианобактерий и основных линий эукариотических водорослей, что свидетельствует о раннем эволюционном происхождении ферментативных комплексов их биосинтеза (Goiris et al., 2014). Необходимо отметить, что обширная флавоноидная группа соединений характеризуется многофункциональностью, в частности, данные метаболиты участвуют в регуляции ростовых процессов у растений и индуцируют экспрессию симбиотически-ассоциированных генов в клетках цианобактерии Nostoc punctiforme (Cohen, Yamasaki, 2000).
В эволюционном отношении обособленную группу антиоксидантов из семейства флавоноидов представляют собой антоцианиды, которые синтезируются только в клетках высших растений (мхов, папоротников и наземных растений) и отвечают за их окраску, наряду с хлорофиллом и каротиноидами. Они придают плодам, ягодам, листьям и цветкам окраску от розовой до черно-фиолетовой. В геномах цианобактерий и водорослей не были обнаружены гены синтеза основных антоцианидов (Campanella et al., 2014). Антоцианиды (агликоны антоцианов) представляют собой производные катиона флавилия (2-фенилбензопирилия) и в растениях они, как правило, присутствуют в виде гликозидов. Термин антоцианы охватывает флавилиевые агликоны (антоцианидины) и их гликозиды. Это один из наиболее распространенных и многочисленных по разнообразию классов флавоноидных соединений. Общая формула для шести основных антоцианидинов – пеларгонидина, цианидина, пеонидина, дельфинидина, петунидина и мальвидина приведена на рис. 4б. Эти пигменты могут уменьшать фотоокислительное повреждение листьев как путем защиты хлоропластов от избыточных квантов высокой энергии, так и за счет поглощения АФК. Антоцианы защищают растения от повреждения UV-излучением, поглощая в длинах волн 280–320 нм. UV-B-абсорбирующие пигменты присутствуют во всех тканях листьев, но аккумулируются, главным образом, в адаксиальных эпидермальных клетках (Miret, MunnéBosch, 2015). При действии UV-B-облучения увеличивается содержание гликозида кверцитина в обоих слоях эпидермальных клеток растений (Asensi-Fabado et al., 2015).
В биосинтезе фенольных соединений используются метаболические пути, связанные с образованием углеводов, аминокислот и липидов. Предшественником большинства фенольных соединений является шикимовая кислота, из которой могут синтезироваться оксибензойные кислоты. Однако основная масса фенольных соединений образуется из оксикоричных кислот, предшественниками которых являются фенилаланин и тирозин. Обе аминокислоты синтезируются из шикимовой кислоты через ряд промежуточных стадий. Ключевыми ферментами биосинтеза фенольных соединений являются фенилаланин-аммиак-лиаза и халконсинтаза. Антоцианы, флавоноиды и каротиноиды являются в той или иной степени производными простых фенолов (McClure, 1986).
Пролин (иминокислота) (рис. 5а) – один из широко распространенных метаболитов в высших растениях (Kavi Kishor et al., 2005; Tanner, 2008; Verslues, Sharma, 2010). Содержание свободного пролина многократно (в десятки, иногда в сотни раз) возрастает в условиях засухи, засоления, действия низких температур, тяжелых металлов, патогенов (Verbruggen, Hermans, 2008). Повышение содержания пролина отмечено и у цианобактерий в условиях совместного действия низких температур и яркого света (Deniz et al., 2011), а также при действии тяжелых металлов (Sheeba et al., 2011).
В настоящее время не вызывает сомнения, что пролин при стрессовых воздействиях участвует в осморегуляции, в антиоксидантной защите, работает как энергетический субстрат, регулирует рН и соотношение НАД/НАДН (Matysik et al., 2002). Свободный пролин и пролин в составе белковой молекулы – обязательные компоненты любой клетки. Пролин хорошо растворим в воде, хотя обладает не только гидрофильными, но и гидрофобными свойствами (Matysik et al., 2002; Ignatova, Gierasch, 2006). При изучении физико-химических свойств пролина был сделан вывод, что в основе высокой растворимости этой иминокислоты лежит способность ее молекулы образовывать агрегаты благодаря наличию гидрофильных и гидрофобных групп (Ignatova, Gierasch, 2006). Образовавшиеся полимеры ведут себя как гидрофильные коллоиды. По этой причине пролин не действует на белки подобно детергентам и не вмешивается в интрамолекулярные гидрофобные взаимодействия, что привело бы к их денатурации, а связывается только с поверхностными гидрофобными остатками. Химические свойства пролина обусловлены присутствием амино- и карбоксильной групп. Химическое или биохимическое декарбоксилирование пролина дает в качестве продуктов циклический 2-пирролидон (амид), альдегид и амин. Кроме этих реакций, для пролина характерны реакции, вызывающие размыкание гетероцикла – присоединение молекулы воды с образованием γ-полуальдегида. Пролин, по сравнению с глутаматом, является более обогащенным электронами соединением, поэтому пара пролин/глутамат в митохондриях образует так называемую электронную губку (Matysik et al., 2002). Пролин окисляется до оксипролина в растительной клетке только в пептид-связанной форме аскорбатзависимой моноксигеназой. In vitro получение оксипролина из пролина возможно при его окислении под действием Н2О2. Антиоксидантные свойства пролина также обусловлены строением его молекулы, так как содержащая гидрированное пиррольное гетерокольцо молекула обладает способностью к окислительно-восстановительным реакциям. Как многие гетероциклические соединения, содержащие различные функциональные группы, например, нуклеотидные основания, пролин может образовывать водородные связи между молекулами, формируя полимерные цепи. Пролин содержит третичный углеродный атом. Образование такого устойчивого радикала приводит к “тушению” или обрыву каскада свободно-радикальных реакций, запускаемых супероксид-радикалом, пероксид-радикалом или гидроксил-радикалом (Matysik et al., 2002). Кроме того, в отличие от других низкомолекулярных антиоксидантов (аскорбата, токоферола, фенолов), пролин легко транспортируется по растению, что, вероятно, делает его более конкурентоспособным по отношению к антиоксидантным ферментам, а также к другим низкомолекулярным антиоксидантам.
Биосинтез пролина достаточно консервативен в клетках растений и цианобактерий и осуществляется по двум метаболическим путям – глутаматному и орнитиновому (Fichman et al., 2015). У бактерий существуют некоторые вариации, но и у растений, и у бактерий основным считается глутаматный путь биосинтеза пролина (Verslues, Sharma, 2010). Ключевой фермент глутаматзависимого пути – Δ1-пирролин-5-карбоксилатсинтетаза (П5КС) – обладает двойной функцией. Сначала происходит АТФ-зависимое фосфорилирование L-глутамата (γ-глутамилкиназная активность). Образующийся L-глутамил-γ-фосфат превращается в γ-полуальдегид глутаминовой кислоты (ПАГ) с помощью этого же фермента, функционирующего как НАДФН-зависимая ПАГ-дегидрогеназа, ПАГ самопроизвольно циклизуется с образованием Δ1-пирролин-5-карбоксилата (П5К). Последний восстанавливается до пролина ферментом Δ1-пирролин-5-карбоксилатредуктазой (П5КР) (Verslues, Sharma, 2010). В отличие от растений, у цианобактерий только три гена кодируют четыре фермента пролинового биосинтеза (Fichman et al., 2015).
Функционирование орнитинового пути биосинтеза пролина осуществляется через трансаминирование орнитина, катализируемого орнитин аминотрансферазой, с образованием Δ1-пирролин-2-карбоксилата (П2К) и с последующим его восстановлением до пролина (Verbruggen, Hermans, 2008; Verslues, Sharma, 2010). Уровень пролина в клетках определяется не только скоростью его синтеза, но и скоростью его распада.
Окисление пролина у растений происходит в митохондриях и протекает в две стадии, катализируемые пролиндегидрогеназой (ПДГ) и Δ1-пирролин-5-карбоксилатдегидрогеназой (П5КДГ). ПДГ ассоциирована с внутренней мембраной митохондрий, активный центр фермента обращен в матрикс. П5КДГ также локализуется в матриксе митохондрий. Существуют данные, что П5К из активного центра П5КДГ может поступать в активный центр ПДГ. В этом случае П5К не выходит в раствор, а остается в активном центре (Tanner, 2008). Кроме того, обнаружено две ПДГ, кодирующиеся различными генами. Одна – PRODH1 – окисляет пролин, вторая – PRODH2 – окисляет оксипролин (Cooper et al., 2008). Оба фермента локализуются в митохондриях растений. Нарушение мембранной структуры митохондрий при действии абиотических стрессовых факторов прежде всего отражается на активности ферментов деградации пролина и приводит к нарушению его клеточного гомеостаза (Sells, Koeppe, 1981; Rayapati, Stewart, 1991).
Полиамины. Это широко распространенные низкомолекулярные поликатионы в клетках растений и цианобактерий. Изучение содержания эндогенных полиаминов в клетках растений показало, что конститутивный высокий уровень определяется полиаминами семейства путресцина – диамином путресцином (Пут); триамином спермидином (Спд) и тетраамином спермином (Спм) (рис. 5б). У цианобактерий встречаются диамины, триамины, тетраамины и даже пентаамины (Hamana, Matsuzaki, 1992). Присутствие или отсутствие тех или иных полиаминов у бактерий является таксономическим признаком. У цианобактерий наиболее распространенными полиаминами являются триамины – спермидин и гомоспермидин (Zhu et al., 2015). Они могут находиться как в свободной форме, так и в виде конъюгированных молекул, связанных с фенольными кислотами, другими низкомолекулярными веществами, а также образовывать макромолекулы наподобие белков и нуклеиновых кислот (Galston et al., 1997; Kaur-Sawhney et al., 2003). Образование конъюгированных форм полиаминов катализируется специальными ферментами трансглютаминазами, которые могут активироваться в стрессовых условиях (Mapelli et al., 2008). В растительных клетках обмен между свободными полиаминами и их конъюгатами, вероятно, ограничен, но при этом показано, что конъюгаты полиаминов с оксикоричными кислотами могут регулировать эндогенный пул полиаминов, служить транспортом полиаминов или даже являться субстратом аминооксидаз и пероксидаз (Slocum et al., 1984).
Накоплено большое количество данных о стресс-зависимой аккумуляции полиаминов в клетках растений и цианобактерий и их участии в защите от АФК (Bouchereau et al., 1999; Urano et al., 2003; Groppa, Benavides, 2008; Alcázar et al., 2010; Zhu et al., 2015). Для цианобактерий усиление биосинтеза полиаминов, а также их экзогенное внесение повышают уровень устойчивости к свету и низким температурам – наиболее повреждающим факторам для этих организмов. Показана также положительная корреляция между интенсивным конститутивным синтезом полиаминов и резистентностью растений и цианобактерий к гербицидам (Tanou et al., 2014; Zhu et al., 2015). У растений концентрация полиаминов возрастает в ответ на действие засухи, низких температур, засоления, параквата (Радюкина и др., 2008), озона (Iori et al., 2013), UV-B-радиации (Mapelli et al., 2008).
Протекторная роль полиаминов основана на химических свойствах этих соединений как органических катионов (Bouchereau et al., 1999; Kaur-Sawhney et al., 2003). Благодаря положительному заряду полиамины свободно связываются с отрицательно заряженными фосфатными группами нуклеиновых кислот и с карбоксильными группами белков (Minocha et al., 2014). Связывание полиаминов с белковой молекулой или нуклеиновыми кислотами не только защищает их от распада, но и придает им наиболее эффективную в стрессовых условиях конформацию молекулы (Kuznetsov, Shevyakova, 2011). Защитный механизм полиаминов в условиях стресса состоит в ингибировании ферментов деградации биополимеров (ДНКаз, РНКаз, протеаз) и в предотвращении распада хлорофилла (Sobieszczuk-Nowicka, Legocka, 2014). Полиамины могут ингибировать процесс метилирования ДНК, что позволяет экспрессироваться специфичным генам (Kuznetsov, Shevyakova, 2011). Важную роль полиамины играют в регулировании стабильности и проницаемости мембран в стрессовых условиях. Увеличение положительного заряда молекул в ряду полиаминов (Спм > > Спд > Пут) коррелирует с повышением сродства к плазматической мембране, что способствует образованию множества точек взаимодействия, повышая стабильность мембран. У цианобактерии Synechocystis PCC 6803 инактивация генов синтеза спермидина значительно уменьшает выживаемость клеток на холоде (5°C), причем выживаемость может быть восстановлена в результате добавления спермидина (Zhu et al., 2015).
Антиоксидантная роль полиаминов проявляется также в их способности нейтрализовать действие АФК (Matysik et al., 2002; Kakkar, Sawhney, 2003). Спд и Спм обычно относят к наиболее эффективным антиоксидантам, которые рассматриваются как ловушки оксид-радикалов (Matysik et al., 2002). Антиоксидантные свойства полиаминов могут основываться на эффективном процессе кислород-зависимого авто- и ферментативного окисления аминогрупп с помощью диаминоксидазы (ДАО) и полиаминоксидазы (ПАО) (Kuznetsov, Shevyakova, 2011). Пут может ковалентно связывася с антиоксидантным ферментом СОД, и такой комплекс в 20 раз легче проникает через внутриклеточные мембраны (Poduslo, Curran, 1996). Было также обнаружено, что свободные полиамины, по сравнению с конъюгатами полиаминов с кофейной, кумаровой и феруловой кислотами, имеют низкие константы связывания со всеми типами АФК, тем самым свободные полиамины проявляли менее выраженные свойства молекул-ловушек радикалов кислорода, чем их конъюгированные производные (Bors et al., 1989). Следовательно, образование конъюгированных форм полиаминов в стрессовых условиях должно способствовать повышению эффективности антиоксидантных систем защиты.
В растениях существует несколько путей биосинтеза путресцина. Он может образовываться из орнитина и цитруллина в результате прямого декарбоксилирования, катализируемого соответственно орнитин-декарбоксилазой и цитруллин-декарбоксилазой (Minocha et al., 2014). В цианобактериях путресцин образуется из аргинина с помощью аргининдекарбоксилазы, через промежуточный агматин и N-карбамоилпутресцин (Zhu et al., 2015). Два пути биосинтеза путресцина в клетках растений пространственно разобщены, тканеспецифичны и находятся под онтогенетическим контролем (Minocha et al., 2014). Наращивание алифатической цепи Пут с образованием Спд и Спм идет путем последовательной полимеризации с помощью присоединения аминопропила, образующегося при декарбоксилировании S-аденозилметионина (S-AM) S-аденозилметионин-декарбоксилазой (S-AMДК). Последовательно протекающие реакции полимеризации катализируются спермидин-синтазой и спермин-синтазой, соответственно (Kuznetsov, Shevyakova, 2011). S-AM синтезируется при последовательной трансформации L-метионина метионин-аденозилтрансферазой и является предшественником для спермидина и спермина, а также и этилена. Фермент S-AMДК, регулируя два биосинтетических пути, по-видимому, является лимитирующим фактором в синтезе полиаминов, его содержание в живых организмах очень мало, и он имеет короткое время полужизни (около 12 ч) (Minocha et al., 2014). Катаболизм полиаминов является эффективным средством регуляции их эндогенного уровня, а образующиеся при этом продукты деградации могут выполнять важную физиологическую роль в нормальных и в стрессовых условиях (Do et al., 2014; Minocha et al., 2014). Как уже упоминалось, деградация полиаминов в растениях осуществляется двумя классами окислительных ферментов: ДАО и ПАО (Moschou et al., 2008; Minocha et al., 2014). Оба фермента локализованы в клеточных стенках и являются поставщиками перекиси водорода, необходимой для процессов суберинизации и лигнификации, придающих жесткость клеточным стенкам.
Особое место среди полиаминов занимает кадаверин (Кад) – относительно редко встречающийся в фотосинтезирующих клетках диамин, который образуется из лизина через пиридоксальфосфат-зависимое декарбоксилирование, катализируемое лизиндекарбоксилазой (Kuznetsov, Shevyakova, 2011; Minocha et al., 2014). В стрессовых условиях аккумуляция Кад у растений, очевидно, выполняет компенсаторную роль при снижении содержания полиаминов семейства путресцина. Образование Кад происходит в строме хлоропластов (Kuznetsov et al., 2011; Minocha et al., 2014).
ЗАКЛЮЧЕНИЕ
Антиоксидантные реакции представляют собой разветвленную сеть в клетках растений и цианобактерий, которую с полным правом можно называть антиоксидантной системой.
Несомненно, что описанные выше системы клеточной защиты были сформированы в прокариотических клетках и в той или иной степени являются частью базового метаболизма всех древних организмов, однако они достигают максимального уровня развития в ходе длительной эволюции цианобактериальной филы прокариот (Шестаков, Карбышева, 2017). Необходимость совершенствования антиоксидантных форм защиты приобретает особое значение в ходе формирования механизма оксигенного фотосинтеза в клетках древних фототрофных организмов – цианобактерий, и позднее – в клетках эукариотических водорослей и высших растений.
Огромное разнообразие низкомолекулярных антиоксидантов в фотосинтезирующих клетках заставляет нас думать об их большей эффективности по сравнению с ферментативными защитными системами. Это подтверждается их участием в адаптационных процессах при воздействии различных стрессовых факторов. Не исключено, что существует избирательность в активации синтеза определенных метаболитов при действии стрессовых факторов различной природы. Все это вместе убеждает нас в необходимости комплексных исследований механизмов регуляции различных метаболических путей синтеза и их взаимоотношений в системе низкомолекулярных антиоксидантов в клетках растений и цианобактерий в зависимости от условий внешней среды и климатической зоны обитания организмов.
Список литературы
Бриттон Г. Биохимия природных пигментов. М.: Мир, 1986. 422 с.
Полесская О.Г. Растительная клетка и активные формы кислорода / Ред. И.П. Ермаков. М.: КДУ, 2007. 140 с.
Радюкина Н.Л., Шашукова А.В., Шевякова Н.И., Кузнецов Вл.В. Участие пролина в антиоксидантной защитной системе шалфея при действии NaCl и параквата // Физиол. раст. 2008. Т. 55. С. 721–730.
Соловченко А.Е., Мерзляк М.Н. Экранирование видимого и УФ излучения как механизм фотозащиты у растений // Физиол. раст. 2008. Т. 55. С. 803–822.
Шестаков С.В., Карбышева Е.А. О происхождении и эволюции цианобактерий // Успехи соврем. биол. 2017. Т. 137. № 1. С. 4–20.
Abogadallah G.M. Antioxidative defence under salt stress // Plant Signal. Behav. 2010. V. 5. P. 369–374.
Alcázar R., Altabella T., Marco F. et al. Polyamines: molecules with regulatory functions in plant abiotic stress tolerance // Planta. 2010. V. 231. P. 1237–1249. https://doi.org/10.1007/s00425-010-1130-0
Alonso R., Elvira S., Castillo F.J., Gimeno B.S. Interactive effects of ozone and drought stress on pigments and activities of antioxidative enzymes in Pinus halepensis // Plant Cell Environ. 2001. V. 24. P. 905–916.
Asensi-Fabaldo M.A., Ammon A., Sonnewald U. et al. Tocopherol deficiency reduces sucrose export from salt-stressed potato leaves independently of oxidative stress and symplastic obstruction by callose // J. Exp. Bot. 2015. V. 66. P. 957–971. https://doi.org/10.1093/jxb/eru453
Bartoli C.G., Yu J., Gomez F. et al. Interrelationships between light and respiration in the control of ascorbic acid synthesis and accumulation in Arabidopsis thaliana leaves // J. Exp. Bot. 2006. V. 57. P. 1621–1631.
Bekker D., Holland H.D., Wang P.L. et al. Dating the rise of atmospheric oxygen // Nature. 2004. V. 427. P. 117–120.https://doi.org/10.1038/nature02260
Bieza K., Lois R. An Arabidopsis mutant tolerant to lethal ultraviolet B levels shows constitutively elevated accumulation of flavonoids and other phenolics // Plant Physiol. 2001. V. 126. P. 1105–1115.https://doi.org/10.1104/pp.126.3.1105
Blokhina O., Virolainen E., Fagerstedt K.V. Antioxidants, oxidative damage and oxygen deprivation stress: a review // Ann. Botan. 2003. V. 91. P. 179–194.
Bors W., Langebartels C., Michel C., Sandermann H. Polyamines as radical scavengers and protectants against ozon damage // Phytochemistry. 1989. V. 28. P. 1589–1595.
Bouchereau A., Aziz A., Larher F., Martin-Tanguy J. Polyamines and environmental challenges: recent development // Plant Sci. 1999. V. 140. P. 103–125.
Campanella J.J., Smalley J.V., Dempsey M.E. A phylogenetic examination of the primary anthocyanin production pathway of the Plantae // Bot. Stud. 2014. V. 55. P. 10. https://doi.org/10.1186/1999-3110-55-10
Cheeseman J.M. Hydrogen peroxide and plant stress: a challenging relationship // Plant stress / Global Science Books. 2007. V. 1. P. 4–15.
Chen Q., Zhang M., Shen S. Effect of salt on malondialdehyde and antioxidant enzymes in seedling roots of Jerusalem artichoke (Helianthus tuberosus L.) // Acta Physiol. Plant. 2010. V. 33. P. 273–278.
Cohen M.F., Yamasaki H. Flavonoid-induced expression of a symbiosis-related gene in the cyanobacterium Nostoc punctiforme // J. Bacteriol. 2000. V. 182. P. 4644–4646.
Cooper S.K., Pandhare J., Donald S.P., Phang J.M. A novel function of hydroxyproline oxidase in apoptosis through generation of reactive oxygen species // J. Biol. Chem. 2008. V. 283. P. 485–492. https://doi.org/10.1074/jbc.M702181200
Dat J., Vandenabeele S., Vranová E. et al. Dual action of active oxygen species during plant stress responses // Cell. Mol. Life Sci. 2000. V. 57. P. 779–795.
Deniz F., Saygideger S.D., Karaman S. Response to copper and sodium chloride excess in Spirulina sp. (Cyanobacteria) // Bull. Environ. Contam. Toxicol. 2011. V. 87. P. 11–15.
Do P.T., Drechsel O., Heyer A.G. et al. Changes in free polyamine levels, expression of polyamine biosynthesis genes, and performance of rice cultivars under salt stress: a comparison with responses to drought // Front. Plant Sci. 2014. V. 5. P. 182–192. https://doi.org/10.3389/fpls.2014.00182
Fahey R.C. Glutathione analogs in prokaryotes // Biochim. Biophys. Acta. 2013. V. 1830. P. 3182–3198.
Fichman Y., Gerdes S.Y., Kovasc H. et al. Evolution of proline biosynthesis: enzymology, bioinformatics, genetics and transcriptional regulation // Biol. Rev. Camb. Phylos. Sci. 2015. V. 90. P. 1065–1089. https://doi.org/10.1111/ brv.12146
Foyer C.H., Noctor G. Oxidant and antioxidant signaling in plants: a reevaluation of the concept of oxidative stress in a physiological context // Plant Cell Environ. 2005. V. 28. P. 1056–1071.
Foyer C.H., Noctor G. Ascorbate and glutathione: the heart of the redox hub // Plant Physiol. 2011. V. 155. P. 2–18.
Foyer C.H., Lelandais M., Kunert K. Photooxidative stress in plant // Physiol. Plant. 1994. V. 92. P. 696–717.
Fryzova R., Pohanka M., Martinkova P. et al. Oxidative stress and heavy metals in plants // Rev. Environ. Contam. Toxicol. 2018. V. 245. P. 129–156. https://doi.org/10.1007/398_2017_7
Fu J., Huang B. Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress // Environ. Exp. Bot. 2001. V. 45. P. 105–114.
Galston A.W., Kaur-Sawhney R., Altabella T., Tiburcio A.F. Plant polyamines in reproductive activity and response to abiotic stress // Bot. Acta. 1997. V. 110. P. 197–207. https://doi.org/10.1111/j.1438-8677.1997.tb00629.x
Gechev T.S., van Breusegem F., Stone J.M. et al. Reactive oxygen species as signals that modulate plant stress responses and programmed cell death // BioEssays. 2006. V. 28. P. 1091–1101.
Goiris K., Muylaert K., Voorspoels S. et al. Detection of flavonoids in microalgae of different evolutionary lineages // J. Phycol. 2014. V. 50 (3). P .483–492. https://doi.org/10.1111/jpy.12180
Gotz T., Windhovel U., Boger P., Sandmann G. Protection of photosynthesis against ultraviolet-B radiation by carotinoids in transformants of cyanobacteria Synechoccocus PCC 7942 // Plant Physiol. 1999. V. 120. P. 599–604. https://doi.org/10.1104/pp.120.2.599
Groppa M.D., Benavides M.P. Polyamines and abiotic stress: recent advances // Amino Acids. 2008. V. 34. P. 35–45. https://doi.org/10.1007/s00726-007-0501-8
Gross F., Durner J., Gaupels F. Nitric oxide, antioxidants and prooxidants in plant defence response // Front. Plant Sci. 2013. V. 4. Art. 419. https://doi.org/10.3389/fpls.2013.00419
Halliwell B. Reactive speces and antioxidants. Redox biology is a fundamental theme of aerobic life // Plant Physiol. 2006. V. 141. P. 312–322.
Hamana K., Matsuzaki S. Polyamines as a chemotaxonomic marker in bacterial systematic // Crit. Rev. Microbiol. 1992. V. 18. P. 261–283.https://doi.org/10.3109/10408419209113518
He Y.Y., Häder D.P. Reactive oxygen species and UVB: effect on cyanobacteria // Photochem. Photobiol. Sci. 2002. V. 1. P. 729–736.
Ignatova Z., Gierasch L.M. Inhibition of protein aggregation in vitro and in vivo by a natural osmoprotectant // PNAS USA. 2006. V. 103. P. 13357–13361.
Iori V., Pietrini F., Cheremisina A. et al. Growth responses, metal accumulation and phytoremoval capability in Amaranthus plants exposed to nickel under hydroponics // Water Air Soil Poll. 2013. V. 224. P. 1450. https://doi.org/10.1007/s11270-013-1450-3
Jimenez-Del-Rio M., Velez-Pardo C. The bad, the good, and the ugly about oxidative stress // Oxid. Med. Cell. Longev. 2012. Art. ID 163913. https://doi.org/10.1155/2012/163913
Kakkar R.K., Sawhney V.K. Polyamine research in plants – a changing perspective // Physiol. Plant. 2003. V. 116. P. 281–292.https://doi.org/10.1034/j.1399-3054.2002.1160302.x
Kaur-Sawhney R., Tiburcio A.F., Altabella T., Galston A.W. Polyamines in plants: an overview // J. Cell Mol. Biol. 2003. V. l. P. 1–12.
Kavi Kishor P.B., Sangam S., Amrutha R.N. et al. Regulation of proline biosynthesis, degradation, uptake and transport in higher plants: its implications in plant growth and abiotic stress tolerance // Curr. Sci. 2005. V. 88. P. 424–438.
Kerfeld Ch.A., Melnicki M.R., Sutter M., Domingues-Martin M.A. Structure, function and evolution of the cyanobacteria orange carotenoid protein and its homologs // New Phytol. 2017. V. 215. P. 937–951.
Kirilovsky D., Kerfeld Ch. The orange carotenoid protein in photoprotection of photosysteme II in cyanobacteria // Biochim. Biophys. Acta. 2012. V. 1817. P. 158–166.
Kumar S., Pandey A.K. Chemistry and biological activities of flavonoids: an overview // Sci. World J. 2013. V. 2013. AID 162750. https://doi.org/10.1155/2013/162750
Kumar N., Pal M., Singh A. et al. Exogenous proline alleviates oxidative stress and increase vase life in rose (Rosa hybrida L. ‘Grand Gala’) // Sci. Hort. 2010. V. 127. P. 79–85.
Kuznetsov Vl.V., Shevyakova N.I. Polyamines and plant adaptation to saline environment // Desert plants: biology and biotechnology / Ed. K.B. Ramawat. Heidelberg: Springer-Verlag, 2011. P. 261–297.
Larcher W. Physiological plant ecology. Ecophysiology and stress physiology of functional groups. Berlin: Springer, 2003. 514 p.
Latifi A., Ruiz M., Zhang Ch.-C. Oxidative stress in cyanobacteria // FEMS Microbiol. Rev. 2009. V. 33. P. 258–278.
Leisso R.S., Buchanan D.A., Lee J. et al. Chilling related cell damage of apple (Malus × domestica Borkh.) fruit cortical tissue impacts antioxidant, lipid and phenolic metabolism // Physiol. Plant. 2015. V. 153. P. 204–220. https://doi.org/10.1111/ppl.12244
Li J., OuLee T.M., Raba R. Arabidopsis flavonoid mutants are hypersensitive to ultraviolet B radiation // Plant Cell. 1993. V. 5. P. 171–179.
Mackerness S.A.H. Plant responses to ultraviolet B (UVB: 280–320 nm) stress: what are the key regulators? // Plant Growth Reg. 2000. V. 32. P. 27–39. https://doi.org/10.1023/A:1006314001430
Maeda H., Sakuragi Y., Bryant D.A., DellaPenna D. Tocopherols protect Synechocystis sp. strain PCC 6803 from lipid peroxidation // Plant Physiol. 2005. V. 135. P. 1422–1432.
Mapelli S., Brambilla I.M., Radyukina N.L. et al. Free and bound polyamines changes in different plants as a consequence of UVB light irradiation // Gen. Appl. Plant Physiol. 2008. V. 34. P. 55–66.
Matysik J., Alia B., Bhalu B., Mohanty P. Molecular mechanism of quenching of reactive oxygen species by proline under stress in plant // Curr. Sci. 2002. V. 82. P. 525–532.
McClure J.W. Physiology of flavonoids in plants // Prog. Clin. Biol. Res. 1986. V. 213. P. 525–532.
Minocha R., Majumbar R., Minocha S.C. Poliamines and abiotic stress in plants: a complex relationship // Front. Plant Sci. 2014. V. 5. P. 1–17. https://doi.org/10.3389/fpls.2014.00175
Miret J.A., MunnéBosch S. Redox signaling and stress tolerance in plants: a focus on vitamin E // Ann. N.Y. Acad. Sci. 2015. V. 1340. P. 29–38.
Mittova V., Tal M., Volokita M., Guy M. Upregulation of the leaf mitochondrial and peroxisomal antioxidative systems in response to salt induced oxidative stress in the wild salt-tolerant tomato species Lycopersicon pennellii // Plant Cell Environ. 2003. V. 26. P. 845–856.
Miura K., Tada Y. Regulation of water, salinity, and cold stress responses by salicylic acid // Front. Plant Sci. 2014. V. 5. Art. 4. https://doi.org/10.3389/fpls.2014.00004
Moschou P., Paschalidis K., Roubelakis-Angelakis K.A. Plant polyamine catabolism: the state of the art // Plant Signal. Behav. 2008. V. 12. P. 1061–1066.
Mpoloka S.W. Effects of prolonged UVB exposure in plants // Afr. J. Biotechnol. 2008. V. 7 (25). P. 4874–4883.
Nakabayashi R., Yonekura-Sakakibara K., Urano K. et al. Enhancement of oxidative and drought tolerance in Arabidopsis by overaccumulation of antioxidant flavonoids // Plant J. 2014. V. 77. P. 367–379.
Nishiyama Y., Murata N. Revised scheme for the mechanism of photoinhibition and its application to enhance the abiotic stress tolerance of the photosynthetic machinery // App. Microbiol. Biotechnol. 2014. V. 98. P. 8777–8796. https://doi.org/10.1007/s00253-014-6020-0
Poduslo J.F., Curran G.L. Increased permeability of superoxide dismutase at the blood-nerve and blood-brain barriers with retained enzymatic activity after covalent modification with the naturally occurring polyamine, putrescine // J. Neurochem. 1996. V. 67. P. 734–741.
Radyukina N.L., Ivanov Yu.V., Kartashov A.V. et al. Regulation of gene expression governing proline metabolism in Thellungiella salsuginea by NaCl and paraquat // Rus. J. Plant Physiol. 2011. V. 58. P. 643–652.
Rayapati P.J., Stewart C.R. Solubilization of a proline dehydrogenase from maize (Zea mays L.) mitochondria // Plant. Physiol. 1991. V. 95. P. 787–791.
Rodríguez-Pérez C., Segura-Carretero A., Del Mar Contreras M. Phenolic compounds as natural and multifunctional antiobesity agents: a review // Crit. Rev. Food Sci. Nutr. 2017. V. 11. P. 1–18. https://doi.org/10.1080/10408398.2017.1399859
Satkoski A.M., Beukes M.J., Li W. et al. A redox-stratified ocean 3.2 billion years ago // Earth Planet. Sci. Lett. 2015. V. 430. P. 43–53. https://doi.org/10.1016/j.epsl.2015.08.007
Scandalias J.G. Response of plant antioxidant defense genes to environmental stress // Adv. Genet. 1990. V. 28. P. 1–41.
Schagerl M., Muller B. Acclimation of chlorophyll a and carotinoid levels to different irradiances in four freshwater // J. Plant Physiol. 2006. V. 163. P. 709–716. https://doi.org/10.1016/j.jplph.2005.09.015
Sells G.D., Koeppe D.E. Oxidation of proline by mitochondria isolated from water-stressed maize shoots // Plant. Physiol. 1981. V. 68. P. 1058–1063.
Shah Z.H., Rehman H.M., Akhtar T. et al. Redox and ionic homeostasis regulations against oxidative, salinity and drought stress in wheat (a systems biology approach) // Front. Genet. 2017. V. 8. Art. 141. https://doi.org/10.3389/fgene.2017.00141
Sheeba, Singh V.P., Srivastava P.K., Prasad S.M. Differential physiological and biochemical responses of two cyanobacteria Nostoc muscorum and Phormidium foveolarum against oxyfluorfen and UV-B radiation // Ecotoxicol. Environ. Saf. 2011. V. 74. № 7. P. 1981–1993.
Sheo M.P., Dwivedi R., Zeeshan M., Singh R. UVB and cadmium induced changes in pigments, photosynthetic electron transport activity, antioxidant levels and antioxidative enzyme activities of Riccia sp. // Acta Physiol. Plantarum. 2004. V. 26. P. 423–430.
Singh D.P., Prabha R., Meena K.K. et al. Induced accumulation of polyphenolics and flavonoids in cyanobacteria under salt stress protects organisms through enhanced antioxidant activity // Am. J. Plant Sci. 2014. V. 5. P. 726–735. https://doi.org/10.4236/ajps.2014.55087
Singh D.P., Prabha P., Verma S. et al. Antioxidant properties and polyphenolic content in terrestrial cyanobacteria // 3 Biotech. 2017. V. 7. № 134. P. 1–14.
Singh D.P., Srivastava P.K., Prasad S.M. Differential effect of UV-B radiation on growth, oxidative stress and ascorbat-glutathion cycle in two cyanobacteria under copper toxicity // Plant. Physiol. Biochem. 2012. V. 61. P. 61–67.
Slocum R.D., Kaur-Sawhney R., Galston A. W. The physiology and biochemistry of polyamines in plants // Arch. Biochem. Biophys. 1984. V. 35. P. 283–303.
Sobieszczuk-Nowicka E., Legocka J. Plastid-associated polyamines: their role in differentiation structure, functioning, stress response and senescence // Plant Biol. 2014. V. 16. P. 297–305. https://doi.org/10.1111/plb.12058
Stapleton A.E., Walbot V. Flavonoids can protect maize DNA from the induction of ultraviolet radiation damage // Plant Physiol. 1994. V. 105. P. 881–889.
Storme J.Y., Golubic S., Wilmotte A. et al. Raman characterization of the UV-protective pigment gloeocapsin and its role in the survival of Cyanobacteria // Astrobiology. 2015. V. 10. P. 843–857.
Szarka A., Tomasskovics B., Bánhegyi G. The ascorbate-glutathione-α-tocopherol triad in abiotic stress response // Int. J. Mol. Sci. 2012. V. 13. P. 4458–4483.
Tanner J.J. Structural biology of proline catabolism // Amino Acids. 2008. V. 35. P. 719–730. https://doi.org/10.1007/s00726-008-0062-5
Tanou G., Ziogas V., Belghazi M. et al. Polyamines reprogram oxidative and nitrosative status and the proteome of citrus plants exposed to salinity stress // Plant Cell Environ. 2014. 37. P. 864–885. https://doi.org/10.1111/pce.12204
Tichy M., Vermaas W. In vivo role of catalase-peroxidase in Synechocystis sp. strain PCC 6803. // J. Bacteriol. 1999. V. 181. P. 1875–1882.
Tomitani A., Knoll A.H., Cavanaugh C.M., Ohno T. The evolutionary diversification of cyanobacteria: molecular-phylogenetic and paleontological perspectives // PNAS USA. 2006. V. 103. № 14. P. 5442–5447.
Verbruggen N., Hermans C. Proline accumulation in plants: a review // Amino Acids. 2008. V. 35. P. 753–759. https://doi.org/10.1007/s00726-008-0061-6
Verslues P.E., Sharma S. Proline metabolism and its implications for plant-environment interaction // Arabidopsis Book. 2010. V. 8. P. e0140. https://doi.org/10.1199/tab.0140
Urano K., Yoshiba Y., Nanjo T. et al. Characterization of Arabidopsis genes involved in biosynthesis of polyamines in abiotic stress responses and developmental stages // Plant Cell Environ. 2003. V. 26. P. 1917–1926. https://doi.org/10.1046/j.1365-3040.2003.01108.x
Xue Y., He Q. Cyanobacteria as cell factories to produce plant secondary metabolites // Front. Bioeng. Biotechnol. 2015. V. 3. P. 57–64.
Zhu X., Li Q., Yin Ch. et al. Role of spermidine in overwintering of cyanobacteria // J. Bacteriol. 2015. V. 197. P. 2325–2334. https://doi.org/10.1128/JB.00153-15
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии