Успехи современной биологии, 2019, T. 139, № 5, стр. 434-445
Вес мозга и когнитивные способности лабораторной мыши
О. В. Перепелкина 1, А. Ю. Тарасова 1, Н. А. Огиенко 1, И. Г. Лильп 1, И. И. Полетаева 1, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: pvi-1949@mail.ru
Поступила в редакцию 15.03.2019
После доработки 29.04.2019
Принята к публикации 29.04.2019
Аннотация
Различия в весе мозга как морфологического признака, связанного с уровнем развития когнитивных способностей животных, как правило, рассматривают при сравнении животных разных таксономических групп. Одним из методов, определяющих его роль на уровне внутривидовой изменчивости, является селекция на большие и малые величины веса мозга (лабораторных мышей). После 22 поколений отбора на контрастные значения этого признака селекцию прекратили, а линии мышей с большим и малым весом мозга далее разводили рандомбредно. Оказалось, что и различия в весе мозга, и ряд признаков, связанных с более успешным решением когнитивного теста у мышей с большим мозгом, сохранились. С другой стороны, результатом селекции мышей на более успешное решение когнитивного признака стали более высокие значения веса мозга у этих мышей. Таким образом, на внутривидовом уровне у лабораторной мыши (очень популярного модельного нейробиологического объекта) вес мозга может быть индикатором более высокого уровня развития когнитивных способностей.
ВВЕДЕНИЕ
Настоящий обзор посвящен сложному вопросу соотношения веса мозга лабораторных мышей и их способностей к решению когнитивных тестов. Следует отметить, что и способность к научению, и решение элементарных логических задач, и реакция на новизну, и способность к концентрации внимания основаны на свойстве пластичности ЦНС. В настоящее время все эти феномены нередко объединяют термином “когнитивные способности”, однако в настоящем обзоре этот термин используется только для описания способности к решению элементарных логических задач, то есть для случаев, когда для отыскания выхода из “проблемной” ситуации у животного “нет готового решения” по А.Р. Лурия (Poletaeva, Zorina, 2014). Наши эксперименты (описание которых составляет значимую часть данного обзора) были сфокусированы на тестировании способности мышей двух пар линий к решению теста на экстраполяцию и ни поиск входа в укрытие. Элементарная логическая задача на экстраполяцию направления движения стимула, исчезнувшего из поля зрения, представляет для грызунов достаточно большую сложность (см. ниже). Тест на поиск входа в укрытие более прост по своей структуре – его успешное выполнение основано на наличии у животного понимания принципа “неисчезаемости” (по Ж. Пиаже). Эти тесты по своей логической структуре не требуют предварительного научения и являются когнитивными тестами per se. Поскольку их общая схема отличается от общепринятых тестов на обучение и память, в обзоре приведено их краткое описание.
Энцефализация и уровень развития когнитивных способностей
Вес (или масса) мозга – важный морфологический показатель, который, как показывают сравнительные исследования, связан с уровнем развития ЦНС (Tang, 2006) и сложных форм поведения (в частности, когнитивных способностей) и обычно сопоставляется у животных разных таксономических групп. Его традиционно считают показателем уровня эволюционного развития вида. У приматов, слонов, китообразных, врановых птиц, попугаев вес мозга больше, чем у многих других видов, причем он крупнее не просто по массе, а по соотношению вес мозга/вес тела (в частности, по так называемому индексу или коэффициенту энцефализации). Коэфициент энцефализации (encephalization quotient, EQ) вычисляется по формуле EQ = m 0.12 M 2/3, где m – масса мозга (г), а М – масса тела (кг). Такая оценка относительного размера мозга животных разных видов была предложена Джериссоном (Jerisson, 1985). Наибольшее число исследований соотношения когнитивных способностей и размера мозга выполнены на представителях отряда приматов, причем в настоящее время оценивается и роль отдельных генов в формировании таких соотношений (McGowen et al., 2011; Villanea et al., 2012). В то же время исследования эволюции мозга и ряда его отделов у млекопитающих других групп демонстрируют не только корреляцию уровня когнитивных способностей и размеров мозга, но и конвергенцию ряда показателей у животных разных видов, имеющих сходные экологические ниши, что принципиально важно для рассматриваемой проблемы (de Winter, Oxnard, 2001). Важность такого показателя, как собственно число нейронов в определении когнитивных способностей, также показана на грызунах разных видов (Herculano-Houzel, 2007, 2011).
Для суждения об уровне развития интеллекта животных в эволюционном ряду данные по EQ достаточно убедительны, однако исследования внутривидовой изменчивости веса мозга, во-первых, не столь многочисленны, а во-вторых, иногда дают противоречивые результаты, то есть информативность подобных сопоставлений не столь очевидна (Kruska, 2005). Характер соотношения веса мозга и когнитивных способностей зависит и от вида животного, и от выбора популяции для анализа, а также от критериев, по которым судят об уровне интеллекта. Серьезные молекулярно-генетические сопоставления могут быть основой для получения более современной картины таких корреляций (Castillo-Morales et al., 2013). Хорошо известна изменчивость размера мозга человека – размах различий достигает 800 г (при среднем весе его мозга около 1500 г). При этом крайние варианты представляют собой, тем не менее, “интеллектуальную норму”. Это не касается случаев патологических мутаций человека, нарушающих процессы деления клеток-предшественников нейронов в пренатальном онтогенезе, которые в настоящее время моделируются и на мышах (гены микроцефалии, мегенцефалии и лиссенцефалии, Bond et al., 2005; Sugiyama et al., 2009; Yu et al., 2010).
Доместикация и вес мозга
Внутривидовая изменчивость веса мозга достаточно подробно описана для животных, у которых можно сравнивать одомашненные (доместицированные) и дикие формы. Такие сравнения для разных пар видов – мышей, крыс, кур, свиней, норок и др. показали, что вес мозга одомашненных форм был ниже, чем у их диких родственников (Kruska, 2005). Дитер Круска, который подробно анализировал этот вопрос, считает, что такое снижение веса мозга есть результат внутривидовой адаптации к особой экологической нише (то есть к условиям одомашнивания). Херре и Рорс (Herre, Röhrs, www.primitivism.com/domestic.htm) привели созданную Б. Гржимеком таблицу изменений морфологических показателей мозга у группы видов (со сравнением одомашненных и диких форм). Уменьшение веса мозга отмечено у всех проанализированных видов. У мыши, крысы, морской свинки, кролика, свиньи, овцы, ламы, хорька, кошки и собаки вес мозга был ниже, чем у диких сородичей с колебаниями от 8.1% (крыса) до 33.1% (свинья). Объем структур новой коры варьировал сходным образом. Очевидно, что при одомашнивании животных ряда видов отбор шел и на повышение мышечной массы и фертильности, а у некоторых видов – против агрессивности, как проявления страха человека, однако снижение веса мозга оказалось общим для них признаком. Интересно отметить, что в случаях возвращения одомашненных видов в дикую природу (это называют ферализацией, см. Röhrs, Ebinger, 1999) увеличения размера мозга не происходило.
Возможная роль внутривидовых вариаций размера мозга в популяции в сопоставлении с поведением, основанном на “пластических” его изменениях, исследована значительно менее подробно, чем для случаев доместикации.
Когнитивные тесты и поведение лабораторных грызунов
Прежде, чем рассматривать, существует ли (в пределах видовой изменчивости) ассоциация между размером мозга и “интеллектом” животных, следует более четко определить, что в настоящее время понимается под когнитивными способностями. В самом общем определении в это понятие включают все проявления пластичности поведения, включая разные формы условных рефлексов (то есть научение), а также феномены внимания и привыкания. В целях рассмотрения указанной выше проблемы мы рассматриваем “когнитивные способности” животных в более узком смысле – как способность к решению элементарных логических задач. Такими задачами могут быть формирование пространственной “карты” (Vorhees, Williams, 2014), и проявления элементарной рассудочной деятельности (Крушинский, 2018). Иными словами, речь идет не о формировании условно-рефлекторного ответа на определенные средовые сигналы, а о реакциях, в основе которых лежит формирование внутренних представлений о событиях и связях между ними.
По определению Л.В. Крушинского (2018), решение задачи на рассудочную деятельность требует от животного “улавливания” эмпирических законов, связывающих предметы и явления внешней среды. Речь идет о ситуациях, когда в эксперименте (а может быть и в жизни!) животное сталкивается с необходимостью решить элементарную логическую задачу, например, на экстраполяцию направления движения стимула, исчезнувшего из поля зрения животного (это был один из тестов, использованных в наших опытах).
Тест на экстраполяцию заключается в том, что (голодная) мышь помещается в пластиковую камеру и начинает пить через отверстие в середине одной из стенок. После начала питья поилка с молоком отодвигается вправо или влево и исчезает из поля зрения животного. Контрольная (невидимая мыши) поилка перемещается в противоположном направлении (для того, чтобы животное не могло отыскать пищу по запаху) (рис. 1а). Если мышь подошла к тому боковому отверстию, куда переместилось молоко, это считается правильным решением, если к противоположному отверстию – неправильным. Для решения этой задачи животное (например, крыса или мышь) должно обладать способностью: 1) понимать свойство “неисчезаемости” объекта (понимать, что исчезнувший из поля зрения предмет все-таки существует, и его можно искать); 2) оно должно понимать элементарное свойство движения – что предмет, начавший движение, будет продолжать двигаться даже будучи невидимым; 3) в ситуации решения теста на экстраполяцию животное должно также сохранить в рабочей памяти информацию о направлении, в котором исчезла пища; 4) реализовать адекватно ситуации уже имеющийся у него инструментальный навык отыскания возможного места, где пища может оказаться (в тесте с мышами – бокового отверстия камеры); 6) а также подавить врожденное стремление пойти в направлении, противоположном только что совершенной побежке (то есть не реализовать врожденную реакцию “спонтанного чередования”). В целом, лабораторные мыши и крысы решают тест на экстраполяцию на случайном уровне (доля правильных решений у них, как правило, не отличается от 50% случайного уровня), исключение составляют отдельные генетические группы (Перепелкина и др., 2013). Иными словами, такой когнитивной способности они, в целом, не обнаруживают (ее проявление можно увидеть только у некоторых генетических групп как крыс, так и мышей). Наиболее четким критерием решения этого теста является доля животных исследуемой группы, которые правильно его решили при первом предъявлении. В условиях первого столкновения с необходимостью решить данную элементарную логическую задачу животное, которое не имеет аналогичного предшествовавшего опыта, реализует (или не реализует) имеющуюся у него способность решить данный тест. Сложность адекватного решения теста для грызунов очевидна – она состоит в необходимости одновременного адаптивного выполнения нескольких различающихся по механизмам операций. В то же время врановые птицы и хищные млекопитающие решают ее достаточно успешно (Крушинский, 2018).
Рис. 1.
Тесты на когнитивные способности мышей. (а) – схема экспериментальной установки для тестирования у мышей способности к экстраполяции направления движения стимула (пищи), исчезнувшего из поля зрения (рис. авторов). 1 – центральное отверстие в непрозрачной передней стенке камеры, 2 – поилка с молоком, 3 – боковые отверстия, куда может переместиться поилка. (б) – схема экспериментальной установки для тестирования способности на поиск входа в укрытие. 1 – освещенная часть экспериментальной камеры, 2 – темная часть камеры, 3 – углубленный в пол лаз.
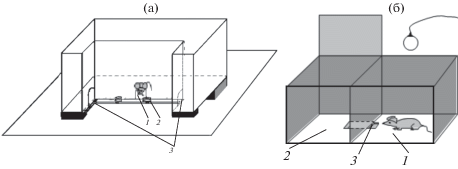
Тест на поиск входа в укрытие (в англоязычной литературе он называется puzzle-box, Galsworthy et al., 2005). В отличие от базирующегося на пищевой мотивации теста на экстраполяцию, данный тест основан на оборонительном поведении – стремлении животного спрятаться в темноте (рис. 1б). Мышь помещают в ярко освещенную часть камеры, в которой имеется углубленный в пол лаз, через который животное стремится попасть в более комфортное темное отделение. В тесте из 8 проб, пробы 1 и 2 – самые простые (как вариант опыта со светло-темной камерой), вход через лаз препятствий не имеет, в пробах с 3-ей по 5-ю лаз засыпают стружкой вровень с полом. Теперь, чтобы попасть в темную часть камеры мыши нужно разгрести стружку. В пробах 6 и 7 лаз закрывают легкой пробкой из пластика и картона, которую мышь может вытащить зубами или отодвинуть. В пробе 8 вся нижняя часть стенки камеры с лазом засыпана стружкой на высоту 5–7 см.
Этот тест выполняется успешно, если у животного существует способность к пониманию свойства (эмпирического закона, по Л.В. Крушинскому) “неисчезаемости” (object permanence). Данное понятие первым сформулировал французский психолог Ж. Пиаже, исследуя развитие интеллекта у маленьких детей (данные по этому тесту в экспериментах с птицами см. Zucca et al., 2007). Животное может (или не может!) “понять”, что ранее воспринимавшийся объект (в нашем случае – лаз в темный отсек камеры), который из-за маскировки более не виден, продолжает существовать, и его можно отыскать (схема опыта – на рис. 1). Для оценки успешности решения этого теста используют время (латентный период) перехода в темный отсек. Критерием решения с 1-й по 5-ю и 8-й проб было выполнение теста за 180 с, для проб 6 и 7 (с пробкой) – 240 с. Если животное за это условное время не перешло в темную часть камеры, считалось, что тест не решен. Еще одним критерием успешности решения теста группой животных является доля мышей, которые смогли решить очередную пробу теста.
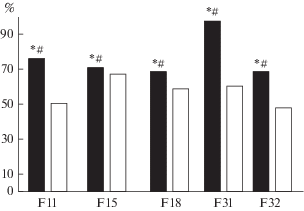
Рис. 2.
Решение теста на экстраполяцию направления движения стимула, исчезнувшего из поля зрения. Доли (%, ось ординат) правильных решений теста на экстраполяцию при его 1-м предъявлении у мышей БМ и ММ при проведении селекции (F11–19) и после прекращения селекции (F31–32). Обозначения: черные столбики – БМ, белые – ММ; * – достоверно отличается от показателя ММ, р < 0.05 и 0.001 соответственно; # – достоверно отличается от 50% случайного уровня (оценка разности альтернативных долей, метод φ по Фишеру).
Селекция мышей на разный вес мозга и поведение животных линий “Большой мозг” и “Малый мозг”
Генетический контроль веса мозга у лабораторных мышей методом искусственного отбора был впервые продемонстрирован, когда были выведены линии мышей с большим (БМ) и малым (ММ) относительным весом мозга, а также показана вариация этого признака в панели инбредных линий мышей. При этом обнаружилось, что мыши с большим весом мозга обучались более успешно (Fuller, 1979).
Уже в первые годы исследований элементарной рассудочной деятельности, встал вопрос о поиске путей анализа ее генетического контроля. Было проведено сравнение решения теста на экстраполяцию доместицированными (Институт цитологии и генетики РАН, Новосибирск) и дикими лисицами, а также лабораторными и дикими крысами (Крушинский, 2018). Еще одним путем такого анализа была селекция лабораторных мышей на большой и малый относительный вес мозга на основе генетически гетерогенной популяции – гибридов F4 инбредных линий C57BL6/J, C57BR/J, CBA/Lac-Sto, DBA/2J, BALB/c и А/Не. Подробный обзор данных по селекции мышей на большой и малый вес мозга был дан нами ранее (Перепелкина и др., 2013). Суммарно в нашей лаборатории было проведено три селекционных эксперимента с получением линий БМ и ММ, достоверно различавшихся и по относительному весу мозга, и по его абсолютным значениям. Процедура селекции на большой и малый относительный вес мозга была следующей. В возрасте 1.5 мес. у половины животных каждого помета после эвтаназии определяли вес мозга и тела. Индивидуальные показатели животных данного помета относительно линии регрессии, связывающей вес тела и вес мозга, были индикатором того, чтобы животных оставшейся половины помета брать для дальнейшего размножения (для ММ – если точки лежали ниже линии регрессии, для БМ – выше), либо отбраковать (Перепелкина и др., 2013).
Селекция мышей на разный вес мозга (практически во всех случаях) не только приводила к быстрому (в течение 3–4 поколений) расхождению линий по данному признаку, но и сопровождалась появлением различий в поведении (Перепелкина и др., 2013; Fuller, 1979). Уже по данным первого из наших селекционных экспериментов между мышами БМ- и ММ-линий были выявлены различия в способности к решению теста на экстраполяцию и в способности к формированию инструментального пищевого условного рефлекса с более успешным выполнением таких тестов мышами линий БМ. Хотя мыши, селектированные на большой вес мозга, решали тест на экстраполяцию более успешно, чем мыши с малым мозгом, такое превосходство обнаруживалось не во всех поколениях. Были показаны различия и в числе клеточных элементов, и в площади коры больших полушарий этих мышей – у мышей линий БМ область новой коры была на 22%, а старой – на 17% больше, чем у линий ММ (Попова и др., 1983). Более успешное усвоение условно-рефлекторного навыка у мышей с большим весом мозга обнаруживалась как в случае пищедобывательной реакции (как и в опытах Дж. Фуллера), так и при избегании удара электрического тока. В наших экспериментах были выявлены различия между линиями БМ и ММ в исследовательском поведении (Salimov et al., 2004), стресс-реактивности и уровне тревожности, при этом повышенная стресс-реактивность и тревожность были обнаружены у мышей ММ-линий (Маркина и др., 1999).
Когда в третьем селекционном эксперименте на большой и малый относительный вес мозга было получено 22 поколение (рис. 2), было решено продолжить эксперимент в измененной форме – разводить далее мышей линий БМ и ММ как отдельные линии без поддерживающей селекции.
Оценка веса мозга мышей линий БМ и ММ в последовательных поколениях после прекращения селекции показала сохранение такого же уровня межлинейных различий по этому признаку, как это было и при процедуре селекции, с отсутствием (во многих случаях) различий по весу тела (табл. 1).
Таблица 1.
Показатели веса мозга и тела мышей в отдельных поколениях 3-го селекционного эксперимента (селекция мышей на большой и малый относительный вес мозга)
| Поколение | Линия | n | Вес тела, г | p ≤ # | Вес мозга, мг | p ≤ # | Индекс* | р |
|---|---|---|---|---|---|---|---|---|
| F5 | БМ | 54 | 22.06 ± 0.26 | p > 0.05 | 438 ± 3.86 | p > 0.05 | 19.85 | p < 0.05 |
| ММ | 30 | 22.03 ± 0.34 | 426.4 ± 4.7 | 19.35 | ||||
| F10 | БМ | 36 | 24.68 ± 0.66 | p > 0.05 | 472.9 ± 4.2 | p < 0.001 | 19.14 | p < 0.001 |
| ММ | 25 | 25.41 ± 0.82 | 424.7 ± 5.1 | 16.72 | ||||
| F19 | БМ | 44 | 26.3 ± 0.5 | p < 0.001 | 504.1 ± 5.3 | p < 0.001 | 19.17 | p < 0.01 |
| ММ | 36 | 23.2 ± 0.6 | 409.3 ± 3.6 | 17.64 | ||||
| F22 | БМ | 23 | 21.1 ± 0.5 | p < 0.001 | 481.9 ± 5.8 | p < 0.001 | 22.84 | p > 0.05 |
| ММ | 22 | 17.3 ± 0.4 | 400.5 ± 3.5 | 23.15 | ||||
| F25 | БМ | 28 | 28.4 ± 1.1 | p > 0.05 | 490.2 ± 5.9 | p < 0.001 | 17.26 | p < 0.001 |
| ММ | 34 | 28.3 ± 0.8 | 402.1 ± 3.9 | 14.21 | ||||
| F31 | БМ | 27 | 29.96 ± 0.5 | p > 0.05 | 473.7 ± 5.5 | p < 0.001 | 15.81 | p < 0.001 |
| ММ | 21 | 30.6 ± 0.6 | 420.3 ± 6.2 | 13.73 | ||||
| F34 | БМ | 19 | 27.4 ± 0.4 | p > 0.05 | 461.7 ± 4.3 | p < 0.001 | 17.0 | p < 0.001 |
| ММ | 26 | 28.2 ± 0.4 | 424.4 ± 3.7 | 15.2 | ||||
| F36 | БМ | 27 | 29.4 ± 0.4 | p > 0.05 | 499.5 ± 2.7 | p < 0.001 | 17.32 | p < 0.001 |
| ММ | 29 | 29.9 ± 0.4 | 446.9 ± 2.6 | 15.30 |
Примечание: n – число животных в группе; * – отношение веса мозга (мг) к весу тела (г); достоверность различий оценивали с помощью однофакторного ANOVA c использованием post hoc критерия LSD Фишера; # – достоверность различий оценивали с помощью непараметрического критерия. Здесь и в табл. 2.
Далее проводилась оценка сохранения обнаруженных ранее различий в поведении между БМ- и ММ-линий в отсутствии селекции. Так, например, в F28 (6-е поколение разведения без селекции) оценивали межлинейные различия в исследовательской реакции после в.бр. введения этанола (2.4 мг/кг). У мышей линий ММ этанол вызвал замедление обследования новой среды, тогда как у линий БМ этого эффекта не было (Perepelkina et al., 2013). Следует отметить, что подобный эксперимент проводили с мышами БМ- и ММ-линий при проведении второго селекционного эксперимента, и различия между линиями имели такой же характер (Markina et al., 2001). Это может быть свидетельством устойчивости связанных с весом мозга различий в реакции на этанол. При разведении мышей линий БМ и ММ без селекции эти различия также обнаружились.
Выполнение теста на поиск входа в укрытие мышами БМ- и ММ-линий также различалось. Это было показано как в ходе селекции, так и после ее прекращения. Мыши линий БМ решали данный тест достоверно более успешно, чем ММ в F37 и 38 (то есть в 15-м и 16-м поколениях, размножавшихся без селекции) (рис. 3).
Рис. 3.
Решение теста на поиск входа в укрытие мышами БМ и ММ. Доли мышей (%, ось ординат) БМ и ММ, решивших последовательные 8 проб (ось абсцисс) теста в поколениях F37 (слева) и F38 (справа). Обозначения, как на рис. 2. *, **, *** – достоверно отличается от соответствующей доли мышей ММ при р < 0.05, 0.01 и 0.001 соответственно (оценка разности альтернативных долей, метод φ по Фишеру).

Следует отметить особенности выполнения мышами теста на поиск входа в укрытие. В первых двух пробах (когда лаз открыт для перехода в темную часть камеры) помещенные в камеру мыши сразу же начинают ее обследовать и достаточно быстро находят лаз. Отметим, что у многих мышей (обеих линий) боязнь освещенной камеры выражена достаточно слабо, и они не сразу убегают в темноту. Однако в пробах, когда лаз замаскирован, первая реакция практически всех мышей – реакция замирания, которая обычно длится несколько секунд и часто сменяется реакцией умывания–чистки шерсти (груминга). Это означает, что мышь мгновенно замечает изменение состояния лаза. Иное дело, как такое животное ведет себя дальше. Некоторые мыши после ряда подходов к закрытому лазу (а иногда и сразу) раскапывают стружку и уходят в темноту, но у многих животных этот процесс может занять почти все время теста, а многие – не решают тест вовсе (не переходят в темноту за 180 с). Интересно отметить, что подобное “фотографирование” мышью изменения обстановки (и оценка потенциальной возможности уйти в темноту) остается у животного в памяти (в “скрытом” виде). Нередко оказывается, что при приближении руки экспериментатора для изъятия мыши из камеры (в конце пробы), она стремительно и “без колебаний” убегает в темноту, интенсивно раскапывая маскирующую лаз стружку.
Как видно из рис. 3, в F37 (16-е поколение после прекращения селекции) мыши БМ-линий достоверно быстрее перебегали в темноту, чем мыши ММ-линий, даже в пробах с открытым лазом. Однако в дальнейшем, при следующих пробах теста они действовали достоверно быстрее только в пробе 6 (когда лаз нужно было открыть, вытащив или отодвинув легкую пробку). Причина сходства средних величин времени попадания в темноту у двух групп заключается в описанном выше поведении мышей БМ-линий, которые не раскапывают лаз и не вынимают пробку, пока не увидят руку экспериментатора (которая, как можно полагать, для них представляет бóльшую угрозу, нежели пребывание в освещенной части камеры). Это предположение подтверждается тем, что доли мышей, успешно решивших тест в последовательных пробах, были достоверно выше у линии БМ, в том числе и в пробах, имеющих “когнитивный” компонент, то есть в случаях, когда надо было найти ход в темноту при замаскированном лазе (рис. 3).
Селекция мышей на высокие показатели решения теста на экстраполяцию
Вывод о роли веса мозга в выполнении когнитивного теста получил в наших исследованиях неожиданное подтверждение. В 2008 г. был начат селекционный эксперимент по отбору мышей на высокие показатели теста на экстраполяцию. Критериями отбора (формирование пар для следующего поколения) были: 1) правильное решение теста при его первом предъявлении, 2) 5 или 6 правильных решений теста из 6 его предъявлений, 3) отсутствие выраженной боязни обстановки опыта. Поведение мышей селектируемой линии (ЭКС) сопоставляли с таковым мышей-потомков исходной гетерогенной популяции (КоЭКС), разводившейся без отбора и служившей контролем. В тесте на экстраполяцию тревожность животного проявляется в виде “отказов” от решения (мышь не подходит к центральному отверстию) и “нулевых” решениях (в течение 120 с мышь не подходит к боковому отверстию). В начальных поколениях этого эксперимента (до F8) мыши ЭКС в целом были способны к решению теста на экстраполяцию (правильных решений у них было достоверно больше 50%) и были, в целом, более успешны, чем мыши неселектированной популяции – у мышей КоЭКС показатели были менее стабильными (Перепелкина и др., 2011). Отбор против проявлений тревожности (как одного из критериев данного селекционного эксперимента) в этом тесте, снизил показатели тревожности, что проявилось в виде снижения тревожности в “специализированном” для оценки тревожности тесте – приподнятого крестообразного лабиринта (ПКЛ) (Перепелкина и др., 2018).
Однако далее, в последующих поколениях (после F8–F9), мыши ЭКС не демонстрировали устойчивого превышения уровня правильных решений над случайным, и в этом аспекте они почти не отличались от мышей контрольной популяции (Перепелкина и др., 2015, 2018).
Начиная с 9-го поколения селекции мышей ЭКС и КоЭКС начали тестировать в экспериментах на поиск входа в укрытие (Perepelkina et al., 2013). В этом тесте мыши ЭКС обнаруживали устойчивое превосходство на животными контрольной популяции. Доли мышей, способных решать наиболее сложные пробы этого теста (когда лаз закрыт пробкой) были достоверно выше долей таких животных в контрольной популяции (рис. 4).
Рис. 4.
Решение мышами ЭКС и КоЭКС (20-е поколение селекции) теста на поиск входа в укрытие. (а) – время решения последовательных проб теста (с, ось ординат); ЭКС – черные ромбы, КоЭКС – серые квадраты,** – достоверно отличается от показателя КоЭКС при p < 0.01 (однофакторный ANOVA с post hoc LSD тестом по Фишеру); (б) – доли мышей F20 (%, ось ординат), решивших последовательные этапы данного теста. ЭКС (черные столбики) и КоЭКС (серые столбики). *** – достоверно отличается от доли мышей КоЭКС при p < 0.001 (оценка разности альтернативных долей, метод ȹ по Фишеру).
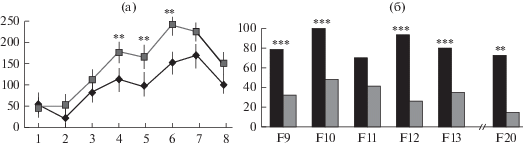
Таким образом, мыши ЭКС решают тест более успешно, чем мыши КоЭКС. Это можно было бы объяснить их более высокой тревожностью (поскольку в более поздних поколениях селекции различия по этому признаку стали неустойчивыми, а в ряде поколений тревожность мышей ЭКС была выше таковой у контроля. Однако оказывалось, что мыши ЭКС, попав в темное отделение камеры, достаточно быстро стремятся вернуться в освещенную часть установки (данные не представлены), а это не согласуется с более выраженной тревожностью ЭКС (по показателям теста ПКЛ) (Перепелкина и др., 2018).
В специальных экспериментах (рис. 5), когда сравнивали реакцию мышей ЭКС и КоЭКС на новую пищу (Голибродо и др., 2014) или на новый предмет (данные не представлены), у мышей ЭКС была выявлена более четкая исследовательская реакция на новое, а не боязнь (как у КоЭКС) новых элементов среды. У мышей ЭКС также была четко выражена реакция на руку экспериментатора, когда мышь вынимали из установки, подобно тому, как это наблюдалось у мышей, селектированных на большой вес мозга (описано выше).
Рис. 5.
Решение теста на новизну (новая пища в новой обстановке) у мышей ЭКС и КоЭКС. Число подходов к новой пище (ось ординат) у мышей ряда поколений селекции. Обозначения, как на рис. 2. **, *** – достоверно отличается от показателей КоЭКС, р < 0.01 и 0.001 соответственно (однофакторный ANOVA с post hoc LSD по Фишеру, Голибродо и др., 2014).

Ввиду особого внимания, которое в наших экспериментах уделялось такому показателю, как вес мозга, его начали определять и у мышей ЭКС и КоЭКС уже с ранних этапов селекции. Оказалось, что на протяжении всего селекционного эксперимента вес мозга мышей, селектированных на когнитивный признак, был достаточно устойчиво выше, чем у мышей контрольной популяции (табл. 2).
Таблица 2.
Вес тела, вес мозга и отношение веса мозга (мг)/вес тела (г) у мышей ЭКС и КоЭКС в ряде поколений селекционного эксперимента
| Поколение | Группа | n | Вес тела | p# | Вес мозга | p# | Индекс* | р |
|---|---|---|---|---|---|---|---|---|
| F2 | ЭКС | 54 | 29.7 ± 0.6 | p > 0.05 | 499.4 ± 2.4 | p < 0.001 | 17.1 | p > 0.05 |
| КоЭКС | 23 | 30.2 ± 0.9 | 476.2 ± 6.01 | 16.2 | ||||
| F4 | ЭКС | 36 | 31.1 ± 0.8 | p > 0.05 | 513.2 ± 5.2 | p > 0.05 | 16.4 | p > 0.05 |
| КоЭКС | 24 | 31.7 ± 0.6 | 499.9 ± 6/2 | 16 | ||||
| F6 | ЭКС | 16 | 36.9 ± 0.5 | p > 0.05 | 518.6 ± 4.8 | p < 0.001 | 14.1 | p < 0.01 |
| КоЭКС | 17 | 32.1 ± 0.5 | 491.9 ± 5.9 | 13.0 | ||||
| F9 | ЭКС | 39 | 32.1 | p < 0.01 | 492.3 ± 4.0 | p > 0.05 | 15.6 | p < 0.001 |
| КоЭКС | 35 | 38.1 | 503 ± 9.0 | 13.7 | ||||
| F10 | ЭКС | 21 | 30.7 ± 0.8 | p > 0.05 | 498.7 ± 6.6 | p < 0.001 | 16.24 | p < 0.001 |
| КоЭКС | 40 | 30.5 ± 0.5 | 526.6 ± 4.4 | 12.3 | ||||
| F11 | ЭКС | 29 | 30.4 ± 0.5 | p < 0.01 | 482.7 ± 5.3 | p < 0.001 | 16.3 | p > 0.05 |
| КоЭКС | 26 | 32.6 ± 0.6 | 512.3 ± 5.6 | 15 | ||||
| F12 | ЭКС | 94 | 29.3 ± 0.3 | p < 0.001 | 485.8 ± 3.1 | p < 0.001 | 16.7 | p < 0.01 |
| КоЭКС | 81 | 33.1 ± 0.34 | 543.9 ± 3.4 | 16.4 | ||||
| F14 | ЭКС | 119 | 31.1 ± 0.28 | p < 0.001 | 500.6 ± 2.8 | p < 0.001 | 16.3 | p < 0.001 |
| КоЭКС | 80 | 34.8 ± 0.37 | 535.8 ± 3.7 | 15.0 | ||||
| F15 | ЭКС | 65 | 31.7 ± 0.35 | p < 0.001 | 507.0 ± 3.1 | p < 0.01 | 16.3 | p < 0.001 |
| КоЭКС | 50 | 33.6 ± 0.45 | 521.5 ± 4.0 | 14.9 | ||||
| F16 | ЭКС | 68 | 33.8 ± 0.34 | p > 0.05 | 513.8 ± 3.4 | p > 0.05 | 15.5 | p > 0.05 |
| КоЭКС | 42 | 34.7 ± 0.48 | 518.5 ± 4.6 | 14.5 | ||||
| F17 | ЭКС | 81 | 30.95 ± 0.29 | p > 0.05 | 507.5 ± 2.6 | p > 0.05 | 16.7 | p > 0.05 |
| КоЭКС | 76 | 32.79 ± 0.3 | 514.1 ± 2.7 | 15.9 | ||||
| F19 | ЭКС | 69 | 32.3 ± 0.6 | p < 0.001 | 516.1 ± 2.64 | p < 0.001 | 16.24 | p > 0.05 |
| КоЭКС | 59 | 32.3 ± 0.6 | 532.9 ± 2.8 | 15.45 |
Таким образом, в независимых селекционных экспериментах было получено достаточно четко выраженное совпадение данных. Селекция на большой и малый относительный вес мозга (создание линий БМ и ММ) привела к появлению преимущества мышей БМ-линий в решении когнитивных тестов (в тестах на экстраполяцию и на поиск входа в укрытие). Одновременно с этим селекция на когнитивный признак (успешная в плане решения мышами теста на поиск входа в укрытие, но не по показателям теста на экстраполяцию) привела к появлению различий в весе мозга с более высокими его величинами у мышей ЭКС. Эти данные позволяют говорить о существовании связи между способностью к решению когнитивных тестов и увеличенным размером мозга, продемонстрированной на уровне популяций лабораторной мыши.
Такое серьезное средовое воздействие, как содержание мышей ЭКС и КоЭКС в “обогащенных” условиях среды, вызвало при последующем тестировании общую активацию поведения, усиление реакции на новизну и увеличение веса мозга, более четко выраженную у мышей ЭКС (Тарасова и др., 2018). Проведенный ранее сходный опыт по “обогащению среды” с мышами БМ- и ММ-линий (во время 2-го селекционного эксперимента) также выявил более сильно выраженные изменения поведения мышей линий БМ, однако влияния обогащенных условий на вес мозга обнаружено не было (Перепелкина и др., 2006). Показано (Kempermann et al., 2010), что наиболее важным компонентом активирующего влияния обогащенных условий содержания на нейрогенез взрослого мозга является “упражнение движений”, то есть бег животных в колесах активности. Продемонстрировано также, что именно бег в колесах является, по данным МРТ мозга мыши, решающим фактором в увеличении объема серого вещества поля СА3 гиппокампа в условиях питания животных высококалорийной пищей (Sack et al., 2017). Можно предположить, что увеличенный объем мозга, созданный путем селекции (как на вес мозга, так и на выраженность когнитивного признака), связан с реализацией более активного поведения при решении когнитивных задач. Иными словами, активация таких феноменов, как внимание (при исследовании среды) и способность преодолеть осторожность при обследовании новых компонентов (а возможно их комбинированное проявление) может быть основой для проявления способности к решению элементарных логических задач, то есть выполнения адекватных сложившейся обстановке действий, которые животное ранее не выполняло, так как не имело соответствующего опыта.
Генетические исследования, связанные с различиями в весе мозга, выполняются в настоящее время, в частности, с помощью метода “quantitative trait loci”, – метода, основанного на ассоциации уровня выраженности выбранного количественного признака с молекулярными “маркерами”, для которых известна их локализация на хромосомах. Используя этот метод, удалось показать, что на вес мозга мыши влияют гены на хромосомах 11, 15, 16 и 19 (Peirce et al., 2003). С другой стороны, существуют многочисленные данные, показывающие роль отдельных элементов сигнальных путей в клетках и межклеточной среде мозга, в их влиянии на когнитивное поведение. Примером такого исследования может быть демонстрация участия сигнальной системы TNF (tumor necrosis factor) в реализации когнитивного поведения (Morgan et al., 2018). Следует, однако, отметить, что выявление участия отдельных генетических элементов в реализации поведения, еще не может означать важности для поведения (и конкретных когнитивных его аспектов, в частности) соответствующих сигнальных каскадов. В настоящее время в подобных исследованиях недооценивается возможное общее нарушение адекватности поведения и, соответственно, усиления, например, тревожности животного. Возможно, что дисбаланс в работе мозга, вызванный генно-инженерными вмешательствами, может снизить общую способность организма к адаптации, а изменения в поведении могут рассматриваться как неспецифические феномены (Edgar et al., 2011; Ng et al., 2016; Kaitsuka et al., 2018), поскольку не связаны с реализацией реакций “когнитивного спектра”.
На уровне нейрофизиологического анализа поведения исследователи начинают использовать заимствованное из психологии понятие об “исполнительных функциях”. Оно включает в себя активное использование имеющихся у субъекта знаний и навыков для достижения адаптивного результата (Ben Abdallah et al., 2011; Marquardt et al., 2014).
В настоящее время имеется очень большая база данных по участию отдельных генетических элементов в реализации когнитивных способностей мыши, в том числе способности к пространственной ориентации в водном лабиринте Морриса. Такие исследования выполнены преимущественно с использованием генетически измененных животных (в том числе нокаутов по ряду генов) (Wolfer, Lipp, 1996; Malleret et al., 1999; Gerlai, 2001; Kirchner et al., 2004; Curzon et al., 2006; Ren et al., 2007 и др.), а также при сравнении поведения мышей ряда инбредных линий (Holmes et al., 2002; Wahlsten et al., 2005; Moy et al., 2007). В настоящее время, несмотря на большой интерес современных нейробиологов к генетическим основам когнитивного поведения, искусственного отбора на высокие и низкие показатели решения теста Морриса или теста “радиального лабиринта” не проводилось. В то же время оценка коррелятивных связей между выполнением разных тестов, в том числе адресованных когнитивным способностям, успешно проводилась (Bushnell et al., 1995, Plusnina et al., 2008), но такие показатели, как способность к решению элементарных логических задач и вес мозга в этих исследованиях практически не используются.
ЗАКЛЮЧЕНИЕ
В целом можно заключить, что в популяциях лабораторных мышей есть определенная доля особей, которые способны решать тест на экстраполяцию (на предвидение нового положения искомого стимула), и решать тест на “неисчезаемость” (понимание этого правила необходимо и для успешного решения теста на экстраполяцию). Искусственный отбор на способность к решению теста на экстраполяцию, в целом был неудачен – повышения доли мышей, способных к решению этого теста, в ходе селекции не произошло. Однако такой отбор оказался успешным в том отношении, что в селектированной линии оказалось больше животных, способных “понимать” принцип неисчезаемости. Селекция мышей на большой и малый вес мозга выявила более высокие когнитивные способности мышей линии БМ, что выразилось наиболее четко в их достоверно более высокой способности к решению теста на неисчезаемость. Это влияние отбора и на когнитивный признак, и на морфологический признак – вес мозга, успешно, на наш взгляд, дополняется тем, что у мышей, селектированных на когнитивный признак, вес мозга – больше.
Связь веса мозга c более успешным выполнением адаптивных реакций обнаруживается и у животных других видов. Так, например, селекция рыбок гуппи (Poecilia reticulata) на большой и малый относительный вес мозга сопровождалась появлением различий в поведении. У рыбок, селектированных на большой вес мозга, была выше подвижность, повышена исследовательская активность и быстрота формирования условно-рефлекторной дифференцировки (Kotrschal et al., 2013). Исследование подобного соотношения у млекопитающих ряда видов показало, что адаптация к новым средовым условиям была более успешной у видов с большей величиной отношения (индекса) вес мозга/вес тела (Sol et al., 2008). Такой же результат был получен при сопоставлении данного индекса в пределах отряда воробьиных в аспекте способности их адаптации к жизни в условиях города (Maklakov et al., 2011).
Таким образом, как данные литературы, так и результаты наших экспериментов свидетельствуют, что увеличенный вес мозга оказывается фактором, который позитивно влиияет на проявление адаптивных способностей животных, в частности, в аспекте когнитивного поведения.
Список литературы
Голибродо В.А., Перепелкина О.В., Лильп И.Г. и др. Поведение мышей, селектированных на когнитивный признак, в тесте на гипонеофагию // Журн. высш. нерв. деят. 2014. Т. 64. № 6. С. 639–645.
Крушинский Л.В. Биологические основы элементарной рассудочной деятельности. 4 изд. М.: УРСС, 2018. 272 с.
Маркина Н.В., Попова Н.В., Салимов Р.М. и др. Сравнение уровней тревожности и стресс-реактивности у мышей, селектированных на большой и малый вес мозга // Журн. высш. нерв. деят. 1999. Т. 49. С. 789–798.
Перепелкина О.В., Голибродо В.А., Лильп И.Г. и др. Селекция мышей на высокие показатели решения элементарной логической задачи // ДАН. 2015. Т. 460. С. 52–56. https://doi.org/10.1134/S0012496615010159
Перепелкина О.В., Лильп И.Г., Маркина Н.В. и др. Cелекция мышей на большой и малый вес мозга / Формирование поведения животных в норме и патологии. 50 лет спустя. К 100-летию Л.В. Крушинского. 2013. Языки славянской культуры. С. 263–296.
Перепелкина О.В., Маркина Н.В., Голибродо В.А. и др. Селекция мышей на высокий уровень способности к экстраполяции при низком уровне тревожности // Журн. высш. нерв. деят. 2011. Т. 61. С. 742–749.
Перепелкина О.В., Маркина Н.В., Полетаева И.И. Способность к экстраполяции направления движения у мышей, селектированных на большой и малый вес мозга: влияние обогащения условий среды // Журн. высш. нерв. деят. 2006. Т. 56. С. 282–286.
Перепелкина О.В., Тарасова А.Ю., Голибродо В.А. и др. Поведение мышей, селектированных на высокие значения когнитивного признака // Журн. высш. нерв. деят. 2018. Т. 68. С. 434–447.
Попова Н.В., Кесарев В.С., Полетаева И.И. и др. Цитоархитектоника коры головного мозга мышей, селектированных на большой и малый вес мозга // Вестн. МГУ. 1983. Сер. 16. Биология. Т. 6. С. 30–34.
Тарасова А.Ю., Перепелкина О.В., Лильп И.Г. и др. Влияние “обогащения среды” на поведение и нейрогенез у мышей, селектированных на когнитивный признак // Бюл. эксп. биол. мед. 2018. Т. 64. С. 583–586.
Ben Abdallah N. M., Fuss J., Trusel M. et al. The puzzle box as a simple and efficient behavioral test for exploring impairments of general cognition and executive functions in mouse models of schizophrenia // Exp. Neurol. 2011. V. 227 (1). P. 42–52. https://doi.org/10.1016/j.expneurol.2010.09.008
Bond J., Roberts E., Springell K. et al. A centrosomal mechanism involving CDK5RAP2 and CENPJ controls brain size // Nat. Genet. 2005. V. 37. P. 353–355.
Bushnell P.J., Levin E.D., Overstreet D.H. Spatial working and reference memory in rats bred for autonomic sensitivity to cholinergic stimulation: acquisition, accuracy, speed, and effects of cholinergic drugs // Neurobiol. Learn. Mem. 1995. V. 63. P. 116–132.
Castillo-Morales A., Monzón-Sandoval J., Urrutia A.O. et al. Increased brain size in mammals is associated with size variations in gene families with cell signalling, chemotaxis and immune-related functions // Proc. Biol. Sci. 2013. V. 281 (1775). P. 20132428.https://doi.org/10.1098/rspb.2013.2428
Curzon P., Anderson D., Nikkel A.L. et al. Antisense knockdown of the rat alpha7 nicotinic acetylcholine receptor produces spatial memory impairment // Neurosci. Lett. 2006. V. 410. P. 15–19.
de Winter W., Oxnard C.E. Evolutionary radiations and convergences in the structural organization of mammalian brains // Nature. 2001. V. 409. P. 710–714.
Edgar N.M., Touma.C., Palme R. et al. Resilient emotionality and molecular compensation in mice lacking the oligodendrocyte-specific gene Cnp1 // Transl. Psychiat. 2011. Sep 20. V. 1. P. e42. https://doi.org/10.1038/tp.2011.40
Fuller J.L. Fuller BWS lines: history and results // Eds V.E. Hahn, C. Jensen, B.S. Dudek. Development and evolution of brain size. N.Y.: Academic Press, 1979. P. 518–539.
Gerlai R. Behavioral tests of hippocampal function: simple paradigms complex problems // Behav. Brain Res. 2001. V. 125. P. 269–277.
Herculano-Houzel S. Encephalization, neuronal excess, and neuronal index in rodents // Anat. Rec (Hoboken). 2007. V. 290. P. 1280–1287.
Herculano-Houzel S. Brains matter, bodies maybe not: the case for examining neuron numbers irrespective of body size // Ann. N.Y. Acad. Sci. 2011. V. 1225. P. 191–199.https://doi.org/10.1111/j.1749-6632.2011.05976.x
Herre W., Rohrs M. Domestic animals and behavior. www.primitivism.com/domestic.htm
Holmes A., Wrenn C.C., Harris A.P. et al. Behavioral profiles of inbred strains on novel olfactory, spatial and emotional tests for reference memory in mice // Genes Brain Behav. 2002. V. 1. P. 55–69.
Jerison H.J. Animal intelligence as encephalization // Philos. Trans. R. Soc. Lond. B Biol. Sci. 1985. V. 308. P. 21–35.
Kaitsuka T., Kiyonari H., Shiraishi A. et al. Deletion of long isoform of eukaryotic elongation factor 1bδ leads to audiogenic seizures and aversive stimulus-induced long-lasting activity suppression in mice // Front. Mol. Neurosci. 2018. V. 11. P. 358.https://doi.org/10.3389/fnmol.2018.00358
Kempermann G., Fabel K., Ehninger D. et al. Why and how physical activity promotes experience-induced brain plasticity // Front. Neurosci. 2010. V. 4. P. 189.https://doi.org/10.3389/fnins.2010.00189
Kirchner L., Weitzdoerfer R., Hoeger H. et al. Impaired cognitive performance in neuronal nitric oxide synthase knockout mice is associated with hippocampal protein derangements // Nitric Oxide. 2004. V. 11. P. 316–330.
Kotrschal A., Lievens E.J.P., Dahlbom J. et al. Artificial selection on relative brain size reveals a positive genetic correlation between brain size and proactive personality in the guppy // Evolution. 2013. V. 68. P. 1139–1149.
Kruska D.C. On the evolutionary significance of encephalization in some eutherian mammals: effects of adaptive radiation, domestication, and feralization // Brain Behav. Evol. 2005. V. 65. P. 73–108.
Maklakov A.A., Immler S., Gonzalez-Voyer A. et al. Brains and the city: big-brained passerine birds succeed in urban environments // Biol. Lett. 2011. V. 7. P. 730–732.
Malleret G., Hen R., Guillou J.L. et al. 5-HT1B receptor knock-out mice exhibit increased exploratory activity and enhanced spatial memory performance in the Morris water maze // J. Neurosci. 1999. V. 19. P. 6157–6168.
Markina N.V., Salimov R.M., Poletaeva I.I. Behavioral screening of two mouse lines selected for different brain weight // Prog. Neuropsychopharmacol. Biol. Psych. 2001. V. 25. P. 1083–1109.
Marquardt K., Sigdel R., Caldwell K. et al. Prenatal ethanol exposure impairs executive function in mice into adulthood // Alcohol. Clin. Exp. Res. 2014. V. 38(12). P. 2962–2968.https://doi.org/10.1111/acer.12577
McGowen M.R., Montgomery S.H., Clark C. et al. Phylogeny and adaptive evolution of the brain-development gene microcephalin (MCPH1) in cetaceans // BMC Evol. Biol. 2011. V. 14. P. 98. https://doi.org/10.1186/1471-2148-11-98
Morgan J.A., Singhal G., Corrigan F. et al. TNF signalling via the TNF receptors mediates the effects of exercise on cognition-like behaviours // Behav. Brain Res. 2018. V. 353. 74–82. https://doi.org/10.1016/j.bbr.2018.06.036
Moy S.S, Nadler J.J., Young N.B. et al. Mouse behavioral tasks relevant to autism: phenotypes of 10 inbred strains // Behav. Brain Res. 2007. V. 176. P. 4–20.
Ng R.C., Cheng O.Y., Jian M. et al. Chronic adiponectin deficiency leads to Alzheimer’s disease-like cognitive impairments and pathologies through AMPK inactivation and cerebral insulin resistance in aged mice // Mol. Neurodegener. 2016. V. 11. № 1. P. 71–86.
Peirce J.L., Chesler E.J., Williams R.W. et al. Genetic architecture of the mouse hippocampus: identification of gene loci with selective regional effects // Genes, Brain and Behavior. 2003. P. 238–252.
Perepelkina O.V., Golibrodo V.A., Lil’p I.G. et al. Mice selected for large and small brain weight: The preservation of trait differences after the selection was discontinued // Adv. Biosci. Biotechn. 2013. V. 4. P. 1–8 ABB https://doi.org/10.4236/abb.2013.46A001 http://www.scirp.org/journal/abb/.
Plyusnina I.Z, Shchepina O.A., Os’kina I.N. et al. Some features of learning in the Morris water test in rats selected for responses to humans // Neurosci. Behav. Physiol. 2008. V. 38. P. 511–516. https://doi.org/10.1007/s11055-008-9010-9
Poletaeva I.I., Zorina Z.A. A genetic approach to the study of simple cognitive abilities in animals // Russ. J. Cogn. Sci. 2014. V. 1. P. 31–55.
Ren K., Thinschmidt J., Liu J. et al. α7 Nicotinic receptor gene delivery into mouse hippocampal neurons leads to functional receptor expression, improved spatial memory-related performance, and tau hyperphosphorylation // Neurosci. 2007. V. 145. P. 314–322.
Röhrs M., Ebinger P. Wild is not really wild: brain weight of wild domestic mammals // Berl. Munch. Tierarztl. Wochenschr. 1999. V. 112. P. 234–238.
Sack M., Lenz J.N., Jakovcevski M. et al. Early effects of a high-caloric diet and physical exercise on brain volumetry and behavior: a combined MRI and histology study in mice // Brain Imag. Behav. 2017. V. 11 (5). P. 1385–1396. https://doi.org/10.1007/s11682-016-9638-y
Salimov R.M., Markina N.V, Perepelkina O.V. et al. Exploratory behavior of F2 crosses of mouse lines selected for different brain weight: a multivariate analysis // Prog. Neuropsychopharmacol. Biol. Psych. 2004. V. 28. P. 583–589.
Sol D., Bacher S., Reader S.M. et al. Brain size predicts the success of mammal species introduced into novel environments // Am. Nat. 2008. V. 172. Suppl. 1. P. 63–71.https://doi.org/10.1086/588304
Sugiyama N., Andersson S., Lathe R. et al. Abnormally large, heavy brain with a decreased number of apoptotic cells in CYP7B1 knockout mice // Mol. Psychiat. 2009. V. 117. P. 1349. www.nature.com/mp.
Tang B.L. Molecular genetic determinants of human brain size // Biochem. Biophys. Res. Commun. 2006. V. 345. P. 911–916.
Villanea F.A., Perry G.H., Gutiérrez-Espeleta G.A. et al. ASPM and the evolution of cerebral cortical size in a community of New World monkeys // PLoS One. 2012. V. 7. P. e44928. https://doi.org/10.1371/journal.pone.0044928
Vorhees C.V., Williams M.T. Assessing spatial learning and memory in rodents // ILAR J. 2014. V. 55. P. 310–332. https://doi.org/10.1093/ilar/ilu013
Wahlsten D., Cooper S.F., Crabbe J.C. Different rankings of inbred mouse strains on the Morris maze and a refined 4-arm water escape task // Behav. Brain Res. 2005. Nov. 30. V. 165 (1). P. 36–51.
Wolfer D.P, Lipp H.-P. Dissecting the behaviour of transgenic mice: is it the mutation, the genetic background, or the environment? // Exp. Physiol. 2000. V. 85. P. 627–634.
Yu T.W., Mochida G.H., Tischfield D.J. et al. Mutations in WDR62, encoding a centrosome-associated protein, cause microcephaly with simplified gyri and abnormal cortical architecture // Nat. Genet. 2010. V. 42. P. 1015–1020. https://doi.org/10.1038/ng.683
Zucca P., Milos N., Vallortigara G. Piagetian object permanence and its development in Eurasian jays (Garrulus glandarius) // Anim. Cogn. 2007. V. 10. P. 243–258.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


