Успехи современной биологии, 2019, T. 139, № 6, стр. 553-561
Роль лизин- и аргининсодержащих глипролинов в восстановлении функционального состояния системы гемостаза при экспериментальном метаболическом синдроме
Л. А. Ляпина 1, *, М. Е. Григорьева 1, Н. Ф. Мясоедов 2, Т. А. Шубина 1, Т. Ю. Оберган 1, Л. А. Андреева 2
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
Москва, Россия
2 Институт молекулярной генетики РАН
Москва, Россия
* E-mail: lyapinal@mail.ru
Поступила в редакцию 19.06.2019
После доработки 19.06.2019
Принята к публикации 19.06.2019
Аннотация
Изучено регуляторное влияние пептидов глипролинового ряда, включающих аминокислоты аргинин и лизин – Lys-Lys-Arg-Arg-Pro-Gly-Pro (KKRRPGP), Arg-Lys-Lys-Arg-Pro-Gly-Pro (RKKRPGP) и Lys-Arg-Lys-Pro-Gly-Pro (KRKPGP), на состояние первичного и плазменного гемостаза в динамике. Эксперименты проведены на здоровых животных и модели крыс с метаболическим синдромом, который развивался при включении в пищевой рацион продуктов с избытком животных жиров и углеводов, вызывающих нарушения в жировом и углеводном метаболизме организма и способствующих повышенной свертываемости крови. Исследованные регуляторные пептиды вводились интраназально многократно в течение 7 сут ежедневно в дозе 100 мкг/кг массы тела через каждые 24 ч. Установлено, что через 20 ч после последнего введения пептидов параметры первичного (уровень агрегации тромбоцитов) и плазменного (активированное частичное тромбопластиновое время, уровень фактора XIIIa, фибриногена, фибриндеполимеризационная активность) гемостаза свидетельствовали о восстановлении функционального состояния свертывающей и противосвертывающей систем организма. Подобные изменения сохранялись и через 7 сут после отмены введения препаратов. Высказывается предположение о перспективности изучения указанной группы пептидов в условиях патологически повышенной свертываемости крови с последующим их внедрением в клиническую практику.
ВВЕДЕНИЕ
Во многих работах показано, что регуляторные короткие пептиды предотвращают процессы тромбообразования при развитии атеросклеротических изменений в сосудах, сахарном диабете, предтромбозах и других состояниях, сопровождающихся гиперкоагуляцией (Ашмарин и др., 2008; Xiao et al., 2011). Подобные нарушения наблюдаются и при развитии метаболического синдрома (МС), который включает ряд факторов риска, способствующих возникновению сердечно-сосудистых осложнений (Agyemang-Yeboah et al., 2019). При этом происходит дезорганизация компенсаторно-приспособительных реакций организма.
Правильная терапевтическая стратегия при развитии МС оказывает корригирующее воздействие при всех метаболических нарушениях, характерных для МС. В качестве терапевтических средств при атерогенных дислипопротеидемиях и кардиоваскулярных рисках у пациентов с МС предлагают фибраты и статины (Day, 2007). Помимо восстановления метаболизма в органах и тканях, для коррекции нарушений в системе гемостаза при МС рекомендуется применять агенты с антитромботическими эффектами (Watson et al., 2010; Kong et al., 2011). Известно, что некоторые пептидные соединения восстанавливают компенсаторно-приспособительные реакции организма и способствуют нормальному функционированию системы гемостаза, а также липидного и углеводного обмена в организме (Кузник и др., 2013; Andreeva et al., 2013; Мyasoedov et al., 2016).
Исследования пептидных биорегуляторов глипролиновой природы направлены на выявление их регуляторного воздействия как на первичный гемостаз, так и на разные стадии плазменного гемостаза (Andreeva et al., 2013; Golla et al., 2018). Представляют интерес регуляторные пептиды глипролинового ряда, дополнительно содержащие аминокислоты аргинин и лизин. Известны антитромбоцитарные эффекты тафцина, киоторфина и других аргининсодержащих пептидов, в том числе включающих последовательность аминокислот аргинина, глицина и аспарагина – RGD (аргинин-глицин-аспарагиновая кислота) (Закуцкий и др., 2008). Аргинин способствует стабильности тройной спирали коллагена и участвует в электростатическом взаимодействии образования его фибрилл (Brunini et al., 2007). Благодаря присоединению аргинина к дипептиду Gly-Pro увеличивается стабильность трипептида Gly-Pro-Arg, являющегося, как и другие короткие пролинсодержащие пептиды, продуктом гидролиза молекулы коллагена.
Аминокислоту L-аргинин часто используют в кардиологии и иммунологии. Из аргинина в организме в ходе комплексной окислительной реакции, катализируемой группой ферментов NO-синтаз, вырабатывается оксид азота (NO), участвующий в реализации вазодилатации, снижении уровня агрегации тромбоцитов (АТ) и улучшении реологических свойств крови (Napoli et al., 2007). В присутствии аргинина в кровотоке активируется функция противосвертывающей системы и угнетается свертываемость крови. Указанные свойства аргинина способствуют уменьшению риска развития заболеваний сердечно-сосудистой системы и нарушений обмена веществ, росту капилляров в скелетных мышцах, ингибированию перекисного окисления липидов (МсСonell, 2007). Кроме того, аргинин в комплексе с цинком эффективно применяется в профилактике сердечно-сосудистых осложнений у больных сахарным диабетом, оказывая антиоксидантное действие и улучшая показатели в системе аргинин/NO (Preetha et al., 2015).
Показано также, что аргинин совместно с лизином усиливают жировой обмен, снижая уровень липопротеинов низкой плотности и триглицеридов (Duparc et al., 2017). Лизин, являясь предшественником карнитина, метаболизирует жир и тем самым способствует снижению веса индивидуума. Одновременно под действием лизина активируются фибринолитический и антикоагулянтный потенциалы крови (Brzoska et al., 2015; Zhang, Liu, 2017).
Таким образом, комплекс исследований многообразия коротких регуляторных пролинсодержащих пептидов, включающих дополнительно аминокислоты аргинин и лизин, и их роли в процессах гемостаза при метаболических нарушениях является актуальным и перспективным направлением не только для фармакологии и медицины, но и для современной фундаментальной биологии.
Цель настоящей работы – обобщение собственных экспериментальных данных по комплексному изучению состояния плазменно-тромбоцитарного гемостаза при действии регуляторных пептидов глипролинового ряда, содержащих аминокислоты аргинин и лизин, в условиях развития экспериментального МС.
МАТЕРИАЛЫ И МЕТОДЫ
В работе применялись пептиды Lys-Lys-Arg-Arg-Pro-Gly-Pro (KKRRPGP), Arg-Lys-Lys-Arg-Pro-Gly-Pro (RKKRPGP) и Lys-Arg-Lys-Pro-Gly-Pro (KRKPGP), синтезированные в Институте молекулярной генетики РАН, Москва.
Проводилось изучение пептидных препаратов в экспериментах in vitro и in vivo.
В экспериментах было использовано 80 лабораторных белых крыс: самцов массой тела 300–400 г. Все эксперименты на животных проведены в соответствии с этическими принципами и документами, рекомендованными Европейской конвенцией по защите позвоночных животных (Страсбург, 18.03.1986). Индуцирование метаболических нарушений вызывали высококалорийной диетой (ВКД) (Мясоедов и др., 2013). ВКД включала избыток углеводов, холестерина и насыщенных жирных кислот – жира свиного (15%), манной каши на молоке (30%), муки пшеничной и хлеба (15%), сахарного песка (5%), животных жиров (маргарин с гидрогенизированными жирами, майонез, сыр) (25%), сухого корма (10%). В качестве питья животные получали 10%-ный раствор глюкозы.
До начала проведения эксперимента крысы в течение 6 нед получали кормление в соответствии с ВКД c целью развития у них МС. Далее при продолжающемся соблюдении ВКД животные были разделены на четыре группы – три опытные, получавшие семикратно интраназально каждый из трех исследуемых пептидов в дозах 100 мкг/кг, и одну контрольную, получавшую в те же сроки и подобным образом вместо пептидов 0.85%-ный NaCl (физиологический раствор).
Дополнительно в экспериментах использовали нормальных здоровых крыс, которые содержались на обычном лабораторном рационе, для сравнения с животными, содержащимися на ВКД, с целью доказательства развития МС.
Через 20 ч после последнего (седьмого) введения пептидов или физиологического раствора и через 7 сут после отмены их применения при продолжающемся содержании животных на ВКД у них натощак брали кровь на анализы. Взятие крови осуществляли из внутренней vеnae jugularis в количестве 2 мл с использованием в качестве консерванта 3.8%-ного раствора цитрата натрия в соотношении кровь : консервант 9 : 1. Образцы крови центрифугировали в двух режимах: сначала при 1000 об/мин в течение 5 мин для получения богатой тромбоцитами плазмы, а затем при 3000 об/мин в течение 10–12 мин для получения бедной тромбоцитами плазмы. В богатой тромбоцитами плазме определяли АТ с использованием в качестве агреганта АДФ в концентрации 10–6 М. Измерения проводили на агрегометре марки Биола (Россия). В бедной тромбоцитами плазме проводили определение следующих биохимических показателей плазменного гемостаза: антикоагулянтной активности по тестам активированного частичного тромбопластинового времени (АЧТВ) и тромбинового времени (ТВ) на анализаторе свертывания крови марки Астра 2-01 (Россия); фибринолиза по тестам фибриндеполимеризационной активности (ФДПА), суммарной (СФА), неферментативной (НФА) и ферментативной (ФФА) фибринолитической активности на нестабилизированных FXIIIa фибриновых пленках, а также время лизиса эуглобулинового сгустка (ВЛЭС) и активности тканевого активатора плазминогена (ТАП). Одновременно проводили измерение в плазме крови активности FХIIIа с использованием набора реагентов Фактор XIII-тест фирмы РЕНАМ и концентрацию фибриногена с использованием набора реагентов Фибриноген-тест фирмы РЕНАМ (Ляпина и др., 2012).
Показатели жирового обмена в плазме крови исследовали энзиматическим колориметрическим методом с использованием набора реагентов фирмы Ольвекс Диагностикум (Россия). При этом определяли концентрации (ммоль/л) общего холестерина (ОХ) и триглицеридов (ТГ).
Полученные данные были подвергнуты статистической обработке по непараметрическому критерию Манна–Уитни (STATISTICA 8.0).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние пептидных препаратов KKRRPGP, RKKRPGP и KRKPGP на параметры гемостаза in vitro
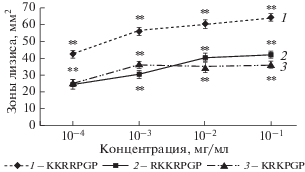
Экспериментально установлено, что все лизин- и аргининсодержащие пептиды оказывали влияние на первичный гемостаз, достоверно подавляя АТ (рис. 1), и плазменный гемостаз, проявляя антикоагулянтную активность и способность растворять нестабилизированный фактором ХIIIa фибрин (ФДПА). Максимальное снижение АТ (до 48 от 100% в контроле) обеспечивал гексапептид KRKPGP при малой концентрации в системе 10–4 мг/мл. В этом пептиде аргинин находится между двумя лизинами.
Рис. 1.
АТ при добавлении пептидов KKRRPGP, RKKRPGP и KRKPGP к плазме крови в условиях in vitro. Здесь и на рис. 2 показатели рассчитаны относительно контроля с NaCl, принятого за 100%.
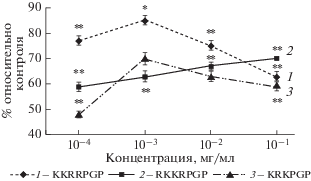
При этом ФДПА была выявлена также у всех пептидов, но максимальным действием обладал пептид, содержащий по 2 молекулы лизина и аргинина – KKRRPGP (рис. 2).
Влияние пептидных препаратов KKRRPGP, RKKRPGP и KRKPGP на параметры гемостаза in vivo у здоровых животных
Направленность действия пептидов при их интраназальном применении у здоровых крыс установлена в сторону возрастания противосвертывающих свойств крови. Проведенные эксперименты были направлены на выявление антитромботических эффектов аргинин- и лизинсодержащих пептидов.
В условиях in vivo интраназально многократно (в течение 7 сут) введенные здоровым крысам пептиды KKRRPGP, KRKPGP и RKKRPGP уже через 20 ч после последнего введения снижали АТ (максимум действия наблюдался у пептида KKRRPGP, который вызывал снижение АТ на 29%). При этом все исследованные пептиды в той или иной степени повышали антикоагулянтные свойства плазмы по тестам АЧТВ (максимальный эффект выявлен у пептидов KKRRPGP, RKKRPGP) и ТВ (с максимальным эффектом при применении KRKPGP). Концентрация фибриногена в плазме крови животных достоверно снижалась (на 47%) при применении пептида KRKPGP. Активность FXIIIa снижалась, особенно значительно при действии пептидов KRKPGP и RKKRPGP (на 33 и 39% соответственно) (табл. 1).
Таблица 1.
Показатели гемостаза после семикратного интраназального введения здоровым крысам пептидов KKRRPGP, RKKRPGP и KRKPGP в ежедневной дозе 100 мкг/кг
| Условия опыта |
АТ, % | АЧТВ, с (%) | ТВ, с (%) | Концентрация фибриногена, г/л (%) | Активность FXIIIa, у.е. (%) |
|---|---|---|---|---|---|
| Контроль NaCl |
100.0 ± 9.2 | 30.6 ± 1.6 (100) |
15.7 ± 1.6 (100) |
3.6 ± 0.9 (100) |
75.5 ± 5.76 (100) |
| KKRRPGP | 71.0 ± 7.3** | 39.6 ± 2.2** (129.6) |
15.9 ± 1.0 (101) |
3.1 ± 0.2 (86) |
63.8 ± 4.81 (85)* |
| RKKRPGP | 89.0 ± 7.8* | 40.3 ± 2.0 (131.7)** |
19.3 ± 0.9 (123)* |
3.8 ± 0.2 (105) |
46.0 ± 2.88 (61)** |
| KRKPGP | 94.7 ± 8.5 | 35.7 ± 1.6 (116.7)* |
24.6 ± 1.3 (153)** |
1.9 ± 0.1 (53)** |
50.0 ± 3.84 (67)** |
Примечание: * – p < 0.05, ** – р < 0.01; статистические показатели рассчитаны относительно соответствующих проб контроля здесь и в табл. 2–4.
Что касается фибринолиза, то каждый из трех пептидов повышал СФА, НФА и ФФА плазмы крыс, а KRKPGP и RKKRPGP снижали ВЛЭС, что свидетельствовало об их высокой фибринолитической активности в плазме крови крыс. СФА повышалось на 32–103%, НФА – на 24–113%, ФФА на нестабилизированном фибрине – на 46–93%, ВЛЭС снижалось на 37–59% (табл. 2).
Таблица 2.
Показатели фибринолитического процесса в плазме крови после семикратного введения здоровым крысам пептидов KKRRPGP, RKKRPGP и KRKPGP в ежедневной дозе 100 мкг/кг
| Условия опыта |
СФА, мм2 (%) | НФА, мм2 (%) | ФФА, мм2 (%) | ТАП, мм2 (%) | ВЛЭС, мм2 (%) |
|---|---|---|---|---|---|
| Контроль NaCl |
33.1 ± 1.1 (100) | 22.6 ± 0.5 (100) |
10.5 ± 1.0 (100) |
86.6 ± 4.6 (100) |
76.0 ± 4.6 (100) |
| KKRRPGP | 67.2 ± 4.3 (203)** |
48.1 ± 2.2 (213)** |
19.1 ± 2.3 (182)** |
– | – |
| RKKRPGP | 49.1 ± 1.3 (148)** |
28.8 ± 0.8 (127)** |
20.3 ± 2.1 (193)** |
78.3 ± 5.3 (90) |
48.0 ± 2.4 (63)** |
| KRKPGP | 43.7 ± 2.0 (132)** |
28.2 ± 0.8 (124)* |
15.4 ± 1.8 (146)** |
99.5 ± 1.9 (115)* |
31.3 ± 4.7 (41)** |
Анализируя результаты экспериментов in vitro и in vivo на здоровых животных, необходимо отметить, что исследованные нами пептиды обладали сочетанными антикоагулянтным, антитромбоцитарным, фибриндеполимеризационным (неферментативным фибринолитическим), антифибринстабилизирующим эффектами. Установлено, что они ингибируют активность тромбина и других свертывающих факторов в условиях in vitro, восстанавливая до нормы повышенную свертываемость крови в организме. В других работах показано только сочетанное антикоагулянтное и антитромбоцитарное действие других пептидов (Liu et al., 2017). Снижение АТ под влиянием исследованных пептидов, вероятно, обусловлено их взаимодействием с гликопротеиновыми рецепторами тромбоцитов с последующим ингибированием их связи с фибриногеном, как это описано в литературе об антитромбоцитарном действии пептида His-Leu-Gly-Gly-Ala-Lys-Gln-Ala-Gly-Asp-Val, входящего в участок γ-цепи фибриногена человека (последовательность аминокислот 400–411) (Луговской и др., 2013). О взаимодействии исследованных олигопептидов с фибриногеном свидетельствует выявленное нами наличие у них ФДПА за счет ингибирования процессов полимеризации фибрина. Кроме того, по данным литературы, подтверждается ингибирование этих процессов пептидами, содержащими последовательность аминокислот Gly-Pro-Arg-Pro, которые взаимодействуют с периферическими D-доменами α-цепи фибриногена. Известно также, что А-α цепь фибриногена содержит последовательность аминокислотных остатков Arg-Gly-Asp (RGD), которые являются участками ингибирования взаимодействия фибриногена с гликопротеиновыми рецепторами (ГП) IIb/IIIa (Луговской и др., 2013). Пептиды коллагена I и III типов (Chiang et al., 2007) содержат Arg-Gly-Asp-Ser-аминокислотную последовательность (RGDS) и прерывают заключительный этап связывания фибриногена с ГП IIb/IIIa активированных тромбоцитов. Таким же действием обладает и синтетический пептид, содержащий последовательность аминокислот Arg-Pro-Asp (RPD), куда входит пролиновый остаток, имеющийся и в исследованных в настоящей статье пептидах. Таким образом, RGD-, RGDS-, RPD-последовательности аминокислот с дополнительным включением пролина проявляют высокий антитромбоцитарный эффект. Известно также, что RPD-последовательность была использована для конструирования мощных пептидов-миметиков, обладающих антикоагулянтной активностью наряду с антитромбоцитарной. Этот факт заслуживает внимания, поскольку пептиды с такой последовательностью аминокислот могут быть применены для будущих конструкций бифункциональных антитромботических агентов (Yu et al., 2014).
Итак, на основании полученных нами результатов и имеющихся данных литературы, мы можем предполагать, что антитромбоцитарные эффекты исследованных нами пролиновых пептидов, выражающиеся в подавлении АДФ-зависимой АТ, обусловлены либо их взаимодействием с фибриногеном, либо ингибированием ГП тромбоцитов. Известно, что для подавления патологического тромбообразования используют одновременно как ингибиторы тромбина, так и ингибиторы активации тромбоцитов, которым принадлежит ключевая роль в формировании тромба. Природные RGD-содержащие пептиды обладали не только антитромбоцитарным эффектом, но и значительным антикоагулянтным действием (Hasan et al., 2003). Подобное же действие проявляли и исследованные нами пептиды. Их антикоагулянтная активность, вероятно, связана с ингибированием факторов свертывания крови (Ха и факторов протромбинового комплекса), о чем свидетельствует установленное нами повышение активности АЧТВ.
Объяснить механизм фибриндеполимеризационного эффекта исследованных нами пептидов можно как прямым действием пептидов, поскольку они сами обладают ФДПА, так и опосредованным эффектом. Пептиды ингибируют процессы превращения фибриногена в фибрин в основном на стадии “самосборки” фибрина, как это описано в литературе (Бышевский и др., 2012). Механизм антифибринстабилизирующего действия аргинин- и лизинсодержащих пептидов заключается, вероятно, в их способности ингибировать тромбин, участвующий в активации фактора XIIIа (Луговской и др., 2013).
Таким образом, применение исследованных пептидных препаратов KKRRPGP, RKKRPGP и KRKPGP у здоровых животных приводило к созданию в организме высокого противосвертывающего фона за счет ингибирующего действия на первичный гемостаз и на процессы превращения фибриногена в фибрин, а также за счет блокады активности тромбина. При этом отмечалось снижение АТ и активности фактора XIIIa, повышение фибриндеполимеризационной и антикоагулянтной активности в плазме крови.
Влияние пептидных препаратов KKRRPGP, RKKRPGP и KRKPGP на параметры гемостаза in vivo в условиях развития МС
На модели крыс с МС, который вызывали шестинедельным кормлением крыс пищей, обогащенной жирами и углеводами, при постоянном соблюдении крысами ВКД были продемонстрированы нарушения функции гемостаза и жирового обмена. Так, контрольные животные, содержащиеся на ВКД, демонстрировали гиперкоагуляцию по данным AТ (повышение на 25%), активности FXIIIа (повышение на 17%), ФДПА и АЧТВ (снижение на 50% и 16% соответственно), а также повышенную концентрацию ОХ (на 18–20%), ТГ (на 75%), Хс-ЛПНП (на 45%) и сниженную концентрацию Хс-ЛПВП (на 17%) по сравнению с нормальными здоровыми крысами. Полученные данные свидетельствовали о развитии МС в организме крыс (Fan et al., 2019), которым проводили в дальнейшем терапию пептидами.
Влияние пептидов на первичный гемостаз (по тесту АТ)
В эксперименте на модели МС у животных предварительно было установлен повышенный уровень АТ крови (контроль). На этом фоне применение каждого из пептидов в течение 7 сут интраназально приводило через 20 ч после последнего введения к снижению АТ на 35.5% (RKKRPGP), на 21.7% (KRKPGP). Через 7 сут после отмены применения препаратов АТ несколько повышалась, но не превышала контрольные значения. Так, уровень АТ оставался сниженным − на 21% (RKKRPGP), на 2% (KRKPGP). Пептид KKRRPGP действовал в кровотоке иначе, чем пептиды RKKRPGP и KRКPGP. Через 20 ч после последнего семикратного введения этого пептида АТ практически не изменилась, но и не превысила контрольный уровень, в то время как при продолжающемся содержании крыс на ВКД в отдаленный период (через 168 ч) АТ снизилась на 11.4% по сравнению с контрольным уровнем (табл. 3).
Влияние пептидов на плазменный гемостаз
Используемый нами тест АЧТВ предназначен для выявления процессов внутреннего механизма свертывания крови и для определения антикоагулянтных или прокоагулянтных свойств плазмы крови животных.
После многократного введения 0.85%-ного раствора NaCl животным с развившимся МС (на фоне ВКД) наблюдалась гиперкоагуляция, поскольку АЧТВ было значительно снижено на 20% по сравнению с нормой. Семисуточное применение каждого из пептидов приводило к восстановлению нарушенной свертываемости крови (на 15–25%), то есть пептиды KKRRPGP, RKKRPGP и KRKPGP оказывали корригирующий антикоагулянтный эффект, восстанавливая нормальную свертываемость крови (табл. 4).
Таблица 4.
Влияние пептидов на изменение активности FXIIIa, ФДПА и АЧТВ на фоне развития МС
| Параметры плазменного гемостаза | Контроль NaCl |
KKRRPGP | RKKRPGP | KRKPGP |
|---|---|---|---|---|
| Через 20 ч после 7 сут введения | ||||
| АЧТВ, с (%) | 28.9 ± 1.6 (100) | 33.1 ± 1.2* (115) | 36.1 ± 0.8** (125) | 35.1 ± 0.6** (121.3) |
| ФДПА, мм2 (%) | 10.0 ± 1.1 (100) | 17.0 ± 0.9** (170) | 30.6 ± 1.8** (306) | 25.0 ± 0.7** (250) |
| Активность FXIIIa (%) | 93.8 ± 2.65 (100) | 62.9 ± 3.49** (67) | 55.3 ± 3.24** (59) | 42.5 ± 2.42** (45) |
| Через 168 ч после 7 сут введения | ||||
| АЧТВ, с (%) | 28.2 ± 1.0 (100) | 33.6 ± 1.2* (119.2) | 41.1 ± 1.2** (145.6) | 34.4 ± 1.4** (122) |
| ФДПА, мм2 (%) | 12.4 ± 1.8 (100) | 22.8 ± 0.7** (184.3) | 24.4 ± 0.5** (198) | 23.7 ± 0.5** (191) |
| Активность FXIIIa (%) | 96.0 ± 4.62 (100) | 67.0 ± 2.89* (70) | 72.0 ± 4.81** (75) | 75.7 ± 3.49* (79) |
Фибриндеполимеризационная или неферментативная фибринолитическая активность плазмы крови животных характеризует ее способность предотвращать процессы начинающегося фибрино- или тромбообразования.
Аргинин- и лизинсодержащие пептиды вследствие многократного в течение 7 сут поступления в организм повышают в кровотоке ФДПА спустя 20 ч после последнего интраназального их применения, и эта активность сохраняется с небольшими изменениями на протяжении 168 ч при продолжающемся кормлении крыс в соответствии с ВКД. Так, через 20 ч после семисуточного введения пептидов ФДПА увеличивалась на 70% (KKRRPGP), 206% (RKKRPGP) и 150% (KRKPGP). Через 168 ч после последнего введения указанных пептидов эта активность была увеличенной и превышала контрольные значения на 84.3, 98 и 91% соответственно после применения пептидов KKRRPGP, RKKRPGP и КRKPGP (табл. 4).
В более ранних работах с пептидными препаратами был установлен антифибринстабилизирующий эффект коротких пролинсодержащих пептидов (Pro-Gly, Pro-Gly-Pro) в условиях in vitro, которые в плазме крови ингибировали активность FXIIIа (Ашмарин и др., 2008).
В настоящей работе при исследовании эффектов трех пептидов KKRRPGP, RKKRPGP и KRKPGP в условиях in vivo также был установлен их антифибринстабилизирующий эффект (табл. 4). Так, через 20 ч после семикратного введения пептидов в плазме крови крыс снижалась активность FXIIIа на 33, 41 и 55% соответственно. Через 7 сут (то есть через 168 ч) после отмены введения пептидов при продолжающемся кормлении крыс в соответствии с ВКД в крови крыс сохранялась антифибринстабилизирующая активность, хотя и в меньшей степени, чем через 20 ч после последнего введения пептидов (табл. 4).
Возможные механизмы антисвертывающих эффектов пептидных препаратов KKRRPGP, RKKRPGP и KRKPGP
После многократного ежедневного в течение 7 сут применения каждого из аргинин- и лизинсодержащих пептидов было установлено восстановление нормального функционирования системы гемостаза. Спустя 20 ч после интраназального многократного введения исследованных пептидов крысам как в норме, так и c развившимся МС в плазме крови увеличивались показатели АЧТВ, повышалась ФДПА, снижались показатели АТ и активности FХIIIa по сравнению с контролем. Эта направленность противосвертывающего действия пептидов в отношении состояния системы гемостаза отмечалась и через 7 сут после отмены введения исследованных препаратов у животных с МС. Было показано, что вводимые интраназально пептиды все еще продолжали в той или иной степени демонстрировать антикоагулянтно-фибринолитические, антифибринстабилизирующие и антитромбоцитарные эффекты в организме.
Следовательно, по данным нашего гемостазиологического исследования аргинин- и лизинсодержащие пептиды по сравнению с контролем проявляли антикоагулянтную активность и ингибировали факторы свертывания крови, в том числе основной фермент свертывания тромбин и FXIIIа, на что указывало удлинение ТВ и АЧТВ. Это подтверждается данными о влиянии других пролинсодержащих пептидов на ингибирование активности фермента тромбина (Ашмарин и др., 2008).
В нашем исследовании впервые был доказан факт блокады активности тромбина аргининсодержащими пептидами, которые, возможно, из-за присутствия в их структуре аминокислоты аргинина, способствующего выбросу из сосудистого эндотелия оксида азота (Ilas et al., 2008), проявляют не только антикоагулянтное, но и антитромбоцитарное действие в организме. Ранее было показано, что регуляторный пептид PGP (Andreeva et al., 2013) при интраназальном многократном введении в организм животных с гиперхолестеринемией оказывает нормохолестеринемическое действие с одновременным проявлением фибриндеполимеризационных и антитромбоцитарных активностей в кровотоке, что может быть обусловлено его структурными особенностями. Исследованные нами пептиды можно отнести к препаратам широкого антитромботического действия, одновременно влияющим как на первичный, так и на плазменный гемостаз.
Полученные новые экспериментальные данные свидетельствуют о сочетанном регуляторном воздействии аргинин- и лизинсодержащих глипролинов на процессы свертывания крови в организме как в норме, так и при патологии, приводящей в конечном итоге к повышенной свертываемости крови. Установленные нами результаты свидетельствуют о перспективности использования препаратов регуляторных пептидов в качестве терапевтических средств защиты организма даже в условиях уже развившегося МС. Модельные эксперименты, проведенные с аргинин- и лизинсодержащими пептидами, показали, что под влиянием этих эндогенных метаболитов могут изменяться параметры как первичного, так и плазменного гемостаза. При этом отмечается изменение АТ, степень и скорость образования фибринового сгустка в кровотоке, влияние FXIIIa на процессы полимеризации и стабилизации фибрина крови в сторону нормализации функции системы гемостаза. Кроме того, выброс тканевого активатора плазминогена из сосудистого эндотелия под действием исследованных пептидов способствует увеличению фибринолитического потенциала крови.
ЗАКЛЮЧЕНИЕ
Полученные результаты указывают на потенциальные возможности пептидных соединений, включающих аргинин и лизин, влиять на гомеостатические процессы, изменять метаболизм органов и тканей и участвовать в регуляции обмена веществ, поддерживать метаболический и гемостазиологический баланс организма.
В условиях моделирования МС у крыс исследованные нами пептиды обладали комплексным действием на показатели системы гемостаза, повышая антитромбоцитарные, антикоагулянтные, фибриндеполимеризационные и антифибринстабилизирующие свойства плазмы крови. При нарушениях жирового обмена, сопровождающихся повышенной свертываемостью крови и снижением ее реологических свойств, аргинин- и лизинсодержащие пептиды обладают сочетанным действием не только на первичный и плазменный гемостаз, но и на функцию сосудистого эндотелия, эксперессируя в кровоток оксид азота и тканевой активатор плазминогена. Эта группа пептидов может быть отнесена к перспективным универсальным терапевтическим средствам с широкими антитромботическими свойствами.
Список литературы
Ашмарин И.П., Ляпина Л.А., Андреева Л.А. и др. Лечебный эффект глипролинов Pro-Gly и Pro-Gly-Pro при развитии экспериментального инсулинзависимого диабета // Тромбоз, гемостаз и реология. 2008. Т. 34. № 2. С. 38–43.
Бышевский А.Ш., Галян С.Л., Калинин Е.П. и др. Ингибиторы самосборки фибрина растительного происхождения // Мед. наука и образов. Урала. 2012. Т. 13. № 1. С. 163–170.
Закуцкий А.Н., Чалисова Н.И., Субботина Т.Ф. Функциональные аргининсодержащие последовательности в пептидах и белках // Биоорган. химия. 2008. Т. 34. № 2. С. 149–159.
Кузник Б.И., Хавинсон В.Х., Тарновская С.И., Линькова Н.С. Эпигенетическое действие регуляторных пептидов на цитокиновый профиль и систему гемостаза // Вестн. гематол. 2013. Т. 9. № 2. С. 29–33.
Луговской Э.В., Макогоненко Е.М., Комисаренко С.В. Молекулярные механизмы образования и разрушения фибрина. Киев: Наукова думка, 2013. 230 с.
Ляпина Л.А., Григорьева М.Е., Оберган Т.Ю., Шубина Т.А. Теоретические и практические вопросы изучения функционального состояния противосвертывающей системы крови. М.: Адвансед Солюшнз, 2012. 160 с.
Мясоедов Н.Ф., Шубина Т.А., Оберган Т.Ю. и др. Профилактическое гипохолестеринемическое действие регуляторного пептида Pro-Gly-Pro-Leu // Вопр. питания. 2013. Т. 82. № 5. С. 41–45.
Agyemang-Yeboah F., Eghan B.A.J., Annani-Akollor M.E. et al. Evaluation of metabolic syndrome and its associated risk factors in type 2 diabetes: a descriptive cross-sectional study at the Komfo Anokye Teaching Hospital, Kumasi, Ghana // Biomed. Res. Int. 2019. P. 4562904.
Andreeva L.A., Myasoedov N.F., Lyapina L.A. et al. Effect of the PRO-GLY-PRO peptide on hemostasis and lipid metabolism in rats with hypercholesterolemia // Dokl. Biol. Sci. 2013. V. 453. № 1. P. 333–335.
Brunini T.M.C., Mendes-Ribeiro A.C., Ellory J.C., Mann G.E. Plateletnitric oxide synthesis in uremia and malnutrition: a role for Larginine supplementation in vascular protection? // Cardiovasc. Res. 2007. V. 73. № 2. P. 359–367.
Brzoska T., Tanaka-Murakami A., Suzuki Y. et al. Endogenously generated plasmin at the vascular wall injury site amplifies lysine binding site-dependent plasminogen accumulation in microthrombi // PLoS One. 2015. V. 10. № 3. P. e0122196.
Chiang T.M., Zhu J., Woo-Rasberry V. Peptides derived from platelet non-integrin collagen-receptors or types Iand III collagen inhibit collagen-platelet interaction // Cardiovasc. Hematol. Disord. Drug Targets. 2007. V. 7. № 1. P.71−75.
Day K. Metabolic syndrome, or what you will: definitions and epidemiology // Diab. Vasc. Dis. Res. 2007. V. 4. № 1. P. 32–38.
Duparc C., André C., Ménard J. et al. l-lysine acts as a serotonin type 4 receptor antagonist to counteract in vitro and in vivo the stimulatory effect of serotonergic agents on aldosterone secretion in man // Horm. Metab. Res. 2017. № 4. P. 269−275.
Fan J., Liu Y., Yin S. et al. Small dense LDL cholesterol is associated with metabolic syndrome traits independently of obesity and inflammation // Nutr. Metab. 2019. V. 16. P. 7.
Golla K.I., Stavropoulos D., Shields D.C., Moran N.R. Peptides derived from cadherin juxtamembrane region inhibit platelet function // R. Soc. Open Sci. 2018. V. 5. № 10. P. 172347.
Hasan A.A.K., Warnock M., Nieman N. Mechanisms of Arg-Pro-Pro-Gly-Phe inhibition of thrombin // Am. J. Physiol. Heart Circ. Physiol. 2003. V. 285. № 1. P. 183−193.
Ilas J., Hudecz F., Süli-Vargha H., Kikelj D. Peptides and pseudopeptides incorporating D-Phe-Pro-Arg and Arg-Gly-Asp lead sequences as potential antithrombotic agents // J. Pept. Sci. 2008. V. 14. № 8. P. 946–953.
Kong X., Zhang D.Y., Wu H.B., Li F.X. Losartan and pioglitazone ameliorate nephropathy in experimental metabolic syndrome rats // Biol. Pharm. Bull. 2011. V. 34. № 5. P. 693–698.
Liu T., Hu Y., Tan J. et al. Surface biomimetic modification with laminin-loaded heparin/poly-l-lysine nanoparticles for improving the biocompatibility // Mater. Sci. Eng. C. Mater. Biol. Appl. 2017. V. 71. P. 929–936.
McConell G.K. Effects of L-arginine supplementation on exertcise metabolism // Curr. Opin. Clin. Nutr. Metab. Care. 2007. V. 10. № 1. P. 46–51.
Myasoedov N.F., Lyapina L.A., Grigorjeva M.E. et al. Mechanism for glyproline protection in hypercholesterolemia // Pathophysiol. 2016. V. 23. № 1. P. 27–33.
Napoli C.C., Stanley W.C., Ignarro L.J. Nutrition and cardiovascular disease: putting a pathogenetic framework into focus // Cardiovasc. Res. 2007. V. 73. № 2. P. 253−256.
Preetha P.P., Devi V.G., Rajamohan T. Mature coconut water exhibits antidiabetic and antithrombotic potential via L-arginine-nitric oxide pathway in alloxan induced diabetic rats // J. Basic. Clin. Physiol. Pharmacol. 2015. V. 26. № 6. P. 575–583.
Watson T., Arya A., Sulke N., Lip G.Y.H. Antithrombotic therapy: relationship of indices of inflammation and thrombogenesis to arithmia burden in paroxysmal arterial fibrillation // Chest. 2010. V. 137. P. 869–876.
Xiao C., Hsieh J., Adeli K., Lewis G.F. Gut-liver interaction in triglyceride-rich lipoprotein metabolism // Am. J. Physiol. Endocrin. Metab. 2011. V. 301. P. E429–E446.
Yu Z., Huang Y., Wang Y. et al. Construction and characterization of novel hirulog variants with antithrombin and antiplatelet activities // Protein. Pept. Lett. 2014. V. 21. № 1. P. 69−74.
Zhang W., Liu F. Effect of polylysine on blood clotting and red blood cell morphology, aggregation and hemolysis // J. Nanosci. Nanotechnol. 2017. V. 17. № 1. P. 251−255.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии