Успехи современной биологии, 2019, T. 139, № 6, стр. 562-576
О роли нуклеофозмина в функционировании клеток и в опухолевой прогрессии
Д. А. Понкратова 1, *, А. А. Лушникова 1
1 Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
Министерства здравоохранения РФ
Москва, Россия
* E-mail: hunger13@mail.ru
Поступила в редакцию 17.05.2019
После доработки 13.06.2019
Принята к публикации 22.07.2019
Аннотация
Нуклеофозмин/В23/NPM – многофункциональный белок, регулирующий важнейшие процессы жизнедеятельности клеток и апоптоз. Нарушения структуры гена NPM и экспрессии кодируемого им белка В23 играют важную роль в развитии и прогрессии онкологических, неврологических и других заболеваний. В обзоре рассмотрены структура гена NPM и белка В23, функции нуклеофозмина и его роль в канцерогенезе с позиций прикладных и фундаментальных молекулярно-биологических аспектов современной онкологии.
ВВЕДЕНИЕ
Изучение механизмов опухолевой прогрессии и поиск новых мишеней для молекулярно-направленной терапии новообразований являются актуальными научными проблемами. Молекулярно-генетические исследования злокачественных опухолей позволяют разработать методы ранней диагностики, профилактики и лечения онкологических заболеваний. Благодаря молекулярно-направленной (таргетной) терапии возможно персонализированное лечение онкобольных, улучшающее их выживаемость. Однако во многих случаях таргетные препараты оказывают кратковременное действие, вызывая стабилизацию опухолевого процесса с последующим развитием резистентности к терапии. В обзоре рассмотрены структура, функции и роль в канцерогенезе белка нуклеофозмина/В23/NPM, регулирующего важнейшие процессы жизнедеятельности клеток и апоптоз. Взаимодействие В23 с широким спектром белков позволяет рассматривать нуклеофозмин как перспективную мишень для молекулярно-направленной терапии быстрорастущих и устойчивых к химиотерапии опухолей человека.
СТРУКТУРА B23 И КОДИРУЮЩЕГО ГЕНА
Нуклеофозмин, В23, или ньюматрин, относится к семейству многофункциональных негистоновых белков с высококонсервативной структурой. Он локализован, преимущественно, в ядрышке и выполняет ключевую роль во многих процессах, необходимых для поддержания стабильности в жизнедеятельности клетки.
Ген NPM, кодирующий белок В23, картирован на хромосоме 5q35 и состоит из 12 экзонов и 11 интронов. На 5'-концевом участке нуклеотидной последовательности гена идентифицирован сайт связывания с транскрипционным фактором YY1 (Chan et al., 1997). Первый интрон гена NPM содержит последовательность, с которой связывается онкогенный фактор транскрипции с-Мус (Zeller et al., 2001). Еще одной важной структурной особенностью гена NPM является т.н. сайт ломкости, локализованный внутри последовательности интрона 4, где наиболее часто происходят транслокации генов. В результате транслокации возникают слитные (fusion) белки, обнаруженные в некоторых типах опухолевых клеток (Chan et al., 1997; Cordell et al., 1999). Вследствие альтернативного сплайсинга мРНК NPM образуются 3 изоформы белка: полноразмерная с молекулярной массой 37 кДа, содержащая 294 аминокислотных остатка (а. о.), и две укороченные, включающие 259 аминокислот из-за делеции транскрипта экзона 12 и 265 аминокислот – вследствие делеции транскрипта экзона 8, функции этой формы ограничены (Kuramitsu et al., 2010).
Молекулы В23 содержат уникальные области, ответственные за олигомеризацию, шаперонную активность, взаимодействие с нуклеиновыми кислотами и белками (Hingorani et al., 2000; Gjerset, 2006).
N-концевой домен (с 1 по 110 а. о.) связан с олигомеризацией и шаперонной активностью, содержит 2 сигнальных мотива, отвечающих за ядерный экспорт молекул (NES) и обогащенных лейцином. Первый из NES (42–49 а. о.) связывается с рибосомным белком L5 и с 5S рРНК, а затем В23 переносит этот комплекс в цитоплазму (Herrera et al., 1995). Второй аминокислотный мотив NES (94–102 а. о.) отвечает за локализацию В23 в области центросом и контролирует их дупликацию (Wang et al., 2005; Okuwaki, 2008). Первые 15 аминокислотных остатков в молекуле нуклеофозмина обогащены метионином, однако функциональное значение этого мотива не вполне понятно. Предполагается его участие в усилении процесса инициации трансляции других белков, поскольку метиониновые кодоны входят в состав консенсусной последовательности Козак, фланкирующей стоп-кодон и важной для трансляции. Возможно, что Met-богатый участок В23 влияет на конформацию этого белка (Lindstrom, 2011). Функционирование В23 в качестве шаперонного белка предотвращает агрегацию белков в ядрышке и способствует сборке гистонов и нуклеосом (Okuwaki et al., 2001). Кроме того, N-концевой домен В23 играет важную роль в образовании олигомерных комплексов (Herrera et al., 1996; Hingorani et al., 2000). Однако по другим данным, для образования олигомерных комплексов необходим не только N-концевой домен, но и 5 остатков на С-концевом участке молекулы (Liu, Chan, 1991). За N-концевым доменом следуют 2 кислых отрицательно заряженных мотива, которые необходимы для связывания гистоновых и рибосомных белков, для сборки нуклеосом и ремоделирования хроматина. Между этими мотивами локализована последовательность, обусловливающая рибонуклеазную активность, которая критична для биогенеза рибосом, а также последовательность, отвечающая за ядерную локализацию белка (NLS, 190–197 а. о.). Основной домен локализован между 189 и 243 аминокислотами. Он играет ключевую роль в связывании В23 с нуклеиновыми кислотами и опосредует его участие в сборке нуклеосом и в регуляции структуры хроматина. Этот домен участвует в связывании В23 с р53, стабилизируя структуру белка-супрессора (Kurki et al., 2004a,b). Кроме того, в состав С-концевого домена входят ароматические аминокислоты, взаимодействующие с ДНК и РНК, а также сайты связывания с АТФ и гистонами (Lindstrom, 2011). В С-концевом домене локализован сигнал ядрышковой локализации NoLS. Транспорт В23 в различные клеточные компартменты регулируется с помощью мотивов NES, NLS и NoLS (Falini et al., 2010). Короткая пептидная последовательность сигнала ядерной локализации NLS отличается от сигнала ядерного экспорта NES, поскольку последовательность NLS обогащена основными аминокислотами, а NES представляет собой консенсусную последовательность LXXLXXVXL, обогащенную лейцином (Bolli et al., 2007).
Показано, что С-концевой домен В23 вовлечен в специфичное распознавание G-квадруплексов – обогащенных гуанином последовательностей, образующих 4-цепочные структуры ДНК (Bañuelos et al., 2013; Scognamiglio et al., 2014).
Несмотря на то, что ген NPM напоминает по структуре т.н. гены домашнего хозяйства, он содержит сигнальные последовательности, характерные для тканеспецифичных генов. Это указывает на возможность альтернативного сплайсинга мРНК и активацию дополнительных транскрипционных факторов в клетках различных тканей (Chang, Olson, 1990).
Функциональная активность В23 зависит от степени фосфорилирования. В молекуле В23 имеется несколько сайтов фосфорилирования киназами Cdc2, CK II, N-II, Plk2 (табл. 1).
Таблица 1.
Сайты фосфорилирования в пределах высококонсервативного N-конца молекулы В23 (по Mitrea, Kriwacki, 2012)
| Сайт фосфорилирования | Консервативный остаток | Модифицирующие киназы |
|---|---|---|
| S4 | S | PLK2 |
| S10 | S/G/N | CDK |
| Y17 | Y/F | TK, PDGFR |
| S43 | S | PKA, CaM-II, CKI |
| T46 | T | CKI, CAMK |
| S48 | S/T | PKA |
| Y67 | Y | TK, Ab1 |
| S70 | S/N | CDK |
| T75 | T/V | PKA |
| T78 | T/S | PKC |
| S82 | S | CKI |
| S88 | S | PKA, PKG, ATM |
| T95 | T | PDK, cdc2, p38MAPK |
| S106 | S | – |
| S112 | S | PKA |
| S125 | S | CK II, CDK2 |
Фосфорилирование молекул В23 чрезвычайно важно для регуляции клеточного цикла и контролируется также пептидил-пролил-цис/транс-изомеразой, а нарушение этого процесса резко снижает пролиферацию клеток и опухолевую прогрессию (Zhao et al., 2015). Фосфорилирование молекул В23 необходимо также для взаимодействия с другими белками и для раскручивания молекул ДНК (Okuwaki, 2008). В процессах фосфорилирования задействован целый ряд киназ. Фосфорилирование Ser4 в молекуле В23 киназой Plk2 опосредует прохождение клеткой сверочной точки в фазе G1/S и дупликацию центромеры в S-фазе митоза (Dabbous et al., 2011). Мутации нуклеотидного триплета, кодирующего Ser4 В23, нарушают фосфорилирование белка и приводят к остановке клеточного цикла в S-фазе (Krause, Hoffmann, 2010). Известно, что фосфорилирование молекул В23 по остаткам Ser4 и Thr199, Thr 234, Thr 237 связано с высокой метастатической активностью гепатоклеточной карциномы, рака предстательной железы, легкого и ряда других солидных опухолей (Ching et al., 2015). В митозе В23 фосфорилируется циклинзависимой киназой 2 (CDK2) по остатку Thr199 и инициирует дупликацию центросомы (Peter et al., 1990). Показано также, что функциональная активность молекул В23 зависит от фосфорилирования остатков Ser10 и Ser70 циклинзависимой киназой 2. Обнаружено, что одновременная инактивация фосфорилирования этих аминокислот в молекуле В23 в клетках мышиного лейкоза ускоряет прохождение фазы G2/М клеточного цикла и прохождение клеткой сверочной точки G2/М. На границе фаз G1/S клеточного цикла фосфорилирование циклин Е/cdk2 регулирует способность В23 связываться с центросомами (Tokuyama et al., 2001): будучи фосфорилированным по Thr199 В23 диссоциирует из комплекса с центросомами, инициируя их репликацию (Okuda, 2002).
В интерфазе (G2) В23 фосфорилируется по остатку Ser125 казеинкиназой II (CK II) (Lawson et al., 2005). Фосфорилирование В23 протеинкиназой СК II крайне важно для распределения молекул В23 в клеточном ядре. Нарушение взаимодействия В23 и СК II приводит к снижению скорости пролиферации и к индукции апоптоза (Qi et al., 2008). Фосфорилирование по Ser125 вызывает диссоциацию субстрата и В23. Кроме того, фосфорилирование по этому остатку влияет на миграцию молекул В23 в цитоплазме и ядре (Negi, Olson, 2006).
Известно, что рРНК-связывающая активность В23 регулируется путем фосфорилирования Тhr199, Тhr219, Тhr234 и Тhr237 циклин В/Cdc2. Фосфорилирование по этим остаткам подавляет связывание В23 с РНК и, тем самым, помогает ингибировать расщепление рРНК (Bolli et al., 2009).
Специфичная для фазы митоза фосфорилированная форма В23 участвует в поддержании конденсированного состояния митотических хромосом (Lu et al., 1996).
Дефосфорилирование В23 в клетке происходит с помощью локализованной в ядрышках δ-изоформы протеинфосфотазы типа I – серинтреониновой фосфатазы (Kotani et al., 1998).
Кроме фосфорилирования, модификация молекул В23 возможна путем ацетилирования, убиквитинирования и связывания с убиквитинподобными белками-модификаторами (SUMO), белками-супрессорами BRCA2 и р53, протеазами SENP3 и SENP5. Эти пока не до конца изученные процессы играют определенную роль в активации и поддержании стабильной структуры ядрышка, обеспечивая его функции (Szebeni et al., 1997; Tulchin et al., 2010). Белки семейства SUMO ковалентно присоединяются к остаткам лизина в молекуле В23, в сумоилировании участвует ядрышковый белок-супрессор ARF. Сумоилированный В23 препятствует образованию и созреванию 28S рРНК из предшественника 32S рРНК, влияя таким образом на биогенез рибосом и клеточный цикл (Haindl et al., 2008). Сумоилирование по аминокислотным остаткам Lys230 и Lys263 имеет большое значение также для локализации В23 в клетке. Например, ингибирование сумоилирования по Lys263 приводит к нарушению локализации В23, а также регуляции дупликации центросомы и клеточного цикла (Colombo et al., 2011).
Специфичное убиквитинирование В23 по одному сайту происходит с помощью убиквитинлигазы Е3 и комплекса BRCA1, при этом структура В23 стабилизируется, и деградации молекулы не происходит (Sato et al., 2004). Показано, что убиквитинлигазная активность BRCA1/BARD1 важна для правильной сборки митотического веретена (Joukov et al., 2006). Убиквитиновые метки с молекул В23 удаляются протеазами SENP3 и USP36, что приводит к стабилизации структуры этого белка. Известно, что инактивация или отсутствие протеазы USP36 в ядрышках нарушает биогенез рибосом, однако В23 может связываться с молекулами USP36 и транспортировать их в ядрышко (Endo et al., 2009).
Глутатионирование В23 по остатку Cys275 является необходимым условием для активации р53 в условиях стресса (Yang et al., 2016).
Ацетилирование В23 посредством р300 оказывает двойной эффект: стимулируется транслокация В23 из ядрышка в нуклеоплазму и РНК-полимераза II-зависимая транскрипция ДНК с участием В23 (Kotani et al., 1998). Ацетилирование остатков лизина В23, опосредованного ацетилтрансферазой р300, влияет на его гистон-связывающую активность и индуцирует транскрипцию хроматина (Swaminathan et al., 2005). С-концевой домен В23, включающий остатки Lys212, Lys215, Lys229, Lys230, Lys257, Lys267, Lys292, ацетилируется р300. Ацетилированный В23 локализуется в нуклеоплазме, взаимодействует с транскрипционно-активной РНК-полимеразой II и активирует гены, связываясь с их промоторными последовательностями. Деацетилирование В23 с помощью HDAC класса III и SIRT1 значительно снижает уровень транскрипции генов (Shandilya et al., 2009).
Молекулы В23, локализованные на плазматической мембране, гликозилированы и связываются с различными вне- и внутриклеточными лигандами, регулируя молекулярный транспорт и сигналинг (Brandt et al., 2004).
Кроме фосфорилирования и других модификаций, на функции В23 влияет олигомеризация и местоположение в клетке. Олигомеризация молекул В23 усиливает их шаперонную активность, увеличивает сродство к нуклеиновым кислотам и белкам и ускоряет созревание рибосом (Okuwaki, 2008; Kuramitsu et al., 2010). Мономеры В23 ассоциируют с образованием пентамерных комплексов посредством гидрофобных связей, заряд в которых распределяется асимметрично, так что отрицательный заряд сконцентрирован снаружи олигомера. Это позволяет В23 взаимодействовать как с гистонами хроматина, так и с нуклеиновыми кислотами, а также с различными по заряду белками. Пентамеры могут объединяться в декамер, сохраняющий структурную пластичность благодаря “гибкому” межмолекулярному интерфейсу. Фосфорилирование Тhr95 или Ser125 сдвигает термодинамическое равновесие в сторону мономерной формы и тем самым увеличивает доступность киназ к остаткам, которые скрыты в пентамерных “складках”, таких как Ser48 и Ser88 (Mitrea et al., 2014).
Олигомеризация В23 in vivo в виде гексамера усиливает экспрессию целого ряда генов, что указывает на онкогенную активность В23 (Okuwaki, 2008; Kuramitsu et al., 2010). Формирование мультимеров В23 возможно за счет посттрансляционных модификаций молекулы, чаще всего – фосфорилирования. В последнее время предложены подходы к ингибированию процессов олигомеризации и деградации В23 путем связывания его с соответствующими лигандами. Это позволяет рассматривать нуклеофозмин как перспективную мишень для молекулярно-направленной терапии быстрорастущих и устойчивых к стандартной химиотерапии опухолей человека (Di Matteo et al., 2016).
Взаимодействие мономера В23 с белком теплового шока HLJ1 приводит к снижению уровня экспрессии генов с последующим замедлением клеточной пролиферации и роста опухоли (Chang et al., 2010).
Олигомерная форма В23 важна для ядерной локализации белка и регуляции клеточной пролиферации, в то время как мономерная форма белка участвует в ответе на повреждение ДНК и в индукции апоптоза (Koike et al., 2010).
Большое значение имеет локализация В23 в клетке на протяжении определенной фазы клеточного цикла: в ядерном матриксе В23 регулирует сборку функционального комплекса кинетохора и взаимодействует с РНК-ассоциированным белком CENP-W (Mitrea, Kriwacki, 2012); в интерфазе во время экспоненциальной фазы роста клеток В23 локализуется в ядрышках в гранулярном компоненте, где проходят поздние этапы сборки предшественников рибосом (Smetana et al., 1984; Spector et al., 1984). В плотном фибриллярном компоненте наблюдается совместная локализация В23 с С23 (Biggiogera et al., 1989). В непролиферирующих клетках или в стационарной фазе роста В23 локализован в нуклеоплазме (Yun et al., 2003). Однако в составе ядерного матрикса опухолевых клеток человека на долю В23 приходится около 23% от суммарного содержания белков матрикса. Отметим, что в моноцитах В23 обнаружен и в составе (FL)-специфических рецепторов, представленных на плазматической мембране в виде высокомолекулярных комплексов (Brandt et al., 2004). Условием для ядрышковой локализации В23 является наличие во-первых, двух остатков триптофана Trp288 и Trp290, которые предположительно обеспечивают нужную вторичную структуру В23 для его связывания с нуклеиновыми кислотами (Nishimura et al., 2002), во-вторых, двух остатков лизина Lys263 и Lys267 (Choi et al., 2008; Grummitt et al., 2008).
Экспрессия, локализация и олигомеризация молекул В23 опосредуют про- или антиапоптотические свойства этого белка, важные как для нормальной, так и для опухолевой клетки.
ФУНКЦИИ В23 В НОРМАЛЬНОЙ И ОПУХОЛЕВОЙ КЛЕТКЕ
Нуклеофозмин является многофункциональным регуляторным и транспортным белком-шапероном и выполняет различные функции.
Роль В23 в регуляции репликации, транскрипции и репарации ДНК
В процессе репликации ДНК молекулы В23 связываются с белком pRB, стимулируя активность ДНК-полимеразы-α (Takemura et al., 1994, 1999). Показано, что in vitro В23 усиливает репликацию ДНК аденовируса и ряда других вирусов (Takemura et al., 1999). Нуклеофозмин регулирует транскрипцию ДНК несколькими способами:
1) стимулирует транскрипцию, опосредованную РНК-полимеразой II, путем связывания В23 с промоторами ряда генов и с онкобелком с-Myc (Li et al., 2008). В23 участвует в регуляции метаболизма c-Myc и поэтому может повлиять на рост и злокачественную трансформацию клеток (Bonetti et al., 2008).
2) В23 взаимодействует с HEXIM1 – негативным регулятором РНК-полимеразы II и активирует транскрипцию ДНК (Gurumurthy et al., 2008).
3) При ацетилировании коровых гистонов и нуклеофозмина усиливается транскрипция, поскольку ацетилированный В23 участвует в деградации нуклеосом. Ацетилированный В23 встречается, главным образом, в нуклеоплазме в комплексе с РНК-полимеразой II (Swaminathan et al., 2005).
4) Связываясь с YY1, IRF1, p53, NFκB и другими транскрипционными факторами В23 может функционировать как корепрессор или коактиватор транскрипции (Liu et al., 2007).
5) В23 участвует в регуляции транскрипции генов РНК-полимеразой I в ядрышке (Murano et al., 2008) и активирует транскрипционный фактор TAF(I)48, контролирующий транскрипцию генов рРНК (Bergstralh et al., 2007). Активность РНК-полимеразы I напрямую регулируется белками-супрессорами опухолей (например, p53) и онкогенами (c-Myc) (White, 2008). Как c-Myc, так и В23 связываются с участками рДНК в ядрышковом хроматине и активируют транскрипцию, опосредованную РНК-полимеразой I, поэтому гиперэкспрессия В23 усиливает синтез рРНК, индуцированный белком c-Myc (Arabi et al., 2005; Grandori et al., 2005). Известно, что эти белки активируют транскрипцию с промоторов, регулируемых РНК-полимеразой II, что критично для регуляции клеточного роста и злокачественной трансформации клеток.
Таким образом, В23 играет важную роль в транскрипции, опосредованной РНК-полимеразами I и II.
При репарации повреждений ДНК в нормальной клетке В23 переносит р14 в ядро и обеспечивает взаимодействие р14 с фактором MDM2 с последующей активацией р53. Однако связывание В23 с р14/ARF в ядрышке препятствует этой активации (Gjerset, 2006). Функционирование В23 как анти- или проапоптозного белка в процессе репарации обусловлено высоким уровнем экспрессии В23.
От уровня экспрессии В23 зависит также и функциональная активность АРЕ1 – основной неспецифичной эндонуклеазы для эксцизионной репарации нуклеотидов (BER) у млекопитающих. Нуклеофозмин модулирует активность BER, контролируя уровень экспрессии гена BER и ядерную локализацию этого белка (Poletto et al., 2014).
Нормальное функционирование комплекса белков, включающего BRCA2, B23 и ROCK II, обеспечивает безошибочность клеточных делений и прохождение клеточного цикла. Этот белковый комплекс контролирует также репарацию ДНК, регулирует транскрипцию и скорость пролиферации клеток (Wang et al., 2011).
Участие В23 в стабилизации структуры и в сплайсинге мРНК
Нуклеофозмин обладает РНК-связывающей и эндонуклеазной активностями (Dabbous et al., 2011), а также участвует в полиаденилировании мРНК (Palaniswamy et al., 2006). Показано, что В23, фосфорилированный по треонину Thr199, полностью или частично ингибирует сплайсинг пре-мРНК (Tarapore et al., 2006).
Нокдаун В23 с помощью малых интерферирующих РНК нарушает процессинг пре-РНК (в частности, 28S рРНК), а блокировка его перемещения между ядром и цитоплазмой подавляет экспорт рибосомных субъединиц, что приводит к снижению скорости роста клеток (Itahana et al., 2003).
Роль В23 в контроле клеточного цикла и отдельных фаз митоза
Факты о содержании В23 в фазе митоза немногочисленны и противоречивы. Согласно одним данным (Jiang, Yung, 1999), уровень экспрессии мРНК В23 возрастает на ранних стадиях митоза – в прометафазе и метафазе. Однако в других исследованиях обнаружено повышение уровня В23 вскоре после митоза (Okuda et al., 2000), подавление синтеза В23 экспрессией антисенс-олиго-РНК, комплементарной его мРНК, приводит к задержке клеток в предмитотическом периоде (Jiang, Yung, 1999). Кроме того, в N-концевом домене В23 был обнаружен новый сайт фосфорилирования по остатку серина Ser4 G2-специфической киназой Plk-1 (Polo-like kinase-1). Замена этого аминокислотного остатка в молекуле В23 на остаток аланина приводит к аберрациям митоза, например множественной полярности, обусловленной аномальным количеством центросом в митозе (Zhang et al., 2004). С помощью иммуноцитохимического окрашивания in situ было показано, что в митозе В23 локализуется в четырех основных зонах: в цитоплазме, рибонуклеопротеидном перихромосомальном слое, на полюсах деления и в цитоплазматических гранулах NDF (nucleolar derived foci)/PNB (prenuclear bodies)-фиброгранулярных рибонуклеопротеидных предшественниках ядрышек, причем локализация В23 в процессе митоза изменяется. На ранней стадии митоза в профазе начинается деградация функциональной ядрышковой структуры, происходит равномерное перераспределение большей части белка В23 в нуклеоплазму, а после реорганизации ядерной оболочки в прометафазе – в цитоплазму, где В23 локализован в течение всего безъядерного периода деления клетки (Zatsepina et al., 1997). Однако, вместе с доминирующей цитоплазматической фракцией, часть молекул В23 в митозе концентрируется в околохромосомном слое и на полюсах деления, где он взаимодействует, очевидно, с белками цитоскелета (Okuda et al., 2000). Было показано, что уровень фосфорилирования В23 в цитоплазме значительно выше, чем в околохросомном слое и полюсах деления (Okuwaki et al., 2002). В поздней анафазе in situ наблюдалось одновременное ослабление сигнала белка В23 в полюсах деления и значительное усиление его сигнала в околохромосомном слое, сопровождающееся образованием цитоплазматических частиц PNB-преядрышковых производных, содержащих белок В23. В ранней телофазе, с началом восстановления ядерной оболочки, гранулы PNB активно скапливаются в перинуклеарной области цитоплазмы и сливаются с ядрышкоорганизующими районами хромосом до их полной деградации на границе фаз M/G, что косвенно подтверждает гипотезу об их участии в инициации сборки постмитотических ядерных структур в телофазе (Zatsepina et al., 1997). По мере восстановления ядерной оболочки наблюдалось постепенное уменьшение уровня белка В23 в цитоплазме. Вплоть до полного исчезновения его цитоплазматической фракции в фазе G1. Этот процесс совпадает с распадом комплекса циклин Е/CDK2, фосфорилирующего В23 в митозе.
Участие В23 в сборке митотического веретена, цитоскелета и центромер
При образовании веретена деления молекулы В23 формируют околохромосомный слой белков, который составляет основу созревающих рибосомных субъединиц и гранулярного компонента ядрышек.
Нуклеофозмин играет важную роль в дупликации центросом. Показано, что в интерфазе молекулы В23 связаны с неразделившейся центросомой и впоследствии высвобождаются путем фосфорилирования по треонину Thr199 киназой cdk2/cyclin E, что инициирует дупликацию центросомы (Okuda et al., 2000). Известно, что молекулы В23 связываются с комплексом, содержащим CENPA (Centromere protein A) (Foltz et al., 2006).
Роль В23 в регуляции биогенеза рибосом
Как правило, в опухолевых клетках наблюдается гиперэкспрессия гена NPM и высокий уровень белка В23, что обусловливает усиление транскрипции рибосомных генов, обеспечивает транспорт в цитоплазму рибосомных субъединиц и репликацию ДНК в S-фазе митоза (Lindstrom, 2011).
Нуклеофозмин может связываться с незрелыми рибосомными частицами, в частности, с субъединицей 60S, функционируя как фактор сборки рибосом (Yu et al., 2006). В клетках in vitro В23 способствует разрезанию пре-рРНК, проявляя эндорибонуклеазную активность и обеспечивая созревание транскрипта рРНК. Кроме того, В23 контролирует процесс созревания рРНК (Pfister, D’Mello, 2015) и напрямую взаимодействует с рядом рибосомных белков, например, с RPL5 (Yu et al., 2006), RPS9 (Lindström, Zhang, 2008) и RPL23 (Wanzel et al., 2008).
Гиперэкспрессия В23 индуцирует c-Myc-зависимый синтез рРНК в ядрышке за счет усиления c-Myc-опосредованного синтеза рРНК. Кроме того, высокий уровень экспрессии В23 приводит к накоплению c-Myc в ядрышках и усиливает его протеолиз, а также c-Myc-опосредованный синтез рРНК (Lindstrom, 2011).
Участие В23 в модификации, синтезе и деградации белков
Показано, что В23 препятствует агрегации и тепловой денатурации некоторых белков, способствует ренатурации денатурированных белков и специфически связывает денатурированные субстраты (Szebeni, Olson, 1999; Pfister, D’Mello, 2015).
В23 как регулятор апоптоза
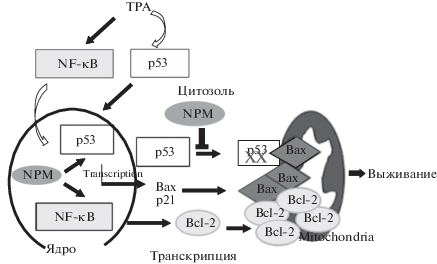
Взаимодействие между молекулами р53 и В23 может привести как к апоптозу, так и к выживанию клеток, в зависимости от присутствия р53 в митохондриях. В нормальных клетках стресс активирует р53 и транслокацию белка Вах в митохондрии, что индуцирует апоптоз. Нуклеофозмин стабилизирует р53 в ядре и активирует гены-мишени р53, включая Bax, а также транскрипционный фактор NF-κВ и его гены-мишени, включая Bcl-2. В опухолевых клетках с высоким уровнем нуклеофозмина в цитозоле В23 связывается с р53 и блокирует его локализацию в митохондриях. Это защищает клетку от апоптоза, несмотря на повышение экспрессии Вах (рис. 1).
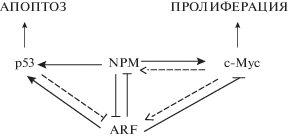
Как описывалось ранее, экспрессия В23 важна для стабилизации молекул белка ARF, подавляющего клеточную пролиферацию посредством р53-зависимых и р53-независимых механизмов. Известно, что В23 взаимодействует с белком-супрессором р53, ингибируя или активируя р53 в зависимости от активности c-Myc и ARF (рис. 2).
Онкогенный c-Myc рекрутирует ARF, что приводит к активации р53 и апоптозу посредством ингибирования Mdm2. Кроме того, ARF может связываться с c-Myc и опосредует р53-независимый апоптоз. При взаимодействии В23 и с-Myc активируется клеточная пролиферация и трансформация. В зависимости от баланса уровней экспрессии указанных белков наступает или апоптоз или злокачественная трансформация (Li et al., 2008).
В ядрышке В23 взаимодействует с супрессором р14ARF, усиливая его деградацию с последующим апоптозом. Однако В23 может связываться также и с молекулами MDM2, ингибируя взаимодействие между р53 и MDM2 и защищая супрессор р53 от деградации, что приводит к индукции апоптоза (Mascaux et al., 2008; Hamilton et al., 2014).
Нуклеофозмин – белок, меняющий локализацию не только в процессе клеточного цикла, но и в ходе апоптоза, хотя зачастую местонахождение В23 в ядрышках прослеживается вплоть до последних стадий клеточной гибели (Martelli et al., 2000). Обнаружено, что транслокация В23 из ядрышка в нуклеоплазму коррелирует с цитотоксичностью целого ряда апоптотических агентов. Выход В23 из ядрышка является начальной стадией сегрегации клеток, при этом усиливается расщепление ДНК ядрышек нуклеазами (Liu, Yung, 1998). Действительно, транслокация В23 опережает такие события, как конденсация хроматина и ДНК-фрагментация. Фазы апоптоза коррелируют со степенью транслокации В23 из ядра. Не исключено, что белок В23 регулирует различные апоптотические сигналы.
В большинстве случаев при индукции апоптоза по разным причинам наблюдалось уменьшение количества В23. Так, снижение уровня В23 при апоптозе клеток HL-60 после инкубации их с берберином и натрий бутиратом/ванадатом было связано с уменьшением количества мРНК NPM и с падением теломеразной активности (Liu, Yung, 1998; Wu et al., 1999). Однако апоптоз в клетках этой же линии, вызванный ретиноевой кислотой, ассоциирован с взаимодействием В23 и IRF-1, с активацией каспазы 3 и уменьшением количества В23 за счет опосредованного каспазой протеолиза (Hsu, Yung, 2000). В ряде работ авторы связывают уменьшение количества В23 с появлением двух взаимно связанных сигналов, включающих дефосфорилирование белка и экспрессию протеазы, активной по отношению к дефосфорилированной форме В23 (Tawfic et al., 1993, 1995; Patterson et al., 1995). Фосфорилирование В23 киназой CDK2 защищает этот белок от апоптоз-зависимой деградации (Tawfic et al., 1995). Протеаза, ответственная за деградацию матричных белков, включая В23, точно неизвестна, в этот процесс могут быть включены, помимо каспаз, и другие протеазы. Уменьшение концентрации В23 и его заряда может повлиять как на сборку рибосом, так и на целостность ядерного матрикса и привести к изменению экспрессии генов, ассоциированных с программируемой клеточной гибелью.
Известно, что гиперэкспрессия В23 понижает чувствительность опухолевых клеток к апоптозу и увеличивает теломеразную активность (Ye, 2005), что приводит к выживанию клеток с поврежденным геномом и часто служит причиной ряда тяжелых заболеваний. Это связано с активным участием В23 в процессах репарации ДНК. Показано, что действие УФ на эмбриональные фибробласты мыши, диплоидные фибробласты человека или различные линии опухолевых клеток, содержащих эндогенный р53, сопровождается индукцией транскрипции и экспрессии В23 (Wu, Yung, 2002).
При стрессе, вызванном гипоксией или УФ-излучением, экспрессия В23 усиливается (Wu, Yung, 2002; Yang et al., 2002), наблюдается его транслокация из ядрышка в нуклеоплазму, где В23 связывается с р53 и ингибирует его транскрипционную активность, нарушая фосфорилирование р53 по остатку Ser15. При этом индукции апоптоза не происходит (Kurki et al., 2004a,b).
Роль В23 в регуляции сигналинга
Известно, что В23 стабилизирует уровень К-Ras на плазматической мембране, что приводит к увеличению кластерной фракции К-Ras с последующей активацией МАРК сигнального пути (Inder et al., 2009).
Факторы роста индуцируют формирование комплекса В23 с Akt как в ядрышке, так и в цитоплазме, где необходима активация Akt, причем С-концевой участок В23 связывается с РН-доменом Akt. Протеолитическая деградация комплекса Akt–В23 каспазой 3 повышает выживаемость клеток. Сумоилирование и стабилизация В23 специфически регулируются изоформой Akt2, а ядерная фракция Akt вовлечена в В23-опосредованную регуляцию клеточного цикла. Молекулы Akt, локализованные в ядре, связываются с В23 и стабилизируют этот белок в нуклеоплазме (Lee et al., 2008).
Участие В23 в сборке нуклеосом
Молекулы В23 могут взаимодействовать с гистонами H3, H4, H2A и H2B и тем самым регулировать сборку нуклеосом, ремоделирование хроматина и модификацию гистонов с участием ряда ферментов (Grisendi et al., 2006).
Транспорт белков и передача сигналов
Благодаря транспортной функции В23, обеспечивается импорт и экспорт рибосомных белков в ядро и из ядра к месту их синтеза, транспорт ядрышковых белков, а также вирусных белков Rev, Rex и Tat в ядрышко ( Falini et al., 2009a,b; Sheng, Zhang, 2010). Известно, что В23 переносит положительно заряженные рибосомные белки из цитоплазмы в ядро (Yu et al., 2006).
МУТАЦИИ ГЕНА NPM В ОПУХОЛЕВЫХ КЛЕТКАХ
В большинстве опухолей наблюдается повышенный уровень экспрессии В23 и его колокализация с белками-продуктами онкогенов или генов-супрессоров c-Fos, c-Myc, p53 и рRb, как в клетках гепатокарциномы человека линии SMMC-772 (Krause, Hoffmann, 2010).
Гиперэкспрессия NPM обусловлена индукцией промотора, например, при связывании его с белком Myc, и связана также с мутациями в различных экзонах этого гена. Наиболее полно такие мутации исследованы при гемобластозах, включая острый миелобластный лейкоз (ОМЛ). В большинстве этих опухолей обнаружена гиперэкспрессия гена NPM в результате сдвига рамки считывания на 3'-конце мРНК. Мутации гена NPM приводят к нарушению цитоплазматической локализации В23, что, в свою очередь, активирует клеточную пролиферацию и канцерогенез (Falini et al., 2009a,b). Описано более 50 мутаций гена NPM, большинство из которых выявлено у больных ОМЛ. До 80% всех известных мутаций картировано в экзоне 12 этого гена и обусловливает структурные изменения на С-конце молекулы В23. Наиболее частая из описанных мутаций приводит к замене остатков триптофана Trp288 и Trp290, определяющих локализацию мотива – дополнительного сигнала ядерного экспорта. Это вызывает накопление мутантного белка в цитоплазме.
Пока нет убедительных данных о том, что потеря аллелей (LOH) гена NPM приводит к нарушению клеточного цикла, к индукции апоптоза и другим процессам. Мутантная цитоплазматическая изоформа В23 подавляет р53/ARF-зависимую супрессию и активирует онкогенный c-Myc-зависимый рост клеток, способствуя развитию опухоли (Adachi et al., 1993).
Остаток лизина Lys263 в сайте связывания обеспечивает взаимодействие В23 с АТФ. Замена Lys263 на аспарагин (К263N) нарушает связывание В23 с АТФ. В то время как дикий тип В23 локализуется в ядрышке, мутантный В23 K263N распределяется по всему ядру, от ядрышка до нуклеоплазмы. Молекулы мутантного В23 K263N неустойчивы и быстро деградируют. Недостаток АТФ блокирует транслокацию В23 из ядрышка в нуклеоплазму (Finch, Chan, 1996). Показано, что В23 является стабильным белком с периодом полураспада более суток, в то время как мутантный В23 К263N не связывается с В23 и деградирует в течение 10 ч. Таким образом, одной из вероятных причин повышенной нестабильности В23 может быть аминокислотная замена К263N и локализация В23 в нуклеоплазме. Известно, что уровень белка В23 коррелирует с клеточной пролиферацией. Мутация K263N усиливает нестабильность В23 через убиквитинирование и протеосомную деградацию, влияющих на пролиферацию клеток. Усиление экспрессии В23 дикого типа приводит к увеличению скорости пролиферации, в то время как В23 К263N снижает скорость пролиферации. Таким образом, мутации могут привести к структурным изменениям молекулы В23, что приводит в нестабильной форме белка и к отсутствию митогенетического эффекта.
С-концевой участок молекулы В23 важен для взаимодействия с нуклеиновыми кислотами, а обогащенный остатками лизина мотив связывается с АТФ (Chang et al., 1998). Показано, что аминокислотный мотив PI(3,4,5)Р3 напрямую связывается с С-концевым доменом B23, ингибируя фрагментацию ДНК в ядре. Более того, К263 является специфическим сайтом связывания АТФ с B23, и его замена приводит к перемещению молекул В23 дикого типа из ядрышек с ингибированием повторного входа белка в ядрышки. Известно также, что мутация K263N приводит к усилению нестабильности и к деградации В23, что способствует снижению скорости клеточной пролиферации.
Показано, что Lys263 является основным сайтом сумоилирования в молекуле В23, и мутация К263R нарушает локализацию нуклеофозмина в центросомах и его агрегирование в ядрышках (Liu et al., 2007). Нуклеофозмин транслоцируется из ядрышка в нуклеоплазму в период стационарной фазы роста опухоли или в результате воздействия некоторых противоопухолевых препаратов. При низком содержании АТФ делокализация В23 из ядрышек блокируется, и вновь синтезированная рРНК сохраняется в ядрах. Однако пока не ясно, как белок В23 К263 (R или N) выходит из ядрышка. Предполагается, что конформационные изменения и выход В23 увеличивают нестабильность молекул нуклеофозмина путем убиквитинирования и протеосомной деградации. При определенных обстоятельствах наблюдается стабилизация В23 за счет связывания с АТФ с последующей локализацией в ядрышке и, в конечном итоге, активная пролиферация клеток (Choi et al., 2008). За локализацию в ядрышках отвечает мотив, содержащий 2 остатка триптофана Trp288, предположительно обеспечивающих правильную структуру аминокислотной последовательности для связывания с нуклеиновыми кислотами, и 2 остатка лизина – Lys263 и Lys267.
Для реализации шаперонной активности В23 необходима олигомеризация и наличие N-концевого цистеинового остатка Cys21. Замена Cys21 на фенилаланин или триптофан резко снижает способность В23 к формированию олигомерных структур высших порядков, а замена на фенилаланин ингибирует шаперонную активность В23. Мутации C21F или C21W нарушали образование пентамера В23, но замена С21S, напротив, стабилизирует димерную форму В23. Мутантный белок с заменой C21F не образует олигомеры с эндогенным В23 дикого типа (Prinos et al., 2010). Мутации L42A и L44A блокируют ядерный экспорт В23 (Yu et al., 2006). Замена L102A в последовательности 94-ITPPVVLRL-102 блокирует не только ядерный экспорт, но и перемещение В23 между ядром и цитоплазмой (Pearson et al., 2012).
Мутации гена NPM чаще встречаются при ОМЛ. В основном, они представлены хромосомными транслокациями, например NPM1-ALK, NPM1-RARα, NPM1-MLF1, и недавно обнаруженными при других формах лейкоза и лимфомах – NPM1-TYK2 и NPM1-HAUS1. Ключевой особенностью этих транслокаций является сохранение N-концевого домена белка В23.
Мутантный белок NPM1-ALK t(2;5)(p23;q35) активирует несколько нижестоящих сигнальных путей, таких как STAT3 (Chiarle et al., 2005; Staber et al., 2007), MEK/ERK (Slupianek et al., 2001; Watanabe et al., 2005) и PI3K/AKT (Redner et al., 2000). Эти сигнальные пути поддерживают рост клеток, ингибируют апоптоз и способствуют миграции клеток. Указанная транслокация чаще всего встречается при анапластической крупноклеточной лимфоме.
Мутантный белок NPM1-RARα t(5;17)(q35; q21) может изменять экспрессию генов, чувствительных к ретиноидам, положительным или отрицательным образом, в зависимости от контекста промотора, а также нарушать транскрипционную активацию различных генов, обусловливая фенотип острого промиелоцитарного лейкоза (Pollock et al., 2014). В лейкозных клетках экспрессируются как NPM-RAR, так и RAR-NPM – продукты реципрокной транслокации этих генов. Экспрессия TGFβ более чем наполовину ингибирует витамин D – трансформирующую TGFβ-опосредованную дифференцировку клеток. И напротив, экспрессия RAR-NPM не изменяет витамин D/TGFβ-опосредованную дифференцировку. Таким образом, NPM-RAR, не RAR-NPM, главный медиатор ареста миелоидной дифференцировки в t(5;17) APL (Yoneda-Kato et al., 1996).
NPM1-MLF1 объединяется с антиапоптотическими онкопротеинами и может играть важную роль в многоступенчатом прогрессировании от миелодиспластического синдрома до ОМЛ (Velusamy et al., 2014).
NPM1-TYK2 t(5q35)(19p13) приводит к конститутивной активации киназы TYK2, в свою очередь, активируя нижестоящие эффекторные молекулы, такие как STAT1, STAT3 и STAT5. Известно, что в мутантных клетках NPM1-TYK2 с дефектной киназой передачи сигналов STAT не происходит.
Химерный белок NPM1-HAUS1 t(5;18)(q35;q21) способствует лейкемогенезу путем инактивации В23 за счет его связывания и транслокации в цитозоль (Ruggero, Pandolfi, 2003).
ВЗАИМОДЕЙСТВИЕ В23 С ДРУГИМИ МОЛЕКУЛАМИ, ПРО- И АНТИАПОПТОТИЧЕСКИЕ СВОЙСТВА
Нуклеофозмин может функционировать как потенциальный опухолевый супрессор, активность которого, в отличие от типичных супрессоров, зависит не только от уровня экспрессии В23 в клетке, но и от его локализации в ядрышке, нуклеоплазме или цитоплазме, а также от функционального статуса р53 и ARF (Hingorani et al., 2000). Кроме того, при повышении уровня экспрессии В23 усиливается биогенез рибосом и подавляется апоптоз (Grisendi et al., 2006; Karhemo et al., 2011).
В клетках немелкоклеточного рака легкого человека линий CL1-0 и CL1-5 выявлены олигомеры В23. Степень олигомеризации зависит от активности белка теплового шока HLJ1. После формирования гетеродимеров HLJ1–В23 происходит рекрутирование регуляторного белка-корепрессора АР2α к промотору гена, кодирующего матричную металлопротеиназу ММР-2. При взаимодействии молекул В23 с HLJ1, В23 в мономерной форме участвует в регуляции (снижении) уровня экспрессии генов, что приводит к замедлению клеточной пролиферации и роста опухоли. Напротив, олигомеризация В23 in vivo в виде гексамера стимулирует экспрессию целого ряда генов, что указывает на онкогенную активность В23 (Chang et al., 2010).
Фосфорилированные молекулы В23 взаимодействуют также с белками ряда вирусов, формируя транспортный комплекс для переноса вирусных нуклеиновых кислот в ядро. Как было показано некоторыми авторами, инактивация В23 снижает репликативную способность штаммов вирусов папилломы высокого риска и экспрессию вирусных белков Е6/Е7, а также усиливает экспрессию маркеров клеточной дифференцировки in vitro и in vivo. Нокаут гена NPM в кератиноцитах, экспрессирующих вирусные белки Е6/Е7, вызывает усиление экспрессии белков-супрессоров р53 и рRb. Таким образом, В23 необходим для пролиферации и ингибирования клеточной дифференцировки в инфицированных HPV-клетках, экспрессирующих вирусные белки Е6/Е7 (табл. 2 и 3) (Takemura et al., 1999).
Таблица 2.
Антиапоптозные свойства В23
| Процесс/модификация молекулы В23 | Результат | Источник |
|---|---|---|
| Изменение уровня экспрессии В23 | Нарушение транспорта гистонов и регуляции сборки хроматина. Это приводит к нарушению процесса митоза, индуцирует геномную нестабильность и развитие опухоли | Okuwaki, 2008;
Kuramitsu et al., 2010 |
| Связывание В23 с белком р14/ARF в ядрышке | Препятствие активации белка-супрессора р53 в клетках | Gjerset, 2006 |
| Олигомеризация
мономеров В23 in vivo в виде гексамера |
Стимулирует экспрессию целого ряда генов, что указывает на онкогенную активность В23 | Okuwaki, 2008; Kuramitsu et al., 2010 |
| Фосфорилирование молекул В23 и его взаимодействие с белками ряда вирусов | Формирование транспортного комплекса для переноса вирусных нуклеиновых кислот в ядро | Takemura et al., 1999 |
Таблица 3.
Проапоптозные свойства В23
| Процесс | Результат | Источник |
|---|---|---|
| Повреждение ДНК, В23 транспортирует р14 в ядро | Обеспечение взаимодействия р14 с фактором MDM2, которое приводит к активации р53 | Gjerset, 2006 |
| Нормальное функционирование комплекса белков BRCA2-В23-Rho-зависимая полимераза ROCK II | Безошибочность клеточных делений и скорость прохождения клеточного цикла, этот комплекс также обеспечивает репарацию ДНК, регулирует транскрипцию и нормальную пролиферацию клеток | Chang et al., 2010 |
| Взаимодействие молекул В23 и белка теплового шока HLJ1, В23 представлен мономерной формой | Участие в снижении уровня экспрессии генов. В итоге пролиферация и рост опухоли замедляются | Okuwaki, 2008;
Kuramitsu et al., 2010 |
| Инактивация В23 | Снижение репликативной способности штаммов папиллома-вирусов высокого риска и экспрессии вирусных белков Е6/Е7, а также усиление экспрессии маркеров клеточной дифференцировки in vitro и in vivo | Takemura et al., 1999 |
| Нокаут NPM в кератиноцитах, экспрессирующих вирусные белки Е6/Е7 | Вызывает усиление экспрессии белков-супрессоров р53 и рRb | McCloskey et al. 2010 |
Связь между В23 и ядерным фактором NF-κB – основным фактором транскрипции, играет решающую роль в инициации, развитии и прогрессировании опухоли. В23 связывается непосредственно с ДНК-связывающим доменом NF-κB, облегчая его связывание с ДНК, чтобы способствовать транскрипционной активации целевых генов (Grisendi et al., 2006).
ВЛИЯНИЕ ЭКСПРЕССИИ В23 НА ОПУХОЛЕВУЮ ПРОГРЕССИЮ
Было показано, что в активно пролиферирующих опухолевых клетках уровень В23 выше, чем в нормальных (Lindstrom, 2011).
В некоторых исследованиях отмечена взаимозависимость уровней экспрессии В23, локализованного в ядрышках, ядрах и цитоплазме, и клинико-патологических характеристик. Например, выявлено снижение уровня экспрессии NPM в быстрорастущих опухолях молочной железы с плохим прогнозом заболевания. Инвазивный потенциал клеток с более высоким уровнем экспрессии нуклеофозмина снижен. На супрессорную функцию В23 в отдельных солидных опухолях указывают также результаты экспериментов с нокаутными мышами, несущими единственный инактивированный аллель гена NPM, что индуцирует рост опухоли (Yung, 2007). Однако снижение уровня экспрессии нуклеофозмина, а также ряда других белков ядерного матрикса в процессе апоптоза клеток остеосаркомы человека линии MG-63 говорит о противоположной регуляторной роли В23 (Lee et al., 2008). Таким образом, немаловажную роль играет и пониженная экспрессия В23.
ЗАКЛЮЧЕНИЕ
Нуклеофозмин/В23 – многофункциональный белок, циркулирующий между ядром и цитоплазмой. Он играет ключевую роль в большинстве жизненно важных клеточных процессов, регулирует скорость прохождения клеточного цикла, сборку веретена деления, структуру хроматина и G-квадруплекса, транспорт и фолдинг белков, клеточный сигналинг, ангиогенез и апоптоз, регулирует процессы созревания рибосом, сборки хроматина и внутриклеточный транспорт молекул. Механизмы этих процессов изучены недостаточно. Фосфорилирование и дефосфорилирование молекул В23 играют важную роль при репарации повреждений ДНК, обусловленных облучением и генотоксическим стрессом, и регулирует апоптоз, что важно учитывать при химиолучевой терапии новообразований. Однако роль В23 в канцерогенезе неоднозначна, поскольку он может функционировать и как онкоген, и как опухолевый супрессор. Локализация В23 в ядрышке и ядре, его взаимодействие с множеством регуляторных белков и участие в важнейших клеточных функциях позволяет рассматривать этот белок в качестве атипичного опухолевого супрессора. Поэтому растет интерес к В23 как к потенциальной мишени для таргетной терапии опухолей.
Список литературы
Adachi Y., Copeland T., Hatanaka M. Nucleolar targeting signal of Rex protein of human T-cell leukimia virus type I specifically binds to nucleolar shuttle protein B23 // J. Biol. Chem. 1993. V. 268. P. 13930–13934.
Arabi A., Wu S., Ridderstråle K. c-Myc associates with ribosomal DNA and activates RNA polymerase I transcription // Nat. Cell Biol. 2005. V. 7. P. 303–310.
Bañuelos S., Lectez B., Taneva S.G. et al. Recognition of intermolecular G-quadruplexes by full length nucleophosmin. Effect of a leukaemia-associated mutation // FEBS Lett. 2013. V. 587. P. 2254–2259.
Bergstralh D.T., Conti B.J., Moore C.B. et al. Global functional analysis of nucleophosmin in Taxol response, cancer, chromatin regulation, and ribosomal DNA transcription // Experim. Cell Res. 2007. V. 317. P. 65–76.
Biggiogera M., Fakan S., Kaufmann S.H. Simultaneous immunoelectron microscopic visualization of protein B23 and C23 distribution in the HeLa cell nucleolus // J. Histochem. Cytochem. 1989. V. 37. P. 1371–1374.
Bolli N., De Marco M.F., Martelli M.P. et al. A dosedependent tug of war involving the NPM1 leukaemic mutant, nucleophosmin, and ARF // Leukemia. 2009. V. 23. P. 501–509.
Bolli N., Nicoletti I., De Marco M.F. et al. Born to be exported: COOH-terminal nuclear export signals of different strength ensure cytoplasmic accumulation of nucleophosmin leukemic mutants // Cancer Res. 2007. V. 67. P. 6230–6237.
Bonetti P., Davoli T., Sironi C. et al. Nucleophosmin and its AML-associated mutant regulate c-Myc turnover through Fbw7γ // J. Cell Biol. 2008. V. 182. P. 19–26.
Brandt R., Nawka M., Kellermann J. Nucleophosmin is a component of the fructoselysine-specific receptor in cell membranes of Mono Mac 6 and U937 monocyte-like cells // Biochim. Biophys. Acta. 2004. V. 1670. P. 132–136.
Chan P.K., Chan F.Y., Morris S.W., Xie Z. Isolation and characterization of the human nucleophosmin/B23 (NPM) gene: identification of the YY1 binding site at the 5' enhancer region // Nucl. Acids. Res. 1997. V. 25. P. 1225–1232.
Chang J.H., Lin J.Y., Wu M.H., Yung B.Y. Evidence for the ability of nucleophosmin/B23 to bind ATP // Biochem. J. 1998. V. 329. P. 539–544.
Chang J.H., Olson M.O. Structure of the gene for rat nucleolar protein B23 // J. Biol. Chem. 1990. V. 265. P. 18227–18233.
Chang T.P., Yu S.-L., Lin S.-Y. et al. Tumor suppressor HLJ1 binds and functionally alters nucleophosmin via activating enhancer binding protein 2α complex formation // Cancer Res. 2010. V. 70. P. 1656–1667.
Chiarle R., Simmons W.J., Cai H. et al. Stat3 is required for ALK-mediated lymphomagenesis and provides a possible therapeutic target // Nat. Med. 2005. V. 11. P. 623–629.
Ching R.H., Lau E.Y., Ling P.M. Phosphorylation of nucleophosmin at threonine 234/237 is associated with HCC metastasis // Oncotarget. 2015. V. 6. P. 43483–43495.
Choi J.W., Lee S.B., Kim C.K. et al. Lysine 263 residue of NPM/B23 is essential for regulating ATP binding and B23 stability // FEBS Lett. 2008. V. 582. P. 1073–1080.
Colombo E., Alcalay M., Pelicci P.G. Nucleophosmin and its complex network: a possible therapeutic target in hematological diseases // Oncogene. 2011. V. 30. P. 2595–2609.
Cordell J.L., Pulford K.A., Bigerna B. et al. Detection of normal and chimeric nucleophosmin in human cells // Blood. 1999. V. 93. P. 632–642.
Dabbous M., Jefferson M., Haney L. Biomarkers of metastatic potential in cultured adenocarcinoma clones // Clin. Exp. Metastasis. 2011. V. 93. P. 101–111.
Di Matteo A., Franceschini M., Chiarella S. Molecules that target nucleophosmin for cancer treatment an update // Oncotarget. 2016. V. 7. P. 44821–44840.
Endo A., Matsumoto M., Inada T. Nucleolar structure and function are regulated by the deubiquitylating enzyme USP36 // J. Cell Sci. 2009. V. 122. P. 678–686.
Falini B., Bolli N., Liso A. Altered nucleophosmin transport in acute myeloid leukaemia with mutated NPM1: molecular basis and clinical implications // Leukemia. 2009a. V. 23. P. 1731–1743.
Falini B., Macijewski K., Weiss T. et al. Multilineage dysplasia has no impact on biologic, clinicopathologic, and prognostic features of AML with mutated nucleophosmin (NPM1) // Blood. 2010. V. 115. P. 3776–3786.
Falini B., Sportoletti P., Martelli M.P. Acute myeloid leukemia with mutated NPM1: diagnosis, prognosis and therapeutic perspectives // Curr. Opin. Oncol. 2009b. V. 21. P. 573–581.
Finch R.A., Chan P.K. ATP depletion affects NPM translocation and exportation of rRNA from nuclei // Biochem. Biophys. Res. Commun. 1996. V. 222. P. 553–558.
Foltz D.R., Jansen L.E., Black B.E. et al. The human CENP-A centromeric nucleosome-associated complex // Nat. Cell Biol. 2006. V. 8. P. 458–469.
Gjerset R. DNA damage, p14ARF, nucleophosmin (NPM1/B23), and cancer // J. Mol. Histol. 2006. V. 37. P. 239–251.
Grandori C., Gomez-Roman N., Felton-Edkins Z.A. c-Myc binds to human ribosomal DNA and stimulates transcription of rRNA genes by RNA polymerase I // Nat. Cell Biol. 2005. V. 7. P. 311–318.
Grisendi S., Mecucci C., Falini B., Pandolfi P.P. Nucleo-phosmin and cancer // Nat. Rev. Cancer. 2006. V. 6. P. 493–505.
Grummitt C.G., Townsley F.M., Johnson C.M. et al. Structural consequences of nucleophosmin mutations in acute myeloid leukemia // J. Biol. Chem. 2008. V. 283. P. 23326–23332.
Gurumurthy M., Tan C.H., Ng R. Nucleophosmin interacts with HEXIM1 and regulates RNA polymerase II transcription // J. Mol. Biol. 2008. V. 378. P. 302–317.
Haindl M., Harasim T., Eick D., Muller S. The nucleolar SUMO-specific protease SENP3 reverses SUMO modification of nucleophosmin and is required for rRNA processing // EMBO Rep. 2008. V. 9. P. 273–279.
Hamilton G., Abraham A.G., Morton J. AKT regulates NPM dependent ARF localization and p53mut stability in tumors // Oncotarget. 2014. V. 5. P. 6142–6167.
Herrera J.E., Correia J.J., Jones A.E., Olson M.O.J. Sedimentation analyses of the salt- and divalent metal ion-induced oligomerization of nucleolar protein B23 // Biochemistry. 1996. V. 35. P. 2668–2673.
Herrera J.E., Savkur R., Olson M.O. The ribonuclease activity of nucleolar protein B23 // Nucl. Acids Res. 1995. V. 23. P. 3974–3979.
Hingorani K., Szebem A., Olson M.O. Mapping the functional domains of nucleolar protein B23 // J. Biol. Chem. 2000. V. 275. P. 24451–24457.
Hsu C.Y., Yung B.Y. Over-expression of nucleophosmin/B23 decreases the susceptibility of human leukemia HL-60 cells to retinoic acid-induced differentiation and apoptosis // Int. J. Cancer. 2000. V. 88. P. 392–400.
Inder K.L., Lau C., Loo D. et al. Nucleophosmin and nucleolin regulate K-Ras plasma membrane interactions and MAPK signal transduction // J. Biol. Chem. 2009. V. 284. P. 28410–28419.
Itahana K., Bhat K.P., Jin A. Tumor suppressor ARF degrades B23, a nucleolar protein involved in ribosome biogenesis and cell proliferation // Mol. Cell. 2003. V. 12. P. 1151–1164.
Jiang P.S., Yung B.Y. Down-regulation of nucleophosmin/B23 mRNA delays the entry of cells into mitosis // Biochem. Biophys. Res. Commun. 1999. V. 257. P. 865–870.
Joukov V., Groen A.C., Prokhorova T. et al. The BRCA1/BARD1 heterodimer modulates ran-dependent mitotic spindle assembly // Cell. 2006. V. 127. P. 539–552.
Karhemo P.R., Rivinoja A., Lundin J. et al. An extensive tumor array analysis supports tumor suppressive role for nucleophosmin in breast cancer // Am. J. Pathol. 2011. V. 179. P. 1004–1014.
Koike A., Nishikawa H., Wu W. et al. Recruitment of phosphorylated NPM1 to sites of DNA damage through RNF8-dependent ubiquitin conjugates // Cancer Res. 2010. V. 70. P. 6746–6756.
Kotani H., Ito M., Hamaguchi T. The delta isoform of protein phosphatase type 1 is localized in nucleolus and dephosphorylates nucleolar phosphoproteins // Biochem. Biophys. Res. Commun. 1998. V. 249. P. 292–296.
Krause A., Hoffmann I. Polo-Like kinase 2-dependent phosphorylation of NPM/B23 on serine 4 triggers centriole duplication // PLoS One. 2010. V. 5. P. 9849.
Kuramitsu Y., Hayashi E., Okada F. Proteomic analysis for nucleolar proteins related to tumor malignant progression: a comparative proteomic study between malignant progressive cells and regressive cells // Anticancer Res. 2010. V. 30. P. 2093–2099.
Kurki S., Peltonen K., Laiho M. Nucleophosmin, HDM2 and p53: players in UV damage incited nucleolar stress response // Cell Cycle. 2004a. V. 3. P. 976–979.
Kurki S., Peltonen K., Latonen L. et al. Nucleolar protein NPM interacts with HDM2 and protects tumor suppressor protein p53 from HDM2-mediated degradation // Cancer Cell. 2004b. V. 5. P. 465–475.
Lawson K., Larentowicz L., Laury-Kleintop L., Gilmour S.K. B23 is a downstream target of polyamine-modulated CK2 // Mol. Cell. Biochem. 2005. V. 274. P. 103–114.
Lee S.B., Xuan Nguyen T.L., Choi J.W. et al. Nuclear Akt interacts with B23/NPM and protects it from proteolytic cleavage, enhancing cell survival // PNAS USA. 2008. V. 105. P. 16584–16589.
Li Z., Boone D., Hann SR. Nucleophosmin interacts directly with c-Myc and controls c-Myc-induced hyperproliferation and transformation // PNAS USA. 2008. V. 105. P. 18794–18799.
Lindstrom M. NPM/B23: a multifunctional chaperone in ribosome biogenesis and chromatin remodeling // Biochem. Res. Int. 2011. V. 2011. P. 195209.
Lindström M.S, Zhang Y. Ribosomal protein S9 is a novel B23/NPM-binding protein required for normal cell proliferation // J. Biol. Chem. 2008. V. 283. P. 15568–15576.
Liu H., Tan B.C-M., Tseng K.H. Nucleophosmin acts as a novel AP2α-binding transcriptional corepressor during cell differentiation // EMBO Reports. 2007. V. 8. P. 394–400.
Liu Q.R., Chan P.K. Formation of nucleophosmin/B23 oligomers requires both the amino- and the carboxyl-terminal domains of the protein // Eur. J. Biochem. 1991. V. 329. P. 715–721.
Liu W.H., Yung B.Y. Mortalization of human promyelocytic leukemia HL-60 cells to be more susceptible to sodium butyrate-induced apoptosis and inhibition of telomerase activity by down-regulation of nucleophosmin/B23 // Oncogene. 1998. V. 17. P. 3055–3064.
Lu Y.Y., Lam C.Y., Yung B.Y. Decreased accumulation and dephosphorylation of themitosis-specific form of nucleophosmin/B23 in staurosporine-induced chromosome decondensation // Biochem. J. 1996. V. 317. P. 321–327.
Martelli A.M., Robuffo I., Bortul R. et al. Behavior of nucleolar proteins during the course of apoptosis in camptothecin-treated HL60 cells // J. Cell. Biochem. 2000. V. 78. P. 264–277.
Mascaux C., Bex F., Martin B. The role of NPM, p14arf and MDM2 in precursors of bronchial squamous cell carcinoma // Eur. Respir. J. 2008. V. 32. P. 678–686.
McCloskey R., Menges C., Friedman A. et al. Human papillomavirus type 16 E6/E7 upregulation of nucleophosmin is important for proliferation and inhibition of differentiation // J. Virol. 2010. V. 84. P. 5131–5139.
Mitrea D.M., Kriwacki R.W. Cryptic disorder: an order-disorder transformation regulates the function of nucleophosmin // Pac. Symp. Biocomput. 2012. P. 152–163.
Mitrea D.M, Grace C.R, Buljan M. et al. Structural polymorphism in the N-terminal oligomerization domain of NPM1 // PNAS USA. 2014. V. 111. P. 4466–4471.
Murano K., Okuwaki M., Hisaoka M., Nagata K. Transcription regulation of the rRNA gene by a multifunctional nucleolar protein, B23/nucleophosmin, through its histone chaperone activity // Mol. Cell. Biol. 2008. V. 28. P. 3114–3126.
Negi S.S., Olson M.O. Effects of interphase and mitotic phosphorylation on the mobility and location of nucleolar protein B23 // J. Cell Sci. 2006. V. 119. P. 3676–3685.
Nishimura Y., Ohkubo T., Furuichi Y., Umekawa H. Tryptophans 286 and 288 in the C-terminal region of protein B23.1 are important for its nucleolar localization // Biosci. Biotechnol. Biochem. 2002. V. 66. P. 2239–2242.
Okuda M. The role of nucleophosmin in centrosome duplication // Oncogene. 2002. V. 21. P. 6170–6174.
Okuda M., Horn H.F., Tarapore P. Nucleophosmin/B23 is a target of CDK2/cyclin E in centrosome duplication // Cell. 2000. V. 103. P. 127–140.
Okuwaki M. The structure and functions of NPM1/Nucleophosmin/B23, a multifunctional nucleolar acidic protein // J. Biochem. 2008. V. 143. P. 441–448.
Okuwaki M., Matsumoto K., Tsujimoto M., Nagata K. Function of nucleophosmin/B23, a nucleolar acidic protein, as a histone chaperone // FEBS Lett. 2001. V. 506. P. 272–276.
Okuwaki M., Tsujimoto M., Nagata K. The RNA binding activity of a ribosome biogenesis factor, nucleophosmin/B23, is modulated by phosphorylation with a cell cycle-dependent kinase and by association with its subtype // Mol. Biol. Cell. 2002. V. 13. P. 2016–2030.
Palaniswamy V., Moraes K.C.M, Wilusz C.J, Wilusz J. Nucleophosmin is selectively deposited on mRNA during polyadenylation // Nat. Struct. Mol. Biol. 2006. V. 13. P. 429–435.
Patterson S.D., Grossman J.S., D’Andrea P., Latter G.I. Reduced numatrin/B23/nucleophosmin labeling in apoptotic Jurkat T-lymphoblasts // J. Biol. Chem. 1995. V. 270. P. 9429–9436.
Pearson J.D., Lee J.K., Bacani J.T. et al. NPM-ALK: the prototypic member of a family of oncogenic fusion tyrosine kinases // J. Signal. Transduct. 2012. V. 2012. P. 123253.
Peter M., Nakagawa J., Dorée M. et al. Identification of major nucleolar proteins as candidate mitotic substrates of cdc2 kinase // Cell. 1990. V. 60. P. 791–801.
Pfister J.A., D’Mello S.R. Insights into the regulation of neuronal viability by nucleophosmin/B23 // Experim. Biol. Med. (Maywood, N.J.). 2015. V. 240. P. 774—786.
Poletto M., Lirussi L., Wilson D.M. 3rd, Tell G. Nucleophosmin modulates stability, activity and nucleolar accumulation of base excision repair proteins // Mol. Biol. Cell. 2014. V. 25. P. 1641–1652.
Pollock S.L., Rush E.A., Redner R.L. NPM-RAR, not the RAR-NPM reciprocal t(5;17)(q35;q21) acute promyelocytic leukemia fusion protein, inhibits myeloid differentiation // Leuk. Lymphoma. 2014. V. 55. P. 1383–1387.
Prinos P., Lacoste M.C., Wong J. et al. Mutation of cysteine 21 inhibits nucleophosmin/B23 oligomerization and chaperone activity // Int. J. Biochem. Mol. Biol. 2010. V. 2. P. 24–30.
Qi W., Shakalya K., Stejskal A. NSC348884 a nucleophosmin inhibitor disrupts oligomer formation and induces apoptosis in human cancer cells // Oncogene. 2008. V. 27. P. 4210–4220.
Redner R.L., Chen J.D., Rush E.A. et al. The t(5;17) acute promyelocytic leukemia fusion protein NPM-RAR interacts with co-repressor and co-activator proteins and exhibits both positive and negative transcriptional properties // Blood. 2000. V. 95. P. 2683–2690.
Ruggero D., Pandolfi P.P. Does the ribosome translate cancer? // Nat. Rev. Cancer. 2003. V. 3. P. 179–192.
Sato K., Hayami R., Wu W. et al. Nucleophosmin/B23 is a candidate substrate for the BRCA1-BARD1 ubiquitin ligase // J. Biol. Chem. 2004. V. 279. P. 30919–30922.
Scognamiglio P.L., Di Natale C., Leone M. et al. G-quadruplex DNA recognition by nucleophosmin: new insights from protein dissection // Biochim. Biophys. Acta. 2014. V. 1840. P. 2050–2059.
Shandilya J., Swaminathan V., Gadad S.S. et al. Acetylated NPM1 localizes in the nucleoplasm and regulates transcriptional activation of genes implicated in oral cancer manifestation // Mol. Cell. Biol. 2009. V. 29. P. 5115–5127.
Sheng J., Zhang W. Identification biomarkers for cervical cancer in peripheral blood lymphocytes by oligonucleotide microarrays // Zhonghua Yi Xue Za Zhi. 2010. V. 90. P. 2611–2615.
Slupianek A., Nieborowska-Skorska M., Hoser G. et al. Role of phosphatidylinositol 3-kinase-Akt pathway in nucleophosmin/anaplastic lymphoma kinase-mediated lymphomagenesis // Cancer Res. 2001. V. 61. P. 2194–2199.
Smetana K., Ochs R., Lischwe M.A. et al. Immunofluorescence studies on proteins B23 and C23 in nucleoli of human lymphocytes // Exp. Cell Res. 1984. V. 152. P. 195–203.
Spector D.L., Ochs R.L., Busch H. Silver staining, immunofluorescence, and immunoelectron microscopic localization of nucleolar phosphoproteins B23 and C23 // Chromosoma. 1984. V. 90. P. 139–148.
Staber P.B., Vesely P., Haq N. et al. The oncoprotein NPM-ALK of anaplastic large-cell lymphoma induces JUNB transcription via ERK1/2 and JunB translation via mTOR signaling // Blood. 2007. V. 110. P. 3374–3383.
Swaminathan V., Kishore A.H., Febitha K.K., Kundu T.K. Human histone chaperone nucleophosmin enhances acetylation-dependent chromatin transcription // Mol. Cell. Biol. 2005. V. 25. P. 7534–7545.
Szebeni A., Olson M.O. Nucleolar protein B23 has molecular chaperone activities // Protein Sci. 1999. V. 8. P. 905–912.
Szebeni A., Mehrotra B., Baumann A. Nucleolar protein B23 stimulated nuclear import of the HIV-1 Rev protein and NLS-conjugated albumin // Biochemistry. 1997. V. 36. P. 3941–3949.
Takemura M., Ohta N., Furuichi Y. Stimulation of calf thymus DNA polymerase α activity by nucleolar protein B23 // Biochem. Biophys. Res. Comm. 1994. V. 199. P. 46–51.
Takemura M., Sato K., Nishio M. et al. Nucleolar protein B23.1 binds to retinoblastoma protein and synergistically stimulates DNA polymerase α activity // J. Biochem. 1999. V. 125. P. 904–909.
Tarapore P., Shinmura K., Suzuki H. Thr199 phosphorylation targets nucleophosmin to nuclear speckles and represses pre-mRNA processing // FEBS Lett. 2006. V. 580. P. 399–409.
Tawfic S., Goueli S.A., Olson M.O., Ahmed K. Androgenic regulation of the expression and phosphorylation of prostatic nucleolar protein B23 // Cell Mol. Biol. Res. 1993. V. 39. P. 43–51.
Tawfic S., Olson M.O., Ahmed K. Role of protein phosphory-lation in post-translational regulation of protein B23 during programmed cell death in the prostate gland // J. Biol. Chem. 1995. V. 270. P. 21009–21015.
Tokuyama Y., Horn H.F., Kawamura K. et al. Specific phosphorylation of nucleophosmin on Thr(199) by cyclin-dependent kinase 2-cyclin E and its role in centrosome duplication // J. Biol. Chem. 2001. V. 276. P. 21529–21537.
Tulchin N., Chambon M., Juan G. BRCA1 protein and nucleolin colocalize in breast carcinoma tissue and cancer cell lines // Am. J. Pathol. 2010. V. 176. P. 1203–1214.
Velusamy T., Kiel M.J., Sahasrabuddhe A.A. et al. A novel recurrent NPM1-TYK2 gene fusion in cutaneous CD30-positive lymphoproliferative disorders // Blood. 2014. V. 124. P. 3768–3771.
Wang H-F., Takenaka K., Nakanishi A. et al. BRCA2 and nucleophosmin coregulate centrosome ampliphication and form complex with the Rho effector kinase ROCK2 // Cancer Res. 2011. V. 71. P. 68–77.
Wang W., Budhu A., Forgues M., Wang X.W. Temporal and spatial control of nucleophosmin by the Ran-Crm1 complex in centrosome duplication // Nat. Cell Biol. 2005. V. 7. P. 823–830.
Wanzel M., Russ A.C., Kleine-Kohlbrecher D. et al. A ribosomal protein L23-nucleophosmin circuit coordinates Miz1 function with cell growth // Nat. Cell Biol. 2008. V. 10. P. 1051–1061.
Watanabe M., Sasaki M., Itoh K. et al. JunB induced by constitutive CD30-extracellular signal-regulated kinase 1/2 mitogen- activated protein kinase signaling activates the CD30 promoter in anaplastic large cell lymphoma and reed-sternberg cells of Hodgkin lymphoma // Cancer Res. 2005. V. 65. P. 7628–7634.
White RJ. RNA polymerases I and III, non-coding RNAs and cancer // Trends in Genetics. 2008. V. 24. P. 622–629.
Wu H.L., Hsu C.Y., Liu W.H., Yung B.Y. Berberine-induced apoptosis of human leukemia HL-60 cells is associated with down-regulation of nucleophosmin/B23 and telomerase activity // Int. J. Cancer. 1999. V. 81. P. 923–929.
Wu M.H., Yung B.Y. UV stimulation of nucleophosmin/B23 expression is an immediate-early gene response induced by damaged DNA // J. Biol. Chem. 2002. V. 277. P. 48234–48240.
Yang C., Maiguel D.A., Carrier F. Identification of nucleolin and nucleophosmin as genotoxic stress-responsive RNA-binding proteins // Nucl. Acids Res. 2002. V. 30. P. 2251–2260.
Yang K., Wang M., Zhao Y. et al. A redox mechanism underlying nucleolar stress sensing by nucleophosmin // Nat. Commun. 2016. V. 7. P. 13599.
Ye K. Nucleophosmin/B23, a multifunctional protein that can regulate apoptosis // Cancer Biol. Ther. 2005. V. 4. P. 918–923.
Yoneda-Kato N., Look A.T., Kirstein M.N. et al. The t(3;5)(q25.1;q34) of myelodysplastic syndrome and acute myeloid leukemia produces a novel fusion gene, NPM-MLF1 // Oncogene. 1996. V. 12. P. 265–275.
Yu Y., Maggi L.B Jr., Brady SN. Nucleophosmin is essential for ribosomal protein L5 nuclear export // Mol. Cell. Biol. 2006. V. 26. P. 3798–3809.
Yun J.P., Chew E.C., Liew C.T. Nucleophosmin/B23 is a proliferate shuttle protein associated with nuclear matrix // J. Cell. Biochem. 2003. V. 90. P. 1140–1148.
Yung BY. Oncogenic role of nucleophosmin/B23 // Chang Gung Med. J. 2007. V. 30. P. 285–293.
Zatsepina O.V., Todorov I.T., Philipova R.N. et al. Cell cycle-dependent translocations of a major nucleolar phosphoprotein, B23, and some characteristics of its variants // Eur. J. Cell. Biol. 1997. V. 73. P. 58–70.
Zeller K.I., Haggerty T.J., Barrett J.F. Characterization of nucleophosmin (B23) as a Myc target by scanning chromatin immunoprecipitation // J. Biol. Chem. 2001. V. 276. P. 48285–48291.
Zhang H., Shi X., Paddon H. et al. B23/nucleophosmin serine 4 phosphorylation mediates mitotic functions of polo-like kinase 1 // J. Biol. Chem. 2004. V. 279. P. 35726–35734.
Zhao X., Ji J., Yu L.R. Cell cycle-dependent phosphorylation of nucleophosmin and its potential regulation by peptidyl-prolyl cis/trans isomerase // J. Mol. Biochem. 2015. V. 4. P. 95–103.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии