Успехи современной биологии, 2020, T. 140, № 1, стр. 30-42
Тропонины, молекулы адгезии и интерлейкины как диагностические маркеры сердечно-сосудистых заболеваний: экспрессия в периферических тканях
Е. А. Карпасова 1, А. С. Дятлова 1, Н. С. Линькова 1, 2, *, В. А. Бунин 1, В. О. Полякова 3, 4, 5, Ю. С. Крылова 4, 6, И. М. Кветной 3, 4, 7
1 Санкт-Петербургский институт биорегуляции и геронтологии
Санкт-Петербург, Россия
2 Академия постдипломного образования ФНКЦ ФМБА России
Москва, Россия
3 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
Санкт-Петербург, Россия
4 Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии
Санкт-Петербург, Россия
5 Санкт-Петербургский медико-социальный институт
Санкт-Петербург, Россия
6 Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова
Санкт-Петербург, Россия
7 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: miayy@yandex.ru
Поступила в редакцию 25.09.2019
После доработки 02.10.2019
Принята к публикации 07.10.2019
Аннотация
Сердечно-сосудистая патология является в развитых странах одной из основных причин смертности населения среднего и пожилого возраста. Часто своевременная диагностика сердечно-сосудистой патологии у лиц старших возрастных групп затрудняется отсутствием характерной клинической картины заболевания. Ранняя диагностика атеросклероза, ишемической болезни сердца, инфаркта миокарда и их коррекция улучшает прогноз выживаемости и качество жизни пациентов. Для оценки эффективности лечения атеросклероза, ишемической болезни сердца, инфаркта миокарда применяется исследование концентрации сердечных тропонинов hs-cTnT, hs-cTnI, молекул адгезии ICAM-1, VCAM-1, ELAM-1 и цитокинов IL-1α, -1β, -4, -5, -6, -13, -17 в плазме крови. Для предиктивной диагностики этих заболеваний рекомендуют исследование концентрации ICAM-1, фактора роста GDF15 и трансмембранного белка NOTCH1 в плазме крови и моче. Оценка экспрессии сигнальных молекул (тропонинов, молекул адгезии, интерлейкинов) в периферических тканях для предикции и прогноза течения сердечно-сосудистых заболеваний является быстро развивающейся областью молекулярной медицины и геронтологии.
ВВЕДЕНИЕ
В настоящее время сердечно-сосудистая патология (ССП) является одной из главных причин смертности людей пожилого и старческого возраста во всем мире (Mozaffarian et al., 2015). Основной причиной развития сердечно-сосудистых заболеваний является атеросклероз – хроническое поражение внутренней оболочки артерий эластического типа, при котором возникают атеросклеротические бляшки, содержащие холестерин (ХС) (Torres et al., 2015; Veseli et al., 2017).
При атеросклерозе для эндотелия сосудов характерно несколько стадий поражения (рис. 1).
Сначала возникает небольшой очаг поражения, гистологически характеризующийся инфильтрацией макрофагов в стенку сосуда и их трансформацией в пенистые клетки за счет захвата, гидролиза и реэтерификации эфиров ХС (Chistiakov et al., 2017; Liu et al., 2017).
Следующая стадия развития атеросклероза – формирование жировых прослоек (fatty streak) в эндотелии сосудов. Такие прослойки формируются вследствие накопления липидов (Ho-Tin-Noé et al., 2017).
Далее возникают промежуточные очаги: увеличивается внутриклеточное содержание липидов, при этом формируются внеклеточные липидные отложения.
Описанные изменения могут длиться годами без клинических проявлений. Клинические проявления атеросклероза возникают на стадии атеромы – “ядра” из внеклеточных липидных отложений. Формирование атеромы и разрастание соединительной ткани приводят к возникновению атеросклеротической бляшки.
Терминальной стадией заболевания считается разрыв оболочки сосуда, приводящий к тромбозу (Funk et al., 2012; Lhoták et al., 2016).
К факторам риска развития атеросклероза относят курение, гиперлипопротеинемию, артериальную гипертензию (АГ), сахарный диабет, ожирение, гиподинамию, стресс, неправильное питание, наследственную предрасположенность, постменопаузу, гиперфибриногенемию, гомоцистеинурию и гомоцистеинемию, гипотиреоз (Yao et al., 2019). Большинство факторов риска развития атеросклероза (АГ, сахарный диабет, постменопауза и т.д.) характерны для лиц пожилого и старческого возраста.
На данный момент не существует единой теории возникновения атеросклероза. Связь атеросклероза и воспаления обсуждается с 1825 г. Установлено, что воспаление и атеросклероз опосредуются одними и теми же клетками (эндотелиоцитами, гладкомышечными клетками, фибробластами, макрофагами, нейтрофилами, тромбоцитами, Т- и B-лимфоцитами) и молекулами (интегринами, интерлейкинами, белками острой фазы воспаления). Такое сходство позволило предположить, что воспаление и атеросклероз зависят от одних и тех же функциональных реакций, и сформулировать воспалительную теорию развития атеросклероза (Pant et al., 2014).
Холестериновая теория патогенеза атеросклероза подразумевает развитие этого заболевания вследствие нарушения липидного обмена. ХС представляет собой природный полициклический липофильный спирт, содержащийся в мембранах клеток животных и человека. ХС нерастворим в воде и плазме крови, поэтому его транспорт в ткани происходит при помощи липопротеинов: аполипопротеина А1 (апоА1) в составе липопротеинов высокой плотности (ЛПВП) и аполипопротеина B (апоB) в составе липопротеинов низкой плотности (ЛПНП) (Kapourchali et al., 2016). Около 80% ХС вырабатывается печенью, кишечником, почками, надпочечниками, половыми железами. Остальные 20% ХС поступают в организм с пищей. ХС обеспечивает устойчивость клеточных мембран к изменению температуры тела, необходим для выработки витамина D, стероидных гормонов (кортизол, альдостерон, эстрогены, прогестерон, тестостерон), желчных кислот, входит в состав миелиновых оболочек и поддерживает функциональную активность серотониновых и адренергических рецепторов в мозге (Krivoi, Petrov, 2019). Несмотря на это, с начала XX в. ХС считался основной причиной развития атеросклероза. Были разработаны и внедрены в клиническую практику лекарственные препараты, снижающие уровень ХС в крови, пациентам с атеросклерозом рекомендовали придерживаться диеты с низким содержанием ХС. Частично это оправдано тем, что у больных атеросклерозом в 50% случаев выявляется гиперхолестеринемия. В настоящее время показано, что ХС, содержащийся в пище, и ХС атеросклеротических бляшек не идентичны (Mattina et al., 2019). Уровень холестерина ЛПНП коррелирует с высоким риском развития атеросклероза. Высокий уровень ЛПНП приводит к гиперхолестеринемии (Biggerstaff, Wooten, 2004).
Следующая теория развития атеросклероза неразрывно связана с холестериновой теорией. Как уже упоминалось выше, ЛПНП – молекулы, содержащие белковую и липидную фракции. Белковая фракция ЛПНП представлена апоB-100, который обеспечивает захват ЛПНП клетками. Согласно данной теории, в некоторых случаях происходит блокада апоB-100, в результате чего в клеточные мембраны и фосфолипиды не могут поступать незаменимые жирные кислоты в форме эфиров ХС. Это приводит к нарушению функций мембранных белков, для которых необходимо окружение фосфолипидами и эстерифицированными жирными кислотами. При этом теряется оптимальная вязкость мембраны и происходит нарушение ее функций (Titov et al., 2019).
Нарушение липидного обмена зависит от окислительного стресса (ОС). Известно, что при ОС нарушается способность эндотелия гидролизовать эфиры ХС, вследствие чего они накапливаются в лизосомах макрофагов, трансформирующихся в пенистые клетки. При этом часть макрофагов гибнет путем некроза, формируя очаг воспаления, после чего окружающие клетки соединительной ткани синтезируют цитокины, стимулирующие синтез белков острой фазы воспаления. Макрофаги синтезируют фактор активации тромбоцитов. Тромбоциты накапливаются в очаге воспаления и образуют тромбы (Salvayre et al., 2016). На основании этой теории предлагается использовать в качестве маркеров риска развития атеросклероза и прогноза послеоперационного течения данного заболевания пероксидазы, ксантиноксидазу и миелопероксидазу, запускающие синтез активных форм кислорода (Юрьева и др., 2014).
Причиной метаболических нарушений, возникающих у лиц старших возрастных групп и приводящих к развитию атеросклероза, может являться жировой гепатоз. У пациентов пожилого и старческого возраста, страдающих атеросклерозом коронарных артерий, в 20–25% случаев была выявлена жировая инфильтрация печени (Хорошинина и др., 2014).
Было изучено влияние половых гормонов на течение субклинического атеросклероза у мужчин среднего и пожилого возраста. Низкий уровень тестостерона и высокий уровень эндогенного эстрадиола в крови повышают вероятность развития субклинического атеросклероза у мужчин среднего и пожилого возраста (Brand et al., 2013).
У пациентов старших возрастных групп с сахарным диабетом атеросклероз рассматривают как одно из основных осложнений, приводящих к смерти (Rahmani et al., 2016). По имеющимся данным (Chen et al., 2018), толщина комплекса интима-медиа сонной артерии, нестабильность бляшек и уровни гомоцистеина, цистатина и С-реактивного белка у пациентов с диабетом повышались. При этом концентрация С-пептида (фрагмента, образующегося при расщеплении проинсулина пептидазами) в крови и скорость клубочковой фильтрации у пациентов с диабетом были снижены. Эта тенденция более ярко прослеживалась у пациентов, страдающих диабетом в течение более 10 лет, по сравнению с лицами, имеющими в анамнезе диабет в течение 5 лет. У пациентов пожилого возраста после лечения статинами значения толщины комплекса интима-медиа, уровни гомоцистеина и С-реактивного белка и количество нестабильных бляшек достоверно снижались на 5–20% (Chen et al., 2018).
Атеросклероз сосудов сердца приводит к развитию ишемической болезни сердца (ИБС). При закупорке коронарных сосудов нарушается кровообращение. Этот процесс может быть острым (инфаркт миокарда, ИМ) или хроническим (периодические приступы стенокардии). Частота мультифокального атеросклероза, поражающего различные сосудистые регионы, у пациентов с острой и хронической формами ИБС составляет 13–94%. У лиц пожилого возраста ИБС в 70% случаев является причиной смерти (Шабанова, Болотнова, 2013). С возрастом меняется клиническая картина течения заболевания. У пациентов пожилого возраста с сочетанием ИБС и АГ преобладают безболевые эпизоды ишемии миокарда, которые наблюдаются на фоне повышения артериального давления и увеличения частоты сердечных сокращений. У людей старших возрастных групп приступы стенокардии характеризуются менее выраженными, но более продолжительными болями. Вместо резких болевых ощущений больных беспокоит дискомфорт в грудной клетке, чувство стеснения и сдавления в верхней части грудины, слева от грудины, в перикардиальной области. Особенностью стенокардии в пожилом и старческом возрасте является необычная иррадиация болей – на левую половину шеи, челюсть, затылок, правое плечо, оба плеча и т.д. Восстановительный период приступа стенокардии в пожилом возрасте замедленный, после него у пациентов длительное время отмечаются общая слабость, головная боль и другие нарушения общего состояния. Атипичное проявление стенокардии у больных старших возрастных групп может выражаться болью, возникающей в эпигастрии, острым расстройством пищеварения, нарастанием одышки (Андреева, Болотнова, 2014).
Острый вариант ИБС – ИМ – определяется как нарушение кровоснабжения участка миокарда с последующим развитием ишемического некроза. Клиническими симптомами ИМ являются: боль в груди, которая распространяется на левую руку или левую часть шеи, одышка, потливость, тошнота, рвота, нарушение сердечного ритма, беспокойство, усталость. Около 64% людей с ИМ не испытывают боли в груди. Такой вариант патологии называют “молчаливым” ИМ. Пожилой и старческий возраст рассматривают в качестве факторов риска развития ИМ наряду с курением, гипертензией, низкой физической активностью, ожирением и болезнью почек (Lu et al., 2015).
Учитывая большой процент людей с “молчаливым” ИМ, возникает необходимость разработки экспресс-тестов, позволяющих с высокой точностью установить наличие ИМ у пациента. В качестве такого теста широко распространено определение уровня тропонина в крови пациента (Bhattacharya et al., 2019). Также предлагается определение в крови уровня дипептидилпептидазы 3 – фермента, опосредующего деградацию сердечно-сосудистых медиаторов. Показано, что концентрация данного фермента в крови коррелирует со степенью кардиогенного шока. При анализе 335 белков, экспрессирующихся в эндотелиальных клетках коронарной артерии пациентов с ИМ, выявлены протеины, экспрессия которых нарушается при ИМ. Это оказались белки, обеспечивающие метаболизм РНК, факторы активации передачи сигналов и агрегации тромбоцитов, факторы дегрануляции нейтрофилов и белки, обеспечивающие реакцию клеток на стресс. Выявлена пониженная активация эндотелиальной NO-синтазы, о чем свидетельствовало снижение уровня изоформ кальмодулина (CALM1, CALM2, CALM3) – кофакторов, необходимых для активации NO-синтазы. Белки просапозин, тиоредоксин и убихилин-1, участвующие в регуляции вызванной ОС гибели клеток, и белок MGST1, участвующий в защите клеток от ОС, также подвергались дисрегуляции. Кроме того, у пациентов с ИМ наблюдалась избыточная экспрессия супероксиддисмутазы в эндотелиальных клетках (Nukala et al., 2019).
Перечисленные молекулы являются маркерами острого ИМ, что облегчает диагностику этого заболевания и позволяет начать скорейшее лечение. Однако в настоящее время не существует маркеров, позволяющих диагностировать атеросклероз на ранних стадиях, либо предиктивно оценить риск развития ИБС и ИМ. Поиск высокоинформативных методов молекулярной диагностики указанных сердечно-сосудистых заболеваний является актуальной задачей молекулярной медицины и геронтологии.
СИГНАЛЬНЫЕ МОЛЕКУЛЫ – ПРЕДИКТОРЫ АТЕРОСКЛЕРОЗА, ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА И ИНФАРКТА МИОКАРДА
Коррекция липидного профиля пациента снижает риск возникновения ССП на 30%. Поэтому своевременное выявление повышенного риска развития атеросклероза позволит избежать проявления клинических признаков заболевания и повысить эффективность лечения. В настоящее время охарактеризовано несколько десятков генов, ассоциированных с атеросклерозом. Первая группа генов кодирует белки, регулирующие метаболизм и транспорт липидов, вторая – белки, регулирующие уровень артериального давления, третья – белки воспаления, апоптоза и пролиферации. Помимо выделенных групп генов, ассоциированных с атеросклерозом и ИБС, существуют общепризнанные биомаркеры сердечно-сосудистых заболеваний, широко используемые в клинике. Поиск таких маркеров начался в середине XX в., и первым биомаркером миокардиальной дисфункции стала аспартат-аминотрансфераза. Затем в качестве маркера повреждения кардиомиоцитов стали рассматривать креатинкиназу, однако прошло несколько лет от предложения использовать эту молекулу в качестве биомаркера до разработки первых диагностических тестов (Ladenson, 2012). Молекулярные тесты стали более специфичными после открытия различных фракций креатинкиназы. Установлено, что при повреждении клеток миокарда наиболее полно отражает их состояние фракция MB креатинкиназы (Rosalki et al., 2004). В качестве маркера ИМ предлагалось использовать легкие цепи миозина, однако после того как эти молекулы были обнаружены в скелетных мышцах, возникла необходимость найти более специфичный миофибриллярный маркер. Было продемонстрировано, что сердечный тропонин T (cTnT) является более специфичным для оценки функции миокарда (Steen et al., 2010). На данный момент тропонины являются наиболее распространенными маркерами некроза миокарда (Кремнева и др., 2016; Eggers, Lindahl, 2017). Таким образом, в настоящее время ведется активный поиск молекулярных маркеров – предикторов развития атеросклероза, ИБС и ИМ.
ТРОПОНИНЫ
Семейство тропонинов состоит из 3 белков: тропонина С (Ca2+-связывающий тропонин), тропонина I (ингибирующий тропонин), тропонина T (тропомиозин, связывающий тропонин). Молекулы тропонина отличаются по молекулярной массе и имеют различия в строении, а также выполняют различные функции (Katrukha, 2013). Тропонин содержится в скелетных и сердечной мышцах, но не обнаруживается в гладкой мускулатуре. У тропонина скелетных мышц имеется четыре сайта для связывания ионов кальция, в то время как тропонин миокарда содержит три таких сайта (Garg et al., 2017).
Актиновые нити окружены волокнами белка тропомиозина. Прикрепление тропомиозина к нитям актина обеспечивает белок тропонин. В состоянии покоя тропомиозин закрывает головке миозина доступ к актину, в результате чего блокируется мышечное сокращение, и мышца остается расслабленной.
При возникновении потенциала действия открываются кальциевые каналы саркоплазматического ретикулума, вследствие чего концентрация кальция в сарколемме возрастает, и ионы кальция связываются с тропонином. Связывание ионов кальция с тропонином приводит к его структурным изменениям, которые обеспечивают подвижность тропомиозина и доступность актиновых нитей для миозина, что вызывает мышечное сокращение (Gresslien, Agewall, 2016).
Сердечные тропонины T (cTnT) и I (cTnI) выявлены только в кардиомиоцитах (Shave et al., 2010), однако эти белки имеют и скелетные изоформы. Тропонин С не имеет кардиоспецифической изоформы, поэтому в качестве маркера повреждения миокарда использоваться не может.
Существует большое количество работ, посвященных cTn как маркеру атеросклероза, ИБС, сердечной недостаточности. В настоящее время традиционные тесты cTn заменяют на новые – с использованием s-cTnT и hs-cTnI (высокочувствительный cTnT и cTnI соответственно), которые могут выявлять тропонин в концентрациях в 10–100 раз ниже, чем в традиционных анализах (рис. 2) (Reichlin et al., 2009; Garg et al., 2017).
Рис. 2.
Диапазон обнаружения cTn, обеспечиваемый различными анализами. Серые столбцы (слева) представляют нормальный диапазон тропонина у здоровых людей. Светло-серые столбцы (посередине) представляют диапазон cTn у людей после начала ИМ (повышение цитозольного cTn вызвано ишемией). Между 2–6 часами после ИМ происходит резкое увеличение уровня cTn (темно-серые столбцы, справа), что означает обширный некроз миокарда. Тесты на cTn с 1 по 4 поколение позволяют определять только повышенный уровень cTn, тогда как тесты 5 поколения являются более чувствительными и позволяют определять скачок cTn в самом начале развития ИМ, или даже в норме (по Garg et al., 2017, с модификациями).

Тропонины являются количественными маркерами повреждения кардиомиоцитов, поэтому вероятность развития ИМ возрастает с увеличением уровня cTn (Mueller, 2014).
В исследовании 4986 пациентов уровень hs-cTnT в плазме крови выше нормы был выявлен у 67% обследуемых. Повышенный уровень hs-cTnT коррелировал с возрастом старше 60 лет, мужским полом, наличием сахарного диабета, гипертонии, дисфункции почек, высоким индексом массы тела (ИМТ), плохим самочувствием (Seliger et al., 2017).
Интерес представляют исследования, посвященные корреляции сердечно-сосудистых и аутоиммунных заболеваний. Установлено, что сердечно-сосудистые заболевания являются основной причиной смерти пациентов с системной красной волчанкой (СКВ) (Thomas et al., 2014). hs-cTnT оценивали в качестве возможного маркера ССП у пациентов с СКВ. Было обследовано 63 пациента с СКВ (средний возраст – 39 лет, 82.5% – женщины) без симптомов сердечно-сосудистых заболеваний и 18 здоровых пациентов группы контроля (средний возраст – 41 год, 77.8% – женщины). Абсолютный риск сердечно-сосудистых заболеваний в течение следующих 10 лет по шкале Фрамингема составлял 1–18% у пациентов с СКВ и 1–13% у контрольной группы. Возраст, пол, употребление табака, гипертония, обхват талии и ИМТ статистически не различались у пациентов с СКВ и у контрольной группы. Уровень ХС и ЛПНП был снижен у пациентов с СКВ по сравнению с контрольной группой. Ни у пациентов с СКВ, ни у контрольных пациентов не было диабета. Систематическое измерение hs-cTnT в сыворотке крови показало, что данный маркер в концентрации выше 3 нг/л обнаруживали у 58.7% больных СКВ и только у 33.3% контрольных обследуемых. Риск развития атеросклероза у пациентов с СКВ, выявляемый по hs-cTnT, коррелировал с наличием атеросклеротических бляшек коронарных артерий (Divard et al., 2017).
Пациенты с преддиабетом имеют признаки субклинического повреждения миокарда и подвержены повышенному риску развития ССП. Более чем 8000 пациентов был сделан анализ содержания hs-cTnT в крови, при этом пациенты с концентрацией hs-cTnT выше 5 нг/л были отнесены к группе с субклиническим повреждением миокарда. Участники с более высоким уровнем hs-cTnT были в большем количестве случаев мужчинами пожилого возраста, с высоким уровнем глюкозы натощак, повышенным ИМТ, наличием гипертонии и метаболического синдрома по сравнению с участниками с более низким уровнем hs-cTnT. Наличие субклинического повреждения миокарда, определяемого по повышению hs-cTnT, было связано с повышенным риском развития диабета (Whelton et al., 2017).
cTnI также является распространенным маркером повреждения миокарда. При анализе данных по 150 пациентам установлено, что hs-cTnI выявляется в крови при всех стадиях развития атеросклероза. Повышение уровня hs-cTnI в крови ассоциируется с кальцификацией бляшек и обструктивными изменениями сосудов (Karpouzas et al., 2018). В другом исследовании чувствительность hs-cTnI для ИМ 1-го и 2-го типа составила более 99%; hs-cTnI в сочетании с электрокардиографией также имел высокую чувствительность для прогноза исхода острого ИМ через 30 дней (Sandoval et al., 2017a,b).
Таким образом, тропонины cTnT и cTnI являются информативными и чувствительными биомаркерами атеросклероза, ИБС, острого ИМ, позволяют прогнозировать исход ИМ. Однако тропонины не являются предиктивными маркерами, то есть определение их уровня в крови не позволяет заблаговременно оценить риск развития ИБС и ИМ. Кроме того, повышенный уровень концентрации тропонинов в крови может быть связан с развитием метаболических и аутоиммунных заболеваний, с патологией почек.
МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ
Ключевым звеном патогенеза атеросклероза и сопутствующей ССП является дисфункция эндотелия. Помимо барьерной функции, которую выполняет эндотелий, разделяя кровеносное русло и гладкую мускулатуру сосудов, он вырабатывает большое количество сигнальных молекул, регулирующих пролиферацию, миграцию клеток и сосудистый тонус. Дисбаланс между этими молекулами может играть ключевую роль в патогенезе атеросклероза. По некоторым данным, экспрессия молекул клеточной адгезии при эндотелиальной дисфункции повышена, что вызывает адгезию макрофагов, их миграцию в сосудистый эндотелий и усугубление патологического процесса (Закирова и др., 2008).
Молекулы клеточной адгезии представляют собой мембранные белки, участвующие во взаимодействии клеток с внеклеточным матриксом и другими клетками. К основным типам молекул клеточной адгезии относят интегрины, адгезивные рецепторы суперсемейства иммуноглобулинов, селектины и кадгерины.
Среди молекул клеточной адгезии, повышенная экспрессия которых влияет на функции эндотелия, выделяют молекулы ELAM-1 (endothelial-leukocyte adhesion molecule 1, или Е-селектин), ICAM-1 (intercellular adhesion molecule 1 или CD54), VCAM-1 (vascular cell adhesion molecule 1). Гиперэкспрессия этих молекул в эндотелии приводит к развитию воспалительного процесса в сосудистой стенке и ее инфильтрации лейкоцитами, которые образуют ядро атеросклеротической бляшки. Бляшки с повышенным инфильтратом и увеличенным содержанием воспалительных клеток и липидов наиболее склонны к разрыву и тромбозу, что повышает риск развития ИМ и инсультов (Максимова и др., 2014; Moss, Jaffe, 2015).
Повышенная концентрация в плазме крови VCAM-1 и галектина-3 коррелирует с высоким риском смертности от сердечно-сосудистых заболеваний. Галектин-3 относится к семейству β-галактозид-связывающих белков и взаимодействует с протеинами экстрацеллюлярного матрикса. Наибольший риск летального исхода наблюдается у пациентов с высоким уровнем VCAM-1 или повышенной концентрацией VCAM-1 и галектина в крови (Ko et al., 2018).
Схема взаимодействия молекул клеточной адгезии и лейкоцитов, приводящая к инфильтрации сосудов и формированию нестабильной бляшки, представлена на рисунке 3.
Рис. 3.
Взаимодействие лейкоцитов и молекул клеточной адгезии, приводящее к образованию нестабильной атеросклеротической бляшки (по Ko et al., 2018, с модификациями).
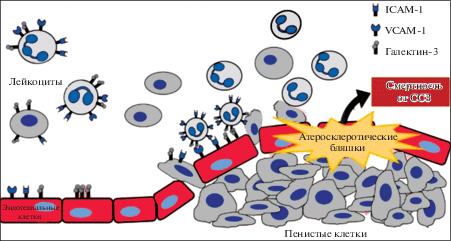
Существует гипотеза, согласно которой повышенная экспрессия молекул адгезии может быть вызвана избыточной секрецией альдостерона. Инфузия альдостерона в дозе 6 мкг в день индуцировала образование атеросклеротических бляшек в аорте мышей с мутациями в генах ApoE и ICAM-1. Такая дозировка альдостерона не вызывала изменений кровяного давления, массы тела и общего ХС в сыворотке крови животных. У мышей, нокаутных по ICAM-1, не наблюдалось альдостерон-индуцированного образования атеросклеротических бляшек. Эти данные подтверждают концепцию, согласно которой концентрация альдостерона, не влияющая на артериальное давление, повышает экспрессию ICAM-1 в аорте, что в сочетании с атерогенной диетой и другими факторами риска приводит к развитию атеросклероза (Marzolla et al., 2017). Полиморфизм гена ICAM-1 rs5498 связан со сниженным риском развития ИБС (Hu et al., 2017; Liu et al., 2018). Другой полиморфизм ICAM-1 – К469Е – ассоциируется с повышенным риском развития этого заболевания (Li et al., 2014).
Предполагается, что эндотелиальную дисфункцию и повышенную экспрессию молекул ICAM-1 и VCAM-1 вызывает ОС. Исследовано (Habas, Shang, 2018) влияние H2O2 на активацию эндотелиальных клеток пупочной вены человека (HUVECs) путем оценки экспрессии генов и белков ICAM-1 и VCAM-1. После инкубации HUVECs с H2O2, экспрессия ICAM-1 и VCAM-1 в клетках возрастала в 1.5–8 раз (Habas, Shang, 2018).
Как уже было сказано, повышенная экспрессия молекул адгезии приводит к развитию воспалительного процесса. Макрофаги, не трансформированные в пенистые клетки, секретируют провоспалительные цитокины, IL-1β и фактор некроза опухоли α (TNF-α) (Арабидзе, 2013).
Интерлейкины
IL продуцируются в ответ на воспалительные и другие стимулы Т-лимфоцитами, моноцитами, макрофагами, тромбоцитами, эндотелиальными клетками и адипоцитами. Описано около 20 интерлейкинов, ассоциированных с атеросклерозом (Фатхуллина и др., 2016; Прудников, Щупакова, 2018; Storan et al., 2015).
IL-4 играет проатерогенную роль, индуцируя развитие воспаления через повышенную регуляцию провоспалительных медиаторов: цитокинов, хемокинов, ICAM-1 в эндотелиальных клетках (Lee, Hirani, 2006). IL-5 ингибирует развитие атеросклероза, стимулируя продукцию анти-oxLDL антител (IgM) B-клетками (Zhao et al., 2015). IL-13 индуцирует продукцию TGF-β (трансформирующего фактора роста β) в макрофагах, подавляет VCAM-1-зависимое привлечение моноцитов через эндотелий (Cardilo-Reis et al., 2012). IL-17 выполняет проатерогенную и противоатерогенную функцию. Атерогенная функция IL-17 заключается в стимуляции хемокинзависимой инфильтрации моноцитов и нейтрофилов в интиму, в регуляции экспрессии VCAM-1, в повышении секреции провоспалительных цитокинов (IL-6, TNF, CCL5). Противоатерогенное действие IL-17 заключается в повышении продукции IL-5 и снижении синтеза интерферона γ (IFN-γ) (Lu, 2017).
Функция некоторых интерлейкинов, например IL-23, в развитии атеросклероза не установлена (Engelbertsen et al., 2018). IL-1α и IL-1β выполняют проатерогенную функцию, регулируя активацию эндотелиальных клеток и макрофагов, дифференцировку Т-хелперов 17 типа (Rader, 2012; Libby, 2017). Проатерогенную функцию выполняют также IL-20, IL-18, IL-12 (Bhat et al., 2015), противоатерогенную – IL-27, IL-35, IL-33, IL-10, IL-19 (Hirase et al., 2013; Lin et al., 2015; Han, Boisvert, 2015; Gabunia et al., 2016).
Цитокин IL-6 является плейотропным – он обеспечивает провоспалительную и противовоспалительную реакцию в зависимости от типа повреждения и органа, в котором он действует. В больших количествах IL-6 обнаруживается в атеросклеротических бляшках, однако его влияние на развитие атеросклероза остается спорным. Проатерогенная функция IL-6 заключается в том, что его повышенный синтез способствует увеличению размера бляшек и разрастанию жировой прослойки. Антиатерогенное действие IL-6 выражается в индукции синтеза антагониста рецептора IL-1 и в высвобождении растворимого рецептора для TNF, что приводит к снижению активности провоспалительных молекул (Schuett et al., 2009).
Уровень IL-6 в крови повышается с возрастом и коррелирует с высоким уровнем смертности среди лиц старше 65 лет от сердечно-сосудистых и других соматических заболеваний. По другим данным, уровень IL-6 в крови повышен у пациентов с ИБС и может служить маркером воспаления, связанным с риском развития сердечно-сосудистой патологии (Zakai et al., 2007). У детей с отягощенным семейным анамнезом по ИБС выявлена высокая концентрация IL-6 в плазме крови (Lefkou et al., 2010). У лиц с ИБС высокий уровень IL-6 в крови связан с неблагоприятным прогнозом течения заболевания (Fisman et al., 2006). Иммуногистохимические исследования выявили высокий уровень экспрессии IL-6 в атеросклеротических бляшках коронарных артерий человека (Schieffer et al., 2000). Исследования на животных не выявили протекторного действия подавления эффектов IL-6 при ИМ. У мышей с ишемией инъекции антител к IL-6 не влияли на степень фиброза миокарда и размер очага повреждения по сравнению с животными, получавшими инъекции контрольного IgG (Hartman et al., 2016).
Как было сказано ранее, люди с диабетом 2-го типа подвержены повышенному риску развития атеросклероза. ОС вызывает повышение уровня IL-6 при диабете 2-го типа, а повышение концентрации IL-6 в крови коррелирует с инсулинорезистентностью (Fernandez-Real, Ricart, 2003). По мнению некоторых авторов, высокий уровень IL-6 при диабете 2-го типа является предиктором сердечно-сосудистых заболеваний (Lowe et al., 2014). Наблюдалась корреляция между уровнем IL-6 в крови и эндотелиальной дисфункцией у молодых пациентов, перенесших ИМ (Erzen et al., 2007).
Проатерогенные эффекты IL-6 включают стимуляцию пролиферации гладких мышц сосудов, активацию эндотелиальных клеток и тромбоцитов.
IL-6 способствует выработке тромбоцитов и у людей, и у животных, что было продемонстрировано в исследованиях (Ceresa et al., 2007). У мышей, получавших экзогенный IL-6 путем инфузии, количество активированных тромбоцитов в крови повышалось, ускорялось образование тромба (Yan et al., 2014). У пациентов с высокой скоростью оседания эритроцитов и повышенным уровнем С-реактивного белка в крови численность тромбоцитов коррелирует с концентрацией IL-6. IL-6 вызывает агрегацию и активацию тромбоцитов, образование сгустка и окклюзию сосудов при атеротромбозе. IL-6 стимулирует выработку фибриногена, который способствует агрегации тромбоцитов и увеличивает вязкость плазмы крови. При инкубации с IL-6 тромбоциты человека активно экспрессируют P-селектин (Oleksowicz et al., 1995). Однако другое исследование (Marino et al., 2013) показало, что IL-6 in vitro не вызывает экспрессию P-селектина тромбоцитами и их агрегацию. Эти противоречивые данные указывают на актуальность продолжения исследования влияния IL-6 на функции тромбоцитов.
IL-6 способствует активации эндотелиальных клеток и индуцирует экспрессию на них молекул клеточной адгезии – ICAM-1, VCAM-1 и E-селектина. Механизмы сигнальных каскадов с участием IL-6 представлены на рис. 4. Классическая передача сигналов IL-6 происходит через рецептор IL-6R, расположенный на клеточной мембране. При транспередаче сигналов клетки, которые не экспрессируют IL-6R, могут отвечать на присутствие IL-6 через растворимую форму рецептора IL-6R (soluble IL-6R, sIL-6R). IL-6R отсоединяется от поверхности клетки при помощи матриксной металлопротеиназы 17 и дизинтегрина А и образует комплекс с IL-6 и белком gsp130 (the cell surface receptor glycoprotein 130). Образование этого комплекса приводит к активации белка gsp130 и фосфорилированию рецептор-ассоциированных киназ семейства JAK. JAK-киназы, в свою очередь, фосфорилируют и активируют транскрипционные факторы STAT, которые индуцируют экспрессию таргетных генов воспаления (Reiss et al., 2017).
В исследовании (Schuett et al., 2012) был использован гибридный белок-ингибитор передачи сигналов IL-6 – gsp130 (sgp130Fc) – для блокирования сигнального каскада, реализуемого IL-6. Введение этого белка мышам уменьшало прогрессирование атеросклеротического поражения сосудов параллельно со снижением экспрессии молекул адгезии в эндотелии и с уменьшением инфильтрация макрофагов в аорте. Это исследование подчеркивает важность транссигнализации в проявлении проатерогенных свойств IL-6.
Полиморфизм Asp358Ala, обнаруженный в экзоне 9 гена IL-6R, приводит к снижению экспрессии рецептора IL-6R на поверхности эндотелия и к повышению внутриклеточной растворимой формы этого белка – sIL-6R (Ferreira et al., 2013). Это приводит к нарушению классической сигнализации, к снижению уровня С-реактивного белка и фибриногена и к снижению риска развития ИБС (Swerdlow et al., 2012). Циркулирующий в крови белок sIL-6R может выполнять буферные функции, частично дезактивируя IL-6 (Ferreira et al., 2013).
В настоящее время продолжается активный поиск биомаркеров, позволяющих оценить риск развития атеросклероза, ИБС и ИМ. Определение уровня сердечного тропонина остается “золотым стандартом” диагностики острого ИМ, а последние исследования позволяют предположить возможное использование данного маркера для предиктивной диагностики ССП. Молекулы клеточной адгезии также изучаются в контексте патогенеза атеросклероза и ИБС. Описано участие молекулы адгезии ICAM-1 в инфильтрации сосудов и в формировании нестабильной атеросклеротической бляшки. IL-1α, -1β и IL-4 являются атерогенными, а IL-5, -13 – антиатерогенными (Silveira et al., 2015). IL-6 и IL-17, являются плейотропными, однако механизмы их влияния на патогенез атеросклероза, ИБС и ИМ остаются до конца не изученными.
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ПЕРИФЕРИЧЕСКИХ ТКАНЕЙ ДЛЯ ДИАГНОСТИКИ СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ
Перспективным направлением исследований молекулярной геронтологии является разработка тестов, позволяющих предиктивно оценить риск развития атеросклероза, ИБС и ИМ (Keskin et al., 2017; Zhang et al., 2018). Такой подход является особенно актуальным, учитывая тот факт, что клинические проявления атеросклероза как основного фактора развития ИБС и ИМ заметны только на терминальной стадии развития заболевания.
Периферические ткани (слюна, моча, буккальный эпителий и др.) широко используются для диагностики ряда нейродегенеративных и некоторых других заболеваний. Эти методики просты в осуществлении, занимают небольшое количество времени и не доставляют неудобств пациенту.
Атерогенный индекс представляет собой логарифмическое преобразование отношения концентрации триглицеридов и холестерина ЛПВП. Имеются данные о том, что атерогенный индекс может быть использован в качестве независимого предиктора ИМ и для контроля эффективности терапии атеросклероза (Иванов и др., 2016; Wu et al., 2018).
В исследовании (Fotis et al., 2012) концентрации молекул адгезии ICAM-1 и VCAM-1 в крови крыс, содержавшихся на диете с высоким содержанием липидов, установлено, что проатерогенная диета повышает уровень ICAM-1, но не влияет на экспрессию VCAM-1 в аорте крыс. Экспрессия ICAM-1 в аорте снижается после отмены диеты, богатой ХС. Определение в сыворотке крови растворенного ICAM-1 является информативным маркером экспрессии ICAM-1 в аорте, vasa vasorum, фибробластах и гладкомышечных клетках сосудов. Таким образом, молекула клеточной адгезии ICAM-1 не только является маркером наличия ССП, но и может служить прогностическим маркером оценки риска развития атеросклероза и сопутствующих сердечно-сосудистых заболеваний.
В исследовании (Martínez et al., 2019) концентрации в моче белков, ассоциированных с риском развития сердечно-сосудистых заболеваний, пациенты в возрасте от 30 до 50 лет были разделены на 3 группы: лица без ССП (контроль); пациенты, имеющие факторы риска развития сердечно-сосудистых заболеваний (АГ, гипергликемия и/или метаболический синдром); пациенты, перенесшие острый ИМ. Авторы количественно проанализировали протеом мочи, в результате чего было выявлено шесть белков, наиболее вероятно ассоциированных с риском развития ССП: адреноксин, эозинофильный катионный белок, фетуин-B, дифференцирующий фактор роста 15 (GDF15), гуанин деаминаза и трансмембранный белок NOTCH1. Вероятно, оценка концентрации этих белков в моче и других периферических тканях (слюна, буккальный эпителий) позволит разработать новый диагностический тест для предиктивной оценки риска развития атеросклероза, ИБС и ИМ.
ЗАКЛЮЧЕНИЕ
Для оценки прогноза течения и эффективности лечения сердечно-сосудистой патологии (атеросклероза, ИБС, ИМ) применяется исследование концентрации сердечных тропонинов hs-cTnT, hs-cTnI, молекул адгезии ICAM-1, VCAM-1, ELAM-1 и цитокинов IL-1α, -1β, -4, -5, -6, -13, -17 в плазме крови. В настоящее время для предиктивной диагностики с использованием периферических тканей (плазма крови, моча) рекомендуется исследование ICAM-1, GDF15 и NOTCH1. Приведенные исследования носят разрозненный характер и не дают полной информации о том, какие именно периферические ткани, помимо плазмы крови и мочи, могут быть информативными для предиктивной и ранней диагностики сердечно-сосудистой патологии.
В последние годы перспективным объектом для диагностики различных заболеваний стал буккальный эпителий. Установлено, что эта периферическая ткань, получение которой является простым и малоинвазивным методом, экспрессирует множество сигнальных молекул – маркеров нейродегенеративных заболеваний, патологии желудочно-кишечного тракта, метаболических нарушений и биологического возраста человека (Пальцев и др., 2012; Зуев и др., 2018а,б). По предварительным данным, исследование синтеза сигнальных молекул, описанных в обзоре, на материале буккального эпителия также будет информативным для диагностики сердечно-сосудистой патологии (Бунин и др., 2018).
В исследованиях рекомендуют проводить диагностику по различным сигнальным молекулам, относящимся к тропонинам, молекулам адгезии и интерлейкинам, однако нет единой информативной панели таких биомаркеров. Таким образом, оценка экспрессии сигнальных молекул (тропонинов, молекул адгезии, интерлейкинов) в периферических тканях для предикции и прогноза течения сердечно-сосудистых заболеваний (атеросклероза, ИБС, ИМ) является важной, динамично развивающейся областью молекулярной медицины и геронтологии.
Список литературы
Андреева О.В., Болотнова Т.В. Особенности клинических проявлений ишемической болезни сердца в пожилом и старческом возрасте // Тюм. мед. журнал. 2014. № 2. С. 10–11.
Арабидзе Г.Г. Клиническая иммунология атеросклероза: от теории к практике // Атероскл. дислипидем. 2013. № 1 (10). С. 4–19.
Бунин В.А., Карпасова Е.А., Кожевникова Е.О. и др. Перспективы применения буккального эпителия для неинвазивной диагностики ишемической болезни сердца у людей разного возраста// Успехи геронтол. 2018. Т. 31. № 6. С. 943–947.
Закирова Н.Э., Оганов Р.Г., Закирова А.Н. и др. Дисфункция эндотелия при ишемической болезни сердца // Рац. фармакотерап. кардиол. 2008. № 4. С. 23–27.
Зуев В.А., Дятлова А.С., Линькова Н.С. и др. Экспрессия α-синуклеина и пептида Аβ42 в черной субстанции и буккальном эпителии при болезни Паркинсона у людей разного возраста // Мол. мед. 2018а. Т. 16. № 6. С. 35–40.
Зуев В.А., Дятлова А.С., Линькова Н.С., Кветная Т.В. Экспрессия Аβ42, τ-протеина, р16, р53 в буккальном эпителии: перспективы диагностики болезни Альцгеймера и темпа старения организма // Бюл. эксперим. биол. мед. 2018б. Т. 166. № 11. С. 627–631.
Иванов В.И., Дорофейков В.В., Кайстря И.В. и др. Изменение показателей липидного спектра и атерогенный индекс плазмы у мужчин Ленинграда и Санкт-Петербурга за последние 30 лет // МедАлфавит. 2016. Т. 1. № 3 (266). С. 32–36.
Кремнева Л.В., Суплотов С.Н., Шалаев С.В. Оценка высокочувствительных тестов на тропонин в диагностике острого коронарного синдрома // Рац. фармакотерап. кардиол. 2016. № 2. С. 204–209.
Максимова М.Ю., Комелькова Л.В., Охтова Ф.Р. Факторы межклеточного взаимодействия при ишемическом инсульте // Журн. неврол. психиатр. им. С.С. Корсакова. 2014. Т. 114 (2). С. 15–20.
Пальцев М.А., Кветной И.М., Полякова В.О. и др. Сигнальные молекулы в буккальном эпителии: оптимизация диагностики социально значимых заболеваний // Мол. мед. 2012. № 4. С. 18–23.
Прудников А.Р., Щупакова А.Н. Роль цитокинов в диагностике нестабильности атеросклеротической бляшки // Вестн. ВГМУ. 2018. № 5. С. 28–45.
Фатхуллина А.Р., Пешкова Ю.О., Кольцова Е.К. Роль цитокинов в развитии атеросклероза (обзор) // Биохимия. 2016. Т. 81. № 11. С. 1614–1627.
Хорошинина Л.П., Турьева Л.В., Радченко В.Г., Кочергина Т.А. Жировое перерождение печени у пожилых и старых больных с атеросклеротическим поражением коронарных артерий (по данным аутопсии) // Эксперим. клин. гастроэнтерол. 2014. № 8 (108). С. 54–59.
Шабанова О.А., Болотнова Т.В. Состояние внутрисердечной гемодинамики у больных зрелого и пожилого возраста с ишемической болезнью сердца и артериальной гипертензией в ассоциации с ХОБЛ // Тюмен. мед. журнал. 2013. Т. 15. № 2. С. 30–31.
Юрьева Э.А., Сухоруков В.С., Воздвиженская Е.С., Новикова Н.Н. Атеросклероз: гипотезы и теории // Рос. вестн. перинатол. педиатр. 2014. № 3. С. 6–16.
Bhat O.M., Kumar P.U., Giridharan N.V., Kaul D. Interleukin-18-induced atherosclerosis involves CD36 and NF-κB crosstalk in Apo E-/- mice // J. Cardiol. 2015. V. 66 (1). P. 28–35.
Bhattacharya P.T., Golamari R.R., Vunnam S. et al. Predictive risk stratification using HEART (history, electrocardiogram, age, risk factors, and initial troponin) and TIMI (thrombolysis in myocardial infarction) scores in non-high risk chest pain patients: an african american urban community based hospital study // Medicine. 2019. V. 98 (32). P. 16370.
Biggerstaff K.D., Wooten J.S. Understanding lipoproteins as transporters of cholesterol and other lipids // Adv. Physiol. Educ. 2004. V. 28 (1–4). P. 105–106.
Brand J.S., den Ouden M.E., Schuurmans M.J. et al. Endogenous sex hormones and subclinical atherosclerosis in middle-aged and older men // Int. J. Cardiol. 2013. V. 168 (1). P. 574–576.
Cardilo-Reis L., Gruber S., Schreier S.M. et al. Interleukin-13 protects from atherosclerosis and modulates plaque composition by skewing the macrophage phenotype // EMBO Mol. Med. 2012. V. 4 (10). P. 1072–1086.
Ceresa I.F., Noris P., Ambaglio C. et al. Thrombopoietin is not uniquely responsible for thrombocytosis in inflammatory disorders // Platelets. 2007. V. 18. P. 579–582.
Chen W., Tian T., Wang S. et al. Characteristics of carotid atherosclerosis in elderly patients with type 2 diabetes at different disease course, and the intervention by statins in very elderly patients // J. Diab. Investig. 2018. V. 9 (2). P. 389–395.
Chistiakov D.A., Melnichenko A.A., Myasoedova V.A. et al. Mechanisms of foam cell formation in atherosclerosis // J. Mol. Med. 2017. V. 95 (11). P. 1153–1165.
Divard G., Abbas R., Chenevier-Gobeaux C. et al. High-sensitivity cardiac troponin T is a biomarker for atherosclerosis in systemic lupus erythematous patients: a cross-sectional controlled study // Arthrit. Res. Ther. 2017. V. 19 (1). P. 132.
Eggers K.M., Lindahl B. Application of cardiac troponin in cardiovascular diseases other than acute coronary syndrome // Clin. Chem. 2017. V. 63 (1). P. 223–235.
Engelbertsen D., Depuydt M.A.C., Verwilligen R.A.F. et al. IL-23R deficiency does not impact atherosclerotic plaque development in mice // J. Am. Heart Assoc. 2018. V. 7 (8). P. e008257.
Erzen B., Sabovic M., Sebestjen M. et al. Interleukin-6 correlates with endothelial dysfunction in young postmyocardial infarction patients // Cardiology. 2007. V. 107. P. 111–116.
Fernandez-Real J.M., Ricart J. Insulin resistance and chronic cardiovascular inflammatory syndrome // Endocr. Rev. 2003. № 24. P. 278–301.
Ferreira R.C., Freitag D.F., Cutler A.J. et al. Functional IL6R 358Ala allele impairs classical IL-6 receptor signaling and influences risk of diverse inflammatory diseases // PLoS Genet. 2013. № 9. P. e1003444.
Fisman E.Z., Benderly M., Esper R.J. et al. Interleukin-6 and the risk of future cardiovascular events in patients with angina pectoris and/or healed myocardial infarction // J. Cardiol. 2006. V. 98. P. 14–18.
Fotis L., Agrogiannis G., Vlachos I.S. et al. Intercellular adhesion molecule (ICAM)-1 and vascular cell adhesion molecule (VCAM)-1 at the early stages of atherosclerosis in a rat model // In Vivo. 2012. V. 26 (2). P. 243–250.
Funk S.D., Yurdagul A.Jr., Orr A.W. Hyperglycemia and endothelial dysfunction in atherosclerosis: lessons from type 1 diabetes // Int. J. Vasc. Med. 2012. V. 2012. P. 569654.
Gabunia K., Ellison S., Kelemen S. et al. IL-19 halts progression of atherosclerotic plaque, polarizes, and increases cholesterol uptake and efflux in macrophages // Am. J. Pathol. 2016. V. 186 (5). P. 1361–1374.
Garg P., Morris P., Fazlanie A.L. et al. Cardiac biomarkers of acute coronary syndrome: from history to high-sensitivity cardiac troponin. Internal and emergency medicine // Int. Emerg. Med. 2017. V. 12 (2). P. 147–155.
Gresslien T., Agewall S. Troponin and exercise // Int. J. Cardiol. 2016. V. 221. P. 609–621.
Habas K., Shang L. Alterations in intercellular adhesion molecule 1 (ICAM-1) and vascular cell adhesion molecule 1 (VCAM-1) in human endothelial cells // Tiss. Cell. 2018. V. 54. P. 139–143.
Han X., Boisvert W.A. Interleukin-10 protects against atherosclerosis by modulating multiple atherogenic macrophage function // Thromb. Haemost. 2015. V. 113 (3). P. 505–512.
Hartman M.H., Vreeswijk-Baudoin I., Groot H.E. et al. Inhibition of interleukin-6 receptor in a murine model of myocardial ischemia-reperfusion // PLoS One. 2016. V. 11. P. e0167195.
Hirase T., Hara H., Miyazaki Y. et al. Interleukin 27 inhibits atherosclerosis via immunoregulation of macrophages in mice // Am. J. Physiol. Heart Circ. Physiol. 2013. V. 305 (3). P. 420–429.
Ho-Tin-Noé B., Vo S., Bayles R. et al. Cholesterol crystallization in human atherosclerosis is triggered in smooth muscle cells during the transition from fatty streak to fibroatheroma // J. Pathol. 2017. V. 241 (5). P. 671–682.
Hu P., Dai T., Yu W. et al. Intercellular adhesion molecule 1 rs5498 polymorphism is associated with the risk of myocardial infarction // Oncotarget. 2017. V. 8 (32). P. 52594–52603.
Kapourchali F.R., Surendiran G., Goulet A., Moghadasian M.H. The role of dietary cholesterol in lipoprotein metabolism and related metabolic abnormalities: a mini-review // Crit. Rev. Food Sci. Nutr. 2016. V. 56 (14). P. 2408–2415.
Karpouzas G.A., Estis J., Rezaeian P. et al. High-sensitivity cardiac troponin I is a biomarker for occult coronary plaque burden and cardiovascular events in patients with rheumatoid arthritis // Rheumatol. 2018. V. 57 (6). P. 1080–1088.
Katrukha I.A. Human cardiac troponin complex. Structure and functions // Biochemistry. 2013. V. 78 (13). P. 1447–1465.
Keskin M., Hayıroğlu M.I., Keskin T. et al. A novel and useful predictive indicator of prognosis in ST-segment elevation myocardial infarction, the prognostic nutritional index // Nutr. Metab. Cardiovasc. Dis. 2017. V. 27 (5). P. 438–446.
Ko W.C., Choy C.S., Lin W.N. et al. Galectin-3 interacts with vascular cell adhesion molecule-1 to increase cardiovascular mortality in hemodialysis patients // J. Clin. Med. 2018. V. 7 (10). P. e300.
Krivoi I.I., Petrov A.M. Cholesterol and the safety factor for neuromuscular transmission // Int. J. Mol. Sci. 2019. V. 20 (1046). P. 1–25.
Ladenson J.H. Reflections on the evolution of cardiac biomarkers // Clin. Chem. 2012. V. 58 (1). P. 21–24.
Lee Y.W., Hirani A.A. Role of interleukin-4 in atherosclerosis // Arch. Pharm. Res. 2006. V. 29 (1). P. 1–15.
Lefkou E., Fragakis N., Ioannidou E. et al. Increased levels of proinflammatory cytokines in children with family history of coronary artery disease // Clin. Cardiol. 2010. V. 33. P. e6–10.
Lhoták Š., Gyulay G., Cutz J.C. et al. Characterization of proliferating lesion-resident cells during all stages of atherosclerotic growth // J. Am. Heart Assoc. 2016. V. 5 (8). P. e003945.
Li D., Qu C., Dong P. The ICAM-1 K469E polymorphism is associated with the risk of coronary artery disease: a meta-analysis // Coron. Art. Dis. 2014. V. 25 (8). P. 665–670.
Libby P. Interleukin-1 beta as a target for atherosclerosis therapy: biological basis of CANTOS and beyond // J. Am. Coll. Cardiol. 2017. V. 70 (18). P. 2278–2289.
Lin J., Kakkar V., Lu X. The role of interleukin 35 in atherosclerosis // Curr. Pharm. Des. 2015. V. 21 (35). P. 5151–5159.
Liu Z., Zhu H., Dai X. et al. Macrophage liver kinase B1 inhibits foam cell formation and atherosclerosis // Circ. Res. 2017. V. 121 (9). P. 1047–1057.
Liu A., Wan A., Feng A. et al. ICAM-1 gene rs5498 polymorphism decreases the risk of coronary artery disease // Medicine. 2018. V. 97 (40). P. e12523.
Lowe G., Woodward M., Hillis G. et al. Circulating inflammatory markers and the risk of vascular complications and mortality in people with type 2 diabetes and cardiovascular disease or risk factors: the advance study // Diabetes. 2014. V. 63. P. 1115–1123.
Lu L., Liu M., Sun R. et al. Myocardial infarction: symptoms and treatments // Cell Biochem. Biophys. 2015. V. 72 (3). P. 865–867.
Lu X. The impact of IL-17 in atherosclerosis // Curr. Med. Chem. 2017. V. 24 (21). P. 2345–2358.
Marino M., Scuderi F., Ponte E. et al. Novel path to IL-6 trans-signaling through thrombin-induced soluble IL-6 receptor release by platelets // J. Biol. Regulat. Homeost. Agents. 2013. V. 27. P. 841–852.
Martínez P.J., Baldán-Martín M., López J.A. et al. Identification of six cardiovascular risk biomarkers in the young population: a promising tool for early prevention // Atherosclerosis. 2019. V. 282. P. 67–74.
Marzolla V., Armani A., Mammi C. et al. Essential role of ICAM-1 in aldosterone-induced atherosclerosis // Int. J. Cardiol. 2017. V. 232. P. 233–242.
Mattina A., Giammanco A., Giral P. et al. Corrigendum to “Polyvascular subclinical atherosclerosis in familial hypercholesterolemia: the role of cholesterol burden and gender” // Nutr. Metab. Cardiovasc. Dis. 2019. V. 29. P. 1068–1076.
Moss M.E., Jaffe I.Z. Mineralocorticoid receptors in the pathophysiology of vascular inflammation and atherosclerosis // Front. Endocrinol. 2015. № 6. P. 153.
Mozaffarian D., Benjamin E.J., Go A.S. et al. Heart disease and stroke statistics–2015 update: a report from the American Heart Association // Circulation. 2015. V. 131 (4). P. e29–322.
Mueller C. Biomarkers and acute coronary syndromes: an update // Eur. Heart J. 2014. V. 35 (9). P. 552–556.
Nukala S.B., Regazzoni L., Aldini G. et al. Differentially expressed proteins in primary endothelial cells derived from patients with acute myocardial infarction // Hypertension. 2019. V. 74 (4). P. 947–956.
Oleksowicz L., Mrowiec Z., Isaacs R. et al. Morphologic and ultrastructural evidence of interleukin-6 induced platelet activation // Am. J. Hematol. 1995. V. 48. P. 92–99.
Pant S., Deshmukh A., Gurumurthy G.S. et al. Inflammation and atherosclerosis // J. Cardiovasc. Pharmacol. Ther. 2014. V. 19 (2). P. 170–178.
Rader D.J. IL-1 and atherosclerosis: a murine twist to an evolving human story // J. Clin. Invest. 2012. V. 22 (1). P. 27–30.
Rahmani S., Nakanishi R., Budoff M.J. Imaging atherosclerosis in diabetes: current state // Curr. Diab. Rep. 2016. V. 16 (11). P. 105.
Reichlin T., Hochholzer W., Bassetti S. et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays // N. Engl. J. Med. 2009. V. 361 (9). P. 858–867.
Reiss A.B., Siegart N.M., De Leon J. Interleukin-6 in atherosclerosis: atherogenic or atheroprotective? // Clin. Lipidol. 2017. V. 12. P. 14–23.
Rosalki S.B., Roberts R., Katus H.A. et al. Cardiac biomarkers for detection of myocardial infarction: perspectives from past to present // Clin. Chem. 2004. V. 50 (11). P. 2205–2213.
Salvayre R., Negre-Salvayre A., Camaré C. Oxidative theory of atherosclerosis and antioxidants // Biochimie. 2016. V. 125. P. 281–296.
Sandoval Y., Smith S.W., Love S.A. et al. Single high-sensitivity cardiac troponin I to rule out acute myocardial infarction // Am. J. Med. 2017a. V. 130 (9). P. 1076–1083.
Sandoval Y., Smith S.W., Sexter A. et al. Type 1 and 2 myocardial infarction and myocardial injury: clinical transition to high-sensitivity cardiac troponin I // Am. J. Med. 2017b. V. 130 (12). P. 1431–1439.
Schieffer B., Schieffer E., Hilfiker-Kleiner D. et al. Expression of angiotensin II and interleukin 6 in human coronary atherosclerotic plaques: potential implications for inflammation and plaque instability // Circulation. 2000. V. 101. P. 1372–1378.
Schuett H., Luchtefeld M., Grothusen C. et al. How much is too much? Interleukin-6 and its signalling in atherosclerosis // Thromb. Haemost. 2009. V. 102 (2). P. 215–222.
Schuett H., Oestreich R., Waetzig G.H. et al. Transsignaling of interleukin-6 crucially contributes to atherosclerosis in mice // Arterioscler. Thromb. Vasc. Biol. 2012. V. 32. P. 281–290.
Seliger S.L., Hong S.N., Christenson R.H. et al. High-sensitive cardiac troponin T as an early biochemical signature for clinical and subclinical heart failure: MESA (multi-ethnic study of atherosclerosis) // Circulation. 2017. V. 135 (16). P. 1494–1505.
Shave R., Baggish K., George M. et al. Exerciseinduced cardiac troponin elevation: evidence, mechanisms, and implications // J. Am. Coll. Cardiol. 2010. V. 56 (3). P. 169–176.
Silveira A., McLeod O., Strawbridge R.J. Plasma IL-5 concentration and subclinical carotid atherosclerosis // Atherosclerosis. 2015. V. 239 (1). P. 125–130.
Steen H., Madadi-Schroeder M., Lehrke S. et al. Staged cardiovascular magnetic resonance for differential diagnosis of troponin T positive patients with low likelihood for acute coronary syndrome // J. Cardiovasc. Magn. Reson. 2010. V. 12. P. 51.
Storan E.R., O’Gorman S.M., McDonald I.D., Steinhoff M. Role of cytokines and chemokines in itch // Handb. Exp. Pharmacol. 2015. V. 226. P. 163–176.
Swerdlow D.I., Holmes M.V., Kuchenbaecker K.B. et al. The interleukin-6 receptor as a target for prevention of coronary heart disease: a mendelian randomization analysis // Lancet. 2012. V. 379. P. 1214–1224.
Thomas G., Mancini J., Jourde-Chiche N. et al. Mortality associated with systemic lupus erythematosus in France assessed by multiple-cause-of-death analysis // Arthrit. Rheum. 2014. V. 66 (9). P. 2503–2511.
Titov V.N., Rozhkova T.A., Amelyshkina V.A. et al. Lipolysis in very low density lipoproteins – locus minoris resistentiae – in the pathogenesis of hypertriglyceridemia. Positive effects of diet, polyenic fatty acids, statins and fibrates // Klin. Lab. Diagn. 2019. V. 64 (7). P. 388–396.
Torres N., Guevara-Cruz M., Velázquez-Villegas L.A., Tovar A.R. Nutrition and atherosclerosis // Arch. Med. Res. 2015. V. 46 (5). P. 408–426.
Veseli B.E., Perrotta P., De Meyer G.R.A. et al. Animal models of atherosclerosis // Eur. J. Pharmacol. 2017. V. 816. P. 3–13.
Whelton S.P., McEvoy J.W., Lazo M. et al. High-sensitivity cardiac troponin T (hs-cTnT) as a predictor of incident diabetes in the atherosclerosis risk in communities study // Diabet. Care. 2017. V. 40 (2). P. 261–269.
Wu T.T., Gao Y., Zheng Y.Y. et al. Atherogenic index of plasma (AIP): a novel predictive indicator for the coronary artery disease in postmenopausal women // Lip. Health Dis. 2018. V. 17 (1). P. 197.
Yan S.L., Russell J., Granger D.N. Platelet activation and platelet-leukocyte aggregation elicited in experimental colitis are mediated by interleukin-6 // Inflamm. Bowel Dis. 2014. V. 20. P. 353–362.
Yao B.C., Meng L.B., Hao M.L. et al. Chronic stress: a critical risk factor for atherosclerosis // J. Int. Med. Res. 2019. V. 47 (4). P. 1429–1440.
Zakai N.A., Katz R., Jenny N.S. et al. Inflammation and hemostasis biomarkers and cardiovascular risk in the elderly: the cardiovascular health study // Thromb. Haemost. 2007. V. 5. P. 1128–1135.
Zhang S., Diao J., Qi C., Jin J. et al. Predictive value of neutrophil to lymphocyte ratio in patients with acute ST segment elevation myocardial infarction after percutaneous coronary intervention: a meta-analysis // BMC Cardiovasc. Disord. 2018. V. 18 (1). P. 75.
Zhao W., Lei T., Li H. et al. Macrophage-specific overexpression of interleukin-5 attenuates atherosclerosis in LDL receptor-deficient mice // Gene Ther. 2015. V. 22 (8). P. 645–652.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии




