Успехи современной биологии, 2020, T. 140, № 1, стр. 43-57
Перспективы синтеза молекулярно-генетического и экологического подходов к проблеме видообразования микроба чумы Yersinia pestis
В. В. Сунцов *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
Москва, Россия
* E-mail: vvsuntsov@rambler.ru
Поступила в редакцию 18.10.2019
После доработки 21.10.2019
Принята к публикации 23.10.2019
Аннотация
Рассмотрены два подхода к проблеме происхождения микроба чумы Yersinia pestis: молекулярно-генетический и экологический. Молекулярно-генетический подход прокламирует сальтационное видообразование, при котором основная инновационная роль отводится горизонтальному переносу генов и генных блоков. Экологический сценарий “дарвинского” видообразования позволяет выделить в геноме Y. pestis генетические структуры: инадаптивные, утерявшие в процессе видообразования функции предкового псевдотуберкулезного микроба Y. pseudotuberculosis O:1b; преадаптивные, имеющиеся у предкового псевдотуберкулезного микроба и обеспечившие переход в новые условия; (нео)адаптивные, сформировавшиеся эндогенно в переходной среде – паразитарной системе монгольский сурок Marmota sibirica–блоха Oropsylla silantiewi. Экологический подход может инкорпорировать молекулярно-генетические данные и адекватно интерпретировать их в соответствии с положениями современной синтетической теории эволюции. В статье приведены 10 примеров такой интерпретации. Перспектива раскрытия механизмов видообразовательного процесса просматривается в синтезе экологического и молекулярно-генетического подходов.
ВВЕДЕНИЕ
В филогенетике, филогеографии и вопросах происхождения новых видов в настоящее время доминирует молекулярно-генетический (МГ) подход. С одной стороны, МГ-методы во многих отношениях обладают бесспорным преимуществом перед классическими. С другой – в вопросах видообразования МГ-подходу присущ явный методологический редукционизм. МГ-филогенетические построения и сценарии образования новых видов, созданные на основе сравнительного анализа отдельных молекулярных маркеров или даже полногеномного секвенирования, часто лишены биологического содержания и игнорируют популяционный и адаптационистский подходы – два неотъемлемых атрибута современной синтетической теории эволюции (СТЭ). Молекулярная генетика – перспективная бурно развивающаяся научная дисциплина, но в вопросах видообразования она пока еще не стала вполне самодостаточной. Молекулярные закономерности видообразовательных процессов только начинают проясняться. Молекулярные перестройки геномов, приводящие к возникновению новых видов среди различных живых организмов от микробов до высших животных и растений, порой не находят удовлетворительного экологического и функционально-адаптационного толкования (Павлинов, 2005а,б; Абрамсон, 2007; Achtman, 2008; Ragan, Beiko, 2009). В связи с развитием МГ-методов некоторые авторы стали даже противопоставлять принципы эволюции прокариот и эукариот (Levin, Bergstrom, 2000).
При изучении происхождения и эволюции любых видов необходима консолидация наук, изучающих жизнь на разных уровнях ее организации от молекулярного до биогеоценотического. Для этого нужны удобные адекватные модели. В современных эволюционных моделях стали использовать микроорганизмы, имеющие во многих отношениях преимущества (высокая численность, быстрое размножение) в сравнении с каноническими объектами исследований (MacLean, 2005). Но удобных природных микробных моделей, которые востребованы эволюционной биологией, известно немного. К одной из таких моделей можно отнести экологический сценарий происхождения возбудителя чумы – микроба Yersinia pestis (Сунцов, 2015, 2016, 2018а; Сунцов, Сунцова, 2000, 2006). Выводы в отношении механизмов его видообразования в экологическом и МГ-сценариях пока остаются во многом не совместимыми. МГ-подход прокламирует идею сальтационного видообразования, а экологический – постепенного градуального, “дарвинского”. Принцип внутривидовой МГ-систематики ориентирован на эпидемиологическую значимость таксона (Кисличкина и др., 2019), а экологической – на историю формирования паразитарных систем хозяин–переносчик–микроб чумы (Сунцов, Сунцова, 2000, 2006). Тем не менее, имеются убедительные основания полагать, что экологический сценарий станет своеобразной канвой для инкорпорирования МГ-данных, интерпретация которых не противоречит положениям СТЭ, и положит начало эколого-молекулярно-генетическому синтезу не только в проблеме происхождения микроба чумы, но и возбудителей других чумоподобных инфекций.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ СЦЕНАРИИ ПРОИСХОЖДЕНИЯ Y. pestis
Согласно МГ-данным, прямым предком возбудителя чумы является психрофильный сапрозоонозный энтеропатогенный возбудитель псевдотуберкулеза теплокровных животных и человека – микроб Y. pseudotuberculosis. Формирование вида Y. pestis прошло в эволюционном масштабе недавно, не более 30 тыс. лет назад, в конце плейстоцена–голоцене (Skurnik et al., 2000; Morelli et al., 2010). Высказана идея возникновения микроба чумы в освоенной человеком долине Нила в популяциях синантропных и/или полевых крыс (Achtman et al., 1999). Многие другие сценарии не подразумевают участие человека в происхождении чумы. Будучи генетически близкими, возбудители псевдотуберкулеза и чумы имеют радикальные экологические (этиологические) различия. Псевдотуберкулез у человека редко завершается летальным исходом, в то время как чума – особо опасное заболевание, без оперативного лечения заканчивается быстрой смертью. Возбудители псевдотуберкулеза и чумы занимают радикально различающиеся экологические ниши. Первый – сапрозоонозный обитатель кишечного тракта широкого круга животных, передается алиментарным путем. Второй – зоонозный обитатель лимфомиелоидного комплекса млекопитающих, преимущественно грызунов, передается главным образом трансмиссивным путем через укусы блох, “блокированных” размножающимися в пищеварительном тракте блохи бактериями. Ранее, согласно МГ-признакам (97–99% совпадения нуклеотидной последовательности гомологичных генов), было предложено отнести возбудителей чумы и псевдотуберкулеза к разным подвидам одного вида Y. pseudotuberculosis (Bercovier et al., 1980), но в связи с радикальными различиями фенотипических признаков, прежде всего несравнимой эпидемиологической значимостью, возбудителей этих болезней формально относят к разным видам рода Yersinia. При этом, по оценке экологических ниш, межвидовые различия достигают ранга разных семейств (возбудитель чумы вызывает “кровяную” инфекцию, но не кишечную), и видообразование микроба чумы можно квалифицировать как популяционно-генетический процесс макроэволюционного масштаба (Сунцов, Сунцова, 2008). Микроб чумы как “паразит крови” имеет уникальную экологическую нишу среди кишечных бактерий семейства Enterobacteriaceae, что свидетельствует о каких-то уникальных условиях, при которых проходил процесс видообразования. МГ-логика связывает его дивергенцию от возбудителя псевдотуберкулеза с генетическими преобразованиями микробных клонов либо в тонком кишечнике грызуна-хозяина, либо в организме блохи-переносчика (Sun et al., 2014; Hinnebusch et al., 2016, 2017). Другие варианты не рассматриваются. Действительно, биологическую суть проблемы МГ-подход не раскрывает, выявление искомых уникальных условий видообразования микроба чумы в целом не входит в компетенцию МГ, это прерогатива, главным образом, экологии.
Подавляющее большинство последователей МГ-подхода полагают, что исходная наиболее древняя форма политипического вида Y. pestis по свойствам вирулентности и патогенности должна быть более близкой к предку – микробу Y. pseudotuberculosis 1-го серотипа (O:1b), и по мере экспансии из центра происхождения в популяции других хозяев: песчанок, сусликов, сурков – возрос уровень вирулентности и патогенности (Ерошенко и др., 2010; Rasmussen et al., 2015; Demeure et al., 2019). Соответствующим образом на основе МГ-данных выстроены филогенетические схемы, согласно которым сначала возникла эндемическая ветвь чумного микроба, менее патогенная для лабораторных животных, большинства видов хозяев-грызунов и человека (молекулярный эквивалент – филогенетическая линия-кластер 0.PE) (Кисличкина и др., 2019). Из этой анцестральной ветви выделились более молодые эпидемические ветви с высокой вирулентностью для человека 0.ANT, 1.ANT, 2.ANT, 3.ANT, 4.ANT, 1.ORI, 1.IN, 2.MED, далее дивергировавшие на ветви меньшего порядка, характеризующие конкретные рецентные очаги чумы (Morelli et al., 2010; Cui et al., 2013; Kutyrev et al., 2018; Demeure et al., 2019). Механизм нарастания вирулентности МГ-подход связывает с горизонтальным переносом генов (ГПГ), а также с их инактивациями и делециями.
Наименьшей вирулентностью и, соответственно, наибольшим филогенетическим возрастом, согласно МГ-представлениям, обладают так называемые эндемические подвиды и биовары группы Pestoides (молекулярный эквивалент 0.PE), которые циркулируют в природе в популяциях полевок Microtinae и пищух Ochotona: caucasica, microtus, qinghaiensis, xilingolensis, hissarica, talassica, altaica, ulegeica, Pestoides, Angola, Microtus (Вариабельность…, 2009; Zhou et al., 2004; Li et al., 2009; Eppinger et al., 2010; Kutyrev et al., 2018). Эти подвиды (биовары) по ряду маркерных МГ-признаков действительно занимают промежуточное положение между слабовирулентным для лабораторных животных (морских свинок) возбудителем псевдотуберкулеза и высоковирулентными штаммами возбудителя чумы (Kutyrev et al., 2004). Местом возникновения возбудителя чумы разные авторы называют Кавказ, горы Средней Азии, Центральный Китай, Анголу (заметим, в Африке, включая Анголу, нет полевок, пищух, сурков и псевдотуберкулезного микроба 1-го серотипа). Но следует признать, что МГ-данные не позволяют дать доверительный ответ на вопрос, в популяциях грызунов какого вида, обладающего какими-то уникальными свойствами, проходил видообразовательный процесс.
Видообразование Y. pestis МГ-исследователи рассматривают как последовательность сальтационных комбинаторных изменений генома: аквизиций, инсерций, делеций, инактиваций, в меньшей мере рекомбинаций (“add, stir, reduce”) (Wren, 2003; Cui, Song, 2016; McNally et al., 2016). Центральную роль отводят ГПГ (отдельных генов, оперонов, плазмид, транспозонов, фагов, островов патогенности) из внешней среды или от микробов других видов. При этом встраиваемые извне чужие (foreign) плазмиды и гены, как полагают МГ-исследователи, несли проспективные, специфические для чумного микроба функции, востребованные в бинарной среде обитания грызун–блоха. Гены caf1 и ymt большой плазмиды pFra поддерживают адаптацию, соответственно, к хозяину и переносчику. Ген pla малой плазмиды pPst поддерживает адаптацию к хозяину, а гены pst и pim обеспечивают внутри- и межвидовую регуляцию (Вариабельность…, 2009; Rakin et al., 1996; Zhou, Yang, 2009; Hinnebusch et al., 2016). Успешное горизонтальное встраивание таких крупных специализированных генетических структур в геном будущего чумного микроба объясняют моментальным установлением геномных координаций и корреляций под действием глобальных “анцестральных промискуитетных регуляторных систем” (ancestral promiscuous regulatory system), которые контролируют экспрессию встроенных генов (Cathelyn et al., 2007; Zhou, Yang, 2009; McNally et al., 2016).
В целом следует признать, что на настоящем этапе исследований по проблеме происхождения микроба чумы во многом противоречивые МГ-данные не позволяют выстроить надежную, убедительную филогению Y. pestis. Идея сальтационной эволюции не находит поддержки в классическом эволюционном учении (Иорданский, 2001). Происхождение генов и плазмид, специфических для микроба чумы, но якобы встроенных из какого-то внешнего источника в псевдотуберкулезные, а не какие-либо иные микробные клетки, МГ-сценарии не объясняют. Многие сапронозные и сапрозоонозные бактерии имеют убиквитарное распространение. Почему именно псевдотуберкулезные клетки 1-го серотипа стали реципиентами видообразующего ГПГ? Без этого объяснения реальность предложенных МГ-сценариев вызывает глубокое сомнение. Таким образом, необходимо привлечение данных других классических наук, которые позволили бы рассматривать изучаемый эволюционный процесс на различных уровнях организации жизни, то есть следует подойти к решению данного вопроса с разных сторон (Сунцов, Сунцова, 2009).
ЭКОЛОГИЧЕСКИЙ КОНТЕКСТ ВИДООБРАЗОВАНИЯ Y. pestis
СТЭ рассматривает быстрое дивергентное видообразование как переход популяции в новую экологическую нишу и/или адаптивную зону, то есть из одного устойчивого состояния в другое через состояние временной нестабильности. Таким образом, между средами обитания (экологическими нишами) предкового и дочернего видов должна существовать нестабильная (гетерогенная) промежуточная среда с нестабильными промежуточными формами (Симпсон, 1948; Дубинин, 1966; Майр, 1974; Bock, 1965). В последние полтора–два десятилетия накоплен необходимый и достаточный объем знаний в различных направлениях медицинских, биологических и других естественных наук, прежде всего в молекулярной генетике, экологии и палеоклиматологии, позволивший связать видообразование микроба чумы с конкретной промежуточной средой (рис. 1). Воссоздан валидный экологический сценарий видообразовательного процесса: микроб чумы Y. pestis дивергировал от псевдотуберкулезного микроба Y. pseudotuberculosis O:1b в континуальной гетерогенной (гетеротермной и гетероиммунной) среде – паразитарной системе монгольский сурок-тарбаган (M. sibirica)–блоха O. silantiewi в условиях последнего (сартанского) максимального похолодания климата Центральной Азии 22–15 тыс. лет назад (Сунцов, 2014, 2016, 2018а; Сунцов, Сунцова, 2000, 2006). Микроб чумы проявляет признаки четкой адаптации к определенным видам (подвидам, нескольким близким видам) хозяина (но не переносчика-блохи), из этого следует, что основные процессы адаптации осуществлялись во взаимодействии микроба с организмом первичного хозяина, когда между хозяином и инфекционным агентом сформировался баланс свойств резистентность/вирулентность и возникла первичная эпизоотическая система чумы.
Рис. 1.
Смена микробной среды обитания в процессе преобразования клона Yersinia pseudotuberculosis в Yersinia pestis. Y. pstub – Y. pseudotuberculosis. I – внегостальная среда обитания (внегостальная экологическая субниша) псевдотуберкулезного микроба; II – травматическое заражение крови сурков-тарбаганов во время спячки; III – среда обитания псевдотуберкулезного микроба в холодной крови спящих сурков; IV – гетеротермная (гетероиммунная) среда обитания промежуточной формы Yersinia pseudotuberculosis/pestis; V – гостальная среда обитания в популяции активных сурков-тарбаганов; VI – гостальная среда обитания (гостальная экологическая субниша) микроба чумы в популяциях грызунов и пищух (Ochotona).
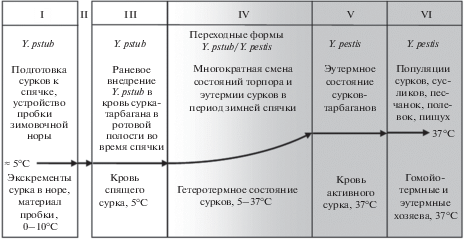
Внутривидовые формы возбудителя чумы (подвиды, биовары, геномовары, эковары, риботипы) характеризуются признаком гостальности (host – хозяин). То есть в природных очагах микроб выработал адаптации к циркуляции в популяциях хозяев определенных видов (подвидов) (Zhou et al., 2004). Отсюда понятно, что преобразование исходного клона псевдотуберкулезного микроба в популяцию микроба чумы, наиболее вероятно, прошло в популяции какого-то одного или немногих видов грызунов, обитающих в границах ареала псевдотуберкулезного микроба 1-го серотипа в каком-то географическом районе с холодным климатом. На основе МГ-данных в качестве первичных хозяев называют представителей подсемейства Microtinae (полевковые) или рода Marmota (сурки) (Анисимов и др., 2016; Wang et al., 2006; Morelli et al., 2010). Первые – гомойотермные, не зимнеспящие мелкие грызуны с постоянной температурой тела (Тт) около 37°С. Вторые – гетеротермные, зимующие большими семьями животные, у которых в осенне-зимне-весенний период многократно (2–5 раз в месяц) меняется физиологическое состояние торпор/эутермия, при этом Тт изменяется в диапазоне 5–37°С и, в соответствии с ней, физиологические и биохимические показатели организма: интенсивность дыхания и кровообращения, свертываемость крови, скорость иммунных реакций, инфекционная чувствительность (Carey et al., 2003; Bouma et al., 2010). Гетеротермное и, соответственно, гетероиммунное состояние зимнеспящих грызунов, по нашим представлениям, является фундаментальным гостальным свойством, организующим гетерогенную промежуточную среду, в которой проходил быстрый процесс “квантового” видообразования микроба чумы (Сунцов, 2018а). Но при МГ-подходе это свойство не принимается во внимание и не обсуждается.
Стартовый механизм видообразования микроба чумы был действительно уникальным среди представителей семейства Enterobacteriaceae, неадаптивным, травматическим. Такой неспециализированный путь “заражения крови” патогенной микрофлорой (септицемии) у человека и животных вполне обычен. Он характерен для возбудителей травматических клостридиозов (газовая гангрена, столбняк), кокковых инфекций (стафилококки, стрептококки), инфекций, вызываемых энтеробактериями (кишечная и синегнойная палочки).
Как следует из экологического сценария, микроб чумы возник благодаря уникальному совмещению в Центральной Азии в конце позднего плейстоцена двух тривиальных абиотических факторов: сухости и суровости климата. Отдаленной предпосылкой послужила аридизация центрально-азиатских ландшафтов во второй половине кайнозоя. Аридный климат стал причиной видоспецифического норостроительного поведения сурка-тарбагана, которое вызвало его массовое заражение псевдотуберкулезом традиционным фекально-оральным путем, но не в процессе пастбищного питания сочной растительностью, а при залегании в спячку при устройстве пробки зимовочной норы. Рецентной предпосылкой видообразовательного процесса стало позднеплейстоценовое максимальное (сартанское) похолодание в Северной и Центральной Азии, вызвавшее изменение поведения личинок сурковой блохи O. silantiewi – переход в зимние месяцы из мерзлой гнездовой выстилки на тело спящих сурков. Это стало причиной факультативной гематофагии: личинки блох со стохастической закономерностью стали проникать в ротовую полость и питаться на слизистой, создавая скарификации (Жовтый, Пешков, 1958; Сунцов, Сунцова, 2006). Раны на слизистой ротовой полости послужили “входными воротами” для прямого устойчивого травматического проникновения псевдотуберкулезного микроба в гетеротермную кровь спящих сурков из фекальных частиц, сохраняющихся в ротовой полости после устройства зимовочной пробки. Травматический путь заражения монгольского сурка псевдотуберкулезом – это центральный экологический принцип для понимания механизма происхождения чумы!
Важной предпосылкой происхождения микроба чумы следует считать образ жизни монгольского сурка как гетеротермного зимнеспящего животного. В популяциях гетеротермных сурков проходили основные экологические, генетические и молекулярно-биологические процессы видообразования. В одном гнезде может зимовать до 22–24 зверьков. В течение холодного периода года сурки не синхронно просыпаются до 30 раз, при этом Тт изменяется в диапазоне 5–37°С (Ortmann, Heldmaier, 2000). В такой гетеротермной среде блохи могут передавать микробы новому хозяину, имеющему любую заданную Тт (и, соответственно, активность иммунной системы) в указанном диапазоне (Сунцов, 2018в). К тому же у сурков в торпидном иммунодепрессивном состоянии кровь не свертывается, раны кровоточат длительное время, что придает высокую эффективность раневому заражению.
Принципиальное отличие экологического сценария от МГ-сценариев состоит в том, что он связывает стартовый этап видообразования не с приоритетом сальтационных генетических событий (ГПГ из пока неизвестного источника), а с реальными изменениями в биогеоценозе – уникальным поведением первичного хозяина (монгольского сурка) и особенностями поведения первичного переносчика (сурочьей блохи). Тандем этих поведенческих сдвигов в условиях максимального сартанского похолодания в Центральной Азии привел к массовому неадаптивному раневому проникновению псевдотуберкулезного микроба в кровь первичного хозяина, следствием которого стало развитие первичной бактериемии в общепопуляционном масштабе, завершающейся сепсисом зараженного хозяина.
Экологический подход описывает видообразовательный процесс как постепенное, но быстрое преобразование клона слабопатогенного псевдотуберкулезного микроба в популяцию высокопатогенного возбудителя чумы (Сунцов, 2018а). То есть, в противовес МГ-филогениям, сначала возникла исходная популяция чумного микроба с высокой вирулентностью для лабораторных животных и человека, а от нее по мере адаптивной радиации независимо сформировались локальные эндемические формы с избирательной вирулентностью к конкретным видам и популяциям полевок и пищух (Анисимов и др., 2016). Истинные переходные полиморфные формы pseudotuberculosis/pestis были нестабильными и в настоящее время не существуют. В процессе отбора они элиминировались клетками, обладающими продвинутым признаком – способностью синтезировать бактериоцин пестицин. В связи с недавним в эволюционном масштабе завершением процесса видообразования микроб чумы, с одной стороны, сохранил многие фенотипические и генотипические признаки своего предка, с другой – является его безусловным антагонистом, активно подавляет пестицином предкового псевдотуберкулезного микроба 1-го серотипа и не устойчивые к пестицину клетки промежуточных и мутантных форм (Степанов и др., 1980).
АДАПТАЦИОГЕНЕЗ МИКРОБА ЧУМЫ
Инфекция животных и человека начинается, как правило, с преодоления возбудителем эпителиального барьера либо специализированным путем (аппарат клеточной адгезии/инвазии), либо через механические повреждения (раны, ожоги). Псевдотуберкулезная инфекция млекопитающих начинается проникновением возбудителя в эпителий тонкого кишечника посредством специализированных детерминант вирулентности. Адаптация к запуску инфекционного процесса состоит (помимо многих других проявлений) во взаимодействии факторов вирулентности: адгезина (Yad), инвазина (Inv), Yops-протеинов (Yersinia outer membrane proteins) и “молекулярного шприца” (T3SS-системы) – с эпителиальными М-клетками тонкого кишечника в кислой (pH ≤ 6) среде. Далее к реализации инфекционного процесса в субэпителиальных и более глубоких тканях и органах присоединяется система вирулентности Ail (attachment invasion locus), активная в широком температурном диапазоне (Bartra et al., 2008; Felek, Krukonis, 2009; Atkinson, Williams, 2016).
У псевдотуберкулезного микроба адаптации к внегостальной среде проявляются в гетеротрофном способе питания мертвой органикой и в подвижности за счет жгутиков. Защитой от факторов внешней среды служит микробная биопленка, в синтезе которой при температуре ≤ 26°С участвуют протеины Hmss, кодируемые генами hms-оперона, размещенными на хромосоме (Hinnebusch, 2005).
Дочерний микроб чумы перешел в другую экологическую нишу, стал возбудителем системной трансмиссивной инфекции. Его адаптация к циркуляции в системе грызун–блоха проходила по трем направлениям: к лимфомиелоидному комплексу теплокровного хозяина-грызуна (факторы вирулентности), к переносчику-блохе (факторы трансмиссии) и взаимоадаптации в микробном сообществе (факторы коммуникации) (Hinnebusch, 2005; West et al., 2007; Zhou, Yang, 2009; Diggle, 2010; Connor et al., 2018). При этом формирование свойств вирулентности и трансмиссивности проходило множественными путями, в том числе включало принцип аддитивности: к преадаптивным признакам, свойственным псевдотуберкулезному предку, добавлялись новые специфические признаки. Эти взаимосвязанные и взаимообусловленные адаптации были направлены на достижение уровня бактериемии, гарантирующего успешное заражение укусами блох нового хозяина, непрерывность эпизоотического процесса и популяционно-видовую стабилизацию нового вида Y. pestis.
Факторы вирулентности
Известные факторы вирулентности (протеины, токсины, ферменты, функциональные молекулы и др.) направлены на ингибирование клеточного и гуморального иммунитета теплокровного хозяина и достижение высокоинтенсивной бактериемии. Микроб чумы владеет многочисленными факторами вирулентности (Demeure et al., 2019). Среди наиболее изученных – базовые факторы T3SS и Ail, которые перешли от псевдотуберкулезного микроба лишь с небольшими изменениями, и аддитивные видоспецифические факторы-протеины Caf1 (кодируется на плазмиде pFra) и Pla (кодируется на плазмиде pPst/pPla). В МГ-подходе принято считать, что плазмиды pFra и pPst приобретены в результате ГПГ извне. При этом большая плазмида pFra, наряду с геном (опероном) вирулентности caf1, несет также уникальный для возбудителя чумы ген трансмиссивности ymt, то есть утверждается, что в геном будущего микроба чумы извне встроился высокоспециализированный генетический блок, кодирующий две разные важнейшие функции, и несколько оригинальных генов жизнеобеспечения! То же можно сказать о малой плазмиде pPst, якобы встроенной от Salmonella typhimurium (Куклева, Бойко, 2016; Prentice et al., 2001). Эта плазмида одновременно несет на себе ген вирулентности pla и гены коммуникации pst и pim. Ген pst кодирует синтез специфического для чумного микроба бактериоцина – пестицина, регулятора внутри- и межвидовых отношений именно микроба чумы (Rakin et al., 1996). Ген pim кодирует функцию устойчивости к пестицину и функционально тесно связан с pst. Поэтому МГ-утверждения о заимствовании цельных плазмид, выполняющих различные специфические функции, откуда-то извне или от других патогенных видов представляются совершенно немыслимыми. Как альтернатива, экологический сценарий предусматривает постепенный поэтапный эндоцеллюлярный синтез двух выше названных специфических плазмид в процессе адаптациогенеза микроба чумы в гетеротермной и гетероиммунной среде сурок-тарбаган–блоха O. silantiewi. При этом ген вирулентности pla характеризует механизм продвинутой формы чумы – бубонной, а гены коммуникации pst и pim обеспечили хиатус с предковым видом и поддерживают статус новообразованного вида в меж- и внутривидовой борьбе за существование.
Факторы трансмиссии
Эти факторы характеризуют связь возбудителя чумы с блохами. Базовым фактором трансмиссии, перешедшим в мало измененном виде от предкового псевдотуберкулезного микроба, являются протеины Hmss, кодированные на хромосоме и формирующие микробный матрикс, который при чуме участвует в формировании блока преджелудка зараженной блохи (Куклева и др., 2011). В процессе адаптациогенеза у микроба чумы сформировался аддитивный механизм длительного выживания микроба в организме блохи и пролонгированной блоковой (позднефазной) трансмиссии (Erickson et al., 2006; Eisen, Gage, 2009). В поддержании этого механизма участвует видоспецифический протеин Ymt (мышиный токсин), кодированный на специфической для чумного микроба большой плазмиде pFra. Экологический сценарий предполагает эндоцеллюлярный синтез ymt и не требует привлечения парадигмы ГПГ для объяснения механизма трансмиссивной передачи (Сунцов, 2018б).
Факторы коммуникации
Коммуникационные связи обязательны для любого формирующегося и устоявшегося микробного сообщества (West et al., 2007). Возникновение межвидового хиатуса псевдотуберкулезного и чумного микробов и поддержание внутри- и межвидовых отношений обеспечили синтезированные на заключительном этапе видообразования протеины-регуляторы Pst и Pim, кодированные на более молодой малой плазмиде pPst.
Итак, согласно экологическому сценарию, формирование характерных для чумного микроба видоспецифических свойств вирулентности и трансмиссивности прошло с участием аддитивных генетических новаций. К факторам базовой вирулентности предкового псевдотуберкулезного микроба (T3SS, Yops, Ail) добавился специфический механизм бубонной чумы (сначала Caf1, кодированный на плазмиде pFra, затем Pla, кодированный на более молодой плазмиде pPst). Таким образом, современная чума несет признаки как примитивной септической формы, так и признаки продвинутой бубонной чумы (Sebbane et al., 2006). К базовой способности образовывать защитный экстрацеллюлярный матрикс у псевдотуберкулезного микроба (Hms-фактор) добавилось свойство противостоять ферментативной активности пищеварительной системы блохи и формировать за счет экстрацеллюлярного матрикса блок преджелудка у блох (Ymt-фактор), обеспечившее возникновение трансмиссивной передачи.
ГРАДАЦИЯ ИЛИ САЛЬТАЦИЯ?
При сравнении многочисленных фактов, накопленных при МГ- и экологическом подходах к проблеме происхождения чумы, и озвученных из них выводов неизбежно возникает вопрос: какой путь видообразования более доверительный: сальтационный или постепенный градуальный? Приведем три феномена, характеризующих видообразовательный процесс, экологическая интерпретация которых склоняет в пользу постепенного, но быстропротекавшего адаптациогенеза – идея квантовой постепенности видообразовательного процесса (Сунцов, 2018а).
• Переход от исходного специализированного (через М-клетки тонкого кишечника) алиментарного заражения псевдотуберкулезом к специализированному трансмиссивному заражению через укусы блох при чуме прошел, как это следует из экологического сценария, через стадию неспециализированного раневого заражения вследствие нарушения слизистой ротовой полости спящих сурков-тарбаганов личинками блохи O. silantiewi. Личиночный паразитизм у блох – обычное явление в условиях холодного климата (Сунцов, Сунцова, 2006). Такое механическое заражение с последующей первичной бактериемией, во-первых, не требовало каких-либо новых адаптаций к преодолению эпителиальных барьеров, во-вторых, принцип заражения псевдотуберкулезным микробом через личиночные скарификации и через укусы блох, по большому счету, единый – раневой: личинки прогрызают эпителиальный слой в ротовой полости сурков и достигают кровеносных капилляров и лимфатических сосудов, открывая возбудителю прямой доступ в кровь и субэпителиальные ткани; взрослые блохи просверливают лациниями эпителиальный слой с теми же последствиями. Таким образом, формирование трансмиссивного способа передачи началось в популяциях торпидного (Тт ≈ 5°С) сурка-тарбагана с возникновением массовой псевдотуберкулезной бактериемии как раневой инфекции, инициированной личинками O. silantiewi, а в процессе адаптации микроба post-pseudotuberculosis к циркуляции в популяциях гетеротермного и активного сурка-тарбагана (Тт = 5–37°С) заражение стали осуществлять имаго O. silantiewi квазираневым, более специализированным способом.
• Эпизоотический процесс при чуме возможен при наличии бактериемии интенсивностью ≥ 107 клеток на 1 мл крови, при которой хотя бы несколько микробных тел могут попасть в пищеварительный тракт блохи после разового кровососания (Lorange et al., 2005). Соответственно, не меньшая концентрация в крови должна быть и у предка чумного микроба. В организме торпидного сурка (Тт ≈ 5°С) при низкой интенсивности иммунных процессов такая концентрация микробных клеток после раневого заражения, надо полагать, обычное явление, так как псевдотуберкулезный микроб интенсивно размножается при низких положительных температурах в культуре ткани, курином эмбрионе, блохах, организме иммуносупрессированных животных (Гайдукова и др., 1975; Головачева, Жовтый, 1978; Ващенок, 1988; Слудский и др., 2003; Anisimov et al., 2005; Bouma et al., 2010; Sun et al., 2014). Первичная раневая псевдотуберкулезная септицемия торпидных сурков стала стартовым условием видообразования микроба чумы. Но для возникновения бактериемии в организме просыпающихся и активных сурков, у которых с повышением Тт иммунные процессы интенсифицируются, и, соответственно, инфекционные агенты элиминируются, потребовались адаптации к гетероиммунной среде по температурному вектору 5→37°С. Проявлением этой адаптации является эндоцеллюлярный синтез специфических плазмид вирулентности pFra и pPst.
• Заражение чумой через укусы блох осуществляется двумя путями: интраваскулярным и экстраваскулярным (Sebbane et al., 2006). При более редком интраваскулярном внедрении микроб вводится прямо в подкожный кровяной капилляр (подобно раневому заражению псевдотуберкулезом с участием личинок блох) с последующим развитием более примитивной первичной септицемической чумы без бубонных проявлений. Тканевых барьеров в этом случае инфекция не встречает, и адаптация микроба к их преодолению (проявлением которой является бубон) не требуется. Вирулентность как чумного, так и псевдотуберкулезного микробов при интраваскулярном заражении высокая (Sebbane et al., 2006; Guinet et al., 2008). При более часто случающемся экстраваскулярном внедрении возбудитель чумы распространяется по лимфоидной ткани до регионарных лимфатических узлов, и у хозяина развивается бубонная форма болезни, которая далее перерастает во вторичную септицемическую. Но у предкового псевдотуберкулезного микроба экстраваскулярное заражение не достигает бубонной стадии и не приводит к вторичной септицемии (Guinet et al., 2008). То есть у чумного микроба постепенно сформировались адаптации к преодолению межклеточных и межтканевых барьеров и развитию бубонной формы. Проявлением этой адаптации является активатор плазминогена (Pla), фактор вирулентности, закодированный на малой плазмиде pPst (Hinnebusch, 2005). Как нам представляется, гены этой плазмиды синтезировались на более поздних стадиях адаптациогенеза – надо полагать, в непосредственной связи и синхронно с адаптацией к оксидантному взрыву макрофагов в организме просыпающегося хозяина при Тт > 20–25°С, когда метаболические процессы в его организме протекают уже достаточно активно (Сунцов, 2019) (рис. 2).
Рис. 2.
Адаптациогенез микроба чумы: инактивация нефункциональных генов (inv, yad), сохранение функций активных генов (T3SS, hms, ail) и новообразование генов вирулентности (caf1, pla), трансмиссии (ymt) и регуляторов внутри- и межвидовых отношений (pst, pim). I–VI – обозначения см. рис. 1; ХРСМ – хромосома; плазмиды: pYV/pCad – кальцийзависимости, pFra – капсулопродукции; pPst – пестициногенности. Тт – температура тела сурков. * – предположительный нижний температурный порог окислительного взрыва макрофагов в организме просыпающихся сурков при Тт ≈ 20–25°С.
Как видим, экологическая интерпретация приведенных феноменов не требует привлечения парадигмы ГПГ.
ИНАДАПТИВНЫЕ, ПРЕАДАПТИВНЫЕ И АДАПТИВНЫЕ ГЕНЫ Y. pestis
Эволюция организмов всегда протекает по мозаичному принципу. В зависимости от адаптивной ценности в новых условиях одни признаки, утерявшие функциональную значимость, исчезают или инактивируются, другие, позволяющие виду заякориться и персистировать в новой среде, – сохраняются в мало измененном виде, третьи, направленные на полноценное освоение новых условий, – формируются заново в процессе адаптациогенеза (Тахтаджян, 1966; Тимофеев-Ресовский и др., 1972). Соответственно, гены и генетические структуры чумного микроба в зависимости от актуальности их функций характеризуются как инадаптивные, преадаптивные и (нео)адаптивные. Судьбу этих генов и генетических структур можно наглядно проследить на основе изложенного экологического сценария происхождения Y. pestis. В качестве иллюстрации адаптациогенеза на МГ-уровне (но не сальтации!) рассмотрим судьбу 10 достаточно хорошо изученных генов и генетических структур, кодирующих факторы вирулентности, трансмиссии и коммуникации (рис. 2).
Инадаптивные гены
В геноме чумного микроба обнаружено 298 генов, гомологичных генам Y. pseudotuberculosis, но утративших свои функции в новой среде обитания (Chain et al., 2004). Из них наиболее хорошо изучены гены inv и yad, кодирующие факторы вирулентности Y. pseudotuberculosis – протеины инвазин (Inv) и адгезин (YadA) (Анисимов, 2002). Эти протеины взаимодействуют с М-клетками Пейеровых бляшек тонкого кишечника и обеспечивают функцию инвазии эпителиальных клеток и субмукозных тканей кишечника млекопитающих (Wren, 2003; Atkinson, Williams, 2016). То есть это специализированные протеины возбудителя кишечной псевдотуберкулезной инфекции, и в связи со сменой пути заражения млекопитающих при чуме, минуя тонкий кишечник, оба гена в геноме Y. pestis инактивированы, первый – IS-вставкой, второй – делецией единичного нуклеотида аденина (Ерошенко и др., 2010). У чумного микроба функции инвазии и адгезии кодированы другими генетическими структурами, в том числе геном pla, локализованным на вновь синтезированной плазмиде pPst (Zhou et al., 2006). Подобным образом в процессе адаптациогенеза произошла утеря чумным микробом подвижности, О-антигена и уреазной активности. При этом известны реверсии последнего признака (Ure–/Ure+) (Вариабельность…, 2009; Zhou et al., 2006).
Согласно выводам молекулярной генетики, принято считать, что нарушения структуры белков YadA и Inv исходно возникли у одного из слабовирулентных подвидов чумного микроба группы Pestoides, которые относят к наиболее древним формам Y. pestis и от которых позднее, якобы, возник более вирулентный “основной” подвид, вызвавший три известные пандемии (Ерошенко и др., 2010). Эта МГ-идея не может объяснить уникальные экологические (биогеоценотические) обстоятельства инактивации генов yad и inv и перехода возбудителя чумы к трансмиссивному пути передачи в популяциях какого-либо вида грызунов в недавнее (в эволюционном масштабе) время, не ранее 30 тыс. лет назад, в аридных биогеоценозах, которые имели уже (почти) современный облик. На вопрос: какие изменения недавно произошли в организме первичного хозяина микроба чумы, которые привели к смене способа заражения – МГ не дает ответа. Наоборот, экологический сценарий наглядно демонстрирует прямой неадаптивный путь проникновения псевдотуберкулезного микроба в кровь с последующим возникновением бактериемии у первичного хозяина, как это случается при раневых инфекциях.
Преадаптивные гены
Преадаптивные гены и генетические структуры свойственны псевдотуберкулезному микробу и как функционально важные сохранились в геноме чумного микроба в малоизмененном виде. В геномах чумного и псевдотуберкулезного микробов обнаружено более 300 общих генов и генных комплексов, отвечающих за реализацию общеметаболических клеточных функций (Willcocks et al., 2018). Помимо этого, обоим микробам свойственна плазмида кальций-зависимости pYV/pCad – детерминанта вирулентности патогенных Yersinia. К хорошо изученным общим признакам относятся рассматриваемые ниже два фактора вирулентности и фактор трансмиссии.
T3SS – крупный локализованный на плазмиде pYV/pCad секреторный аппарат-система всех патогенных Yersinia, базовый фактор вирулентности, с помощью которого протеины внешней мембраны микроба (Yops) транспортируются непосредственно в эукариотическую клетку хозяина (молекулярный шприц).
ail – хромосомный локус, кодирует поверхностный протеин Ail, регулирующий проявление свойств адгезии и инвазии к тканевым клеткам хозяина и резистентность к гуморальным факторам иммунитета (Barta et al., 2008; Felek, Krukonis, 2009; Kolodziejek et al., 2012; Thomson et al., 2019). Функция Ail, обеспечивающая взаимодействие предкового псевдотуберкулезного микроба с гуморальными факторами иммунитета хозяина, оказалась чрезвычайно важной и для дочернего вида – микроба чумы, так как согласно экологическому сценарию стартовым условием его видообразования было прямое попадание псевдотуберкулезного микроба в кровяную систему спящих сурков-тарбаганов и последующая травматическая псевдотуберкулезная септицемия. В связи с этим структура кодирующего гена ail у последнего сохранилась почти в неизменном виде (Ерошенко и др., 2010), а сам ген следует считать преадаптивной генетической структурой, обеспечившей заякоривание псевдотуберкулезного микроба в новой среде обитания, в нашем сценарии – в популяциях монгольского сурка-тарбагана. Особенностью белка Ail чумного микроба является проявление активности не только в организме теплокровных хозяев, имеющих температуру тела около 37°С, но и при более низких (28°С) температурах, что обычно связывают с устойчивостью микроба чумы к бактерицидным факторам в пищеварительном тракте блохи (Ерошенко и др., 2010). В соответствии же с экологическим сценарием, активность Ail в холодной крови хозяина можно рассматривать как преадаптивное свойство противостояния факторам комплемента крови, перешедшее от предкового псевдотуберкулезного микроба и стабилизировавшееся в процессе адаптациогенеза в популяциях исходного гетеротермного (5–37°С) хозяина микроба чумы – монгольского сурка-тарбагана – во время зимней спячки.
hms – совокупность хромосомных генов (оперон), кодирующих протеины Hmss, ответственные за синтез экстрацеллюлярного матрикса, формирующего биопленку у псевдотуберкулезного и чумного микробов при температуре ≤ 26°С (Hinnebusch, 2005). У псевотуберкулезного микроба этот оперон – молекулярно-генетическая основа адаптации к колониальному обитанию во внешней неживой органике, богатой конкурирующими прокариотными видами. Матрикс является физико-химическим средством борьбы за существование в мультимикробном сообществе. У микроба чумы экстрацеллюлярный матрикс выполняет несколько иную функцию. Он участвует в формировании блока преджелудка блохи-переносчика и, таким образом, специфической трансмиссивной передачи. В процессе видообразования Y. pestis блок преджелудка блохи обеспечивал пролонгированное переживание промежуточной формой pseudotuberculosis/pestis летнего периода в популяциях блох (но не в популяциях сурков), так как летом активные сурки обладают полноценным иммунитетом и переходные формы микроба в их организме элиминируются (Сунцов, 2018а).
(Нео)адаптивные гены
Гены, синтезированные в процессе видообразования и специфичные для микроба чумы, следует рассматривать как (нео)адаптивные. Детальный геномный анализ Y. pestis и Y. pseudotuberculosis выявил две специфические для чумного микроба плазмиды pFra и pPst и, по меньшей мере, шесть хромосомных регионов, которые являются уникальными для микроба чумы и представляют вновь приобретенный генетический материал (Chain et al., 2004). К наиболее наглядным новым фенотипическим признакам чумного микроба следует отнести образование бубона и трансмиссивную передачу через укусы блох.
caf1 кодирует на большой плазмиде pFra синтез капсульного антигена F1, который ингибирует фагоцитоз микроба макрофагами и является аддитивным к базовым факторам вирулентности Ail и T3SS. Антиген Caf1 ингибирует фагоцитоз с помощью иного механизма, нежели T3SS и наряду с Pla участвует в формировании бубона (Zhou, Yang, 2009).
ymt локализован также на большой плазмиде pFra и кодирует синтез токсина Ymt – фактора трансмиссии, аддитивного к базовому Hms-фактору. Он поддерживает пролиферацию микроба в пищеварительном тракте блох и оптимизирует процесс блокообразования (Hinnebusch, 2005; Eisen, Gage, 2009; Sun et al., 2014). Как нам представляется, формирование блока преджелудка блох на ранних этапах адаптациогенеза стало адаптацией переходной формы pseudotuberculosis/pestis к пролонгированной персистенции в популяциях блохи O. silantiewi в течение сезона наземной активности сурка-тарбагана (апрель–сентябрь), когда Тт зверьков составляет около 37°С и исходный психрофильный возбудитель тотально элиминируется механизмами иммунитета активных животных.
pla кодирует активатор плазминогена (Pla) – специфический фактор вирулентности, обеспечивающий преодоление микробом чумы, интродуцированным интрадермально (но не интравенозно), межклеточных и тканевых барьеров, формирование бубона и диссеминацию организма зараженного хозяина (Sebbane et al., 2006; Guinet et al., 2008). На ранних стадиях преобразования псевдотуберкулезного микроба в возбудителя чумы заражение спящего первичного хозяина (сурка-тарбагана, Тт = 5°С), согласно экологическому сценарию, проходило интравенозно раневым способом. Более поздний синтез гена в структуре малой плазмиды стал следствием постепенной адаптации (но не ГПГ!) микроба чумы к циркуляции в популяции активных сурков (Тт = 37°С) в теплый период года. Завершение синтеза pla привело к дуалистическому проявлению чумы – в примитивной септической и продвинутой бубонной форме.
pst кодирует синтез бактериоцина пестицина (Pst). Pst – фактор коммуникации – эффективно подавляет рост своего прямого предка, очищает популяцию от более примитивных клеток с предковыми свойствами. Эволюционная функция пестицина состояла в создании межвидового хиатуса между предковым Y. pseudotuberculosis и дочерним Y. pestis видами на более поздней стадии адаптациогенеза. МГ не рассматривает биологическую роль пестицина как индуктора межвидового хиатуса, предполагается его роль в обмене железа и формировании свойства вирулентности к хозяину (Вариабельность…, 2009).
pim функционально тесно связан с геном pst. Он кодирует чувствительность к пестицину и регулирует процессы внутривидовой борьбы за существование, обеспечивает отбор pst-синтезирующих клеток (Вариабельность…, 2009; Rakin et al., 1996). Функции генов pst и pim и их взаимосвязи с геном pla, размещенным на той же плазмиде pPst, пока остаются недостаточно изученными, хотя они в большой мере характеризуют эволюционные коллизии возбудителей чумы и псевдотуберкулеза.
Следует отметить, что функции специфических плазмид чумного микроба pFra и pPst были абсолютно востребованы только в процессе видообразования. При дальнейшей адаптивной радиации в процессе территориальной экспансии из популяций монгольского сурка они могли элиминироваться или инактивироваться (Кавказ, Прибалхашье) без утери общего свойства вирулентности (Вариабельность…, 2009).
Итак, можно видеть, что судьба 10 описанных генов чумного микроба находится в полном соответствии с градуалистическим и популяционным подходами СТЭ.
ПЕРСПЕКТИВЫ СИНТЕЗА МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ И ЭКОЛОГИИ
Лавинообразно нарастающий в последние два десятилетия объем МГ-данных о структуре геномов псевдотуберкулезного и чумного микробов дает богатый материал для изучения их изменчивости, в том числе наследственной, – одного из главных факторов эволюции. Разработано множество МГ-методов, позволяющих на основе сравнения генетических структур выстраивать филогении рода Yersinia и вида Y. pestis. Но полноценными и убедительными МГ-филогении могут быть лишь в том случае, если они согласуются с данными других естественных наук, изучающих жизнь, и прежде всего экологии (Achtman, 2008).
Два определившихся в настоящее время основных подхода к проблеме происхождения микроба чумы – МГ и экологический – опираются на разные эволюционные идеологии. МГ-подход в вопросах видообразования следует идеям сальтационизма и ГПГ. Экологический подход следует идеям градуализма и “вертикального” наследования признаков, опирается на положения СТЭ. Поэтому вполне надежные и достоверные факты, данные и закономерности, полученные каждым из этих подходов, находят различные эволюционные толкования и приводят к разным выводам, чего при объективном анализе не должно быть.
Так, все МГ-сценарии связывают происхождение микроба чумы от псевдотуберкулезного предка с встраиванием извне двух специфических плазмид pFra и pPst, кодирующих факторы вирулентности, трансмиссии и коммуникации, свойственные исключительно возбудителю чумы. То есть, МГ-сценарии прокламируют наличие в природе вне популяций возбудителя чумы сложных генетических структур, обладающих проспективными для этого микроба уникальными свойствами. Механизм происхождения таких проспективных генетических структур в природе МГ-подход не объясняет и условий, индуцирующих их горизонтальное встраивание в псевдотуберкулезную клетку, не раскрывает. И этот отрыв от реальной природы вызывает глубокое недоверие к МГ-филогениям.
Экологический подход видится менее противоречивым и более наглядным, хотя не лишен определенных недостатков и пока не привлекает для аналитических построений весь арсенал МГ-достижений. Экологический сценарий убедительно увязывает уникальность видообразования микроба чумы с массовым заражением псевдотуберкулезом монгольского сурка-тарбагана тривиальным травматическим способом. К массовому заражению привели сдвиги в поведении сурка-тарбагана и паразитирующих на нем блох. Модификации поведения монгольского сурка и его специфической блохи были вызваны уникальным совмещением в Центральной Азии двух глобальных абиотических явлений – постепенным длительным усилением континентальности климата в кайнозое и относительно быстрым наступлением максимального (сартанского) похолодания на рубеже плейстоцена и голоцена (Сунцов, Сунцова, 2006). Апелляция к этим двум природным обстоятельствам позволяет логично вписать процесс видообразования микроба чумы в канву известных биогеоценотических и эволюционных событий, произошедших в природе Центральной Азии в течение Четвертичного периода и голоцена, в частности.
И все-таки, несмотря на несовершенство и разительное несходство экологической и МГ-филогений микроба чумы, между экологическим и МГ-подходами в вопросах происхождения чумы нет непреодолимой пропасти. Более того, как и должно быть, просматривается неизбежный будущий консенсус. Экологический сценарий открывает возможности для интерпретации МГ-фактов с позиций СТЭ. Следуя логике СТЭ, надо признать, что переход псевдотуберкулезного микроба в радикально новую среду обитания с образованием нового вида Y. pestis проходил постепенно, градуально в конкретное геологическое время, в конкретном географическом районе Земли, а именно, в условиях психроаридного климата Центральной Азии на рубеже плейстоцена и голоцена в популяциях одного конкретного хозяина и его специфической блохи при эксклюзивном стечении экологических обстоятельств. Также постепенно, без участия скачкообразного ГПГ, в континуальной промежуточной гетеротермной и гетероиммунной среде протекали видообразующие популяционно-генетические процессы, изменялись микробные МГ-признаки, постепенно элиминировались или инактивировались гены предкового микроба Y. pseudotuberculosis O:1b, терявшие функциональную значимость в промежуточной среде обитания, и эндогенно (эндоцеллюлярно) синтезировались новые гены, обеспечивающие видоспецифические адаптации Y. pestis. Судьбу 10 генов-признаков мы проиллюстрировали в настоящей работе. Успешная инкорпорация в предложенный экологический сценарий других, уже выявленных функционально значимых МГ- и надмолекулярных признаков, и тех, что будут выявляться по мере решения проблемы, должна привести к эколого-молекулярно-генетическому синтезу в рассмотрении проблемы происхождения микроба чумы. Такой междисциплинарный синтез станет основой достаточно простой и наглядной дидактической модели быстрого видообразования чумоподобных патогенных прокариот, позволит разработать современные методы их искусственной селекции в научных и прагматических целях, а также откроет широкие перспективы в противоэпидемической практике, совершенствовании системы биологической (бактериологической) безопасности и создании передовых бактериологических технологий.
ЗАКЛЮЧЕНИЕ
Широко используемым в настоящее время в филогенетике молекулярно-генетическому и эколого-морфологическому подходам свойственны как преимущества, так и недостатки (Абрамсон, 2013). Один из главных недостатков МГ-подхода состоит в том, что он не дает содержательной биологической (экологической) интерпретации филогенетических схем. Выводы о МГ-филогенезах таксонов, сделанные при использовании разных методов и для разных маркеров, порой удручающе не соответствуют выводам классических исследований. Что касается проблемы чумы, то очевидным недостатком МГ-методов является ненадежность суждений о горизонтальном встраивании откуда-то извне специфических для чумного микроба плазмид pFra и pPst в псевдотуберкулезную клетку с последующим формированием нового вида – микроба чумы. Другим большим недостатком является ненадежность датировок филогенетических событий по молекулярным часам, ход которых далек от равномерного. С другой стороны, МГ-данные позволили отыскать прямого предка чумного микроба. Им оказался возбудитель псевдотуберкулеза 1-го серотипа. Другими, действительно революционными достижениями МГ-исследований, стали и бесспорное доказательство эволюционной молодости микроба чумы (классические датировки возникновения микроба чумы относились к олигоцену–плиоцену), и доведенная до совершенства диагностика внутривидовых форм Y. pestis. Эти МГ-достижения позволили пересмотреть ранее накопленные данные классических исследований по проблеме происхождения чумы и создать сценарий, согласующий молекулярно-генетический и экологический подходы, а многочисленные гипотезы о происхождении чумы, отражающие отдельные аспекты проблемы, направить в русло развития единой консолидированной теории. Время противопоставления экологической и молекулярной филогений микроба Y. pestis завершается. Такие малоконструктивные противопоставления должны смениться скрупулезным анализом возможных причин противоречий, технических и методических ограничений и возможностей каждого из подходов. Перспектива решения вопроса о филогении и внутривидовой системе чумного микроба состоит в синтетическом подходе (Сунцов, 2018б, 2019) с обязательным глубоким анализом как экологических (в самом широком плане), так и молекулярных данных с перекрестной оценкой выводов.
Список литературы
Абрамсон Н.И. Филогеография: итоги, проблемы, перспективы // Вестн. ВОГиС. 2007. Т. 11. № 2. С. 307–331.
Абрамсон Н.И. Молекулярная и традиционная филогенетика. На пути к взаимопониманию // Труды ЗИН РАН. Прил. 2. 2013. С. 219–229.
Анисимов А.П. Факторы Yersinia pestis, обеспечивающие циркуляцию и сохранение возбудителя чумы в экосистемах природных очагов. Сообщение 1 // Мол. генет. 2002. № 3. С. 3–23.
Анисимов Н.В., Кисличкина А.А., Платонов М.Е. и др. О происхождении гипервирулентности возбудителя чумы // Мед. паразитол. паразит. болез. 2016. № 1. С. 36–32.
Вариабельность возбудителя чумы и проблемы его диагностики // Ред. Ю.М. Ломов. Ростов н/Д.: Антей, 2009. 534 с.
Ващенок В.С. Блохи (Siphonaptera) – переносчики возбудителей болезней человека и животных. Л.: Наука, 1988. 161 с.
Гайдукова Н.С., Сурков B.C., Конькова К.В., Сучкова Н.С. К характеристике штаммов псевдотуберкулезного микроба, выделенных из эктопаразитов и кровососущих двукрылых на Сахалине // Проб. особо опас. инф. 1975. Вып. 2 (42). С. 116–120.
Головачева В.Я., Жовтый И.Ф. Дальнейшие наблюдения за естественной зараженностью эктопаразитов мелких млекопитающих возбудителями бактериальных инфекций в природных очагах чумы Сибири и МНР // Эпидемиология и профилактика особо опасных инфекций в МНР и СССР. Улан-Батор: Госиздат, 1978. С. 99–100.
Дубинин Н.П. Эволюция популяций и радиация. М.: Атомиздат, 1966. 743 с.
Ерошенко Г.А., Одиноков Г.Н., Куклева Л.М. и др. Сравнительный анализ нуклеотидной последовательности генов yadA, inv и ail и их экспрессия в штаммах Yersinia pestis основного и неосновных подвидов и Yersinia pseudotuberculosis // Генетика. 2010. Т. 46. № 6. С. 734–741.
Жовтый И.Ф., Пешков Б.И. Наблюдения над перезимовкой блох тарбагана в Забайкалье // Изв. Иркутск. противочум. инст. Сибири и Дальнего Востока. 1958. Т. 17. С. 27–32.
Иорданский Н.Н. Эволюция жизни. М.: Академия, 2001. 425 с.
Кисличкина А.А., Платонов М.Е., Вагайская А.С. и др. Рациональная таксономия Yersinia pestis // Мол. ген. микробиол. вирусол. 2019. Т. 37. № 2. С. 76–82.
Куклева Л.М., Бойко А.В. Активатор плазминогена – многофункциональный белок возбудителя чумы // Пробл. особо опас. инф. 2016. № 3. С. 13–20.
Куклева Л.М., Ерошенко Г.А., Видяева Н.А., Кутырев В.В. Бактериальная биопленка и особенности ее образования у возбудителя чумы и других патогенных иерсиний // Пробл. особо опас. инф. 2011. № 110. С. 5–11.
Майр Э. Популяции, виды и эволюция. М.: Мир, 1974. 460 с.
Павлинов И.Я. Введение в современную филогенетику. М.: КМК, 2005а. 392 с.
Павлинов И.Я. Новая филогенетика: источники и составные части // Эволюционные факторы формирования разнообразия животного мира / Ред. Э.И. Воробьева, Б.Р. Стриганова. М.: КМК, 2005б. С. 15–29.
Симпсон Дж. Темпы и формы эволюции. М.: Иностранная литература, 1948. 358 с.
Слудский А.А., Дерлятко К.И., Головко Э.Н., Агеев В.С. Гиссарский природный очаг чумы. Саратов: СГУ, 2003. 248 с.
Степанов В.М., Темиралиева Г.А., Лухнова Л.Ю. и др. Экспериментальная оценка разных способов определения жизнеспособности возбудителя чумы в естественных условиях // Проблемы природной очаговости чумы. Ч. 2 / Тез. докл. IV сов.-монг. конф. спец. противочум. учрежд. Кызыл, 1980. Иркутск: 1980. С. 82–84.
Сунцов В.В. Экологические аспекты происхождения микроба чумы Yersinia pestis: концепция промежуточной среды // Сиб. экол. журн. 2014. Вып. 1. С. 3–16.
Сунцов В.В. Происхождение микроба чумы Yersinia pestis: концепция популяционно-генетической макроэволюции в переходной среде // Журн. общ. биол. 2015. Т. 76. № 4. С. 310–318.
Сунцов В.В. Рецентное видообразование микроба чумы Yersinia pestis в гетеротермной (гетероиммунной) среде сурок–блоха (Marmota sibirica–Oropsylla silantiewi): биогеоценотические предпосылки и преадаптации // Успехи соврем. биол. 2016. Т. 136. № 6. С. 553–567.
Сунцов В.В. Квантовое видообразование микроба чумы Yersinia pestis в гетероиммунной среде – популяциях гибернирующих сурков-тарбаганов (Marmota sibirica) // Сиб. экол. журн. 2018а. № 4. С. 381–396.
Сунцов В.В. Генезис трансмиссивной передачи микроба чумы Yersinia pestis: два подхода – молекулярно-генетический и экологический // Пробл. особо опас. инф. 2018б. № 2. С. 37–44.
Сунцов В.В. Исключительная роль специфической блохи сурков Oropsylla silantiewi (Ceratophyllidae: Siphonaptera) в видообразовании возбудителя чумы – микроба Yersinia pestis // Паразитология. 2018в. Т. 52. № 1. С. 3–18.
Сунцов В.В. Происхождение чумы. Перспективы эколого-молекулярно-генетического синтеза // Вестник РАН. 2019. Т. 89. № 3. С. 260–269.
Сунцов В.В., Сунцова Н.И. Экологические аспекты эволюции микроба чумы Yersinia pestis и генезис природных очагов // Изв. РАН. Сер. биол. 2000. № 6. С. 645–657.
Сунцов В.В., Сунцова Н.И. Чума. Происхождение и эволюция эпизоотической системы (экологические, географические и социальные аспекты). М.: КМК, 2006. 247 с.
Сунцов В.В., Сунцова Н.И. Макро- и микроэволюция в проблеме происхождения и мировой экспансии возбудителя чумы Yersinia pestis // Изв. РАН. Серия биол. 2008. Вып. 4. С. 389–395.
Сунцов В.В., Сунцова Н.И. Принцип видообразования микроба чумы Yersinia pestis: градуализм или сальтационизм? // Изв. РАН. Сер. биол. 2009. № 6. С. 645–653.
Тахтаджян А.Л. Основы эволюционной морфологии покрытосеменных. М., Л.: Наука, 1966. 252 с.
Тимофеев-Ресовский Н.В., Воронцов Н.Н., Яблоков А.Я. Краткий очерк теории эволюции. М.: Наука, 1972. 302 с.
Achtman M. Evolution, population structure, and phylogeo-graphy of genetically monomorphic bacterial pathogens // Ann. Rev. Microbiol. 2008. V. 62. P. 53–70.
Achtman M., Zurth K., Morelli G. et al. Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis // PNAS USA. 1999. V. 96. № 24. P. 14043–14048.
Anisimov A.P., Dentovskaya S.V., Titareva G.M. et al. Intraspecies and temperature-dependent variations in susceptibility of Yersinia pestis to the bactericidal action of serum and to polymyxin B // Inf. Immun. 2005. V. 73. № 11. P. 7324–7331.
Atkinson S., Williams P. Yersinia virulence factors – a sophisticated arsenal for combating host defences // F1000 Facul. Rev. 2016. V. 5. P. 1370.
Bartra S.S., Styer K.L., O’Bryant D.M. et al. Resistance of Yersinia pestis to complement-dependent killing is mediated by the Ail outer membrane protein // Inf. Immun. 2008. V. 76. № 2. P. 612–622.
Bercovier H., Mollaret H., Alonso J.M. et al. Intra- and interspecies relatedness of Yersinia pestis by DNA hybridization and its relationship to Yersinia pseudotuberculosis // Curr. Microbiol. 1980. V. 4. № 4. P. 225–229.
Bock W.J. The role of adaptive mechanisms in the origin of higher levels of organization // Syst. Zool. 1965. V. 14. № 4. P. 272–287.
Bouma H.R., Carey H.V., Kroese F.G.M. Hibernation: the immune system at rest? // J. Leukoc. Biol. 2010. V. 88. P. 619–624.
Carey H.V., Andrews M.T., Martin S.L. Mammalian hibernation: cellular and molecular responses to depressed metabolism and low temperature // Physiol. Rev. 2003. V. 83. P. 1153–1181.
Cathelyn J.S., Ellison D.W., Hinchliffe S.J. et al. The RovA regulons of Yersinia enterocolitica and Yersinia pestis are distinct: evidence that many RovA-regulated genes were acquired more recently then the core genome // Mol. Microbiol. 2007. V. 66. P. 189–205.
Chain S.G., Carniel E., Lavimer F.W. et al. Insights into the evolution of Yersinia pestis through whole-genome comparison with Yersinia pseudotuberculosis // PNAS USA. 2004. V. 101. P. 13826–13831.
Connor M.G., Pulsifer A.R., Chung D. et al. Yersinia pestis targets the host endosome recycling pathway during the biogenesis of the Yersinia-containing vacuole to avoid killing by macrophages // mBio. 2018. V. 9. № 1. P. 1–19.
Cui Y., Song Y. Genome and evolution of Yersinia pestis // Yersinia pestis: retrospective and perspective. Ch. 6 / Eds R. Yang, A. Anisimov. Dordrecht: Springer, 2016. P. 171–192.
Cui Y., Yu C., Yan Y. et al. Historical variations in mutation rate in an epidemic pathogen, Yersinia pestis // PNAS USA. 2013. V. 110. № 2. P. 577–582.
Demeure C.E., Dussurget O., Mas Fiol G. et al. Yersinia pestis and plague: an updated view on evolution, virulence determinants, immune subversion, vaccination, and diagnostics // Gen. Immun. 2019. V. 20. P. 357–370.
Diggle S.P. Microbial communication and virulence: lessons from evolutionary theory // Microbiology. 2010. V. 156. P. 3503–3512.
Eisen R.J., Gage K.L. Adaptive strategies of Yersinia pestis to persist during inter-epizootic and epizootic periods // Vet. Res. 2009. V. 40. № 1. P. 1–14.
Eppinger M., Worsham P.L., Nikolich M.P. et al. Genome sequence of the deep-rooted Yersinia pestis strain Angola reveals new insights into the evolution and pangenome of the plague bacterium // J. Bacteriol. 2010. V. 192. № 6. P. 1685–1699.
Erickson D.L., Jarrett C.O., Wren B.W. et al. Serotype differences and lack of biofilm formation characterize Yersinia pseudotuberculosis infection of the Xenopsylla cheopis flea vector of Yersinia pestis // J. Bacteriol. 2006. V. 188. № 3. P. 1113–1119.
Felek S., Krukonis E.S. The Yersinia pestis Ail protein mediates binding and Yop delivery to host cells required for plague virulence // Infec. Immun. 2009. V. 77. № 3. P. 825–836.
Guinet F., Ave P., Jones L. et al. Defective innate cell response and lymph node infiltration specify Yersinia pestis infection // PLoS One. 2008. V. 3. № 2. P. e1688.
Hinnebusch B.J. The evolution of flea-borne transmission in Yersinia pestis // Curr. Iss. Mol. Biol. 2005. V. 7. № 2. P. 197–212.
Hinnebusch B.J., Chouikha I., Sun Y.C. Ecological opportunity, evolution, and the emergence of flea-borne plague // Infect. Immun. 2016. V. 84. № 7. P. 1932–1940.
Hinnebusch B.J., Jarrett C.O., Bland D.M. “Fleaing” the plague: adaptation of Yersinia pestis to its insect vector that lead to transmission // Ann. Rev. Microbiol. 2017. V. 71. P. 215–232.
Kolodziejek A.M., Hovde C.J., Minnich S.A. Yersinia pestis Ail: multiple roles of a single protein // Front. Cell Infect. Microbiol. 2012. V. 2. № 103. P. 1–10.
Kutyrev V., Protsenko O., Smirnov G. et al. Yersinia pestis from natural foci // Adv. Exp. Biol. Med. 2004. V. 529. P. 313–316.
Kutyrev V.V., Eroshenko G.A., Motin V.L. et al. Phylogeny and classification of Yersinia pestis through the lens of strains from the plague foci of Commonwealth of Independent States // Front. Microbiol. 2018. V. 9. P. 1–11.
Levin B.R., Bergstrom C.T. Bacteria are different: observations, interpretations, speculations, and opinions about the mechanisms of adaptive evolution in procariotes // PNAS USA. 2000. V. 97. № 13. P. 6981–6985.
Li Y., Cui Y., Hauck Y. et al. Genotyping and phylogenetic analysis of Yersinia pestis by MLVA: insights into the worldwide expansion of Central Asia plague foci // PLoS One. 2009. V. 4. № 6. P. e6000.
Lorange E.A., Race B.L., Sebbane F., Hinnebusch J. Poor vector competence of fleas and the evolution of hypervirulence in Yersinia pestis // J. Infec. Dis. 2005. V. 191. P. 1907–1912.
MacLean R.C. Adaptive radiation in microbial microcosms // J. Evol. Biol. 2005. V. 18. P. 1376–1386.
McNally A., Thomson N.R., Reuter S., Wren B.W. “Add, stir and reduce”: Yersinia spp. as model bacteria for pathogen evolution // Nat. Rev. Microbiol. 2016. V. 14. № 3. P. 177–190.
Morelli G., Song Y., Mazzoni C.J. et al. Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity // Nat. Genet. 2010. V. 42. № 12. P. 1140–1143.
Ortmann S., Heldmaier G. Regulation of body temperature and energy requirements of hibernating alpine marmots (Marmota marmota) // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2000. V. 278. № 3. P. 698–704.
Prentice M.B., James K.D., Parkhill J. et al. Yersinia pestis pFra shows biovar-specific differences and recent common ancestry with a Salmonella enteric Typhy plasmid // J. Bacteriol. 2001. V. 183. № 8. P. 2586–2594.
Ragan M.A., Beiko R.G. Lateral genetic transfer: open issues // Phil. Trans. R. Soc. B. 2009. № 364. P. 2241–2251.
Rakin A., Boolgakowa E., Heesemann J. Structural and functional organization of the Yersinia pestis bacteriocin pesticin gene cluster // Microbiology. 1996. V. 142. P. 3415–3424.
Rasmussen S., Allentoft M.E., Nielsen K. et al. Early divergent strains of Yersinia pestis in Eurasia 5,000 years ago // Cell. 2015. V. 163. № 3. P. 571–582.
Sebbane F., Jarrett C.O., Gardner D., Long D. Role of the Yersinia pestis plasminogen activator in the incidence of distinct septicemic and bubonic forms of flea-borne plague // PNAS USA. 2006. V. 103. № 14. P. 5526–5530.
Skurnik M., Peippo A., Ervela E. Characterization of the O-antigen gene cluster of Yersinia pseudotuberculosis and the cryptic O-antigen gene cluster of Yersinia pestis shows that the plague bacillus is most closely related to and has evolved from Y. pseudotuberculosis serotype O:1b // Mol. Microbiol. 2000. V. 37. № 2. P. 316–330.
Sun Y., Jarrett C.O., Bosio C.F., Hinnebusch B.J. Retracing the evolutionary path that led to flea-borne transmission of Yersinia pestis // Cell Host Microbe. 2014. V. 15. № 5. P. 578–586.
Thomson J.J., Plecha S.C., Krukonis E.S. Ail provides multiple mechanisms of serum resistance to Yersinia pestis // Mol. Microbiol. 2019. V. 111. № 1. P. 82–95.
Wang X., Zhou D., Qin L. et al. Genomic comparison of Yersinia pestis and Yersinia pseudotuberculosis by combination of suppression subtractive hybridization and DNA microarray // Arch. Microbiol. 2006. V. 186. P. 151–159.
West S.A., Diggle S.P., Buckling A. et al. The social lives of microbes // Ann. Rev. Ecol. Evol. Syst. 2007. V. 38. P. 53–77.
Willcocks S.J., Stabler R.A., Atkins H.S. et al. High-throughput analysis of Yersinia pseudotuberculosis gene essentiality in optimized in vitro conditions, and implications for the speciation of Yersinia pestis // BMC Microbiol. 2018. V. 18. № 6. P. 1–11.
Wren B.W. The Yersinia – a model genus to study the rapid evolution of bacterial pathogen // Nat. Rev. Microbiol. 2003. V. 1. P. 55–64.
Zhou D., Yang R. Molecular darwinian evolution of virulence in Yersinia pestis // Infect. Immun. 2009. V. 77. № 6. P. 2242–2250.
Zhou D., Han Y., Song Y. et al. Comparative and evolutionary genomics of Yersinia pestis // Microb. Infec. 2004. V. 6. № 13. P. 1226–1234.
Zhou D., Han Y., Yang R. Molecular and physiological insights into plague transmission, virulence and etiology // Microb. Infec. 2006. V. 8. № 1. P. 273–284.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


