Успехи современной биологии, 2020, T. 140, № 2, стр. 166-182
Перенос энергии в светособирающих аппаратах природного фотосинтеза
А. Г. Яковлев 1, *, А. С. Таисова 1, З. Г. Фетисова 1
1 НИИ физико-химической биологии им. А.Н. Белозерского Московского государственного университета
им. М.В. Ломоносова
Москва, Россия
* E-mail: yakov@genebee.msu.ru
Поступила в редакцию 05.12.2019
После доработки 05.12.2019
Принята к публикации 11.12.2019
Аннотация
Фотосинтез – это уникальное биологическое явление, в процессе которого солнечный свет используется живой природой с высокой эффективностью для синтеза органических соединений. Дан аналитический обзор работ, посвященных первичным процессам миграции энергии поглощенного солнечного света в антенных комплексах фотосинтеза. Анализируются многочисленные данные по переносу энергии в светособирающих комплексах высших растений, водорослей и ряда фотосинтезирующих бактерий. Рассмотрены основные теоретические подходы, моделирующие перенос энергии возбуждения в молекулярных агрегатах. Особое внимание уделено связи пространственной архитектуры и функции этих комплексов, а также когерентным явлениям, сопровождающим перенос энергии. Показаны очевидные успехи, достигнутые в изучении первичной стадии фотосинтеза, состоящей в поглощении света и передаче энергии возбуждения реакционным центрам. Показана тесная связь процессов переноса энергии и структурно-функциональной организации светособирающих комплексов различных фотосинтезирующих организмов. Высокая эффективность процессов миграции энергии в светособирающих комплексах обусловлена их высокой скоростью, которая намного превышает скорость потерь энергии. Обширный материал демонстрирует уникальную приспособляемость живой природы к различным условиям обитания. На примере когерентных явлений, сопровождающих перенос энергии в природном фотосинтезе, обсуждается фундаментальная связь между квантовым микромиром и миром живых организмов.
ВВЕДЕНИЕ
Фотосинтез – это один из основных природных процессов, определяющих жизнь на Земле. Вся биосфера Земли своим существованием прямо или косвенно обязана процессу фотосинтеза. Фотосинтез является глобальным биологическим явлением, в процессе которого фотосинтезирующие организмы преобразуют энергию поглощенного ими солнечного света в энергию химических связей, в результате чего происходит синтез органических соединений. Фотосинтез – единственный процесс в биосфере, ведущий к увеличению ее свободной энергии за счет внешнего источника. Запасенная в продуктах фотосинтеза энергия – основной источник энергии для человечества.
К фотосинтезирующим организмам относятся высшие растения, водоросли, а также группа фотосинтезирующих бактерий. Фотосинтез растений, водорослей и цианобактерий, при котором в качестве донора электронов используется вода, сопровождается ее разложением с выделением кислорода. При неоксигенном фотосинтезе в пурпурных и зеленых бактериях и гелиобактериях в качестве источника электронов используются другие восстановленные соединения, и выделения кислорода в атмосферу не происходит.
Процесс фотосинтеза протекает благодаря согласованной работе трех основных компонентов фотосинтетического аппарата: светособирающей антенны, фотохимических реакционных центров (РЦ) и электрон-транспортных цепей. Роль антенной системы заключается в поглощении солнечного света и доставке поглощенной энергии к РЦ. В РЦ происходит преобразование электромагнитной формы энергии в химическую. Электрон-транспортные цепи обеспечивают перенос электронов, сопряженный с запасанием энергии в молекулах аденозинтрифосфата. РЦ и передающие ему энергию возбуждения светособирающие антенны условно называют фотосинтетической единицей (ФСЕ).
Способность фотосинтезирующих организмов использовать энергию света обусловлена в первую очередь наличием у них специфических магнийпорфириновых пигментов – хлорофиллов (Хл) и бактериохлорофиллов (БХл) (рис. 1). Плоское тетрапиррольное кольцо с центральным атомом магния является общим для всех Хл и БХл. Известны пять основных видов Хл (a, b, c, d, f) и семь основных видов БХл (а, b, с, d, e, f, g), которые отличаются строением боковых цепей (Гусев, Минеева, 2003). Хл а – самый распространенный вид хлорофилла на Земле. Изменение химической природы боковых радикалов оказывает значительное влияние на спектральные характеристики Хл и БХл. Все известные магнийпорфириновые пигменты отличаются наличием нескольких максимумов поглощения в диапазоне 350–1100 нм. Следует отметить, что спектральные свойства хлорофиллов как составных частей фотосинтетического аппарата определяются нековалентными взаимодействиями молекул пигмента друг с другом, а также с белками и липидами фотосинтетических мембран. К вспомогательным фотосинтетическим пигментам, которые содержат все фотосинтезирующие организмы, относятся каротиноиды, основу которых составляют длинные полиизопреноидные цепи.
Рис. 1.
Обобщенная формула хлорофиллов. Римскими цифрами указаны пиррольные кольца. Химические формулы радикалов R1–R7 приведены в (Гусев, Минеева, 2003).

Основная масса фотосинтетических пигментов клетки находится в светособирающих антеннах – специализированных структурах, улавливающих световую энергию. Локализация светособирающих пигментов в разных группах фотосинтезирующих организмов различна (см. ниже).
Эффективность первичных фотофизических процессов конверсии поглощенной энергии света в фотосинтезе определяется эффективностью трех ее важнейших стадий: переноса энергии синглетного электронного возбуждения по светособирающей антенне к РЦ, передачи этой энергии от антенны к РЦ и стабилизации этой энергии в РЦ. Экспериментально определенные квантовые выходы этих стадий весьма высоки: квантовые выходы фотоокисления РЦ, измеренные в хроматофорах фотосинтезирующих бактерий и в препаратах изолированных РЦ, равны, соответственно, ≥90% и >98% (Клейтон, 1984).
Большая скорость миграции энергии по светособирающей антенне сама по себе еще не обеспечивает высокого квантового выхода передачи энергии от антенны к РЦ. Для этого необходима жесткая оптимизация структуры фотосинтезирующего аппарата по ряду функциональных параметров (Фетисова, Фок, 1984).
Представленный обзор рассматривает процессы светосбора и переноса энергии возбуждения в антенных комплексах фотосинтеза. Анализируется обширный фактический материал о путях и скоростях миграции энергии возбуждения в светособирающих комплексах высших растений, водорослей и ряда фотосинтезирующих бактерий. Пространственная структура антенных комплексов играет определяющую роль в их функционировании, поэтому в начале каждого из подразделов приведены минимально необходимые данные по молекулярной структуре. Кратко рассмотрены основные теоретические подходы, моделирующие перенос энергии возбуждения в молекулярных агрегатах. Это различные модификации теорий Фёрстера и Редфилда, а также теории более высокого ранга. Проведен анализ данных по когерентным явлениям, сопровождающим раннюю стадию процесса переноса энергии. Обсуждается роль квантовой когерентности в фотосинтезе. Следует отметить, что охватить все типы фотосинтезирующих организмов и все стороны рассматриваемых явлений в рамках одного обзора не представляется возможным. Поэтому в обзоре не рассмотрен ряд интересных и сравнительно малоизученных объектов (таких, например, как гелиобактерии). Кроме того, не затронуты такие интересные темы и объекты, как перенос энергии в искусcтвенном фотосинтезе и в мутантных организмах. Также не рассматриваются разнообразные методики экспериментальных работ. Данный обзор не претендует на полноту: в нем процитированы лишь основные публикации.
ПУТИ И СКОРОСТИ ПЕРЕНОСА ЭНЕРГИИ В РАЗЛИЧНЫХ ПРИРОДНЫХ СВЕТОСОБИРАЮЩИХ АППАРАТАХ
Пурпурные бактерии
В настоящее время первичные процессы светосбора наиболее изучены именно в пурпурных бактериях. Основными светособирающими пигментами у этих бактерий являются бактериохлорофиллы двух видов (a и b) и каротиноиды. Эти пигменты находятся в цитоплазматической мембране вместе с другими компонентами фотосинтетического аппарата. Светособирающие комплексы (ССК) пурпурных фотосинтезирующих бактерий можно разделить на два основных типа: ССК1 с максимумом Qy-полосы поглощения БХл a на длине волны 875 нм и ССК2 с аналогичными максимумами на длинах волн 800 и 850 (или 820) нм (рис. 2). У БХл b-содержащих видов бактерий максимум поглощения ССК1 соответствует длине волны 1020 нм.
Рис. 2.
Схема структурной организации светособирающих комплексов пурпурных бактерий. Фигурными стрелками обозначены направления переноса энергии. Масштаб и относительные размеры молекулярных структур произвольны.

ССК1 непосредственно окружает реакционный центр и носит название прицентровой антенны, а ССК2 контактирует только с ССК1 и называется периферической антенной (Zuber, Cogdell, 1995). Основой структуры обоих типов ССК является белковая матрица, представляющая собой олигомер мембранных α- и β-апобелков. Светособирающие пигменты встроены в эту матрицу с помощью нековалентных связей.
Исследования дифракции электронов на кристаллах ССК1 Rhodospirillum rubrum показали, что этот комплекс образует замкнутое кольцо диаметром 14 нм из 16 белковых субъединиц, каждая из которых связывает 2 молекулы БХл а (всего 32 молекулы БХл а) (Karrasch et al., 1995). Аналогичный вывод сделан с помощью криоэлектронной микроскопии. Информация о структурной организации ССК1 указывает на единственный реакционный центр внутри замкнутого кольца комплекса.
Для кристаллов ССК2 из Rhodopseudomonas acidophila и Rhodospirillum molischianum были получены рентгеноструктурные данные с разрешением 2.5 и 2.4 Å (McDermott et al., 1995; Koepke et al., 1996). Оказалось, что ССК2 обеих бактерий имеют форму идеального кольца. Белковый скелет ССК2 состоит из двух соосных цилиндров, вложенных один в другой. В Rhodopseudomonas acidophila внутренний цилиндр состоит из 9 трансмембранных спиралей α-апобелков и имеет диаметр 3.6 нм. Внешний цилиндр состоит из 9 спиралей β-апобелков и имеет диаметр 6.8 нм. Между этими цилиндрами находятся 18 молекул БХл, тесно упакованных в кольцо и находящихся в сильном экситонном взаимодействии (рис. 2). Этот кольцевой агрегат имеет полосу поглощения с максимумом 850 нм. Плоскости тетрапиррольных колец этих 18 молекул БХл перпендикулярны к плоскости мембраны. Под этим кольцом находится второе кольцо БХл, состоящее из 9 слабосвязанных мономерных молекул, ответственных за полосу поглощения с максимумом 800 нм. Плоскости этих 9 молекул параллельны плоскости мембраны.
ССК2 содержат также разные типы молекул каротиноидов, которые выполняют защитные функции, а также стабилизируют структуру этих комплексов.
Самый быстрый перенос энергии (характерное время ~100 фс) происходит внутри кольца ССК1 между молекулами БХл875 и внутри кольца молекул БХл850 в ССК2 (Ma et al., 1997). Молекулы БХл850 в ССК2 находятся на расстоянии ~9 Å между их центрами и имеют энергию взаимодействия ~300 см−1 (Koolhaas et al., 1998; Scholes et al., 1999). Следствием сильного взаимодействия между молекулами БХл850 являются: делокализация возбуждения по кольцу, красный сдвиг полосы поглощения от 800 нм (для мономеров БХл) к 850 нм и наличие экситонных полос поглощения (Cogdell et al., 2006).
Перенос энергии внутри кольца молекул БХл800 в ССК2 происходит за 0.3–0.8 пс (Kennis et al., 1997; van Grondelle, Novoderezhkin, 2006), что медленнее, чем в кольце БХл850. Такое замедление является следствием слабой связи молекул БХл800, энергия взаимодействия которых не превышает 20–30 см−1, а расстояние между центрами молекул составляет ~2 нм (Sauer et al., 1996; Hu et al., 2002).
Пигменты периферических ССК2 поглощают в более коротковолновой области по сравнению с прицентровой антенной ССК1, что обеспечивает миграцию энергии по термодинамическому потенциалу: ССК2 → ССК1 → РЦ. Перенос энергии от кольца БХл800 к кольцу БХл850 в ССК2 имеет характерное время 1–2 пс, которое незначительно варьирует в разных видах пурпурных бактерий (Kennis et al., 1997; van Grondelle, Novoderezhkin, 2006). В кинетиках поглощения молекул БХл800 в ССК2 одновременно присутствуют как компонента переноса БХл800 → БХл850, так и более быстрая компонента БХл800 → БХл800. В изолированных ССК2 возбуждение мигрирует на нижний экситонный уровень кольца БХл850, откуда релаксирует в основное состояние за ~1 нс. Перенос энергии от ССК2 на кольцо молекул БХл в ССК1 занимает 3–5 пс (Hess et al., 1995). Это время зависит от вида бактерий, деталей взаимного расположения обоих комплексов в мембране, а также геометрии колец БХл (Cleary et al., 2013). Перенос энергии от кольца БХл к реакционному центру в ССК1 занимает 20–50 пс в зависимости от вида бактерий (Visscher et al., 1989; Beekman et al., 1994; Freiberg et al., 1996). За это время возбуждение переносится на расстояние около 4 нм (средний радиус кольца БХл в ССК1). Время релаксации возбуждения в основное состояние ССК1 составляет 1–2 нс, что существенно больше времени переноса энергии к реакционному центру. Тот факт, что скорость переноса энергии по цепи ССК2 → ССК1 → РЦ намного превышает скорость дезактивации энергии на всех этапах, обусловливает высокую квантовую эффективность этого ключевого процесса.
Зеленые бактерии
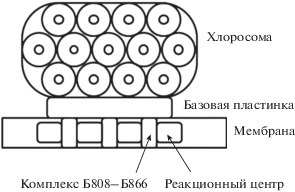
Зеленые бактерии – группа бактерий, осуществляющих фотосинтез бескислородного типа, или аноксигенный фотосинтез. Фотосинтезирующие зеленые бактерии являются типично водными микроорганизмами, распространенными в пресных и соленых водоемах. В клетках зеленых нитчатых и зеленых серных бактерий основная масса светособирающих пигментов представлена различными типами бактериохлорофиллов и каротиноидов. Эти пигменты находятся в уникальных периферических светособирающих антенных структурах – хлоросомах, которые прикреплены своей базовой пластинкой к внутренней поверхности цитоплазматической мембраны, но не являются ее компонентом (рис. 3). Хлоросомы имеют форму эллипсоидов с размерами 70–260 × 30–100 × 6–30 нм (в зависимости от вида бактерий и от условий их культивирования), окруженных монослойной липид-белковой оболочкой (Oelze, Golecki, 1995), и состоят из квазилинейных агрегатов БХл c, d или e. Дипольные моменты Qy-переходов этих агрегатов ориентированы строго вдоль длинной оси хлоросомы (Fetisova et al., 1986; Matsuura et al., 1993). При уменьшении интенсивности света размер хлоросомной БХл антенны возрастает, компенсируя дефицит световой энергии увеличением поглощательной способности периферической антенны (Yakovlev et al., 2002, 2017).
Рис. 3.
Схема строения фотосинтезирующего аппарата зеленой нитчатой бактерии Chloroflexus aurantiacus (поперечный разрез).
Хлоросомы зеленых фотосинтезирующих бактерий – самые большие светособирающие структуры среди всех известных в природе – содержат до 105 молекул БХл, что позволяет клеткам расти при экстремально низких интенсивностях света (Oelze, Golecki, 1995; Frigaard et al., 2003). Уникальность хлоросомных структур зеленых бактерий состоит также и в том, что упаковка молекул БХл в хлоросомной антенне осуществляется путем их самоагрегации в линейные цепочки без участия молекул белка. Самосборка молекул БХл в хлоросоме происходит за счет образования координационных связей между периферическими атомами и центральным атомом Mg соседних молекул (Krasnovsky, Bystrova, 1980). Это отличает зеленые бактерии от других фотосинтезирующих организмов, в которых существенную структурирующую роль играет белок. Олигомерная природа цепочек БХл с/d/e в хлоросомах семейств Chlorobiaceae и Chloroflexaceae показана экспериментально и теоретически (Fetisova et al., 1989, 1994). Сильное экситонное взаимодействие молекул БХл с/d/e в хлоросомах (энергия взаимодействия ~500 см−1) и делокализация возбуждения являются следствием олигомеризации БХл. До настоящего времени вопрос о пространственной организации хлоросомных антенн остается открытым.
Существуют различные теоретические модели структурной организации агрегатов БХл с/d/e в хлоросоме. Согласно одной из наиболее распространенных моделей, хлоросомный БХл образует цилиндрические структуры диаметром 5–10 нм, упакованные параллельно длинной оси хлоросомы (Staehelin et al., 1978; Egawa et al., 2007) (рис. 3). Эта модель основана на данных, полученных методом электронной микроскопии с использованием техники скола замороженных клеток. В хлоросоме может содержаться 10–30 таких цилиндров. Новые данные криоэлектронной микроскопии и малоуглового рассеяния рентгеновских лучей послужили основой создания ламеллярной модели организации БХл в хлоросоме (Pšenčik et al., 2013). Согласно этой модели, молекулы БХл объединены внутри хлоросомы в параллельные плоские структуры (ламеллы), прикрепленные к верхней и нижней поверхностям липидной оболочки хлоросомы. Предполагается, что ламеллярные плоскости удерживаются вместе благодаря встроенным между ними каротиноидам. Также была предложена модель, согласно которой пигментные агрегаты упакованы в виде многослойных трубчатых структур, образованных свертыванием плоских двумерных агрегатов БХл (Oostergetel et al., 2007).
Базовая пластинка хлоросом Chloroflexus aurantiacus представляет собой пигмент-белковый комплекс, в котором мономер CsmA-белка связывает одну молекулу БХл а и 1–2 молекулы каротиноидов. Предполагается, что этот комплекс организован как плоская олигомерная паракристаллическая структура (Bryant et al., 2002). Базовая пластинка служит промежуточной антенной для сопряжения хлоросом с цитоплазматической мембраной клетки.
Зеленые нитчатые бактерии Chloroflexus aurantiacus характеризуются наличием в цитоплазматической мембране БХл а-антенного комплекса Б808–866 (рис. 3) (Feick et al., 1995). Этот комплекс тесно связан с реакционным центром. Методом негативного контрастирования было показано, что комплексы Б808–866 являются кольцевыми агрегатами в плоскости мембраны с диаметром ~20 нм.
Все зеленые серные бактерии содержат в качестве промежуточной антенной структуры FMO-комплекс (комплекс Fenna−Matthews−Olson), расположенный между хлоросомой и цитоплазматической мембраной клетки. Рентгеноструктурный анализ показал, что этот комплекс состоит из трех белковых субъединиц, и каждая субъединица содержит семь молекул БХл а (Olson, 2004). Два FMO-комплекса снабжают энергией один РЦ.
Светособирающая антенна зеленой нитчатой бактерии Chloroflexus aurantiacus находится в трех субклеточных структурах: 1) хлоросоме, содержащей весь олигомерный БХл с с максимумом поглощения 740 нм, 2) базовой пластинке, содержащей мономерный БХл а с максимумом поглощения 798 нм и 3) мембране, содержащей комплексы БХл а с максимумами поглощения 808 и 866 нм. Путь переноса энергии возбуждения от антенны к реакционному центру в Chloroflexus aurantiacus можно представить в виде следующей общей схемы (рис. 3): хлоросомный БХл c → БХл a базовой пластинки → Бхл a мембраны → РЦ. Максимум поглощения РЦ Chloroflexus aurantiacus соответствует 870 нм.
В зеленых серных бактериях светосбор происходит в четырех структурах: 1) хлоросоме с максимумами поглощения от 710 до 750 нм, 2) базовой пластинке с максимумом поглощения 795 нм, 3) FMO-комплексе с максимумом поглощения 809 нм и 4) мембранной БХл а-субантенне с максимумами поглощения 813 и 836 нм. Перенос энергии возбуждения у этих бактерий происходит по схеме: хлоросомный БХл c/d/e → БХл a базовой пластинки → БХл a FMO-комплекса → БХл a мембраны → РЦ с максимумом поглощения 840 нм.
Таким образом, перенос энергии происходит по термодинамическому потенциалу и сопровождается уменьшением энергии оптических переходов пигментов. Последовательный сдвиг спектров поглощения светособирающих структур является целесообразным с точки зрения их спектрального сопряжения.
Квантовая эффективность переноса энергии в клетках Chloroflexus aurantiaсus приближается к 100% при физиологической температуре (Т = 52°С) (van Dorssen et al., 1986, 1988). При температурах Т > 42°С эффективность остается столь же высокой (~100%), однако в области 40–20°С наблюдается резкое падение эффективности переноса энергии вплоть до 40%. При дальнейшем понижении температуры (до 4 К) эффективность переноса энергии от хлоросомы к мембране уменьшается до 15% (van Dorssen et al., 1988).
Самые ранние и самые быстрые процессы миграции, перераспределения и релаксации энергии происходят внутри хлоросомы в течение 100–500 фс после поглощения света (Linnanto, Korppi-Tommola, 2013). Согласно теоретическим расчетам, распространение энергии по каждой из цилиндрических структур хлоросомы (рис. 3) занимает около 100 фс. Перенос энергии между соседними цилиндрическими структурами хлоросомы также происходит примерно за 100 фс. В итоге через 250 фс возбуждение распределяется по всей хлоросоме. Через 500 фс после поглощения света энергия возбуждения собирается в “нижнем” ряду цилиндров хлоросомы, который примыкает к базовой пластинке (рис. 3). Далее происходит перенос энергии от хлоросомы к базовой пластинке в пикосекундном диапазоне. Таким образом, перенос энергии внутри хлоросомы происходит в направлении, перпендикулярном ее длинной оси.
В нативных клетках Chloroflexus aurantiaсus при комнатной температуре перенос энергии от хлоросомы к базовой пластинке занимает 10–40 пс в зависимости от размеров хлоросомы (Fetisova et al., 1996), от базовой пластинки к комплексам Б808–866 – 40 пс и от комплексов Б808–866 к реакционным центрам – 90 пс (Causgrove et al., 1992). Кроме основной кинетической компоненты, в экспериментах регистрируются более быстрые минорные процессы переноса энергии от хлоросомы с характерным временем около 1 пс (Savikhin et al., 1994).
Цианобактерии
Цианобактерии, как и высшие растения и водоросли, содержат тилакоиды и осуществляют оксигенный фотосинтез, при котором начальные стадии преобразования световой энергии происходят с участием последовательно функционирующих фотосистем ФС2 и ФС1, представленных в тилакоидах в виде пигмент-белковых комплексов (Клейтон, 1984; Blankenship 1992).
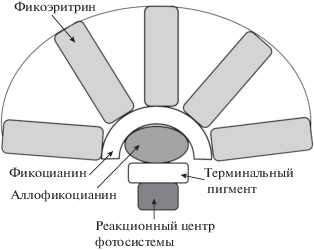
Цианобактерии содержат хлорофилл a и растворимые фикобилиновые пигменты: голубые – фикоцианины и красные – фикоэритрины, которые находятся в фикобилисомах. Наличие фикобилисом, содержащих основную массу светособирающих пигментов, является отличительной особенностью цианобактерий (и красных водорослей). Фикобилисомы – это дисковидные образования, прилегающие снаружи к тилакоидам. Они состоят из фикобилипротеинов, чаще всего – фикоцианина, аллофикоцианина и фикоэритрина, а также бесцветных полипептидов. Фикобилипротеины в свою очередь состоят из двух нековалентно связанных неидентичных субъединиц (альфа и бета), к каждой из которых ковалентно присоединены хромофорные группы – фикоцианобилин или фикоэритробилин. Хромофорная группа пигмента состоит из четырех пиррольных колец, но не замкнутых, как в молекуле хлорофилла (см. рис. 1), а имеющих вид развернутой цепи, не содержащей металл.
Организация фикобилипротеинов в фикобилисомах показана на рис. 4. Молекулы аллофикоцианина и аллофикоцианина В составляют внутреннее ядро фикобилисомы. К нему примыкают расходящиеся в разные стороны палочковидные образования, построенные из агрегированных молекул фикоцианина и фикоэритрина, при этом фикоэритрин располагается на периферической части этих структур. У видов, не содержащих фикоэритрин, палочковидные образования состоят только из фикоцианина. У многих цианобактерий соотношение синего и красного пигментов зависит от спектрального состава света.
Различия в спектральных свойствах фикобилипротеинов определяются аминокислотной последовательностью альфа- и бета-полипептидов, числом и типом присоединенных к ним хромофорных групп, а также степенью агрегации. Степень агрегации зависит от вида и возраста культуры, а также от внешних факторов: рН, ионной силы раствора, температуры. В основе агрегации молекул фикобилипротеинов лежат гидрофобные взаимодействия между мономерами. Значение способности фикобилипротеинов к агрегации становится понятным при формировании ими фикобилисом – структур, в которых эти пигменты организованы в агрегаты высокого порядка (Гусев, Никитина, 1979).
У цианобактерий, в отличие от высших растений, отсутствуют хлорофилл-содержащие ССК, и весь хлорофилл локализован в антенных сore-комплексах фотосистем 1 и 2 (Golbeck, 1994). Главные светосборщики цианобактерий – фикобилисомы – передают поглощенную энергию внутренней (сore) антенне той или другой фотосистемы в зависимости от состояния фотосинтетического аппарата (Biggins, Bruce, 1989). Показано, что роль светосборщиков у цианобактерий могут также выполнять хлорофилл-содержащие комплексы, организованные в кольцо вокруг тримера комплекса фотосистемы 1 (Bibby et al., 2001). Core-антенна фотосистемы 1 цианобактерий состоит из коротковолновых (поглощение при 660–690 нм) и длинноволновых (поглощение при 700–740 нм) форм хлорофилла. Поглощенную энергию коротковолновые хлорофиллы с высокой эффективностью передают длинноволновым. Пространственная организация фикобилисом обеспечивает перенос энергии возбуждения по термодинамическому потенциалу: фикоэритрин (λmax = 565 нм) → фикоцианин (λ max = 620 нм) → → аллофикоцианин (λmax = 654 нм) → аллофикоцианин В (λ max = 671 нм) → Хл a (λ max ~ 670–680 нм) → РЦ фотосистемы 2 или 1 (λ max = 680 нм). Перенос энергии в фикобилисомах цианобактерий имеет несколько характерных времен (Krumova et al., 2010; Tian et al., 2011). Самая быстрая стадия заключается в переносе энергии от фикоэритрина к фикоцианину в течение 6–8 пс. Затем следует более медленная стадия переноса энергии от фикоцианина к аллофикоцианину в течение 20–40 пс. Перенос энергии от аллофикоцианина к терминальному комплексу фикобилисомы происходит за 60–90 пс. Наконец, передача энергии от терминального комплекса к реакционному центру фотосистемы 2 или фотосистемы 1 происходит в течение 150–200 пс.
Водоросли
Водоросли – это низшие растения, содержащие хлорофиллы a, b, c, d и осуществляющие оксигенный фотосинтез с использованием воды в качестве источника водорода и выделением кислорода. Фотосинтезирующие пигменты водорослей находятся, как и у высших растений, в особых структурах – хлоропластах, внутренние мембраны которых образуют складчатые структуры – тилакоиды.
Антенные комплексы бурых и динофлагеллатных водорослей отличаются высоким содержанием каротиноидов, которые играют важную роль в светосборе (Frank, Cogdell, 1996). Так, содержание фукоксантина в комплексе фукоксантин–хлорофилл–белок и перидинина в комплексе перидинин–хлорофилл–белок в 4 раза превышает содержание хлорофилла. Каротиноиды этих комплексов поглощают свет в области 500–600 нм. Отличительной особенностью комплексов с фукоксантином является присутствие хлорофилла с в качестве добавочного пигмента. Перенос энергии от каротиноидов к хлорофиллу является самой быстрой стадией в этих комплексах (Akimoto et al., 2014; Gelzinis et al., 2015). В комплексе фукоксантин–хлорофилл–белок перенос возбуждения от второго возбужденного состояния (S2) фукоксантина в состояние Qx хлорофилла а происходит за ~100 фс. В комплексе перидинин–хлорофилл–белок аналогичный перенос от состояния S2 перидинина в состояние Qу хлорофилла а занимает ~200 фс (Polivka, Frank, 2010). Оценки времени переноса энергии от хлорофилла с на хлорофилл а в комплексе фукоксантин–хлорофилл–белок составляют от ≤100 фс (Songaila et al., 2013) до ~600 фс (Akimoto et al., 2014). Перенос энергии возбуждения от первого возбужденного состояния (S1) каротиноидов в состояние Qу хлорофилла а происходит заметно медленнее. Так, в комплексе фукоксантин–хлорофилл–белок этому переносу соответствуют два характерных времени 300–600 фс и 1–2 пс, а в комплексе перидинин–хлорофилл–белок – 700 фс и 3 пс (Akimoto et al., 2014; Gelzinis et al., 2015). Безызлучательный распад состояния Qу хлорофилла а в основное состояние в обоих комплексах происходит за 1–3 нс. Возбужденные состояния каротиноидов распадаются намного быстрее. Переход S2 → S1 занимает ~50 фс в обоих каротиноидах, переход S1 → S0 в фукоксантине происходит за 20 пс, а в перидинине – за 16 пс (Akimoto et al., 2014; Gelzinis et al., 2015).
В криптофитовых водорослях основными антенными комплексами являются фикобилипротеины (фикоцианин или фикоэритрин) (Spear-Bernstein, Miller, 1989). Эти комплексы находятся на люминальной стороне мембраны. Белковая матрица массой около 60 кДа состоит из нескольких цепей и субъединиц (Curutchet et al., 2013). Различные виды хромофоров (билинов), закрепленные в этой матрице, поглощают свет в диапазоне 500–600 нм. Скорость переноса энергии возбуждения между этими билинами зависит от расстояния, взаимной ориентации и вида молекул (Marin et al., 2011). Максимальная скорость переноса наблюдается между близко расположенными одинаковыми билинами с сильным взаимодействием (характерное время <1 пс). За время 1–8 пс происходит перенос энергии между соседними билинами разных видов. Перенос энергии на билины, поглощающие свет в области 600 нм (длинноволновый край области поглощения антенных комплексов), занимает 20–50 пс. В таком же временном диапазоне происходит дальнейший перенос энергии на фотосистему I или II (van der Weij-De Wit et al., 2006).
Высшие растения
Фотосинтетический аппарат высших растений и зеленых водорослей представлен двумя фотосистемами (ФСI и ФСII) и несколькими комплексами антенн (Клейтон, 1984). Каждая из фотосистем имеет реакционный центр и сопряженные с ним антенные комплексы. Особый интерес представляет дополнительный светособирающий комплекс ССКII, который способен в зависимости от физиологических условий (например, уровня освещенности в процессе роста организма) находиться в разных местах мембраны и обслуживать как одну, так и другую фотосистему (Papageorgiou, Govindjee 2011; Wlodarczyk et al., 2015). Такая подвижность помогает организмам приспособиться к разным условиям. При низком уровне освещенности ССКII увеличивает суммарную эффективность светосбора, а при высоком уровне освещенности он отключается. Белковую основу структуры ССКII представляет тример, состоящий из трех мономерных субъединиц. Каждый из этих мономеров содержит 13–15 молекул Хл a и Хл b и 3–4 молекулы каротиноидов (Liu et al., 2004). Некоторые из этих молекул Хл a и Хл b расположены столь близко друг к другу, что в результате сильного взаимодействия образуют своеобразный “гетеродимер”. Каротиноиды также участвуют в поглощении света в ССКII, однако с высокой скоростью передают энергию возбуждения хлорофиллам. Характерные времена переноса энергии от каротиноидов на хлорофиллы составляют ≤100 фс при переносе в полосу Qx и ≤1 пс – при переносе в полосу Qy (Croce et al., 2001). Характерные времена переноса энергии между хлорофиллами в ССКII варьируют от ≤100 фс до ≥20 пс в зависимости от расстояния между молекулами, силы их взаимодействия и принадлежности к одной и той же или разным белковым субъединицам (Croce et al., 2001; Novoderezhkin et al., 2011). Так, перенос Хл b → Хл b происходит за ~50 фс между соседними молекулами из одной белковой субъединицы и за ~100 фс, если соседние молекулы Хл b принадлежат разным белковым мономерам. Перенос Хл b → Хл a занимает ~1.5–2 пс, если обе молекулы принадлежат одному и тому же белковому мономеру. Перенос Хл a → Хл a между молекулами из разных белковых мономеров происходит за 6–20 пс. Время жизни возбуждения в ССКII составляет 2 нс для комплексов в мембране и 4–5 нс – для изолированных комплексов (Ruban et al., 2012).
В фотосистеме I имеется светособирающий комплекс I (ССКI), состоящий из 4 полипептидов, обозначаемых Lhca1–4, массой ~20 кДа каждый. Эти полипептиды образуют два гетеродимера Lhca1–Lhca4 и Lhca2–Lhca3, которые в виде полумесяца примыкают к ядру фотосистемы I (Croce, van Amerongen, 2013). ССКI содержит несколько десятков молекул Хл a и Хл b. Lhca3 и Lhca4 содержат более длинноволновые формы хлорофиллов (так называемые красные хлорофиллы), а Lhca1 и Lhca2 – более коротковолновые формы (синие хлорофиллы). Изучение кристаллической структуры фотосистемы I (Ben-Shem et al., 2003; Amunts et al., 2007) указало на вероятные пути переноса энергии внутри ССКI и от ССКI к ядру фотосистемы I (Wientjes et al., 2011; Croce, van Amerongen, 2013). Основная доля получаемой ядром энергии приходится на ее перенос от Lhca1, хотя Lhca2 и Lhca3 также поставляют энергию ядру, но в меньшей степени. Перенос энергии от синих хлорофиллов в Lhca1 и Lhca2 к красным хлорофиллам в Lhca3 и Lhca4 происходит за ~10 пс. Перенос энергии от синих хлорофиллов в Lhca1 и Lhca2 к ядру фотосистемы I занимает примерно такое же время ~10 пс. Красные хлорофиллы в Lhca3 и Lhca4 также способны переносить энергию к ядру фотосистемы I, но время этого переноса составляет ~40 пс, то есть почти в 4 раза больше аналогичного времени для синих хлорофиллов. Отметим, что время захвата энергии реакционным центром фотосистемы I составляет ~50 пс.
ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ ПЕРЕНОСА ЭНЕРГИИ ПРИ ФОТОСИНТЕЗЕ
Традиционная и обобщенная теория Фёрстера
В традиционной теории Фёрстера рассматривается случай индуктивно-резонансного взаимодействия молекул донора и акцептора, когда кулоновское взаимодействие молекул считается малым параметром в теории возмущений (Förster, 1948, 1965). В результате кулоновского взаимодействия каждая молекула донора D переходит из возбужденного в основное состояние, а каждая молекула акцептора А переходит, наоборот, из основного в возбужденное состояние: D*А → DА*. Ключевым предположением теории Фёрстера является использование золотого правила Ферми при выводе выражения для скорости переноса энергии от донора к акцептору. Согласно правилу Ферми распад начального (“н”) и создание конечного (“к”) состояния системы происходит по экспоненциальному закону со скоростью Wнк, пропорциональной квадрату модуля матричного элемента взаимодействия |Vнк|2 и плотности конечных состояний при энергии начального состояния Рк(Ен). Необходимыми условиями применимости правила Ферми в теории Фёрстера являются сплошные широкие спектры поглощения и испускания молекул донора и акцептора. В сложных молекулах широкие спектры означают высокую скорость диссипативных процессов, протекающих, в основном, за счет колебательной релаксации. Для вычисления гамильтониана кулоновского взаимодействия донора и акцептора часто используют диполь-дипольное приближение, при котором взаимодействующие дипольные моменты переходов считаются точечными, то есть когда расстояние между молекулами донора и акцептора намного больше их размеров. В случае, когда это условие не выполняется, необходимо учитывать мультипольные взаимодействия более высокого порядка. Если молекулы расположены вплотную друг к другу и их электронные орбитали частично перекрываются, то взаимодействие приобретает характер обменно-резонансного, и приближение Фёрстера становится неприменимым.
Фёрстер впервые получил компактное выражение для скорости переноса энергии электронного возбуждения от молекулы донора к молекуле акцептора K, которое нашло широкое применение в практических расчетах (Förster, 1948, 1965). Согласно этому выражению, скорость K обратно пропорциональна шестой степени расстояния между молекулами и зависит от их спектральных свойств, взаимной ориентации и показателя преломления среды. Таким образом, скорость K в теории Фёрстера зависит только от макроскопических величин, которые можно определить экспериментально. Считается, что теория Фёрстера применима при расстояниях между молекулами (или группами молекул) порядка нескольких нм.
Обобщенная теория Фёрстера (Sumi, 1999; Mirkovic et al., 2017) рассматривает перенос энергии между молекулярными агрегатами донора и акцептора. Сильное взаимодействие молекул в обоих агрегатах приводит к коллективным (экситонным) эффектам при передаче энергии от донора к акцептору. Как и в традиционной теории Фёрстера, механизм переноса энергии в обобщенной теории зависит от расстояния между донором и акцептором. Если это расстояние много больше размеров молекулярных агрегатов донора и акцептора, то имеет место индуктивно-резонансный перенос энергии. В противоположном случае необходима дополнительная информация о пространственной структуре молекул донора и акцептора, находящихся в обменно-резонансном взаимодействии. Взаимодействие между донором и акцептором считается слабым в обобщенной теории Фёрстера, что позволяет использовать золотое правило Ферми. Также полагают, что экситонные состояния линейно сопряжены с фононным окружением. Это позволяет использовать в расчетах спектральные характеристики экситонных полос. Когерентные эффекты и эффекты, связанные с запоминанием (немарковские процессы) в обобщенной теории Фёрстера не рассматриваются. Отметим важную роль усреднения по беспорядку в обобщенной теории Фёрстера. Эта процедура существенно сближает теоретические расчеты и данные экспериментов по переносу энергии при фотосинтезе (Scholes et al., 2001).
Традиционная и модифицированная теория Редфилда
В традиционной теории Редфилда (Redfield, 1965) взаимодействие молекулярной системы с фононным окружением (термостатом) является малым параметром в теории возмущений. Рассматривая марковское приближение и пренебрегая влиянием системы на термостат, можно получить уравнение Редфилда для матрицы плотности системы, которое представляет динамику системы как сумму диссипативных и когерентных процессов (Redfield, 1965).
Расчеты с помощью теории Редфилда представляют нетривиальную задачу. В самых простых теоретических моделях хромофоров в белковом окружении предполагается, что белковое окружение однородно и изотропно и что спектр колебательных мод непрерывен (Еремин и др., 2009). Основное предположение теории Редфилда о малости взаимодействия системы с термостатом выполняется далеко не всегда в реальных случаях. Чтобы преодолеть этот недостаток, используют различные модификации этой теории. В одной из наиболее удачных модификаций рассматривается случай значительного статического беспорядка в молекулярном агрегате, когда имеется значительный разброс энергий состояний (Zhang et al., 1998). При этом экситонные состояния с близкими энергиями слабо перекрываются в пространстве, поскольку локализованы в разных частях агрегата. В целом ряде случаев (когда имеется значительный разброс энергий экситонных состояний) модифицированная теория Редфилда дает лучшее соответствие с данными экспериментов по сравнению как с ее традиционным вариантом, так и с теорией Фёрстера. Сравнительный анализ этих трех подходов применительно к простейшему случаю молекулярного димера показал, что модифицированная теория Редфилда применима в более широком диапазоне параметров (Yang, Fleming, 2002). Все три теории показывают максимальную скорость переноса при равных энергиях мономеров в агрегате. Если разность этих энергий незначительна по сравнению с энергией взаимодействия мономеров друг с другом и с термостатом, то результаты модифицированной теории Редфилда приближаются к таковым для традиционного варианта. В этом случае скорость переноса энергии, рассчитанная по Фёрстеру, может заметно отличаться от таковой, рассчитанной по Редфилду, в ту или другую сторону в зависимости от соотношений параметров. В противоположном случае большого энергетического зазора модифицированная теория Редфилда близка к теории Фёрстера, а традиционный подход Редфилда дает намного меньшую скорость переноса.
Иерархические уравнения
Теории Фёрстера и Редфилда описывают два качественно разных механизма переноса энергии: некогерентный или прыжковый механизм Фёрстера и когерентный или волнообразный механизм Редфилда. Существуют теории более высокого ранга, объединяющие оба механизма в рамках единого подхода. Одна из таких теорий, названная в англоязычной литературе “HEOM – hierarxical equations of motion” анализирует динамику системы в немарковском приближении (Ishizaki, Fleming, 2009a). Применение этой теории привело к ряду важных выводов о природе долговременной когерентности в биологии вообще и в природных светособирающих антеннах в частности (Fassioli et al., 2014; Chenu, Scholes, 2015). Была показана важная роль термостата в поддержании электронной когерентности. Оказалось, что эта когерентность может существовать даже в случае, когда энергия реорганизации много больше энергии взаимодействия молекул в агрегате. Отметим, что марковское приближение в теории Редфилда означает бесконечно быстрые флуктуации, что исключает их вклад в когерентность. Также отметим, что даже в простейшем случае димерного агрегата численное решение системы иерархических уравнений представляет серьезную проблему.
КОГЕРЕНТНЫЕ ЭФФЕКТЫ ПРИ ПЕРЕНОСЕ ЭНЕРГИИ В РАЗЛИЧНЫХ СВЕТОСОБИРАЮЩИХ КОМПЛЕКСАХ
Развитие различных методов фемтосекундной спектроскопии привело к накоплению данных о когерентных эффектах, сопровождающих перенос энергии возбуждения в светособирающих комплексах различных фотосинтезирующих организмов. Необходимо различать пространственную когерентность, обусловленную делокализацией возбуждения в молекулярных агрегатах, и временну́ю когерентность, отражающую фазовые соотношения между различными состояниями. Пространственная когерентность приводит к сдвигу и расщеплению уровней энергии. Временнáя когерентность проявляется в виде осцилляций в кинетиках поглощения и излучения в пико- и фемтосекундном диапазонах. В данном разделе речь пойдет, в основном, о временно́й когерентности. Постоянный интерес к этой проблематике обусловлен рядом фундаментальных вопросов, которые пока не получили удовлетворительного объяснения. Одной из нерешенных проблем, имеющей философское звучание, является роль квантовой когерентности в жизни вообще и в фотосинтезе в частности. Другая важная проблема заключается в значительных трудностях, возникающих при объяснении аномально большого (пикосекундного) времени жизни когерентных эффектов, наблюдаемых при комнатной температуре в светособирающих комплексах. Большое количество экспериментальных данных по когерентным осцилляциям в различных биологических объектах вызвало продолжительную и оживленную дискуссию о роли когерентности в первичном переносе энергии и, шире, о роли квантовых эффектов в фотосинтезе. Параллельно с применением новых методик (2D-спектроскопия, фотонное эхо, спектроскопия одиночных молекул) шло развитие все более сложных теоретических моделей. В узком смысле основной вопрос сводится к тому, способна ли электронно-колебательная когерентность повлиять (желательно, ускорить) на общую скорость переноса энергии или нет. Рассмотрим ряд конкретных примеров.
Хлоросомы зеленых бактерий
Когерентные осцилляции наблюдались в хлоросомах зеленых бактерий Chloroflexus aurantiacus при криогенной и комнатной температурах (Savikhin et al., 1994; Yakovlev et al., 2018). В этих экспериментах измерялись кинетики спектров поглощения. В кинетиках на фоне основной, неосциллирующей части наблюдались небольшие затухающие осцилляции сложной формы (рис. 5 ). Осцилляции наблюдались в течение 1–2 пс после возбуждения. Фурье-анализ осцилляций выявил несколько частот в области 10–400 см−1. Наиболее сильная осцилляция имела частоту ~130–150 см−1 (период ~220 фс). Было найдено, что Фурье-спектры осцилляций зависят от степени олигомеризации молекулярных агрегатов в хлоросомах (Yakovlev et al., 2018).
Рис. 5.
Разностная (свет–темнота) кинетика (а), осцилляции кинетики (б) и Фурье-спектр осцилляций (в) в полосе поглощения Qy (740 нм) хлоросом зеленой бактерии Chloroflexus aurantiacus при температуре 90 К.
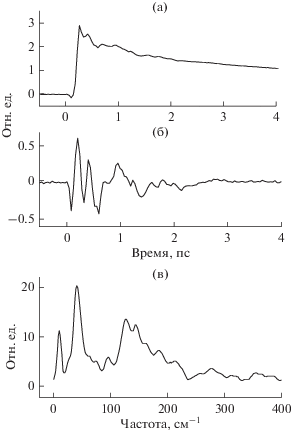
Для понимания природы осцилляций очень важным стало сравнение их частот с частотами вынужденного комбинационного рассеяния в хлоросомах (Cherepy et al., 1996). Оказалось, что большинство мод осцилляций, регистрируемых фемтосекундной спектроскопией, совпадают по частоте с модами комбинационного рассеяния. Это может указывать на колебательную природу осцилляций. В целом, колебательные моды хлоросомы в диапазоне нескольких сот см−1 представляют собой сложную смесь межмолекулярных и внутримолекулярных движений. Аккуратные измерения осцилляций с частотами 10–40 см−1 в хлоросомах Chloroflexus aurantiacus указывают на то, что единичный строительный блок этих хлоросом состоит из коротких (в несколько молекул) цепей БХл с (Yakovlev et al., 2018). С другой стороны, возможна электронная или электронно-колебательная природа осцилляций, когда в них участвуют уровни энергии, принадлежащие разным электронным состояниям. Так, применение фемтосекундной 2D-спектроскопии при криогенной температуре выявило квантовые биения на частоте 620 см−1 между экситонными состояниями в хлоросомах Chlorobium limnaeum (Jun et al., 2014).
Светособирающий комплекс II зеленых растений
Светособирающий комплекс II является основным аппаратом для осуществления светосбора в зеленых растениях. Кроме того, это самая распространенная светособирающая антенна на Земле, содержащая более половины всего имеющегося на нашей планете хлорофилла. Когерентные явления были обнаружены в ССК II Arabidopsis thaliana с помощью 2D-спектроскопии (Calhoun et al., 2009). Основное внимание в этой работе было уделено поиску электронной когерентности между отдельными экситонными состояниями. Квантовые биения, отражающие эту когерентность, были обнаружены в спектрах как Хл а, так и Хл b. Эти затухающие биения наблюдались в течение ~0.5 пс после возбуждения. Характерный период биений составлял от нескольких десятков до нескольких сот фс, однако самые интенсивные биения имели период ~0.3 пс.
Морские водоросли
Квантовая когерентность была обнаружена с помощью 2D-спектроскопии при комнатной температуре в светособирающих комплексах криптофитовых водорослей (Collini et al., 2010). В этой работе исследовался комплекс фикоэритрина 545 из Rhodomonas CS24 и комплекс фикоцианина 645 из Chroomonas CCMP270. Был сделан вывод о том, что когерентные явления сопровождают процесс светосбора криптофитовых водорослей при температуре, соответствующей естественным условиям.
FMO-комплексы зеленых серных бактерий
Исследования переноса энергии в FMO (Fenna–Matthews–Olson)-комплексах зеленых серных бактерий при криогенной и комнатной температурах выявили сопутствующие квантовые эффекты (Engel et al., 2007; Panitchayangkoon et al., 2010). Эти комплексы являются связующим звеном между светособирающей хлоросомой и комплексом реакционного центра. FMO-комплекс состоит из трех одинаковых белковых субъединиц, каждая из которых содержит 7 (по последним данным 8) молекул БХл а. Исследования динамики переноса энергии в FMO-комплексах Chlorobaculum tepidum с помощью 2D-спектроскопии выявили сложное пространственное распределение потоков энергии (Brixner et al., 2005). Перенос энергии сопровождался квантовыми осцилляциями сложной формы, которые имели выраженную электронную (не колебательную) природу. Характерное время жизни этих осцилляций составило ~700 фс при температуре 77 К (Engel et al., 2007) и ~300 фс при комнатной температуре (Panitchayangkoon et al., 2010). Отметим, что указанные времена сравнимы по порядку величины с временем переноса энергии в FMO-комплексах, что указывает на вовлеченность когерентных процессов в перенос энергии.
Влияние когерентных эффектов на перенос энергии в светособирающих комплексах
Многочисленные эксперименты по фемтосекундной спектроскопии различных ССК указывают на то, что перенос поглощенной световой энергии сопровождается осцилляциями, которые видны в спектрах поглощения и излучения. Разработка адекватной теории, учитывающей все особенности строения ССК различных фотосинтезирующих организмов, продолжается до сих пор. Тем не менее, понять основные проявления когерентности в ССК можно в рамках традиционной теории Редфилда (Redfield, 1965). Можно показать, что динамика заселенностей тесно связана с динамикой фазовых соотношений (когерентностей) между ними. В спектре осцилляций будут представлены частоты как электронной, так и колебательной когерентности. Для ССК фотосинтеза большинство этих частот находятся в диапазоне 10–1000 см−1. В рамках теории Редфилда перенос когерентности между колебательными уровнями энергии позволяет качественно объяснить большое (несколько пс) время жизни осцилляций в экспериментах.
Наблюдаемые в кинетиках излучения и поглощения ССК осцилляции имеют ряд общих признаков. Как правило, это затухающие колебания с небольшой амплитудой (рис. 5 ). При комнатной температуре суммарная амплитуда осцилляций не превышает нескольких процентов от амплитуды кинетик, а при криогенной температуре может достигать 10–20%. Небольшая амплитуда осцилляций в ССК порождает сомнение в том, что когерентные биения могут серьезно повлиять на общее время переноса энергии.
В ССК терминальным акцептором энергии является реакционный центр, а количество промежуточных акцепторов может быть велико (как, например, в хлоросоме зеленых бактерий). В этом случае максимальная скорость передачи энергии по цепочке акцепторов достигается в режиме когерентного экситона, когда характерное время переноса между соседними акцепторами много меньше времени колебательной релаксации. При этом в передаче энергии участвуют верхние колебательные уровни. Время переноса когерентного экситона оценивается в 10–100 фс, что заметно меньше времени колебательной релаксации большинства сложных молекул (~1 пс). Распространение когерентного экситона по цепочке акцепторов можно уподобить расплыванию пространственного волнового пакета. В случае сильного экситон-фононного взаимодействия характерное время локальных деформаций молекулы может стать меньше времени миграции экситона. При этом деформация перемещается вместе с экситоном, а сам экситон становится пространственно-некогерентным, или локализованным. Распространение некогерентного экситона имеет характер случайных перескоков, а характерное время миграции оценивается в 100–1000 фс. При понижении температуры некогерентный экситон может стать когерентным, поскольку при этом наряду с замедлением миграции замедляется деформация молекул.
С помощью теории иерархических уравнений НЕОМ было показано, что относительно медленная релаксация континуума низкочастотных колебательных мод приводит к значительному увеличению времени жизни электронной когерентности по сравнению с марковским случаем бесконечно быстрого уравновешивания фононных состояний (Ishizaki, Fleming, 2009b). В этом случае процесс затухания электронной когерентности компенсируется ее восстановлением за счет релаксации термостата. С другой стороны, различные резонансные явления способны поддерживать когерентность между экситонными состояниями в течение длительного (до нескольких пс) времени (Chin et al., 2013). В светособирающих антеннах такой резонанс может привести к быстрому и направленному переносу энергии по цепочке акцепторов. Таким образом, динамика неуравновешенного окружения способна поддерживать когерентность, созданную фс-возбуждением. Более интересным является вопрос, способна ли эта динамика сама создать когерентность между экситонными состояниями. Моделирование переноса энергии в ССК криптофитовых водорослей с помощью иерархических уравнений дает положительный ответ на этот вопрос (Fassioli et al., 2012). Возбуждение только одного из делокализованных экситонных состояний инициирует осцилляции заселенностей в другом, невозбужденном состоянии. Теоретический анализ показывает, что характерное время затухания осцилляций определяется временем уравновешивания в термостате, которое может значительно превосходить собственное время дефазировки когерентности в системе. Одним из проявлений сложной динамики термостата может быть динамическая локализация экситона. Количество молекул, по которым делокализован экситон, может уменьшаться в процессе термализации окружения. Эта динамическая локализация может приводить к появлению когерентных эффектов при переносе энергии по аналогии с параметрическим возбуждением колебаний.
Центральным вопросом дискуссий стало выяснение того, насколько перенос энергии возбуждения, вызванного фемтосекундным лазерным светом, отличается от такового при некогерентном солнечном освещении в природных условиях. Казалось бы, стационарный солнечный свет исключает возможность создания когерентности. Тем не менее, исследование и обсуждение такой возможности продолжается. Одним из перспективных направлений является шумовая корреляционная спектроскопия, использующая импульсный некогерентный свет для возбуждения (Turner et al., 2013). Показана возможность получения информации о квантовых процессах с помощью этого вида спектроскопии. Другим перспективным направлением является спектроскопия одиночных молекул, которую в применении к ССК можно назвать спектроскопией одиночных комплексов (Hildner et al., 2013). Исследование динамики переноса энергии в одиночных комплексах молекул может выявить те стороны этого процесса, которые обычно скрыты статическим беспорядком и усреднением по огромному числу реализаций. Также показано, что методика фотонного эха, примененная к одиночным комплексам, может быть эффективным инструментом при исследовании квантовых событий, сопровождающих перенос энергии (Dong, Fleming, 2013).
ЗАКЛЮЧЕНИЕ
В XXI веке человечество вплотную подошло к рубежу, за которым поиск альтернативных источников энергии становится не просто насущной необходимостью, но и глобальным условием выживания. По самым оптимистичным оценкам, запасов ископаемых углеводородов может хватить на срок от нескольких десятков (нефть и газ) до нескольких сотен (уголь) лет. Солнечный свет предлагает одну из доступных альтернатив, являясь неисчерпаемым источником относительно дешевой возобновляемой энергии. В настоящее время известен только один пример успешного использования солнечной энергии с высокой эффективностью в течение миллиардов лет – это природный фотосинтез. Вся биосфера Земли своим существованием прямо или косвенно обязана процессу фотосинтеза, в результате которого энергия света, поглощенного фотосинтезирующими организмами, запасается в виде энергии химических связей. Изучение этого уникального феномена имеет не только фундаментальный, но и четкий прикладной аспект в свете усилий по созданию устройств, имитирующих природный фотосинтез. Данный обзор демонстрирует очевидные успехи, достигнутые в изучении первичной стадии фотосинтеза, состоящей в поглощении света и передаче энергии возбуждения реакционным центрам. Опираясь на обширный фактический материал, показана тесная связь процессов переноса энергии и структурно-функциональной организации светособирающих комплексов различных фотосинтезирующих организмов. Высокая эффективность процессов миграции энергии в ССК обусловлена их высокой скоростью (пико- и фемтосекундный диапазон характерных времен), которая намного превышает скорость потерь энергии. Этот материал еще раз указывает на уникальную приспособляемость живой природы к различным условиям обитания. Изучение когерентных явлений, сопровождающих перенос энергии в природном фотосинтезе, раскрывает фундаментальную связь между квантовым микромиром и миром живых организмов.
Список литературы
Гусев М.В., Минеева Л.А. Микробиология. М.: Академия, 2003. 464 с.
Гусев М.В., Никитина К.А. Цианобактерии. М.: Наука, 1979. 228 с.
Еремин В.В., Глебов И.О., Белов А.С. Квантовая теория открытых систем и ее применение к биохимическим процессам // Вестн. Башкирского ун-та. 2009. Т. 14. С. 1318–1327.
Клейтон Р. Фотосинтез. Пер. с англ. М.: Мир, 1984. 350 с.
Фетисова З.Г., Фок М.В. Пути оптимизации преобразования световой энергии в первичных актах фотосинтеза. I. Необходимость оптимизации структуры фотосинтетической единицы и метод расчета ее эффективности // Мол. биол. 1984. Т. 18. С. 1651–1656.
Akimoto S., Teshigahara A., Yokono M. et al. Excitation relaxation dynamics and energy transfer in fucoxanthin−chlorophyll a/c-protein complexes, probed by time-resolved fluorescence // Biochim. Biophys. Acta. Bioenerg. 2014. V. 1837. P. 1514–1521.
Amunts A., Drory O., Nelson N. The structure of a plant photosystem I supercomplex at 3.4 Å resolution // Nature. 2007. V. 447. P. 58–63.
Beekman L.M.P., van Mourik F., Jones M.R. et al. Trapping kinetics in mutants of the photosynthetic purple bacterium Rhodobacter sphaeroides: influence of the charge separation rate and consequences for the rate-limiting step in the light-harvesting process // Biochemistry. 1994. V. 33. P. 3143–3147.
Ben-Shem A., Frolow F., Nelson N. The crystal structure of plant photosystem I // Nature. 2003. V. 426. P. 630–635.
Bibby T.S., Nield J., Partensky F., Barber J. Antenna ring around photosystem I // Nature. 2001. V. 413. P. 590.
Biggins J., Bruce D. Regulation of excitation energy transfer in photosynthetic organisms containing phycobilins // Photosynth. Res. 1989. V. 20. P. 1–34.
Blankenship R.E. Origin and early evolution of photosynthesis // Photosynth. Res. 1992. V. 33. P. 91–111.
Brixner T., Stenger J., Vaswani H.M. et al. Two-dimensional spectroscopy of electronic couplings in photosynthesis // Nature. 2005. V. 434. P. 625–628.
Bryant D.A., Vassilieva E.V., Frigaard N.-U., Li H. 2002. Selective protein extraction from Chlorobium tepidum chlorosomes using detergents. Evidence that CsmA forms multimers and binds bacteriochlorophyll a // Biochemistry. 2002. V. 41. P. 14403–14411.
Calhoun T.R., Ginsberg N.S., Schlau-Cohen G.S. et al. Quantum coherence enabled determination of the energy landscape in light-harvesting complex II // J. Phys. Chem. B. 2009. V. 113. P. 16291–16295.
Causgrove T.P., Brune D.C., Blankenship R.E. Förster energy transfer in chlorosomes of green photosynthetic bacteria // J. Photochem. Photobiol. B: Biol. 1992. V. 15. P. 171–179.
Chenu A., Scholes G.D. Coherence in energy transfer and photosynthesis // Annu. Rev. Phys. Chem. 2015. V. 66. P. 69–96.
Cherepy N.J., Du Mei, Holzwarth A.R., Mathies R.A. Near-infrared resonance Raman spectra of chlorosomes: probing nuclear coupling in electronic energy transfer // J. Phys. Chem. 1996. V. 100. P. 4662–4671.
Chin A.W., Prior J., Rosenbach R. et al. The role of nonequilibrium vibrational structures in electronic coherence and recoherence in pigment–protein complexes // Nat. Phys. 2013. V. 9. P. 113–118.
Cleary L., Chen H., Chuang C. et al. Optimal fold symmetry of LH2 rings on a photosynthetic membrane // PNAS USA. 2013. V. 110. P. 8537–8542.
Cogdell R.J., Gall A., Köhler J. The architecture and function of the light-harvesting apparatus of purple bacteria: from single molecules to in vivo membranes // Q. Rev. Biophys. 2006. V. 39. P. 227–324.
Collini E., Wong C.Y., Wilk K.E. et al. Coherently wired light-harvesting in photosynthetic marine algae at ambient temperature // Nature. 2010. V. 463. P. 644–648.
Croce R., Müller M.G., Bassi R., Holzwarth A.R. Carotenoid-to-chlorophyll energy transfer in recombinant major light-harvesting complex (LHCII) of higher plants. I. Femtosecond transient absorption measurements // Biophys. J. 2001. V. 80. P. 901–915.
Croce R., van Amerongen H. Light-harvesting in photosystem I // Photosynth. Res. 2013. V. 116. P. 153–166.
Curutchet C., Novoderezhkin V.I., Kongsted J. et al. Energy flow in the cryptophyte pe545 antenna is directed by bilin pigment conformation // J. Phys. Chem. B. 2013. V. 117. P. 4263–4273.
Dong H., Fleming G.R. Three-pulse photon echo of finite numbers of molecules: single-molecule traces // J. Phys. Chem. B. 2013. V. 117. P. 11318–11325.
Egawa A., Fujiwara T., Mizoguchi T. et al. Structure of the light-harvesting bacteriochlorophyll c assembly in chlorosomes from Chlorobium limicola determined by solid-state NMR // PNAS USA. 2007. V. 104. P. 790–795.
Engel G. S., Calhoun T.R., Read E.L. et al. Evidence for wavelike energy transfer through quantum coherence in photosynthetic systems // Nature. 2007. V. 446. P. 782–786.
Fassioli F., Olaya-Castro A., Scholes G.D. Coherent energy transfer under incoherent light conditions // J. Phys. Chem. Lett. 2012. V. 3. P. 3136–3142.
Fassioli F., Dinshaw R., Arpin P.C., Scholes G.D. Photosynthetic light harvesting: excitons and coherence // J. R. Soc. Interface. 2014. V. 11. Art. 20130901.
Feick R., Shiozawa J.A., Ertlmaier A. Biochemical and spectroscopic properties of the reaction center of the green filamentous bacterium Chloroflexus aurantiacus // Anoxygenic photosynthetic bacteria / Eds R.E. Blankenship, M.T. Madigan, C.E. Bauer. Dordrecht: Kluwer Acad. Publishers, 1995. P. 699–708.
Fetisova Z.G., Kharchenko S.G., Abdourakhmanov I.A. Strong orientational ordering of the near-infrared transition moment vectors of light-harvesting antenna bacterioviridin in chromatophores of the green photosynthetic bacterium Chlorobium limicola // FEBS Lett. 1986. V. 199. P. 234–236.
Fetisova Z.G., Shibaeva L.V., Fok M.V. Biological experience of oligomerization of chlorophyllous pigments in natural photosynthetic systems // J. Theor. Biol. 1989. V. 140. P. 167–184.
Fetisova Z.G., Mauring K., Taisova A.S. Strongly exciton-coupled BChl e chromophore system in the chlorosomal antenna of intact cells of the green bacterium Chlorobium phaeovibrioides: a spectral hole burning study // Photosynth. Res. 1994. V. 41. P. 205–210.
Fetisova Z.G., Freiberg A.M., Mauring K. et al. Excitation energy transfer in chlorosomes of green bacteria: theoretical and experimental studies // Biophys. J. 1996. V. 71. P. 995–1010.
Förster T. Zwischenmolekulare Energiewanderung und Fluoreszenz // Ann. Phys. 1948. V. 2. P. 55–75.
Förster T. Modern quantum chemistry // Istanbul lectures. Part III: Action of light and organic crystals / Ed. O. Sinannoğlu. New York: Academic Press, 1965. 323 p.
Frank H.A., Cogdell R.J. Carotenoids in photosynthesis // Photochem. Photobiol. 1996. V. 63. P. 257–264.
Freiberg A., Allen J.P., Williams J., Woodbury N.W. Energy trapping and detrapping by wild type and mutant reaction centers of purple non-sulfur bacteria // Photosynth. Res. 1996. V. 48. P. 309–319.
Frigaard N.-U., Chew A.G.M., Li H. et al. Chlorobium tepidum: insights into the structure, physiology and meta-bolism of a green sulfur bacterium derived from the complete genome sequence // Photosynth. Res. 2003. V. 78. P. 93–117.
Gelzinis A., Butkus V., Songaila E. et al. Mapping energy transfer channels in fucoxanthin–chlorophyll protein complex // Biochim. Biophys. Acta. Bioenerg. 2015. V. 1847. P. 241–247.
Golbeck J.H. Photosystem I in cyanobacteria // The molecular biology of cyanobacteria / Ed. D.A. Bryant. Dordrecht: Kluwer Acad. Publishers, 1994. P. 319–360.
Hess S., Åkesson E., Cogdell R. et al. Energy transfer in spectrally inhomogeneous light-harvesting pigment−protein complexes of purple bacteria // Biophys. J. 1995. V. 69. P. 2211–2225.
Hildner R., Brinks D., Nieder J.B. et al. Quantum coherent energy transfer over varying pathways in single light-harvesting complexes // Science. 2013. V. 340. P. 1448–1451.
Hu X., Ritz T., Damjanovic A. et al. Photosynthetic apparatus of purple bacteria // Q. Rev. Biophys. 2002. V. 35. P. 1–62.
Ishizaki A., Fleming G.R. Unified treatment of quantum coherent and incoherent hopping dynamics in electronic energy transfer: reduced hierarchy equation approach // J. Chem. Phys. 2009a. V. 130. Art. 234111.
Ishizaki A., Fleming G.R. Theoretical examination of quantum coherence in a photosynthetic system at physiological temperature // PNAS USA. 2009b. V. 106. P. 17255–17260.
Jun S., Yang C., Isaji M. et al. Coherent oscillations in chlorosome elucidated by two-dimensional electronic spectroscopy // J. Phys. Chem. Lett. 2014. V. 5. P. 1386–1392.
Karrasch S., Bullough P.A., Ghosh R. The 8.5 Å projection map of the light-harvesting complex I from Rhodospirillum rubrum revealed a ring composed of 16 subunits // EMBO J. 1995. V. 14. P. 631–638.
Kennis J.T.M., Streltsov A.M., Vulto S.I.E. et al. Femtosecond dynamics in isolated LH2 complexes of various species of purple bacteria // J. Phys. Chem. B. 1997. V. 101. P. 7827–7834.
Koepke J., Hu X., Muenke C. et al. The crystal structure of the light-harvesting complex II (B800–850) from Rhodospirillum molischianum // Structure. 1996. V. 4. P. 581–597.
Koolhaas M.H.C., Frese R.N., Fowler G.J.S. et al. Identification of the upper exciton component of the B850 bacteriochlorophylls of the LH2 antenna complex, using a B800-free mutant of Rhodobacter sphaeroides // Biochemistry. 1998. V. 37. P. 4693–4698.
Krasnovsky A.A., Bystrova M.I. Self-assembly of chlorophyll aggregated structures // BioSystems. 1980. V. 12. P. 181–194.
Krumova S.B., Laptenok S.P., Borst J.W. et al. Monitoring photosynthesis in individual cells of Synechocystis sp. PCC 6803 on a picosecond timescale // Biophys. J. 2010. V. 99. P. 2006–2015.
Linnanto J., Korppi-Tommola J. Exciton description of chlorosome to baseplate excitation energy transfer in filamentous anoxygenic phototrophs and green sulfur bacteria // J. Phys. Chem. B. 2013. V. 117. P. 11144–11161.
Liu Z., Yan H., Wang K. et al. Crystal structure of spinach major light-harvesting complex at 2.72 Å resolution // Nature. 2004. V. 428. P. 287–292.
Ma Y.Z., Cogdell R.J., Gillbro T. Energy transfer and exciton annihilation in the B800−850 antenna complex of the photosynthetic purple bacterium Rhodopseudomonas acidophila (strain 10050). A femtosecond transient absorption study // J. Phys. Chem. B. 1997. V. 101. P. 1087–1095.
Marin A., Doust A.B., Scholes G.D. et al. Flow of excitation energy in the cryptophyte light-harvesting antenna phycocyanin 645 // Biophys. J. 2011. V. 101. P. 1004–1013.
Matsuura K., Hirota M., Shimada K., Mimuro M. Spectral forms and orientation of bacteriochlorophylls c and a in chlorosomes of the green photosynthetic bacterium Chloroflexus aurantiacus // Photochem. Photobio1. 1993. V. 57. P. 92–97.
McDermott G., Prince S.M., Freer A.A. et al. Crystal structure of an integral membrane light-harvesting complex from photosynthetic bacteria // Nature. 1995. V. 374. P. 517–521.
Mirkovic T., Ostroumov E.E., Anna J.M. et al. Light absorption and energy transfer in the antenna complexes of photosynthetic organisms // Chem. Rev. 2017. V. 117. P. 249–294.
Novoderezhkin V. I., Marin A., van Grondelle R. Intra- and inter-monomeric transfers in the light harvesting LHCII complex: the Redfield−Förster picture // Phys. Chem. Chem. Phys. 2011. V. 13. P. 17093–17103.
Oelze J., Golecki J. R. Membranes and chlorosomes of green bacteria: structure, composition and development // Anoxygenic photosynthetic bacteria / Eds R.E. Blankenship, M.T. Madigan, C.E. Bauer. Dordrecht: Kluwer Acad. Publishers, 1995. P. 399–435.
Olson J.M. The FMO protein // Photosynth. Res. 2004. V. 80. P. 181–187.
Oostergetel G.T., Reus M., Gomez Maqueo Chew A. et al. Long-range organization of bacteriochlorophyll in chlorosomes of Chlorobium tepidum investigated by cryo-electron microscopy // FEBS Lett. 2007. V. 581. P. 5435–5439.
Panitchayangkoon G., Hayes D., Fransted K.A. et al. Long-lived quantum coherence in photosynthetic complexes at physiological temperature // PNAS USA. 2010. V. 107. P. 12766–12770.
Papageorgiou G.C., Govindjee. Photosystem II fluorescence: slow changes – scaling from the past // J. Photochem. Photobiol. B. 2011. V. 104. P. 258–270.
Polivka T., Frank H. A. Molecular factors controlling photosynthetic light harvesting by carotenoids // Acc. Chem. Res. 2010. V. 43. P. 1125–1134.
Pšenčik J., Arellano J., Collins A., et al. Structural and functional roles of carotenoids in chlorosomes // J. Bacteriol. 2013. V. 195. P. 1727–1734.
Redfield A.G. The theory of relaxation processes // Advances in magnetic resonance / Ed. J.S. Waugh. New York: Acad. Press, 1965. V. 1. P. 1–32.
Ruban A.V., Johnson M.P., Duffy C.D.P. The photoprotective molecular switch in the photosystem II antenna // Biochim. Biophys. Acta. Bioenerg. 2012. V. 1817. P. 167–181.
Sauer K., Cogdell R.J., Prince S.M. et al. Structure-based calculations of the optical spectra of the LH2 bacterio-chlorophyll-protein complex from Rhodopseudomonas acidophila // Photochem. Photobiol. 1996. V. 64. P. 564–576.
Savikhin S., Zhu Y., Lin S. et al. Femtosecond spectroscopy of chlorosome antennas from the green photosynthetic bacterium Chloroflexus aurantiacus // J. Phys. Chem. 1994. V. 98. P. 10322–10334.
Scholes G.D., Gould I.R., Cogdell R.J., Fleming G. R. Ab initio molecular orbital calculations of electronic couplings in the LH2 bacterial light-harvesting complex of Rps. acidophila // J. Phys. Chem. B. 1999. V. 103. P. 2543–2553.
Scholes G.D., Jordanides X.J., Fleming G.R. Adapting the Förster theory of energy transfer for modeling dynamics in aggregated molecular assemblies // J. Phys. Chem. B. 2001. V. 105. P. 1640–1651.
Songaila E., Augulis R., Gelzinis A. et al. Ultrafast energy transfer from chlorophyll c2 to chlorophyll a in fucoxanthin–chlorophyll protein complex // J. Phys. Chem. Lett. 2013. V. 4. P. 3590–3595.
Spear-Bernstein L., Miller K. R. Unique location of the phycobiliprotein light-harvesting pigment in the cryptophyceae // J. Phycol. 1989. V. 25. P. 412–419.
Staehelin L.A., Golecki J.R., Fuller R.C., Drews G. Visualization of the supramolecular architecture of chlorosomes (Chlorobium type vesicles) in freeze-fractured cells of Chloroflexus aurantiacus // Arch. Microbiol. 1978. V. 119. P. 269–277.
Sumi H. Theory on rates of excitation-energy transfer between molecular aggregates through distributed transition dipoles with application to the antenna system in bacterial photosynthesis // J. Phys. Chem. B. 1999. V. 103. P. 252–260.
Tian L., van Stokkum I.H.M., Koehorst R.B.M. et al. Site, rate, and mechanism of photoprotective quenching in cyanobacteria // J. Am. Chem. Soc. 2011. V. 133. P. 18304–18311.
Turner D.B., Arpin P.C., McClure S.D. et al. Coherent multidimensional optical spectra measured using incoherent light // Nat. Commun. 2013. Art. 4. P. 2298.
van Dorssen R.J., Vasmel H., Amesz J. Pigment organization and energy transfer in the green photosynthetic bacterium Chloroflexus aurantiacus. II. The chlorosome // Photosynth. Res. 1986. V. 9. P. 33–45.
van Dorssen R.J., Amesz J. Pigment organization and energy transfer in the green photosynthetic bacterium Chloroflexus aurantiacus. III. Energy transfer in whole cells // Photosynth. Res. 1988. V. 15. P. 177–189.
van der Weij-De Wit C.D., Doust A.B., van Stokkum I.H. et al. How energy funnels from the phycoerythrin antenna complex to photosystem I and photosystem II in cryptophyte Rhodomonas CS24 cells // J. Phys. Chem. B. 2006. V. 110. P. 25066–25073.
van Grondelle R., Novoderezhkin V.I. Energy transfer in photosynthesis: experimental insights and quantitative models // Phys. Chem. Chem. Phys. 2006. V. 8. P. 793–807.
Visscher K.J., Bergström H., Sundström V. et al. Temperature dependence of energy transfer from the long wavelength antenna BChl-896 to the reaction center in Rhodospirillum rubrum, Rhodobacter sphaeroides (w.t. and M21 mutant) from 77 to 177K, studied by picosecond absorption spectroscopy // Photosynth. Res. 1989. V. 22. P. 211–217.
Wientjes E., van Stokkum I.H., van Amerongen H., Croce R. The role of the individual Lhcas in photosystem I excitation energy trapping // Biophys. J. 2011. V. 101. P. 745–754.
Wlodarczyk L.M., Snellenburg J.J., Ihalainen J.A. et al. Functional rearrangement of the light-harvesting antenna upon state transitions in a green alga // Biophys. J. 2015. V. 108. P. 261–271.
Yakovlev A.G., Taisova A.S., Fetisova Z.G. Light control over the size of an antenna unit building block as an effecient strategy for light harvesting in photosynthesis // FEBS Lett. 2002. V. 512. P. 129–132.
Yakovlev A., Taisova A., Arutyunyan A. et al. Variability of aggregation extent of light-harvesting pigments in peripheral antenna of Chloroflexus aurantiacus // Photosynth. Res. 2017. V. 133. P. 343–356.
Yakovlev A.G., Taisova A.S., Shuvalov V.A., Fetisova Z.G. Estimation of the bacteriochlorophyll c oligomerisation extent in Chloroflexus aurantiacus chlorosomes by very low-frequency vibrations of the pigment molecules: a new approach // Biophys. Chem. 2018. V. 240. P. 1–8.
Yang M., Fleming G.R. Influence of phonons on exciton transfer dynamics: comparison of the Redfield, Förster, and modified Redfield equations // Chem. Phys. 2002. V. 275. P. 355–372.
Zhang W.M., Meier T., Chernyak V., Mukamel S. Exciton-migration and three-pulse femtosecond optical spectroscopies of photosynthetic antenna complexes // J. Chem. Phys. 1998. V. 108. P. 7763–7774.
Zuber H., Cogdell R.J. Structure and organization of purple bacterial antenna complexes // Anoxygenic Photosynthetic Bacteria / Eds. R.E. Blankenship, M.T. Madigan, C.E Bauer. Dordrecht: Kluwer Acad. Publishers, 1995. P. 315–348.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии