Успехи современной биологии, 2020, T. 140, № 2, стр. 149-165
Механизмы реализации антиоксидантных эффектов альфа-токоферола
С. В. Чепур 1, *, Н. Н. Плужников 1, С. А. Сайганов 2, О. В. Чубарь 1, Л. С. Бакулина 3, И. В. Литвиненко 4, М. А. Юдин 1, А. С. Никифоров 1
1 Государственный научно-исследовательский испытательный институт военной медицины Минобороны России
Санкт-Петербург, Россия
2 Северо-западный государственный медицинский университет им. И.И. Мечникова Минздрава России
Санкт-Петербург, Россия
3 Воронежская государственная медицинская академия им. академика Н.Н. Бурденко Минздрава России
Воронеж, Россия
4 Военно-медицинская академия им. С.М. Кирова Минобороны России
Санкт-Петербург, Россия
* E-mail: gniiivm_2@mail.ru
Поступила в редакцию 13.12.2019
После доработки 23.12.2019
Принята к публикации 30.12.2019
Аннотация
Антиоксидантные свойства витамина Е (α‑токоферола) реализуются посредством нейтрализации пероксильных и алкильных радикалов, взаимодействие с которыми осуществляется благодаря конформации молекул в электростатическом поле по градиенту напряженности. Учитывая соотношение фосфолипидов и токоферола, сформирована научная гипотеза, согласно которой электродинамика межмолекулярных взаимодействий про- и антиоксиданта интенсифицируется благодаря подвижности последнего в комплексе с витамином А (ретинола пальмитатом), фиксирующемся в слое фосфолипидов определенным образом. В такой молекулярной ассоциации ОН‑группа хроманольного кольца витамина Е, будучи высокополярной, находится в гидрофильной части липидного бислоя и удерживается в составе мембраны фитильной цепью посредством ее гидрофобного взаимодействия с полиненасыщенным фрагментом ретинола пальмитата или остатками полиненасыщенных жирнокислотных остатков фосфолипидов. Подвижность молекулы витамина Е обеспечивает реализацию его антиоксидантных свойств в системе антирадикальной защиты мембран. Кверцетин, выполняя роль проводника электронов и протонов с восстановленной L-аскорбиновой кислоты, ускоряет рециклирование витамина Е, что блокирует прооксидантные эффекты формирующегося токоферильного радикала.
ВВЕДЕНИЕ
Витамин Е, по-видимому, – последний из всех витаминов, биологическая роль которого все еще в значительной степени не понятна (Brigelius-Flohe, 2009). Биология витамина Е и накануне столетия изучения его свойств остается загадочной (Blaner, 2013; Galli et al., 2017). Даже вопросы относительно механизмов восстановления α‑токоферолом алкильных и пероксильных радикалов в толще липидного бислоя клеточных мембран остаются открытыми (Marquardt et al., 2015). В силу этого, целью настоящего обзора была попытка определить взаимосвязь имеющихся фактов в отношении антиоксидантной активности витамина Е и представить в виде гипотезы вариант событий, определяющих антиоксидантную защиту биологических мембран и, соответственно, обеспечивающих многообразие их функций.
ИСТОРИЯ ОТКРЫТИЯ И ИЗУЧЕНИЯ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ВИТАМИНА Е
В 1922 году в Калифорнийском университете в Беркли Герберт М. Эванс и его ассистентка Кэтрин С. Бишоп пришли к заключению о существовании пищевого “фактора Х”, при отсутствии которого в рационе крыс у животных возникали нарушения репродукции (Evans, Bishop, 1922; Evans, 1962). В продолжение сложившейся номенклатуры ранее открытых витаминов (использование заглавных букв латинского алфавита: A, B, C и D) Барнетт Суре в 1924 году предложил обозначать “фактор Х” как витамин Е (Sure, 1924). С данным предложением согласился первооткрыватель “фактора Х” (Evans, 1925; Evans, Burr, 1925) и идентифицировал его как α‑токоферол (токоферол – производящий потомство) в 1936 г. (Evans et al., 1936).
К числу значимых достижений начального периода изучения витамина Е следует отнести:
– выделение в чистом виде β-, γ-токоферолов в 1937 г. (Emerson et al., 1937) и δ‑токоферола в 1947 г. (Stern et al., 1947);
– установление структуры и путей синтеза α‑токоферола в 1938 г. (Karrer et al., 1938; Fernholz, 1938);
– выявление антиоксидантной активности токоферолов в 1937 г. (Olcott, Emerson, 1937) и повторное открытие их антиоксидантных свойств в шестидесятые годы прошлого столетия (Tappel, Zalkin, 1960; Tappel, 1962);
– выделение природных токотриенолов (Pennock et al., 1964; Whittle et al., 1966; Chow, Draper, 1970) и обнаружение их способности ингибировать активность 3‑гидрокси-3-метилглутарил коэнзима А (HMC-CoA)-редуктазы – скорость-лимитирующего энзима синтеза холестерина (Qureshi et al., 1986, 1991; Pearce et al., 1994; Song, DeBose-Boyd, 2006).
В дальнейшем интерес исследователей привлекали вопросы биологии витамина Е, связанные с транспортом, распределением, метаболизмом токолов и биологической активностью их производных (Rimbach et al., 2002; Kaempf-Rotzoll et al., 2003; Azzi et al., 2003, 2004; Parker et al., 2004; Gianello et al., 2005; Abe et al., 2007; Jiang et al., 2008; Wallert et al., 2014; Schubert et al., 2018). Последние публикации по проблеме витамина Е чаще всего не ассоциированы с его антиоксидантной активностью – внимание специалистов сфокусировано на молекулярных механизмах модулирующего влияния токоферолов, токотриенолов и их метаболитов на клеточные каскады сигнальной трансдукции и механизмы регуляции экспрессии генов (Galli et al., 2017; Azzi, 2018; Schubert et al., 2018; Galmes et al., 2018; Khadangi, Azzi, 2019).
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА И СТРУКТУРА ИЗОФОРМ ВИТАМИНА Е
Природные представители семейства витамина Е – токоферолы и токотриенолы, известные как токолы или токохроманолы, при комнатной температуре представляют собой светло-желтые прозрачные маслянистые жидкости, нерастворимые в воде, но хорошо растворимые в органических растворителях и жирах. Токолы чувствительны к воздействию ультрафиолета, кислорода воздуха и легко образуют сложные эфиры с различными кислотами (фосфорная, уксусная, янтарная, никотиновая, пальмитиновая кислоты) (Duncan, Suzuki, 2017). В последнем случае сохраняется их биологическая активность и увеличивается водорастворимость (Kofler et al., 1962; Nakamura et al., 1978; Gianello et al., 2005; Ben-Shabat et al., 2013; Zingg, 2018).
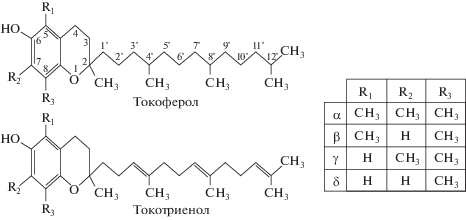
По химическому строению витамины группы Е представляют собой 6-хроманолы (гидроксибензол, конденсированный с γ-дигидропираном) с боковой полиизопреноидной (фитильной) цепью (рис. 1). Токотриенолы отличаются от токоферолов наличием трех двойных связей в фитильной цепи в позиции углеродных атомов С3', С7' и С11'. И токоферолы, и токотриенолы представлены четырьмя гомологами (α-, β-, γ-, δ-), отличающимися друг от друга числом и расположением метильных групп на бензольном кольце (Sen et al., 2006; Zielinska, Nowak, 2014).
Наличие трех хиральных центров (асимметрических атомов углерода С2, С4', С8') обеспечивает возможность существования восьми (23) оптических стереоизомеров для каждого токоферола (RRR, RRS, RSR, RSS, SRR, SRS, SSR, SSS). Из них биологически активны только 2R-стереоизомеры (RRR, RRS, RSR, RSS), и среди них наиболее активна природная форма – (RRR)‑α‑токоферол (рис. 2).
Рис. 2.
Ориентация фитильной цепи некоторых стереоизомеров α-токоферола относительно 6-хроманольной группы (адаптировано по Brigelius-Floe, Traber, 1999).
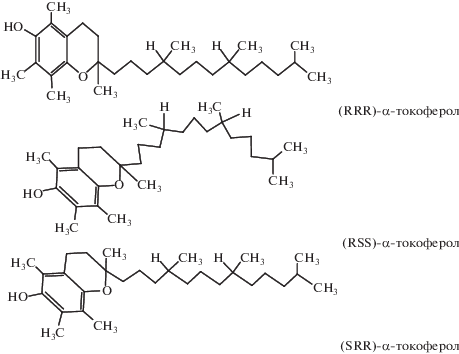
Отсутствие специфической активности у (2S)‑стереоизомеров токолов, по-видимому, обусловлено особенностями пространственной ориентации боковой фитильной цепи относительно 6-хроманольной группы (Weiser, Vecchi, 1982; Weiser et al., 1996; Colombo, 2010; Dersjant-Li, Peisker, 2010; Lashkari et al., 2019).
Из-за отсутствия асимметрических атомов углерода в боковой цепи, каждый токотриенол имеет только один хиральный атом углерода в позиции С2 и поэтому может быть представлен лишь в форме двух оптических стереоизомеров (2R и 2S). Но наличие двойных связей в боковой цепи в позиции углеродных атомов С3' и С7' обеспечивает возможность их существования в виде четырех cis/trans-геометрических изомеров. Однако, в биологических системах обнаружены только 2R-, 3-trans-, 7-trans-изомеры токотриенолов (Kamal-Eldin, Appelqvist, 1996; Clarke et al., 2008; Ahsan et al., 2015; Shahidi, de Camargo, 2016).
Биологическая активность токолов самым существенным образом зависит от их химической структуры (табл. 1).
Таблица 1.
Относительная биологическая активность токолов in vivo (по: Ball, 1988; Kamal-Eldin, Appelqwist, 1996)
| Токол | Биол. акт-ть (%) | Токол | Биол. акт-ть (%) |
|---|---|---|---|
| (RRR)‑α‑токоферол | 100 | (2R)-α-токотриенол | 29–30 |
| (RRR)‑β‑токоферол | 25–50 | (2R)-β-токотриенол | 5 |
| (RRR)‑γ‑токоферол | 1–11 | (2R)-γ-токотриенол | Неизвестна |
| (RRR)‑δ‑токоферол | 1–3 | (2R)-δ-токотриенол | Неизвестна |
ПОСТУПЛЕНИЕ, АБСОРБЦИЯ, МЕТАБОЛИЗМ И РАСПРЕДЕЛЕНИЕ ТОКОЛОВ
Токолы – наиболее значимые жирорастворимые антиоксиданты (Burton et al., 1983), биосинтез которых осуществляется фотосинтезирующими организмами (растения, водоросли, некоторые цианобактерии) и возбудителем малярии Plasmodium falciparum для подавления свободнорадикальных параметаболических реакций (Munné-Bosch, Alegre, 2002; Falk, Munné-Bosch, 2010; Sussmann et al., 2011, 2017; Mène-Saffrané, 2017).
Гидрофобная природа токохроманолов предопределяет полную зависимость абсорбции изоформ витамина Е от всасывания жиров:
– пищевые жиры, содержащие растворенные токоферолы и токотриенолы, в двенадцатиперстной кишке под влиянием поверхностно-активных солей желчных кислот эмульгируются и в виде жировых мицелл, главным образом, рецептор-зависимым путем поступают в энтероциты (Gallo-Torres, 1970; Reboul, Borel, 2011; Schmölz et al., 2016; Reboul, 2017; Yamanashi et al., 2017);
– в цитозоле энтероцитов витамин Е локализуется в составе образующихся хиломикронов, которые при участии белка-переносчика триглицеридов через базальную мембрану эпителиальных клеток транслоцируются в лимфатические сосуды (лактеали) ворсинок кишечника и далее поступают в системный кровоток (Anwar et al., 2006, 2007; Lemaire-Ewing et al., 2010; Hussain, 2014; Xiao et al., 2019);
– в сосудистом русле хиломикроны, претерпев композиционную динамику в течение нескольких минут под влиянием липопротеинлипазы, трансформируются в остаточные хиломикроны (Mead et al., 2002; Ory, 2007), которые в последующем рецептор-зависимым путем поступают в гепатоциты (Cooper, 1997; Havel, 1998; Lemaire-Ewing et al., 2010; Hultin et al., 2013);
– в цитозоле гепатоцитов токолы, как липофильные субстанции, связываются с α-токоферол-транспортным белком (α-ТТБ). Это взаимодействие носит выраженный дискриминационный характер – среди всех изоформ витамина Е наибольшим сродством к α-ТТБ отличается (RRR)-α-токоферол (табл. 2), что и предопределяет его преимущественное накопление в организме (Hosomi et al., 1997; Stocker, Azzi, 2000; Meier et al., 2003; Gohil et al., 2008; Lemaire-Ewing et al., 2010);
Таблица 2.
Лиганд-специфичность α‑токоферол-транспортного белка (адаптировано по Hosomi et al., 1997; Panagabko et al., 2003)
| Лиганд | Константа диссоциации (Kd, nM) | Относительное сродство к токолам, % |
|---|---|---|
| (RRR)-α-токоферол | 25.0 | 100 |
| (RRR)-β-токоферол | 124.0 | 38 |
| (RRR)-γ-токоферол | 266.0 | 9 |
| (RRR)-δ-токоферол | 586.0 | 2 |
| (2R)-α-токотриенол | 214 | 12 |
– ассоциированные с α‑ТТБ токохроманолы формируют термодинамически стабильные высокомолекулярные олигомерные комплексы, поступают в кровоток и транслоцируются в состав липопротеинов очень низкой плотности (Aeschimann et al., 2017). В циркуляторном русле при участии фосфолипид-транспортного белка (ФЛТБ) происходит перераспределение токолов между липопротеинами очень низкой плотности и более плотными липопротеинами (Jiang et al., 2002). Клетками тканей α‑токоферол абсорбируется либо рецептор-зависимым путем (LDLR (low density lipoprotein receptor), SR-B1 (scavinger receptor class B type 1)), либо посредством ассоциированного с фосфолипид-транспортным белком лиганд-обменного механизма (Lemaire-Ewing et al., 2010);
– все не связанные с α‑ТТБ изоформы витамина Е, в том числе и избыток свободного (RRR)‑α‑токоферола, в организме животных и человека повторяют метаболическую траекторию липофильных ксенобиотиков: претерпев омега-гидроксилирование при участии цитохрома Р450 (CYP4F2), бета-окисление в митохондриях и последующие реакции конъюгирования, они выводятся из организма в виде полярных метаболитов (Sontag, Parker, 2002; Mustacich et al., 2010; Traber, 2013; Schmölz et al., 2016).
Следует заметить, что в дополнение к дискриминационному характеру связывания токолов с α‑ТТБ, катаболизм изоформ витамина Е также отличается дискриминационной направленностью. Цитохром CYP4F2, как единственная специализированная омега-гидроксилаза токолов (Sontag, Parker, 2002; Parker et al., 2004; Bardowell et al., 2010), характеризуется пониженной субстратной специфичностью и метаболической активностью относительно (RRR)-α-токоферола (Sontag, Parker, 2007; Abe et al., 2007). То есть, α-ТТБ и цитохром CYP4F2 функционируют как единый механизм аккумулирования (гомеостатирования) α‑токоферола в организме. Гомеостатирование α-токоферола – важный аспект биологии витамина Е, так как при высоких уровнях содержания витамина наблюдают инверсию его антиоксидантных эффектов (Takahashi et al., 1989). Токофероксильный радикал даже при том, что неспаренный электрон делокализован в ароматическом кольце хроманольной группы, способен, хоть и с относительно невысокой скоростью, восстанавливаться, разрывая связь С–Н в бис-аллильной позиции углерода в цепи полиненасыщенных жирных кислот, и присоединять атом водорода, инициируя, тем самым, цепную реакцию пероксидации (Bowry, Stocker, 1993). Прооксидантное действие витамина Е подавляется в присутствии физиологических концентраций витамина С (Terao, Matsushita, 1986; Kontush et al., 1996; Bakir et al., 2013; Slavova-Kazakova, Kancheva, 2018). В ткани головного мозга, отличающейся высоким уровнем содержания полиненасыщенных жирных кислот, а следовательно, и высокой вероятностью возникновения/поддержания свободнорадикальных параметаболических реакций (Uttara et al., 2009; Kim et al., 2015; Mohn et al., 2017), на долю α‑токоферола приходится 99.8% от всех изоформ витамина Е (Podda et al., 1996).
МЕХАНИЗМЫ РЕАЛИЗАЦИИ АНТИРАДИКАЛЬНЫХ ЭФФЕКТОВ α-ТОКОФЕРОЛА
Нейтрализация алкильных радикалов. α-Токоферол эффективно ингибирует (нейтрализует) не содержащие кислорода радикалы R• (алкил-радикалы, углерод-центрированные радикалы). Алкил-радикалы способны эстафетным путем (внутри- и межмолекулярно) перемещаться по гидрофобной углеводородной зоне в энергетически более выгодное положение, приближаясь к редокс-активной гидроксильной группе антиоксиданта. То есть, в градиенте электрического поля, формируемого антиоксидантом и прооксидантом, липидные радикалы (R•) могут претерпевать изомеризацию, перемещаясь из дистального положения в проксимальное относительно 6‑хроманольной группы α‑токоферола, далее, после сближения, вступая с ней в редокс-реакцию. При этом сложноэфирная связь блокирует передачу/передвижение углерод-центрированного радикала. Вероятно, именно для обеспечения эстафетной передачи алкильных радикалов из гидрофобной зоны на хроманольное кольцо α‑токоферола, ароматическая структура и боковая фитильная цепь антиоксиданта не соединены посредством “изолирующей” сложноэфирной группировки (Макарова, 1985).
Нейтрализация пероксильных радикалов. Посредством компьютерного моделирования взаимодействие пероксильного радикала жирных кислот (ROO•) и α‑токоферола в составе фосфолипидной мембраны, в процессе которого осуществляется трансфер протона и электрона с гидроксильной группы хроманольного кольца антиоксиданта на свободный радикал, показано, что реакция нейтрализации пероксильного радикала может протекать лишь тогда, когда реагирующие функциональные группы молекул оказываются в непосредственной близости друг от друга (Новикова, Красильников, 2009). Вместе с тем, известно, что ROO•-радикалы остатков полиненасыщенных жирных кислот фосфолипидов, будучи неспособными покидать гидрофобную зону фосфолипидного бислоя путем внутримолекулярной изомеризации (Schneider, 2009), все же достигают раздела фаз липид/вода (Yazu et al., 2000). Также установлено, что миграция пероксильных радикалов к границе гидрофобной зоны биомембран и их взаимодействие с α-токоферолом резко подавляется в фосфолипидном бислое, содержащем остатки лишь насыщенных жирных кислот (Krumova et al., 2012). Кроме того, экспериментально показано, что хроманольное кольцо α-токоферола может несколько “погружаться” в толщу липидного бислоя (дистанция 2–3 атома углеводородной цепи), что так же способствует установлению контакта между реагирующими группами антиоксиданта и свободного радикала (Atkinson et al., 2008).
Сближение на дистанцию протекания редокс-реакции между α-токоферолом и пероксильным радикалом жирнокислотного остатка фосфолипида (рис. 3) может достигаться за счет конформационной перестройки окисленного остатка полиненасыщенной жирной кислоты (Новикова, Красильников, 2009; Buettner, 1993).
Рис. 3.
Конформационная динамика цепи остатка полиненасыщенной жирной кислоты, несущей пероксильный радикал (адаптировано по Buettner, 1993; Новикова, Красильников, 2009).
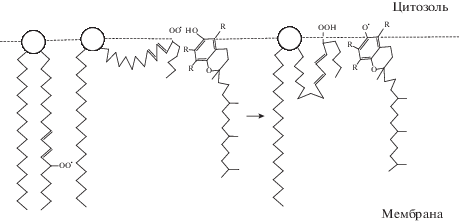
При этом величина константы скорости реакции α‑токоферола с пероксильными радикалами различных полиненасыщенных жирнокислотных остатков фосфолипидов биомембран составляет 5 × 105–3 × 106 (М · с)–1, то есть одна молекула антиоксиданта в течение секунды может нейтрализовать сотни тысяч и даже несколько миллионов ROO•‑радикалов. Константа скорости реакции α‑токоферола и пероксильных радикалов более чем на три порядка превышает показатель скорости взаимодействия данных радикалов с остатками полиненасыщенных жирных кислот фосфолипидов биомембран, поэтому α‑токоферол эффективно ингибирует процесс пероксидации липидов, инициируемый ROO•-радикалами (Niki, 2014, 2018). Следует заметить, что в отношении нейтрализации гидроксильного радикала (ОН•) α‑токоферол менее эффективен, поскольку константа скорости взаимодействия ОН• с липидами очень велика – 1.0 ×1010 (M · с)–1 (Buxton et al., 1988), а с α-токоферолом данный показатель существенно ниже k ≈ 2.7 × 108 (M · с)–1 (Navarrete et al., 2005).
α-Токоферол и фосфолипиды, содержащие остатки полиненасыщенных жирных кислот, локализуются преимущественно во внутреннем монослое плазматических мембран (Тюрин и др., 1989). Считается, что именно состав фосфолипидов предопределяет включение альфа-токоферола в данный монослой липидных биомембран (Тюрин и др., 1988). Но при том, что уровень и распределение витамина Е в ткани головного мозга прямо коррелируют с уровнем и распределением арахидоновой кислоты (Mohn et al., 2017), математическое моделирование молекулярной динамики в фосфолипидных мембранах не подтвердило предположения о тропности α‑токоферола к фосфолипидным рафтам с высоким содержанием остатков полиненасыщенных жирных кислот (Leng et al., 2018).
В умеренных модельных условиях (физиологическое значение температуры среды и отсутствие пероксидации) α-токоферол фосфолипидных мембран не способен транслоцироваться из одного монослоя мембраны в другой, то есть не способен осуществлять флип-флоп переход (Тюрин и др., 1986; Qin et al., 2009). Но в то же время, при стимуляции пероксидации молекула витамина Е, преодолевая термодинамический запрет (энергетический барьер), в субмикросекундные интервалы времени может мигрировать из одного монослоя биомембраны в другой и обратно (Рангелова и др., 1990; Leng et al., 2015; Boonnoy et al., 2018). Скорость, с которой осуществляется флип-флоп переход, существенно превышает показатель скорости взаимодействия пероксильных радикалов с остатками полиненасыщенных жирнокислотных остатков фосфолипидов. То есть, α-токоферол способен эффективно гасить свободные радикалы и в противолежащем монослое фосфолипидных биомембран. Следует заметить, для обеспечения флип-флоп перехода фосфолипидов плазматической мембраны необходимо наличие электрохимического градиента на данной мембране (Stevens, Nichols, 2007).
Если отвлечься от частностей, антиоксидантные эффекты α‑токоферола ассоциированы с такими феноменами, как:
– латеральная подвижность молекул антиоксиданта и фосфолипидных свободных радикалов (R•, ROO•);
– внутри-/межмолекулярная миграция алкильных радикалов (R•) в апикальное положение посредством изомеризации;
– погружение молекулы антиоксиданта в толщу липидного бислоя мембран;
– конформационная перестройка окисленных остатков полиненасыщенных жирнокислотных остатков (ROO•) фосфолипидов;
– транслокация молекулы антиоксиданта из одного монослоя фосфолипидной мембраны в другой (флип-флоп переход).
Перечисленные феномены молекулярной динамики, по-нашему мнению, объединяет то, что все они – проявление электростатического взаимодействия в градиенте электрического поля, формирующегося между свободным радикалом-окислителем и антиоксидантом-восстановителем. Поэтому их взаимоориентация и сближение на дистанцию протекания редокс-реакции не носят стохастического характера, а детерминированы разностью окислительно-восстановительных потенциалов свободного радикала и восстановленного α-токоферола. О величине электростатического взаимодействия между прооксидантом и антиоксидантом в биомембранах можно судить исходя из того, что редокс-потенциал пероксильного радикала (ROO•) и α‑токоферола равны 1000 и 500 мВ, соответственно, то есть разность редокс-потенциалов составляет 500 мВ (Steenken, Neta, 1982; Buettner, 1993; Jovanovic et al., 1996; Choe, Min, 2005). При толщине гидрофобного слоя биомембран 3–4 нм (Lewis, Engelman, 1983; Rawicz et al., 2000; Mashaghi et al., 2012) напряжение электрического поля между пероксильным радикалом и α-токоферолом в монослое может составить 0.33–0.25 В/нм (более привычный масштаб: 3.3 × 106–2.5 × 106 В/см).
Электростатическое взаимодействие описывается формулой Кулона: F = k(|q1||q2|)/r2, где k – коэффициент пропорциональности, |q1| и |q2| – модули величины зарядов, r – расстояние между зарядами. Как видно из формулы, сила взаимодействия уменьшается обратно пропорционально квадрату расстояния между зарядами, то есть в рассматриваемом случае электростатическое взаимодействие будет обеспечивать гашение алкильных и пероксильных радикалов только в ближайшем окружении молекулы α-токоферола. Учитывая тот факт, что в различных биомембранах величина соотношения молекул α-токоферола и фосфолипидов колеблется в пределах 1 : 100–1 : 1000 и более (Gruger, Tappel, 1971; Kombrust, Mavis, 1980; Buttriss, Diplock, 1988a,b; Wang, Quinn, 1999; Atkinson et al., 2010), закономерно возникает вопрос: посредством каких молекулярных механизмов обеспечивается антиоксидантная защита биомембран при столь низком уровне антиоксиданта?
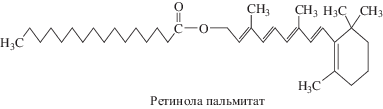
Участие ретинола в реализации антиоксидантных эффектов альфа-токоферола. В комплексе с витамином Е в защите биологических мембран от повреждения их прооксидантами принимает участие и ретинол (витамин А) (Барабой, 1985; Kensler, Trush, 1981; Sies, Stahl, 1995; Palace et al., 1999; Young, Lowe, 2001; Krinsky, Johnson, 2005). Ретинол в мембранах клеточных элементов тканей находится в виде эфиров пальмитиновой и других жирных кислот, в такой форме он депонируется в звездчатых клетках печени (De Luca et al., 1984; Senoo et al., 2007).
При рассмотрении молекулярных механизмов антирадикальной защиты биомембран следует учитывать то, что:
– гидрофобная часть липидного бислоя представляет собой диэлектрик, а потому является трудно преодолимым барьером для небольших (одноатомных) анионов, катионов и электронов (Геннис, 1997; Henn, Thompson, 1969);
– гашение свободных радикалов в гидрофобной зоне биомембран обеспечивается при условии прямого контакта реакционноспособных групп антиоксиданта и прооксиданта (Новикова, Красильников, 2009; Atkinson et al., 2008);
– молекулы α-токоферола в липидном бислое клеточных мембран склонны формировать ассоциации c фосфолипидами и свободными жирными кислотами, в первую очередь с полиненасыщенными, аффинность к которым на четыре порядка превышает сродство антиоксиданта к насыщенным жирным кислотам (Ерин и др., 1983, 1985, 1988);
– при комбинированном применении ретинола и α-токоферола степень антиоксидантного синергизма линейно зависит от молярного соотношения витамин А/витамин Е в диапазоне 0.1–1.0 с резким его снижением при соотношении равном 2.0 (Tesoriere et al., 1996).
В связи с вышеизложенным возникает ряд вопросов, основные среди которых:
– каким образом в процессе гашения липидных радикалов биомембран обеспечивается доставка электронов и протонов в среде диэлектрика на достаточно большие расстояния, когда на одну молекулу антиоксиданта (донора электронов и протонов) приходятся сотни и даже тысячи молекул фосфолипидов?
– почему ретинол, потенциально способный поддерживать реакции пероксидации в силу наличия в его структуре полиеновой цепи (Dobrucki, Radomska, 2002), в присутствии α-токоферола (при соблюдении определенного молярного соотношения) усиливает антиоксидантные эффекты витамина Е (Haila, 1999)?
В качестве ответа на первый вопрос ранее высказывалось предположение, что углеводородная фитильная цепь α-токоферола играет роль своеобразного проводника, по которому свободнорадикальные центры эстафетным путем покидают гидрофобную зону биологических мембран (Иванов, 1984). Но ROO•‑радикалы неспособны мигрировать в гидрофобной зоне липидного бислоя посредством внутри-/межмолекулярной изомеризации (Schneider, 2009). И тем не менее, эффективное участие витамина Е, как донора электронов и протонов, в гашении пероксильных радикалов в составе фосфолипидного бислоя клеточных мембран – факт, не вызывающий сомнений.
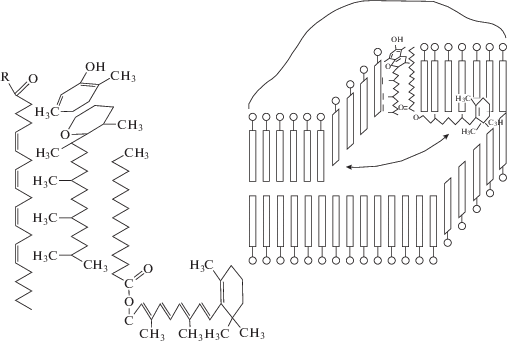
По нашему мнению, молекулы альфа-токоферола и ретинола пальмитата способны формировать в липидном бислое мембран динамичные сенсорно-проводящие комплексы (рис. 4). Структурной основой таких комплексов может быть стабильная ассоциация, состоящая из одной молекулы α-токоферола, одной молекулы ретинола пальмитата и арахидоновой кислоты (остатка молекулы арахидоновой кислоты из состава фосфолипида мембраны), ориентированных относительно друг друга определенным образом. В такой молекулярной ассоциации ОН-группа хроманольного кольца витамина Е, будучи высоко полярной, находится в гидрофильной части липидного бислоя и удерживается в составе мембраны фитильной цепью посредством ее гидрофобного взаимодействия с фрагментом ретинола пальмитата или полиненасыщенными жирнокислотными остатками фосфолипидов.
При этом наибольшую аффинность боковая цепь α-токоферола проявляет относительно арахидоновой кислоты (Ерин и др., 1983; Lucy, 1972; Diplock, 1983; Erin et al., 1985; Atkinson et al., 2010). По мнению некоторых исследователей, метильные группы фитильной цепи α-токоферола взаимодействуют с жирнокислотными остатками фосфолипидов и фиксируются в “карманах”, формируемых цис-конфигурацией двойных связей, например, арахидоновой кислоты (Diplock, Lucy, 1973). За счет гидрофобного взаимодействия остаток пальмитиновой кислоты ретинола пальмитата может связываться с ассоциацией фитильная цепь α-токоферола/арахидоновая кислота. Вероятно, в данном тройственном комплексе ретинол, связанный эфирной связью с пальмитиновой кислотой, находится между монослоями фосфолипидов биомембраны и способен совершать вращательные движения относительно длинника остатка пальмитиновой кислоты, находясь в плоскости границы раздела этих монослоев за счет подвижности одинарной связи “углерод–углерод”. При появлении в толще липидного бислоя (в любом из его монослоев) свободного радикала остатка жирной кислоты фосфолипида, активных форм и радикалов кислорода, ОН-группа α-токоферола (восстановитель) и прооксидант (окислитель) формируют редокс-пару с окислительно-восстановительным потенциалом до нескольких вольт (редокс-потенциал гидроксильного радикала более двух вольт (Buettner, 1993; Winterbourn, 2008). Для сравнения можно указать на то, что для синтеза макроэргов необходим мембранный потенциал около 0.2 В (Dzbek, Kozeniewski 2008, Kim et al., 2012). Именно поэтому остаток ретинола, вероятно, как стрелка компаса в магнитном поле, оставаясь в плоскости границы раздела монослоев биомембраны и совершая вращательное движение вокруг оси, совпадающей с длинником остатка пальмитиновой кислоты, ориентируется электрическим полем в направлении прооксиданта.
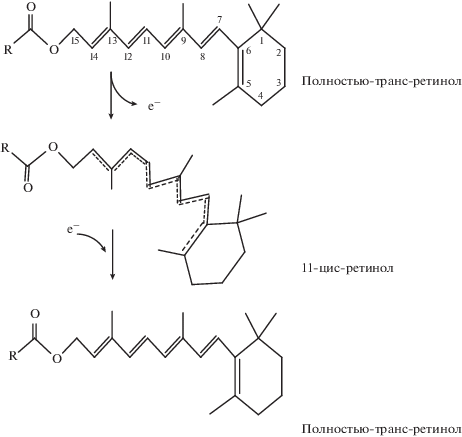
Ретинол, будучи по электрохимической природе восстановителем (Lovander et al., 2018), может функционировать как электронный носитель (проводник) (Hammerling, 2016). При этом остаток ретинола изначально находится в состоянии полностью транс-ретинола. Предполагается, что в электрическом поле индуцируется делокализация электронной плотности, ее смещение в сторону прооксиданта и происходит “разрыв” π‑электронной компоненты двойной связи С11–С12 полиеновой цепи, что и обеспечивает транс-цис-изомеризацию остатка ретинола. Под действием градиента электрического поля остаток ретинола в цис-конформационном состоянии может погружаться, достигая пероксильного радикала, как во внутренний, так и внешний монослой биологической мембраны. Одновременно с ОН-группы α-токоферола электрон в градиенте электрического поля транслоцируется по системе сопряженных двойных связей в толщу гидрофобной зоны мембраны и передается на окисленный остаток ретинола, восстанавливая его и возвращая в исходное состояние посредством геометрической изомеризации (рис. 5).
Ретинол при физиологических значениях парциального давления кислорода эффективно взаимодействует с синглетным кислородом, гидро-ксильными, пероксильными и супероксидными радикалами без образования реакционноспособного радикала, делокализуя неспаренный электрон в системе сопряженных двойных связей (Burton, Ingold, 1984; Iannone et al., 1998; van Lieshout et al., 2003; Rozanowska et al., 2005; Dao et al., 2017; Edge, Truscott, 2018). При этом скорость взаимодействия с пероксильным радикалом существенно превышает скорость взаимодействия последних с аллильным водородом полиненасыщенных жирных кислот (Rice-Evans et al., 1997). В результате количество молекул фосфолипидов, защищаемых от свободнорадикальной деградации ассоциацией “α‑токоферол–арахидоновая кислота–ретинола пальмитат” становится достаточно большим, то есть соответствующим соотношению витамин Е/фосфолипид 1 : 100–1 : 1000. Мы полагаем, представления о том, что антиоксидантные свойства витамина А реализуются при участии витамина Е и арахидоновой кислоты (остатка арахидоновой кислоты фосфолипида), снимают сомнения, существующие до настоящего времени (Pérez-Rodrigues, 2009; Dao et al., 2017; Ribeiro et al., 2018), относительно антиоксидантного потенциала ретинола и его участия в ингибировании неферментативного окисления липидов.
В окислительно-восстановительных реакциях нейтрализации свободных радикалов помимо электрона переносится и ион водорода (протон). Особенности трансфера протона в гидрофобной зоне биомембран обусловлены рядом обстоятельств:
– латеральная диффузия протонов по поверхности фосфолипидного бислоя (в плоскости раздела фаз липид/вода) осуществляется в 20 раз быстрее, чем диффузия через объем мембраны (Prats et al., 1987; Nguyen et al., 2018) и на значительные (100 мкм), в масштабе фосфолипидных молекул, расстояния (Antonenko, Pohl, 1998; Georgievskii et al., 2002; Serowy et al., 2003; Springer et al., 2011);
– проницаемость липидного бислоя мембран для протонов на несколько порядков выше (1 × 106), чем для других простых ионов и электронов (Gutknecht, 1987; Deamer, 1987; Campos, Kataky, 2012).
Поэтому, скорее всего, перенос протона сначала осуществляется посредством латеральной диффузии по границе раздела фаз липид/вода. В последующем, после достижения точки проекции прооксиданта на плоскость биомембраны – путем проникновения иона водорода (протона) непосредственно в толщу фосфолипидного бислоя к аниону свободного радикала по градиенту электрического поля.
Способность ретинола (каротиноидов) обеспечивать трансфер электронов по системе сопряженных двойных связей как полиена и выступать в роли субстрата неферментативного окисления может весьма негативно отразиться на процессах митохондриальной энергопродукции – вызвать деполяризацию внутренней митохондриальной мембраны. Для предупреждения диссипации мембранного потенциала во внутренней митохондриальной мембране локализован и функционирует энзим BCDO2 (бета-каротин-9',10'-диоксигеназa, ЕС 1.13.11.71), обеспечивающий окислительную деструкцию каротиноидов (Amengual et al., 2011; Lobo et al., 2012). Отсутствие ретинола во внутренней митохондриальной мембране компенсируется тем, что содержание витамина Е в них на порядок превышает уровень α‑токоферола в других клеточных мембранах (Evarts, Bieri, 1974; Buttriss, Diplock, 1988a,b; Pekiner, 2003).
Последнее можно рассматривать как косвенное указание на то, что ретинол существенным образом увеличивает антиоксидантный потенциал α-токоферола в других клеточных мембранах.
Участие кверцетина и L-аскорбиновой кислоты в реализации антиоксидантных эффектов α-токоферола. Антирадикальное действие α‑токоферола в фосфолипидных мембранах синергично усиливается флавоноидом кверцетином (Becker et al., 2007).
Формируя нековалентные ассоциации с полярными группами фосфолипидов и α‑токоферола, кверцетин локализуется в плоскости биомембран на границе раздела сред липид/вода (Oteiza et al., 2005; Košinova et al., 2012; Fabre et al., 2015). Учитывая, что редокс-потенциал кверцетина и α‑токоферола 330 мВ и 500 мВ соответственно (Buettner, 1993; Jovanovic et al., 1996), мы полагаем: синергизм взаимодействия, помимо способности кверцетина хелатировать ионы металлов переменной валентности (Leopoldini et al., 2006; Gholampour, Saki, 2019), стимулировать экспрессию антиоксидантных энзимов (Chen et al., 2017) и прямо восстанавливать свободные радикалы жирнокислотных остатков фосфолипидов (Belyakov et al., 1995; Wang et al., 2006; Ozgen et al., 2016), обусловлен, главным образом, его способностью восстанавливать окисленный α-токоферол. Кверцетин, выполняя роль проводника электронов и протонов с восстановленной L-аскорбиновой кислоты, ускоряет рециклирование витамина Е, что блокирует прооксидантные эффекты токоферильного радикала. Именно поэтому антиоксидантный потенциал данного флавоноида наиболее значимо проявляется в присутствии L-аскорбиновой кислоты (Askari et al., 2012; Ajibade et al., 2017).
ЗАКЛЮЧЕНИЕ
Гипотеза, как открытая проблема, предполагающая доказательство и претендующая на адекватное отражение объективной реальности, должна изначально отличаться такими качествами (Плужников и др., 2002), как: отсутствие внутренних противоречий, наличие гностического потенциала, обладание прогностической значимостью.
Относительно возможности привлечения положений гипотезы для понимания содержательной сущности известных феноменов, целесообразно указать на то, что представления об электростатическом характере взаимодействия антиоксидантов и прооксидантов в биологических мембранах удовлетворительно объясняют флип-флоп переход альфа-токоферола из одного монослоя фосфолипидных мембран в другой и его быстрого сближения с прооксидантами на дистанцию протекания окислительно-восстановительной реакции. А предположение о формировании тройственных комплексов α-токоферол–арахидоновая кислота–ретинола пальмитат объясняет природу синергизма действия липофильных витаминов-антиоксидантов и их способность обеспечивать защиту от свободнорадикальной деградации многих сотен молекул фосфолипидов.
Предлагаемая гипотеза механизмов реализации антиоксидантных эффектов альфа-токоферола позволяет сделать и некоторые прогнозные предположения:
– антиоксидантные эффекты α‑токоферола наиболее полно могут реализовываться только в условиях определенного молярного соотношения с другими неферментативными и ферментативными антиоксидантами;
– антиоксидантная эффективность α-токоферола in vivo, в процессе биологической эволюции отобранного в качестве основного гасителя свободнорадикальных реакций в фосфолипидных мембранах, вряд ли может быть превышена какими-либо синтетическими липофильными антиоксидантами.
Последнее не стоит воспринимать пессимистически – это лишь побудительный стимул для обоснования дизайна корректных рецептур и порядка назначения антиоксидантов в клинической практике.
Список литературы
Барабой В.А. Ретиноиды и рак // Научно-технический прогресс в медицине и биологии. Киев, 1985. С. 280–296.
Геннис Р. Биомембраны: молекулярная структура и функции. Пер. с англ. М.: Мир, 1997. 624 с.
Ерин А.Н., Спирин М.М., Табидзе Л.В., Каган В.Е. Образование комплексов α‑токоферола с жирными кислотами. Возможный механизм стабилизации мембран витамином Е // Биохимия. 1983. Т. 48. № 11. С. 1855–1861.
Ерин А.Н., Скрыпин В.И., Прилипко Л.Л., Каган В.Е. Образование комплексов токоферола с фосфатидной кислотой // Бюл. эксперим. биол. мед. 1985. Т. 100. № 8. С. 184–186.
Ерин А.Н., Скрыпин В.И., Прилипко Л.Л., Каган В.Е. Витамин Е: молекулярные механизмы действия в биологических мембранах // Кислородные радикалы в химии, биологии и медицине / Сб. тр. Рижск. мед. ин-та. Рига, 1988. С. 109–129.
Иванов И.И. Эстафетные механизмы в процессах перекисного окисления липидов в биологических мембранах // Успехи биол. химии. М.: Наука, 1984. Т. 25. С. 110–124.
Макарова Т.Б. Изучение молекулярных механизмов антиокислительного действия токоферола в мембранных системах: Дис. … канд. биол. наук. Москва: МГУ, 1985. 169 с.
Новикова П.Ю., Красильников П.М. Молекулярное моделирование реакционноспособной конфигурации окисленного липида и альфа-токоферола // Биофизика. 2009. Т. 54. № 4. С. 675–680.
Плужников Н.Н., Чепур С.В., Покровская Л.А. и др. Судорожный электрогенез: фундаментальные и прикладные проблемы // Актуальные проблемы и перспективы развития военной медицины. СПб, 2002. Т. 3. С. 197–217.
Рангелова Д.С., Желев Ж.А., Бакалова Р.А. и др. Межмембранный перенос и антиоксидантное действие альфа-токоферола в липосомах // Бюл. эксперим. биол. мед. 1990. Т. 109. № 1. С. 37–39.
Тюрин В.А., Каган В.Е., Сербинова Е.А. и др. Взаимодействие α‑токоферола с фосфолипидными липосомами: отсутствие трансмембранной подвижности // Бюл. эксперим. биол. мед. 1986. Т. 102. № 12. С. 689–692.
Тюрин В.А., Каган В.Е., Аврова М.П., Прозоровская М.Л. Асимметрия липидов и распределение α‑токоферола в наружном и внутреннем монослое бислойных липидных мембран // Бюл. эксперим. биол. мед. 1988. Т. 40. № 6. С. 667–669.
Тюрин В.А., Корольков С.Н., Каган В.Е. Трансмембранное распределение α-токоферола и асимметрия липидов в мембранах нервной ткани // Биохимия. 1989. Т. 54. № 6. С. 940–947.
Abe C., Uchida T., Ohta M. et al. Cytochrome P450-dependent metabolism of vitamin E isoforms is critical determinant of their tissue concentrations in rats // Lipids. 2007. V. 42. № 7. P. 637–645.
Aeschimann W., Staats S., Kammer S. et al. Self-assembled α‑tocopherol transfer protein nanoparticles promote vitamin E delivery across an endothelial barrier // Sci. Rep. 2017. V. 7. № 1. Art. 4970.
Ahsan H., Ahad A., Siddiqui W.A. A review of characterization of tocotrienols from plant oils and foods // J. Chem. Biol. 2015. V. 8. № 2. P. 45–59.
Ajibade T.O., Oyagbemi A.A., Omobowale T.O. et al. Quercetin and vitamin C mitigate cobalt chloride-induced hypertension through reduction in oxidative stress and nuclear factor kappa beta (NF-κB) expression in experimental rat model // Biol. Trace Elem. Res. 2017. V. 175. № 2. P. 347–359.
Amengual J., Lobo G.P., Golczak M. et al. A mitochondrial enzyme degrades carotenoids and protects against oxidative stress // FASEB J. 2011. V. 25. № 3. P. 948–959.
Antonenko Y.N., Pohl P. Coupling of proton source and sink via H+-migration along the membrane surface as revealed by double patch-clamp experiments // FEBS Lett. 1998. V. 429. № 2. P. 197–200.
Anwar K., Kayden H.J., Hussain M.M. Transport of vitamin E by differentiated Caco-2 cells // J. Lipid Res. 2006. V. 47. № 6. P. 1261–1273.
Anwar K., Igbal J., Hussain M.M. Mechanisms involved in vitamin E transport by primary enterocytes and in vivo absorption // J. Lipid Res. 2007. V. 48. № 9. P. 2028–2038.
Askari G., Ghiasvand R., Feizi A. et al. The effect of quercetin supplementation on selected markers of inflammation and oxidative stress // J. Res. Med. Sci. 2012. V. 17. № 7. P. 637–641.
Atkinson J., Epand R.F., Epand R.M. Tocopherols and tocotrienols in membranes: a critical review // Free Radic. Biol. Med. 2008. V. 44. № 5. P. 739–764.
Atkinson J., Harroun T., Wassall S.R. et al. The location and behavior of alpha-tocopherol in membranes // Mol. Nutr. Food Res. 2010. V. 54. № 5. P. 641–651.
Azzi A. Many tocopherols, one vitamin E // Mol. Aspects Med. 2018. V. 61. P. 92–103.
Azzi A., Gysin R., Kempna P. et al. The role of alpha-tocopherol in preventing disease: from epidemiology to molecular events // Mol. Aspects Med. 2003. V. 24. № 6. P. 325–336.
Azzi A., Gysin R., Kempna P. et al. Vitamin E mediates cell signaling and regulation of gene expression // Ann. N.-Y. Acad. Sci. 2004. V. 1031. № 1. P. 86–95.
Bakir T., Beker B.Y., Sonmezoglu I. et al. Antioxidant and prooxidant effects of α‑tocopherol in a linoleic acid-copper(II)-ascorbate system // Eur. J. Lipid Sci. Technol. 2013. V. 115. № 3. P. 372–376.
Ball G.F.M. Fat-soluble vitamin assays in food analysis: a comprehensive review. London: Elsevier Sci. Publ. Ltd., 1988. P. 34–50.
Bardowell S.A., Stec D.E., Parker R.S. Common variants of cytochrome P450 4F2 exhibit altered vitamin E-ω-hydroxylase specific activity // J. Nutr. 2010. V. 140. № 11. P. 1901–1906.
Becker E.M., Ntouma G.N., Skibsted L.H. Synergism and antagonism between quercetin and other chain-breaking antioxidants in lipid systems of increasing structural organization // Food Chem. 2007. V. 103. P. 1288–1296.
Belyakov V.A., Roginsky V.A., Bors W. Rate constants for the reaction of peroxyl free radical with flavonoids and related compounds as determined by the kinetic chemiluminescence method // J. Chem. Soc. Perkin Trans. 2. 1995. № 12. P. 2319–2326.
Ben-Shabat S., Kazdan Y., Beit-Yannai E., Sintov A.C. Use of alpha-tocopherol esters for topical vitamin E treatment: evaluation of their skin permeation and metabolism // J. Pharm. Pharmacol. 2013. V. 65. № 5. P. 652–658.
Blaner W.S. Vitamin E: the enigmatic one! // J. Lipid Res. 2013. V. 54. № 9. P. 2293–2294.
Boonnoy M., Karttunen M., Wong-Ekkabut J. Does α‑tocopherol flip-flop help to protect membranes against oxidation? // J. Phys. Chem. 2018. V. 122. № 45. P. 10362–10370.
Brigelius-Flohe R. Vitamin E: the shrew waiting to be tamed // Free Radic. Biol. Med. 2009. V. 46. № 5. P. 543–554.
Brigelius-Flohe R., Traber M.G. Vitamin E: function and metabolism // FASEB J. 1999. V. 13. № 10. P. 1145–1155.
Bowry V.W., Stocker R. Tocopherol-mediated peroxidation. The prooxidant effect of vitamin E on the radical-initiated oxidation of human low-density lipoprotein // J. Am. Chem. Soc. 1993. V. 115. № 14. P. 6029–6044.
Buettner G.R. The pecking order of free radicals and antioxidants: lipid peroxidation, alpha-tocopherol, and ascorbate // Arch. Biochem. Biophys. 1993. V. 300. № 2. P. 535–543.
Burton G.W., Ingold K.U. β-Carotene: an unusual type of lipid antioxidant // Science. 1984. V. 224. № 4649. P. 569–573.
Burton G.W., Joyce A., Ingold K.U. Is vitamin E only lipid-soluble, chain-breaking antioxidant in human blood plasma and erythrocyte membranes? // Arch. Biochem. Biophys. 1983. V. 221. № 1. P. 281–290.
Buttriss J.L., Diplock A.T. The alpha-tocopherol and phospholipid fatty acid content of rat liver subcellular membranes in vitamin E and selenium deficiency // Biochim. Biophys. Acta. 1988a. V. 963. № 1. P. 61–69.
Buttriss J.L., Diplock A.T. The relationship between α‑tocopherol and phospholipid fatty acids in rat liver subcellular membrane fractions // Biochim. Biophys. Acta. 1988b. V. 962. № 1. P. 81–90.
Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. Critical review of rate constants of hydrated electrons, hydrogen atoms and hydroxyl radicals (OH/O–) in aqueous solution // J. Phys. Chem. Ref. Data. 1988. V. 17. № 2. P. 513–886.
Campos R., Kataky R. Electron transport in supported and tethered lipid bilayers modified with bioelectroactive molecules // J. Phys. Chem. 2012. V. 116. № 13. P. 3909–3917.
Chen B.H., Park J.H., Ahn J.H. et al. Pretreated quercetin protects gerbil hippocampal CA1 pyramidal neurons from transient cerebral ischemic injury by increasing the expression of antioxidant enzymes // Neur. Regen. Res. 2017. V. 12. № 2. P. 220–227.
Choe E., Min D.B. Chemistry and reactions of reactive oxygen species in foods // Crit. Rev. Food Sci. Nutr. 2005. V. 46. № 1. P. 1–22.
Chow C.K., Draper H.H. Isolation of gamma-tocotrienol dimers from Hevea latex // Biochemistry. 1970. V. 9. № 2. P. 445–450.
Clarke M.W., Burnett J.R., Croft K.D. Vitamin E in human health and disease // Crit. Rev. Clin. Lab. Sci. 2008. V. 45. № 5. P. 417–450.
Colombo M.L. An update on vitamin E, tocopherol and tocotrienol – perspectives // Molecules. 2010. V. 15. № 4. P. 2103–2113.
Cooper A.D. Hepatic uptake of chylomicron remnants // J. Lipid. Res. 1997. V. 38. № 11. P. 2173–2192.
Dao D.Q., Ngo T.C., Thong N.M., Nam P.C. Is vitamin A an antioxidant or a pro-oxidant? // J. Phys. Chem. 2017. V. 121. № 40. P. 9348–9357.
De Luca L.M., Brugh M., Silverman-Jones C.S. Retinyl palmitate, retinyl phosphate, and dolichyl phosphate of postnuclear membrane fraction from hepatoma, host liver, and regenerating liver: marginal vitamin A status of hepatoma tissue // Cancer Res. 1984. V. 44. № 1. P. 224–232.
Deamer D.W. Proton permeation of lipid bilayers // J. Bioenerg. Biomembr. 1987. V. 19. № 5. P. 457–479.
Dersjant-Li Y., Peisker M. Utilization of stereoisomers from alpha-tocopherol in livestock animals // J. Anim. Physiol. Anim. Nutr. 2010. V. 94. № 4. P. 413–421.
Diplock A.T. The role of vitamin E in biological membranes // Ciba Found Symp. 1983. V. 101. P. 45–55.
Diplock A.T., Lucy J.A. The biochemical modes of action of vitamin E and selenium: a hypothesis // FEBS Lett. 1973. V. 29. № 3. P. 205–210.
Dobrucki R., Radomska A. Retinol palmitate as a model substance to test antioxidant properties in vitro on the example of captopril // Pharmazie. 2002. V. 57. № 9. P. 635–637.
Duncan K.R., Suzuki Y.J. Vitamin E nicotinate // Antioxidants. 2017. V. 6. № 1. Art. E20.
Dzbek J., Korzeniewski B. Control over contribution of the mitochondrial membrane potential (Δψ) and proton gradient (ΔpH) to the protonmotive force (Δp). In silico studies // J. Biol. Chem. 2008. V. 283. № 48. P. 33232–33239.
Edge R., Truscott T.G. Singlet oxygen and free radical reactions of retinoids and carotenoids – a review // Anti-oxidants. 2018. V. 7. № 1. Art. E5.
Emerson O.H., Emerson G.A., Mohammad A., Evans H.M. The chemistry of vitamin E: tocopherols from various sources // J. Biol. Chem. 1937. V. 122. № 1. P. 99–107.
Erin A.N., Skrypin W., Kagan V.E. Formation of alpha-tocopherol complexes with fatty acids. Nature of complexes // Biochim. Biophys. Acta. 1985. V. 815. № 2. P. 209–214.
Evans H.M. Invariable occurrence of male sterility with dietaries lacking fat soluble vitamin E // PNAS USA. 1925. V. 11 № 7. P. 373–377.
Evans H.M. The pioneer history of vitamin E // Vitam. Horm. 1962. V. 20. P. 379–387.
Evans H.M., Bishop K.S. On the existence of a hitherto unrecognized dietary factor essential for reproduction // Science. 1922. V. 56. № 1458. P. 650–651.
Evans H.M., Burr G.O. The anti-sterility vitamin fat soluble E // PNAS USA. 1925. V. 11. № 6. P. 334–341.
Evans H.M., Emerson O.H., Emerson G.A. The isolation from wheat germ oil of an alcohol, α tocopherol, having the properties of vitamin E // J. Biol. Chem. 1936. V. 113. № 1. P. 319–332.
Evarts R.P., Bieri J.G. Ratios of polyunsaturated fatty acids to alpha-tocopherol in tissues of rats fed corn or soybean oils // Lipids. 1974. V. 9. № 11. P. 860–864.
Fabre G., Bayach I., Berka K. et al. Synergism of antioxidant action of vitamins E, C and quercetin is related to formation of molecular associations in biomembranes // Chem. Commun. 2015. V. 51. № 36. P. 7713–7716.
Falk J., Munné-Bosch S. Tocochromanol functions in plant: antioxidation and beyond // J. Exp. Bot. 2010. V. 61. № 6. P. 1549–1566.
Fernholz E. On the constitution of α‑tocopherol // J. Am. Chem. Soc. 1938. V. 60. № 3. P. 700–705.
Galli F., Azzi A., Birringer M. et al. Vitamin E: emerging aspects and new directions // Free Radic. Biol. Med. 2017. V. 102. P. 16–36.
Gallo-Torres H.E. Obligatory role of bile for the intestinal absorption of vitamin E // Lipids. 1970. V. 5. P. 379–384.
Galmes S., Serra F., Palou A. Vitamin E metabolic effects and genetic variants: a challenge for precision nutrition in obesity and associated disturbances // Nutrients. 2018. V. 10. № 12. P. 1919.
Georgievskii Y., Medvedev E.S., Stuchebrukhov A.A. Proton transport via the membrane surface // Biophys. J. 2002. V. 82. № 6. P. 2833–2846.
Gholampour F., Saki N. Hepatic and renal protective effects of quercetin in ferrous sulfate induced toxicity // Gen. Physiol. Biophys. 2019. V. 38. № 1. P. 27–38.
Gianello R., Libinaki R., Azzi A. et al. Alpha-tocopheryl phosphate: a novel, natural form of vitamin E // Free Radic. Biol. Med. 2005. V. 39. № 7. P. 970–976.
Gohil K., Oommen S., Quach H.T. et al. Mice lacking alpha-tocopherol transfer protein gene have severe alpha-tocopherol deficiency in multiple regions of the central nervous system // Brain Res. 2008. V. 1201. P. 167–176.
Gruger E.H. Jr., Tappel A.L. Reactions of biological anti-oxidants. 3. Composition of biological membranes // Lipids. 1971. V. 6. № 2. P. 147–148.
Gutknecht J. Proton/hydroxide conductance and permeability through phospholipid bilayer membranes // PNAS USA. 1987. V. 84. № 18. P. 6443–6446.
Haila K. Effects of carotenoids and carotenoid-tocopherol interaction on lipid oxidation in vitro: Academic Dissertation. Helsinki: Univ. of Helsinki, 1999. 64 p.
Hammerling U. Retinol as electron carrier in redox signaling, a new frontier in vitamin A research // Hepatobil. Surg. Nutr. 2016. V. 5. № 1. P. 15–18.
Havel R.J. Receptor and non-receptor mediated uptake of chylomicron remnants by the liver // Atherosclerosis. 1998. V. 141(Suppl. 1). P. S1–S7.
Henn F.A., Thompson T.E. Synthetic lipid bilayer membrane // Annu. Rev. Biochem. 1969. V. 38. P. 241–262.
Hosomi A., Arita M., Sato Y. et al. Affinity for alpha-tocopherol transfer protein as a determinant of the biological activities of vitamin E analogs // FEBS Lett. 1997. V. 409. № 1. P. 105–108.
Hultin M., Savonen R., Chevreuil O., Olivercrona T. Chylomicron metabolism in rats: kinetic modeling indicates that the particles remain at endothelial sites for minutes // J. Lipid Res. 2013. V. 54. № 10. P. 2595–2605.
Hussain M.M. Intestinal lipid absorption and lipoprotein formation // Curr. Opin. Lipidol. 2014. V. 25. № 3. P. 200–206.
Iannone A., Rota C., Bergamini S. et al. Antioxidant activity of carotenoids: an electron-spin resonance study on beta-carotene and lutein interaction with free radicals generated in a chemical system // J. Biochem. Mol. Toxicol. 1988. V. 12. № 5. P. 299–304.
Jiang Q., Yin X., Lill M.A. et al. Long-chain carboxychromanols, metabolites of vitamin E, are potent inhibitors of cyclooxygenases // PNAS USA. 2008. V. 105. № 51. P. 20464–20469.
Jiang X.-C., Tall A.R., Qin S. et al. Phospholipid transfer protein deficiency protects circulating lipoproteins from oxidation due to the enhanced accumulation of vitamin E // J. Biol. Chem. 2002. V. 277. № 35. P. 31850–31856.
Jovanovic S.V., Steenken S., Hara Y., Simic M.G. Reduction potentials of flavonoid and model phenoxyl radicals. Which ring in flavonoids is responsible for antioxidant activity? // J. Chem. Soc. Perkin Trans. 1996. V. 2. № 11. P. 2497–2504.
Kaempf-Rotzoll D.E., Traber M.G., Arai H. Vitamin E and transfer proteins // Curr. Opin. Lipidol. 2003. V. 14. № 3. P. 249–254.
Kamal-Eldin A., Appelqvist L.A. The chemistry and antioxidant properties of tocopherols and tocotrienols // Lipids. 1996. V. 31. № 7. P. 671–701.
Karrer P., Fritzsche H., Ringer B.H., Salomon H. Synthese des α‑tocopherols // Helv. Chim. Acta. 1938. V. 21. № 1. P. 820–825.
Kensler T.W., Trush M.A. Inhibition of phorbol ester-stimulated chemiluminescence in human polymorphonuclear leukocytes by retinoic acid and 5,6-epoxyretinoic acid // Cancer Res. 1981. V. 41. № 1. P. 216–222.
Khadangi F., Azzi A. Vitamin E – the next 100 years // IUBMB Life. 2019. V. 71. № 4. P. 411–415.
Kim G.H., Kim J.E., Rhie S.J., Yoon S. The role of oxidative stress in neurodegenerative diseases // Exp. Neurobiol. 2015. V. 24. № 4. P. 325–340.
Kim N., Ripple M.O., Springett R. Measurement of the mitochondrial membrane potential and pH gradient from the redox poise of the hemes of bc1 complex // Biophys. J. 2012. V. 102. № 5. P. 1194–1203.
Kofler M., Sommer P.F., Bolliger H.R. et al. Physicochemical properties and assay of the tocopherols // Vitam. Horm. 1962. V. 20. P. 407–440.
Kombrust D.J., Mavis R.D. Relative susceptibility of microsomes from lung, heart, liver, brain and testes to lipid peroxidation: correlation with vitamin E content // Lipids. 1980. V. 15. № 5. P. 315–322.
Kontush A., Finckh B., Karten B. et al. Antioxidant and prooxidant activity of alpha-tocopherol in human plasma and low-density lipoprotein // J. Lipid Res. 1996. V. 37. № 7. P. 1436–1448.
Košinova P., Berka K., Wykes M. et al. Positioning of antioxidant quercetin and its metabolites in lipid bilayer membranes: implication for their lipid-peroxidation inhibition // J. Phys. Chem. 2012. V. 116. № 4. P. 1309–1318.
Krinsky N.I., Johnson E.J. Carotenoid actions and their relation to health and disease // Mol. Aspects Med. 2005. V. 26. № 6. P. 459–516.
Krumova K., Friedland S., Cosa G. How lipid unsaturation, peroxyl radical partitioning, and chromanol lipophilic tail affect the antioxidant activity of α-tocopherol: direct visualization via high-throughput fluorescence studies conducted with fluorogenic α‑tocopherol analogues // J. Am. Chem. Soc. 2012. V. 134. № 24. P. 10102–10113.
Lashkari S., Krogh Jensen S., Bernes G. Biodiscrimination of α‑tocopherol stereoisomers in plasma and tissues of lambs fed different proportions of all-rac-α‑tocopheryl acetate and RRR‑α‑tocopheryl acetate 1,2 // J. Anim. Sci. 2019. V. 97. №3. P. 1222–1233.
Lemaire-Ewing S., Desrumaux C., Neel D., Lagrost L. Vitamin E transport, membrane incorporation and cell metabolism: is alpha-tocopherol in lipid rafts an oar in the lifeboat? // Mol. Nutr. Food Res. 2010. V. 54. № 5. P. 631–640.
Leng X., Kinnun J.J., Marquardt D. et al. α‑Tocopherol is well designed to protect polyunsaturated phospholipids: MD simulations // Biophys. J. 2015. V. 109. № 8. P. 1608–1618.
Leng X., Zhu F., Wassall S.R. Vitamin E has reduced affinity for a polyunsaturated phospholipid: an umbrella sampling molecular dynamics simulations study // J. Phys. Chem. 2018. V. 122. № 35. P. 8351–8358.
Leopoldini M., Russo N., Chiodo S., Toscano M. Iron chelation by the powerful antioxidant flavonoid quercetin // J. Agric. Food Chem. 2006. V. 54. № 17. P. 6343–6351.
Lewis B.A., Engelman D.M. Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles // J. Mol. Biol. 1983. V. 166. № 2. P. 211–217.
Lobo G.P., Isken A., Hoff S. et al. BCDO2 acts as a carotenoid scavenger and gatekeeper for the mitochondrial apoptotic pathway // Development. 2012. V. 139. № 6. P. 2966–2977.
Lovander M.D., Lyon J.D., Parr D.L. et al. Critical review – electrochemical properties of 13 vitamins: a critical review and assessment // J. Electrochem. Soc. 2018. V. 165. № 2. P. G18–G49.
Lucy J.A. Functional and structural aspects of biological membranes: a suggested structural role for vitamin E in the control of membrane permeability and stability // Ann. N.-Y. Acad. Sci. 1972. V. 203. № 1. P. 4–11.
Marquardt D., Kučerka N., Katsaras J., Harroun T.A. α-Tocopherol’s location in membranes is not affected by their composition // Langmuir. 2015. V. 31. № 15. P. 4464–4472.
Mashaghi A., Partovi-Azar P., Jadidi T. et al. Hydration strongly affects the molecular and electronic structure of membrane phospholipids // J. Chem. Phys. 2012. V. 136. № 11. P. 114709.
Mead J.R., Irvine S.A., Ramji D.P. Lipoprotein lipase: structure, function, regulation, and role in disease // J. Mol. Med. 2002. V. 80. № 12. P. 753–769.
Meier R., Tomizaki T., Schulze-Briese C. et al. The molecular basis of vitamin E retention: structure of human alpha-tocopherol transfer protein // J. Mol. Biol. 2003. V. 331. № 3. P. 725–734.
Mène-Saffrané L. Vitamin E biosynthesis and its regulation in plants // Antioxidants. 2017. V. 7. № 1. https://doi.org/10.3390/antiox7010002
Mohn E.S., Kuchan M.J., Erdman J.W. et al. The subcellular distribution of alpha-tocopherol in the adult primate brain and its relationship with membrane arachidonic acid and its oxidation products // Antioxidants. 2017. V. 6. № 4. https://doi.org/10.3390/antiox6040097
Munné-Bosch S., Alegre L. The function of tocopherols and tocotrienols in plants // Crit. Rev. Plant Sci. 2002. V. 21. № 1. P. 31–57.
Mustacich D.J., Leonard S.W., Patel N.K., Traber M.G. Alpha-tocopherol beta-oxidation localized to rat liver mitochondria // Free Radic. Biol. Med. 2010. V. 48. № 1. P. 73–81.
Nakamura T., Horie T., Masugi F. Effect of d,l-alpha-tocopheryl esters on vitamin E-deficient rats // J. Nutr. Sci. Vitaminol. 1978. V. 24. № 5. P. 459–469.
Navarrete M., Rangel C., Corchado J.C., Espinosa-Garcia J. Trapping of the OH radical by α‑tocopherol: a theoretical study // J. Phys. Chem. 2005. V. 109. № 21. P. 4777–4784.
Nguyen T.H., Zhang C., Weichselbaum E. et al. Interfacial water molecules at biological membranes: structural features and role for lateral proton diffusion // PLoS One. 2018. V. 13. № 2. Art. 0193454.
Niki E. Role of vitamin E as a lipid-soluble peroxyl radical scavenger: in vitro and in vivo evidence // Free Radic. Biol. Med. 2014. V. 66. P. 3–12.
Niki E. Oxidant-specific biomarkers of oxidative stress. Association with atherosclerosis and implication for antioxidant effects // Free Radic. Biol. Med. 2018. V. 120. P. 425–440.
Olcott H.S., Emerson O.H. Antioxidants and the autoxidation of fats. IX. The antioxidant properties of the tocopherols // J. Am. Chem. Soc. 1937. V. 59. № 6. P. 1008–1009.
Ory D.S. Chylomicrons and lipoprotein lipase at the endothelial surface: bound and GAG-ged? // Cell. Metab. 2007. V. 5. № 4. P. 229–231.
Oteiza P.I., Erlejman A.G., Verstraeten S.V. et al. Flavonoid-membrane interactions: a protective role of flavonoids at the membrane surface? // Clin. Dev. Immunol. 2005. V. 12. № 1. P. 19–25.
Ozgen S., Kiline O.K., Selamoglu Z. Antioxidant activity of quercetin: a mechanistic review // Turkish J.A.F. Sci. Tech. 2016. V. 4. № 12. P. 1134–1138.
Palace V.P., Khaper N., Qin Q., Singal P.K. Antioxidant potentials of vitamin A and carotenoids and their relevance to heart disease // Free Radic. Biol. Med. 1999. V. 26. № 5–6. P. 746–761.
Panagabko C., Morley S., Hernandez M. et al. Ligand specificity in the CRAL-TRIO protein family // Biochemistry. 2003. V. 42. № 21. P. 6467–6474.
Parker R.S., Sontag T.J., Swanson J.E., McCormick C.C. Discovery, characterization, and significance of the cytochrome P450 omega-hydroxylase pathway of vitamin E // Ann. N.-Y. Acad. Sci. 2004. V. 1031. № 1. P. 13–21.
Pearce B.C., Parker R.A., Deason M.E. et al. Inhibitors of cholesterol biosynthesis. 2. Hypocholesterolemic and antioxidant activities of benzopyran and tetrahydronaphthalene analogues of the tocotrienols // J. Med. Chem. 1994. V. 37. № 4. P. 526–541.
Pekiner B.D. Vitamin E as antioxidant // J. Fac. Pharm. Ankara. 2003. V. 32. № 4. P. 243–267.
Pennock J.F., Hemming F.W., Kerr J.D. A reassessment of tocopherol in chemistry // Biochem. Biophys. Res. Commun. 1964. V. 17. № 5. P. 542–548.
Pérez -Rodrigues L. Carotenoids in evolutionary ecology: re-evaluating the antioxidant role // Bioassays. 2009. V. 31. № 10. P. 1116–1126.
Podda M., Weber C., Traber M.G., Packer L. Simultaneous determination of tissue tocopherols, tocotrienols, ubiquinols, and ubiquinones // J. Lipid. Res. 1996. V. 37. № 4. P. 893–901.
Prats M., Tocanne J.F., Teissie J. Lateral proton conduction at a lipid/water interface. Effect of lipid nature and ionic content of the aqueous phase // Eur. J. Biochem. 1987. V. 162. № 2. P. 379–385.
Qin S.S., Yu Z.W., Yu Y.X. Structural and kinetic properties of alpha-tocopherol in phospholipid bilayers, a molecular dynamics simulation study // J. Phys. Chem. 2009. V. 113. № 52. P. 16537–16546.
Qureshi A.A., Burger W.C., Peterson D.M., Elson C.E. The structure of an inhibitor of cholesterol biosynthesis isolated from barley // J. Biol. Chem. 1986. V. 261. № 23. P. 10544-10550.
Qureshi A.A., Qureshi N., Hasler-Rapacz J.O. et al. Dietary tocotrienols reduce concentrations of plasma cholesterol, apolipoprotein B, thromboxane B2, and platelet factor 4 in pigs with inherited hyperlipidemias // Am. J. Clin. Nutr. 1991. V. 53. № 4. P. 1042S–1046S.
Rawicz W., Olbrich K.C., McIntosh T. et al. Effect of chain length and unsaturation on elasticity of lipid bilayers // Biophys. J. 2000. V. 79. № 1. P. 328–339.
Reboul E. Vitamin E bioavailability: mechanisms of intestinal absorption in the spotlight // Antioxidants. 2017. V. 6. № 4. Art. 95.
Reboul E., Borel P. Proteins involved in uptake, intracellular transport and basolateral secretion of fat-soluble vitamins and carotenoids by mammalian enterocytes // Prog. Lipid Res. 2011. V. 50. № 4. P. 388–402.
Ribeiro D., Freitas M., Silva A.M.S. et al. Antioxidant and pro-oxidant activities of carotenoids and their oxidation products // Food Chem. Toxicol. 2018. V. 120. P. 681–699.
Rice-Evans C.A., Sampson J., Bramley P.M., Holloway D.E. Why do we expect carotenoids to be antioxidants in vivo? // Free Radic. Res. 1997. V. 26. № 4. P. 381–398.
Rimbach G., Minihane A.M., Majewicz J. et al. Regulation of cell signalling by vitamin E // Proc. Nutr. Soc. 2002. V. 61. № 4. P. 415–425.
Rozanowska M., Cantrell A., Edge R. et al. Pulse radiolysis study of the interaction of retinoids with peroxyl radicals // Free Radic. Biol. Med. 2005. V. 39. № 10. P. 1399–1405.
Schmölz L., Birringer M., Lorkowski S., Wallert M. Complexity of vitamin E metabolism // World J. Biol. Chem. 2016. V. 7. № 1. P. 14–43.
Schneider C. An update on products and mechanisms of lipid peroxidation // Mol. Nutr. Food Res. 2009. V. 53. № 3. P. 315–321.
Schubert M., Kluge S., Schmölz L. et al. Long-chain meta-bolites of vitamin E: metabolic activation as a general concept for lipid-soluble vitamins? // Antioxidants. V. 7. № 1. Art. 10.
Sen C.K., Khanna S., Roy S. Tocotrienols: vitamin E beyond tocopherols // Life Sci. 2006. V. 78. № 18. P. 2088–2098.
Senoo H., Kojima N., Sato M. Vitamin A-storing cells (stellate cells) // Vitam. Horm. 2007. V. 75. P. 131–159.
Serowy S., Saparov S.M., Antonenko Y.N. et al. Structural proton diffusion along lipid bilayers // Biophys. J. 2003. V. 84. № 2. P. 1031–1037.
Shahidi F., de Camargo A.C. Tocopherols and tocotrienols in common and emerging dietary sources: occurrence, applications, and health benefits // Int. J. Mol. Sci. 2016. V. 17. № 10. Art. E1745.
Sies H., Stahl W. Vitamins E and C, beta-carotene, and other carotenoids as antioxidants // Am. J. Clin. Nutr. 1995. V. 62. № 6. P. S1315–S1321.
Slavova-Kazakova A., Kancheva V.D. Synergism between DL-alpha-tocopherol and ascorbyl palmitate at various ratios in binary antioxidant composition // Rivista Italiana Della Sostanze Grasse. 2018. V. 95. № 2. P. 75–87.
Song B.L., DeBose-Boyd R.A. Insig-dependent ubiquitination and degradation of 30hydroxy-3-methylglutaryl coenzyme A reductase stimulated by delta- and gamma-tocotrienols // J. Biol. Chem. 2006. V. 281. № 35. P. 25054–25061.
Sontag T.J., Parker R.S. Cytochrome P450 ω-hydroxylase pathway of tocopherol catabolism: novel mechanism of regulation of vitamin E status // J. Biol. Chem. 2002. V. 277. № 28. P. 25290–25296.
Sontag T.J., Parker R.S. Influence of major structural features of tocopherols and tocotrienols on their omega-oxidation by tocopherol-omega-hydroxylase // J. Lipid Res. 2007. V. 48. № 5. P. 1090–1098.
Springer A., Hagen V., Cherepanov D.A. et al. Protons migrate along interfacial water without significant contributions from jumps between ionizable groups on the membrane surface // PNAS USA. 2011. V. 108. № 35. P. 14461–14466.
Steenken S., Neta P. One-electron redox potentials of phenols. Hydroxy- and aminophenils and related compounds of biological interest // J. Phys. Chem. 1982. V. 86. P. 3661–3667.
Stern M.H., Robeson C.D., Weisler L., Baxter J.G. δ-Tocopherol. I. Isolation from soybean oil and properties // J. Am. Chem. Soc. 1947. V. 69. № 4. P. 869–874.
Stevens H.C., Nichols J.W. The proton electrochemical gradient across the plasma membrane of yeast is necessary for phospholipid flip // J. Biol. Chem. 2007. V. 282. № 24. P. 17563–17567.
Stocker A., Azzi A. Tocopherol-binding proteins: their function and physiological significance // Antioxid. Redox Signal. 2000. V. 2. № 3. P. 397–404.
Sure B. Dietary requirements for reproduction. III. The existence of the reproductive dietary complex (vitamin E) in the ethereal extracts of yellow corn, wheat embryo, and hemp-seed // J. Biol. Chem. 1924. V. 62. № 2. P. 371–396.
Sussmann R.A.C., Angeli C.B., Peres V.J. et al. Intraerythrocytic stages of Plasmodium falciparum biosynthesize vitamin E // FEBS Lett. 2011. V. 585. Iss. 24. P. 3985–3991.
Sussmann R.A.C., Fotoran W.L., Kimura E.A., Katzin A.M. Plasmodium falciparum uses vitamin E to avoid oxidative stress // Parasit. Vectors. 2017. V. 10. № 1. Art. 461.
Takahashi M., Yoshikawa Y., Niki E. Oxidation of lipids. XVII. Crossover effect of tocopherols in the spontaneous oxidation of methyl linoleate // Bull. Chem. Soc. Jpn. 1989. V. 62. № 6. P. 1880-1884.
Tappel A.L. Vitamin E as the biological lipid antioxidant // Vitam. Horm. 1962. V. 20. P. 493–510.
Tappel A.L., Zalkin H. Inhibition of lipid peroxidation in microsomes by vitamin E // Nature. 1960. V. 185. № 4705. P. 35.
Terao J., Matsushita S. The peroxidizing effect of α‑tocopherol on autoxidation of methyl linoleate in bulk phase // Lipids. 1986. V. 21. № 4. P. 255–260.
Tesoriere L., Bongiorno A., Pintaudi A.N. et al. Synergistic interactions between vitamin A and vitamin E against lipid peroxidation in phosphatidylcholine liposomes // Arch. Biochem. Biophys. 1996. V. 326. № 1. P. 57–63.
Traber M.G. Mechanisms for the prevention of vitamin E excess // J. Lipid Res. 2013. V. 54. № 9. P. 2295–2306.
Uttara B., Singh A., Zamboni P., Mahajan R.T. Oxidative stress and neurodegenerative diseases: a review of upstream and downstream antioxidant therapeutic options // Curr. Neuropharmacol. 2009. V. 7. № 1. P. 65–74.
van Lieshout M., West C.E., van Breemen R.B. Isotopic tracer techniques for studying the bioavailability and bioefficacy of dietary carotenoids, particularly beta-carotene, in humans: a review // Am. J. Clin. Nutr. 2003. V. 77. № 1. P. 12–28.
Wallert M., Schmolz L., Galli F. et al. Regulatory metabolites of vitamin E and their putative relevance for atherogenesis // Redox Biol. 2014. V. 2. P. 495–503.
Wang L., Tu Y.C., Lian T.W. et al. Distinctive antioxidant and antiinflammatory effects of flavonoids // J. Agric. Food Chem. 2006. V. 54. № 26. P. 9798–9804.
Wang X., Quinn P.J. Vitamin E and its function in membranes // Prog. Lipid Res. 1999. V. 38. № 4. P. 309–336.
Weiser H., Vecchi M. Stereoisomers of alpha-tocopheryl acetate. II. Biopotencies of all eight stereoisomers, individually or in mixtures, as determined by rat resorption-gestation tests // Int. J. Vitam. Nutr. Res. 1982. V. 52. № 3. P. 351–370.
Weiser H., Riss G., Kormann A.W. Biodiscrimination of the eight alpha-tocopherol stereoisomers results in preferential accumulation of the four 2R forms in tissues and plasma of rats // J. Nutr. 1996. V. 126. № 10. P. 2539–2549.
Whittle K.J., Dunphy P.J., Pennock J.F. The isolation and properties of δ-tocotrienol from Hevea latex // Biochem. J. 1966. V. 100. № 1. P. 138–145.
Winterbourn C.C. Reconciling the chemistry and biology of reactive oxygen species // Nat. Chem. Biol. 2008. V. 4. № 5. P. 278–286.
Xiao C., Stahel P., Lewis G.F. Regulation of chylomicron secretion: focus on post-assembly mechanisms // Cell. Mol. Gastroenterol. Hepatol. 2019. V. 7. № 3. P. 487–501.
Yamanashi Y., Takada T., Kurauchi R. et al. Transporters for the absorption of cholesterol, vitamin E, and vitamin K // J. Atheroscler. Thromb. 2017. V. 24. № 4. P. 347–359.
Yazu K., Yamamoto Y., Niki E. et al. Migration of highly unsaturated fatty acid methyl ester peroxyl radicals from lipid core to aqueous surface lowers the oxidizability of highly unsaturated lipids in aqueous micelles // J. Jpn. Oil Chem. Soc. 2000. V. 49. № 6. P. 611–615.
Young A.J., Lowe G.M. Antioxidant and prooxidant properties of carotenoids // Arch. Biochem. Biophys. 2001. V. 385. № 1. P. 20–27.
Zielinska A., Nowak I. Tocopherols and tocotrienols as vitamin E // Chemik. 2014. V. 68. № 7. P. 585–591.
Zingg J.M. Water-soluble vitamin E – tocopheryl phosphate // Adv. Food Nutr. Res. 2018. V. 83. P. 311–363.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии