Успехи современной биологии, 2020, T. 140, № 3, стр. 253-262
Неортодоксальные феномены клинической иммунологии
А. М. Земсков 1, В. А. Земскова 1, В. М. Земсков 2, *
1 Воронежский государственный медицинский университет им. Н.Н. Бурденко
Воронеж, Россия
2 Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского
Москва, Россия
* E-mail: arturrego@yandex.ru
Поступила в редакцию 01.03.2020
После доработки 01.03.2020
Принята к публикации 01.03.2020
Аннотация
В результате проведения собственных исследований и анализа литературы установлены неортодоксальные феномены и сигнальные лабораторные маркеры альтернативного реагирования иммунной системы на патологию – специфичность и неспецифичность, стимуляция и супрессия, единство и вариабельность, региональность и системность, “дезинтеграция” и интеграция, модуляция и ассоциация, а также профильность иммунокоррекции.
ВВЕДЕНИЕ
Целью настоящей работы был анализ установленных в последнее время неортодоксальных феноменов клинической иммунологии (Хаитов и др., 2010; Хаитов, 2011; Земсков и др., 2013, 2017, 2018а,б; Черешнев, Шмагель, 2014; Иммунология, 2016; Zemskov, Zemskov, 2016; Zemskov et al., 2016, 2018).
ФЕНОМЕН ДИФФЕРЕНЦИРОВАННОГО ИММУННОГО РЕАГИРОВАНИЯ ПРИ ПАТОЛОГИЧЕСКИХ ПРОЦЕССАХ
Анализу подвергались результаты иммунолабораторного обследования 322 больных с верифицированным диагнозом бронхиальная астма: смешанная форма (сБА), экзогенная (экБА), эндогенная (энБА), бронхиальная астма средней тяжести и в стадии обострения. При поступлении в стационар у всех пациентов с помощью традиционных методов оценивали 9 рутинных иммунных и 9 гематологических тестов. Группой сравнения служили 20 здоровых разовых доноров аналогичного возраста (Земсков и др., 2017).
Полученные данные подвергали статистическому анализу. Расчет репрезентативности выборок осуществлялся по формуле Холодова–Яковлева; достоверность отличий от заданного уровня, нормальность, коэффициент вариации определяли с помощью известных критериев Стьюдента, Манна–Уитни, Колмогорова–Смирнова. Частотный анализ (ЧА) использовался для оценки риска формирования патологии заданного уровня в популяции больных, а анализ корреляционных связей (КС) – для характеристики напряжения в иммунной системе. Коэффициент диагностической ценности (Кj) выявлял ключевые параметры формул расстройств иммунной системы (ФРИС). Сравнительная оценка сгруппированных показателей реализовывалась ранговым методом со следующей трактовкой: изменения 1–33% – несущественный ранг, 34–66% – средний, >66% – значительный (Земсков и др., 2003, 2015).
Для формирования групп пациентов со “своеобразным” типом иммунного реагирования в общей популяции больных использовали несколько методических приемов.
На первом этапе осуществляли формирование групп, основываясь на патогенезе БА (смешанная, экзогенная, эндогенная формы).
На втором – с помощью частотного анализа производился отбор пациентов с сБА, показавших альтернативные достоверные изменения по маркерному тесту (повышенные или пониженные значения) с последующим дополнительным иммунолабораторным обследованием. В рангах оценивали отличия от нормы сгруппированных гематологических и иммунных показателей.
Третий этап проводился среди отобранных групп больных: 1 – определение параметров, достоверно отличающихся от нормы по средним абсолютным значениям (АЗ); 2 – выделение с помощью ЧА-тестов с запредельными (очень высокими или низкими) величинами; 3 – отбор ключевых показателей при совпадении двух видов анализа; 4 – составление слагаемых ФРИС с помощью Кj (например, ${\text{Л}}_{3}^{ + }{\text{Тх}}_{2}^{ - }{\text{Т}}_{2}^{ - }$ означает накопление лейкоцитов 3 степени и снижение содержания Т-хелперов и Т-клеток средней выраженности); 5 – отбор и анализ данных обследования групп больных, согласно ключевым маркерам.
Исходя из полученных данных, для сортировки пациентов на 10 отдельных групп были избраны следующие кластеры: 1) клинические формы БА (сБА, экБА, энБА); 2) критические значения вариаций 2–3 степени ключевых лабораторных маркеров – повышенная и пониженная СОЭ (>СОЭ, <СОЭ), моноцитоз (>М) и моноцитопения (<М), увеличение содержания лейкоцитов (>Л), дефицит Т-хелперов (<Тх) и Т-клеток (<Т). Поскольку в сформированных группах количество пациентов составляло от 30–83 до более 100 человек, эти выборки были высокорепрезентативными.
У объединенной группы больных сБА в остром периоде заболевания регистрировалось снижение содержания гемоглобина, эритроцитов, Т- и В-клеток, регуляторных Т-субпопуляций лимфоцитов на фоне накопления лейкоцитов, незрелых гранулоцитов, циркулирующих иммунных комплексов (ЦИК) и молекул средней массы (МСМ). При этом ЧА выявил достоверную стимуляцию 2–3-ей степени содержания Л, эозинофилов (Эф), палочкоядерных нейтрофилов (П), М, Т- и В-лимфоцитов, ЦИК со снижением у других больных уровней СОЭ, Эф, М, Т-клеток, Т-цитотоксических лимфоцитов (Тц) и Тх. Таким образом, по ряду тестов (СОЭ, ЭФ и М) у разных больных наблюдалась достоверная вероятность как увеличения, так и снижения этих параметров.
В табл. 1 приведены итоги использования 8 видов формализованной ранговой оценки вариаций слагаемых иммунолабораторного статуса десяти групп больных БА.
Таблица 1.
Лабораторные маркеры выраженности иммунных расстройств у больных бронхиальной астмой при формализованной оценке
| Показатели | Клинико-лабораторные маркеры БА | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| сБА | экБА | энБА | >Л | <Тх | <Т | >СОЭ | <СОЭ | >М | <М | |
| Средние АЗ | 2 | 1 | 2 | 2 | 2 | 2 | 3 | 2 | 2 | 2 |
| ЧА | 2 | 2 | 2 | 1 | 2 | 2 | 3 | 2 | 1 | 3 |
| КС | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 1 | 3 |
| Сгруппированные лабораторные показатели | ||||||||||
| Гематологические | 2 | 1 | 2 | 2 | 2 | 2 | 3 | 2 | 2 | 2 |
| Иммунные | 1 | 1 | 1 | 2 | 2 | 1 | 3 | 2 | 2 | 2 |
| Итоговый рейтинг отличий | ||||||||||
| Сумма рангов | 9/III | 7/I | 9/III | 9/III | 10/IV | 9/III | 14/VI | 10/IV | 8/II | 12/V |
| ФРИС | ${\text{Л}}_{2}^{ + }{\text{Тх}}_{2}^{ - }{\text{Т}}_{2}^{ - }$ | ${\text{Л}}_{3}^{ + }{\text{Тц}}_{2}^{ + }{\text{Тх}}_{2}^{ + }$ | ${\text{П}}_{3}^{ + }{\text{Т}}_{2}^{ - }{\text{Л}}_{2}^{ + }$ | ${\text{Л}}_{2}^{ + }{\text{МСМ}}_{2}^{ + }{\text{Тх}}_{2}^{ - }$ | ${\text{Тх}}_{2}^{ - }{\text{Т}}_{2}^{ - }{\text{В}}_{2}^{ - }$ | ${\text{Т}}_{2}^{ - }{\text{Тх}}_{2}^{ - }{\text{Тц}}_{2}^{ - }$ | ${\text{СОЭ}}_{3}^{ + }{\text{ЦИК}}_{2}^{ - }{\text{П}}_{2}^{ + }$ | ${\text{МСМ}}_{1}^{ + }{\text{СОЭ}}_{3}^{ - }{\text{П}}_{3}^{ + }$ | ${\text{М}}_{3}^{ + }{\text{МСМ}}_{1}^{ - }{\text{П}}_{3}^{ + }$ | ${\text{М}}_{2}^{ - }{\text{МСМ}}_{1}^{ - }{\text{Тх}}_{2}^{ + }{\text{В}}_{2}^{ - }$ |
| Распределение по звеньям иммунитета | ||||||||||
| Т : В : Н | 1 : 3 : 2 | 1 : 3 : 2 | 2 : 3 : 1 | 2 : 2 : 2 | 1 : 1 : 2 | 1 : 3 : 3 | 3 : 2 : 1 | 3 : 2 : 1 | 3 : 2 : 1 | 2 : 2 : 2 |
Математический анализ полученных данных показал: если обобщенные лабораторные показатели, в основном, демонстрировали непараметрическое распределение с предельным уровнем вариаций параметров, то в группах, отобранных согласно патогенезу и маркерным лабораторным показателям, нормальность оказалась близкой к 100%, а вариации существенно сниженными, что свидетельствует о повышении однородности популяций больных БА в группах относительно объединенной популяции.
Из табл. 1 следует, что вариации лабораторных параметров существенно зависели от наличия у пациентов сигнальных лабораторных маркеров. Например, согласно снижающейся ранговой оценке, достоверные итоговые изменения лабораторных показателей были обнаружены в следующей последовательности: экБА → >М → сБА, энБА, >Л, <Т → <Тх, <СОЭ → <М → >СОЭ.
Столь же дифференцированными оказались и панели ключевых параметров иммунных расстройств в ФРИС: сБА = ${\text{Л}}_{2}^{ + }{\text{Тх}}_{2}^{ - }{\text{Т}}_{2}^{ - }$; экБА = ${\text{Л}}_{3}^{ + }{\text{Тц}}_{2}^{ + }{\text{Тх}}_{2}^{ + }$; энБА = = ${\text{П}}_{3}^{ + }{\text{Т}}_{2}^{ - }{\text{Л}}_{2}^{ + }$; >Л = ${\text{Л}}_{2}^{ + }{\text{МСМ}}_{2}^{ + }{\text{Тх}}_{2}^{ - }$; <Тх = ${\text{Тх}}_{2}^{ - }{\text{Т}}_{2}^{ - }{\text{В}}_{2}^{ - }$; <Т = ${\text{Т}}_{2}^{ - }{\text{Тх}}_{2}^{ - }{\text{Тц}}_{2}^{ - }$; >СОЭ = ${\text{СОЭ}}_{3}^{ + }{\text{ЦИК}}_{2}^{ - }{\text{П}}_{2}^{ + }$; <СОЭ = = ${\text{МСМ}}_{1}^{ + }{\text{СОЭ}}_{3}^{ - }{\text{П}}_{3}^{ + }$; >М = ${\text{М}}_{3}^{ + }{\text{МСМ}}_{1}^{ - }{\text{П}}_{3}^{ + }$; <М = = ${\text{М}}_{2}^{ - }{\text{Тх}}_{2}^{ + }{\text{В}}_{2}^{ - }$. Расшифровка формул показывает, что у пациентов с сБА отмечалась средней выраженности стимуляция числа лейкоцитов на фоне дефицита Т-клеток и Тх; при экБА – рост уровня лейкоцитов, Тц и Тх; при энБА – накопление палочкоядерных клеток и лейкоцитов и недостаточность Т-лимфоцитов. У больных с лейкоцитозом, кроме роста количества лейкоцитов, наблюдалось увеличение иммуноактивных МСМ и уменьшение Т-хелперов, а у пациентов со снижением Тх – недостаточность основных субпопуляций Т-лимфоцитов. При дефиците Т-лимфоцитов отмечалось также падение уровня ключевых субпопуляций B-клеток. Возрастание СОЭ сопровождалось уменьшением образования ЦИК и стимуляцией уровня палочкоядерных гранулоцитов, тогда как при снижении этого показателя развивалось повышение МСМ и палочек. Моноцитоз ассоциировался с повышением палочкоядерных гранулоцитов – показателей активации костного мозга – и небольшим снижением агрессивных МСМ. С другой стороны, моноцитопения была связана с подавлением накопления МСМ и В-лимфоцитов наряду с возрастанием Т-хелперов. Однако при сопоставлении порядка расположения опорных показателей в формулах, векторов и степени изменений случаев повторов в составе ФРИС не было. Анализ распределения ключевых параметров ФРИС по основным звеньям иммунитета Т : В : Н выявил его значительную вариабельность у больных из разных групп. Так, у пациентов с сБА соотношение составило 1 : 3 : 2; энБА – 2 : 3 : 1; >Л – 2 : 2 : 2; <Тх – 1 : 1 : 2; <Т – 1 : 3 : 3; >СОЭ – 3 : 2 : 1 и др. Эти данные свидетельствуют, что точечный механизм иммунопатологии при БА зависит от клинических форм и лабораторных маркеров.
Таким образом, в рандомизированной группе больных с БА обнаружены 10 подгрупп, с различной выраженностью и характером иммуногематологических изменений. Сигнальными маркерами этих особенностей являются патогенез заболевания, критические значения уровня лейкоцитов, Т-клеток, Т-хелперов, СОЭ и моноцитов. Обнаруженные закономерности свидетельствуют о вероятности вариабельной реакции иммунного гомеостаза на патологический процесс, что имеет теоретическое и практическое значение, поскольку позволяет, с одной стороны, уточнить патогенез заболевания, с другой – выявить группы риска, с третьей – модифицировать проводимое лечение. В принципе, такие же данные были получены при обследовании лиц с рассеянным склерозом, церебро-сосудистыми и некоторыми вирусными заболеваниями (Земсков и др., 2003, 2013, 2017, 2018б; Луцкий и др., 2016).
ФЕНОМЕН ВЛИЯНИЯ ПАТОГЕНЕЗА ЗАБОЛЕВАНИЙ НА ИММУНОПАТОЛОГИЮ И ЕЕ КОРРЕКЦИЮ
Под наблюдением находилось 120 больных с гнойно-воспалительными заболеваниями (ГВЗ) различного генеза: обострение глубокой пиодермии (ОГП), обострение хронического пиелонефрита (ОХПН) и обострение сальпингоофорита (ОХСО).
У всех пациентов до и после традиционного лечения с модулятором галавитом определяли рутинные гематологические маркеры воспаления, иммунные показатели, метаболические параметры свободно-радикального окисления (СРО) липидов и белков, антиоксидантной системы (АОС), специфические для конкретных заболеваний бактериологические и клинические показатели. Полученные клинико-лабораторные показатели группировали с определением степени вариаций, формализовали в виде формул гематологических (ФГР), иммунных (ФРИС), метаболических (ФМР) расстройств, мишеней лечения с галавитом (ФМИ) и одного модулятора (ФМИсоб) независимо от традиционного лечения. Ранговым методом (табл. 2 и 3) оценивали эффективность комплексной терапии больных (Земсков и др., 2013, 2017).
Таблица 2.
Влияние патогенеза ГВЗ на формализованную оценку иммунолабораторных показателей больных в остром периоде ГВЗ
| Заболевания | Ключевые параметры | Сумма рангов/отличия |
|||
|---|---|---|---|---|---|
| сгруппированные показатели |
ФГР | ФРИС | ФМР | ||
| ОГП | ${\text{Г}}_{2}^{{\text{н}}}{\text{И}}_{2}^{{\text{н}}}{\text{М}}_{2}^{{\text{н}}}$ | ${\text{Л}}_{3}^{ + }{\text{Н}}_{3}^{ + }{\text{Лф}}_{2}^{ - }$ | ${\text{CD95Лф}}_{3}^{ + }{\text{НКц}}_{3}^{ + }{\text{ИЛ - 6}}_{3}^{ + }$ | ${\text{ОШ}}_{2}^{ + }{\text{ОАА}}_{2}^{ - }{\text{ВЕ}}_{3}^{ + }$ | 6/III |
| ОХПН | ${\text{Г}}_{1}^{{\text{н}}}{\text{И}}_{1}^{{\text{н}}}{\text{М}}_{1}^{{\text{н}}}$ | ${\text{Л}}_{3}^{ + }{\text{Н}}_{3}^{ + }{\text{Лф}}_{2}^{ - }$ | ${\text{В}}_{3}^{ + }{\text{МСМ}}_{2}^{ + }{\text{Тц}}_{3}^{ + }$ | ${\text{ВЕ}}_{2}^{ + }{\text{ОАА}}_{2}^{ - }{\text{СОД}}_{2}^{ - }$ | 3/I |
| ОХСО | ${\text{Г}}_{1}^{{\text{н}}}{\text{И}}_{2}^{{\text{н}}}{\text{М}}_{1}^{{\text{н}}}$ | ${\text{Л}}_{2}^{ + }{\text{Н}}_{2}^{ + }{\text{М}}_{2}^{ + }$ | ${\text{ФНО}}_{3}^{ + }{\text{IgG}}_{3}^{ + }{\text{T}}_{2}^{ - }$ | ${\text{ОАА}}_{3}^{ - }{\text{ВЕ}}_{3}^{ + }{\text{СОД}}_{2}^{ - }$ | 4/II |
Примечание: Г, И, М – сгруппированные гематологические, иммунные, метаболические показатели; 1,2,3 – ранги отличий от нормы (1 – > 66%, 2 – 33–66%, 3 – < 33% параметров); вектор +/– и степень 1,2,3 изменений ключевых тестов; I–II–III – значительные, средние, несущественные итоговые отличия; Н – нейтрофилы, Лф – лимфоциты, НКц – цитотоксические НК-клетки, ФНО – фактор некроза опухоли, ОШ – основания Шиффа, ВЕ – витамин Е, СОД – супероксиддисмутаза, ОАА – общая антиокислительная активность плазмы. ФГР – формула гематологических, ФРИС – иммунных, ФМР – метаболических расстройств.
Таблица 3.
Влияние патогенеза ГВЗ на эффекты иммунокорректора галавита
| Заболевания | Сгруппированные показатели |
ФМИ | ФМИсоб | Сумма рангов/отличия |
|---|---|---|---|---|
| ОГП | ${\text{Г}}_{1}^{1}{\text{И}}_{1}^{3}{\text{Б}}_{1}^{1}{\text{К}}_{1}^{1}$ | ${\text{ИЛ - 4}}_{3}^{ + }{\text{ФНО}}_{3}^{ - }{\text{CD95Лф}}_{3}^{ + }$ | ${\text{ФНО}}_{3}^{ - }{\text{CD95IgM}}_{2}^{ + }$ | 10/I |
| ОХПН | ${\text{Г}}_{1}^{1}{\text{И}}_{2}^{1}{\text{Б}}_{1}^{2}{\text{К}}_{2}^{1}$ | ${\text{ФП}}_{3}^{ + }{\text{ИЛ - 4}}_{3}^{ + }{\text{Тр}}_{3}^{ + }$ | ${\text{ИЛ - 4}}_{2}^{ + }{\text{ФП}}_{3}^{ + }{\text{Тр}}_{3}^{ + }$ | 11/II |
| ОХСО | ${\text{Г}}_{3}^{1}{\text{И}}_{1}^{3}{\text{Б}}_{1}^{2}{\text{К}}_{1}^{1}$ | ${\text{ФЧ}}_{3}^{ + }{\text{ИЛ - 4}}_{3}^{ + }{\text{НКт}}_{3}^{ + }$ | ${\text{НКт}}_{3}^{ + }{\text{ЦИК}}_{3}^{ - }{\text{IgM}}_{3}^{ - }$ | 13/III |
Результаты табл. 2 свидетельствуют, что все 3 варианта ГВЗ индуцируют универсальную реакцию накопления гематологических маркеров воспаления на фоне лимфопении у ОГП и у ОХПН и моноцитоза у ОХСО. Качественные ключевые вариации иммунной системы оказались дифференцированными. Так, при ОГП обнаружен дисбаланс цитокинов, на фоне накопления клеток с маркером апопотоза, при ОХПН – активация В-зависимых параметров и Т-цитотоксических лимфоцитов, а при ОХСО – повышение образования ФНО и IgG с уменьшением уровня Т-клеток. Сигнальные метаболические изменения выражались в дисбалансе неферментативных и снижении ферментативных механизмов АОС, либо в общей диспропорции и несостоятельности всех слагаемых АОС. Итоговая выраженность патологии по рангам оказалась максимальной при ОХПН, средней – при ОХСО и менее выраженной – при ОГП.
Данные табл. 3 свидетельствуют, что максимальная количественная клинико-лабораторная эффективность галавита была показана у пациентов с ОГП, далее – ОХПН и затем – ОХСО. Качественные механизмы комбинации традиционного лечения с модулятором (ФМИ) у пациентов с разными ГВЗ оказались дифференцированными по двум–трем слагаемым из трех. При этом расчетная собственная активность галавита (ФМИсоб) оказалась персонифицированной у пациентов в зависимости от генеза патологического процесса. Так, при ОГП препарат преимущественно влиял на провоспалительный цитокин ФНО, CD95-лимфоциты и IgM. Тогда как при ОХПН – на противовоспалительный ИЛ-4, фагоцитарный показатель (ФП) и Т-регуляторы (Тр), а при ОХСО – на тимусзависимые натуральные киллеры (НКт), ЦИК и IgM.
ФЕНОМЕН “ПАУТИНЫ” ИММУННОГО РЕАГИРОВАНИЯ
Имеющиеся данные свидетельствуют о принципе многокомпонентности реагирования иммунной системы на любые индукторы. Одним из маркеров этой закономерности является число сильных связей иммунолабораторных параметров пациента (коэффициент корреляции больше 0.6). Из литературы известно, что развитие патологии уменьшает, а ремиссия и проведение адекватного лечения, наоборот, увеличивают число коррелятивных связей между показателями иммунной системы (Земсков и др., 2013, 2017, 2018а,б).
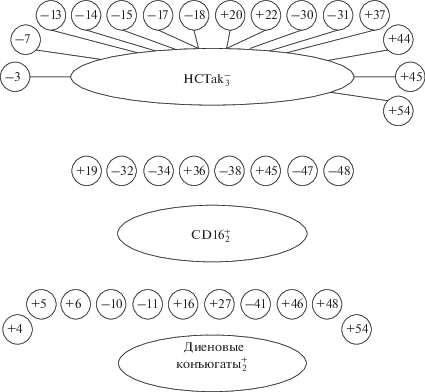
Как следует из рис. 1 и 2, у здоровых людей напряжение в иммунной системе, определяемое по числу ассоциаций сигнальных параметров ФРИС с другими гематоиммунными тестами, составляет 53, у больных с гипертоническим кризом значительно меньше – 35. Что же касается качественных характеристик феномена, то он включает широчайший спектр иммунобиохимических показателей.
Таким образом, реакция иммунной системы на раздражение является комплексной и возникает по принципу паутины, когда воздействие на один параметр обусловливает модификацию всей структуры ассоциаций в целом.
Рис. 1.
Корреляционные связи параметров у здоровых лиц. Обозначения (здесь и на рис. 2): 1 – эритроциты, 3 – Л, 4 – Эф, 5, 6 – палочко- и сегментоядерные нейтрофилы, 7 – Лф, 8 – М, 9 – СОЭ, 10 – CD3+, 11 – CD4+, 12 – CD8+, 13 – CD16+, 14 – CD19+, 15 – IgG, 16 – IgM, 17 – IgA, 18 – ЦИК, 19 – CD11b+, 20 – ФП, 22 – НСТсп (спонтанное восстановление нитросинего тетразолия), 23 – НСТак (стимулированное восстановление НСТ), 25 – ИЛ-8, 27 – АСАТ (аспартатаминотрансфераза), 29 – общий билирубин, 30 – мочевина, 31 – холестерин, 32 – липопротеиды, 33 – амилаза крови, 34 – общий белок, 35 – малоновый диальдегид, 36 – диеновые конъюгаты, 37 – кетодины, 38 – ОШ, 39 – ВЕ, 40 – общие тиолы, 41 – небелковые тиолы, 43 – восстановленный глутатион, 44 – ОАА, 45 – арабиноза, 46 – СОД, 47 –каталаза, 48 –пероксидаза, 50 –глутатионпероксидаза, 51 –глутатионредуктаза, 52 – перекисная резистентность эритроцитов, 53 – метаболиты оксида азота, 54 – кольцевые остатки аминокислот, 55 – битирозиновые сшивки, +/– – положительная и отрицательная корреляция показателей.

ФЕНОМЕН СОХРАНЕНИЯ ПРОФИЛЬНОСТИ МОДУЛЯЦИИ
Этот феномен сохраняется при стандартной патологии иммунного статуса при различных заболеваниях (Земсков и др., 1999, 2003, 2008). В специальном исследовании изучали влияние нуклеината натрия (натриевая соль дрожжевой низкомолекулярной РНК) на исходное снижение маркерного показателя – количества Т-лимфоцитов у пациентов, страдающих различными заболеваниями и имеющих вторую–третью степень исходного снижения сигнального параметра.
Как следует из данных рис. 3, во всех случаях (14 нозоформ и более 300 больных) нуклеинат натрия достоверно стимулировал существенно сниженное количество общих CD3+-лимфоцитов.
Рис. 3.
Позитивная динамика количества Т-клеток после приема нуклеината натрия у больных с исходным дефицитом этого показателя: 1 – ревматоидный артрит; 2 – ревматизм; 3 – бронхиальная астма; 4 – хронический бронхит; 5 – затяжная пневмония; 6 – язва желудка; 7 – язва двенадцатиперстной кишки; 8 – циррозы печени; 9 – пиелонефрит; 10 – дизентерия; 11 – сифилис; 12 – глаукома; 13 – секреторный средний отит; 14 – гнойная инфекция мягких тканей. Отличия показателей достоверны (р < 0.05).

ФЕНОМЕН ИММУНОМОДУЛЯЦИИ
Одним из постулатов клинической иммунологии является наличие у иммунокорректоров неких фиксированных паспортных характеристик (Иммунотерапия, 2012, 2018; Новиков, Новиков, 2009), однако научные данные последних лет не подтверждают эту закономерность.
Под модуляцией понимают нормализацию функции иммунной системы через стимуляцию сниженных и супрессию завышенных ее параметров. В принципе, этот феномен воспроизводит закон Вильдера. Сложилось так, что он, в основном, принимается на веру, то есть является аксиомой. Для его доказательства было проведено обследование 200 больных, страдающих заболеваниями различного генеза, разделенных на 8 рандомизированных групп, получающих традиционное для каждой нозоформы лечение и его комбинацию с модулятором тимогеном. До и после лечения у пациентов определяли от 26 до 32 показателей иммунного статуса, характеризующих его основные звенья, гематологические и иные маркеры. Количественный критерий оценки – расчет процента достоверно сниженных и отдельно увеличенных параметров относительно уровня нормы до лечения или относительно исходных значений после терапии. Итоговую эффективность воздействий характеризовали разницей стимулированных (+) или подавленных (–) лабораторных показателей у больных до и после лечения (Земсков и др., 2013, 2017, 2018а,б).
Под наблюдением находилось 8 групп пациентов, страдающих облитерирующим атеросклерозом (ОА), тромбангиитом (ТА), гиподермальным и дермальным ангиитами (ГА, ДА) по 25 человек в каждой (Земсков и др., 1999, 2003, 2008, 2017).
Как следует из данных табл. 4, у больных с преобладанием исходного снижения (–) иммунологических показателей (ОА – 19% и ТА – 28%) наблюдалась достоверная стимуляция (+) от исходного уровня количества параметров под влиянием Ти (21 и 21% соответственно). У страдающих ГА и ДА с альтернативной тенденцией – преимущественной активацией (+) исходной реактивности (ГА – 30% и ДА – 17%) – вектор действия тимогена оказался отрицательным (19 и 19% соответственно). Складывается впечатление, что вектор эффекта иммуномодуляции напрямую зависит от изменений исходного иммунного статуса больных.
ФЕНОМЕН МАЯТНИКА
Это соотношение стимуляции и супрессии иммунных реакций в процессе лечения заболеваний. Известно, что биологические процессы подвержены определенной вариабельности, имеющей физиологическую и патологическую направленность. Мы постулируем, что изменения на 33% (III ранг) в пределах достоверной стимуляции/супрессии величин изученных параметров являются физиологическими, несущественными (р > 0.05), средними (II ранг) – 33–66% или значимыми (I ранг) – > 66% (р < 0.05 в обоих случаях). Отсутствие колебаний в живой системе исключается (Земсков и др., 2017, 2018б).
Под наблюдением находилось более 250 лиц, страдающих ГВЗ и НВЗЛ (неспецифические воспалительные заболевания легких). Все больные получали традиционное для каждого заболевания лечение либо его комбинацию с модулятором галавитом при ГВЗ или тимогеном – при НВЗЛ. До начала лечения и через 2–3 нед. после начала все пациенты подвергались стандартному гематоиммунологическому обследованию. Для интерпретации вариаций показателей использовались методы формализованной математической оценки. Для этого лабораторные показатели пациентов группировали по пяти основным звеньям иммунитета – рутинному гематологическому (Л, Лф, зрелые и незрелые гранулоциты, М, СОЭ), клеточному (Т-клетки, натуральные киллеры, их субпопуляции), гуморальному (В-лимфоциты, Ig разных классов, МСМ, ЦИК), фагоцитарному (клетки с рецепторами адгезии, поглотительная и метаболическая способность нейтрофилов), цитокиновому (про- и противовоспалительные цитокины) и оценивали их ранговым методом (Иммунные расстройства…, 2007; Земсков и др., 2017).
Данные табл. 5 показывают, что при ГВЗ и НВЗЛ тесты, сгруппированные по 5 звеньям иммунитета, до лечения были достоверно изменены от нормативного уровня здоровых лиц с преобладанием стимулирующего вектора над супрессорным.
Таблица 5.
Вектор преимущественных вариаций сгруппированных показателей после моноиммунотерапии больных с ГВЗ и НВЗЛ в ранговой оценке
| Звенья иммунитета | Ранги отличий | |||||
|---|---|---|---|---|---|---|
| общая | стимуляция | супрессия | общая | стимуляция | супрессия | |
| ГВЗ | НВЗЛ | |||||
| Сумма показателей | II/II/III | II/II/II | III /III/III | I/II/III | II/II/II | II/III/III |
| Гематологические | I/II/III | I/II/III | III/III/III | II/II/III | II/II/II | III/III/III |
| Клеточные | II/II/II | III/II/II | II/III/III | I/II/II | II/II/II | II/II/III |
| Гуморальные | I/II/II | I/I/II | III/III/III | I/II/II | II/I/I | III/III/III |
| Фагоцитарные | II/II/II | III/II/III | II/III/III | I/II/II | III/III/III | II/II/II |
| Цитокиновые | II/II/II | III/II/III | III /III/III | I/III/III | II/II/III | III/III/III |
Примечание: I – значительные изменения > 66% показателей (р < 0.05); II – средние изменения 33–66% показателей (р < 0.05); III – несущественные – < 33% показателей (р > 0.05); исходные данные до традиционного лечения и данные после традиционного лечения + галавит у больных с ГВЗ или в группе НВЗЛ после традиционного лечения + тимоген).
При детальном анализе у больных с ГВЗ гематологические маркеры воспаления и показатели гуморальной защиты существенно повышались (I), тогда как клеточные и фагоцитарные показатели снижались до меньшего (II), но достоверного уровня от нормативных значений. При НВЗЛ все сгруппированные по звеньям лабораторные параметры были активированы до среднего достоверного уровня, тогда как фагоцитарные и клеточные, наоборот, подавлены. При этом стимулирующий потенциал в целом при заболеваниях легких был предпочтительно высоким, а вариации Т-зависимых параметров оказывались разнонаправленными.
Таким образом, в острой стадии ГВЗ различного генеза было установлено формирование разнонаправленных относительно стимуляции/супрессии и сгруппированных по звеньям иммунитета лабораторных показателей. В стадии ремиссии заболеваний, после проведения базового лечения, полностью устранилась супрессорная и сохранилась достоверная стимулирующая динамика всех пяти звеньев иммунитета. Дополнительное назначение больным корректора галавита обусловило нормализацию гематологических, фагоцитарных и цитокиновых маркеров, но не иммунных клеточных и гуморальных показателей.
У пациентов с НВЗЛ в стадии ремиссии практически сохранился исходный характер иммунопатологии – активация гематологических, иммунных клеточных, гуморальных и цитокиновых маркеров и в то же время подавление Т-зависимых и фагоцитарных маркеров. Тимоген на данной клинической модели проявил иммуномодулирующие свойства – снизил накопление гематологических, иммунных клеточных и цитокиновых параметров и одновременно устранил торможение Т-зависимого и фагоцитарного звеньев иммунитета.
ФЕНОМЕН АЛЬТЕРНАТИВНОСТИ ИММУННОГО РЕАГИРОВАНИЯ
Специфичность и неспецифичность иммунного реагирования
Иммунные реакции всегда конкретны, но при этом подвержены неспецифической регуляции. К регуляторным факторам относят тимусные, миелопептидные, интерлейкиновые и интерфероновые. К ним же принадлежат эндогенные гормоны, протеолитические и гликолитические ферменты, система комплемента, продукты катаболического разрушения иммунных глобулинов F(ab)2 и Fc-фрагменты, модулирующие иммунный ответ, а также альбуминовый фактор печени, временно инактивирующий аффинную специфичность IgM (Земсков и др., 2017, 2018а,б).
Стимуляция и супрессия иммунного реагирования
Эти состояния изучены при комплексном лабораторном обследовании более 200 пациентов со сложным патогенезом заболеваний, к которым относятся рассеянный склероз в стадии обострения и ремиссии, 8 видов церебро-васкулярных заболеваний, вирусный гепатит В, также среди пациентов были носители HbsAg (австралийского антигена) (Земсков и др.., 2008, 2018а). У пациентов с рассеянным склерозом в стадии обострения установлено, что 70% иммунных показателей были достоверно повышены, а 30% находились в пределах физиологической нормы. В стадии стабилизации эта динамика оказалась 50 на 50%. При всех других нозоформах количество увеличенных параметров составило 25–62%, а сниженных 19–62%. В целом доминирование активированных иммунных параметров было превалирующим. Лишь у носителей HbsAg преимущество было за иммуносупрессией (69 на 39%).
ЕДИНСТВО И ВАРИАБЕЛЬНОСТЬ ИММУННОГО РЕАГИРОВАНИЯ
Доказательством функционального единства и вариабельности регулирующих систем организма является феномен анафилактического шока, который индуцируется реакцией иммунной системы на аллерген, обусловливающий выброс биогенных аминов, изменение эндокринологического статуса и поведенческих реакций нервной системы (Калинина и др., 2008; Новиков Д. , Новиков П., 2009; Хаитов и др., 2009; Хаитов, 2011; Покровский и др., 2013).
Иммунокомпетентная сфера организма способна продуцировать вещества крайне высокой биологической активности. К ним относятся регуляторные пептидные гормоны, моноциты, лимфоциты и макрофаги селезенки, синтезирующие АКТГ, эндорфины. В костном мозге образуется мет-энкефалин, бета-эндорфин, а в тимусе – лей- и мет-энкефалины. Установлено эндокриноподобное действие иммунных медиаторов интерферонов, интерлейкинов, а также иммунотропное действие гормонов надпочечников, щитовидной, поджелудочной желез, половых стероидов.
Региональность и системность иммунного реагирования
Для сохранения гомеостаза организма реализуется несколько уровней защиты – региональный, местный, общеорганизменный и системный, обусловленный функциональной связью иммунной и метаболической систем (Хаитов и др., 2009). Региональный иммунитет обеспечивает защиту покровов и органов организма, непосредственно сообщающихся с внешней средой (кожа, мочеполовые органы, легкие, желудочно-кишечный тракт). Системный – подразумевает функциональную связь иммунной системы с метаболическим иммунитетом, поскольку иммунные функции организма постоянно осуществляются на фоне метаболических процессов, действия на организм различных биологических агентов, лекарственных препаратов, особенностей питания и др. (Прокопенко, Бровкина, 2003; Земсков и др., 2018а,б, 2019).
“Дезинтеграция” и интеграция иммунного реагирования
При патологическом и физиологическом разрушении чужеродных и собственных клеток высвобождаются эндогенные биологически активные вещества: R-белки, трансфер-фактор, эндотоксины, высоко- и низкомолекулярные нуклеиновые кислоты, белки острой фазы и др., которые в начале процесса способствуют индукции иммунопатологии, а позже – активации и интеграции иммунных клеточных, гуморальных, фагоцитарных, цитокиновых и метаболических реакций. Например, образование С-реактивного белка уже в первые 6–8 ч от начала болезни и его последующая кинетика позволяют использовать этот маркер в качестве индикатора дебюта, а также для хронизации или прогноза некротических и воспалительных процессов при хронических и острых воспалительных заболеваниях, вирусных, бактерильных инфекциях, аллергии, ревматизме и др.
ЗАКЛЮЧЕНИЕ
Таким образом, оказалось, что в клинической иммунологии работает принцип альтернативности практически всех иммунных реакций и составляющих. Более того, иммунная система глубоко интегрирована в другие системы организма и функционирует с ними в комплексе. Она вариабельно (дифференцированно) реагирует в зависимости от очень многих причин: патогенеза заболевания, сопутствующих осложнений, метаболического статуса, накопления различных биоактивных компонентов и т.д. По существу, она работает по принципу “паутины”, то есть ключевого закона нелокальности окружающего мира.
Список литературы
Земсков А.М., Земсков В.М., Караулов А.В. Клиническая иммунология. Учебник. М.: МИА, 1999. 604 с.
Земсков A.M., Земсков В.M., Сергеев Ю.В. и др. 1000 формул клинической иммунологии. M.: Медицина для всех, 2003. 332 с.
Земсков A.M., Земсков В.M., Есауленко И.Э. и др. Новые принципы оценки и коррекции иммунологических расстройств. M.: Триада-X, 2008. 336 с.
Земсков А.М., Земскова В.А., Попов В.И. и др. Иммунология. Учеб. пособие. Воронеж: Научная книга, 2013. 593 с.
Земсков А.М., Земсков В.М., Земскова В.А. и др. Настольная книга клинического иммунолога. Теоретические, практические и прикладные аспекты клинической иммунологии на современном этапе. М.: Триада-Х, 2015. 704 с.
Земсков А.М., Есауленко И.Э., Черешнев В.А. и др. Курс лекций по клинической иммунофизиологии. Воронеж: РИТМ, 2017. 1048 с.
Земсков А.М., Черешнев В.А., Ревишвили А.Ш. и др. Проблемы клинической иммунологии XXI века. М.: Научная книга, 2018а. 320 с.
Земсков А.М., Черешнев В.А., Ревишвили А.Ш. и др. Проблемы клинической иммунологии XXI века. II. Естественные и медикаментозные механизмы регуляции иммунологического гомеостаза. М.: Научная книга, 2018б. 286 с.
Земсков А.М., Земсков В.М., Луцкий М.А. и др. Иммунометаболические ассоциации при заболеваниях сложного генеза // Успехи соврем. биол. 2019. Т. 139. № 6. С. 577–582.
Иммунология. Фармакотерапия без ошибок. Руководство для врачей / Ред. Р.М. Хаитов. М.: Е-noto, 2016. 504 c.
Иммунотерапия. Руководство для врачей / Ред. Р.M. Хаитов, Р.И. Атауллаханов. M.: ГЭОТАР-Медиа, 2012. 669 с.
Иммунотерапия. Руководство для врачей. 2-е издание, переработанное и дополненное / Ред. Р.М. Хаитов, Р.И. Атауллаханов, А.Е. Шульженко. М.: ГЭОТАР-Медиа, 2018. 768 с.
Иммунные расстройства и их коррекция при гнойно-воспалительных процессах. М.: Триада-Х, 2007. 159 с.
Калинина Н.М., Кетлинский С.А., Оковитый С.В., Шуленин С.Н. Заболевания иммунной системы. Диагностика и фармакотерапия. М.: Эксмо, 2008. 494 с.
Луцкий М.А., Земсков А.М., Савиных В.П. Рассеянный склероз. Современные аспекты этиопатогенеза, диагностики, особенности клинического течения и лечения. Воронеж: ВГМУ, 2016. 167 с.
Новиков Д.К., Новиков П.Д. Клиническая иммунопатология. М.: Медицинская литература, 2009. 449 с.
Покровский В.И., Пак С.Г., Брико Н.И., Данилкин Б.К. Инфекционные болезни и эпидемиология. Учебник. 3-е изд. М.: ГЭОТАР-Медиа, 2013. 1008 с.
Прокопенко Л.Г., Бровкина И.Л. Иммунометаболические нарушения и их коррекция // Окислительный энергетический и иммунный гомеостаз / Ред. Л.Г. Прокопенко, А.И. Лазарев, А.И. Конопля. Курск: КГМУ, 2003. С. 13–34.
Хаитов Р.М. Иммунология. М.: ГЭОТАР-Медиа, 2011. 570 с.
Хаитов Р.M., Пинегин Б.В., Ярилин A.A. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы. М.: ГЭОТАР-Медиа, 2009. 345 с.
Хаитов Р.М., Игнатьева Г.А., Сидорович И.Г. Иммунология. Норма и патология. М.: Медицина, 2010. 762 с.
Черешнев В.А., Шмагель К.В. Иммунология. Учебник для студентов образовательных учреждений высшего профессионального образования. М.: Центр стратегического партнерства, 2014. 519 с.
Zemskov A., Zemskov V. An integral concept of regulation immune homeostasis // J. Clin. Exp. Patol. 2016. V. 6. Iss. 2. P. 2–5.
Zemskov V.M., Zemskov A.M., Suchkov S.V., Parshenkov A.V. Tactic- and strategy- affiliated policy to drive clinical immunology ahead and to secure the future // Anat. Physiol. Curr. Res. 2016. V. 6. Iss. 3. P. 2–8.
Zemskov A.M., Zemskov V.M., Lutsky M.A., Suchkov S.V. Metabolic immunity as a factor in assessing the reactivity of the body // Biol. Bull. Rev. 2018. V. 8. № 4. C. 319–327.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии