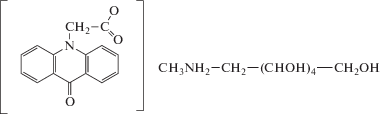Успехи современной биологии, 2020, T. 140, № 3, стр. 263-277
Сочетание традиционной терапии генитального герпеса с иммунотерапией: опыт использования отечественных иммунотерапевтических препаратов
Ф. И. Ершов 1, А. В. Пронин 1, А. В. Санин 1, *, А. Н. Наровлянский 1
1 Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи
Москва, Россия
* E-mail: saninalex@inbox.ru
Поступила в редакцию 17.02.2020
После доработки 17.02.2020
Принята к публикации 17.02.2020
Аннотация
Генитальный герпес (ГГ) – типичный представитель убиквитарно распространенных, социально значимых болезней, передающихся половым путем, основным этиологическим агентом которых являются вирусы простого герпеса первого и второго типов (ВПГ-1 и ВПГ-2). Заболеваемость ГГ в РФ составила в 2014 г. 14.2 случая на 100 000 населения. Однако истинная распространенность генитальной герпесвирусной инфекции остается недостаточно изученной. Предполагается, что в целом инфицированность населения ВПГ-2 может составлять 15–30 млн человек. Нами, на основании изучения клинических и литературных данных, рекомендуется сочетание традиционной этиотропной терапии с иммунотерапией для нормализации у больных с рецидивирующим ГГ нарушений функционирования систем иммунитета и интерферона. Для лечения больных ГГ с частыми рецидивами рекомендуется персонифицированная терапия, сочетающая использование хорошо известных базисных этиотропных химиопрепаратов с препаратами интерферона (Виферон) и их индукторами (Циклоферон, Кагоцел). Перспективен, на наш взгляд, и новый лекарственный препарат Фортепрен, который в настоящее время проходит регистрацию в МЗ РФ. Действующими веществами Фортепрена являются полипренилфосфаты, уже доказавшие высокую противовирусную эффективность при терапии вирусных инфекций у мелких домашних и сельскохозяйственных животных. Предлагаемый подход целесообразно применять как для профилактики в период ремиссий ГГ, так и для терапии во время рецидивов.
ВВЕДЕНИЕ
Генитальный герпес (ГГ) – типичный представитель повсеместно распространенных, социально значимых заболеваний, передающихся половым путем, основными этиологическими агентами которых являются вирусы простого герпеса первого и второго типов – ВПГ-1 и ВПГ-2 (Hofstetter et al., 2014). Согласно данным Всемирной организации здравоохранения, 67% взрослого трудоспособного населения Земли инфицированы ВПГ-1, что составляет 3.7 млрд человек (Вирус простого герпеса, 2017). Значительно меньшее число людей (около 530 млн чел.) инфицированы ВПГ-2 (Looker et al., 2015). Доля поражения ГГ в странах с высоким уровнем социального и промышленного развития составляет от 10 до 20% взрослого населения. Приведенные данные указывают на реально существующую глобальную эпидемию ГГ (Самгин, Халдин, 2002; Аковбян и др., 2003; Баринский, Махмудов, 2013).
МАСШТАБЫ И ЗНАЧИМОСТЬ ПРОБЛЕМЫ ГГ
С 1993 г. в РФ началась обязательная регистрация заболевания ГГ. Согласно статистическим данным, заболеваемость ГГ возрастала в период с 1994 г. по 2005 г. с 7.4 до 21.6 случая на 100 тыс. населения (Ershov et al., 2017). К 2012 г. отмечалось некоторое снижение заболеваемости с 21.6 до 16.8 случая на 100 тыс. чел., однако в ряде регионов тенденция к росту заболеваемости по-прежнему остается стабильной (Кузнецова, Хлыстова, 2016). Выявлена группа риска по заболеваемости ГГ – это прежде всего женщины репродуктивного возраста. Заболеваемость в этой группе составляет 135.7 случаев на 100 тыс. чел. данного пола и возраста (Хрянин и др., 2015; Кузнецова, Хлыстова, 2016).
Сравнение показателей заболеваемости ГГ в РФ и развитых станах Запада пока свидетельствует в пользу отечественного здравоохранения: если в России на 100 тыс. населения приходится 19 случаев ГГ, то в Европе и США эти показатели составляют 80 и 200 случаев на 100 тыс. населения соответственно. Однако в период с 1993 г. по 1999 г. заболеваемость ГГ только в Москве выросла в 6.8 раза (74.8 случаев на 100 тыс. чел.) и вплотную приблизилась к европейской. Важной причиной продолжающегося роста заболеваемости ГГ является распространенность бессимптомных и недиа-гностированных форм ГГ (Исаков и др., 2013), с чем связывают до 70% случаев передачи генитального ВПГ.
К сожалению, анализ статистических данных по заболеваемости ГГ в России и по регионам сильно затруднен. Поэтому истинная распространенность ВПГ-1 и ВПГ-2 остается слабоизученной, так как практически не проводятся крупномасштабные популяционные эпидемиологические исследования (Ershov et al., 2017). По информации еще 15-летней давности, соотношение выявленных ВПГ-2 и ВПГ-1 при ГГ у обследованных больных в Москве и Московской обл. приблизительно составляло 3 к 1. Тем не менее, по данным Российского общества дерматовенерологов и косметологов (Кузнецова, Хлыстова, 2016), частота инфицирования вновь приобретенным ВПГ-2 составляет 5.1 случаев на 100 чел. в год. В РФ показатель заболеваемости ГГ в 2014 г. составил 14.2 случаев на 100 тыс. населения: у лиц в возрасте 0–14 лет – 0.1 случаев на 100 тыс. населения, у лиц в возрасте 15–17 лет – 8.5 случаев на 100 тыс. населения, а у лиц в возрасте старше 18 лет – 17.2 случаев на 100 тыс. населения.
ПЕРСИСТЕНЦИЯ ВИРУСА ГЕРПЕСА ПРИ ГГ
Доказано, что ведущую роль в нейтрализации ВПГ играет врожденный иммунитет. В основе персистенции возбудителя при ГГ лежит нарушение иммунологического и интерферонового (ИФН) статуса, вторичная негативная иммунная перестройка, связанная с угнетением реакций клеточного иммунитета и ИФН-продуцирующей способности лейкоцитов. Поражение иммунокомпетентных клеток – причина вторичного иммунодефицита (Ершов, Киселев, 2005; Ершов, 2006).
Характерные иммунологические нарушения у больных часто рецидивирующим ГГ связаны с рядом факторов: 1) снижением продукции эндогенных ИФН, лимфоцитов Th1-типа, активности НК-клеток и антителозависимой клеточной цитотоксичности; 2) уменьшением абсолютного числа и снижением активности Т-лимфоцитов (СD3+- и СD4+-клеток, СD8+-цитотоксических Т-лимфоцитов); 3) снижением активности нейтрофилов (незавершенный фагоцитоз); 4) повышением количества иммунных комплексов (Шульженко, Тутушкина, 2004; Ershov et al., 2017).
Наиболее распространенными пусковыми механизмами активации латентной инфекции являются стрессы, хронические заболевания, сезонные ОРВИ, экологическая обстановка и пр. Обычно герпесвирусный геном находится в латентном состоянии под контролем иммунной и интерфероновой систем организма и локализуется, в основном, в сенсорных ганглиях люмбосакрального отдела позвоночника. Первичное проникновение вируса происходит через поврежденные ткани или неповрежденные слизистые оболочки, далее вирус использует параневральные ткани для своей репродукции и перемещения в сенсорные ганглии, где и переходит в нереплицирующееся состояние (Chentoufi, BenMohamed, 2012). При высокой активности СD8+-Т-клеток возникает латентная инфекция, которая может сохраняться пожизненно (Shin, Iwasaki, 2013).
В целом, в основе латенции генома ВПГ лежит отсутствие экспрессии полного набора вирусных генов, отвечающих за репродуктивный цикл вируса. Дефектность врожденного и адаптивного иммунитета приводит к изменению синтеза ранних и поздних цитокинов (Ershov et al., 2017). Персистенция вируса объясняется также и тем, что под его влиянием индуцируются процессы апоптоза, направленные против клеток иммунной системы. Снижение экспрессии вирусных генов в период латентной фазы не позволяет клеткам иммунной системы распознать наличие вируса в инфицированных клетках, поскольку на поверхности этих инфицированных клеток не представлены вирусные антигены (Matis, Kúdelová, 2011). Цитокины ИФН-α, -β, -γ, TNF-α, ИЛ-6 постоянно синтезируются плазматическими дендритными клетками в инфицированных ганглиях, поддерживая состояние латенции ВПГ. Экспрессия ИФН-α/-β определяет дифференциацию Т-клеточного ответа по Th-1-типу и увеличивает пролиферацию, цитолиз и поддержание популяции CD8+ цитотоксических лимфоцитов (Ершов, Наровлянский, 2011).
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ И ТРАДИЦИОННЫЕ МЕТОДЫ ТЕРАПИИ ГГ
Хотя клинические проявления ГГ детально описаны в литературе (Баринский, Махмудов, 2013; Gupta et al., 2007), считаем необходимым отметить некоторые особенности, характерные для ГГ. Большинство зарегистрированных заболеваний ГГ имеют тенденцию к латентному пожизненному течению с высокой частотой (50–75%) рецидивов. Средний возраст большинства больных ГГ приходится на продуктивный период жизни (20–45 лет). Для подавляющего большинства случаев характерно бессимптомное (20%) или атипичное течение (60%), затрудняющее своевременную постановку диагноза и начало лечения (Исаков и др., 2013).
При ГГ у мужчин наиболее подвержены герпесвирусной атаке уретра, мочевой пузырь, простата и семенники, а при аногенитальных половых контактах – область ануса и прямая кишка. У женщин герпесвирусная инфекция может быть причиной бесплодия (до 60%), невынашивания беременности (до 20%), преждевременных родов (до 80%), а также неонатальной летальности (достигающей 20%), респираторного дистресс-синдрома (до 12%) и других форм патологии новорожденных (Баринский, Махмудов, 2013).
Основной подход к лечению ГГ определяется необходимостью торможения вирусной репродукции в период обострения и формирования адаптивного иммунного ответа. Целями терапии являются: 1) купирование острых симптомов болезни в наиболее короткие сроки; 2) сокращение сроков реэпителизации; 3) профилактика рецидивов и уменьшение их частоты и тяжести; 4) предупреждение передачи вируса половым партнерам (Буданов, 2011; Ershov et al., 2017).
Терапия часто рецидивирующих форм ГГ остается сложной задачей (Шульженко, Зуйкова, 2011). Несмотря на значительное количество предложенных эффективных лечебных схем и этиотропных антигерпетических препаратов (Федеральные…, 2015), радикального эффекта лечения до сих пор достичь не удается.
Европейские стандарты лечения ГГ предусматривают, прежде всего, использование хорошо известных аномальных нуклеозидов: Ацикловира, Валацикловира, Фамцикловира и др. (Ершов, 2006; Leung, Saks, 2000). К сожалению, многолетнее использование этой группы классических этиотропных химиопрепаратов мало влияет на общее снижение заболеваемости ГГ, что может быть связано c нерациональной фармакотерапией и развитием резистентности вирусов к используемым препаратам. Эффективность лечения осложняется также часто наблюдаемыми при ГГ смешанными инфекциями.
Доказана важность иммунных факторов в реактивации и развитии клинических проявлений ВПГ, например: цитотоксических Т-лимфоцитов, естественных киллеров, факторов гуморального иммунитета, мононуклеарных фагоцитов и цитокинов. При этом выявленные иммунологические нарушения регистрируются как в фазе рецидива, так и во время ремиссии заболевания (Буданов, 2011).
ОПЫТ ИСПОЛЬЗОВАНИЯ ОТЕЧЕСТВЕННЫХ ИММУНОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ ПРИ ГГ
Исследованиями последних лет доказано, что система ИФН играет существенную позитивную роль при хронически рецидивирующем ГГ. Поэтому для коррекции подавленных механизмов иммунитета при ГГ необходимо использовать иммунотерапевтические лекарственные средства системного и местного действия (Рахматулина, 2007; Марченко, 2011).
Российскими учеными доказана перспективность использования в комплексной профилактике и терапии ГГ ИФН и их индукторов. К числу наиболее изученных и перспективных препаратов для интерферонотерапии ГГ относятся: препарат экзогенного интерферона альфа 2b (ИФН-α2b) – Виферон и индукторы эндогенного интерферона – Циклоферон и Кагоцел. Эти препараты широко используются для лечения ряда вирусных заболеваний (Ершов, Наровлянский, 2011).
Виферон® представляет собой сочетание ИФН-α2b и двух антиоксидантов – токоферола ацетата и аскорбиновой кислоты. Препарат в виде ректальных суппозиториев применяют в комплексной терапии при различных инфекционно-воспалительных заболеваниях. Виферон® – единственное лекарственное средство в России, разрешенное для профилактики вирусных инфекций у беременных и новорожденных.
Вот пример лечения Вифероном® 74 беременных женщин с диагнозом ГГ. Курс терапии проводили с 28–30-й недели беременности. Суппозитории (500 000 ЕД) вводили ректально ежедневно через 12 ч (всего 20 свечей – 10 дней), затем импульсно – по 1 суппозиторию 2 раза в неделю. С 35–36-й недели гестации курс лечения Вифероном® повторяли. У леченых женщин наблюдался абортивный характер клинического течения ГГ. Установлена корреляция между частотой рецидивов до и после начала лечения (Каграманова и др., 2008). У 14 пациенток с частотой рецидивов ГГ от 8 до 11 раз в год до начала исследования после терапии Вифероном® наблюдали уменьшение частоты рецидивов до 3–4 раз в год. У больных с исходной частотой рецидивов 3–4 раза в год на фоне проводимой терапии не определялись клинические проявления ГГ. То есть наблюдали снижение частоты рецидивов в 3 и более раз в зависимости от исходного состояния больных (Буданов, 2004; Шперлинг и др., 2010).
В целом, терапия ГГ Вифероном® сокращает длительность острого периода, уменьшает выраженность клинических проявлений, пролонгирует период ремиссии в 1.5–2 раза, снижает частоту рецидивов, возможные осложнения беременности и перинатальную заболеваемость (Шперлинг и др., 2010).
Циклоферон® (ЦФ) – метилглюкаминовая соль карбоксиметиленакридона (НТФФ “Полисан”, СПб). Относится к низкомолекулярным индукторам ИФН (рис. 1).
Показано, что применение Циклоферона® сопровождалось образованием ИФН-α в клетках различных органов, тканях и биологических жидкостях в течение более чем 72 ч. При этом ИФН-α синтезировался в высоких титрах как нелимфоидными клетками, так и клетками гемопоэтической и лимфоидной систем (Ершов, 2006).
Циклоферон® активирует у пациентов систему ИФН, запускает продукцию ИФН-α в В-клетках, дендритных клетках, макрофагах, нейтрофилах, повышает уровень CD4+, фагоцитоз, активность естественных киллеров и цитотоксических Т-клеток. Кроме того, препарат активирует образование иммуноглобулина, интерлейкинов (ИЛ-2, -1) и ИФН-γ, повышает продукцию высокоаффинных антител, влияет на переключение синтеза классов иммуноглобулинов В-лимфоцитами (Соколова и др., 2015).
Циклоферон® использовали для лечения больных рецидивирующей герпесвирусной инфекцией при монотерапии или в комбинации с другими антивирусными лекарственными препаратами. В 88% случаев доказана эффективность клинического применения ЦФ, у 10% больных отмечено улучшение клинического течения рецидива ГГ. Делается вывод, что введение ЦФ больным ГГ приводит к стойкой клинико-иммунологической ремиссии (Иммунопатогенез…, 1999).
В 2013 г. в руководстве для врачей “Герпесвирусные инфекции человека” (Исаков и др., 2013) представлены убедительные свидетельства эффективности применения Ацикловира (АЦ – 200 мг 5 раз в сутки 5 дней) и Циклоферона® (ЦФ – 2 мл 12.5%-ного раствора 1 раз в сутки 1, 2, 4, 6, 8 дней лечения) у 100 больных ГГ (по 50 человек на каждый лекарственный препарат). В исследовании участвовали мужчины и женщины (20 и 80 человек соответственно) в возрасте 24–42 лет. В группы отбирались больные с длительностью заболевания от 1 до 5 лет и частотой рецидивов 5–8 раз в год. Локализация герпетических поражений у женщин – промежность, большие и малые половые губы, у мужчин – крайняя плоть, головка и тело полового члена. В таблице 1 представлена продолжительность клинических проявлений ГГ, анализ которых позволяет сделать заключение об отсутствии различий в динамике основных клинических симптомов и о сопоставимости АЦ и ЦФ, что свидетельствует о высокой эффективности ЦФ при лечении рецидивирующей генитальной герпесвирусной инфекции.
Таблица 1.
Продолжительность основных клинических проявлений ГГ (по: Исаков и др., 2013)
| Симптомы | Продолжительность симптомов (дни) | |
|---|---|---|
| Циклоферон (n = 50) | Ацикловир (n = 50) | |
| Местные субъективные проявления (зуд, жжение, боль) | 4.1 | 3.8 |
| Интоксикация | 0.8 | 1.0 |
| Везикулярная стадия | 1.8 | 1.6 |
| Эрозивная стадия | 2.2* | 2.1* |
| Стадия эпителизации (образование корочек) | 2.6 | 2.4 |
| Продолжительность рецидива | 6.6 | 6.4 |
Кроме того, изучение клеточного иммунного ответа у леченых ЦФ больных в сопоставлении с больными, леченными АЦ, показало статистически достоверное возрастание представительства субпопуляций Т-лимфоцитов, хелперных и регуляторных Т-клеток, естественных киллерных клеток. Также в тесте спонтанной и индуцированной РБТЛ (реакция бласттрансформации лимфоцитов) получены данные по восстановлению функциональной активности лимфоцитов у леченых ЦФ больных за счет повышения резервных возможностей иммунокомпетентных клеток (Исаков и др., 2013).
Таким образом, лечение ЦФ сопровождалось увеличением продолжительности ремиссии в 2.0–2.5 раза, сокращением в 2 раза сроков разрешения высыпаний и исчезновением других клинических симптомов. Уже со второго дня терапии больные отмечали стабильное улучшение самочувствия и исчезновение субъективных симптомов.
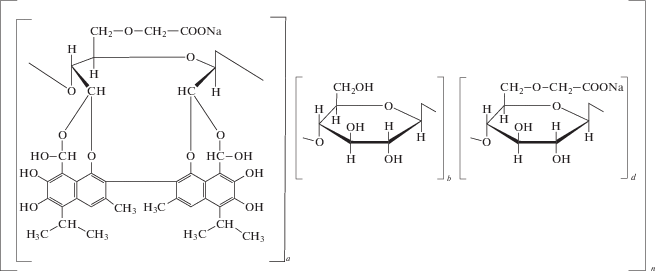
Кагоцел® – натриевая соль карбоксиметилцеллюлозы, ковалентно связанная с госсиполом, полученным из семян хлопчатника. Является высокомолекулярным соединением (рис. 2) и индуктором ИФН.
При детальном изучении мишеней и механизмов действия Кагоцела® было обнаружено, что обработка вирус-инфицированных клеток при культивировании in vitro приводит к изменению активности ряда генов, участвующих в переключении клетки на апоптотический путь развития, а значит, к уменьшению количества полноценных вирусных частиц. Получены данные о вовлечении в каскад реакций на Кагоцел® белков системы апоптоза – bcl-2 и p53 (Соколова и др., 2015).
При введении в организм Кагоцел® стимулирует продукцию эндогенных ИФН-α/-β с пиком активности через 24–48 ч с последующей циркуляцией ИФН до 4–5 дней. Препарат регулирует выработку цитокинов, оказывающих иммуномодулирующее и иммуностимулирующее действие и принимающих участие в противовирусной защите.
Показано, что курс лечения Кагоцелом® достоверно сокращает частоту и длительность рецидивов ГГ и снижает тяжесть течения рецидивов заболевания (Тутушкина, Шульженко, 2004).
Были проведены клинические исследования эффективности и переносимости Кагоцела® (Масюкова и др., 2006). В исследование были отобраны 50 человек в возрасте от 18 до 50 лет, страдающих ГГ: 30 женщин (60%) и 20 мужчин (40%). По тяжести течения ГГ больные распределялись следующим образом: легкая степень, или 1–3 рецидива в год, – 8 человек (16%); средняя степень, или 4–6 рецидивов в год, – 14 человек (28%); тяжелая степень, или 6 и более рецидивов в год, – 28 пациентов (56%). Одним из показателей тяжести заболевания ГГ является длительность обострения. У 52% пациентов она составила от 5 до 10 дней и у 40% – более 10 дней.
Все больные были разделены на 3 группы:
группа 1 (монотерапия Кагоцелом®): 20 больных, из которых 12 женщин и 8 мужчин;
группа 2 (комбинированная терапия Кагоцел® + + ацикловир): 10 больных, из которых 6 женщин и 4 мужчин;
группа 3 – группа сравнения (монотерапия ацикловиром): 20 больных, из которых 12 женщин и 8 мужчин.
Авторы отмечают, что при сравнительном анализе эволюции клинических проявлений наиболее показательные результаты эффективности были получены при комбинированной терапии (группа 2: 3.2 ± 0.18) и монотерапии Кагоцелом® (группа 1: 5.6 ± 0.31). Монотерапия ацикловиром (группа 3: 6.4 ± 0.49) была менее эффективна. В результате лечения с Кагоцелом® наблюдалось сокращение сроков разрешения элементов, исчезновение зуда, локальных болей и длительности рецидива. Через 3 мес. после лечения зафиксировано снижение средней продолжительности рецидива ГГ у пациентов группы 1 с 12.8 до 6.25 сут и группы 2 с 13.4 до 5.0 сут по сравнению с группой 3, в которой длительность рецидива сократилась с 12.5 до 8.7 сут (Масюкова и др., 2006).
В целом, лечение больных ГГ Вифероном®, Циклофероном® и Кагоцелом® показало, что их использование в монотерапии и комбинированной терапии с аномальными нуклеозидами приводит к более раннему прекращению вирусовыделения, купированию проявлений ГГ, снижению частоты и сокращению продолжительности рецидивов заболевания (Масюкова и др., 2006; Малиновская и др., 2007; Исаков и др., 2010; Халдин, Игнатьев, 2011).
Помимо вышеизложенных и наиболее изученных препаратов, недавно разработан и в настоящее время проходит регистрацию в МЗ РФ новый лекарственный препарат Фортепрен®, действующее вещество которого представляет собой динатриевую соль одного из продуктов пути мевалоновой кислоты – полипренилфосфата (рис. 3). Полипренолы имеют существенное значение в жизненном цикле вирусов и могут влиять на некоторые стадии вирус-клеточного взаимодействия (Наровлянский и др., 2007; Blanc et al., 2011).
Фортепрен® представляет собой продукт фосфорилирования полипренолов хвои пихты, относится к противовирусным препаратам (группа J05AX) с иммуномодулирующей активностью. Препарат недавно прошел полный цикл доклинических испытаний и клинической апробации при ГГ (Наровлянский и др., 2015а; Седов и др., 2018).
ПРАКТИКА ПРИМЕНЕНИЯ ПОЛИПРЕНИЛФОСФАТОВ В ВЕТЕРИНАРИИ
Препараты на основе фосфорилированных полипренолов обладают доказанной противовирусной эффективностью (Ожерелков и др., 2000, 2001, 2017; Наровлянский и др., 2012), что нашло применение в ветеринарной практике при лечении многих заболеваний мелких домашних и сельскохозяйственных животных.
В РФ давно и успешно применяют два препарата на основе фосфорилированных полипренолов: Фоспренил (ФП) и Гамапрен.
ФП уже более 25 лет используют для профилактики и лечения вирусных инфекций собак (чума плотоядных, инфекционный гепатит, парвовирусный энтерит, аденовирозы, папилломатоз, болезнь Ауески, инфекционный трахеобронхит и др.), кошек (панлейкопения, герпетический ринотрахеит, кальцивироз, коронавирусные инфекции и др.) и других животных (Батуев и др., 2003; Наровлянский и др., 2005; Санин, 2005; Санин и др., 2008, 2015; Савойская и др., 2008; Переслегина и др., 2013; Руднева и др., 2016; Савойская, Кожевникова, 2019). Препарат продемонстрировал противовирусную и терапевтическую эффективность и на экспериментальной модели ГГ (Наровлянский и др., 2015б).
Эффективность ФП при лечении вирусных инфекций связывают со стимуляцией продукции ИФН, а также с восстановлением ранних цитокиновых реакций, подавленных под действием вирусов. В частности, продемонстрирована способность ФП стимулировать продукцию ИЛ-1, -12 и TNF-α (Пронин и др., 2000). Препарат повышает гуморальный и клеточный иммунный ответ на некоторые вирусные белки (Масалова и др., 2018). Возможные механизмы индукции раннего противовирусного процесса в организме под влиянием ФП могут быть связаны с активацией ряда звеньев врожденного иммунитета, обеспечивающих повышение неспецифической резистентности (Пронин и др., 2002; Ожерелков и др., 2012). Введение ФП в организм сопровождается быстрой индукцией и последующей секрецией ряда цитокинов, которые активируют макрофаги и естественные клетки-киллеры, что в результате приводит либо к гибели инфицированных вирусами клеток и их элиминации из организма, либо к прерыванию вирусной репликации в клетках-мишенях (Пронин и др., 2000). Благодаря повышению продукции ключевых цитокинов, обеспечивающих сбалансированное формирование Th1 и Th2 иммунного ответа при вирусном инфекционном процессе, ФП способен восстанавливать этот необходимый баланс, нарушенный вирусами (Пронин и др., 2002). Иными словами, ФП является классическим препаратом, сочетающим противовирусные и иммуномодулирующие свойства. Немаловажно для понимания эффективности ФП при вирусных инфекциях, что препарат обладает антитоксическими (Зайцева и др., 2005), антиоксидантными (Санин и др., 2017) и противовоспалительными свойствами (Чернова и др., 2012). Показано, что ФП подавляет воспалительную реакцию, контррегулируя фактор, ингибирующий миграцию макрофагов MIF (macrophage migration inhibitory factor) (Санин и др., 2011а), и подавляя активность 5-липоксигеназы и 15-липоксигеназы (Ганшина и др., 2011; Санин и др., 2011г). Все эти свойства ФП в сочетании с прямым противовирусным действием (Ожерелков и др., 2017), по-видимому, и обеспечивают защиту от вирусной инфекции (Васильев и др., 2008).
ФП нашел применение и в сельском хозяйстве. Препарат активизирует метаболические процессы в организме, стимулирует естественную резистентность и привесы, повышает напряженность иммунитета при вакцинации животных, снижает частоту поствакцинальных осложнений (Санин и др., 2011б; Гулюкин и др., 2016). ФП применяют для лечения и профилактики вирусных инфекций молодняка, показана его высокая эффективность при аэрозольном применении у кур, которое способствует профилактике респираторных инфекций, повышению напряженности иммунитета и привесов (Дементьева и др., 2007). У цыплят-бройлеров ФП используют при вакцинации против ньюкаслской болезни, инфекционном бронхите кур и инфекционной бурсальной болезни (Санин и др., 2011в).
У лошадей показана эффективность ФП при вирусном артериите, папилломатозе и гриппе. Также ФП позволяет предотвратить развитие респираторных инфекций у лошадей. При вакцинации лошадей против лептоспироза и гриппа отмечено повышение титров антител и снижение частоты поствакцинальных осложнений с 20 до 3% (Зайцева и др., 2006).
Адъювантные свойства ФП выявлены также при вакцинации собак и других животных (Ожерелков и др., 2012).
Назначение ФП телятам при острых вирусных инфекциях способствует снижению заболеваемости и оптимизирует показатели естественной резистентности (Деева и др., 2005). Продемонстрирована высокая терапевтическая и профилактическая эффективность препарата при трансмиссивном гастроэнтерите свиней, вызванном коронавирусами (Деева и др., 2004).
Введение ФП свиноматкам и поросятам одновременно с вакцинами против сальмонеллеза, классической чумы свиней, болезни Ауески и рожи приводило к снижению заболеваемости со 100 до 58%, к увеличению сохранности с 58.6 до 73.3% и повышению титров антител в 2–4 раза (Санин и др., 2011б).
При алеутской болезни норок, вызванной парвовирусами, ФП повышал выживаемость животных и стимулировал основные параметры естественной резистентности (Ростроса и др., 2019).
Препарат Гамапрен, действующими веществами которого являются фосфорилированные полипренолы из листьев шелковицы, был первоначально разработан для лечения герпесвирусных инфекций (Наровлянский и др., 2014), показав при этом высокую эффективность как in vitro (Санин и др., 2018а), так и in vivo (Санин и др., 2009, 2018г). Однако дальнейшее изучение его свойств выявило, что препарат эффективен при лечении кошачьего инфекционного перитонита (Фурман и др., 2010; Переслегина, Жавнис, 2019), коронавирусного гастроэнтерита (Жавнис и др., 2019), панлейкопении кошек (Санин и др., 2018б), аденовироза и парагриппа собак (Савойская и др., 2008), а также при различных инфекциях, вызванных флавивирусами (Ожерелков и др., 2008, 2017; Санин и др., 2018в). При этом было показано, что Гамапрен вызывает стимуляцию продукции ИФН-γ и ИЛ-12 в сыворотке крови животных на ранних сроках инфекции, одновременно подавляя стимулированную вирусами продукцию ИЛ-10. Возможно, это является одним из ключевых механизмов противовирусной активности препарата при его использовании в качестве профилактического средства или на самых ранних стадиях инфекционного процесса.
Кроме Фоспренила и Гамапрена, в мировой ветеринарной практике применяют разработанный в США препарат Polyprenyl Immunostimulant, основными действующими веществами которого также являются фосфорилированные полипренолы, выделенные из листьев шелковицы. Polyprenyl Immunostimulant применяют для лечения герпесвирусных инфекций кошек, в частности инфекционного ринотрахеита (Legendre et al., 2017б). Кроме того, он проявил эффективность в контролируемых клинических испытаниях при сухой форме кошачьего инфекционного перитонита (Legendre at al., 2017а).
ЭФФЕКТИВНОСТЬ ПРЕПАРАТА ФОРТЕПРЕН® ПРИ ЛЕЧЕНИИ ГГ
В трех исследовательских центрах было проведено многоцентровое клиническое исследование препарата Фортепрен®. Отобранные в процессе скрининга 80 пациентов прошли 10-дневный курс лечения острой фазы заболевания противовирусным препаратом Ацикловир в дозе по 400 мг три раза в день. По окончании базового курса пациенты получили препарат Фортепрен® по следующей схеме – 8 мг/чел. на стадии ремиссии трехкратно с интервалом в 21 день.
Продолжительность генитальной герпесвирусной инфекции у пациентов, включенных в исследование, составила от 1 года до 35 лет, в среднем 7.31 ± 4.5 года. В исследование были включены пациенты с высокой частотой обострений герпесвирусной инфекции: 12.81 ± 0.44 раз в год для пациентов лечебной группы и 12.95 ± 0.34 раз в год для контрольной группы. В данной категории пациентов особенно тяжело подбирается терапия герпесвирусной инфекции, так как при высокой частоте рецидивов формируется вторичная иммунологическая недостаточность, физическое и психологическое истощение пациентов, низкая чувствительность к терапии из-за неэффективности ранее проведенного лечения.
Была оценена клиническая эффективность и безопасность проводимой терапии (с применением препарата Фортепрен®) и параметров интерферонового статуса.
Критерии клинической эффективности проводимой терапии:
– увеличение продолжительности межрецидивного периода (ремиссии);
– снижение частоты рецидивов (обострений) герпесвирусной инфекции;
– уменьшение выраженности рецидивов, оцениваемой в баллах и включающей в себя характеристику местных признаков рецидива (зуд, жжение, болезненность, гиперемия, отек, регионарный лимфаденит) и общих признаков рецидива (слабость, головная боль, температура, озноб, невралгия, миалгия);
– уменьшение выраженности поражения кожи или слизистой до и после лечения (количество очагов поражения, площади поражения, числа везикулезно-эрозивных элементов поражения);
– изменение иммунологических показателей на основе оценки интерферонового статуса.
Анализ полученных результатов показал, что лечение пациентов с хронической рецидивирующей герпесвирусной инфекцией генитальной локализации изучаемым препаратом Фортепрен® приводит к увеличению продолжительности межрецидивного периода, что соответствует одному из основных критериев оценки эффективности лечения.
В лечебной группе пациентов, получавших препарат Фортепрен®, межрецидивный период за время проведения исследования увеличился в 1.5 раза с 29.36 ± 2.16 сут за 3 мес. до начала исследования до 42.98 ± 3.29 сут (p = 0.0002) в период исследования. При этом в контрольной группе пациентов, получавших плацебо, межрецидивный период изменился статистически незначимо с 28.51 ± 1.98 сут за 3 месяца до начала исследования до 32.83 ± 19.12 сут в период исследования (p = 0.37).
С критерием продолжительности межрецидивного периода (ремиссии) напрямую связан показатель частоты рецидивов (обострений). Оценка частоты обострений ГГ в лечебной группе пациентов показала достоверное снижение этого показателя во время лечения в 1.6 раз. Если частота рецидивов герпеса за 3 мес. до лечения составляла 3.03 ± 0.02, то во время лечения за 3 месяца наблюдения она составила уже 1.94 ± 0.19 (p < 0.05). Эти результаты достоверно отличались от показателей контрольной группы, где количество рецидивов за 3 мес. до лечения составляло 3.13 ± 0.05 и 2.75 ± 0.34 – за время исследования, разница была статистически недостоверна (p = 0.27).
Снижение выраженности рецидивов фиксировалось следующим образом: у пациентов лечебной и контрольной групп симптомы оценивались в баллах на скрининге (при первом визите до начала лечения) и во время лечения.
Проявления рецидива ГГ могут быть различными: от бессимптомного выделения вируса или легких симптомов до очень болезненных сливных изъязвлений с четкими границами.
Суммарное значение баллов выраженности рецидива по местным (зуд, жжение, болезненность, гиперемия, отек, регионарный лимфаденит), общим (слабость, головная боль, озноб, невралгия, миалгия) признакам рецидива, температуре тела, количеству очагов поражения, площади очагов поражения, числу везикулезно-эрозивных элементов в очаге поражения в лечебной группе составило 7.36 ± 0.35 баллов на первом визите до начала лечения и снизилось до 4.75 ± 0.35 баллов во время лечения (р = 0.0002). В контрольной группе пациентов, получавших плацебо по той же схеме, снижение суммарного значения балла выраженности признаков рецидива было статистически недостоверно (р = 0.24) от 6.91 ± 0.42 при первом визите до 5.95 ± 0.42 во время лечения.
Согласно МКБ-10, все больные, принявшие участие в настоящем исследовании, могли быть отнесены по клинической форме ГГ к разделу А60 – Аногенитальная герпетическая вирусная инфекция (Herpes simplex). По клинико-морфологической классификации в исследовании участвовали больные с рецидивирующим ГГ (типичная и атипичная формы). Кроме того, при классификации тяжести клинического течения ГГ выделяют следующие формы:
– легкая степень – обострение заболевания 3– 4 раза в год, ремиссия не менее 4 мес.;
– средняя степень – обострение 4–6 раз в год, ремиссия не менее 2–3 мес.;
– тяжелая степень – ежемесячные обострения, ремиссия от нескольких дней до 6 нед.
Именно к указанной последней форме тяжести клинического течения ГГ относились все пациенты, принимавшие участие в настоящем исследовании. Такие больные с выраженными поражениями иммунной системы и ежемесячными рецидивами ГГ более медленно поддаются противовирусной и противорецидивирующей терапии.
Известно, что вирус простого герпеса имеет особенность поражать клетки иммунной системы организма (Интерферон-2011, 2012). Персистируя и репродуцируясь в них, он обусловливает снижение функциональной активности или даже гибель иммунокомпетентных клеток. Вследствие этого происходит подавление как клеточного, так и гуморального звеньев иммунитета. Развиваются иммунодефицитные состояния (Paludan et al., 2011; Guo et al., 2015; Kumari et al., 2015). При ослаблении контроля со стороны иммунной системы становится невозможной полная элиминация внутриклеточного вируса, и создаются благоприятные условия для его распространения в организме и активизации других инфекций.
До настоящего времени идет дискуссия, какие иммунологические показатели должны исследоваться при лечении больных ГГ (Буданов, 2011; Марченко, 2011; Силина, Бибичева, 2011; Шульженко, Зуйкова, 2011; Интерферон-2011, 2012).
Вирусная инвазия в большинстве случаев контролируется системой ИФН. По данным многих авторов (Ершов, Киселев, 2005; Исаков и др., 2013), при рецидивирующем герпесе способность лейкоцитов периферической крови вырабатывать интерфероны снижается в 100 раз во время рецидива и в 10 раз – во время ремиссии.
В ряде работ показано, что более чем у 90% больных рецидивирующим ГГ выявлено выраженное снижение способности к продукции ИФН-α – интегративного показателя состояния противовирусной защиты организма (Ершов, Киселев, 2005; Интерферон-2011, 2012). Именно поэтому при исследовании особое внимание нами было обращено на этот показатель.
Показатель уровня лейкоцитарного вирус-индуцированного интерферона (ЛВИ-ИФН) дал нам ценную информацию о состоянии и функционировании противовирусного иммунитета у обследованных больных с тяжелой степенью клинического течения рецидивирующего ГГ.
Этот показатель важен тем более, что в настоящее время выделяют 5 основных способов ухода вирусов, в том числе и ВПГ, от действия ИФН: 1) общее интерферирование с экспрессией генов и синтезом белка; 2) минимизирование ИФН-индукции путем ограничения продукции вирусных патоген-ассоциированных молекулярных паттернов (PAMPs) и/или специфической блокады каскада реакций индукции ИФН; 3) ингибиция ИФН-сигналов; 4) блокирование действия ИФН-индуцированных ферментов с антивирусной активностью; 5) приобретение репликационной стратегии, нечувствительной к действию ИФН (Randall, Goodbourn, 2008). Таким образом, ВПГ имеет большое разнообразие молекулярных механизмов, позволяющих уйти от действия ИФН.
Следовательно, показатель ЛВИ-ИФН, свидетельствующий о потенциальной способности клеток продуцировать ИФН при хронической рецидивирующей генитальной герпесвирусной инфекции с тяжелой степенью клинического течения, по-видимому, может адекватно отражать состояние противовирусного иммунитета больных при лечении препаратом Фортепрен®.
Следует отметить, что, в целом, в лечебной группе, наряду с увеличением продолжительности межрецидивного периода и уменьшением частоты рецидивов ГГ у 70% пациентов, уровень ЛВИ-ИФН остался без изменений или повысился у 64.4% больных.
Таким образом, проведение терапии Фортепреном® в дозе 2.0 мл внутримышечно трехкратно с интервалом в 21 день у пациентов с изначально высокой частотой рецидивов ГГ приводит к статистически достоверному (p < 0.0002) увеличению продолжительности межрецидивного периода в 1.5 раза, снижению частоты обострений у пациентов в 1.6 раза (p < 0.05) и снижению суммарного значения баллов выраженности рецидивов в 1.6 раза (р = 0.0002) в лечебной группе по сравнению с контрольной группой (плацебо), что сопровождается сохранением или восстановлением параметров противовирусного иммунитета у 64.4% пациентов, получивших лечение, в течение трех месяцев наблюдения за пациентами.
Для дополнительного обоснования возможности повышения иммунного ответа клеток, установления возможных механизмов, определяющих эффективность лечения препаратом Фортепрен®, с помощью современного мультиплексного метода анализа у пациентов с хронической рецидивирующей герпесвирусной инфекцией генитальной локализации была проведена оценка продукции основных цитокинов, участвующих в защите от герпесвирусной инфекции.
Результаты проведенных исследований показали, что ИФН-α и ИФН-γ не обнаруживались в сыворотках пациентов контрольной группы, тогда как у больных, леченных Фортепреном®, наблюдалась определенная динамика изменения их уровня со спадом на шестом (ИФН-γ) и восьмом (ИФН-α) визитах и с последующим возрастанием к девятому визиту.
ИЛ-10 относится к числу противовоспалительных цитокинов. Он ингибирует продукцию всех провоспалительных цитокинов макрофагами, экспрессию рецепторов TNF-α и ИЛ-12 на естественных киллерах. Избыток ИЛ-10 ведет к снижению противоинфекционной защиты и развитию хронических инфекций. Способность ИЛ-10 ингибировать продукцию ИЛ-1, -6, TNF-α макрофагами связана с его способностью угнетать продукцию ИЛ-12 (Хаитов, 2019). Полученные данные показывают, что содержание ИЛ-10 в сыворотке крови больных из опытной группы несколько повышается к восьмому визиту, когда наблюдается снижение продукции ИФН-α, с последующим уменьшением его уровня к девятому визиту. При этом уровень ИЛ-10 не достигает критических ингибирующих значений.
Существенного увеличения концентрации субъединицы ИЛ-12р40 в сыворотке крови больных, леченных Фортепреном®, по сравнению с контрольной группой, отмечено не было. В то же время концентрации субъединицы ИЛ-12р70 в сыворотках пациентов опытной и контрольной групп изменялись противоположным образом, что свидетельствовало о стимуляции активной формы ИЛ-12 под действием Фортепрена®.
ИЛ-15 регулирует активацию и пролиферацию Т-лимфоцитов и естественных киллеров. Сигналы, которые поддерживают выживание Т-клеток памяти в отсутствие антигена, также обеспечиваются ИЛ-15 (Хаитов, 2019). В сыворотках контрольной группы содержание ИЛ-15 достигало максимальных значений к четвертому визиту, затем постепенно снижалось и возвращалось к исходному уровню в заключительной стадии исследования. Напротив, у пациентов, леченных препаратом Фортепрен®, концентрация ИЛ-15 в сыворотке повышалась вплоть до восьмого визита с последующим возвращением к контрольным значениям.
ИЛ-2 необходим для поддержания пролиферации Т-клеток, в том числе Т-хелперов (Th) и регуляторных Т-клеток. Этот цитокин не обнаруживался в сыворотках больных контрольной группы. Напротив, у больных, леченных препаратом Фортепрен®, он регистрировался на всех сроках исследования с пиком во время шестого визита.
ИЛ-4, продуцирующийся Т-хелперами типа 2, аутокринно регулирует их пролиферацию, обеспечивает рост и дифференцировку В-лимфоцитов. В контрольной группе этот цитокин регистрируется только на четвертом визите, тогда как в опытной группе он обнаруживался в течение всего периода исследования с некоторым снижением на шестой и восьмой визиты, когда наблюдалась максимальная активность Th1, регистрируемая по продукции ИЛ-12р70. Это согласуется с данными о том, что Th1 и Th2 активируются в противофазе и угнетают друг друга.
MIP-1α (macrophage inflammatory protein 1α) относится к СС-подсемейству хемокинов. Он продуцируется стимулированными лейкоцитами и обеспечивает хемотаксис и повышение концентрации внутриклеточного кальция. MIP-1α играет важную роль при активации Т-клеток, усиливая их пролиферацию, а также секрецию ИЛ-2 и экспрессию его рецептора (Хаитов, 2019). Достоверное увеличение продукции этого цитокина в сыворотках больных опытной группы, по сравнению с контрольной, отмечено на шестой и девятый визиты.
Уровень TNF-α существенно не изменялся в течение всего периода наблюдения и был несколько ниже у больных опытной группы.
При исследовании спонтанной и индуцированной в условиях in vitro продукции цитокинов лейкоцитами крови больных двух групп пациентов были получены результаты, во многом аналогичные описанным выше. Так, под действием вируса болезни Ньюкасла (NDV) лейкоциты больных опытной группы значимо сильнее продуцировали ИФН-α и ИФН-γ, по сравнению с клетками пациентов контрольной группы. Такая же закономерность выявлена и при исследовании продукции ИЛ-12р40, как после стимуляции клеток NDV, так и без дополнительной стимуляции.
Напротив, продукция лейкоцитами ИЛ-17А, основного цитокина Th17, участвующими в развитии аутоиммунных и аллергических реакций, а также в защите от внеклеточных патогенов, резко усиливается к девятому визиту у пациентов контрольной группы, тогда как после лечения Фортепреном® ИЛ-17А практически не обнаруживается в супернатантах лейкоцитов крови.
Ключевой цитокин, с которым связано иммуномодулирующее действие Фортепрена®, – ИЛ-1 также усиленно продуцировался клетками пациентов опытной группы во время девятого визита, по сравнению с контрольной группой. Этот эффект регистрировался как с неактивированными лейкоцитами, так и с лейкоцитами, активированными NDV или фитогемагглютинином (ФГА), и еще больше возрастал после дополнительного внесения в культуральную среду препарата Фортепрен®.
Следует отметить, что лейкоциты больных, леченных препаратом Фортепрен®, в условиях in vitro не продуцировали ИЛ-2. Это на первый взгляд не согласуется с результатами, полученными при исследовании сывороток крови. Различия могут быть связаны с тем, что за продукцию ИЛ-2, регистрируемого в сыворотке, отвечают резидентные, а не циркулирующие Т-клетки.
Цитокин ИЛ-6 синтезируется главным образом активированными макрофагами, в том числе и под воздействием ИЛ-1 и TNF-α, а также T-клетками. Он стимулирует иммунный ответ, выработку печенью белков острой фазы и служит одним из важнейших медиаторов острой фазы воспаления. ИЛ-6 усиливает пролиферацию и дифференцировку B- и T-клеток, а также лейкоцитопоэз. Не удивительно поэтому, что лечение препаратом Фортепрен® приводит к значительному усилению способности лейкоцитов продуцировать ИЛ-6 спонтанно, а также под воздействием NDV или ФГА.
Аналогичные данные получены и при исследовании двух других цитокинов той же группы – MIP-1α и TNF-α. В последнем случае также наблюдается некоторое противоречие с данными, приведенными выше. Однако это противоречие мнимое. Очевидно, TNF-α продуцируется и потребляется непосредственно в очаге воспаления, а его поступление в циркуляцию, следствием чего является повышение температуры тела, напротив, снижается после лечения.
Таким образом, проведенные исследования показали, что курс лечения препаратом Фортепрен® приводит к усилению продукции ключевых цитокинов (табл. 2), обеспечивающих защиту от вирусной инфекции (Pronin et al., 2016). При этом в результате терапии в группе плацебо, по сравнению с лечебной группой, повышаются 2 показателя – ИЛ-17А и ИЛ-2, свидетельствующие о возможном развитии иммуновоспалительных и аутоиммунных заболеваний, что не наблюдается в лечебной группе. Полученные данные позволяют предполагать, что воздействие препарата направлено прежде всего на клетки, отвечающие за естественную резистентность организма (макрофаги, дендритные клетки и др.). Именно активация естественного иммунитета, по-видимому, является ведущим механизмом защиты от герпесвирусной инфекции под воздействием Фортепрена®.
Таблица 2.
Продукция цитокинов клетками крови больных ГГ в контрольной (плацебо) и лечебной (Фортепрен®) группах до проведения терапии Фортепреном® (визит 1) и после терапии (визит 9)
| Показатель | Визит 1 | Визит 9 | ||
|---|---|---|---|---|
| Плацебо | Фортепрен® | Плацебо | Фортепрен® | |
| ИФН-α, NDV | 211.28 ± 74.89 | 241.0 ± 70.88 | 139.25 ± 47.08 | 592.79 ± 57.9 |
| ИФН-γ, NDV | 12.72 ± 7.97 | 11.56 ± 3.76 | 20.12 ± 12.65 | 40.04 ± 12.82 |
| ИЛ-12p40, NDV | 4.42 ± 1.1 | 4.34 ± 1.13 | 5.7 ± 2.0 | 9.66 ± 2.21 |
| ИЛ-12p40 | 4.25 ± 0.11 | 3.15 ± 0.8 | 14.35 ± 8.12 | 25.58 ± 4.9 |
| ИЛ-17А | 0.1 ± 0.16 | 0.37 ± 0.09 | 6.46 ± 4.9 | 0.77 ± 0.16 |
| ИЛ-1β, NDV | 1.14 ± 0.7 | 0.95 ± 0.7 | 40.95 ± 28.96 | 181.49 ± 18.02 |
| ИЛ-1β, NDV + Фортепрен® | 1.06 ± 0.75 | 3.22 ± 2.31 | 24.67 ± 17.44 | 227.79 ± 65.09 |
| ИЛ-1β, ФГА | 17.36 ± 0.92 | 9.56 ± 2.93 | 53.04 ± 35.06 | 203.14 ± 55.02 |
| ИЛ-1β | 2.67 ± 1.88 | 1.16 ± 1.06 | 71.5 ± 50.56 | 223.38 ± 40.0 |
| ИЛ-2 | 0 | 0 | 6.87 ± 4.86 | 0 |
| ИЛ-6, NDV | 27.07 ± 2.58 | 15.94 ± 4.52 | 291.16 ± 129.07 | 835.67 ± 149.06 |
| ИЛ-6, ФГА | 487.07 ± 103.66 | 297.28 ± 108.04 | 466.97 ± 204.92 | 1837.7 ± 112.9 |
| ИЛ-6 | 13.29 ± 8.95 | 7.47 ± 5.17 | 184.7 ± 82.51 | 1045.64 ± 250.74 |
| MIP-1α, NDV | 268.86 ± 31.73 | 209.58 ± 51.98 | 1143.29 ± 498.02 | 2503.95 ± 149.06 |
| MIP-1α, NDV + Фортепрен® | 371.34 ± 149.17 | 380.19 ± 138.49 | 842.46 ± 369.07 | 3946.51 ± 151.79 |
| TNF-α, NDV | 22.84 ± 5.71 | 16.89 ± 5.52 | 229.88 ± 99.97 | 444.42 ± 71.19 |
| TNF-α | 6.19 ± 2.61 | 3.38 ± 0.68 | 97.05 ± 68.02 | 223.85 ± 77.02 |
ЗАКЛЮЧЕНИЕ
Как известно, ИФН обладают универсальным механизмом подавления репродукции вирусов и блокируют трансляцию вирусных мРНК на рибосомах инфицированных клеток, то есть на стадии, без которой невозможен синтез вирусных белков. Помимо противовирусного действия, что не менее важно, препараты ИФН являются важными факторами врожденного иммунитета и контролируют латенцию вирусов герпеса. ИФН-α, -β и особенно -γ осуществляют взаимосвязь между лимфоцитами и макрофагами, а также регулируют соотношение клеточных и гуморальных составляющих иммунного ответа (Ершов, Наровлянский, 2011; Хаитов, 2019).
На основании полученных нами данных и данных из литературных источников как новое направление в лечении ГГ предлагается включение в традиционную терапию препаратов ИФН и индукторов ИФН, которые нормализуют работу систем иммунитета и ИФН у больных. Эти препараты могут быть использованы профилактически в монотерапии герпесвирусных инфекций (в период ремиссий ГГ) и в комплексной терапии с базисными этиотропными средствами (во время рецидивов). Проведенные клинические исследования показали, что терапия ГГ с помощью разработанных в Национальном исследовательском центре эпидемиологии и микробиологии им. Н.Ф. Гамалеи препаратов приводит к нормализации иммунологических показателей, в частности к восстановлению синтеза и продукции ИФН-α и ИФН-γ. Параллельно такое лечение приводит к снижению тяжести течения ГГ и к более раннему исчезновению признаков заболевания по сравнению с больными, получавшими только общепринятую терапию. Предлагаемый подход в 1.5–3 раза снижает частоту, остроту и длительность рецидивов ГГ по сравнению с пациентами, получавшими только базисную терапию (Седов и др., 2018; Pronin et al., 2016).
В целом, для лечения больных ГГ с частыми рецидивами нами рекомендуется персонифицированная терапия, сочетающая использование известных этиотропных химиопрепаратов с дополнительной иммунотерапией заболевания новыми отечественными препаратами (Виферон®, Циклоферон®, Кагоцел®).
Список литературы
Аковбян В.А., Масюкова С.А., Владимирова Е.В. и др. Генитальный герпес: современные проблемы и пути их решения // Клин. микробиол. антимикроб. химиотерап. 2003. Т. 5. № 1. С. 4–18.
Баринский И.Ф., Махмудов Ф.Р. Герпес. Баку: Victory, 2013. 352 с.
Батуев Ю.М., Березина Л.К., Наровлянский А.Н. и др. Активность Фоспренила на модели медоносной пчелы // Ветеринария. 2003. № 5. С. 26– 28.
Буданов П.В. Проблемы терапии рецидивирующего генитального герпеса // Вопр. гинекол. акуш. перинатол. 2004. Т. 3. № 4. С. 94– 98.
Буданов П.В. Рецидивирующий генитальный герпес // Иммунотерапия / Ред. Р.М. Хаитов, Р.И. Атауллаханов. М.: ГЭОТАР-Медиа, 2011. С. 423–433.
Васильев А.Н., Ожерелков С.В., Козлов В.В. и др. Противовирусная и иммуномодулирующая активность полипренилфосфатов при вирусных инфекциях // Антибиот. химиотер. 2008. Т. 53. № 3–4. С. 3–8.
Вирус простого герпеса. Информационный бюллетень ВОЗ. 2017.
Ганшина И.В., Судьина Г.Ф., Санина В.Ю. и др. Фосфорилированные полипренолы – новый класс соединений с противовоспалительной и бронхолитической активностью // Инфек. иммун. 2011. Т. 1. № 4. С. 355–360.
Гулюкин М.И., Санин А.В., Деева А.В. и др. Ветеринарная наука на страже продовольственной безопасности России // Аграр. наука. 2016. № 4. С. 21–23.
Деева А.В., Мищенко Н.К., Лобова Т.П. и др. Применение Фоспренила для профилактики и терапии при трансмиссивном гастроэнтерите свиней // Ветеринария. 2004. № 2. С. 12–15.
Деева А.В., Ракова Т.Н., Лобова Т.П. и др. Эффективность применения Фоспренила для повышения неспецифической резистентности организма и лечения острых вирусных инфекций у молодняка КРС // Ветерин. патол. 2005. № 1. С. 96–98.
Дементьева В.А., Мехдиханов Г.Г., Деева А.В. и др. Неспецифическая профилактика респираторных болезней птиц при аэрозольном применения Фоспренила // Ветеринария. 2007. № 12. С. 16–17.
Ершов Ф.И. Антивирусные препараты. Справочник (2-е издание). М.: ГЭОТАР-Медиа, 2006. 312 с.
Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЭОТАР-Медиа, 2005. 368 с.
Ершов Ф.И., Наровлянский А.Н. Интерфероны и индукторы интерферонов // Иммунотерапия / Ред. Р.М. Хаитов, Р.И. Атауллаханов. М.: ГЭОТАР-Медиа, 2011. С. 80–98.
Жавнис С.Э., Переслегина И.О., Санина А.А. Комплексное лечение коронавирусного гастроэнтерита у котят: клинический случай // Изв. Оренб. гос. аграр. унив. 2019. № 5 (79). С. 205–207.
Зайцева Л.Г., Бехало В.А., Васильев И.К. и др. Коррекция функциональной активности перитонеальных макрофагов мышей Фоспренилом и Гамавитом при введении высоких доз α-токсина Staphylococcus aureus // Журн. микробиол. эпидемиол. иммунобиол. 2005. № 6. С. 51–57.
Зайцева М.Л., Деева А.В., Андреева М.В. и др. Опыт применения Фоспренила при лечении инфекционных заболеваний лошадей // Мат. III конф. по уч.-мет., воспит. и науч.-практ. раб. акад. М.: МГАВМиБ им. К.И. Скрябина, 2006. С. 48–51.
Иммунопатогенез и лечение генитального герпеса и хламидиоза / Ред. В.А. Исаков, Ю.В. Аспель. Новгород, СПб.: НовГУ, 1999. 150 с.
Интерферон-2011 / Ред. Ф.И. Ершов, А.Н. Наровлянский. М., 2012. 512 с.
Исаков В.А., Гавриш Н.А., Пайкачева Ю.М. Эффективность препарата Кагоцел® в терапии рецидивирующего простого герпеса // Terra medica. 2010. № 2 (61). С. 9–12.
Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. Руководство для врачей. СПб.: СпецЛит, 2013. 677 с.
Каграманова Ж.А., Малиновская В.В., Парфенов В.В. Терапия рецидивирующей герпесвирусной инфекции у женщин препаратом Виферон-3 // Эффект. фармакотерап. акуш. гинекол. 2008. № 1. С. 33.
Кузнецова И.В., Хлыстова Е.А. Генитальный герпес: современные подходы к решению проблемы (обзор литературы) // Эффект. фармакотер. дерматовенерол. дерматокосметол. 2016. Вып. 1 (30). С. 48–56.
Малиновская В.В., Деленян Н.В., Ариненко Р.Ю. Виферон. М.: ИНКО-ТНК, 2007. 87 с.
Марченко Л.А. Генитальный герпес: патогенез, диагностика, лечение // Иммунотерапия / Ред. Р.М. Хаитов, Р.И. Атауллаханов. М.: ГЭОТАР-Медиа, 2011. С. 408–422.
Масалова О.В., Леснова Е.И., Онищук А.А. и др. Полипренилфосфаты индуцируют высокий гуморальный и клеточный ответ на иммунизацию рекомбинантными белками репликативного комплекса вируса гепатита С // Докл. РАН. 2018. Т. 482. № 4. С. 459–462.
Масюкова С.А., Гладько В.В., Егорова Ю.С., Устинов М.В. Кагоцел в лечении генитального герпеса // Герпес. 2006. № 2. С. 48–52.
Наровлянский А.Н., Березина Л.К., Веткова Л.Г. и др. Лечение герпесвирусных инфекций с помощью препаратов полипренолов // Ветерин. клин. 2005. № 2 С. 11–15.
Наровлянский А.Н., Васильев А.Н., Савойская С.Л. и др. Система изопреноидов: роль в противовирусном иммунитете // Ведом. Науч. центра эксперт. средств мед. примен. 2007. № 3. С. 66–78.
Наровлянский А.Н., Дерябин П.Г., Седов А.М. и др. Противовирусная активность полипренилфосфатов при экспериментальной инфекции, вызванной вирусом гепатита С in vitro // Журн. микробиол. эпидемиол. иммунол. 2012. № 5. С. 80–84.
Наровлянский А.Н., Ожерелков С.В., Санин А.В. и др. Противовирусная активность и возможные механизмы действия морапренилфосфатов при экспериментальной инфекции, вызванной вирусом простого герпеса 1 типа // Журн. микробиол. эпидемиол. иммунол. 2014. № 5. С. 54–60.
Наровлянский А.Н., Седов А.М., Пронин А.В. и др. Лечение больных с хронической рецидивирующей герпесвирусной инфекцией генитальной локализации: клиническое исследование препарата Фортепрен // Журн. микробиол. эпидемиол. иммунол. 2015а. № 4. С. 112–118.
Наровлянский А.Н., Иванова А.М., Шевлягина Н.В. и др. Эффективность применения полипренилфосфатов в экспериментальной модели генитального герпеса // Вопр. вирусол. 2015б. Т. 60. № 4. С. 9–13.
Ожерелков С.В., Тимофеев А.В., Новикова Г.П. и др. Защитное действие нового противовирусного препарата Фоспренил при экспериментальном клещевом энцефалите // Вопр. вирусол. 2000. Т. 45. № 1. С. 33–37.
Ожерелков С.В., Белоусова Р.В., Данилов Л.Л. и др. Препарат Фоспренил подавляет размножение вирусов диареи и инфекционного ринотрахеита крупного рогатого скота в чувствительных культурах клеток // Вопр. вирусол. 2001. Т. 5. С. 43–45.
Ожерелков С.В., Калинина Е.С., Кожевникова Т.Н. и др. Экспериментальное исследование феномена антителозависимого усиления инфекционности вируса клещевого энцефалита in vitro // Журн. микробиол. эпидемиол. иммунобиол. 2008. № 6. С. 39–43.
Ожерелков С.В., Деева А.В., Санин А.В. и др. Полипренилфосфаты как адъюванты, поляризующие иммунный ответ в сторону Th1 // Инфек. иммун. 2012. Т. 2. № 3. С. 645–650.
Ожерелков С.В., Кожевникова Т.Н., Наровлянский А.Н. и др. Противовирусное действие препаратов Фоспренил и Гамапрен в отношении флавивирусов // Ветерин. кормл. 2017. № 3 С. 78–80.
Переслегина И.О., Жавнис С.Э. Достижение ремиссии при комплексной терапии кошачьего инфекционного перитонита: клинический случай // Ветеринария. 2019. № 6. С. 48–52.
Переслегина И.О., Виденина А.А., Наровлянский А.Н. и др. Новое в лечении кошачьего инфекционного перитонита // Рос. ветерин. журн. мелк. дом. дик. животн. 2013. № 1. С. 6–10.
Пронин А.В., Ожерелков С.В., Наровлянский А.Н. и др. Роль цитокинов в иммуномодулирующих эффектах фосфатов полипренолов – противовирусных препаратов нового поколения // Russ. J. Immunol. 2000. V. 5. № 2. P. 155–164.
Пронин А.В., Григорьева Е.А., Санин А.В. и др. Полипренолы как возможные факторы, определяющие инструктивную роль естественного иммунитета в развитии приобретенного иммунного ответа // Рос. иммунол. журн. 2002. Т. 7. № 2. С. 135–142.
Рахматулина М.Р. Интерферон-гамма в терапии генитального герпеса // Инфекц. болезни. 2007. № 3. С. 76–79.
Ростроса П.А., Санин А.В., Наровлянский А.Н. и др. Повышение естественной резистентности и выживаемости норок при неблагополучии по алеутской болезни // Рос. ветерин. журн. 2019. № 6. С. 14–19.
Руднева С.Ю., Наровлянский А.Н., Пронин А.В. и др. Лечение папилломатоза ротовой полости у собаки с использованием Фоспренила // Рос. ветерин. журн. мелк. дом. дик. животн. 2016. № 3. С. 9–11.
Савойская С.Л., Кожевникова Т.Н. Эффективность Фоспренила при лечении парвовирусного энтерита собак // Ветеринар. кормл. 2019. № 7. С. 22–24.
Савойская С.Л., Клицунова Н.В., Наровлянский А.Н. и др. Эффективность препарата Гамапрен при лечении аденовироза и парагриппа собак // Ветерин. доктор. 2008. № 11. С. 15–16.
Самгин М.А., Халдин А.А. Простой герпес: дерматологические аспекты. М.: МЕДпресс-информ, 2002. 160 с.
Санин А.В. Применение иммуномодуляторов при вирусных заболеваниях мелких домашних животных // Рос. ветерин. журн. мелк. дом. дик. животн. 2005. № 1. С. 38–42.
Санин А.В., Наровлянский А.Н., Ожерелков С.В. и др. Иммуномодуляторы в ветеринарной практике – применение и противоречия // Ветерин. клин. 2008. № 10. С. 10–12.
Санин А.В., Савойская С.Л., Васильев И.К. и др. Применение Гамапрена при лечении вирусных инфекций у кошек // Ветерин. Кубани. 2009. № 6. С. 29–30.
Санин А.В., Суслов А.П., Третьяков О.Ю. и др. Разнонаправленное влияние MIF и полипренилфосфата на течение экспериментальной флавивирусной инфекции у мышей // Журн. микробиол. эпидемиол. иммунол. 2011а. № 5. С. 56– 61.
Санин А.В., Наровлянский А.Н., Пронин А.В. Иммуномодуляторы в сельском хозяйстве – дань моде или необходимость // Рос. ветерин. журн. сел.-хоз. животн. 2011б. № 1. С. 37–40.
Санин А.В., Виденина А.А., Наровлянский А.Н., Пронин А.В. О применении иммуномодуляторов в птицеводстве // Птица и птицепрод. 2011в. № 6. С. 34–36.
Санин А.В., Суханова С.А., Проскурина О.В. и др. Исследование противовоспалительной активности фоспренила в эксперименте // Рос. ветерин. журн. мелк. дом. дик. животн. 2011г. № 4. С. 17–20.
Санин А.В., Пронин А.В., Наровлянский А.Н. и др. Действие полипренилфосфата натрия на вирус ринотрахеита кошек // Ветеринария. 2015. № 11. С. 17–21.
Санин А.В., Наровлянский А.Н., Пронин А.В. и др. Изучение антиоксидантных свойств Фоспренила в различных биологических тест-системах // Рос. ветерин. журн. мелк. дом. дик. животн. 2017. № 10. С. 28–31.
Санин А.В., Наровлянский А.Н., Пронин А.В. и др. Экспериментальное изучение противовирусной активности Гамапрена при герпесвирусной инфекции in vitro // Рос. ветерин. журн. мелк. дом. дик. животн. 2018а. № 3. С. 28–33.
Санин А.В., Анников В.В., Анникова Л.В. и др. Клиническая эффективность Гамапрена® при панлейкопении кошек: контролируемое исследование // Ветерин. кормл. 2018б. № 5. С. 45–48.
Санин А.В., Наровлянский А.Н., Пронин А.В. и др. Влияние Гамапрена на продукцию регуляторных цитокинов при экспериментальной флавивирусной инфекции у мышей // Рос. ветерин. журн. мелк. дом. дик. животн. 2018в. № 4. С. 18–24.
Санин А.В., Наровлянский А.Н., Пронин А.В. и др. Лечебно-профилактическая эффективность Гамапрена при экспериментальной инфекции мышей, вызванной вирусом простого герпеса 1 типа // Ветерин. Кубани. 2018г. № 3. С. 15–19.
Седов А.М., Наровлянский А.Н., Пронин А.В. и др. Механизм противовирусного действия и оценка эффективности нового препарата Фортепрен® при комплексной терапии хронической рецидивирующей герпесвирусной инфекции генитальной локализации // Журн. микробил. эпидемиол. иммунобиол. 2018. № 5. С. 81–87.
Силина Л.В., Бибичева Т.В. Рецидивирующий генитальный герпес // Иммунотерапия / Ред. Р.М. Хаитов, Р.И. Атауллаханов. М.: ГЭОТАР-Медиа, 2011. С. 434–450.
Соколова Т.М., Шувалов А.Н., Полосков В.В., Ершов Ф.И. Стимуляция генов сигнальной трансдукции препаратами Ридостин, Циклоферон и Ингавирин // Циток. воспал. 2015. № 2. С. 26–34.
Тутушкина Т.В., Шульженко А.Е. Влияние терапии кагоцелом на показатели иммунограммы пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции // Физиол. патол. иммун. сист. 2004. Т. 4. С. 24–30.
Федеральные клинические рекомендации по ведению больных генитальным герпесом. М.: РОДВК, 2015. 14 с.
Фурман И.М., Васильев И.К., Наровлянский А.Н. и др. Применение препаратов на основе растительных полипренолов при различных формах кошачьего инфекционного перитонита // Рос. ветерин. журн. мелк. дом. дик. животн. 2010. № 3. С. 42–43.
Хаитов Р.М. Иммунология: структура и функция иммунной системы. М.: ГЭОТАР-Медиа, 2019. 328 с.
Халдин А.А., Игнатьев Д.В. Новый индуктор интерферона Кагоцел® в терапии простого герпеса: возможности и перспективы // Эффектив. фармакотер. дерматовенерол. дерматокосметол. 2011. № 2. С. 14–18.
Хрянин А.А., Корниенко М.В., Титенко А.В. Эпидемиологические особенности герпесвирусной инфекции: многолетние тенденции // Мед. образов. в Сибири. 2015. № 3. С. 38.
Чернова С.И., Пронин А.В., Наровлянский А.Н., Санин А.В. Воспалительные процессы в эволюции атеросклероза и их коррекция полиизопреноидами // Терапевт. 2012. № 4. С. 15–21.
Шперлинг Н.В., Венгеровский А.И., Шперлинг И.А. и др. Клиническая эффективность интерферонотерапии в лечении рецидивирующего генитального герпеса // Клин. дерматол. венерол. 2010. № 1. С. 69–72.
Шульженко А.Е., Тутушкина Т.В. Структура иммунных изменений у пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции (ХРГВИ) на фоне терапии Кагоцелом // Клин. фармакол. терап. 2004. № 13 (2). С. 74–76.
Шульженко А.Е., Зуйкова И.Н. Иммунотерапия герпесвирусных инфекций // Иммунотерапия / Ред. Р.М. Хаитов, Р.И. Атауллаханов. М.: ГЭОТАР-Медиа, 2011. С. 398–407.
Blanc M., Hsieh W.Y., Robertson K.A. et al. Host defense against viral infection involves interferon mediated down-regulation of sterol biosynthesis // PLoS Biol. 2011. V. 9. № 3. P. 1–19.
Chentoufi A., BenMohamed L. Mucosal herpes immunity and immunopathology to ocular and genital herpes simplex virus infections // Clin. Dev. Immunol. 2012. V. 2012. Art. 149135. P. 1–22.
Ershov F.I., Narovlyansky A.N., Pronin A.V., Sanin A.V. Genital herpes in Russia: the scope of the problem and treatment prospects // Advances in medicine and biology. Ch. 6. / Ed. L.V. Berhardt. N.Y.: Nova Science Publishers, Inc., 2017. V. 124. P. 121–174.
Guo H., Omoto Sh., Harris P.A. et al. Herpes simplex virus suppresses necroptosis in human cells // Cell Host. Microb. 2015. V. 17. P. 243–251.
Gupta R., Warren T., Wald A. Genital herpes // Lancet. 2007. V. 370. P. 2127–2137.
Hofstetter A.M., Rosenthal S.L., Stanberry L.R. Current thinking on genital herpes // Curr. Opin. Infect. Dis. 2014. V. 27. № 1. P. 75–83.
Kumari P., Narayanan S., Kumar H. Herpesviruses: interfering innate immunity by targeting viral sensing and interferon pathways // Rev. Med. Virol. 2015. V. 25. № 3. P. 187–201.
Legendre A.M., Kuritz T., Galyon G. et al. Polyprenyl immunostimulant treatment of cats with presumptive non-effusive feline infectious peritonitis in a field study // Front. Vet. Sci. 2017a. V. 4. P. 7–20.
Legendre A.M., Kuritz T., Heidel R.E., Baylor V.M. Polyprenyl immunostimulant in feline rhinotracheitis: randomized placebo-controlled experimental and field safety studies // Front. Vet. Sci. 2017b. V. 4. P. 24.
Leung D.N., Saks S.L. Current recommendation for the treatment of genital herpes // Drugs. 2000. V. 60. P. 1329–1352.
Looker K.J., Magaret A.S., Turner K.M.E. et al. Global estimates of prevalent and incident herpes simplex virus type 2 infections in 2012 // PLoS One. 2015. V. 10 (1). P. e114989.
Matis J., Kúdelová M. HSV-1 ICP0: paving the way for viral replication // Fut. Virol. 2011. V. 6. № 4. P. 421–429.
Paludan Sr.R., Bowie A.G., Horan K.A., Fitzgerald K.A. Recognition of herpesviruses by the innate immune system // Nat. Rev. Immunol. 2011. V. 11. P. 143–154.
Pronin A.V., Narovlyansky A.N., Shulzhenko A.E. et al. New polyprenyl phosphate based preparation Fortepren as promising cytokine regulating antiviral remedy // Cytok. Grow. Fact. Rev. 2016. P. 119–126.
Randall R.E., Goodbourn S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures // J. Gener. Virol. 2008. V. 89 (1). P. 1–47.
Shin H., Iwasaki A. Generating protective immunity against genital herpes // Tr. Immunol. 2013. V. 34 (10). P. 487–494.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии