Успехи современной биологии, 2020, T. 140, № 4, стр. 359-377
Респираторные РНК-вирусы: как подготовиться к встрече с новыми пандемическими штаммами
С. В. Чепур 1, *, Н. Н. Плужников 1, О. В. Чубарь 1, Л. С. Бакулина 2, И. В. Литвиненко 3, В. А. Макаров 4, А. С. Гоголевский 1, В. А. Мясников 1, И. А. Мясникова 1, Р. И. Аль-Шехадат 1
1 Государственный научно-исследовательский испытательный институт военной медицины Минобороны России
Санкт-Петербург, Россия
2 Воронежская государственная медицинская академия им. акад. Н.Н. Бурденко
Воронеж, Россия
3 Военно-медицинская академия им. С.М. Кирова
Санкт-Петербург, Россия
4 Федеральный исследовательский центр “Фундаментальные основы биотехнологии” РАН
Москва, Россия
* E-mail: gniiivm_2@mail.ru
Поступила в редакцию 20.04.2020
После доработки 20.04.2020
Принята к публикации 20.04.2020
Аннотация
Изложены особенности биологии вирусов гриппа и коронавирусов, определяющие реализацию инфекционного процесса. С учетом патогенеза инфекции рассмотрены возможные эффекты блокаторов сериновых протеиназ, гепарина и блокаторов гепарансульфатных рецепторов в профилактике контаминации клеток вирусами. Определена необходимость применения хелаторов металлов переменной валентности и антиоксидантов для снижения репликативной активности вирусов и противовоспалительной терапии. Возможность pH-зависимого нарушения гликозилирования клеточных и вирусных белков прослежена для хлорохина и его производных. Применение низкотоксичных лекарственных средств в составе вспомогательной терапии повышает эффективность противовирусных синтетических препаратов и интерферонов, обеспечивает безопасность применения средств базисной терапии.
ВВЕДЕНИЕ
Человечество с мистической регулярностью сталкивается с появлением новых, ранее неизвестных штаммов вирулентных респираторных вирусов, угрожающих гибелью большому количеству людей. Особую эпидемическую/пандемическую опасность представляют вирусы гриппа и коронавирусы, с которыми человек контактирует с древнейших времен.
Считают, что первая крупная вспышка респираторной инфекции, по клиническим проявлениям похожая на грипп, детально описана Гиппократом еще в 412 г. до н.э. как заразный “перинфский кашель” (Kuszewski, Brydak, 2000; Pappas, 2008). Следующий подробный письменный отчет об эпидемическом респираторном заболевании, сходном с гриппом и получившим название “крестьянская лихорадка” 1173–1174 гг., был составлен лишь полторы тысячи лет спустя в Англии (Potter, 2001). Первая пандемия гриппа четко задокументирована в 1580 г. (Potter, 2001; Daly et al., 2007). И тогда же, в XVI в., эта инфекционная напасть получила название “инфлюэнца” (influentia – влияние, лат.), поскольку данную болезнь в то время считали плохим “влиянием небес” (Broxmeyer, 2006). С тех пор зафиксирована тридцать одна пандемия гриппа, три из которых наблюдали в ХХ в. и одну уже в ХХI в. (Kilbourne, 2006; Daly et al., 2007; Al-Muharrmi, 2010) (табл. 1).
Таблица 1.
Пандемии гриппа последних ста лет
| Пандемия (название) | Годы | Штамм | Количество умерших (млн чел.) |
|---|---|---|---|
| Испанский грипп | 1918–1920 | H1N1 | 40–50 |
| Азиатский грипп | 1957–1958 | H2N2 | 1–2 |
| Гонконгский грипп | 1968–1970 | H3N2 | 0.5–2 |
| Свиной грипп | 2009–2010 | H1N1 | 0.5 |
И хотя целенаправленный поиск патогенов, способных вызывать эпидемии/пандемии острых респираторных инфекций, был начат с конца XIX в. (Pfeiffer, 1893; Olitsky, Gates, 1921a,b), только в 1933 г. был выделен вирус гриппа типа А “mixovirus influenza” (Smith et al., 1933). Вирусы гриппа типов В и С были идентифицированы в 1940 г. и 1947 г. соответственно (Francis, 1940; Taylor, 1949), только в 2011 г. изолирован и охарактеризован вирус гриппа типа D (Hause et al., 2013; Ducatez et al., 2015).
Коронавирусы также распространены повсеместно (Suzuki et al., 2005; Koetz et al., 2006; Sloots et al., 2006; Zhao et al., 2008) и с древности, по-видимому, контактируют с человеком (Wertheim et al., 2013). До недавнего времени полагали, что коронавирусные инфекции, проявляющиеся лишь симптомами простуды, вызывают от 15 до 35% сезонных острых респираторных заболеваний. Дети болеют в 5–7 раз чаще взрослых (McIntosh et al., 1970; Callow et al., 1990; Holmes, 2001). У человека острые респираторные инфекции вызывают два вида α-коронавирусов (229E и NL63) и два вида β-коронавирусов (OC43 и HKU1) (Gaunt et al., 2010). Вместе с тем, ветеринарам давно известно, что коронавирусы способны вызывать фатальные респираторные и кишечные инфекции у животных (Pensaert, 1999). Коронавирусы как потенциальная биологическая угроза бросили реальный вызов современной медицине. В последние десятилетия часто возникают новые пандемические штаммы коронавирусов, чрезвычайно опасные для человека: коронавирус тяжелого респираторного синдрома (SARS-CoV, 2002/2003), коронавирус ближневосточного респираторного синдрома (MERS-CoV, 2012), коронавирус пневмонии нового типа (COVID-19, 2019/2020) – способные вызывать тяжелые, часто с неблагоприятным исходом, бронхиолиты и пневмонии (Cherry, 2004; Ramadan, Shaib, 2019; Hui et al., 2020).
Коронавирусы человека впервые были выделены от больных с острыми респираторными заболеваниями в 1965 г. (Hamre, Procknow, 1966; Tyrrell, Bynoe, 1966). Их структурная особенность, выявляемая при электронной микроскопии как корона, нашла отражение в их названии – коронавирусы (Tyrrell et al., 1975). В последующие почти три десятилетия (до появления пандемических штаммов) коронавирусы мало привлекали внимание исследователей.
Очевидно, что пандемии респираторных вирусных инфекций преследовали человечество в прошлом, и нет никаких оснований полагать, что этого не будет происходить в будущем. Время и место появления новых пандемий, вирулентность пандемических штаммов вирусов не поддаются прогнозированию.
ОСОБЕННОСТИ БИОЛОГИИ ВИРУСОВ ГРИППА И КОРОНАВИРУСОВ
Вирусы гриппа относят к семейству ортомиксовирусов (Orhtomyxoviridae – РНК-вирусы с сегментированным геномом) и распределяют между четырьмя монотипическими родами: вирусы гриппа А (Alphainfluenza virus), вирусы гриппа В (Betainfluenza virus), вирусы гриппа С (Gammainfluenza virus) и вирусы гриппа D (Deltainfluenza virus), каждый из которых представлен только одним одноименным типом вируса. Считают, что только вирусы гриппа А обладают пандемическим потенциалом (Bouvier, Palese, 2008; Spickler, 2016; King et al., 2018). В зависимости от антигенных свойств гемагглютинина НА (гликопротеин оболочки вириона, обеспечивающий распознавание клеток-мишеней и связывание вирусных частиц с концевыми остатками сиаловых кислот гликопротеинов плазматической мембраны эпителиоцитов) и нейраминидазы NA (экзо-α-сиалидаза, катализирующая расщепление гликозидных связей концевых остатков сиаловых кислот олигосахаридов, гликопротеинов, гликолипидов и обеспечивающая тем самым выход дочерних вирионов гриппа из зараженных клеток) вирусы гриппа А подразделяют на подтипы.
Всего существует 18 известных серотипов гемагглютинина (Н1–Н18) и 11 выявленных серотипов нейраминидазы (N1–N11), поэтому теоретически возможно образование 198 различных комбинаций этих белков – подтипов вируса гриппа А (Skehel, 2009; Tong et al., 2013; Quan et al., 2016; Kosik, Yewdell, 2019; Zhao et al., 2019), из которых более 120 сочетаний идентифицировано в природе (Tsai, Chen, 2011; Rejmanek et al., 2015).
Восемь негативно-полярных сегментов РНК-генома вируса гриппа кодируют не менее 10 структурных и 9 регуляторных белков (Varga et al., 2011; Muramoto et al., 2013; Hutchinson et al., 2014; Vasin et al., 2014). Некоторая неопределенность относительно протеома вирусов гриппа А связана с тем, что, в отличие от большинства РНК-вирусов, транскрипция и трансляция их генома происходит в ядре, а не в цитоплазме инфицированных клеток. Это позволяет вирусам гриппа А (рис. 1) эксплуатировать клеточную машинерию сплайсинга для образования сплайс-вариантов вирусных мРНК. Кроме того, для расширения своего протеома вирусы гриппа А, по-видимому, используют альтернативные открытые рамки считывания.
Рис. 1.
Структурные элементы вируса гриппа типа А. НА – гемагглютинин (тример), NA – нейраминидаза (тетрамер), М1 – матричный белок 1, М2 – матричный белок 2, МЕ – фосфолипидная мембрана, NEP – белок ядерного экспортера, RNA – негативно-полярная РНК в составе рибонуклеопротеиновых сегментов, NP – нуклеокапсидный белок, PA – кислый полимеразный белок, РВ1 – основной полимеразный белок 1, PB2 – основной полимеразный белок 2.
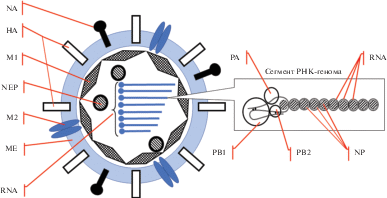
Большая часть вирусных белков локализована внутри вирусной липидной оболочки и только НА и NA в молярном соотношении ~10:1 (Mitnaul et al., 2000) и протеин М2, встроенные в оболочку вириона, несут антигенные детерминанты, доступные для воздействия иммунных антител (Kosik, Yewdell, 2019). Молекулы НА и NA – обильно гликозилированные белки, что обеспечивает их функциональную активность и уклонение от защитных иммунных реакций посредством экранирования антигенных детерминант (Kim et al., 2018; York et al., 2019).
В отличие от вирусов гриппа, коронавирусы представляют собой оболочечные РНК-вирусы (с несегментированной положительно-полярной РНК) отряда Nidovirales, семейства Coronaviridae, подсемейства Orthocoronavirinae (Fehr, Perlman, 2015). Вирионы коронавирусов имеют сферическую форму с характерными булавовидными выступами (Neuman et al., 2006; Barcena et al., 2009) (рис. 2). Оболочку вирионов формирует липидный бислой, в котором фиксированы S-, M- и E-протеины (Lai, Cavanagh, 1997; De Haan, Rottier, 2005).
Рис. 2.
Структурные элементы вириона коронавируса. SP – S-белок (тример), МР – димер мембранного протеина в различных конформациях, ЕР – трансмембранный оболочечный белок, МЕ – фосфолипидная мембрана, RNA – РНК (положительно полярная), NP – нуклеокапсидный белок.
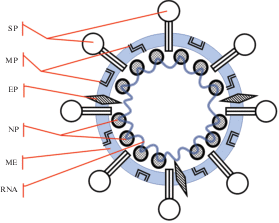
SP функционирует в виде обильно гликозилированных тримерных комплексов (Zheng et al., 2017; Parsons et al., 2019), обеспечивает взаимодействие вириона с рецепторами эпителиальных клеток и последующую интернализацию вирусного генома (Li, 2016).
MP функционирует в форме димера с гликозилированным N-концевым эктодоменом (Nal et al., 2005) и может принимать два различных конформационных состояния. Конформеры этого гликопротеина обеспечивают сборку вирусной частицы и придание ей формы (Neuman et al., 2011).
EP – трансмембранный белок, присутствует в малом количестве, выполняет несколько функций: сборка вириона, формирование оболочки и выделение из клетки вирусной частицы. Получены косвенные указания на то, что они представляют собой гликопротеины (Schoeman, Fielding, 2019).
NP – единственный протеин, присутствующий внутри вириона и обеспечивающий упаковку вирусного генома (McBride et al., 2014).
Обращает на себя внимание то, что, как и в случае вирусов гриппа А, оболочечные белки коронавирусов – гликопротеины.
Процесс проникновения вируса гриппа в клетку состоит из нескольких этапов. Критически важный момент жизненного цикла вируса гриппа – распознавание специфических клеточных рецепторов, представляющих собой гликопротеины или гликолипиды, гликан которых содержит концевую α2,6- или α2,3-сиаловую кислоту (Leung et al., 2012; Byrd-Leotis et al., 2017). Прикрепление HA вириона к сиалилированным гликопротеинам, гликолипидам плазматической мембраны эпителиоцитов инициирует различные механизмы эндоцитоза, быстро приводящего к формированию эндосом, в каждую из которых заключена вирусная частица (Chardonnet, Dales, 1970; Matlin et al., 1981; Kartenbeck et al., 1989; Rojek et al., 2008; Nanbo et al., 2010; Watanabe et al., 2010; Boulant et al., 2015).
Следующий этап интернализации – выделение генома вируса (РНК-сегментов) в цитозоль клетки – зависит от активности Na+/K+-АТФазы, локализованной в эндосомальной мембране и функционирующей в качестве протонной помпы. Na+/K+-АТФаза обеспечивает закисление среды внутри эндосом/лизосом до значения рН = 5.0 (Cain et al., 1989). Закисление внутриэндосомальной среды, то есть накопление протонов Н+ в объеме эндосом, позволяет реализовать протонофорный потенциал тетрамеров М2-протеина оболочки вирусной частицы (Sugrue, Hay, 1991; Pinto et al., 1992; Manzoor et al., 2017). Проникновение ионов водорода внутрь вирусной частицы опосредует конформационные изменения и декомпозицию структурных компонент оболочки вириона и, в конечном итоге, приводит к лабилизации его генома (Shibata et al., 1983; Yoshimura, Ohnishi, 1984). Однако слияние оболочки вирусной частицы и эндосомальной мембраны, обеспечивающее выход РНК-генома вируса в цитозоль клетки, возможно только при участии в этом процессе HA вириона, прошедшего предварительный протеолитический процессинг сериновыми (секреторными трипсин-подобными) протеиназами (Klenk, 1975; Lazarowitz, Choppin, 1975; Tashiro et al., 1987; Steinhauer, 1999; Kido et al., 2009).
Транслокация РНК-сегментов генома вируса гриппа из цитозоля в ядро клетки необходима для их репликации, в ходе которой вирусные мРНК из ядра выходят в цитозоль для синтеза белков вирусных частиц. Самосборка вирионов происходит на апикальной части плазматической мембраны эпителиоцитов, где сосредоточены молекулы HA и NA (Samji, 2009; Dou et al., 2018).
Процесс интернализации коронавирусов детерминирован функциональной активностью SP оболочки вириона. SP коронавирусов – обильно гликозилированная структура, обеспечивающая фиксирование вирусных частиц на плазматической мембране эпителиоцитов и последующее высвобождение их РНК-генома в цитозоль клетки (Li, 2016; Watanabe et al., 2020). Каждый SP располагает двумя локализованными на его S1-субъединице рецептор-связывающими доменами, которые способны взаимодействовать либо со специфическими белками, либо с сиалогликанами эпителиальных клеток (Li, 2012; Shahwan et al., 2013; Hulswit et al., 2019). Например, MERS-CoV преимущественно связывается с α2,3-связанной сиаловой кислотой (в меньшей степени с α2,6-связанной сиаловой кислотой) (Li et al., 2017). Подобной же тропностью к конъюгатам α2,3-сиаловой кислоты, по-видимому, обладают и вирусы COVID-19.
Интернализация вирусного генома может происходить либо посредством эндоцитоза вириона (процесс во многом аналогичен процессу интернализации вирусов гриппа), либо путем слияния оболочки коронавируса и плазматической мембраны эпителиоцита без образования эндосомы (непосредственно на плазматической мембране). Но в любом случае выделению РНК-генома вируса в цитозоль клетки предшествует осуществляемое сериновыми протеиназами протеолитическое отщепление S1-субъединицы и модулирование S2-субъединицы SP (Bosch et al., 2003; Belouzard et al., 2009; Simmons et al., 2013; Heurich et al., 2014; Zumla et al., 2016).
В цитоплазме эпителиальной клетки РНК-геном вируса функционирует как мРНК, когда репликационно-транскрипционный комплекс обеспечивает и репликацию РНК-генома, и синтез мРНК структурных белков вирусной частицы (Sola et al., 2015; Nakagawa et al., 2016). Вновь синтезированные белки коронавируса после посттрансляционного гликозилирования в цистернах аппарата Гольджи (Nal et al., 2005; Tseng et al., 2010) попадают в цитозоль и обеспечивают самосборку вирусных частиц, которые далее в составе везикул мигрируют к клеточной мембране и выходят из клетки посредством экзоцитоза (Fehr, Perlman, 2015; Lim et al., 2016).
Учитывая значимость сериновых протеиназ, гликопротеинов и гликолипидов в жизненном цикле вирусов гриппа и коронавирусов, логично сделать предположение о том, что факторы, модулирующие профиль гликозилирования протеинов и липидов эпителиоцитов и вирусов и контролирующие активность сериновых протеиназ на эпителиальной выстилке дыхательных путей, могут существенно ограничить вирулентность вирусов гриппа и коронавирусов.
ГЕНЕТИЧЕСКАЯ ЭВОЛЮЦИЯ ВИРУСОВ ГРИППА А И КОРОНАВИРУСОВ
Для вирусов гриппа при их циркуляции в условиях естественных природных резервуаров характерна высокая генетическая изменчивость, проявляющаяся в формировании квазисубтипов (иммунологически различающихся антигенных вариантов) вирусов А (Barbezange et al., 2018). Эта биологическая особенность – антигенный дрейф (Taubenberger, Kash, 2010) – обусловлена тем, что РНК-зависимая РНК-полимераза вирусов гриппа не имеет активного корректирующего сайта (Steinhauer et al., 1989; Cheung et al., 2014), что приводит к высокой частоте точечных мутаций в процессе репликации РНК-генома (в 300 раз чаще, чем при репликации ДНК-генома бактерий) (Drake, 1993). Другая их отличительная характеристика – высокая мутационная толерантность оболочечных гликопротеинов вирусных частиц, то есть способность НА и NA сохранять функциональную активность при существенных изменениях первичной структуры полипептидной цепи (Thyagarajan, Bloom, 2014; Visher et al., 2016).
Важный и распространенный феномен в эволюции вирусов гриппа типа А – антигенный сдвиг (Holmes, 2005; Dugan et al., 2008). Антигенный сдвиг – обмен РНК‑сегментами вирусного генома, кодирующими структуру НА и/или NA, в случаях одновременного инфицирования клетки несколькими штаммами вируса гриппа типа А (Taubenberger, Kash, 2010). Именно антигенный сдвиг позволяет новым субтипам вируса гриппа типа А преодолевать межвидовые барьеры (Scholtissek et al., 1978; Garten et al., 2009).
В репликации генома коронавирусов, в отличие от других РНК-вирусов, участвует РНК-зависимая РНК-полимераза, обладающая 3'-экзонуклеазной корректирующей активностью (Smith et al., 2014). В целях уклонения от механизмов иммунного реагирования организма человека и сохранения генотипа в популяции Homo sapiens, как показано на штамме HCoV-OC43, коронавирусы также поддерживают состояние антигенного дрейфа (Ren et al., 2015). Кроме того, геном коронавирусов эволюционирует и путем РНК–РНК-рекомбинаций (Keck et al., 1988; Huang et al., 2016; Forni et al., 2017). Гомологичная РНК-рекомбинация – перераспределение генетического материала путем обмена участками РНК-генома вирусов в условиях коинфекции (Makino et al., 1986; Lai, 1990; Lai, Cavanagh, 1997). Помимо уклонения от механизмов иммунного реагирования организма-хозяина, РНК-рекомбинация позволяет коронавирусам изменять профиль вирулентности, тканевой тропизм и преодолевать межвидовые барьеры (Haijema et al., 2003; Stavrinides, Guttman, 2004).
Высокая генетическая и фенотипическая изменчивость вирусов гриппа типа А и коронавирусов чревата приобретением данными патогенами устойчивости к средствам специфической профилактики и терапии, внезапным появлением новых вирулентных пандемических штаммов.
ПАНДЕМИИ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ И ПРОБЛЕМА ПНЕВМОНИЙ
Пандемия гриппа 1918–1920 гг. – наиболее фатальное событие в истории человечества, унесшее жизни более 50 млн человек (Johnson, Mueller, 2002). Смертность в период пандемий гриппа и коронавирусов в немалой степени ассоциирована с пневмониями (Morens et al., 2008; Metersky et al., 2012; Yin, Wunderink, 2018; Al-Baadani et al., 2019). Первичные вирусные пневмонии часто осложнены бактериальной коинфекцией, то есть переходят в вирусно-бактериальные и бактериальные пневмонии (Oswald et al., 1958; Bisno et al., 1971; Palacios et al., 2009; Gill et al., 2010; Martin-Loeches et al., 2011; Cilloniz et al., 2012). Поэтому среди инфекционистов распространено мнение, сформулированное Луи Крювелье еще в 1919 г.: “Грипп выносит приговор, а бактериальная флора приводит его в исполнение” (Cruveilhier, 1919, 448 p.).
Вместе с тем, клиническая картина тяжелых вирусных респираторных инфекций часто представлена симптомокомплексом первичной вирусной пневмонии. Возникновение первичных вирусных пневмоний при респираторных вирусных инфекциях, по-видимому, связано с копрезентацией гликопротеинов и гликолипидов, отличающихся наличием гликанов с терминальной α2,3-связанной сиаловой кислотой (выполняющей роль рецептора респираторных вирусов), с трансмембранной сериновой протеиназой TMPRSS2 (протеолитически активирующей НА и SP вирионов) на плазматических мембранах эпителиальных клеток альвеол и бронхиол (Ibricevic et al., 2006; Shinya et al., 2006; Kumlin et al., 2008; Bertram et al., 2010; Limburg et al., 2019; Tortorici et al., 2019).
Формирование предрасположенности к бактериальной коинфекции при респираторных вирусных пандемиях ассоциировано с множеством факторов:
– вирус-индуцированным дисбиотическим состоянием и нарушением барьерной функции эпителиальной выстилки дыхательных путей (Pittet et al., 2010; Ellis et al., 2015; Nita-Lazar et al., 2015; Hanada et al., 2018; Sencio et al., 2020);
– вирус-индуцированной дисфункцией эффекторных клеток иммунной системы (McNamee, Harmsen, 2006; Small et al., 2010; Ghoneim et al., 2013; Sun, Metzger, 2014) и иммуносупрессивной активностью цитокинов относительно антибактериального иммунитета (van der Sluijs et al., 2004; Cao et al., 2014; Shepardson et al., 2019);
– вирус-ассоциированной дисфункцией альвеолярно-капиллярного барьера (McAuley et al., 2007; Henkel et al., 2010; Short et al., 2016; Kamal et al., 2017) и супрессией активности ионных помп, обеспечивающих абсорбцию жидкости из просвета альвеол (Carlson et al., 2010; Peteranderl et al., 2016; Brand et al., 2018).
Пневмонии, ассоциированные с респираторными вирусными инфекциями, – независимый фактор тяжести заболевания и смертности (Maruyama et al., 2016; Ishiguro et al., 2017). То есть в значительной степени основная проблема тяжелых вирусных инфекций, как в прошлом, так и в настоящем – проблема вирусных, вирусно-бактериальных и вторичных бактериальных пневмоний.
ОБОСНОВАНИЕ НАПРАВЛЕНИЙ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ
Биология вирусов гриппа и коронавирусов с неизбежностью обусловливает появление их новых пандемических штаммов, время возникновения, генетические характеристики и антигенные свойства которых предсказать невозможно. То есть пандемии новых респираторных инфекций всегда будут начинаться в отсутствие средств специфической иммунной профилактики и терапии этих инфекций. Последнее предопределяет необходимость заблаговременного изыскания и разработки патогенетических средств и способов профилактики/терапии респираторных вирусных инфекций исходя из особенностей биологии коронавирусов и вирусов гриппа типа А.
Природа РНК-вирусов предполагает эффективность применения для базисной неспецифической терапии инфекций, вызванных ими, системного введения препаратов интерферона (виферон, интрон, реаферон и др.) с учетом вызываемой ими астенизации. Эффективность местного применения растворов интерферона сомнительна и может рассматриваться при наличии локальной симптоматики (ринит, фарингит и т.п.). Применение индукторов интерферонов (амиксин, циклоферон, неовир и др.) предполагает формирование через 10–14 сут. вторичной иммунодепрессии, что может в продолжающемся эпидемическом периоде привести к повторному инфицированию. К препаратам базисной противовирусной терапии относят и средства направленного действия, воздействующие на репликацию вирусного генома: осельтамивир, триазавирин и наиболее сильный, но и наиболее токсичный из препаратов данной группы рибавирин, а также противовирусные средства направленного действия (лопинавир, ритонавир, нельфинавир) (Yamamoto et al., 2020). Антирепликативная активность прослежена для производного пурина изопринозина, проявляющего свою активность в отношении вирусов гриппа А и В.
Современные знания о природе вирусов и формировании инфекционного процесса позволяют рассматривать возможность широкого применения средств патогенетической терапии, эффективность которых прослежена в различных исследованиях.
Известно, что сериновые протеиназы участвуют в обеспечении интернализации коронавирусов и вирусов гриппа типа А в эпителиальные клетки (Simmons et al., 2013; Garten et al., 2015). Активность трипсин-подобных протеиназ в верхних отделах дыхательных путей в значительной степени зависит от активности секреторных ингибиторов лейкопротеиназ, а в нижних отделах – от сурфактанта (Kido et al., 2004). В силу этого препараты, обладающие способностью индуцировать экспрессию ингибиторов секреторных лейкопротеиназ и сурфактанта и их прямые ингибиторы, могут значимо ингибировать мультициклическую репликацию РНК-вирусов.
Такими свойствами обладает кверцетин. Кверцетин в микромолярном диапазоне концентраций, помимо антиоксидантных эффектов: хелатирование металлов переменной валентности (Gholampour, Saki, 2019), стимулирование экспрессии антиоксидантных энзимов (Chen et al., 2017), прямого восстановления свободных радикалов жирнокислотных остатков фосфолипидов и окисленных форм витамина Е (Чепур и др., 2020; Ozgen et al., 2016), – ингибирует активность сериновых протеиназ (Xue et al., 2017; Jo et al., 2019) и экранирует активный центр НА вируса гриппа типа А (Wu et al., 2015), что и наделяет его широким спектром противовирусных эффектов (Zakaryan et al., 2017).
Транс-4-[[(2-амино-3,5-дибромфенил)метил]-амино]циклогексанола гидрохлорид (в виде амброксола или лазолвана) также привлекает внимание в качестве вспомогательного противовирусного средства (Yang et al., 2002; Yamaya et al., 2014). Спектр фармакологической активности амброксола, помимо его муколитического действия (Rogers, 2007), включает:
– антибактериальные и противобиопленочные эффекты (Lu et al., 2010; Li et al., 2011; Cabral-Romero et al., 2013; Cataldi et al., 2014);
– способность проявлять активность химического шаперона (Bendikov-Bar et al., 2013; Sanchez-Martinez et al., 2016), модулятора секреции сурфактанта (Yang et al., 2002; Seifart et al., 2005), оказывать противовоспалительное (Gibbs et al., 1999; Beeh et al., 2008; Gupta, 2010) и антиоксидантное действие (Nowak et al., 1994; Štětinová et al., 2004);
– способность локально (органы дыхания) стимулировать секрецию иммуноглобулинов IgA и IgG (Yang et al., 2002) и оказывать местноанестезирующее действие (Kern, Weiser, 2015).
Обладая перечисленными свойствами, отличаясь высокой биодоступностью при пероральном поступлении (Jauch et al., 1978), амброксол может быть включен в перечень лекарственных средств, используемых для лечения вирусных пневмоний.
Значимая роль в патогенезе респираторных инфекций принадлежит вирус-индуцированному оксидативному стрессу (Schwarz, 1996; Lin et al., 2006; Liu et al., 2017; Khomich et al., 2018). В формировании симптомокомплекса проявлений и осложнений вирус-ассоциированных пневмоний лидирующую роль играет ксантиноксидоредуктаза (КсОР). КсОР – цитозольный энзим катаболизма пуринов (Frederiks, Vreeling-Sindelárová, 2002; Agarwal et al., 2011), активность которого резко возрастает в условиях гипоксии (Poss et al., 1996; Terada et al., 1997; Linder et al., 2003) и под действием провоспалительных медиаторов и цитокинов (Page et al., 1998; Brandes et al., 1999). При патологических условиях КсОР выходит из клеток в кровь (преобладает оксидазная форма фермента) (Spiekermann et al., 2003) и фиксируется на люминальной поверхности плазматической мембраны эндотелиоцитов в зоне воспаления посредством физико-химического взаимодействия с гликозаминогликанами (Rouquette et al., 1988; Akaike et al., 1990; Adachi et al., 1993). КсОР, локализованная на цитоплазматической мембране эндотелиальных клеток, в процессе окисления пуринов продуцирует супероксидный анион-радикал и одновременно может на другом активном сайте восстанавливать нитрит- и нитрат-анионы до оксида азота NO• (Jansson et al., 2008; Cantu-Medellin, Kelley, 2013), то есть рециклировать данный вазодилатирующий агент. Локальная продукция комплекса прооксидантов ${\text{O}}_{{\text{2}}}^{{-- \bullet }},$ H2O2, NO• и ONOO– потенциально очень опасна, особенно в сосудистом ложе легких. Но попытки использования ингибитора КсОР аллопуринола (Pacher et al., 2006; George, Struthers, 2009) в качестве терапевтического средства при индуцированной вирусом гриппа типа А пневмонии в диапазоне суточных доз 5–50 мг/кг не увенчались успехом – аллопуринол не оказывал влияния на течение и исходы вирусной инфекции (Dolganova, Sharonov, 1997). Отсутствие терапевтического эффекта в данном случае сопряжено с тем, что при ингибировании молибдоптеринсодержащего центра фермента аллопуринолом NADH-оксидазная и нитрит-/нитрат-редуктазная активность КсОР, реализуемая FAD-зависимым сайтом энзима, не страдает (Harris, Massey, 1997; Doel et al., 2001; Boueiz et al., 2008). Поскольку среди лекарственных средств пока нет препаратов, способных ингибировать FAD-зависимую активность КсОР, постольку в качестве профилактики тромбоэмболии легочной артерии и с целью десорбции фермента с цитоплазматической мембраны эндотелиоцитов целесообразно назначение гепарина (Povalyaev, 2014; Obi et al., 2019), высвобождающего КсОР из связи с гликанами и способствующего ее элиминации из очага воспаления.
В качестве еще одного значимого источника активных форм и метаболитов кислорода при респираторных вирусных инфекциях выступают митохондрии (To et al., 2020). И мелатонин как митохондриальный антиоксидант (Reiter et al., 2017), проявляя противовоспалительное и иммуномодулирующее действие, оказывает выраженное благоприятное влияние на течение и исходы вирусных инфекций в эксперименте (Srinivasan et al., 2012; Silvestri, Rossi, 2013; Tan et al., 2014; Huang et al., 2019; Zhang et al., 2020).
Супероксидный анион-радикал в отношении органических и неорганических химических соединений, в зависимости от их химической природы, способен исполнять роль как окислителя (E0${\text{O}}_{{\text{2}}}^{{-- \bullet }}$/H2O2 = +0.89 B), так и восстановителя (E0 O2/${\text{O}}_{{\text{2}}}^{{-- \bullet }}$ = –0.16 B) (Wood, 1987, 1988). Восстановительные свойства супероксид-радикала, продуцируемого в пессимальном количестве при вирусных пневмониях, в зоне воспаления определяют возможность, в частности, восстановления ионов железа и их высвобождения из комплексов с биомакромолекулами. Например, в составе ферритина железо представлено в форме ионов Fe3+, которые под влиянием супероксидного анион-радикала переходят в Fe2+ и покидают указанный выше белок (Biemond et al., 1984; Bolann, Ulvik, 1987). В присутствии свободных ионов железа и частично восстановленных форм кислорода возникают условия для функционирования своеобразного каталитического реактора редокс-катаболической продукции прооксидантов и, в частности, чрезвычайно токсичного гидроксильного радикала (Morris et al., 1995). Это крайне опасное состояние биологической системы еще и потому, что при наличии свободных ионов железа биологические жидкости утрачивают антибактериальные свойства (Bullen et al., 1991; Griffiths, 1991; Sritharan, 2006).
Удаление свободных ионов железа из биосред организма – вопрос жизни и смерти при вирусных пневмониях. Но попытки использования для связывания ионов железа доступных комплексонов (дефероксамина) при вирусных пневмониях не только не оказали положительного влияния на течение патологического процесса, но и, вопреки ожиданиям, увеличили летальность (Dolganova, Sharanov, 1997). Объяснение данного парадокса в том, что дефероксамин (десферал), обладая примерно равной с сидерофорами микроорганизмов константой сродства к ионам железа (Hallaway et al., 1989; Askwith et al., 1996), не в состоянии ограничить доступность Fe3+ для патогенных микроорганизмов (Kim et al., 2007; Cassat, Skaar, 2013). И при этом хелатированные дефероксамином ионы железа, по-видимому, не теряют полностью способность претерпевать редокс-превращения и, таким образом, обеспечивают протекание реакций Фентона и Осипова (Borg, Schaich, 1986; Klebanoff et al., 1989; Dulchavsky et al., 1996; Niihara et al., 2002; Francisco et al., 2010).
В отличие от этого, 2-этил-6-метил-3-гидрокси-пиридина сукцинат (мексидол, эмиксипин) характеризуется выраженным железо-хелатирующим действием (Андрусишина и др., 2015), антиоксидантной активностью (Воронина, 2001) и свойствами ингибитора сериновых и матриксных протеиназ (Золотов и др., 1989; Ахмедов и др., 2009). Обладая таким перечнем биологических эффектов, мексидол может быть эффективно использован как вспомогательное средство при лечении пневмоний (Ильяшенко и др., 2003; Лужников и др., 2006) и вирусных инфекций (Ласеева, 2009; Павелкина, 2010).
В клинической практике вот уже более семи десятилетий – с 1947 г. (Solomon, Lee, 2009) – широкое применение находит хлорохин (в виде фосфата, гидрохлорида или сульфата) в качестве безопасного, эффективного и доступного лекарственного средства:
– для профилактики и терапии малярии (Mengesha, Makonnen, 1999; Bello et al., 2010; Waqar et al., 2016);
– при лечении проказы (Meinao et al., 1996; Bezerra et al., 2005; Gordon et al., 2018);
– как противовоспалительное средство при лечении ревматоидного артрита (Augustijns et al., 1992; Schrezenmeier, Dorner, 2020);
– в качестве средства терапии антифосфолипидного синдрома (Tektonidou et al., 2019);
– при лечении синдрома Шегрена (Vivino et al., 2016; Shivakumar et al., 2018; Lee et al., 2019);
– при лечении амебных гепатитов и абсцессов печени (Sodeman et al., 1951; Cohen, Reynolds, 1975);
– в терапии злокачественных новообразований как средство сенситизации (Solomon, Lee, 2009; Maycotte et al., 2012; Kimura et al., 2013);
– при лечении метаболического синдрома (Kastan et al., 2007; McGill et al., 2019) и воспалительных заболеваний бактериальной этиологии (как синергист антибиотиков) (Crowle, May, 1990; Feurle et al., 2012; Son, Chung, 2014).
Хлорохин и его аналоги (делагил, плаквенил, иммард, мефлохин и др.), проявляя свойства слабощелочных аминов, в непротонированной форме легко преодолевают клеточные мембраны (Chinappi et al., 2010) и, претерпев протонирование, накапливаются в замкнутых компартментах клеток с кислотными значениями показателя рН (эндосомы, лизосомы) (Vincent et al., 2005). Уровень хлорохина в них может более чем на два порядка превосходить его концентрацию вне клетки (De Duve et al., 1974). Не вступая в реакции биотрансформации, хлорохин может пребывать во внутриклеточных изолированных компартментах сотни часов (Schrezenmeier, Dorner, 2020).
Накапливаясь в эндосомах/лизосомах, хлорохин сдвигает показатель величины рН в сторону основных значений (Homewood et al., 1972; Ohkuma, Poole, 1978; Al-Bari, 2017) и ингибирует различные АТФазы, в том числе и Н+-АТФазу (V-ATPase), определяющую подкисление среды эндосом, цистерн аппарата Гольджи (Chandra et al., 1992; Bhattacharyya, Sen, 1999; Holliday, 2017). Возможно, перечисленные феномены определяют блок выделения фрагментов РНК-генома вирусов гриппа из липопротеидов их оболочки (Shibata et al., 1983), что и приводит к подавлению репликации вирионов (Ooi et al., 2006; Di Trani et al., 2007).
Способность хлорохина ингибировать ацидификацию эндосом, содержащих вирусы респираторных инфекций, и таким образом блокировать выделение их РНК-геномов и последующую репликацию, трудно принять в качестве удовлетворительного объяснения его противовирусной активности. Дело в том, что хлорохин проявляет высокую противовирусную активность не только относительно вирусов гриппа типа А (интернализация в составе эндосом), но и относительно коронавирусов (Keyaerts et al., 2004; Vincent et al., 2005; Ooi et al., 2006; Yan et al., 2013; De Wilde et al., 2014; Kearney, 2020), интернализация которых, практически исключительно, осуществляется посредством слияния мембран, то есть без стадии образования эндосом (Matsuyama et al., 2005).
Среди трех типов биологических апериодических полимеров (нуклеиновые кислоты, полипептиды, углеводы) наибольшей информационной емкостью, в силу их структурных особенностей, отличаются апериодические полимеры углеводов (гликаны, олигосахариды). Это обеспечивает высокую специфичность лиганд-рецепторных взаимодействий конъюгатов олигосахаридов. Но структура гликанов закодирована в геноме эукариот не прямо, а опосредованно. Олигосахариды синтезируются в цистернах аппарата Гольджи при участии вторичных белковых матриц, формирующих функциональные гетерогенные ассоциации (конвейерные линии) гликозилтрансфераз (Чепур и др., 2019). Естественно, пространственная структура таких матричных белковых молекул и, следовательно, их аффинитет к ферментам синтеза гликанов могут быстро и существенно измениться под влиянием динамики значений величины рН и показателя окислительно-восстановительного потенциала среды цистерн аппарата Гольджи.
Поэтому значимо то обстоятельство, что хлорохин способен изменять редокс-статус клетки (Giovanella et al., 2015) и уменьшать концентрацию протонов (увеличивать значение показателя рН) в просвете цистерн аппарата Гольджи посредством супрессирования активности АТФаз, в том числе Н+-АТФазы (Reaves, Banting, 1994; Hassinen et al., 2011). А наиболее чувствительной к динамике величины рН функцией аппарата Гольджи считают синтез апериодических олигосахаридов (Kellokumpu, 2019): возрастание рН на 0.2 единицы в просвете цистерн комплекса Гольджи сопровождается нарушением терминального α2,3-сиалилирования как N-связанных, так и О-конъюгированных гликанов (Rivinoja et al., 2006, 2009). Аберрантное гликозилирование при уменьшении кислотности внутрилюминальной среды цистерн комплекса Гольджи, по-видимому, ассоциировано с рН-индуцированным изменением топологии/позиции гликозил-трансфераз в мультиферментных комплексах синтеза апериодических олигосахаридов.
Поскольку все участники взаимодействия клеток организма человека с респираторными РНК-вирусами (гликопротеины, гликолипиды) обильно декорированы гликанами с терминальными сиаловыми кислотами, которые служат для вирусных частиц специфическими рецепторами, постольку хлорохин-индуцированное нарушение процессов сиалилирования/гликозилирования клеточных и вирусных участников этого взаимодействия определяет противовирусный эффект препаратов этой группы.
Вопросы участия гликанов в вирусной адгезии и репликации крайне важны. Следует отметить, что целый ряд вирусов, в том числе и коронавирусы (Milewska et al., 2014, 2018; Szczepanski et al., 2019), используют общий гепарансульфат-зависимый механизм присоединения к мембране клетки. В настоящее время получены производные диспиротрипиперазина (Макаров и др., 2016; Новоселова и др., 2019), ингибирующие репликацию вирусов различных семейств, использующих гепарансульфат для прикрепления и/или проникновения внутрь клетки хозяина. Исследуемый класс соединений открывает новые возможности ингибирования процесса вирусной трансмиссии, что было экспериментально доказано на модели инфицирования простым вирусом герпеса первого типа.
Для профилактики/терапии аспирационных и вентилятор-ассоциированных пневмоний была использована методика, которая может быть адаптирована для лечения вирус-ассоциированных пневмоний. Содержательная сущность методики состоит в создании для эритроцитов аутокрови гипоосмотической (до 200–250 ммоль/л) среды в растворе антибиотика широкого спектра действия с добавлением диметилсульфоксида и гепарина. Последний используют для улучшения реологических свойств крови, для десорбции КсОР с люминальной поверхности эндотелиоцитов и ее удаления из воспалительного очага. Реализация подхода позволяет избежать гемолиза и при внутривенном введении использовать эритроциты аутокрови в качестве депо для таргетированной доставки лекарственных средств к воспалительному очагу, в частности очагу пневмонии, где происходит их высвобождение. Диметилсульфоксид в употребляемых количествах (0.3–0.4 мл) увеличивает текучесть (уменьшает микровязкость) и проницаемость клеточных (эритроцитарных) мембран и способствует проникновению антибиотика внутрь клетки, не оказывая отрицательного влияния на структуру и функциональные характеристики форменных элементов крови (Gurtovenko, Anwar, 2007). Кроме того, диметилсульфоксид ингибирует активацию провоспалительных факторов транскрипции NF-κB, AP-1 и экспрессию молекул адгезии ICAM-1 (Chang et al., 2001), блокирует транскрипцию генов интерлейкинов IL-1, -6, -8, активирование инфламмасом NLRP3 (Ahn et al., 2014; Elisia et al., 2016) и обладает выраженной антиоксидантной активностью при экстремально низких концентрациях (Jia et al., 2010; Sanmartin-Suarez et al., 2011).
Современные знания о свойствах антибиотиков позволяют подобрать препараты, эффект которых не сопряжен с бактериолизом и выделением патоген-ассоциированных молекулярных образов (Tauber, Nau, 2008), реализован без активации эффекторных функций полиморфноядерных лейкоцитов (Rahman, Mazumder, 2001) и их хемотаксиса (Burgaleta et al., 1982), а также без повышения активности НАДФН-оксидазы нейтрофилов (Umeki, 1995; Dutta et al., 2009).
ЗАКЛЮЧЕНИЕ
Респираторные РНК-вирусы – антропозоо-нозные инфекционные патогены, имеющие природные резервуары инфекции и образующие единые динамичные генофонды. Единый генофонд предполагает обмен генетическим материалом между геномами родственных РНК‑вирусов человека и животных. Это с неизбежностью обусловливает появление новых высоковирулентных штаммов патогенов, время возникновения и антигенные свойства которых предсказать невозможно. То есть эпидемии новых респираторных РНК-вирусных инфекций всегда будут начинаться в отсутствие препаратов иммунной профилактики и терапии этих инфекций. Последнее предопределяет необходимость заблаговременного поиска и разработки эффективных средств и способов патогенетической профилактики/терапии респираторных РНК-вирусных инфекций.
Список литературы
Андрусишина И.Н., Важничая Е.М., Мокляк Е.В. и др. Средство для лечения перегрузки организма железом или гемахроматоза. Патент RU 2557959 C1. Опуб. 27.07.2015 г.
Ахмедов В.А., Будылгин А.Л., Долгих В.Е., Притыкин Т.В. Особенности активности матриксных металлопротеиназ при хроническом рецидивирующем панкреатите // Вестн. НГУ. Сер. биол. клин. мед. 2009. Т. 7. Вып. 4. С. 117–120.
Воронина Т.А. Антиоксидант мексидол. Основные нейропсихотропные эффекты и механизм действия // Психофармакол. биол. наркол. 2001. Т. 1. № 1. С. 2–12.
Золотов Н.Н., Смирнов Л.Д., Кузьмин В.И. и др. Производные 3-оксипиридина как ингибиторы протеолитических ферментов // Хим. фарм. журн. 1989. Т. 23. № 2. С. 133–135.
Ильяшенко К.К., Лужников Е.А., Абакумов М.М. и др. Способ лечения и профилактики пневмоний при острых экзогенных отравлениях. Патент RU 2 205 641 С2. Опуб. 10.06.2003 г.
Ласеева М.Г. Клинико-патогенетические особенности синдрома эндогенной интоксикации и возможности его коррекции при некоторых вирусных инфекциях: Дис. … канд. мед. наук. Саранск: НИМГУ им. Н.П. Огарева, 2009. 161 с.
Лужников Е.А., Ильяшенко К.К., Пинчук Т.П., Ермохина Т.В. Применение препарата Мексидол в комплексном лечении больных с острыми экзогенными отравлениями // Бюл. эксперим. биол. мед. 2006. Прил. 1. С. 190–198.
Макаров В.А., Монахова Н.С., Рябова О.Б. 4,6-ди(3,12-диаза-6,9-диазониадиспиро[5.2.5.2]гексадекан-1-ил)-2-метил-5-нитропиримидин тетрахлорид гексагидрат для лечения герпетической инфекции, фармацевтическая композиция для местного применения. Патент RU 2573977 C2. Опуб. 27.01.2016 г.
Новоселова Е.A., Рябова О.Б., Ленева И.А., Макаров В.А. Специфическая противовирусная активность пиримидин-диспиротрипиперазиния в монотерапии и в комбинации с ацикловиром на модели герпес-вирусной инфекции // Хим. фарм. журн. 2019. Т. 53. № 9. С. 3–8.
Павелкина В.Ф. Клинико-патогенетические аспекты эндогенной интоксикации и ее коррекции при заболеваниях вирусной и бактериальной этиологии: Дис. … док. мед. наук. М.: МГМУ, 2010. 389 с.
Чепур С.В., Плужников Н.Н., Сайганов С.А. и др. Гипотеза матричного синтеза апериодических полисахаридов // Успехи соврем. биол. 2019. Т. 139. № 6. С. 583–593.
Чепур С.В., Плужников Н.Н., Сайганов С.А. и др. Механизмы реализации антиоксидантных эффектов альфа-токоферола // Успехи соврем. биол. 2020. Т. 140. № 2. С. 149–165.
Adachi T., Fukushima T., Usami Y., Hirano K. Binding of human xanthine oxidase to sulphated glycosaminoglycans on the endothelial-cell surface // Biochem. J. 1993. V. 289. Pt 2. P. 523–527.
Agarwal A., Banerjee A., Banerjee U.C. Xanthine oxidoreductase: a journey from purine metabolism to cardiovascular excitation-contraction coupling // Crit. Rev. Biotechnol. 2011. V. 31. Is. 3. P. 264–280.
Ahn H., Kim J., Jeung E.B., Lee G.S. Dimethyl sulfoxide inhibits NLRP3 activation // Immunobiology. 2014. V. 219. Is. 4. P. 315–322.
Akaike T., Ando M., Oda T. et al. Dependence on O2-generation by xanthine oxidase of pathogenesis of influenza virus infection in mice // J. Clin. Invest. 1990. V. 85. Is. 3. P. 739–745.
Al-Baadani A.M., Elzein F.E., Alhemyadi S.A. et al. Characteristics and outcome of viral pneumonia caused by influenza and Middle East respiratory syndrome-coronavirus infections: a 4-year experience from a tertiary care center // Ann. Thorac. Med. 2019. V. 14. Is. 3. P. 179–185.
Al-Bari M.A.A. Targeting endosomal acidification by chloroquine analogs as a promising strategy for the treatment of emerging viral diseases // Pharmacol. Res. Perspect. 2017. V. 5. Is. 1. Art. e00293.
Al-Muharrmi Z. Understanding the influenza A H1N1 2009 pandemic // Sultan Qaboos Univ. Med. J. V. 10. № 2. P. 187–195.
Askwith C.C., De Silva D., Kaplan J. Molecular biology of iron acquisition in Saccharomyces cerevisiae // Mol. Microbiol. 1996. V. 20. Is. 1. P. 27–34.
Augustijns P., Geusens P., Verbeke N. Chloroquine levels in blood during chronic treatment of patients with rheumatoid arthritis // Eur. J. Clin. Pharmacol. 1992. V. 42. № 4. P. 429–433.
Barbezange C., Jones L., Blanc H. et al. Seasonal genetic drift of human influenza A virus quasispecies revealed by deep sequencing // Front. Microbiol. 2018. V. 9. Art. 2596.
Barcena M., Oostergetel G.T., Bartelink W. et al. Cryo-electron tomography of mouse hepatitis virus: insights into the structure of the coronavirion // PNAS USA. 2009. V. 106. № 2. P. 582–587.
Beeh K.M., Beier J., Esperester A., Paul L.D. Antiinflammatory properties of ambroxol // Eur. J. Med. Res. 2008. V. 13. № 12. P. 557–562.
Bello S.O., Chika A., Bello A.Y. Is chloroquine better than artemisinin combination therapy as first line treatment in adult nigerians with uncomplicated malaria? A cost effectiveness analysis // Afr. J. Infect. Dis. 2010. V. 4. № 2. P. 29–42.
Belouzard S., Chu V.C., Whittaker G.R. Activation of the SARS coronavirus spike protein via sequential proteolytic cleavage at two distinct sites // PNAS USA. 2009. V. 106. № 14. P. 5871–5876.
Bendikov-Bar I., Maor G., Filocamo M., Horowitz M. Ambroxol as a pharmacological chaperone for mutant glucocerebrosidase // Blood Cells Mol. Dis. 2013. V. 50. Is. 2. P. 141–145.
Bertram S., Glowacka I., Blazejewska P. et al. TMPRSS2 and TMPRSS4 facilitate trypsin-independent spread of influenza virus in Caco-2 cells // J. Virol. 2010. V. 84. № 19. P. 10016–10025.
Bezerra E.L.M., Vilar M.J.P., Da Trindade Neto P.B., Sato E.I. Double-blind, randomized, controlled clinical trial of clofazimine compared with chloroquine in patients with systemic lupus erythematosus // Arthr. Rheum. 2005. V. 52. Is. 10. P. 3073–3078.
Bhattacharyya D., Sen P.C. The effect of binding of chlorpromazine and chloroquine to ion transporting ATPases // Mol. Cell. Biochem. 1999. V. 198. Is. 1–2. P. 179–185.
Biemond P., van Eijk H.G., Swaak A.J., Koster J.F. Iron mobilization from ferritin by superoxide derived from stimulated polymorphonuclear leukocytes. Possible mechanism in inflammation diseases // J. Clin. Invest. 1984. V. 73. Is. 6. P. 1576–1579.
Bisno A.L., Griffin J.P., van Epps K.A. et al. Pneumonia and Hong Kong influenza: a prospective study of the 1968–1969 epidemic // Am. J. Med. Sci. 1971. V. 261. № 5. P. 251–263.
Bolann B.J., Ulvik R.J. Release of iron from ferritin by xanthine oxidase. Role of the superoxide radical // Biochem. J. 1987. V. 243. Is. 1. P. 55–59.
Borg D.C., Schaich K.M. Prooxidant action of desferrioxamine: fenton-like production of hydroxyl radicals by reduced ferrioxamine // J. Free Radic. Biol. Med. 1986. V. 2. Is. 4. P. 237–243.
Bosch B.J., van der Zee R., De Haan C.A., Rottier P.J. The coronavirus spike protein is a class I virus fusion protein: structural and functional characterization of the fusion core complex // J. Virol. 2003. V. 77. № 16. P. 8801–8811.
Boueiz A., Damarla M., Hassoun P.M. Xanthine oxidoreductase in respiratory and cardiovascular disorder // Am. J. Physiol. Lung Cell Mol. Physiol. 2008. V. 294. Is. 5. P. L830–L840.
Boulant S., Stanifer M., Lozach P.Y. Dynamics of virus-receptor interactions in virus binding, signaling, and endocytosis // Viruses. 2015. V. 7. Is. 6. P. 2794–2815.
Bouvier N.M., Palese P. The biology of influenza viruses // Vaccine. 2008. V. 26. Suppl. 4. P. D49–D53.
Brand J.D., Lazrak A., Trombley J.E. et al. Influenza-mediated reduction of lung epithelial ion channel activity leads to dysregulated pulmonary fluid homeostasis // JCI Insight. 2018. V. 3. Is. 20. Art. 123467.
Brandes R.P., Koddenberg G., Gwinner W. et al. Role of increased production of superoxide anions by NAD(P)H oxidase and xanthine oxidase in prolonged endotoxemia // Hypertension. 1999. V. 33. № 5. P. 1243–1249.
Broxmeyer L. Bird flu, influenza and 1918: the case for mutant avian tuberculosis // Med. Hypotheses. 2006. V. 67. Is. 5. P. 1006–1015.
Bullen J.J., Ward C.G., Rogers H.J. The critical role of iron in some clinical infections // Eur. J. Clin. Microbiol. Infect. Dis. 1991. V. 10. № 8. P. 613–617.
Burgaleta C., Martinez-Beltran J., Bouza E. Comparative effects of moxalactam and gentamicin on human polymorphonuclear leukocyte functions // Antimicrob. Agents Chemother. 1982. V. 21. № 5. P. 718–720.
Byrd-Leotis L., Cummings R.D., Steinhauer D.A. The interplay between the host receptor and influenza virus hemagglutinin and neuraminidase // Int. J. Mol. Sci. 2017. V. 18. Is. 7. Art. 1541.
Cabral-Romero C., Martinez-Sanmiguel J.J., Reséndez-Pérez D. et al. Antibacterial and anti-biofilm activities of ambroxol against oral bacteria // Pharma Innov. 2013. V. 2. Is. 3. P. 52–58.
Cain C.C., Sipe D.M., Murphy R.F. Regulation of endocytic pH by the Na+,K+-ATPase in living cells // PNAS USA. 1989. V. 86. № 2. P. 544–548.
Callow K.A., Parry H.F., Sergeant M., Tyrrell D.A. The time course of the immune response to experimental coronavirus infection of man // Epidemiol. Infect. 1990. V. 105. № 2. P. 435–446.
Cantu-Medellin N., Kelley E.E. Xanthine oxidoreductase-catalyzed reduction of nitrite to nitric oxide: insights regarding where, when and how // Nitric. 2013. V. 34. P. 19–26.
Cao J., Wang D., Xu F. et al. Activation of IL-27 signaling promotes development of postinfluenza pneumococcal pneumonia // EMBO Mol. Med. 2014. V. 6. Is. 1. P. 120–140.
Carlson C.M., Turpin E.A., Moser L.A. et al. Transforming growth factor-β: activation by neuraminidase and role in highly pathogenic H5N1 influenza pathogenesis // PLoS Pathog. 2010. V. 6. Is. 10. Art. e1001136.
Cassat J.E., Skaar E.P. Iron in infection and immunity // Cell Host Microbe. 2013. V. 13. Is. 5. P. 509–519.
Cataldi M., Sblendorio V., Leo A., Piazza O. Biofilm-dependent airway infections: a role for ambroxol? // Pulm. Pharmacol. Ther. 2014. V. 28. Is. 2. P. 98–108.
Chandra S., Adhikary G., Sikdar R., Sen P.C. The in vivo inhibition of transport enzyme activities by chloroquine in different organs of rat is reversible // Mol. Cell. Biochem. 1992. V. 118. № 1. P. 15–21.
Chang C.K., Albarillo M.V., Schumer W. Therapeutic effect of dimethyl sulfoxide on ICAM-1 gene expression and activation of NF-κB and AP-1 in septic rats // J. Surg. Res. 2001. V. 95. Is. 2. P. 181–187.
Chardonnet Y., Dales S. Early events in the interaction of adenoviruses with Hela cells. I. Penetration of type 5 and intracellular release of the DNA genome // Virology. 1970. V. 40. Is. 3. P. 462–477.
Chen B.H., Park J.H., Ahn J.H. et al. Pretreated quercetin protects gerbil hippocampal CA1 pyramidal neurons from transient cerebral ischemic injury by increasing the expression of antioxidant enzymes // Neural. Regen. Res. 2017. V. 12. № 2. P. 220–227.
Cherry J.D. The chronology of the 2002–2003 SARS mini pandemic // Paediatr. Respir. Rev. 2004. V. 5. Is. 4. P. 262–269.
Cheung P.P., Watson S.J., Choy K.T. et al. Generation and characterization of influenza A viruses with altered polymerase fidelity // Nat. Commun. 2014. V. 5. Art. 4794.
Chinappi M., Via A., Marcatili P., Tramontano A. On the mechanism of chloroquine resistance in Plasmodium falciparum // PLoS One. 2010. V. 5. Is. 11. Art. e14064.
Cilloniz C., Ewig S., Menendez R. et al. Bacterial co-infection with H1N1 infection in patients admitted with community acquired pneumonia // J. Infect. 2012. V. 65. Is. 3. P. 223–230.
Cohen H.G., Reynolds T.B. Comparison of metronidazole and chloroquine for the treatment of amoebic liver abscess. A controlled trial // Gastroenterology. 1975. V. 69. № 1. P. 35–41.
Crowle A.J., May M.H. Inhibition of tubercle bacilli in cultured human macrophages by chloroquine used alone and in combination with streptomycin, isoniazid, pyrazinamide, and two metabolites of vitamin D3 // Antimicrob. Agents Chemother. 1990. V. 34. № 11. P. 2217–2222.
Cruveilhier L. Action du serum antipneumococcique au cours de la pneumonie et dans les complications de la grippe // Ann. de l’Institut Pasteur. 1919. V. 33. P. 448–461.
Daly P., Gustafson R., Kendall P. Introduction to pandemic influenza // BC Med. J. 2007. V. 49. № 5. P. 240–244.
De Duve C., De Barsy T., Poole B. et al. Commentary. Lysosomotropic agents // Biochem. Pharmacol. 1974. V. 23. Is. 18. P. 2495–2531.
De Haan C.A., Rottier P.J. Molecular interactions in the assembly of coronaviruses // Adv. Virus Res. 2005. V. 64. P. 165–230.
De Wilde A.H., Jochmans D., Posthuma C.C. et al. Screening of an FDA-approved compound library identifies four small-molecule inhibitors of Middle East respiratory syndrome coronavirus replication in cell culture // Antimicrob. Agents Chemother. 2014. V. 58. № 8. P. 4875–4884.
Di Trani L., Savarino A., Campitelli L. et al. Different pH requirements are associated with divergent inhibitory effects of chloroquine on human and avian influenza A viruses // Virol. J. 2007. V. 4. Art. 39.
Doel J.J., Godberg B.L., Eisenthal R., Harrison R. Reduction of organic nitrates catalyzed by xanthine oxidoreductase under anaerobic conditions // Biochim. Biophys. Acta. 2001. V. 1527. Is. 1–2. P. 81–87.
Dolganova A., Sharonov B.P. Application of various antioxidants in the treatment of influenza // Braz. J. Med. Biol. Rev. 1997. V. 30. № 11. P. 1333–1336.
Dou D., Revol R., Ostbye H. et al. Influenza A virus cell entry, replication, virion assembly and movement // Front. Immunol. 2018. V. 9. Art. 1581.
Drake J.W. Rates of spontaneous mutation among RNA viruses // PNAS USA. 1993. V. 90. № 9. P. 4171–4175.
Ducatez M.F., Pelletier C., Meyer G. Influenza D virus in cattle, France, 2011–2014 // Emerg. Infect. Dis. 2015. V. 21. № 2. P. 368–371.
Dugan V.G., Chen R., Spiro D.J. et al. The evolutionary genetics and emergence of avian influenza viruses in wild birds // PLoS Pathog. 2008. V. 4. Is. 5. Art. e1000076.
Dulchavsky S.A., Davidson S.B., Cullen W.J. et al. Effects of deferoxamine on H2O2-induced oxidative stress in isolated rat heart // Bas. Res. Cardiol. 1996. V. 91. № 6. P. 418–424.
Dutta N.K., Mazumdar K., Park J.H. In vitro synergistic effect of gentamicin with the anti-inflammatory agent diclofenac against Listeria monocytogenes // Lett. App. Microbiol. 2009. V. 48. Is. 6. P. 783–785.
Elisia I., Nakamura H., Lam V. et al. DMSO represses inflammatory cytokine production from human blood cells and reduces autoimmune arthritis // PLoS One. 2016. V. 11. № 3. Art. e0152538.
Ellis G.T., Davidson S., Crotta S. et al. TRAIL+ monocytes and monocyte-related cells causes lung damage and thereby increase susceptibility to influenza–Streptococcus pneumoniae coinfection // EMBO Rep. 2015. V. 16. Is. 9. P. 1203–1218.
Fehr A.R., Perlman S. Coronaviruses: an overview of their replication and pathogenesis // Meth. Mol. Biol. 2015. V. 1282. P. 1–23.
Feurle G.E., Moos V., Schneider T. et al. The combination of chloroquine and micocycline, a therapeutic option in cerebrospinal infection of Whipple’s disease refractory to treatment with ceftriaxone, meropenem and co-trimoxazole // J. Antimicrob. Chemother. 2012. V. 67. Is. 5. P. 1295–1296.
Forni D., Cagliani R., Clerici M., Sironi M. Molecular evolution of human coronavirus genomes // Tr. Microbiol. 2017. V. 25. Is. 1. P. 35–48.
Francis T. A new type of virus from epidemic influenza // Science. 1940. V. 92. Is. 2392. P. 405–408.
Francisco A.F., De Abreu Vieira P.M., Arantes J.M. et al. Increase of reactive oxygen species by desferrioxamine during experimental Chagas’ disease // Redox Rep. 2010. V. 15. Is. 4. P. 185–190.
Frederiks W.M., Vreeling-Sindelárová H. Ultrastructural localization of xanthine oxidoreductase activity in isolated rat liver cells // Acta Histochem. 2002. V. 104. Is. 1. P. 29–37.
Garten R.J., Davis C.T., Russell C.A. et al. Antigenic and genetic characteristics of swine-origin 2009 A(H1N1) influenza viruses circulating in humans // Science. 2009. V. 325. Is. 5937. P. 197–201.
Garten W., Braden C., Arendt A. et al. Influenza virus activating host proteases: identification, localization and inhibitors as potential therapeutics // Eur. J. Cell Biol. 2015. V. 94. Is. 7–9. P. 375–383.
Gaunt E.R., Hardie A., Claas E.C.J. et al. Epidemiology and clinical presentation of the four human coronaviruses 229E, HKU1, NL63, and OC43 detected over 3 years using a novel multiplex real-time PCR method // J. Clin. Microbiol. 2010. V. 48. № 8. P. 2940–2947.
George J., Struthers A.D. Role of urate, xanthine oxidase and the effects of allopurinol in vascular oxidative stress // Vasc. Health Risk Manag. 2009. V. 5. № 1. P. 265–272.
Gholampour F., Saki N. Hepatic and renal protective effects of quercetin in ferrous sulfateinduced toxicity // Gen. Physiol. Biophys. 2019. V. 38. № 1. P. 27–38.
Ghoneim H.E., Thomas P.G., McCullers J.A. Depletion of alveolar macrophages during influenza infection facilitates bacterial superinfection // J. Immunol. 2013. V. 191. Is. 3. P. 1250–1259.
Gibbs B.F., Schmutzler W., Vollrath I.B. et al. Ambroxol inhibits the release of histamine, leukotrienes and cytokines from human leukocytes and mast cells // Inflamm. Res. 1999. V. 48. Is. 2. P. 86–93.
Gill J.R., Sheng Z.M., Ely S.F. et al. Pulmonary pathologic findings of fatal 2009 pandemic influenza A/H1N1 viral infections // Arch. Pathol. Lab. Med. 2010. V. 134. Is. 2. P. 235–243.
Giovanella F., Ferreira G.K., De Pra S.D. et al. Effects of primaquine and chloroquine on oxidative stress parameters in rats // Ann. Acad. Bras. Ciênc. 2015. V. 87. № 2. P. 1487–1496.
Gordon C., Amissah-Arthur M.B., Gayed M. et al. The British Society for Rheumatology guideline for the management of systemic lupus erythematosus in adults: executive summary // Rheumatology. 2018. V. 57. Is. 1. P. e1–e45.
Griffiths E. Iron and bacterial virulence – a brief overview // Biol. Metals. 1991. V. 4. № 1. P. 7–13.
Gupta P.R. Ambroxol – resurgence of an old molecule as an anti-inflammatory agent in chronic obstructive airway diseases // Lung India. 2010. V. 27. № 2. P. 46–48.
Gurtovenko A.A., Anwar J. Modulating the structure and properties of cell membranes: the molecular mechanism of action of dimethyl sulfoxide // J. Phys. Chem. B. 2007. V. 111. Is. 35. P. 10453–10460.
Haijema B.J., Volders H., Rottier P.J. Switching species tropism: an effective way to manipulate the feline coronavirus genome // J. Virol. 2003. V. 77. № 8. P. 4528–4538.
Hallaway P.E., Eaton J.W., Panter S.S., Hedlund B.E. Modulation of deferoxamine toxicity and clearance by covalent attachment to biocompatible polymers // PNAS USA. 1989. V. 86. № 24. P. 10108–10112.
Hamre D., Procknow J.J. A new virus isolated from the human respiratory tract // Proc. Soc. Exp. Biol. Med. 1966. V. 121. Is. 1. P. 190–193.
Hanada S., Pirzadeh M., Carver K.Y., Deng J.C. Respiratory viral infection-induced microbiome alterations and secondary bacterial pneumonia // Front. Immunol. 2018. V. 9. Art. 2640.
Harris C.M., Massey V. The reaction of reduced xanthine dehydrogenase with molecular oxygen. Reaction kinetics and measurement of superoxide radical // J. Biol. Chem. 1997. V. 272. № 13. P. 8370–8379.
Hassinen A., Pujol F.M., Kokkonen N. et al. Functional organization of Golgi N- and O-glycosylation pathways involves pH-dependent complex formation that is impaired in cancer cells // J. Biol. Chem. 2011. V. 286. № 44. P. 38329–38340.
Hause B.M., Ducatez M., Collin E.A. et al. Isolation of a novel swine influenza virus from Oklahoma in 2011 which is distantly related to human influenza C virus // PLoS Pathog. 2013. V. 9. Is. 2. Art. e1003176.
Henkel M., Mitzner D., Henklein P. et al. The proapoptotic influenza A virus protein PB1-F2 forms a nonselective ion channels // PLoS One. 2010. V. 5. Is. 6. Art. e11112.
Heurich A., Hofmann-Winkler H., Gierer S. et al. TMPRSS2 and ADAM17 cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory syndrome coronavirus spike protein // J. Virol. 2014. V. 88. № 2. P. 1293–1307.
Holliday L.S. Vacuolar H+-ATPases (V-ATPases) as therapeutic targets: a brief review and recent developments // Biotarget. 2017. V. 1. Art. 18.
Holmes K.V. Coronaviruses // Fields Virology / Eds D.M. Knipe, P.M. Howley. Philadelphia: Lippincott Williams and Wilkins, 2001. P. 1187–1203.
Holmes E.C., Ghedin E., Miller N. et al. Whole-genome analysis of human influenza A virus reveals multiple persistent lineages and reassortment among recent H3N2 viruses // PLoS Biol. 2005. V. 3. Is. 9. Art. e300.
Homewood C.A., Warhurst D.C., Peters W., Baggaley V.C. Lysosomes, pH and the anti-malarial action of chloroquine // Nature. 1972. V. 235. Is. 5332. P. 50–52.
Huang C., Liu W.J., Xu W. et al. A bat-derived putative cross-family recombinant coronavirus with a reovirus gene // PLoS Pathog. 2016. V. 12. Is. 9. Art. e1005883.
Huang S.H., Liao C.L., Chen S.J. et al. Melatonin possesses an anti-influenza potential through its immune modulatory effect // J. Funct. Foods. 2019. V. 58. P. 189–198.
Hui D.S., Azhar E.I., Madani T.A., Ntoumi F. The continuing 2019-nCoV epidemic threat of a novel coronaviruses to global health – the latest 2019 novel coronavirus outbreak in Wuhan, China // Int. J. Infect. Dis. 2020. V. 91. P. 264–266.
Hulswit R.J., Lang Y., Bakkers M.J. et al. Human coronaviruses OC43 and HKU1 bind to 9-O-acetylated sialic acid via a conserved receptor-binding site in spike protein domain A // PNAS USA. 2019. V. 116. № 7. P. 2861–2890.
Hutchinson C.E., Charles P.D., Hester S.S. et al. Conserved and host-specific features of influenza virion architecture // Nat. Commun. 2014. V. 5. Art. 4816.
Ibricevic A., Pekosz A., Walter M.J. et al. Influenza virus receptor specificity and cell tropism in mouse and human airway epithelial cells // J. Virol. 2006. V. 80. № 15. P. 7469–7480.
Ishiguro T., Kagiyama N., Uozumi R. et al. Clinical characteristics of influenza-associated pneumonia of adults: clinical features and factors contributing to severity and mortality // Yale J. Biol. Med. 2017. V. 90. Is. 2. P. 165–181.
Jansson E.A., Huang L., Malkey R. et al. A mammalian functional reductase that regulates nitrite and nitric oxide homeostasis // Nat. Chem. Biol. 2008. V. 4. № 7. P. 411–417.
Jauch R., Bozler G., Hammer R. et al. Ambroxol, studies of biotransformation in man and determination in biological samples // Arzneimittelforschung. 1978. B. 28. № 5a. S. 904–911.
Jia Z., Zhu H., Li Y., Misra H.P. Potent inhibition of peroxynitrite-induced DNA strand breakage and hydroxyl radical formation by dimethyl sulfoxide at very low concentration // Exp. Biol. Med. 2010. V. 235. Is. 5. P. 614–622.
Jo S., Kim H., Kim S. et al. Characteristics of flavonoids as potent MERS-CoV 3C-like protease inhibitors // Chem. Biol. Drug Des. 2019. V. 94. Is. 6. P. 2023–2030.
Johnson N.P., Mueller J. Updating the accounts: global mortality of the 1918–1920 “Spanish” influenza pandemic // Bull. Hist. Med. 2002. V. 76. № 1. P. 105–115.
Kamal R.P., Alymova I.V., York I.A. Evolution and virulence of influenza A virus protein PB1‑F2 // Int. J. Mol. Sci. 2017. V. 19. № 1. Art. 96.
Kartenbeck J., Stukenbrok H., Helenius A. Endocytosis of simian virus 40 into the endoplasmic reticulum // J. Cell. Biol. 1989. V. 109. № 6. Pt 1. P. 2721–2729.
Kastan M.B., Semenkovich C.F., Schneider J. Use of chloroquine to treat metabolic syndrome. Patent WO/2007/059372. Pub. 24.05.2007.
Kearney J. Chloroquine as a potential treatment and prevention measure for the 2019 novel coronavirus: a review // Preprints. 2020. Art. 202003.0275.
Keck J.G., Matsushima G.K., Makino S. et al. In vivo RNA–RNA recombination of coronavirus in mouse brain // J. Virol. 1988. V. 62. № 5. P. 1810–1813.
Kellokumpu S. Golgi pH, ion and redox homeostasis: how much do they really matter? // Front. Cell. Dev. Biol. 2019. V. 7. Art. 93.
Kern K.U., Weiser T. Topisches Ambroxol zur Behandlung neuropathischer Schmerzen // Der Schmerz. 2015. B. 29. Is. 6. S. 632–640.
Keyaerts E., Vijgen L., Maes P. et al. In vitro inhibition of severe acute respiratory syndrome coronavirus by chloroquine // Biochem. Biophys. Res. Commun. 2004. V. 323. Is. 1. P. 264–268.
Khomich O.A., Kochetkov S.N., Bartosch B., Ivanov A.V. Redox biology of respiratory viral infections // Viruses. 2018. V. 10. Is. 8. Art. e392.
Kido H., Okumura Y., Yamada H. et al. Secretory leukoprotease inhibitor and pulmonary surfactant serve as principal defenses against influenza A virus infection in the airway and chemical agents up-regulating their levels may have therapeutic potential // Biol. Chem. 2004. V. 385. Is. 11. P. 1029–1034.
Kido H., Okumura Y., Takahashi E. et al. Host envelope glycoprotein processing proteases are indispensable for entry into human cells by seasonal and highly pathogenic avian influenza viruses // J. Mol. Genet. Med. 2009. V. 3. № 1. P. 167–175.
Kilbourne E.D. Influenza pandemics of the 20th century // Emerg. Infect. Dis. 2006. V. 12. № 1. P. 9–14.
Kim C.M., Park Y.J., Shin S.H. A widespread deferoxamine-mediated iron-uptake system in Vibrio vulnificus // J. Infect. Dis. 2007. V. 196. Is. 10. P. 1537–1545.
Kim P., Jang Y.H., Kwon S.B. et al. Glycosylation of hemagglutinin and neuraminidase of influenza A virus as signature for ecological spillover and adaptation among influenza reservoirs // Viruses. 2018. V. 10. Is. 4. Art. 183.
Kimura T., Takabatake Y., Takahashi A., Isaka Y. Chloroquine in cancer therapy: a double-edged sword of autophagy // Canc. Res. 2013. V. 73. Is. 1. P. 3–7.
King A.M.Q., Lefkowitz E.L., Mushegian A.R. et al. Changes to taxonomy and the international code of virus classification and nomenclature ratified by the International Committee on Taxonomy of Viruses // Arch. Virol. 2018. V. 163. Is. 9. P. 2601–2631.
Klebanoff S.J., Waltersdorph A.M., Michel B.R., Rosen H. Oxygen-based free radicals generation by ferrous ions and deferoxamine // J. Biol. Chem. 1989. V. 264. № 33. P. 19 765–19 771.
Klenk H.D., Rott R., Orlich M., Blödorn J. Activation of influenza A viruses by trypsin treatment // Virology. 1975. V. 68. № 2. P. 426–439.
Koetz A., Nilsson P., Linden M. et al. Detection of human coronavirus NL63, human metapneumovirus and respiratory syncytial virus in children with respiratory tract infections in south-west Sweden // Clin. Microbiol. Infect. 2006. V. 12. № 11. P. 1089–1096.
Kosik I., Yewdell J.W. Influenza hemagglutinin and neuraminidase: Yin-Yang proteins coevolving to thwart immunity // Viruses. 2019. V. 11. Is. 4. Art. 346.
Kumlin U., Olofsson S., Dimock K., Arnberg N. Sialic acid tissue distribution and influenza virus tropism // Infl. Oth. Respir. Viruses. 2008. V. 2. Is. 5. P. 147–154.
Kuszewski K., Brydak L. The epidemiology and history of influenza // Biomed. Pharmacother. 2000. V. 54. Is. 4. P. 188–195.
Lai M.M. Coronavirus: organization, replication and expression of genome // Ann. Rev. Microbiol. 1990. V. 44. P. 303–333.
Lai M.M., Cavanagh D. The molecular biology of coronaviruses // Adv. Virus Red. 1997. V. 28. P. 35–112.
Lazarowitz S.G., Choppin P.W. Enhancement of the infectivity of influenza A and B viruses by proteolytic cleavage of the hemagglutinin polypeptide // Virology. 1975. V. 68. Is. 2. P. 440–454.
Lee H.J., Shin S., Yoon S.G. et al. The effect of chloroquine on the development of dry eye in Sjogren syndrome animal model // Invest. Ophthalmol. Vis. Sci. 2019. V. 60. № 12. P. 3708–3716.
Leung H.S., Li O.T., Chan R.W. et al. Entry of influenza A virus with a α2,6-linked sialic acid binding preference requires host fibronectin // J. Virol. 2012. V. 86. № 19. P. 10704–10713.
Li F. Evidence for a common evolutionary origin of coronavirus spike protein receptor-binding subunits // J. Virol. 2012. V. 86. № 5. P. 2856–2858.
Li F. Structure, function, and evolution of coronavirus spike proteins // Ann. Rev. Virol. 2016. V. 3. № 1. P. 237–261.
Li F., Wang W., Hu L. et al. Effect of ambroxol on pneumonia caused by Pseudomonas aeruginosa with biofilm formation in an endotracheal intubation rat model // Chemotherapy. 2011. V. 57. № 2. P. 173–180.
Li W., Hulswit R.J., Widjaja I. et al. Identification of sialic acid-binding function for the Middle East respiratory syndrome coronavirus spike glycoprotein // PNAS USA. 2017. V. 114. № 40. P. E8508–E8517.
Lim Y.X., Ng Y.L., Tam J.P., Liu D.X. Human coronaviruses: a review of virus-host interactions // Diseases. 2016. V. 4. № 3. Art. 26.
Limburg H., Harbig A., Bestle D. et al. TMPRSS2 is the major activating protease of influenza A virus in primary human airway cells and influenza B virus in human type II pneumocytes // J. Virol. 2019. V. 93. Is. 21. Art. e00649-19.
Lin C.W., Lin K.H., Hsieh T.H. et al. Severe acute respiratory syndrome coronavirus 3C-like protease-induced apoptosis // FEMS Immunol. Med. Microbiol. 2006. V. 46. Is. 3. 375–380.
Linder N., Martelin E., Lapatto R., Raivio K.O. Posttranslational inactivation of human xanthine oxidoreductase by oxygen under standard cell culture conditions // Am. J. Physiol. Cell. Physiol. 2003. V. 285. Is. 1. P. C48–C55.
Liu M., Chen F., Liu T. et al. The role of oxidative stress in influenza virus infection // Microbes Infect. 2017. V. 19. Is. 12. P. 580–586.
Lu Q., Yu J., Yang X. et al. Ambroxol interferes with Pseudomonas aeruginosa quorum sensing // Int. J. Antimicrob. Agents. 2010. V. 36. Is. 3. P. 211–215.
Makino S., Keck J.G., Stohlman S.A., Lai M.M. High-frequency RNA recombination of murine coronaviruses // J. Virol. 1986. V. 57. № 3. P. 729–737.
Manzoor R., Igarashi M., Takada A. Influenza A virus M2 protein: roles from ingress to egress // Int. J. Mol. Sci. 2017. V. 18. Is. 12. Art. 2649.
Martin-Loeches I., Sanchez-Carral A., Diaz E. et al. Community-acquired respiratory coinfection in critically ill patients with pandemic 2009 influenza A(H1N1) virus // Chest. 2011. V. 139. Is. 3. P. 555–562.
Maruyama T., Fujisawa T., Suga S. et al. Outcomes and prognostic features of patients with influenza requiring hospitalization and receiving early antiviral therapy: a prospective multicenter cohort study // Chest. 2016. V. 149. Is. 2. P. 526–534.
Matlin K.S., Reggio H., Helenius A., Simons K. Infectious entry pathway of influenza virus in a canine kidney cell line // J. Cell. Biol. 1981. V. 91. Is. 3. Pt 1. P. 601–613.
Matsuyama S., Ujike M., Morikawa S. et al. Protease-mediated enhancement of severe acute respiratory syndrome coronavirus infection // PNAS USA. 2005. V. 102. № 35. P. 12543–12547.
Maycotte P., Aryal S., Cummings C.T. et al. Chloroquine sensitizes breast cancer cells to chemotherapy independent of autophagy // Autophagy. 2012. V. 8. Is. 2. P. 200–212.
McAuley J.L., Hornung F., Boyd K.L. et al. Expression of the 1918 influenza A virus PB1-F2 enhances the pathogenesis of viral and secondary bacterial pneumonia // Cell Host Microbe. 2007. V. 2. Is. 4. P. 240–248.
McBride R., van Zyl M., Fielding B.C. The coronavirus nucleocapsid is a multifunctional protein // Viruses. 2014. V. 6. № 8. P. 2991–3018.
McGill J.B., Johnson M., Hurst S. et al. Low dose chloroquine decreases insulin resistance in human metabolic syndrome but does not reduce carotid intima-media thickness // Diabetol. Metab. Syndr. 2019. V. 11. Art. 61.
McIntosh K., Kapikian A.Z., Turner H.C. et al. Seroepidemiological studies of coronavirus infection in adults and children // Am. J. Epidemiol. 1970. V. 91. Is. 6. P. 585–592.
McNamee L.A., Harmsen A.G. Both influenza-induced neutrophil dysfunction and neutrophil-independent mechanisms contribute to increased susceptibility to a secondary Streptococcus pneumoniae infection // Infect. Immun. 2006. V. 74. № 12. P. 6707–6721.
Meinao I.M., Sato E.I., Andrade L.E. et al. Controlled trial with chloroquine diphosphate in systemic lupus erythematosus // Lupus. 1996. V. 5. Is. 3. P. 237–241.
Mengesha T., Makonnen E. Comparative efficacy and safety of chloroquine and alternative antimalarial drugs: a meta-analysis from six African countries // East Afr. Med. J. 1999. V. 76. № 6. P. 314–319.
Metersky M.L., Masterton R.G., Lode H. et al. Epidemiology, microbiology, and treatment considerations for bacterial pneumonia complicating influenza // Int. J. Infect. Dis. 2012. V. 16. Is. 5. P. e321–e331.
Milewska A., Zarebski M., Nowak P. et al. Human coronavirus NL63 utilizes heparan sulfate proteoglycans for attachment to target cells // J. Virol. 2014. V. 88. № 22. P. 13 221–13 230.
Milewska A., Nowak P., Owczarek K. et al. Entry of human coronavirus NL63 into the cell // J. Virol. 2018. V. 92. Is. 3. Art. e01933-17.
Mitnaul L.J., Matrosovich M.N., Castrucci M.R. et al. Balanced hemagglutinin and neuraminidase activities are critical for efficient replication of influenza A virus // J. Virol. 2000. V. 74. № 13. P. 6015–6020.
Morens D.M., Taubenberger J.K., Fauci A.S. Predominant role of bacterial pneumonia as a cause of death in pandemic influenza: implications for pandemic influenza preparedness // J. Infect. Dis. 2008. V. 198. Is. 7. P. 962–970.
Morris C.J., Earl J.R., Trenam C.W., Blake D.R. Reactive oxygen species and iron – a dangerous partnership in inflammation // Int. J. Biochem. Cell Biol. 1995. V. 27. Is. 2. P. 109–122.
Muramoto Y., Noda T., Kawakami E. et al. Identification of novel influenza A virus proteins translated from PA mRNA // J. Virol. 2013. V. 87. № 5. P. 2455–2462.
Nakagawa K., Lokugamage K.G., Makino S. Viral and cellular mRNA translation in coronavirus-infected cells // Adv. Virus Res. 2016. V. 96. P. 165–192.
Nal B., Chan C., Kien F. et al. Differential maturation and subcellular localization of severe acute respiratory syndrome coronavirus surface proteins S, M and E // J. Gen. Virol. 2005. V. 86. Is. 5. P. 1423–1434.
Nanbo A., Imai M., Watanabe S. et al. Ebolavirus is internalized into host cells via macropinocytosis in a viral glycoprotein-dependent manner // PLoS Pathog. 2010. V. 6. Is. 9. Art. e1001121.
Neuman B.W., Adair B.D., Yoshioka C. et al. Supramolecular architecture of severe acute respiratory syndrome coronavirus revealed by electron cryomicroscopy // J. Virol. 2006. V. 80. № 16. P. 7918–7928.
Neuman B.W., Kiss G., Kunding A.H. et al. A structural analysis of M protein in coronavirus assembly and morpho-logy // J. Struct. Biol. 2011. V. 174. Is. 1. P. 11–22.
Niihara Y., Ge J., Shalev O. et al. Desferrioxamine decreases NAD redox potential of intact red blood cells: evidence for desferrioxamine as an inducer of oxidant stress in red blood cells // BMC Clin. Pharmacol. 2002. V. 2. Is. 1. Art. 8.
Nita-Lazar M., Banerjee A., Feng C. et al. Desialylation of airway epithelial cells during influenza virus infection enhances pneumococcal adhesion via galectins binding // Mol. Immunol. 2015. V. 65. Is. 1. P. 1–16.
Nowak D., Antczak A., Krol M. et al. Antioxidant properties of ambroxol // Free Radic. Biol. Med. 1994. V. 16. № 4. P. 517–552.
Obi A.T., Tignanelli C.J., Jacobs B.N. et al. Empirical systemic anticoagulation is associated with decreased venous thromboembolism in critically ill influenza A H1N1 acute respiratory distress syndrome patients // J. Vasc. Surg. Venous Lymphat. Dis. 2019. V. 7. № 3. P. 317–324.
Ohkuma S., Poole B. Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents // PNAS USA. 1978. V. 75. № 7. P. 3327–3331.
Olitsky P.K., Gates F.L. Experimental studies of the nasopharyngeal secretions from influenza patients. I. Transmission experiments with nasopharyngeal washings // J. Exp. Med. 1921a. V. 33. № 2. P. 125–145.
Olitsky P.K., Gates F.L. Experimental studies of the nasopharyngeal secretions from influenza patients. II. Filterability and resistance to glycerol // J. Exp. Med. 1921b. V. 33. № 3. P. 361–372.
Ooi E.E., Chew J.S., Loh J.P., Chua R.C. In vitro inhibition of human influenza A virus replication by chloroquine // Virol. J. 2006. V. 3. Art. 39.
Oswald N.C., Shooter R.A., Curwen M.P. Pneumonia complicating Asian influenza // Br. Med. J. 1958. V. 2. Is. 5108. P. 1305–1311.
Ozgen S., Kilinc O.K., Selamoglu Z. Antioxidant activity of quercetin: a mechanistic review // Turkish J.A.F. Sci. Tech. 2016. V. 4. № 12. P. 1134–1138.
Pacher P., Novorozhkin A., Szabo C. Therapeutic effects of xanthine oxidase inhibitors: renaissance half a century after the discovery of allopurinol // Pharmacol. Rev. 2006. V. 58. Is. 1. P. 87–114.
Page S., Powell D., Benboubetra M. et al. Xanthine oxidoreductase in human mammary epithelial cells: activation in response to inflammatory cytokines // Biochim. Biophys. Acta. 1998. V. 1381. Is. 2. P. 191–202.
Palacios G., Hornig M., Cisterna D. et al. Streptococcus pneumoniae coinfection is correlated with the severity of H1N1 pandemic influenza // PLoS One. 2009. V. 4. Is. 12. Art. e8540.
Pappas G., Kiriaze I.J., Falagas M.E. Insights into infectious disease in the era of Hippocrates // Int. J. Infect. Dis. 2008. V. 12. Is. 4. P. 347–350.
Parsons L., Bouwman K.M., Azurmendi H. et al. Glycosylation of the viral attachment protein of avian coronavirus is essential for host cell and receptor binding // J. Biol. Chem. 2019. V. 294. № 19. P. 7797–7809.
Pensaert M.B. Porcine epidemic diarrhea // Diseases of swine / Eds B.E. Straw, S. D’Allaire, W.L. Mengeling, D. Taylor. Ames: Iowa State Univ. Press, 1999. P. 179–185.
Peteranderl C., Morales-Nebreda L., Selvakumar B. et al. Macrophage-epithelial paracrine crosstalk inhibits lung edema clearance during influenza infection // J. Clin. Invest. 2016. V. 126. № 4. P. 1566–1580.
Pfeiffer R.F.J. Die Aetiologie der Influenza // Zeitschrift für Hygiene und Infektioskrankheiten. 1893. B. 13. S. 357–386.
Pinto L.H., Holsinger L.J., Lamb R.A. Influenza virus M2 protein has ion channel activity // Cell. 1992. V. 69. Is. 3. P. 517–528.
Pittet L.A., Hall-Stoodley L., Rutkowski M.R., Harmsen A.G. Influenza virus infection decreases tracheal mucociliary velocity and clearance of Streptococcus pneumonia // Am. J. Respir. Cell. Mol. Biol. 2010. V. 42. Is. 4. P. 450–460.
Poss W.B., Huecksteadt T.R., Panus P.C. et al. Regulation of xanthine dehydrogenase and xanthine oxidase activity by hypoxia // Am. J. Physiol. 1996. V. 270. Is. 6. P. L941–L946.
Potter C.W. A history of influenza // J. Appl. Microbiol. 2001. V. 91. Is. 4. P. 572–579.
Povalyaev D. The efficacy of adjuvant use low molecular weight heparins in patients with community-acquired pneumonia // Eur. Respir. J. 2014. V. 44. Suppl. 58. Art. P2503.
Quan F.S., Lee Y.T., Kim K.H. et al. Progress in developing virus-like particle influenza vaccines // Exp. Rev. Vacc. 2016. V. 15. Is. 10. P. 1281–1293.
Rahman M.U., Mazumder A. The immunomodulatory effects of gentamicin, imipenem, piperacillin and amphotericin B on LAK effector function in vitro // FEMS Immunol. Med. Microbiol. 2001. V. 30. Is. 3. P. 249–252.
Ramadan N., Shaib H. Middle East respiratory syndrome coronavirus (MERS-CoV): a review // Germs. 2019. V. 9. Is. 1. P. 35–42.
Reaves B., Banting G. Vacuolar ATPase inactivation blocks recycling to the trans-Golgi network from the plasma membrane // FEBS Lett. 1994. V. 345. Is. 1. P. 61–66.
Reiter R.J., Rosales-Corral S., Tan D.X. et al. Melatonin as a mitochondria-targeted antioxidant: one of evolution’s best ideas // Cell. Mol. Life Sci. 2017. V. 74. Is. 21. P. 3863–3881.
Rejmanek D., Hosseini P.R., Mazet J.A. et al. Evolutionary dynamics and global diversity of influenza A virus // J. Virol. 2015. V. 89. № 21. P. 10993–11001.
Ren L., Zhang Y., Li J. et al. Genetic drift of human coronavirus OC43 spike gene during adaptive evolution // Sci. Rep. 2015. V. 5. Art. 11451.
Rivinoja A., Kokkonen N., Kellokumpu I., Kellokumpu S. Elevated Golgi pH in breast and colorectal cancer cells correlates with the expression of oncofetal carbohydrate T-antigen // J. Cell. Physiol. 2006. V. 208. Is. 1. P. 167–174.
Rivinoja A., Hassinen A., Kokkonen N. et al. Elevated Golgi pH impairs terminal N-glycosylation by inducing mislocalization of Golgi glycosyltransferases // J. Cell. Physiol. 2009. V. 220. Is. 1. P. 144–154.
Rogers D.F. Mucoactive agents for airway mucus hypersecretory diseases // Respir. Care. 2007. V. 52. Is. 9. P. 1176–1193.
Rojek J.M., Perez M., Kunz S. Cellular entry of lymphocytic choriomeningitis virus // J. Virol. 2008. V. 82. № 3. P. 1505–1517.
Rouquette M., Page S., Bryant R. et al. Xanthine oxidoreductase is asymmetrically localized on the outer surface of human endothelial and epithelial cells in culture // FEBS Lett. 1988. V. 426. Is. 3. P. 397–401.
Samji T. Influenza A: understanding the viral life cycle // Yale J. Biol. Med. 2009. V. 82. Is. 4. P. 153–159.
Sanchez-Martinez A., Beavan M., Gegg M.E., Chau K. Parkinson disease-linked GBA mutation effects reversed by molecular chaperones in human cell and fly models // Sci. Rep. 2016. V. 6. Art. 31380.
Sanmartín-Suárez C., Soto-Otero R., Sánchez-Sellero I., Méndez-Álvarez E. Antioxidant properties of dimethyl sulfoxide and its viability as a solvent in the evaluation of neuroprotective antioxidants // J. Pharmacol. Toxicol. Meth. 2011. V. 63. Is. 2. P. 209–215.
Schoeman D., Fielding B.C. Coronavirus envelope protein: current knowledge // Virol. J. 2019. V. 16. № 1. Art. 69.
Scholtissek C., Rohde W., von Hoyningen V., Rott R. On the origin of the human influenza virus subtypes H2N2 and H3N2 // Virology. 1978. V. 87. Is. 1. P. 13–20.
Schrezenmeier E., Dorner T. Mechanisms of action of hydroxychloroquine and chloroquine: implications for rheumatology // Nat. Rev. Rheumatol. 2020. V. 16. Is. 3. P. 155–166.
Schwarz K.B. Oxidative stress during viral infection: a review // Free Radic. Biol. Med. 1996. V. 21. Is. 5. P. 641–649.
Seifart C., Clostermann U., Seifart U. et al. Cell-specific modulation of surfactant proteins by ambroxol treatment // Toxicol. Appl. Pharmacol. 2005. V. 203. Is. 1. P. 27–35.
Sencio V., Barthelemy A., Tavares L.P. et al. Gut dysbiosis during influenza contributes to pulmonary pneumococcal superinfection through altered short-chain fatty acid production // Cell Reports. 2020. V. 30. Is. 9. P. 2934–2947.
Shahwan K., Hesse M., Mork A.K. et al. Sialic acid binding properties of soluble coronavirus spike (S1) proteins: differences between infectious bronchitis virus and transmissible gastroenteritis virus // Viruses. 2013. V. 5. Is. 8. P. 1924–1933.
Shepardson K., Larson K., Cho H. et al. A novel role for PDZ-binding motif of influenza A virus nonstructural protein 1 in regulation of host susceptibility to postinfluenza bacterial superinfections // Viral Immunol. 2019. V. 32. № 3. P. 131–143.
Shibata M., Aoki H., Tsurumi T. et al. Mechanisms of uncoating of influenza B virus in MDCK cells: action of chloroquine // J. Gen. Virol. 1983. V. 64. Is. 5. P. 1149–1156.
Shinya K., Ebina M., Yamada S. et al. Avian flu: influenza virus receptors in the human airway // Nature. 2006. V. 440. № 7083. P. 435–436.
Shivakumar S., Panigrahi T., Shetty R. et al. Chloroquine protects human corneal epithelial cells from desiccation stress induced inflammation without altering the autophagy flux // Biomed. Res. Int. 2018. V. 2018. Art. 76 273 29.
Short K.R., Kasper J., van der Aa S. et al. Influenza virus damages the alveolar barrier by disrupting epithelial tight junctions // Eur. Respir. J. 2016. V. 47. Is. 3. P. 954–966.
Silvestri M., Rossi G.A. Melatonin: its possible role in the management of viral infections – a brief review // Ital. J. Pediatr. 2013. V. 39. Art. 61.
Simmons G., Zmora P., Gierer S. et al. Proteolytic activation of the SARS-coronavirus spike protein: cutting enzymes at the cutting edge of antiviral research // Antivir. Res. 2013. V. 100. Is. 3. P. 605–614.
Skehel J. An overview of influenza haemagglutinin and neuraminidase // Biologicals. 2009. V. 37. Is. 3. P. 177–178.
Sloots T.P., McErlean P., Speicher D.J. et al. Evidence of human coronavirus HKU1 and human bocavirus in Australian children // J. Clin. Virol. 2006. V. 35. Is. 1. P. 99–102.
Small C.L., Shaler C.R., McCormick S. et al. Influenza infection leads to increased susceptibility to subsequent bacterial superinfection by impairing NK cell responses in the lung // J. Immunol. 2010. V. 184. Is. 4. P. 2048–2056.
Smith W., Andrewes C.H., Laidlaw P.P. A virus obtained from influenza patients // Lancet. 1933. V. 222. № 5732. P. 66–68.
Smith E.C., Sexton N.R., Denison M.R. Thinking outside the triangle: replication fidelity of the largest RNA viruses // Ann. Rev. Virol. 2014. V. 1. № 1. P. 111–132.
Sodeman W.A., Doerner A.A., Gordon E.M., Gillikin C.M. Chloroquine in hepatic amebiasis // Ann. Intern. Med. 1951. V. 35. № 2. P. 331–341.
Sola I., Almazan F., Zuniga S., Enjuanes L. Continuous and discontinuous RNA synthesis in coronaviruses // Ann. Rev. Virol. 2015. V. 2. № 1. P. 265–288.
Solomon V.R., Lee H. Chloroquine and its analogs: a new promise of an old drug for effective and safe cancer therapies // Eur. J. Pharmacol. 2009. V. 625. Is. 1–3. P. 220–233.
Son D., Chung M.H. In vitro synergism between chloroquine and antibiotics against Orientia tsutsugamushi // Infect. Chemother. 2014. V. 46. № 3. P. 182–188.
Spickler A.R. Influenza. Flu, grippe, avian influenza, grippe aviaire, fowl plaque, swine influenza, hog flu, pig flu, equine influenza, canine influenza. 2016. http://www.cfsph.iastate.edu/Factsheets/pdfs/influenza.pdf, oбpaщeниe 07.04.2020 г.
Spiekermann S., Landmesser U., Dikalov S. et al. Electron spin resonance characterization of vascular xanthine and NAD(P)H oxidase activity in patients with coronary artery disease // Circulation. 2003. V. 107. № 10. P. 1383–1389.
Srinivasan V., Mohamed M., Kato H. Melatonin in bacterial and viral infections with focus on sepsis: a review // Rec. Pat. Endocr. Metab. Immune. Drug Discov. 2012. V. 6. Is. 1. P. 30–39.
Sritharan M. Iron and bacterial virulence // Ind. J. Med. Microbiol. 2006. V. 24. Is. 3. P. 163–164.
Stavrinides J., Guttman D.S. Mosaic evolution of the severe acute respiratory syndrome coronavirus // J. Virol. 2004. V. 78. № 1. P. 76–82.
Steinhauer D.A. Role of hemagglutinin cleavage for the pathogenicity of influenza virus // Virology. 1999. V. 258. Is. 1. P. 1–20.
Steinhauer D.A., de la Torre J.C., Holland J.J. High nucleotide substitution error frequencies in clonal pools of vesicular stomatitis virus // J. Virol. 1989. V. 63. Is. 5. P. 2063–2071.
Štětinová V., Herout V., Květina J. In vitro and in vivo antioxidant activity of ambroxol // Clin. Exp. Med. 2004. V. 4. Is. 3. P. 152–158.
Sugrue R.J., Hay A.J. Structural characteristics of the M2 protein of influenza A viruses: evidence that it forms a tetrameric channel // Virology. 1991. V. 180. № 2. P. 617–624.
Sun K., Metzger D.W. Influenza infection suppresses NADPH oxidase-dependent phagocytic bacterial clearance and enhances susceptibility to secondary methicillin-resistant Staphylococcus aureus infection // J. Immunol. 2014. V. 192. Is. 7. P. 3301–3307.
Suzuki A., Okamoto M., Ohmi A. et al. Detection of human coronavirus-NL63 in children in Japan // Pediatr. Infect. Dis. J. 2005. V. 24. № 7. P. 645–646.
Szczepanski A., Owczarek K., Bzowska M. et al. Canine respiratory coronavirus, bovine coronavirus, and human coronavirus OC43: receptors and attachment factors // Viruses. 2019. V. 11. Is. 4. Art. 328.
Tan D.X., Kormaz A., Reiter R.J., Manchester L.C. Ebola virus disease: potential use of melatonin as a treatment // J. Pineal Res. 2014. V. 57. Is. 4. P. 381–384.
Tashiro M., Ciborowski P., Reinacher M. et al. Synergistic role of staphylococcal proteases in the induction of influenza virus pathogenicity // Virology. 1987. V. 157. Is. 2. P. 421–430.
Taubenberger J.K., Kash J.C. Influenza virus evolution, host adaptation and pandemic formation // Cell Host Microbe. 2010. V. 7. Is. 6. P. 440–451.
Tauber S.C., Nau R. Immunomodulatory properties of antibiotics // Curr. Mol. Pharmacol. 2008. V. 1. № 1. P. 68–79.
Taylor R.M. Studies on survival of influenza virus between epidemics and antigenic variants of the virus // Am. J. Public. Health Nat. Health. 1949. V. 39. № 9. P. 171–178.
Tektonidou M.G., Andreoli L., Limper M. et al. EULAR recommendations for the management of antiphospholipid syndrome in adults // Ann. Rheum. Dis. 2019. V. 78. № 10. P. 1296–1304.
Terada L.S., Piermattei D., Shibao G.N. et al. Hypoxia regulates xanthine dehydrogenase activity at pre- and posttranslational levels // Arch. Biochem. Biophys. 1997. V. 348. № 1. P. 163–168.
Thyagarajan B., Bloom J.D. The inherent mutational tolerance and antigenic evolvability of influenza hemagglutinin // eLife. 2014. V. 3. P. e03300.
To E.E., Erlich J.R., Liong F. et al. Mitochondrial reactive oxygen species contribute to pathological inflammation during influenza A virus infection in mice // Antioxid. Redox Signal. 2020. V. 32. № 13. P. 929–942.
Tong S., Zhu X., Li Y. et al. New world bats harbor diverse influenza A viruses // PLoS Pathog. 2013. V. 9. Is. 10. Art. e1003657.
Tortorici M.A., Walls A.C., Lang Y. et al. Structural basis for human coronavirus attachment to sialic acid receptors // Nat. Struct. Mol. Biol. 2019. V. 26. № 6. P. 481–489.
Tsai K.N., Chen G.W. Influenza genome diversity and evolution // Microbes Infect. 2011. V. 13. Is. 5. P. 479–488.
Tseng Y.T., Wang S.M., Huang K.J. et al. Self-assembly of severe acute respiratory syndrome coronavirus membrane protein // J. Biol. Chem. 2010. V. 285. № 17. P. 12 862–12 872.
Tyrrell D.A., Bynoe M.L. Cultivation of viruses from a high proportion of patients with colds // Lancet. 1966. V. 1. Is. 7428. P. 76–77.
Tyrrell D.A., Almeida J.D., Cunningham C.H. et al. Coronaviridae // Intervirology. 1975. V. 5. № 1–2. P. 76–82.
Umeki S. Anti-inflammatory action of gentamycin through inhibitory effect on neutrophil NADPH oxidase activity // Comp. Biochem. Physiol. B. Biochem. Mol. Biol. 1995. V. 110. Is. 4. P. 817–821.
van der Sluijs K.F., van Elden L.J., Nijhuis M. et al. IL-10 is an important mediator of the enhanced susceptibility to pneumococcal pneumonia after influenza infection // J. Immunol. 2004. V. 172. Is. 12. P. 7603–7609.
Varga Z.T., Ramos I., Hai R. et al. The influenza virus protein PB1-F2 inhibits the induction of type I interferon at the level of the MAVS adaptor protein // PLoS Pathog. 2011. V. 7. Is. 6. Art. e1002067.
Vasin A.V., Temkin O.A., Egorov V.V. et al. Molecular mechanisms enhancing the proteome of influenza A viruses: an overview of recently discovered proteins // Virus Res. 2014. V. 185. P. 53–63.
Vincent M.J., Bergeron E., Benjannet S. et al. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread // Virol. J. 2005. V. 2. № 1. Art. 69.
Visher E., Whitefield S.E., McCrone J.T. et al. The mutational robustness of influenza A virus // PLoS Pathog. 2016. V. 12. Is. 8. Art. e1005856.
Vivino F.B., Carsons S.E., Foulks G. et al. New treatment guidelines for Sjogren’s disease // Rheum. Dis. Clin. North Am. 2016. V. 42. Is. 3. P. 531–551.
Waqar T., Khushdil A., Haque K. Efficacy of chloroquine as a first line agent in the treatment of uncomplicated malaria due to Plasmodium vivax in children and treatment practices in Pakistan: a pilot study // J. Pak. Med. Assoc. 2016. V. 66. № 1. P. 30–33.
Watanabe T., Watanabe S., Kawaoka Y. Cellular networks involved in the influenza virus life cycle // Cell Host Microbe. 2010. V. 7. Is. 6. P. 427–439.
Watanabe Y., Berndsen Z.T., Raghwani J. et al. Vulnerabilities in coronavirus glycan shields despite extensive glycosylation // bioRxiv. 2020. oбpaщeниe 07.04.2020 г.https://doi.org/10.1101/2020.02.20.957472
Wertheim J.O., Chu D.K.W., Peiris J.S.M. et al. A case for the ancient origin of coronaviruses // J. Virol. 2013. V. 87. № 12. P. 7039–7045.
Wood P.M. The two redox potentials for oxygen reduction to superoxide // Tr. Biochem. Sci. 1987. V. 12. P. 250–251.
Wood P.M. The potential diagram for oxygen at pH 7 // Biochem. J. 1988. V. 253. Is. 1. P. 287–289.
Wu W., Li R., Li X. et al. Quercetin as an antiviral agent inhibits influenza A virus (IAV) entry // Viruses. 2015. V. 8. Is. 1. Art. e6.
Xue G., Gong L., Yuan C. et al. A structural mechanism of flavonoids in inhibiting serine proteases // Food Funct. 2017. V. 8. Is. 7. P. 2437–2443.
Yamamoto N., Matsuyama S., Hoshino T., Yamamoto N. Nelfinavir inhibits replication of severe acute respiratory syndrome coronavirus 2 in vitro // bioRxiv. 2020. https://doi.org/10.1101/2020.04.06.026476
Yamaya M., Nishimura H., Nadine L.K. et al. Ambroxol inhibits rhinovirus infection in primary cultures of human tracheal epithelial cells // Arch. Pharm. Res. 2014. V. 37. Is. 4. P. 520–529.
Yan Y., Zou Z., Sun Y. et al. Anti-malaria drug chloroquine is highly effective in treating avian influenza A H5N1 virus infection in an animal model // Cell Res. 2013. V. 23. № 2. P. 300–302.
Yang B., Yao D.F., Ohuchi M. et al. Ambroxol suppresses influenza-virus proliferation in the mouse airway by increasing antiviral factor levels // Eur. Respir. J. 2002. V. 19. Is. 5. P. 952–958.
Yin Y., Wunderink R.G. MERS, SARS and other coronaviruses as causes of pneumonia // Respirology. 2018. V. 23. Is. 2. P. 130–137.
York I.A., Stevens J., Alymova I.V. Influenza virus N-linked glycosylation and innate immunity // Biosci. Rep. 2019. V. 39. Is. 1. Art. BSR20171505.
Yoshimura A., Ohnishi S. Uncoating of influenza virus in endosomes // J. Virol. 1984. V. 51. № 2. P. 497–504.
Zakaryan H., Arabyan E., Oo A., Zandi K. Flavonoids: promising natural compounds against viral infection // Arch. Virol. 2017. V. 162. Is. 9. P. 2529–2551.
Zhang R., Wang X., Ni L. et al. COVID-19: melatonin as potential adjuvant treatment // Life Sci. 2020. V. 250. Art. 117583.
Zhao Q., Li S., Xue F. et al. Structure of the main protease from a global infectious human coronavirus, HCoV-HKU1 // J. Virol. 2008. V. 82. № 17. P. 8647–8655.
Zhao P., Sun L., Xiong J. et al. Semiaquatic mammals might be intermediate hosts to spread avian influenza virus from avian to human // Sci. Rep. 2019. V. 9. № 1. Art. 11 641.
Zheng J., Yamada Y., Fung T.S. et al. Identification of N-linked glycosylation sites in the spike protein and their functional impact on the replication and infectivity of coronavirus infectious bronchitis virus in cell culture // Virology. 2017. V. 513. P. 65–74.
Zumla A., Chan J.F., Azhar E.I. et al. Coronaviruses – drug discovery and therapeutic options // Nat. Rev. Drug. Discov. 2016. V. 15. № 5. P. 327–347.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


