Успехи современной биологии, 2020, T. 140, № 4, стр. 378-394
Современные представления о токсинах высших грибов: простые азотсодержащие соединения
А. А. Ховпачев 1, *, В. А. Башарин 1, С. В. Чепур 2, **, С. В. Волобуев 3, ***, М. А. Юдин 2, А. С. Гоголевский 2, А. С. Никифоров 2, Л. Б. Калинина 3, М. А. Тюнин 2
1 Военно-медицинская академия им. С.М. Кирова
Санкт-Петербург, Россия
2 Государственный научно-исследовательский испытательный институт военной медицины
Санкт-Петербург, Россия
3 Ботанический институт им. В.Л. Комарова РАН
Санкт-Петербург, Россия
* E-mail: vtmz@vmeda.org
** E-mail: gniiivm_2@mail.ru
*** E-mail: rbo.fungi@binran.ru
Поступила в редакцию 15.03.2020
После доработки 03.04.2020
Принята к публикации 03.04.2020
Аннотация
В микологическом и химическом отношении высшие грибы представляют собой еще малоизученную группу организмов. Из числа их вторичных метаболитов особый интерес для медицины представляют токсичные соединения, выступающие в качестве этиологического фактора острых пищевых интоксикаций, а именно мицетизмов. В настоящем обзоре обобщены данные по видовому распределению на территории России, а также сведения по токсикологическим свойствам некоторых высших грибов – продуцентов простых азотсодержащих соединений. Проанализирована роль индивидуальных веществ этой группы в формировании токсидромов. Рассмотрен ряд минорных компонентов, которые ввиду малых концентраций не обладают самостоятельным значением, однако могут представлять весомый фактор в модификации токсического действия основного соединения. Обобщены данные о новых видах синдромов, ассоциированных с токсинами высших грибов. Cделан вывод о том, что важную роль в ходе течения интоксикации азотсодержащими соединениями может играть сочетанное воздействие токсинов.
ВВЕДЕНИЕ
Предполагают, что на Земле может существовать от 1.5 до 3.8 млн видов грибов, из которых в настоящее время науке известно около 120 тыс., в том числе свыше 27 тыс. макромицетов, то есть видов с крупными плодовыми телами (Ainsworth et Bisby’s…, 2008; Hawksworth, Lücking, 2017). Из всего изученного биоразнообразия около 500 видов макромицетов ядовиты для человека, а 216 – обладают галлюциногенными свойствами (Guzmаn et al., 2000; Beuhler, 2016; Yin et al., 2019). Состояния, возникающие при отравлении высшими грибами, – мицетизмы (шифры МКБ-10 T 40.9, Т 62.0). Из ядовитых и галлюциногенных грибов на территории России описано порядка 150 видов, что определяет значимость мицетизмов в структуре заболеваемости среди прочих причин пищевых интоксикаций небактериальной этиологии (Клиника, диагностика…, 2016; Вишневский, 2019; Govorushko et al., 2019). Несмотря на эволюцию методов анализа и идентификации веществ, токсины макромицетов до настоящего времени мало изучены. Химическая структура идентифицирована не более чем для 5–20% токсинов высших грибов (Arłukowicz-Grabowska et al., 2019).
Макромицеты представляют собой источники видоспецифических биологически активных простых азотсодержащих соединений (Lundström, 1989; Schüffler, 2018; Sandargo et al., 2019). Они могут быть причиной возникновения отдельных нозологий в составе каждой из шести описанных групп токсидромов клинической классификации мицетизмов (Spoerke, Rumack, 1994), дополненной в последнее десятилетие несколькими новыми синдромами (White et al., 2019). В связи с этим необходимо рассмотреть основные токсикологически значимые азотсодержащие соединения высших грибов и современные представления о механизмах их действия. Вследствие тесной связи между распространением ядовитых макромицетов и структуры интоксикаций ими, практический интерес вызывает их биологическое разнообразие, в том числе – на территории нашей страны.
РОЛЬ ПРОСТЫХ АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИИЙ ВЫСШИХ ГРИБОВ В ФОРМИРОВАНИИ ПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ
Несмотря на значимость клинической классификации интоксикаций макромицетами, для понимания вызываемого ими патологического процесса не теряет важности химическая систематизация их токсинов. Простые азотсодержащие соединения макромицетов – разнообразная группа веществ со структурой аминов, нуклеозидов и аминокислот, в том числе непротеиногенных, а также содержащих кислородные (оксоланы) и азотистые (изоксазолы, триптамины, пиридины) гетероциклы (Jin, 2016). Только часть из них можно рассматривать как алкалоиды в традиционном понимании этого термина (Gosselin et al., 1984).
Токсический эффект некоторых соединений обусловлен структурным сходством с нуклеозидами млекопитающих, что определяет цитотоксические свойства, и с аминокислотами-нейромедиаторами, что сопряжено с нейротоксическими и психодислептическими эффектами (Lundström, 1989). Примером служит сходство нестандартных нуклеозидов клитидина и небуларина с биогенными макроэргами, а непротеиногенных аминокислот высших грибов – с нейротрансмиттерами. Корреляция эффектов токсинов макромицетов со структурой их молекулы описана еще акад. С.В. Аничковым (Аничков, 1974) на примере ацетилхолина и мускарина, при этом мускарин в настоящее время – наиболее изученный грибной токсин.
Оксоланы
Интоксикации макромицетами, содержащими оксоланы группы мускарина, сопряжены с формированием судоринового (лат. sudor – потеть) синдрома, летальность при котором в отсутствие лечения может составлять от 2 до 5% (Мусселиус, Рык, 2002; Lurie et al., 2009). Кроме мускарина и его изомеров, к числу широко распространенных среди грибов соединений, которые также в определенных условиях влияют на парасимпатическую нервную систему, относят ряд четвертичных аммониевых оснований и алкалоидов – производных холина и бетаина: ацетилхолин, тригонеллин, гомарин и бутиробетаин, глицинбетаин, гликоилбетаин, а также ареколин и кондельфин (Шиврина, 1965; Jaeger et al., 2013; Chen, Liu, 2017).
Среди ядовитых видов макромицетов, содержащих мускарин и его производные в количествах, достаточных для проявления судоринового синдрома, в нашей стране описаны агарикоидные грибы трех родов (Нездойминого, 1996; Lurie et al., 2009; Funga Nordica…, 2012; Govorushko et al., 2019):
– рода Волоконница (Inocybe): В. темноволосая (I. cincinnata (Fr.) Quеl.), В. краснеющая = = В. Патуйяра (I. erubescens A. Blytt = I. patouillardii Bres.), В. клочковатая (I. flocculosa (Berk.) Sacc.), В. землисто-пластинковая (I. geophylla (Sowerby) P. Kumm.), В. Годэ (I. godeyi Gillet), В. серовато-лиловая (I. griseolilacina Lange), В. иглистая (I. hystrix (Fr.) P. Karst.), В. рваная (I. lacera (Fr.) P. Kumm.), В. пятнистая (I. maculata Boud.), В. реповидноногая (I. napipes Lange.), В. приятная (I. oblectabilis (Britzelm.) Sacc.), В. трещиноватая (I. rimosa (Bull.) P. Kumm.), В. Вайта (I. whitei (Berk., Broome) Sacc.), В. медово-желтая (I. xanthomelas Boursier, Kühner);
– рода Энтолома (Entoloma): Э. продавленная (E. rhodopolium (Fr.) P. Kumm.);
– рода Говорушка (Clitocybe): Г. белесая (C. candicans (Fr.) Р. Kumm.), Г. листолюбивая (C. phyllophila (Pers.) P. Kumm.), Г. красноватая (C. rivulosa (Pers.) P. Kumm.).
До 75% известных представителей рода Inocybe содержат мускарин в концентрациях на порядок выше, чем в других известных видах грибов (Гуревич, Нездойминого, 1990). Наибольшее количество мускарина выявлено в I. oblectabilis – до 16%, а также в I. erubescens и I. geophylla – 6–8% сухой массы, в то время как в плодовых телах Entoloma и Clitocybe – до 0.5% (Lurie et al., 2009).
По механизму действия мускарин – неселективный агонист M-ацетилхолиновых рецепторов и, в отличие от эндогенного лиганда, не подвержен инактивации ацетилхолинэстеразой, что обусловливает большую продолжительность его действия. Среднесмертельные дозы (ЛД50) мускарина составляют для кроликов 27 мг/кг при подкожном введении и 127 мг/кг перорально, для кошек – 1.1 мг/кг внутривенно и 7 мг/кг перорально (The Merck index, 2006). За ЛД50 для человека принимают 50 г свежих плодовых тел I. erubescens, что в пересчете на чистый мускарин составляет 300–500 мг (Jin, 2016).
В количестве менее 0.02% сухой массы, то есть в следовых концентрациях, мускарин и его производные выявлены в Мухоморах красном (Amanita muscaria (L.) Lam.) и пантерном (A. pantherina (DC.) Krombh.), в Свинушке тонкой (Paxillus involutus (Batsch) Fr.), в Руброболете сатанинском, или сатанинском грибе (Rubroboletus satanas (Lenz) Kuan Zhao et Zhu L. Yang), и некоторых миценах (Chilton, Ott, 1976; Jaeger et al., 2013). При этом ошибочное потребление последних вместе с содержащими псилоцибин грибами по причине внешнего сходства может приводить к модификации серотонинового синдрома. Наличие в плодовых телах изоксазолсодержащих грибов мускарина в следовых количествах во многом определяет клинику делирия при отравлении мухоморами, в то время как мусцимол и иботеновая кислота в изолированном виде к нему приводят редко (Brvar et al., 2006).
Наличие в мускарине трех ассиметричных атомов углерода обусловливает существование оптически активных форм – D- и L-изомеров алломускарина, эпиалломускарина, эпимускарина. Однако физиологическую активность проявляют только L(+)-изомеры. Также из числа производных мускарина (1) в составе плодовых тел известны: нормускарин (2), мускарон, нецикличный мускаридин (3) и его два аминоальдегида (рис. 1) (Шиврина, 1965).
Рис. 1.
Химическая структура некоторых токсинов галлюциногенных мухоморов (адаптировано по: Jin, 2016).

Положительный заряд аминогруппы во многом ограничивает способность мускарина преодолевать гематоэнцефалический (ГЭБ) и гематоликворный барьеры, а его токсичность сопряжена с периферическим действием (Мусселиус, Рык, 2002). Однако в больших концентрациях возможно проникновение мускарина или его производных в головной мозг, что ведет к неврологическим нарушениям в виде угнетения и изменения сознания. Так, центральное действие мускарина в изолированном виде отмечали при терапии судоринового синдрома гликопироллатом, обладающим исключительно периферическим действием (Brvar еt al., 2006).
Соединения изоксазолового ряда
В отличие от мускарина, высокой способностью к проникновению через ГЭБ обладают непротеиногенные амины и аминокислоты (рис. 1) – производные изоксазола: мусцимол (4), иботеновая кислота (5) и мусказон (6), вызывающие психотонический пантериновый синдром.
На территории России к высшим грибам, содержащим производные изоксазола в качестве главного токсического начала, относят макромицеты рода Мухомор (Amanita): М. красный (A. muscaria), М. пантерный (A. pantherina), М. ярко-желтый (A. gemmata (Fr.) Bertill.), М. королевский (A. regalis (Fr.) Michael, Führ. Pilzfr.), М. шишковидный (A. strobiliformis (Paulet ex Vittad.) Bertill.) (Funga Nordica…, 2012; Stebelska, 2013; Schüffler, 2018).
Концентрации мусцимола и иботеновой кислоты в плодовых телах A. muscaria варьируют и составляют в среднем 0.2–0.6 и 0.1–0.3% сухой массы соответственно. В то время как в A. pantherina содержание иботеновой кислоты (в среднем до 0.4–0.7%) больше, чем содержание мусцимола (0.3%). Это определяет клинические различия в проявлениях интоксикации (Мусселиус, Рык, 2002; Jin, 2016). Кроме этого, грибы рода Amanita содержат в небольших концентрациях непротеиногенные аминокислоты и алкалоиды, обладающие потенцирующим эффектом. К ним относят стизолобовые кислоты, производные β-карболина, буфотенин и, возможно, некоторые пигменты: амавидин, мускааурин, мускаруфин и беталамовую кислоту (Wurst et al., 2002). Наличие гиосциамина и других алкалоидов, обладающих центральными и периферическими атропиноподобными эффектами, в этих грибах до настоящего времени считают спорным (Patočka, 2012).
Название иботеновой кислоте дано по японскому названию одного из видов ядовитого мухомора – иботенгутаке. Этот гриб филогенетически близок к A. panterina и до 2002 г. был его разновидностью, а сейчас выделен в самостоятельный вид – A. ibotengutake T. Oda, C. Tanaka et Tsuda. Похожая на иботеновую – трихоломовая кислота выявлена в эндемичной для Японии Рядовке мускариновой (Tricholoma muscarium Kawam. ex Hongo) (Tamborini et al., 2017).
ЛД50 иботеновой кислоты для крыс составляют 42 мг/кг внутривенно и 129 мг/кг внутрижелудочно, для мышей – 15 мг/кг внутрибрюшинно и 38 мг/кг внутрижелудочно (The Merck index, 2006; Stebelska, 2013).
Иботеновая кислота структурно напоминает глутаминовую, хорошо проникает через ГЭБ и реализует токсический эффект как частично обратимый агонист NMDA-ионофоров. Она также проявляет сильный агонизм к I (mGluR1,5) и II (mGluR2,3) группам метаботропных рецепторов глутамата, слабый агонизм к АМРА- и каинатным рецепторам, не элиминирует из синаптической щели посредством системы активного захвата, существующей для ГАМК и глутамата, что обусловливает более длительный эффект в сравнении с эндогенными лигандами (Michelot, Melendez-Howell, 2003). Из-за ферментативного декарбоксилирования глутаматдекарбоксилазой (КФ 4.1.1.15) in vivo в мусцимол и спонтанного превращения в мусказон, кислота проявляет свойства ГАМКА-агониста, поэтому в некоторых источниках описана как премусцимол. Иботеновая кислота может оказывать Ca2+-зависимый эксайтотоксический эффект, возникающий при чрезмерной активации NMDA-рецепторов. Помимо индукции апоптоза нейронов иботеновая кислота вызывает вторичную альтерацию миелиновых глиальных оболочек и нарушает аксональный транспорт (Jin, 2016).
Мусказон – лактонный изомер иботеновой кислоты, на настоящий момент обнаружен только у A. muscaria (Yin et al., 2019). Нельзя полностью исключить, что мусказон может быть артефактом, возникающим во время обработки иботеновой кислоты (Antkowiak R., Antkowiak W., 1991). В фармакологических исследованиях мусказон был менее активен, чем иботеновая кислота и мусцимол (Chilton, Ott, 1976).
Мусцимол как прямой обратимый агонист бикукуллин-чувствительного ГАМК-ионофорного комплекса приводит к снижению уровня критического мембранного потенциала и входного сопротивления, обусловленному гиперполяризацией мембраны. Тканевая концентрация мусцимола, активирующая ионный ток через ГАМКА- и ГАМКС-рецепторы нейронов человека, варьирует мало и составляет 0.002 мкмоль/л. В то же время пороговая концентрация в крови, при которой наблюдают клинические эффекты, составляет 4–8 мкмоль/л. Для мусцимола, как и для иботеновой кислоты, свойственна таутомерия. При переходе мусцимола в изомусцимол деполяризация заряда и включение аминного азота в шести- или семичленное кольцо придает молекуле ГАМК-антагонистические свойства. Кроме этого, мусцимол обладает высоким аддиктивным потенциалом, то есть определяет риск возникновения зависимости, обусловленной D3‑положительным подкреплением (Stebelska, 2013). ЛД50 мусцимола для крыс составляет 4.5 мг/кг при внутривенном и 45 мг/кг при внутрижелудочном введениях, для мышей при внутрибрюшинном введении – 2.5 мг/кг, для кролика при внутрижелудочном – 10 мг/кг (Gosselin et al., 1984; The Merck index, 2006).
Пантериновый (микоатропиновый) синдром при интоксикациях мухоморами может значительно отличаться от сочетанного действия мусцимола и иботеновой кислоты в аналогичных дозах (Gosselin et al., 1984). Тяжелые формы отравления почти всегда сопряжены с выраженным вегетативным компонентом по типу холинергического синдрома, с возникновением судорог и коматозного состояния, при выходе из которого регистрируют измененное сознание. У детей вследствие неразвитого ГЭБ течение интоксикации сопряжено с формированием судорожного синдрома чаще, чем у взрослых (Мусселиус, Рык, 2002; Brvar et al., 2006).
Стизолобовая и стизолобиновая кислоты
К психоактивным аминокислотам, модулирующим влияние производных изоксазола в составе мухоморов, относят стизолобовые кислоты (Michelot, Melendez-Howell, 2003).
Стизолобовая кислота (7) и ее изомер стизолобиновая кислота (8) (рис. 1) изначально были выделены в 1959 г. из проростков растения Стизолобии жгучей (Mucuna pruriens var. utilis (Wall. ex Wight) L.H. Bailey = Stizolobium hassjoo Piper et Tracy), а уже потом из ядовитой Говорушки акромелалгической (Clitocybe acromelalga Singer = Paralepistopsis amoenolens (Malençon) Vizzini) (рис. 2) (Fushiya et al., 1992). Они были найдены в обнаруживаемых количествах у некоторых популяций A. gemmata и A. muscaria и во всех образцах A. pantherina (Chen, Liu, 2017). Метаболизм кислот в базидиомах C. acromelalga отличен от такового у мухоморов и связан с пиридоновыми фрагментами акромелиновых кислот, общим предшественником которых может быть D-дигидроксифенилаланин (Wurita et al., 2019).
Рис. 2.
Химическая структура простых индольных (9–16) и ß-карболиновых (17–27) алкалоидов (адаптировано по: The Merck index, 2006).

Эти кислоты по механизму действия – конкурентные антагонисты AMPA- и каинатных рецепторов, они обладают атропиноподобными (антихолинергическими) эффектами. При оценке на нервно-мышечном синапсе рака стизолобиновая кислота была примерно в 5 раз слабее стизолобовой, которая, в свою очередь, в 5 раз уступает эталонному антагонисту AMPA- и каинатных рецепторов – цианкиксалину (Ishida, Shinozaki, 1988a,b). У грызунов кислоты аллостерически модулировали активность канала NMDA-рецептора, что может иметь принципиальное значение в условиях достижения токсического эффекта иботеновой кислотой.
Простые индольные алкалоиды
Сейчас особый интерес к биоразнообразию галлюциногенных макромицетов, в том числе содержащих простые индольные алкалоиды, в нашей стране, по большей части, связан с мерами по пресечению наркомании и профилактики девиантного поведения (Клиника, диагностика…, 2016). Однако в совокупности со своей ограниченной нейротоксичностью некоторые из них могут представлять терапевтическое значение в лечении депрессивных расстройств, резистентных к стандартной терапии (Geiger et al., 2018; Adams et al., 2019; Blei et al., 2020).
К простым индольным алкалоидам, которые выявлены у представителей высших грибов (рис. 2), следует отнести псилоцибин (9), псилоцин (10), диметилтриптамин (ДМТ, 11), буфотенин (12), 5-метоксидиметилтриптамин (5-МеО-ДМТ, 13), эругинасцин (14), беоцистин (15), норбеоцистин (16) (Stebelska, 2013). Также описана группа прениллированных триптаминов, в частности N-метил-4-аллилтриптофан, которые встречают у Спорыньевых (Clavicipitaceae) и считают промежуточными соединениями в биосинтезе производных лизергиновой кислоты. Несмотря на то, что производные псилоцибина формально относят к биогенным аминам, традиционно их рассматривают как алкалоиды (Wurst et al, 2002).
В молекулярном строении производных индол-алкиламинов, которое определяет их психодислептические эффекты, особое значение отведено наличию двух атомов углерода между индолом и аминогруппой. Предполагают, что присутствие четвертичного атома аминного азота значительно снижает проницаемость для ГЭБ и гематоликворного барьера, а наличие ортофосфорной группы увеличивает биодоступность и стабильность соединений. Наличие метоксигруппы в положении 5 индола (5-МеО-ДМТ) и одной метильной группы при атоме азота (беоцистин) усиливает галлюцинаторную активность, увеличивая сродство к рецептору-мишени 5-HT2A. Такая же закономерность прослежена для производных группы фенилэтиламинов, которые могут сопутствовать триптаминам в составе плодовых тел (Lundström, 1989).
Поскольку производные триптамина не относят к вторичным метаболитам, представляющим разграничительный критерий для таксономии, содержащие их макромицеты распределены по 7 семействам порядка Agaricales: Bolbitiaceae, Cortinariaceae, Hymenogastraceae, Mycenaceae, Pluteaceae, Psathyrellaceae, Strophariaceae (Нездойминого, 1996; Малышева, 2018; Guzmаn et al., 2000; Wurst et al., 2002; Jaeger et al., 2013; Stebelska, 2013). Из них на территории РФ можно встретить 22 вида, к токсикологически значимым относят всего 3: Псилоцибе полуланцетовидную (P. semilanceata (Fr.) P. Kumm.), Волоконницу хохлатковую (Inocybe сorydalina Quél.) и Панеолус подпоясанный (Panaeolus subbalteatus (Berk. et Broome) Sacc.). Отмечено, что ядовитые виды Inocybe могут содержать либо мускарин, либо производные триптамина (Гуревич, Нездойминого, 1990). К буфотенин (буфотенидин)-содержащим грибам относят 2 вида из секции Phalloideae рода Amanita: Мухомор поганковидный (Amanita citrina Pers.) и М. порфировый (A. porphyria Alb. et Schwein.) (Stebelska, 2013). Есть мнение, что буфотенин может быть веществом, характерным для всех мухоморов этой секции, однако присутствует в незначительных количествах (Вишневский, 2019).
Содержание псилоцина и псилоцибина в плодовых телах макромицетов с ареалом обитания в нашей стране варьирует и в среднем может составлять до 1–2% сухой массы, что зависит от вида, условий, сезона, климата и субстрата произрастания. Кроме этого, для части из них подтверждено наличие сопутствующих β-карболинов, фенилэтиламинов и психоактивных нециклических терпеноидов, которые могут значимо влиять на токсикокинетику триптаминов и вариабельность проявлений интоксикации (Lundström, 1989).
Псилоцибин обладает собственной активностью такой же, как и у псилоцина, исполняя роль его предшественника. Так, отношение активности по константе взаимодействия с 5-HT2-рецептором, по психодислептическому эффекту и по вегетативному сдвигу у субстанций псилоцибин : псилоцин составляет 1.48, что соответствует разнице по молекулярной массе и отражает одинаковую молярную эффективность этих соединений (Halberstadt, Geyer, 2011).
Среднеэффективные дозы псилоцина для человека при внутривенном введении составляют 22 мкг/кг, при этом выявляют только психологические эффекты; 60 мкг/кг перорально или 37 мкг/кг внутривенно – преходящие галлюцинации, слабые вегетативные реакции; 75 мкг/кг внутримышечно – выраженный галлюцинаторный эффект, средний вегетативный ответ; 130–150 мкг/кг внутримышечно – выраженный токсический психоз, яркие галлюцинации, параноид, средний вегетативный сдвиг (Halberstadt, Geyer, 2011; MacLean et al., 2011). По силе развернутого психотического эффекта при внутривенном введении 45 мкг/кг псилоцина эквивалентны 1 мкг/кг диэтиламида лизергиновой кислоты (ДЛК) и 66 мкг/кг мескалина. Действие псилоцина сравнимо с менее выраженным эффектом ДЛК с незначительными отличиями, заключающимися в характере галлюцинаций, уровне эмоциональности и мистицизма переживаний (Vollenweider et al., 1999).
У животных отклонения в поведении псилоцибин и псилоцин вызывают в дозах от 0.25 до 10 мг/кг, в то время как их ЛД50 составляют соответственно: для крыс – 280–293 мг/кг и 74 мг/кг внутривенно; 420 мг/кг и 280 мг/кг внутрибрюшинно; для кроликов – 13 мг/кг и 7 мг/кг внутривенно. Смерть наступает от остановки дыхания (The Merck index, 2006).
Простые индольные алкалоиды действуют главным образом на рецепторы 5-гидрокситриптамина (5-HT). Псилоцин представляет неселективный агонист, обладая высоким сродством к серотониновым рецепторам 5-HT1A,1В,1D, 5-HT2A,2В,2C, 5‑HT5, 5-HT6, 5‑HT7 при низких и умеренных концентрациях (IC50 < 570 нмоль/л), активируя пресинаптические адренорецепторы α2A (IC50 = 1380 нмоль/л), α2В (IC50 = 1894 нмоль/л) – при больших (Madsen et al., 2019). Также псилоцин обладает аддиктивным потенциалом, напрямую активируя D3‑дофаминергические нейроны в концентрациях, в несколько раз превышающих среднеэффективные для триптаминовой группы рецепторов – IC50 D3 = 2694 нмоль/л, и, в отличие от ДЛК, не взаимодействует с остальными типами дофаминорецепторов напрямую (Blei et al., 2020). Кроме этого, псилоцибин обладает облегчающим действием для выхода эндогенного серотонина и может быть ингибитором серотонинового транспортера в синаптической щели SERT (sodium-dependent serotonin transporter), что приводит к усилению возбуждающего эффекта на постганглионарные нейроны за счет снижения обратного захвата (Halberstadt, Geyer, 2011).
В формировании галлюцинаторного эффекта триптаминов решающее значение имеет возбуждение 5-HT1A и 5-HT2A-рецепторов. Показано, что предварительный прием 20 мг кетансерина, антагониста 5-НТ2А/2C-рецепторов, может полностью заблокировать психотомиметические эффекты псилоцибина (Madsen et al., 2019). Тем не менее, предварительное введение антагониста D2‑рецептора также уменьшает псилоцибин-индуцированный психоз, повышая вероятность того, что вызванные псилоцибином психодислептические эффекты могут быть вторичными в ответ на увеличение дофаминергической нейропередачи. Эта связь также была продемонстрирована при помощи позитронно-эмиссионной визуализации на примере лиганда D2-рецептора [11C]-раклоприда (Vollenweider et al., 1999).
Пороговая концентрация псилоцина в плазме, при которой возникают психотические эффекты у человека, составляет 1.96 мкг/л, при этом происходит оккупация 25% 5-HT2A-рецепторов головного мозга. Кривая насыщения отражает логарифмическую зависимость и характеризует быстрое взаимодействие с 5-HT2A-рецепторами при концентрации псилоцибина в диапазоне от 4.6 до 6.2 мкг/л, когда задействовано от 30 до 60% рецепторов, далее скорость падает. Так, при концентрации в плазме, равной 24 мкг/л, количество провзаимодействовавших рецепторов не достигает 74% (Geiger et al., 2018; Madsen et al., 2019).
Начиная с доз 0.2–0.25 мг/кг, псилоцибин увеличивает общий метаболизм головного мозга в среднем на 10–30%. Разница в скорости нарастания метаболизма напрямую зависит от количества накопленного в зоне мозга псилоцибина и, вероятно, связана с достижением концентраций, при которых происходит опосредованная активация адренергической нейротрансмиссии (Geiger et al., 2018).
Помимо острых проявлений, психоактивные производные триптаминов обладают рядом отдаленных последствий, которые в большей степени актуальны для их хронического потребления. При наркомании, помимо высокой частоты развития психиатрических заболеваний, к ним можно отнести повышение сердечно-сосудистого риска за счет гипертрофической кардиомиопатии с усилением транскрипции и трансляции белка и пролиферацией кардиомиоцитов, опосредованных активацией расположенных на них 5-HT2B-рецепторов (Wurst et al., 2002).
Кроме производных триптамина, группа индольных алкалоидов грибов, а именно изопреноидных индолов, представлена токсинами Спорыньевых (Clavicipitaceae) и Кордицепсовых (Ophiocordycipitaceae), схожими с лизергиновой и клавиновой кислотами. При отравлении алкалоидами проявления эрготизма и клавицепстоксикоза соответствуют по механизмам попаданию токсинов в организм при микотоксикозах. Однако в условиях потребления для достижения психодислептического эффекта, который может быть обусловлен водорастворимыми фракциями алкалоидов группы эрготамина, спорынью рассматривают как источник психоактивных соединений наряду с макромицетами (Guzmаn et al., 2000).
Алкалоиды – производные β-карболина
Алкалоиды β-карболинового ряда (рис. 2): гарман (17), гармол (18), гармин (19), норгарман (20), перлолирин (21) и некоторые эфиры тетрагидрокарболинкарбоновой кислоты по причине общности метаболических путей присутствуют в большинстве содержащих псилоцибин видов и могут значимо влиять на его токсикокинетику (Jaeger et al., 2013; Blei et al., 2020).
Многие β-карболины (17–27) хорошо проникают через ГЭБ, проявляют широкий спектр собственных психофармакологических эффектов, к которым в зависимости от дозы и строения молекулы могут быть отнесены галлюциногенный, анальгетический, анксиогенный и судорожный (Дуленко и др., 1992). Несмотря на собственную высокую психоактивность, содержание β-карболинов в плодовых телах макромицетов составляет до 50–100 мкг/г, поэтому они играют второстепенную роль, модулируя эффекты основных токсинов (Schüffler, 2018).
При интоксикации психоактивными макромицетами β-карболины, обнаруженные в их составе, могут выполнять потенцирующую роль для соединений, утилизация которых происходит при помощи ингибирования моноаминоксидазы А (МАОА, КФ 1.4.3.4.), а именно для триптаминов. Гармин по активности в отношении МАОА в 100 раз превосходит по силе действия антидепрессант ипрониазид. Так, гарман и гармин наполовину (IC50) ингибируют активность МАОА мозга в концентрациях 8.9 и 0.5 мкмоль/л соответственно, а печени – при концентрациях 9.9 и 0.2 мкмоль/л, что на порядок ниже доз, вызывающих судорожный синдром (Дуленко и др., 1992).
Вероятно, β-карболины могут потенцировать развитие делириозного синдрома при интоксикации мускарин- и изоксазол-содержащими грибами. Так, наличие 1-метил-1,2,3,4-тетрагидро-β-карболин-3-карбоновой кислоты (МБККК, 23) было подтверждено у галлюциногенных мухоморов A. panterina и A. сitrina (Antkowiak R., Antkowiak W., 1991). Кроме этого, МБККК и кордисинин D (22) присутствуют в плодовых телах M. metata (Jaeger et al., 2013). Последний также известен для некоторых психоактивных видов рода Cordyceps (Yang et al., 2011).
Избирательным сродством к ацетилхолинэстеразе (КФ 3.1.1.7) обладают 3-(7-гидрокси-9H-β-карболин-1-ил)-пропановая кислота БКПК (24) и бруннеины A (25), B, C, выделенные из Паутинника коричневого (Cortinarius brunneus (Pers.) Fr.) и Полевки цилиндрической (Agrocybe cylindracea (DC.) Maire) (Teichert et al., 2007; Krüzselyi et al., 2019). Высоким сродством к ацетилхолинэстеразе при полном отсутствии ингибирования бутирилхолинэстеразы (КФ 3.1.1.8) обладают алкалоиды инфрактопикрин (26) и 10-гидрокси-инфрактопикрин (27), выделенные из плодовых тел Паутинника надломленного (Cortinarius infractus (Pers.) Fr.). Эффективные концентрации (IC50) этих соединений по ингибированию ацетилхолинэстеразы головного мозга составляют 9.72 и 12.7 мкмоль/л соответственно (Geissler et al., 2010; Patočka, 2012).
По отношению к ГАМК-бензодиазепин-ионофорному комплексу β-карболины делят на три группы: полные антагонисты существенно снижают константу диссоциации для 1,4-замещенных бензодиазепинов (тетраметиленгарман); частичные агонисты/антагонисты действуют как прямые агонисты в низких дозах и антагонисты в высоких (гарман, гармин, МБККК, ее метиловый эфир); модуляторы/ингибиторы (нейтральные агонисты) не влияют на функцию рецептора (этиловый эфир МБККК). В связи с этим, алкалоиды первых двух групп могут выступать как судорожные агенты. Однако ввиду невысоких концентраций в плодовых телах, этот эффект β-карболинов может ограничиваться анксиогенными проявлениями, в том числе при сочетанном действии с псилоцибином.
Производные тетрагидрокарболинкарбоновой кислоты взаимодействуют с серотониновыми рецепторами, выступая как частичные агонисты: для гармана IC50 5-HT2A = 4 мкмоль/л. МБККК и гарман наполовину ингибировали связывание кетансерина (агонист 5-HT7) в концентрациях IC50 = 1.8 и 56 мкмоль/л соответственно, спиперона (агонист 5-HT1A, 5-HT2A) – в концентрациях IC50 = 1.81 и 23.7 мкмоль/л. В тех же концентрациях происходило снижение функции D2–5-дофаминовых и α1-адренорецепторов всех подтипов (Blei et al., 2020).
У гармана, гармола и гармина обнаруживают прямое агонистическое сродство к μ1–3, δ1–2 опиатным рецепторам. Структурное сходство с морфином у β-карболинов с заместителем CH3 в положении R2, к которым, помимо перечисленных веществ, относят МБККК и бруннеины, на порядок выше по отношению к другим алкалоидам данной группы (Дуленко и др., 1992).
Алкалоиды гиромитринового ряда
К грибным ядам, вызывающим неврологические нарушения, а также гемолиз, поражения печени и почек, могут быть отнесены алкалоиды гиромитринового ряда, похожие по механизму токсичности на гидразин (рис. 3) (Мусселиус, Рык, 2002).
Рис. 3.
Химическая структура гиромитрина (28), его гомологов (29–35) и некоторых циклических производных (36–38) (адаптировано по: Schüffler, 2018).
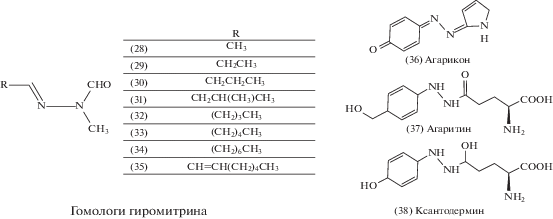
К условно и смертельно ядовитым грибам, содержащим в своем составе гомологи гиромитрина, относят аскомицеты двух семейств порядка Пецицевые (Pezizales) (Patočka et al., 2012):
– семейства Строчковые (Discinaceae): Строчок обыкновенный (Gyromitra esculenta (Pers.) Fr.), С. гигантский (G. gigas (Krombh.) Cooke) и С. осенний, или неприкосновенный (G. infula (Schaeff.) Quél.);
– семейства Лопастниковые (Helvellaceae): Лопастник чашевидный (Helvella acetabulum (L.) Quél.), Л. курчавый (H. crispa (Scop.) Fr.) и Л. белоножковый (H. leucopus Pers.).
Кроме этого, в нашей стране встречаются ядовитые виды, содержащие циклические производные гиромитрина: Шампиньон желтокожий, или карболовый (Agaricus xanthodermus Genev.), о котором известно, что он имеет в составе агарикон (36) и ксантодермин (38), и Рядовку сросшуюся (Leucocybe connata (Schumach.) Vizzini, P. Alvarado, G. Moreno et Consiglio), из которой выделили коннатин, псаллиотин и лиофиллин.
Из производных гидразина в съедобном Шампиньоне двуспоровом (Agaricus bisporus J.E. Lange) выявлен агаритин (37), лишенный острой токсичности (Schüffler, 2018). Предполагают, что под действием грибной агаритин-γ-глутамилтрансферазы (КФ 2.3.2.9) из агаритина высвобождается 4-метоксиметилфенилгидразин, который далее может окисляться до соответствующей диазониевой соли, способной оказывать канцерогенное действие. При лабораторных испытаниях было прослежено возникновение новообразований у мышей в различных тканях при наличии в их рационе большого количества шампиньонов, содержащих агаритин, однако при аналогичных условиях и дозах самого агаритина канцерогенной активности выявлено не было (Patočka et al., 2012).
Съедобными двойниками строчков и лопастников может быть род Сморчки (Morchella), которые настолько похожи на первых, что их тоже рассматривают как условно-съедобные, хотя они лишены ядовитых свойств. Примечательным остается факт, что родовой эпитет esculenta – съедобный, получил именно условно-ядовитый G. esculenta.
Гиромитрин – N-этилиден-N-метилформилгидразон (28) в старых изданиях фигурирует как гельвеловая кислота, которая, как изначально считали, была ядовитым началом строчков, что в ходе дальнейших исследований не нашло подтверждений. Концентрация гомологов гиромитрина (29–35) в сушеной массе G. esculenta сильно зависит от климата и возраста макромицета. При этом на долю гиромитрина может приходиться от 0.05 до 0.9%, а на долю метилбутан-гиромитрина (31) – до 2.3% биомассы, в то время как другие производные обнаруживают в следовых количествах (Antkowiak R., Antkowiak W., 1991).
Острая пероральная токсичность (ЛД50) гиромитрина составляет 344 мг/кг для мышей, 320 мг/кг – для крыс, от 20 до 70 мг/кг – для кроликов. Гибель животных наступает на 2–8 сут (Michelot, Toth, 1991; Patočka et al., 2012). Для человека ЛД50 составляет 25–50 мг/кг для взрослых и 10–30 мг/кг для детей (Мусселиус, Рык, 2002).
В желудке производные гиромитрина подвержены кислотному гидролизу, а в кишке – ферментативной токсификации в метилформилгидразин и монометилгидразин, пик концентраций которых наблюдают в крови через 2 ч после отравления. Так, при внутривенном введении монометил-гидразина собакам ЛД50 составляет 12 мг/кг (The Merck index, 2006). Основным путем первой фазы метаболизма гиромитрина и продуктов его гидролиза может быть P450-микросомальное окисление, в результате которого образуются метильные радикалы и нестабильный диазен, играющие основную роль в реализации перекисного окисления липидов, которое на клеточном уровне опосредует цитолитическое и канцерогенное действия (Patočka et al., 2012). Кроме того, производные гиромитрина вступают в химическое взаимодействие с нуклеиновыми кислотами, образуя ковалентные связи с аминогруппами пуриновых и пиримидиновых оснований, что также оказывает алкилирующее и канцерогенное действия. В сравнении с гиромитринами алифатического ряда, канцерогенное действие у фенил-гиромитринов проявляется в большей степени (Hilbig et al., 1985). В ходе второй фазы метаболизма при участии соответствующих трансфераз происходит конъюгация с эндогенным уридином, фосфатом и ацетатом. В течение суток с мочой элиминирует до 40% гиромитрина, который, обладая диуретическим эффектом, приводит к чрезмерному выведению калия из организма, что, в свою очередь, повышает риск развития электрической нестабильности миокарда (Arłukowicz-Grabowska et al., 2019).
Попав в кровяное русло, гиромитрин с кровотоком распределяется в органах и тканях, проникает через ГЭБ. Он напрямую связывается с альдегидными группами пиридоксаля, образуя пиридоксаль-гидразоны, которые могут ингибировать пиридоксаль-фосфокиназу (КФ 2.7.1.35), ответственную за превращение провитамина B6 в активный пиридоксаль-5-фосфат. Без кофактора пиридоксаль-5-фосфата декарбоксилаза глутаминовой кислоты (КФ 4.1.1.15) не может преобразовать глутамат в ГАМК в шунте Робертса. По мере истощения пула γ-аминомасляной кислоты стимуляция ГАМК-ионофоров падает, что приводит к снижению судорожного порога (Hilbig et al., 1985).
В результате ингибирования других пиридоксальсодержащих ферментов возникают нарушения обмена, которые на аутопсии косвенно определяют по жировому перерождению всех внутренних органов и тканей (Мусселиус, Рык, 2002). Ингибируя кишечную диаминоксидазу (КФ 1.4.3.6), гиромитрин может приводить к нарушению деятельности энтерогематического барьера и повышению его проницаемости для тканевых ядов и микрофлоры, что может потенцировать риск развития множественной органной дисфункции (Michelot, Toth, 1991). В отчетах об отравлениях описаны непостоянная токсичность гиромитрина, влияние повторного потребления содержащих его макромицетов на уровень индивидуальной чувствительности к токсину и наличие идиосинкразии (Perisetti et al., 2018).
Коприн
К непротеиногенным аминокислотам в составе макромицетов относят коприн (39) (рис. 4), вызывающий тетурамовую реакцию при совместном приеме с алкоголем. Данное состояние описано как коприновый синдром, проявляющийся неврологическими и вегетативными изменениями при нарушении метаболических процессов в ходе утилизации этилового спирта.
Рис. 4.
Механизм токсификации коприна (39) до активных метаболитов (40, 41) (адаптировано по: Yin et al., 2019).

Среди произрастающих на территории России грибов данная реакция может возникать при потреблении четырех различных пластинчатых видов: Лепиоты шероховатой (Lepiota aspera (Pers.) Quél., Agaricaceae), Говорушки булавоногой (Ampulloclitocybe clavipes (Pers.) Redhead, Lutzoni, Moncalvo et Vilgalys, Hygrophoraceae), Навозника чернильного (Coprinopsis atramentaria (Bull.) Redhead et al., Psathyrellaceae), Чешуйчатки чешуйчатой (Pholiota squarrosa (Oeder) P. Kumm., Strophariaceae). Среди грибов с пористым гименофором подобные реакции прослежены только у Боровика мясистого (Boletus torosus Fr., Boletaceae) (Haberl et al., 2011; Funga Nordica…, 2012).
В любительской литературе бытует представление, что все навозники обладают свойствами вызывать дисульфирамоподобные реакции, однако это ошибочное мнение. В частности, наличие коприна было опровергнуто для Навозников белого и мерцающего. Кроме этого, коприн может быть не единственным соединением с подобными свойствами. Несмотря на эффект, наличие коприна в составе L. aspera не подтверждено (Вишневский, 2019).
Среднеэффективная доза коприна, ингибирующая альдегиддегидрогеназу (АльДГ, КФ 1.2.1.3), для кроликов составляет 0.2–0.6 г/кг внутривенно. У крыс при перитонеальном введении он начинает оказывать антиферментное действие с дозы 9 мг/кг, развивая максимальный эффект в дозе 0.15–0.18 г/кг. При этой дозе время действия, в ходе которого наблюдают алкоголь-альдегидную диссоциацию, составляет в среднем 75 ч после однократного введения (Antkowiak R., Antkowiak W., 1991). Группа исследователей, выделившая коприн в 1975 г., пришла к выводу, что он тормозит АльДГ печени in vivo, но не in vitro и не может быть прямым ее ингибитором (Hatfield, Schaumberg, 1975). Позднее было выяснено, что коприн, подвергаясь гидролизу в желудочно-кишечном тракте, распадается до аминоциклопропанола (40) и его аналога циклопропангидрата (41) (рис. 4). Коприн и его метаболиты по активности могут быть более мощными, чем дисульфирам, неизбирательными ингибиторами для всех изофором АльДГ и, в отличие от него, не проникать через ГЭБ (Yin et al., 2019).
Помимо ингибирования изоформы АльДГ2, задействованной в реализации целевого тетурамового эффекта, аминоциклопропанол ингибирует и другие изоформы фермента, которые участвуют еще в 17 метаболических путях, фигурирующих в противоопухолевой защите, в утилизации ксенобиотиков и в регуляции сосудистого тонуса. В частности, аминоциклопропанол, ингибируя механизм преобразования из пролекарства, снижает или отменяет сосудорасширяющее действие нитроглицерина на артериальные сосуды, при этом эффективность прямых доноров оксида азота сохранена (Koppaka et al., 2012). Клиническому использованию коприна и аминоциклопропанола в качестве средств, снижающих тягу к алкоголю, препятствовали обусловленные ингибированием АльДГ1 канцерогенные эффекты, выявленные в тесте Эймса и при оценке хронической тридцати- и шестидесятисуточной токсичности для крыс и собак: у животных выявляли угнетение кроветворения, лимфоцитопению и деградацию сперматогенеза и семенников (по: Chen, Liu, 2017).
В ходе интоксикации интенсивность симптомов антабусных реакций тесно связана с количеством грибов и объемом принятого алкоголя, а также временным интервалом между их потреблением. Как правило, проявления регрессируют в течение 2–4 ч. Длительную непереносимость к алкоголю прослеживали в течение нескольких суток преимущественно у лиц с генетически детерминированными низкоактивными формами АльДГ2 с заменой Glu487 на Lys487 (Koppaka et al., 2012).
Пиридиновые аминокислоты P. amoenolens
Синдром эритромелалгии конечностей, связанный с отравлениями Говорушкой акромелалгической (C. acromelalga), был описан еще в 1918 г. в Японии и Южной Корее. До серии случаев эритромелалгии во Франции, а затем в Италии в 1996 г., ассоциированных с Говорушкой благовонной (C. amoenolens), заболевание считали эндемичным для азиатских стран. В 2012 г. оба вида, не встречающиеся в России, по результатам филогенетического анализа были объединены в Paralepistopsis amoenolens (Malençon) Vizzini (Vizzini, Ercole, 2012). P. amoenolens не относят к смертельно ядовитым, но, тем не менее, его употребление вызывает сильную нейропатическую жгучую боль, которая сопровождается гиперемией и отеком конечностей. В наблюдавшихся случаях исход был благоприятный, но разрешение симптоматики было затяжным и происходило в течение от 1 до 4 нед. (Saviuc et al., 2001).
Первоначально к числу ядовитых веществ в составе плодовых тел говорушек были отнесены рибофуранозидные нуклеозиды клитидин (42) и небуларин (43) (рис. 5). Эти соединения, открытые изначально в 1954 г. в Говорушке дымчатой (C. nebularis (Batsch) P. Kumm.), представляют структурные аналоги предшественников НАД и АТФ, поэтому могут приводить к возникновению антиметаболитного эффекта, энергодефицита и нарушения всех видов обмена, связанных с аденином. Прекращая синтез ДНК во время S-фазы митоза, небуларин и клитидин проявляли цитотоксическую и антимитотическую активность на культурах клеток различных тканей. При внутрибрюшинном введении крысам ЛД50 небуларина и клитидина составляют 220 и 50 мг/кг соответственно (Wurita et al., 2019). Содержание клитидина в базидиомах Р. amoenolens европейского и азиатского ареалов может колебаться от 1.4 до 9.3 мг/г и от 3.2 до 14.4 мг/г соответственно (Konno et al., 1982).
Рис. 5.
Химическая структура токсинов P. amoenolens (42–48) и таутомерия дипиридина орелланина (49–51) (адаптировано по: Herrmann et al., 2012).

Однако результаты исследований аналогов нуклеозидов с антиметаболическими свойствами не могли объяснить возникновение выраженного болевого синдрома (Yin et al., 2019). Дальнейший поиск привел к открытию пяти (44–48) типов акромелевых кислот в составе Р. amoenolens. Концентрация аминокислот в плодовых телах крайне мала и может составлять от 0.0001 до 0.00056% сухой биомассы (Fushiya et al., 1992).
Было показано, что акромелевая кислота типа А (44) имеет собственный участок связывания на глутаматных рецепторах и на α2δ-субъединицах потенциалзависимых кальциевых каналов VGCC (voltage-gated Ca2+-channel) нейронов спинного мозга, а ее интратекальное введение крысам в дозе 1 фг/особь приводило к аллодинии (Minami et al., 2004). Активация NMDA- и AMPA-рецепторов акромелевой кислотой участвует в индукции аллодинии только на ранней стадии, а болевому синдрому и спастическому парапарезу в поздней фазе способствуют прямое повреждение спинальных вставочных интернейронов, вторичное повреждение астроцитарной глии и миелинолиз, которые возникают по механизму эксайтотоксичности (Omoto et al., 2015). Альтерация интернейронов акромелевыми кислотами может приводить не только к нарушению деятельности ноцицептивного спинномозгового реле c формированием самоподдерживающихся гиперактивных клеточных агрегатов, но и к дисфункции высших структур системы болевой чувствительности по механизму афферентной сенситизации (Tsuji et al., 1995). Так, острая аллодиния в результате воздействия акромелевой кислотой типа А может возникать у крыс при внутрибрюшинном введении ее в дозе 50 пг/кг и продолжаться в течение месяца наблюдений (Tsuji et al., 1995; Wurita et al., 2019).
Острые эффекты акромелевых кислот снижались или полностью отменялись при коррекции неконкурентными ингибиторами глутаматергической нейротрансмиссии и ингибиторами α2δ-субъединиц VGCC – габапентином и прегабалином (Bourinet et al., 2016). Несмотря на эффективность на ранних стадиях, эти препараты не приводили к значимому снижению болевого синдрома в отдаленном периоде, который мог частично устраняться введением обратного агониста Ca2+-кальмодулин зависимой протеинкиназы II типа (CaMK II) KN-93 (Hendrich et al., 2008).
Пиридиновые алкалоиды грибов рода Cortinarius
До первого упоминания в 1957 г. о серии случаев отравлений в польском г. Быдгощ Паутинником плюшевым (Cortinarius orellanus Fr.) 132 человек, 11 из которых умерли, представителей этого вида считали съедобными. После долгого поиска причины лишь в 1962 г. из C. orellanus был выделен орелланин в количестве 14 мг/г и изучена его токсичность (Grzymala, 1965). Позднее считали, что причиной цитотоксического действия паутинников могут быть еще и индольные циклопептиды, подобные аманитину. Однако существование выделенных в 1984 г. кортинаринов A, B и C почти сразу было поставлено под сомнение, а на данный момент отрицается (Dinis-Oliveira et al., 2016).
Производные орелланина выявлены у 34 из около 700 известных представителей рода Паутинников (Cortinarius), все из которых относят к подроду Leprocybe. Они могут вызывать острое повреждение почек, описанное как орелланиновый синдром (Moser, 1969). Из известных Cortinarius, встречающихся на территории РФ, наличие токсина описано для П. красноватого (C. rubellus Cooke), П. благородного (C. gentilis (Fr.) Fr.), П. блестящего (C. splendens Rob. Henry), содержащих его в сухой массе от 2.5 до 3.0%, и П. браслетчатого (C. armillatus (Fr.) Fr.), у которого орелланин выделен в следовых концентрациях (Нездойминого, 1996; Herrmann et al., 2012; Shao et al., 2016).
Орелланин (49) – тетрагидроксилированное диамин-окисленное бипиридиновое соединение, структурно подобное пульмонотоксичным гербицидам параквату, диквату и нейротоксичному гербициду 1-метил-4-фенил-1,2,3,6-тетрагидропиридину, проявляющему дофаминергическую эксайтотоксичность, которую используют при моделировании паркинсонизма у животных (Shao et al., 2016). Сходными по строению с орелланином соединениями в макромицетах могут быть гомологи эринацерина и пиристриатина, которые содержат только одно пиридиновое кольцо, но также обладают цитотоксической активностью в микромолярном диапазоне концентраций (Chen, Liu, 2017).
В природе орелланин существует еще в виде двух интермедиатов: ореллинина (50) и ореллина (51), а также в форме эпоксидов и семихинонов, в которые вне биологических систем он деградирует после ультрафиолетового облучения (рис. 5). Также он встречается в виде конъюгатов – орелланин-4-глюкопиранозида и орелланин-4-диглюкопиранозида, которые могут проявлять токсические свойства как сами, так и подвергаясь гидролизу (Herrmann et al., 2012). В сравнении с гербицидами, орелланин и ореллинин проявляют окислительные свойства в большей степени, в то время как ореллин лишен ядовитости (Buvall еt al., 2017).
Орелланин обладает избирательным сродством к нефроцитам (Esposito et al., 2015). Биохимический механизм нефротоксичности орелланина заключен в образовании при окислении долгоживущих О-семихиноновых радикалов руллинина и руллина, которые могут участвовать в различных реакциях, в том числе и в ковалентном связывании с биологическими соединениями, что приводит к прямому повреждению клеток. Степень токсичности сильно зависит от активности P450-микросомальной системы и может увеличиваться при введении индукторов этого фермента у грызунов в 1.5–3 раза (Dinis-Oliveira et al., 2016).
Орелланин обладает высокой токсичностью, ЛД50/7 сут для крыс варьирует от 8 до 12.5 мг/кг при внутрибрюшинном введении, а per os составляет 33 мг/кг (Dinis-Oliveira et al., 2016). В организме орелланин подвержен реакции токсификации, двухэтапно преобразуясь в семихинонные соединения. Токсин проявляет ингибирующую активность в отношении синтеза белков, РНК и ДНК, способствует неконкурентному торможению активности щелочной фосфатазы, γ-глутамилтранспептидазы и лейцинаминопептидазы и прерывает продукцию АТФ именно в проксимальном отделе канальцев почки, ухудшая энергозависимую реабсорбцию пептидов и полисахаридов (Buvall еt al., 2017). Было показано, что метаболиты орелланина, но не сам токсин, ингибируют ДНК-зависимую активность РНК-полимераз в клетках как прокариот, так и эукариот, однако в гораздо меньшей степени в сравнении с аманитинами (Moser, 1969).
Аминокислоты грибов рода Amanita
Несмотря на то, что нефротоксичное действие грибов в первую очередь ассоциировано с орелланиновым синдромом, существует еще ряд соединений (рис. 6), вызывающих почечный синдром раннего типа, который по названию главного действующего вещества получил наименование норлейциновый, а в отечественной литературе фигурирующий как проксимановый.
Рис. 6.
Химическая структура токсичных непротеиногенных аминокислот (адаптировано по: Yin et al., 2019).

Впервые случаи острого повреждения почек и печени при потреблении Мухомора псевдопорфирового (Amanita pseudoporphyria Hongo), не содержащего аманитотоксины, были описаны в 1978 г. в Японии (по: Iwafuchi et al., 2003). Тогда же из плодовых тел были выделены L-изомеры норлейцина (53), аллилглицина, или 2-амино-4-пентеновой кислоты (54), и 2-амино-4,5-гексадиеновой кислоты (55) в качестве основных действующих компонентов, вызывающих в эксперименте острый тубулярный некроз почек и стеатоз печени, повторяющий токсическое действие A. pseudoporphyria у людей (рис. 6) (Yin et al., 2019).
После исследования нескольких произошедших в США, Германии и Португалии случаев проксиманового синдрома, вызванного этими непротеиногенными аминокислотами, было выявлено, что они присутствуют, помимо М. очевидного (A. proxima Dumée), еще в нескольких смежных видах: американском A. smithiana Bas, а также западно-европейских A. boudieri Barla и A. gracilior Bas et Honrubia (West et al., 2009). В России к видам, содержащим токсичные аминокислоты, отнесены М. щетинистый (A. echinocephala (Vittad.) Quél.), а также недавно обнаруженный в Приморском крае A. sphaerobulbosa Hongo, у которых определено до 0.26% аллилглицина, 0.91% 2-амино-4,5-гексадиеновой кислоты от сухой массы, а также в следовых количествах 2-амино-5-хлор-6-гидрокси-4-гексеновая кислота (Вишневский, 2019; Govorushko et al., 2019).
Непосредственное повреждение печени и почек токсинами сопровождается нарушениями водно-электролитного баланса, гипогликемией, метаболическим кетоацидозом, гипераммониемией и гиперглицинемией. Ретроспективный анализ клинического течения 53 случаев проксиманового синдрома показал, что токсидром в 38% наблюдений коррелирует только с креатининемией средней выраженности, в 32% – возникает анурия, которая в 24.5% требует заместительной терапии в связи с критическими нарушениями метаболизма (White et al., 2019).
Нестабильные аминокислоты P. porrigens
До серии отравлений в 2004, 2007 и в 2010 гг. Плевроцибеллу вытянутую (Pleurocybella porrigens (Pers.) Singer, Marasmiaceae) в азиатских странах считали съедобным видом грибов. Так, только в Японии в 2004 г. из 55 подвергшихся интоксикации лиц 17 погибло. Несмотря на широкое распространение в наших лесах P. porrigens, связанный с ней синдром отсроченной энцефалопатии в РФ пока не зарегистрирован (Govorushko et al., 2019).
Исследования случаев отравлений показали, что средний возраст пациентов составлял 70 лет, и все они имели хроническую болезнь почек различной степени выраженности (Yin et al., 2109). Симптоматика интоксикаций манифестировала через 12–18 дней в виде легкого тремора в конечностях. Далее спустя 2–3 сут. манифестировала судорожная энцефалопатия, которой сопутствовала гипертермия (Kawaguchi et al., 2010).
Была выдвинута гипотеза о наличии в плодовых телах плевроцибелл антивитамина D, который мог бы приводить к неврологическим нарушениям и тяжелой гипокальциемии, что позднее не подтвердили. В 2010 г. из макромицета выделили четыре нестабильные циклические аминокислоты, а именно изомеры N-ацетил- и N-гликоил-нейраминовых кислот, которые незначительно снижали жизнеспособность культур олигодендроцитов крысы (Kawaguchi et al., 2010). Позже были экстрагированы еще 6 нестабильных амиридинов, которые обладали более выраженной токсичностью, и азиридин – непротеиногенная циклическая аминокислота, которая могла быть предшественником этих соединений в пределах плодовых тел. Ее содержание в плодовых телах P. porrigens составляло до 0.4 мг на 1 г свежей массы. Плевроцибеллазиридин (52) по механизму действия может быть демиелинизирующим агентом, проявляющим тропность к глиоцитам. Эта аминокислота в концентрации 10 мкг/л (87 мкмоль/л) приводила к гибели 50% олигодендроцитов в культуре in vitro, а в концентрации 30 мкг/л – 95% (Wakimoto et al., 2010).
Полиненасыщенные аминокислоты T. venenata
Эпидемиологический анализ 400 смертельных случаев в течение 35 лет в юго-восточной китайской провинции Юньнань привел к выделению в 2010 г. трех ненасыщенных аминокислот в древоразрушающей Трогии ядовитой (Trogia venenata Zhu L. Yang, Y.C. Li et L.P. Tang, Marasmiaceae): 2-амино-5-гексиновой (56), 2-амино-4-гидрокси-5-гексиновой (57) и 4-гуанидинмасляной (58) кислот (рис. 6) (Shi et al., 2006). Гриб эндемичен для этой провинции и собран только в субтропических горных районах на высоте от 1700 до 3000 м над уровнем моря (Yang et al., 2012).
До 70% летальных исходов при Юньнаньском синдроме внезапной сердечной смерти происходили спустя от 8 до 24 ч от начала интоксикации, а летальность была больше среди мужчин 35–55 лет (Zhou et al., 2012). Внезапное начало острых кардиальных симптомов часто сопровождалось такой же внезапной смертью. Средняя продолжительность между возникновением клинических проявлений до летального исхода составляла 2 ч, при этом 60% пострадавших не имели никаких жалоб или признаков сердечно-сосудистых заболеваний (Shi et al., 2006). На этапах оказания помощи регистрировали признаки подостроразвивающегося синдрома электрической нестабильности миокарда и критической гипогликемии. Симптоматика отравления была неспецифичной и проявлялась тошнотой, сердцебиением, слабостью, головокружением, потерей сознания вследствие остановки кровообращения (Wang et al., 2007; Xu et al., 2018).
Танатологический анализ летальных исходов, произошедших с 1991 г. по 2006 г., показал, что морфологические изменения протекали в форме миокардита или жировой дисплазии миокарда. В 38% случаев была обнаружена лимфоцитарная инфильтрация с очаговым некрозом и дисплазией, в 10% – нейтрофильный миокардит с очаговым коагуляционным некрозом, в 14% – изолированное жировое перерождение миокарда, а в 17% наблюдений патологических изменений найдено не было. При этом только в 5% случаев были найдены признаки хронической ишемической болезни сердца в виде кардиофиброза (Wang et al., 2007).
При моделировании интоксикации на грызунах экстракт T. venenata приводил к возникновению сходной симптоматики, сопровождавшейся гипогликемией до 0.6 ммоль/л, развивавшейся в течение 2 ч с момента введения ЛД50, а также нарушением обмена АТФ. Нарушения нуклеозидного обмена, даже при условии компенсации гипогликемии, приводили к энергодефициту с повреждением всех органов и тканей и с дозозависимым нарастанием ферментов повреждения миокарда (Zhou et al., 2012).
ЛД50 2-амино-4-гидрокси-5-гексиновой кислоты и 2-амино-5-гексиновой кислоты при введении крысам per os составляют 71 мг/кг и 84 мг/кг соответственно (Yin et al., 2019). Несмотря на найденные токсины, исследования носят противоречивый характер из-за нестабильности искомых соединений, а также не до конца уточненного патогенеза, что может быть основанием для дальнейшего их изучения (Xu et al., 2018).
ЗАКЛЮЧЕНИЕ
Исследование ядовитых грибов, как и ядовитых организмов в целом, важно с точки зрения как профилактики и лечения отравлений, так и понимания эволюции, поскольку ядовитость – один из значимых механизмов в борьбе за существование. Рассмотренные группы токсичных и галлюциногенных макромицетов неоднородны по своему составу, однако их может объединять то, что они являются одним из этиологических факторов острых интоксикаций.
Благодаря проанализированным источникам, прослежены определенные сложности как в диагностике и терапии клинических проявлений мицетизмов, так и в воспроизводимости симптомокомплексов в условиях экспериментальных исследований. Причинами этого могут быть не до конца изученная этиология отравлений, проблемы в идентификации ядовитых грибов, высокая вариабельность в видовом распределении токсинов, их сочетанность при воздействии. Ответы на эти вопросы могут послужить теоретической основой для дальнейшего совершенствования медицинской помощи при мицетизмах.
Список литературы
Аничков С.В. Избирательное действие медиаторных средств. Л.: Медицина, 1974. 295 с.
Вишневский М.В. Ядовитые грибы России. М.: Проспект, 2019. 448 с.
Гуревич Л.С., Нездойминого Э.Л. Возможность использования алкалоидов псилоцибина и мускарина в хемотаксономии рода Inocybe (Fr.) Fr. // Микол. фитопатол. 1990. Т. 24. № 2. С. 97–105.
Дуленко В.И., Комиссаров И.В., Долженко А.Т. Бета-карболины. Химия и нейробиология. Киев: Наукова Думка, 1992. 216 с.
Клиника, диагностика, лечение, судебно-медицинская экспертиза отравлений грибами. Пособие для врачей / Ред. Е.Ю. Бонитенко. СПб.: ЭЛБИ-СПб, 2016. 240 с.
Малышева Е.Ф. Семейство больбитиевые. Определитель грибов России: Порядок агариковые. Вып. 2. СПб.: Нестор-история, 2018. 416 с.
Мусселиус С.Г., Рык А.А. Отравления грибами. М.: Демиург-АРТ, 2002. 310 с.
Нездойминого Э.Л. Семейство паутинниковые. Определитель грибов России: Порядок агариковые. Вып. 1. СПб.: Наука, 1996. 408 с.
Шиврина А.Н. Биологические активные вещества высших грибов. Л.: Наука, 1965. 200 с.
Adams A.M., Kaplan N.A., Wei Z. et al. In vivo production of psilocybin in E. coli // Metabol. Engin. 2019. V. 56. P. 111–119.
Ainsworth et Bisby’s dictionary of the Fungi. 10th ed. / Eds P.M. Kirk, P.F. Cannon, D.W. Minter, J.A. Stalpers. London: CAB International, 2008. 771 p.
Antkowiak R., Antkowiak W.Z. Alkaloids from mushrooms. Ch. 2 // The alkaloids: chemistry and pharmacology / Ed. A. Brossi. New York: Academic Press, 1991. P. 189–340.
Arłukowicz-Grabowska M., Wójcicki M., Raszeja-Wyszomirska J. et al. Acute liver injury, acute liver failure and acute on chronic liver failure: a clinical spectrum of poisoning due to G. esculenta // Ann. Hepatol. 2019. V. 18. № 3. P. 514–516.
Beuhler M.C. Overview of mushroom poisoning. Ch. 1 // Critical care toxicology / Eds J. Brent, K. Burkhart, P. Dargan et al. Cham: Springer Int. Publ., 2016. P. 1–26.
Blei F., Dörner S., Fricke J. et al. Simultaneous production of psilocybin and a cocktail of β‑carboline monoamine oxidase inhibitors in “magic” mushrooms // Eur. Chem. J. 2020. V. 26. № 3. P. 729–734.
Bourinet E., Francois A., Laffray S. T-type calcium channels in neuropathic pain // Pain. 2016. V. 157. № 1. P. 15–22.
Brvar M., Možina M., Bunc M. Prolonged psychosis after Amanita muscaria ingestion // Wien. Klin. Wochen. 2006. V. 118. № 9–10. P. 294–297.
Buvall L., Khramova A., Najar D. et al. Orellanine specifically targets renal clear cell carcinoma // Oncotarget. 2017. V. 8. P. 91085−91098.
Chen H.P., Liu J.K. Secondary metabolites from higher fungi // Progress in the chemistry of organic natural products / Eds A. Kinghorn, H. Falk, S. Gibbons, J. Kobayashi. Cham: Springer Int. Publ., 2017. P. 1−201.
Chilton W.S., Ott J. Toxic metabolites of Amanita pantherina, A. cothurnata, A. muscaria and other Amanita species // Lloydia. 1976. V. 39. № 2–3. P. 150–157.
Dinis-Oliveira R.J., Soares M., Rocha-Pereira C. et al. Human and experimental toxicology of orellanine // Hum. Experim. Toxicol. 2016. V. 35. № 9. P. 1016–1029.
Esposito P., La Porta E., Calatroni M. et al. Renal involvement in mushroom poisoning: the case of Orellanus syndrome // Hemodial. Int. 2015. V. 19. № 4. P. 11–15.
Funga Nordica: agaricoid, boletoid, clavarioid, cyphelloid and gastroid genera / Eds H. Knudsen, J. Vesterholt. Copenhagen: Nordsvamp, 2012. 1083 p.
Fushiya S., Sato S., Nozoe S.L. Stizolobic acid and L-stizolobinic acid from Cl. acromelalga, precursors of acromelic acid // Phytochem. 1992. V. 31. № 7. P. 2337–2339.
Geiger H.A., Wurst M.G., Daniels R.N. Dark classics in chemical neuroscience: psilocybin // ACS Chem. Neurosci. 2018. V. 9. № 10. P. 2438–2447.
Geissler T., Brandt W., Porzel A. et al. Acetylcholinesterase inhibitors from the toadstool C. infractus // Bioorg. Med. Chem. 2010. V. 18. № 6. P. 2173–2177.
Gosselin R.E., Smith R.P., Hodge H.C. Clinical toxicology of commercial products. 5th ed. Baltimore: Williams and Wilkins, 1984. 248 p.
Govorushko S., Rezaee R., Dumanov J., Tsatsakis A. Poisoning associated with the use of mushrooms: a review of the global pattern and main characteristics // Food Chem. Tox. 2019. V. 128. P. 267–279.
Grzymala S. L’expérimentation par la toxine // Bull. Med. Leg. Tox. 1965. V. 8. P. 73–83.
Guzman G., Allen J.W., Gartz J. A worldwide geographical distribution of the neurotropic fungi, an analysis and discussion // Ann. Mus. Civ. Rover. 2000. V. 14. P. 189–280.
Haberl B., Pfab R., Berndt S. et al. Case series: alcohol intolerance with coprine-like syndrome after consumption of the mushroom Lepiota aspera (Pers.:Fr.) Quél., 1886 (Freckled Dapperling) // Clin. Toxicol. 2011. V. 49. № 2. P. 113–114.
Halberstadt A., Geyer M. Multiple receptors contribute to the behavioral effects of indoleamine hallucinogens // Neuropharmacology. 2011. V. 61. P. 364–381.
Hatfield G.M., Schaumberg J.P. Isolation and structure studies of coprine, the disulfiram-like constituent of C. atramentarius // Lloydia. 1975. V. 38. P. 489−496.
Hawksworth D.L., Lücking R. Fungal diversity revisited: 2.2 to 3.8 million species // Microbiol. Spectr. 2017. V. 5. P. 79–95.
Hendrich J., van Minh A.T., Heblich F. et al. Pharmacological disruption of calcium channel trafficking by the alpha2delta ligand gabapentin // PNAS USA. 2008. V. 105. № 9. P. 3628–3633.
Herrmann A., Hedman H., Rosen J. et al. Analysis of the mushroom nephrotoxin orellanine and its glucosides // J. Nat. Prod. 2012. V. 75. P. 1690–1696.
Hilbig S., Andries T., Steglich W. Zur chemie und antibiotischen aktivität des carbolegerlings (A. xanthoderma) // Ang. Chem. Int. Ed. 1985. B. 97. № 12. S. 1063–1064.
Ishida M., Shinozaki H. Excitatory action of a plant extract, stizolobic acid, in the isolated spinal cord of the rat // Brain Res. 1988a. V. 473. № 1. P. 193–197.
Ishida M., Shinozaki H. Stizolobic acid, a competitive antagonist of the quisqualate-type receptor at the crayfish neuromuscular junction // Brain Res. 1988b. V. 451. № 1–2. P. 353–356.
Iwafuchi Y., Morita T., Kobayashi H. et al. Delayed onset acute renal failure associated with Amanita pseudoporphyria Hongo ingestion // Intern. Med. 2003. V. 42. № 1. P. 78–81.
Jaeger R.J.R., Lamshöft M., Gottfried S. et al. HR–MALDI–MS imaging assisted screening of β-carboline alkaloids discovered from Mycena metata // J. Nat. Prod. 2013. V. 76. № 2. P. 127–134.
Jin Z. Muscarine, imidazole, oxazole and thiazole alkaloids // Nat. Prod. Rep. 2016. V. 33. № 11. P. 1268–1317.
Kawaguchi T., Suzuki T., Kobayashi Y. et al. Unusual amino acid derivatives from the mushroom Pleurocybella porrigens // Tetrahedron. 2010. V. 66. P. 504–507.
Konno K., Hayano K., Shirahama H. et al. Clitidine, a new toxic pyridine nucleoside from Clitocybe acromelalga // Tetrahedron. 1982. V. 38. № 22. P. 3281–3284.
Koppaka V., Thompson D.C., Chen Y. et al. Aldehyde dehydrogenase inhibitors: a comprehensive review of the pharmacology, mechanism of action, substrate specificity, and clinical application // Pharmacol. Rev. 2012. V. 64. № 3. P. 520–539.
Krüzselyi D., Vetter J., Ott P.G. et al. Isolation and structural elucidation of a novel brunnein-type antioxidant β-carboline alkaloid from Cyclocybe cylindracea // Fitoterapia. 2019. V. 137. P. 1–5.
Lundström J. β-phenethylamines and ephedrines of plant origin. Ch. 2 // The alkaloids: chemistry and pharmacology / Ed. G.A. Cordell. San Diego: Academic Press, 1989. P. 77–154.
Lurie Y., Wasser S.P., Taha M. et al. Mushroom poisoning from species of genus Inocybe (fiber head mushroom): a case series with exact species identification // Clin. Toxicol. 2009. V. 47. P. 562–565.
MacLean K.A., Johnson M.W., Griffiths R.R. Mystical experiences occasioned by the hallucinogen psilocybin lead to increases in the personality domain of openness // J. Psychopharm. 2011. V. 25. № 11. P. 1453–1461.
Madsen M.K., Fisher P.M., Burmester D. et al. Psychedelic effects of psilocybin correlate with serotonin 2A receptor occupancy and plasma psilocin levels // Neuropsychopharmacology. 2019. V. 44. № 7. P. 1328–1334.
Michelot D., Melendez-Howell L.M. Amanita muscaria: chemistry, biology, toxicology and ethnomycology // Mycol. Res. 2003. V. 107. № 2. P. 131–146.
Michelot D., Toth B. Poisoning by Gyromitra esculenta – a review // J. App. Toxicol. 1991. V. 11. № 4. P. 235–243.
Minami T., Matsumura S., Nishizawa M. et al. Acute and late effects on induction of allodynia by acromelic acid, a mushroom poison related structurally to kainic acid // Brit. J. Pharm. 2004. V. 142. № 4. P. 679–688.
Moser M. Cortinarius Fr. untergattung Leprocybe subgen. Nov., die rauhkopfe // Zeit Pilzkunde. 1969. B. 35. S. 213–248.
Omoto H., Matsumura S., Kitano M. et al. Comparison of mechanisms of allodynia induced by acromelic acid A between early and late phases // Eur. J. Pharm. 2015. V. 760. P. 42–48.
Patočka J. Natural cholinesterase inhibitors from mushrooms // Mil. Med. Sci. Lett. 2012. V. 81. № 1. P. 40–44.
Patočka J., Pita R., Kuča K. Gyromitrin, mushroom toxin of Gyromitra spp. // Mil. Med. Sci. Lett. 2012. V. 81. № 2. P. 61–67.
Perisetti A., Raghavapuram S., Sheikh A. et al. Mushroom poisoning mimicking painless progressive jaundice: a case report with review of the literature // Cureus. 2018. V. 10. № 4. P. 24–36.
Sandargo B., Chepkirui C., Cheng T. et al. Biological and chemical diversity go hand in hand: Basidiomycota as source of new pharmaceuticals and agrochemicals // Biotechnol. Adv. 2019. V. 37. № 6. P. 107–344.
Saviuc P.F., Danel V.C., Moreau P.A. et al. Erythromelalgia and mushroom poisoning // J. Clin. Toxicol. 2001. V. 39. № 4. P. 403–407.
Schüffler A. Secondary metabolites of basidiomycetes // The physiology and genetics. 2nd ed. / Eds T. Anke, A. Schüffler. N.Y.: Springer Int. Publ., 2018. P. 231–275.
Shao D., Tang S., Healy R.A. et al. A novel orellanine containing mushroom Cortinarius armillatus // Toxicon. 2016. V. 114. P. 65–74.
Shi G.Q., Zhang J., Huang W.L. et al. Retrospective study on 116 unexpected sudden cardiac deaths in Yunnan, China // Chin. J. Epidemiol. 2006. V. 27. P. 96–101.
Spoerke D.G., Rumack B.H. Handbook of mushroom poisoning diagnosis and treatment. Boca Raton: CRC Press, 1994. 456 p.
Stebelska K. Fungal hallucinogens psilocin, ibotenic acid and muscimol // Ther. Drug Monit. 2013. V. 35. № 4. P. 420–442.
Tamborini L., Mastronardi F., Presti L.L. et al. Synthesis of L-tricholomic acid analogues and pharmacological characterization at ionotropic glutamate receptors // Chem. Select. 2017. V. 2. № 31. P. 10295–10299.
Teichert A., Schmidt J., Porzel A. et al. Brunneins A–C, β-carboline alkaloids from Cortinarius brunneus // J. Nat. Prod. 2007. V. 70. № 9. P. 1529–1531.
The Merck index. An encyclopedia of chemicals, drugs, and biological. 13th ed. / Ed. M.J. O’Neil et al. N.J.: Merck and Co., Inc., 2006. 1091 p.
Tsuji K., Nakamura Y., Ogata T. et al. Neurotoxicity of acromelic acid in cultured neurons from rat spinal cord // Neuroscience. 1995. V. 68. № 2. P. 585–591.
Vizzini A., Ercole E. Paralepistopsis gen. nov. and Paralepista (Basidiomycota, Agaricales) // Mycotaxon. 2012. V. 120. № 1. P. 253–267.
Vollenweider F.X., Vontobel P., Hell D., Leenders K.L. 5-HAT modulation of dopamine release in basal ganglia in psilocybin-induced psychosis in man – a PET study with [11C] raclopride // Neuropsychopharmacology. 1999. V. 20. P. 424–433.
Wakimoto T., Asakawa T., Akahoshi S. et al. Proof of the existence of an unstable amino acid: pleurocybellaziridine in Pleurocybella porrigens // Ang. Chem. Int. Ed. 2010. V. 50. № 5. P. 1168–1170.
Wang H., Zhao H., Song L. et al. Pathological study of unexpected sudden death clustered in family or village in Yunnan province: report of 29 cases of autopsy // Zhonghua yi xue za zhi. 2007. V. 87. № 31. P. 2209–2214.
West P.L., Lindgren J., Horowitz B.Z. Amanita smithiana mushroom ingestion: a case of delayed renal failure and literature review // J. Med. Toxicol. 2009. V. 5. № 1. P. 32–38.
White J., Weinstein S.A., De Haro L. et al. Mushroom poisoning: a proposed new clinical classification // Toxicon. 2019. V. 157. P. 53–65.
Wurita A., Hasegawa K., Konno K. et al. Quantification of clitidine in caps and stems of poisonous mushroom P. acromelalga by hydrophilic interaction liquid chromatography-tandem mass spectrometry // Foren. Toxicol. 2019. V. 37. № 2. P. 378–386.
Wurst M., Kysilka R., Flieger M. Psychoactive tryptamines from basidiomycetes // Folia Microbiol. 2002. V. 47. № 1. P. 3–27.
Xu Y.C., Xie X.-X., Zhou Z.Y. et al. A new monoterpene from the poisonous mushroom Trogia venenata, which has caused sudden unexpected death in Yunnan province, China // Nat. Prod. Res. 2018. V. 1. P. 2547–2552.
Yang M.L., Kuo P.C., Hwang T.L. et al. Anti-inflammatory principles from Cordyceps sinensis // J. Nat. Prod. 2011. V. 74. № 9. P. 1996–2000.
Yang Z.L., Li Y.C., Tang L.P. et al. Trogia venenata (Agaricales), a novel poisonous species which has caused hundreds of deaths in southwestern China // Mycol. Prog. 2012. V. 11. № 4. P. 937–945.
Yin X., Yang A., Jin-Ming G. Mushroom toxins: chemistry and toxicology // J. Agricult. Food Chem. 2019. V. 18. № 67. P. 5053–5071.
Zhou Z.Y., Shi G.Q., Fontaine R. et al. Evidence for the natural toxins from the mushroom Trogia venenata as a cause of sudden unexpected death in Yunnan province, China // Ang. Chem. Int. Ed. 2012. V. 51. № 10. P. 2368–2370.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


