Успехи современной биологии, 2020, T. 140, № 4, стр. 315-332
Вопросы математического моделирования в биологии. Часть 1. Динамические модели первичных процессов фотосинтеза
Г. Ю. Ризниченко 1, *, А. Б. Рубин 1
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет, кафедра биофизики
Москва, Россия
* E-mail: riznich@biophys.msu.ru
Поступила в редакцию 24.04.2020
После доработки 24.04.2020
Принята к публикации 24.04.2020
Аннотация
Обсуждаются возможности и преимущества системно-динамического и агентного подходов для моделирования процессов в живых системах. На примере моделирования процессов в энергопреобразующей фотосинтетической мембране демонстрируются основные принципы и примеры кинетического и прямого многочастичного компьютерного моделирования фотосинтетического электронного транспорта и сопряженных процессов. В первой части статьи рассмотрены детальные кинетические модели, которые позволяют изучать динамику происходящих в фотосинтетической мембране процессов, недоступных непосредственному экспериментальному измерению. Идентификация параметров кинетических моделей по данным экспериментов позволяет оценить константы скоростей отдельных реакций, а также проследить изменения характеристик фотосинтеза у разных автотрофных организмов в ходе роста культуры, при разных режимах освещения, в условиях стресса. Материал статьи основан на результатах исследований, выполненных на кафедре биофизики биологического факультета МГУ им. М.В. Ломоносова.
ВВЕДЕНИЕ
История развития математического моделирования процессов в живых системах прошла несколько этапов. К середине XX в. были предложены отдельные феноменологические модели процессов в живых системах. Некоторые наиболее известные из них: модель неограниченного роста Мальтуса (Мальтус, 1993; Malthus, 1798), модель ограниченного роста Ферхюльста (Verhulst, 1838), модели взаимодействия биологических видов Вольтерра (Вольтерра, 1976; Volterra, 1931), модель ферментативного катализа Михаэлиса–Ментен (Michaelis, Menten, 1913), модель роста микроорганизмов в проточной культуре Моно (Monod, 1950).
Во второй половине XX в. круг моделируемых процессов существенно расширился, появились модели ферментативных реакций, в том числе: модели колебаний в гликолизе Хиггинса (Higgins, 1954, 1967) и Селькова (Сельков, 1968; Иваницкий и др., 1978), модели метаболической и генной регуляции (Эйген, 1973; Эйген, Шустер, 1982), модели биологических ритмов, или биологических часов (Колебательные процессы…, 1967; Уинфри, 1990; Гласс, Мэки, 1991).
Были предложены и получили развитие модели, представлявшие собой системы нелинейных дифференциальных уравнений c двумя или тремя переменными, допускающие аналитическое исследование методами качественной теории дифференциальных уравнений (Романовский и др., 1975, 1984; Рубин и др., 1977, 1987). Представление о характерных временах процессов в клетке и о наличии узкого места (bottle neck), соответствующее в биологии принципу Либиха, теория лимитирующего фактора (Полетаев, 1966, 1973) давали возможность упростить полную систему уравнений и при этом выявить главные факторы, которые определяют динамику биологических процессов, протекающих в системе. Теорема Тихонова (Тихонов, 1952), в которой сформулированы условия, допускающие упрощение систем дифференциальных уравнений с малыми параметрами при производных, дала строгое математическое обоснование метода квазистационарных концентраций для сложных систем, в которых процессы протекают с сильно отличающимися характерными временами. Именно таким путем было, по существу, получено и классическое уравнение ферментативной кинетики Михаэлиса–Ментен.
СИСТЕМНО-ДИНАМИЧЕСКИЕ (КИНЕТИЧЕСКИЕ) МОДЕЛИ
Перечисленные выше классические модели математической биологии являются результатом системно-динамического подхода к моделированию. Он состоит в том, что в изучаемой системе выделяются реально измеряемые переменные (концентрация веществ в клетке, численность видов в популяции или клеток в культуре) и связи между ними. Важно, что при этом должна обеспечиваться достаточность выделенных характеристик для адекватного описания системы (гипотеза о замкнутости). Затем составляется система дифференциальных или дискретных уравнений, в которых количественно отражено, как меняются величины этих переменных во времени и пространстве. Аналитическое или численное решение такой системы уравнений при различных значениях внешних и внутренних параметров системы и при различных начальных условиях позволяет дать прогноз динамического поведения системы, что соответствует решению прямой кинетической задачи. Обратная кинетическая задача состоит в таком подборе формы уравнений и значений параметров (констант скоростей), при которых поведение переменных системы в модели будет соответствовать реально наблюдаемой в эксперименте или в природе динамике.
В докомпьютерную эпоху описывающая реальную систему модель (система уравнений) исследовалась аналитически (на бумаге). Поэтому авторы стремились сформулировать модель максимально просто, в силу чего большинство моделей имели феноменологический характер. Хотя и сильно упрощенные, такие системно-динамические, или кинетические, модели сыграли большую роль в становлении и развитии математической биологии. Они позволили найти общие (базовые) условия возникновения нетривиальных динамических режимов таких, как периодические колебания, хаос, пространственно-временные режимы типа автоволн и самоорганизация негомогенных структур. В ряде монографий и учебников представлено современное состояние математической биологии (Романовский и др., 2004; Мюррей, 2009, 2011; Ризниченко, 2011; Рубин, 2013; Ризниченко, Рубин, 2018; Rubin, Riznichenko, 2014; Rubin, 2017).
В реальных живых системах параметры функционирования непрерывно меняются, а сами лимитирующие стадии переключаются. Поэтому описание сложных систем с помощью небольшого числа уравнений в большинстве случаев могло отражать лишь самые общие качественные черты процессов, например наличие автоколебаний или автоволн. В целом феноменологические модели были слишком схематичными и, конечно, не могли удовлетворить биологов, обладавших к этому времени обширными и детальными знаниями о сложной организации биологических систем на всех уровнях от макромолекулярного до популяционного.
Возможности математического моделирования существенно расширились в конце XX в. в связи с появлением и бурным развитием компьютерной техники. Стало возможным разрабатывать детальные системно-динамические модели, содержащие сотни и тысячи реальных компонентов, решать системы огромного числа уравнений, моделировать процессы в системах, обладающих сложной геометрией. Современные информационные технологии позволяют моделировать процессы в многокомпонентных системах, используя большие массивы данных, объем которых непрерывно возрастает в разных областях биологии. В свою очередь, необходимость обработки больших объемов данных (Big data) требует достаточно изощренных математических методов.
АГЕНТНЫЕ МОДЕЛИ
В начале XXI в. при моделировании систем самой разной природы получили распространение так называемые агентные модели. В традиционном системно-динамическом подходе система исходно характеризуется некими обобщенными переменными (численность видов, концентрация веществ).
Реальные биологические системы включают в себя компоненты различных пространственных масштабов, и в них протекают процессы, характерные времена которых отличаются на многие порядки. Очевидно, адекватное описание динамики таких сложных систем требует одновременного применения целой совокупности различных математических методов и модельных подходов.
В новом агентном, корпускулярном методе моделирования предполагается выводить общие свойства сложных систем на основе свойств и механизмов взаимодействия составляющих эти системы агентов, или атомов, – неких простейших реальных объектов, составных элементов этой системы.
Агентное и традиционное системно-динамическое описания взаимно дополняют друг друга. В большой мере сам способ описания во многом определяется целями моделирования. Так, для ответа на качественные вопросы о типе и условиях динамического поведения системы удобно составлять и изучать упрощенные феноменологические модели. А детальные атомистические модели необходимы для понимания, каким образом механизмы взаимодействия биомакромолекул в клетке или особей в популяции определяют динамические свойства сложных систем. Наиболее полное понимание достигается, когда оба описания проникают друг в друга. В науке таким классическим примером взаимопроникновения общего феноменологического и атомистического подхода является истолкование методами статистической физики понятия химического потенциала и характеристических функций (свободная энергия), которыми широко пользуются в химии и биологии (Рубин, 2013).
В настоящее время в моделировании биологических процессов в клетке разрабатываются как системно-динамические (кинетические), так и агентные (атомистические) многочастичные модели. На разных уровнях здесь выступают в качестве агентов (атомов) непосредственно атомы (модели внутримолекулярной динамики биополимеров), взаимодействующие биомакромолекулы (модели броуновской динамики белков), а также фрагменты разной степени агрегированности этих же элементов – крупнозернистые (course-grain) модели. Часть 1 данной статьи посвящена кинетическим моделям первичных процессов фотосинтеза разной степени сложности, часть 2 – многочастичным агентным моделям. В последнем разделе статьи будет приведен пример использования качественных и детальных кинетических моделей и многочастичного броуновского моделирования (агентный подход) для выяснения механизмов переключения метаболических потоков в клетках водород выделяющих водорослей с пути фиксации углерода на путь производства молекулярного водорода (альтернативного топлива).
ОЦЕНКА ПАРАМЕТРОВ
В настоящее время модели различных технических систем достигли большой степени детализации. Так, 3D-модели автомобилей, самолетов, других технических устройств позволяют проигрывать разнообразные ситуации и тестировать систему in silico уже на стадии инженерной разработки. Конечно, практически все параметры элементов и их взаимодействий для рукотворных технических устройств известны, что позволяет в модели воспроизвести реальную динамику объекта.
Однако моделирование живых систем представляет намного более трудную задачу. Биологические системы являются настолько сложными, многокомпонентными, взаимодействия их составных элементов так лабильны и нелинейны, что точно описать законы этих взаимодействий либо не удается, либо возможно только феноменологически. Определение параметров (констант скоростей реакций) взаимодействия компонентов системы также представляет большие сложности, в том числе для биохимических реакций, где скорости отдельных реакций и механизмы взаимодействий реагентов в растворе могут сильно отличаться от тех же скоростей в нативной системе.
Именно эти обстоятельства и не позволяют осуществить заманчивый проект “Электронная клетка”, хотя мощь современных компьютеров, казалось бы, позволяет воспроизвести динамику всех реакций в клетке, число которых около 10 млн. Строго говоря, параметры взаимодействия между элементами системы можно точно определить только в моделях внутримолекулярной динамики биополимеров, где известны физические силы взаимодействия отдельных атомов в макромолекуле. В настоящее время такими методами рассчитывают динамику систем, состоящих из миллионов атомов, но на временах не более порядка микросекунд. Однако молекулярными носителями настоящей жизни являются взаимодействующие комплексы, содержащие намного больше атомов, а характерные времена процессов занимают широкий диапазон от миллисекунд до минут, часов и более. В связи с этим в моделях субклеточных, клеточных и систем более высокого уровня выделяют составные элементы, содержащие много атомов, это так называемые, крупнозернистые модели (Papoian, 2017).
СИСТЕМА ПЕРВИЧНЫХ ПРОЦЕССОВ ФОТОСИНТЕЗА
С точки зрения демонстрации возможностей математического моделирования, система первичных процессов фотосинтеза – уникальный объект. В течение последних десятилетий наблюдается существенное продвижение в нашем понимании фундаментальных механизмов трансформации энергии в биомембранах. Прикладное значение этих фундаментальных исследований состоит в направленной разработке методов получения целевых продуктов фотосинтеза: биотоплива (водород), каротиноидов, липидов и др. Фотосинтетические реакционные центры (РЦ) могут служить и составляющими частями биосенсоров, фотопреобразующих устройств, гибридных нанобиосистем, содержащих искусственные структуры (квантовые точки).
В настоящее время в первичных процессах фотосинтеза экспериментально определены константы скоростей отдельных элементарных стадий как в растворах, так и в нативных системах. Для большинства биологических процессов это представляет собой очень сложную задачу. Так, регистрируемая в биохимических экспериментах кинетика обычных ферментативных реакций отражает лишь этапы образования и распада фермент-субстратных комплексов, но не элементарных взаимодействий в них, которые протекают в соответствии с квантово-химическими механизмами в наносекундном временном диапазоне.
Между тем, короткие лазерные вспышки длительностью от фемтосекунд до пикосекунд запускают быстрые первичные процессы в фотосинтезирующих мембранах. Кинетика переноса электронов по фотосинтетической цепи и сопряженных процессов преобразования энергии в фотосинтетической мембране может непосредственно регистрироваться при возбуждении такими короткими мощными вспышками света с помощью спектральных методов (дифференциальная спектроскопия, флуоресцентные методы, метод электронного парамагнитного резонанса). Эти методы и позволяют в реальном времени регистрировать кинетические кривые и определять скорости быстрых изменений состояний отдельных компонентов системы в начальных стадиях фотосинтеза.
Другой важной особенностью системы первичных процессов фотосинтеза как объекта моделирования является то обстоятельство, что отдельные фотосинтетические РЦ фотосистем I и II (ФСI и ФСII) могут быть выделены из фотосинтетической мембраны. Это позволяет непосредственно изучать значения кинетических параметров реакций, необходимых для построения модели целостной системы фотосинтетического электронного транспорта.
Система первичных процессов фотосинтеза как объект математического моделирования
Первичные процессы преобразования поглощенных квантов света в энергию макроэргических соединений происходят в субклеточных системах – тилакоидах хлоропластов зеленых растений и водорослей и хроматофорах фотосинтезирующих бактерий. На рис. 1 представлены схемы и микрофотографии хлоропластов зеленых растений.
Рис. 1.
Схемы и микрофотографии хлоропластов зеленых растений. В верхнем правом углу показано расположение основных молекулярных комплексов в фотосинтетической мембране (Albertsson, 2001). Подробнее эти комплексы изображены на рис. 2.

Фотосинтетическая энергопреобразующая мембрана и происходящие в ней процессы запасания энергии детально изучены экспериментально, полученные данные суммированы в обзорах и монографиях (Рубин, 2013; Rabinowitch, Govindjee, 1969; Amesz, 1987; Hall, Rao, 1999; Ke, 2001, 2006; Nelson, Yocum, 2006; Blankenship, 2014; Barber, 2015; Shevela et al., 2019), информация представлена на сайтах (Govindjee, 2019).
В настоящее время имеются структурные данные о белковом составе комплексов фотосинтетических РЦ ФСI и ФСII, цитохромного комплекса, комплекса АТФ-синтазы. Получены рентгеноструктурные разрешения комплексов с точностью до 1–2 Ǻ. На рис. 2 приведена схема фотосинтетической мембраны в соответствии с этими структурными данными.
Рис. 2.
Мультиферментные комплексы в фотосинтетической мембране.
Стрелками на рисунке указаны пути переноса электрона (http://photosynthesis.sbcs.qmul.ac.uk/nield/downloads.html).

Основные участники процесса фотосинтетического электронного транспорта – мультиферментные комплексы – встроены в бислойную мембрану и обеспечивают направленный перенос электрона через фотосинтетическую мембрану. Быстрое (в течение 10–12 с) разделение зарядов в первичной фотохимической паре ФСI и ФСII, перенос электрона с внутренней (люминальной) на внешнюю сторону тилакоидной мембраны и дальнейшая квазистабилизация разделенных зарядов на разных сторонах мембраны приводят к тому, что мембрана заряжается как конденсатор. Кроме комплексов фотосинтетических РЦ ФСI и -II, в мембрану встроены еще два типа комплексов – цитохромный комплекс, организующий трансмембранный перенос протонов внутрь тилакоида, и комплекс АТФ-синтазы, в ходе работы которого электрохимический потенциал на мембране превращается в энергию химических связей АТФ. Эти четыре типа комплексов представляют собой своеобразные молекулярные машины.
Перенос электронов по электрон-транспортной цепи сопряжен с переносом протонов из внешнего (строма) во внутреннее (люмен) пространство тилакоида. Выделение протонов в люминальное пространство происходит на участке разложения воды (донорная часть ФСII) – один протон на один электрон. Второй участок выделения протонов – люминальная сторона цитохромного комплекса b6f. Сюда протоны приносят молекулы протонированного пластохинона (пластохинола), которые, будучи двухэлектронными переносчиками, принимают два электрона с акцепторной части ФСII, захватывают два протона из внешнего пространства тилакоидной мембраны, и в нейтральном виде молекулы PQH2 диффундируют в тилакоидной мембране. При взаимодействии с люминальной частью цитохромного комплекса они отдают два протона в люмен тилакоида, один электрон – в цепь линейного транспорта и второй электрон – в цепь электронного транспорта внутри цитохромного комплекса (так называемый цикл Митчелла). Таким образом, на один электрон, перенесенный в цепи линейного транспорта, в люминальное пространство выделяется три протона.
Цепь переноса электрона от воды к НАДФН, высокоэнергетическому соединению, важнейшему участнику цикла фиксации углерода и других биохимических циклов, называется линейным путем электронного транспорта. Трансмембранный электрический и образующийся позднее электрохимический потенциал (в виде градиента протонов) представляют собой промежуточные формы запасания энергии света. С помощью молекулярного мотора АТФ-синтазы градиент протонов используется для синтеза высокоэнергетических соединений – молекул АТФ, которые участвуют в большинстве метаболических реакций и являются своеобразной энергетической валютой клетки. Подобный механизм образования АТФ существует также в митохондриях – дыхательных фабриках как растительных, так и животных клеток. В настоящее время исследованы физические механизмы и разработаны многочисленные модели работы АТФазы (Романовский, Тихонов, 2010).
Посредниками между цитохромным комплексом и ФСI являются молекулы белка пластоцианина (Pc), диффундирующие в люмене. Восстановление молекул НАДФ, необходимых в цикле фиксации углерода, осуществляют подвижные в строме молекулы небольшого белка ферредоксина (Fd). Кинетические параметры взаимодействия комплексов с подвижными переносчиками определяются как диффузией подвижного переносчика к соответствующему комплексу, так и вероятностью правильной посадки (докинга) подвижного переносчика на соответствующий сайт на донорной или акцепторной стороне комплекса. Важную роль здесь играют размеры, форма и электростатические свойства переносчика, подвижного в соответствующем компартменте (PQ – внутри мембраны, Pc – в люмене, Fd – в стромальном пространстве, см. рис. 2), а также геометрия реакционного объема. Именно эти участки, где скорость переноса электрона зависит от пространственной организации мембраны и характера диффузии переносчиков, являются объектом регуляции со стороны целой клетки. Эффективность взаимодействия в большой мере определяется электростатическими взаимодействиями локальных зарядов атомных групп на поверхности донора и акцептора.
Моделирование процессов различной природы в единой системе первичных процессов фотосинтеза требует разных математических и компьютерных подходов.
Кинетические модели фотосинтетического электронного транспорта
Первые кинетические модели фотосинтеза (Кукушкин и др., 1975; Holzapfel, Bauer, 1975), как и модели других биохимических процессов, были основаны на известном законе действующих масс, который гласит, что скорость взаимодействия двух веществ пропорциональна произведению концентраций этих веществ. Этот закон справедлив только в случае полного перемешивания, когда достаточно большое число молекул каждого вещества свободно диффундируют в гомогенной среде. Тогда скорость реакции можно считать пропорциональной вероятности столкновений двух молекул разного типа.
В конце 1960-х гг. пришло понимание того факта, что компоненты фотосинтетической цепи не плавают свободно в цитоплазме. Это вызвало к жизни появление новых моделей, где отдельный фотосинтетический РЦ рассматривается как единое целое. В таких моделях (Сорокин, 1973; Malkin, 1971) перенос электрона в пределах фотосинтетического РЦ ФСII рассматривался как строго упорядоченный переход между состояниями целостного комплекса. Эти состояния отличаются зарядами на отдельных компонентах в составе этого комплекса, где переход электрона с донорной на акцепторную сторону комплекса инициируется при поглощении света. В монографии (Рубин, Шинкарев, 1984) изложены математическое обоснование и методы анализа переноса электрона в мультиферментных комплексах. Применение этого метода для описания процессов в выделенных комплексах РЦ бактерий и ФСI и -II описано в статьях (Ризниченко и др., 1986; Riznichenko et al., 1988, 1990; Rubin, Riznichenko 2009) и книгах (Ризниченко, 1991; Ризниченко, Рубин, 2007; Рубин, 2013; Ризниченко и др., 2014; Rubin, Riznichenko, 2009, 2014).
В основу большинства современных моделей процессов переноса электрона в пределах ФСII (Stirbet, Strasser, 1995, 1996; Stirbet et al., 1998; Strasser, Stirbet, 2001; Vredenberg, Prasil, 2009; Lazár, 2003, 2009; Zhu et al., 2005; Xin et al., 2013) положена модель обратимой радикальной пары (Schatz et al., 1988; Baake, Schloder, 1992; Roelofs et al., 1992; Dau, 1994). В этой модели предполагается, что при поглощении света молекула фотосинтетического РЦ Р680 находится в экситонном равновесии с молекулами хлорофилла антенны, от которых она получает энергию электронного возбуждения. Сравнение с экспериментом, как правило, проводится по индукционным кривым флуоресценции хлорофилла, которые регистрируются при разных режимах освещения.
Индукция флуоресценции хлорофилла
Явление индукции флуоресценции и форма индукционных кривых флуоресценции хлорофилла служат на настоящий момент важным источником информации о механизмах и кинетике процессов трансформации энергии в фотосинтетическом аппарате. Энергия электронного возбуждения молекул хлорофилла используется почти полностью для генерации потока электронов по цепи переносчиков, однако ее небольшие потери (1–2%) высвечиваются в виде квантов флуоресценции. При освещении объекта интенсивность флуоресценции меняется во времени вследствие изменения редокс-состояния переносчиков в цепи фотосинтеза. Эти изменения регистрируются в виде индукционной кривой флуоресценции хлорофилла при сохранении нативности объекта. Форма индукционной кривой флуоресценции меняется как в зависимости от состояния переносчиков, так и под действием различных факторов (ингибиторы фотосинтеза, стрессовые воздействия), а также зависит от характера сопряжения первичных процессов фотосинтеза с темновым клеточным метаболизмом. В литературе индукционная кривая флуоресценции получила особое название “автограф (signature) фотосинтеза”. Математическое моделирование позволяет оценить кинетические параметры и эффективность начальных стадий фотосинтеза по соответствующим изменениям индукционных кривых флуоресценции. Такой подход нашел широкое применение в методах экологического мониторинга водоемов и в фотобиотехнологиях.
В работах последних лет (Lazár, 2013; Ebenhöh et al., 2014; Stirbet, Govindjee, 2016; Belyaeva et al., 2016, 2019) моделируются процессы не только в ФСII как в главном источнике флуоресценции, но также и дальнейший путь электрона через ФСI. С экспериментом сравниваются также кинетические кривые окислительно-восстановительных превращений Р700 (поглощение в области 820 нм). Обзор моделей фотосинтетического электронного транспорта различных авторов представлен в книгах (Современные проблемы…, 2014; Photosynthesis in silico…, 2009) и обзорах (Штирбет и др., 2014; Stirbet, Govenjee, 2012).
В ряде работ (Лебедева и др., 2000, 2002; Riznichenko et al., 1999; Belyaeva et al., 2008, 2011, 2014, 2016, 2019) для описания процессов переноса электрона в пределах мультиферментных комплексов, встроенных в фотосинтетическую мембрану, используются обыкновенные дифференциальные уравнения, позволяющие вычислять вероятности тех или иных состояний этих комплексов. В свою очередь сами состояния комплекса отличаются друг от друга редокс-состояниями отдельных составных компонентов комплекса, наличием пустых или занятых сайтов, в которых заякориваются подвижные переносчики электрона (как в случае QB сайта ФСII).
Константы скоростей переходов между состояниями комплекса могут отличаться по величине для комплексов в различных конформационных состояниях, для комплексов, локализованных в гранальной или стромальной частях тилакоида, а также могут зависеть от других параметров системы: температуры, локального рН, трансмембранного электрического потенциала, внешнего электрического поля и т.д. Скорости переходов между состояниями зависят также от фотоиндуцированного электрического потенциала. Электронные пути переноса электронов в пределах мультиферментного комплекса характеризует ориентированный граф переходов между состояниями, для вероятностей которых записываются уравнения типа master equation, линейные относительно вероятностей этих состояний. Сами константы скоростей переходов между состояниями могут зависеть от концентраций протонов в люмене и строме или от концентраций подвижных переносчиков (молекул пула PQ на акцепторной стороне ФСII, Pc на люминальной стороне ФСI и Fd на стромальной стороне ФСI). Поэтому в общем случае уравнения, описывающие переходы между состояниями фотосинтетических мультиферментных комплексов, могут быть нелинейными. Концентрация какого-либо определенного состояния данного мультиферментного комплекса равна произведению вероятности этого состояния комплекса на концентрацию данного комплекса в объекте моделирования.
Модель процессов в ФСII
Основную информацию о процессах в фотосинтетической цепи представляет индукционная кривая флуоресценции, источником которой является ФCII. Поэтому усилия исследователей разных групп были сосредоточены на моделировании процессов в ФСII (Штирбет и др., 2014). На рис. 3 представлена соответствующая схема состояний и переходов между состояниями в комплексе ФСII, которая используется для моделирования процессов как в микроводорослях, так и в хлоропластах высших растений. Подробное описание переходов между состояниями схемы ФСII дано в работах (Беляева и др., 2011; Belyaeva et al., 2008).
Рис. 3.
Схема каталитического цикла фотосистемы II. Каждый прямоугольник – кинетическое состояние ФСII, определяемое редокс-состояниями включенных в ФСII переносчиков электрона. $\left\langle {\begin{array}{*{20}{c}} {{\text{Chl}}} \\ {{\text{P}}680} \end{array}} \right\rangle $ – весь хлорофилл ФСII, включая пигменты антенны и РЦ Р680; ${{\left\langle {\begin{array}{*{20}{c}} {{\text{Chl}}} \\ {{\text{P}}680} \end{array}} \right\rangle }^{*}}$ – синглетные возбужденные состояния 1Chl*, делокализованные на всех пигментах антенны и РЦ. Phe – первичный акцептор электронов феофитин; QA и QB – первичный и вторичный хинонные акцепторы. PQ – пластохинон; PQH2 – пластохинол; ${\text{H}}_{{\text{L}}}^{ + }$ – протоны в люмене, а ${\text{H}}_{{\text{S}}}^{ + }$ – протоны в строме тилакоида. Над прямоугольниками обозначены переменные модели (xi, yi, zi, gi, i = 1, 2…7). Затенены состояния, способные испускать квант флуоресценции. Пунктирными стрелками показаны быстрые (характерное время менее 1 мс) стадии цикла, жирными – световые стадии. Цифры над стрелками соответствуют номерам реакций. Пунктирные дуги показывают необратимые реакции безызлучательной рекомбинации Phe– с P680+ (42–45), ${\text{Q}}_{{\text{A}}}^{--}$ с P680+ (46–49) (Belyaeva et al., 2011).

Формирование возбужденного состояния хлорофилла в модели определяется световыми константами kL = ki, i = 1, 5, 8, 12, 15, 19, 28, 32, пропорциональными интенсивности действующего света (рис. 4). Интенсивность флуоресценции в модели задается константой kF = k–i. Выход флуоресценции в модели рассчитывается как произведение отношения kF/kL на сумму флуоресцирующих состояний:
Рис. 4.
Расчет кинетики заселенности различных состояний ФСII, обозначенных на рис. 3, по индукционной кривой флуоресценции в модели процессов в ФСII целых листьев дикого типа растений Arabidopsis thaliana (кружки) после освещения лазерной вспышкой (10 нс) при двух различных интенсивностях освещения и соответствующих значениях световой константы kL = 7.2 × 109 с–1 (а) и 2.9 × 108 с–1 (б) (Belyaeva et al., 2011).

Трансмембранный электрический потенциал оказывает влияние на электронные потоки, что подтверждают многочисленные эксперименты с воздействием внешнего поля (Bulychev, Vredenberg, 1999, 2001). Поэтому при описании перемещения электрона перпендикулярно плоскости фотосинтетической мембраны необходимо учитывать зависимость скорости этого процесса от генерируемой разности электрических потенциалов ∆ψ (Zheng et al., 1990; Dau, Sauer, 1991, 1992). Для оценки электрогенности каждой стадии переноса заряда в комплексе использовали соотношение (Reynolds et al., 1985):
Здесь индекс (0) относится к константе скорости при ∆ψ = 0. Индекс βj еуказывает на вклад каждой электрогенной стадии в генерацию ∆ψ, δ – часть общего мембранного потенциала (βj ∆ψ), которая влияет на константу скорости прямой реакции. Модель ФСII была применена для описания нарастающего участка индукционной кривой флуоресценции на временах до 1 с при действии вспышки и включении постоянного освещения как малой, так и насыщающей интенсивности.
Моделирование кинетической кривой индукции флуоресценции после освещения насыщающим лазерным импульсом
Модель процессов в РЦ ФСII (схема на рис. 4) содержит большое число параметров – констант скоростей переходов между состояниями, многие из которых известны из независимых экспериментов. Неизвестными являются константы взаимодействия акцепторных компонентов ФСII с молекулами пластохинонного пула, где перенос электрона сопряжен с переносом протонов. Учитывая большое число уравнений в системе, строго и однозначно решить задачу идентификации параметров по экспериментальным данным не представляется возможным. Однако задача упрощается при некоторых специальных условиях эксперимента. Применение ингибиторов позволяет блокировать некоторые процессы (переходы между состояниями в системе). Другой путь – задать освещение в виде короткой вспышки, однократно привести систему в возбужденное состояние и затем наблюдать только процессы релаксации. Вспышка должна быть очень короткой, с характерным временем пикосекунды–наносекунды, чтобы избежать повторного возбуждения комплексов ФСII, уже вовлеченных в процесс электронного транспорта. Процессы релаксации после такой вспышки протекают на временах до секунд, когда происходит генерация электрического потенциала на мембране, но еще не успевают полноценно развиться процессы нефотохимического тушения.
После освещения объекта короткой насыщающей лазерной вспышкой, подавляющая часть РЦ одновременно оказывается в возбужденном состоянии, после чего происходят самопроизвольное перераспределение зарядов в ФСII, сопровождаемое флуоресценцией, и переход электронов по цепи фотосинтеза. Соответствующие опыты были осуществлены совместно с лабораторией проф. Г. Ренгера (Берлин). Насыщающий импульс длительностью 10 нс создавал исходное неравновесное состояние в образце, а изменение сигнала флуоресценции измеряли в диапазоне времени от 100 нс до 10 с. В режиме реального времени регистрировали кинетические кривые интенсивности флуоресценции, вызываемые однократным импульсом (Steffen et al., 2005).
C помощью кинетической модели изолированной ФСII выполнено фитирование данных кинетических измерений на клетках зеленой водоросли Chlorella pyrenoidosa Chick и листьях Arabidopsis thaliana и шпината (Беляева и др., 2011; Belyaeva et al., 2008, 2011, 2014). Для каждого нативного объекта с помощью модели были найдены значения констант скоростей отдельных реакций переноса электрона, а также энергетических потерь при разных интенсивностях светового импульса. Модель наглядно воспроизводит изменения состояний переносчиков в цепи фотосинтеза по сигналу регистрируемой флуоресценции (рис. 4), этот вклад существенно зависит от энергии возбуждающего импульса.
Проведенное фитирование позволило получить оценки тех параметров системы, которые недоступны для экспериментального подхода. Оказалось, что константы скоростей безызлучательной релаксации в РЦ ФСII и перехода энергии света в тепло существенно зависят от интенсивности освещения. При больших интенсивностях поток энергии в тепло может составлять до 30% поглощенной фотосинтетическим объектом энергии света (Belyaeva et al., 2015). Это играет защитную роль, предотвращая образование активных форм кислорода. Таким образом, в данном случае методом математического моделирования удается воспроизвести реальные кинетические изменения, происходящие в нативном объекте на коротких временах, которые недоступны для экспериментального определения.
Детальные модели процессов в фотосинтетической мембране
Как известно, характер индукционной кривой флуоресценции в ходе роста культуры и в неблагоприятных условиях жизни автотрофных организмов существенно меняется. Изменения касаются как нарастающего участка индукционной кривой, который можно анализировать с помощью рассмотренной выше модели ФСII, так и более медленной – спадающей – фазы индукционной кривой флуоресценции. Это обстоятельство используется для мониторинга благополучия среды обитания этих организмов. Для правильной интерпретации изменений выхода флуоресценции на больших временах необходим учет не только переноса электронов в пределах ФСII, но и других процессов в фотосинтетической мембране. Общая схема процессов, учтенных в модели (Belyaeva et al., 2016), приведена на рис. 5.
Рис. 5.
Схема процессов, рассматриваемых в обобщенной кинетической модели первичных процессов фотосинтеза. ФСI, ФСII – фотосистемы I и II, bf – цитохромный комплекс b6 f, Chl – хлорофилл антенны, Р680 и Р700 – пигменты РЦ ФСII и ФСI. QA – первичный хинонный акцептор электронов ФСII, bl и bh – низко- и высокопотенциальный гемы цитохрома b, FeSR – железосерный центр Риске, f – цитохром f, FeSI – акцепторный комплекс ФСI, PQ – пластохинон; PQH2 – пластохинол; Fd – ферредоксин, Рс – пластоцианин, FNR – ферредоксин-НАДФ+-редуктаза,
R-COO– – буферные группы.
Знаки “+” и “–” показывают, что в результате светоиндуцированных процессов люмен тилакоида заряжается положительно, а строма хлоропласта – отрицательно. Жирные стрелки обозначают потоки квантов падающего света и флуоресценции. Тонкими стрелками показан перенос электронов по цепи электронного транспорта и потоки ионов H+, K+ и Cl− после включения освещения (Beliyaeva et al., 2019).

Помимо переходов между состояниями в ФСII (рис. 3) в модель дополнительно включены блоки, описывающие в схематичном виде другие каталитические циклы. Структура модели подробно описана (Belyaeva et al., 2016). Моделируются переходы между состояниями цитохромного комплекса, реакции взаимодействия ФСI с акцептором Fd и участниками циклического транспорта электронов вокруг ФСI, а также взаимодействия акцепторной части ФСII с компонентами пула PQ и цитохромного комплекса. Для фитирования модели наряду с кривыми индукции флуоресценции использованы экспериментальные кривые редокс-превращений Р700 на временах от миллисекунд до 30 с (Belyaeva et al., 2019).
УПРОЩЕННЫЕ МОДЕЛИ. АНАЛИЗ БОЛЬШИХ МАССИВОВ ДАННЫХ
Надо отметить, что полномасштабные модели слишком сложны для обработки больших массивов экспериментальных данных. Идентификация параметров в таких многокомпонентных моделях с помощью стандартных процедур часто оказывается неэффективной, а тщательное фитирование экспериментальных кривых требует слишком трудоемкой ручной обработки. Поэтому для массовой обработки экспериментальных данных более пригодны упрощенные модели, где моделируется динамика частично редуцированных систем.
Анализ фаз индукционной кривой флуоресценции
Для упрощения рассматривается индукционная кривая флуоресценции хлорофилла, состоящая из двух или трех временных фаз (или стадий), которые обычно разделяются соответственно с наблюдаемыми точками перегиба на временной индукционной кривой. Наиболее хорошо изучена первая быстрая стадия (до сотен миллисекунд), обозначаемая в литературе буквами OJIP (рис. 6, слева сверху). Стандартные обозначения на кривой: O (origin, исходная точка) – первый минимальный уровень флуоресценции, J и I – промежуточные перегибы, P (peak) – максимальное значение интенсивности флуоресценции, пик. В отличие от последующих более медленных стадий нарастающая стадия OJIP довольно хорошо воспроизводится. Именно поэтому большинство работ по математическому моделированию первичных процессов фотосинтеза сосредоточено на воспроизведении в модели стабильно наблюдаемой в опытах формы кривой OJIP.
Рис. 6.
Индукционная кривая флуоресценции хлорофилла а (OJIP), измеренная в культуре C. reinhardtii в начале инкубации без серы (t = 0.1 ч), и результат мультиэкспоненциальной аппроксимации этой кривой (а); теплокарта компонентного состава OJIP-кривых в ходе инкубации без серы (б). Ширина и цвет полос отражают амплитуду и время жизни экспоненциальных компонентов кривой. По оси абсцисс отложено время инкубации в часах. По оси ординат слева – шкала амплитуд. Справа приведена цветовая шкала, цвет соответствует характерному времени экспоненциальных членов. Внизу изображены индукционные кривые флуоресценции, наблюдаемые в отдельные моменты времени в ходе голодания культуры. В левом углу каждого графика указано время культивирования в часах (по: Плюснина и др., 2019).
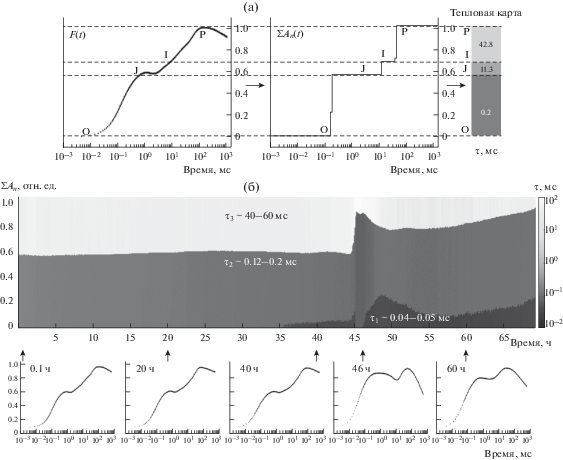
Во многих случаях нарастающий участок индукционной кривой флуоресценции OJIP может быть достаточно хорошо аппроксимирован суммой трех экспонент (Pospíšil, Dau, 2000, 2002; Vredenberg, 2004, 2008; Boisvert et al., 2006). Предложен (Strasser, Govindjee, 1992) формализованный метод расчета характеристик энергетических потоков (JIP-тест) по амплитудам фаз индукционной кривой с использованием значений амплитуд в фиксированные моменты времени (2 мс для OJ и 30 мс для JI), а также наклона кривой в начальный момент времени. Однако времена индивидуальных фаз индукционной кривой не являются фиксированными. Поэтому, хотя предложенный JIP-тест достаточно хорошо работает для зеленых растений, он не может быть применен для водорослей и циановых, форма индукционных кривых которых существенно отличается от классической (Штирбет и др., 2014). Разработаны (Плюснина и др., 2015) и более универсальный метод анализа больших массивов кривых индукции флуоресценции – Метод мультиэкспоненциальной аппроксимации (МЭА), и программное обеспечение pyPhotoSyn. Вместо полуэмпирической оценки стадий, используемой ранее в большинстве исследований, МЭА позволяет ввести более строгие и универсальные критерии оценки фаз.
Мультиэкспоненциальная аппроксимация
Основа метода – разложение регистрируемого сигнала на экспоненты и его представление в виде ряда экспонент (Плюснина и др., 2015). Кинетическая кривая индукции флуоресценции аппроксимируется мультиэкспоненциальным рядом N экспонент с фиксированными характерными временами ${{\tau }_{n}}$:
где F0 – минимальное значение на кривой индукции флуоресценции F(t), An отражает вклад n-й экспоненты с характерным временем τn в общий сигнал, t – время.
Результат аппроксимации представляет собой набор амплитуд An, каждая из которых соответствует выбранным фиксированным временам τn (спектр). Для случая, когда входной сигнал F(t) представляет собой сумму экспоненциальных функций, спектр имеет вид отдельных полос с группами времен, близкими к характерным временам экспонент, составляющих входной сигнал. Ширина полосы определяется свойствами выбранного численного метода аппроксимации и наличием шума во входном сигнале. Характерные времена отдельных стадий переноса электрона в цепи фотосинтеза значительно различаются, и полосы хорошо разрешимы. Характерные времена отдельных компонентов ряда могут быть сопоставлены с конкретными процессами переноса электрона в фотосинтетической электрон-транспортной цепи.
Мониторинг фотосинтетической активности культуры микроводорослей
Метод МЭА позволяет анализировать динамику фаз – изменение характерных времен и амплитуд одновременно сотен и тысяч индукционных кривых флуоресценции. Это делает его удобным при автоматическом мониторинге культуры клеток, растущей в фотобиореакторе, когда кривые снимаются через относительно короткие интервалы времени и составляют в конечном итоге большой массив данных. Такое наблюдение за ростом культуры становится особенно актуальным при решении биотехнологических задач направленного синтеза, когда подбираются условия роста культур, обогащенных липидами, каротиноидами или выделяющих молекулярный водород (Antal et al., 2018а).
Разработанные на кафедре биофизики автоматические методы регистрации индукционных кривых флуоресценции (Конюхов, Воробьева, 2018) позволяют изучать происходящие в фотосинтетическом аппарате изменения путем измерения кинетических кривых индукции флуоресценции хлорофилла непосредственно в биофотореакторе без нарушения физиологического состояния клеток.
Дефицит серы индуцирует ряд изменений в функциональном состоянии компонентов световых процессов фотосинтеза в клетках зеленых микроводорослей, что в значительной степени влияет на форму кинетических кривых флуоресценции хлорофилла. В частности, серное голодание сопровождается нарушениями функционирования донорной и акцепторной стороны ФСII в результате разрушения кислород-выделяющего комплекса и нарушения переноса электронов с первичного хинонного акцептора QA в пластохиноновый пул. Для детального изучения механизмов влияния голодания на отдельные стадии фотосинтетического электронного транспорта были выполнены эксперименты по регистрации фотосинтетических характеристик голодающей культуры клеток дикого типа C. reinhardtii и мутантов HydEF и анализ полученного массива данных с помощью метода МЭА (Плюснина и др., 2019).
Кинетические кривые флуоресценции хлорофилла были измерены в автоматическом режиме с интервалом 3 мин в течение всего периода инкубации без серы. На рис. 6а приведена типичная кривая световой индукции флуоресценции хлорофилла, измеренная на начальной стадии инкубации без серы, и результат мультиэкспоненциального анализа этой кривой с использованием пакета pyPhotoSyn.
Анализ выявил три основных экспоненциальных компонента кривой с временами жизни 0.2, 11.3 и 42.8 мс, характеризующих быструю (OJ), среднюю (JI) и медленную (IP) фазы кривой соответственно. Примеры OJIP кривых, измеренных на разных стадиях серного голодания, приведены на рис. 6б. Характер кривой слабо изменялся за время аэробной стадии инкубации (0–46 ч), однако изменения становились значительными при переходе культуры в анаэробные условия. Отличительными чертами OJIP-кривых, измеренных в анаэробиозе (46 ч), были увеличение вклада фазы OJ; снижение интенсивности флуоресценции между пиками J и I; рост скорости падения сигнала флуоресценции после пика P (рис. 6б). Увеличение амплитуды OJ в анаэробных условиях отражает восстановленное состояние пластохинонового пула. На более поздней стадии анаэробной инкубации (60 ч) наблюдалось незначительное снижение амплитуды OJ, обусловленное частичным реокислением PQ-пула благодаря гидрогеназной активности и фотообразованию водорода.
Аппроксимация экспериментальной кривой мультиэкcпоненциальным рядом предполагает линейный характер моделируемых процессов (Плюснина и др., 2012, 2015). На самом деле, в формировании индукционной кривой флуоресценции принимают участие большое число процессов разной природы. Экситонный перенос возбуждения в димерах РЦ ФСII, изменение электрохимического градиента на тилакоидной мембране и другие процессы обусловливают нелинейный характер зависимости скоростей отдельных реакций от концентраций компонентов системы. Однако метод позволяет оценить вклад наиболее существенных процессов и выделить визуально не обнаруживаемые фазы кривой индукции флуоресценции хлорофилла. Выяснение конкретной природы и механизмов возникновения новых обнаруженных фаз требует дальнейших исследований.
КИНЕТИЧЕСКИЙ МЕТОД МОНТЕ-КАРЛО. ОПИСАНИЕ ПРОЦЕССОВ В АНСАМБЛЯХ ФОТОСИНТЕТИЧЕСКИХ РЕАКЦИОННЫХ ЦЕНТРОВ
Фотосинтетический аппарат отдельной клетки включает миллионы фотосинтетических цепей, в каждой из которых происходит перенос электрона. В реальном эксперименте наблюдаемый ответ представляет собой результат фотосинтетической активности ансамбля сотен миллионов–миллиардов фотосинтетических цепей. Например, интенсивность сигнала флуоресценции определяется общим числом квантов флуоресценции, испускаемой всеми индивидуальными молекулами хлорофилла, входящими в ансамбль.
Реальные процессы в фотосинтетической цепи носят вероятностный характер. С целью воспроизведения совокупности процессов в ансамбле нами разработана кинетическая модель Монте-Карло фотосинтетического электронного транспорта (Маслаков и др., 2016). В модели необходимо задать соотношения вероятностей переходов между возможными состояниями переносчиков системы для каждой индивидуальной фотосинтетической цепи. Для этого, исходя из литературных данных о значениях констант скоростей элементарных реакций переноса электрона на отдельных участках фотосинтетической цепи, в модели задаются вероятности переноса электрона с молекулы-донора на молекулу-акцептор в пределах фотосинтетических мультиферментных комплексов в тилакоидной мембране, а также вероятности переноса электрона между этими комплексами и подвижными переносчиками электронов. Также задаются вероятности возбуждения молекул светособирающей антенны при случайном попадании кванта света в нее и вероятности последующего захвата энергии РЦ ФСI и -II.
В процессе счета программа последовательно делает короткие временные шаги, на каждом из которых выясняется, произошел ли переход каждой элементарной фотосинтетической цепи из того состояния, в котором она находится в данный момент времени, в какое-либо другое из возможных состояний. Каждый осуществленный переход, который при этом сопровождается высвечиванием кванта флуоресценции, фиксируется. В результате получаем информацию о том, сколько актов высвечивания произошло на каждом шаге работы модели. Одновременное воспроизведение в модели работы сотен тысяч–миллионов фотосинтетических РЦ позволяет накопить достаточное количество точек для построения суммарной адекватной кривой индукции флуоресценции. Моделируемый таким образом сигнал флуоресценции может быть напрямую сопоставлен с реальным сигналом, регистрируемым в разных экспериментальных условиях.
Кроме того, в каждый момент времени модель фиксирует редокс-состояния всех компонентов системы и дает информацию о кинетике изменения этих состояний. В частности, модель позволяет получить кинетику редокс-превращений РЦ ФСI P700 после включения и выключения света, что позволяет сравнить результаты с полученными экспериментально кинетическими кривыми изменения ΔA820. Модель реализована с использованием программы, написанной А.С. Маслаковым на языке CUDA. Расчеты проводились на суперкомпьютере “Ломоносов” центра коллективного пользования МГУ им. М.В. Ломоносова с использованием GPU компании NVIDIA для ускорения вычислений.
Эта модель, основанная на методе Монте-Карло, включает пигмент–белковые комплексы ФСII, цитохромного комплекса b6f, ФСI, а также мобильные переносчики: пластохинон, пластоцианин, ферредоксин. Полученный временной характер флуоресценции сопоставляли с экспериментальными кривыми индукции флуоресценции. Изменение концентрации молекул фотоактивного пигмента ФСI Р700 в окисленном состоянии сопоставляли с экспериментально наблюдаемыми изменениями поглощения в спектральной области 820 нм. Модель демонстрирует влияние разной интенсивности света (рис. 7), повышенной температуры, а также различных ингибиторов фотосинтеза на характер кривых индукции флуоресценции (Маслаков и др., 2016; Antal et al., 2018b).
Рис. 7.
Модельные кривые индукции флуоресценции для разных интенсивностей действующего света 120, 1000, 2000, 6000 и 12 000 М × фотон × м–2 с–1 (кривые 1, 2, 3, 4, 5 соответственно). D – дополнительный минимум на OJIP-кривой. Во врезке показаны соответствующие светоиндуцированные изменения P680+ – окисленной формы фотоактивного пигмента ФСII (Antal et al., 2018b).

Возможности кинетического метода Монте-Карло
Прямое моделирование методом Монте-Карло какого-либо процесса основано на моделировании поведения отдельных элементарных частей сложной системы и является примером агентного подхода. В физике кинетический метод Монте-Карло получил распространение, например, для моделирования вероятностных процессов в системе разреженных газов, при облучении твердых тел ионами в приближении бинарных столкновений и др.
В изучении первичных процессов фотосинтеза метод Монте-Карло дает возможность имитировать процессы переноса электрона в ансамбле фотосинтетических РЦ, число которых приближается к реальному числу в растительной клетке (несколько миллионов). Обычные кинетические модели, представляющие собой системы дифференциальных уравнений, построены на основе заранее заданных определенных законах взаимодействия компонентов фотосинтетической цепи, например, о независимости движения отдельных молекул и пропорциональности скорости реакции числу столкновений молекул донора и акцептора по закону действующих масс. В модели Монте-Карло описываются вероятностные процессы в каждой индивидуальной электрон-транспортной цепи или группе из объединенных 2–5 цепей. Вероятности разных переходов задаются на основе кинетических экспериментальных данных, а их реализация в модели задается генератором случайных чисел.
Метод Монте-Карло позволяет легко модифицировать структуру моделируемых цепочек переноса электрона и учитывать как различия отдельных цепей, так и объединений фотореакционных центров ФСII в группы (энергетический обмен). Отметим, что при моделировании такого объединения традиционным способом с помощью дифференциальных уравнений учет возможных состояний системы требует многократного увеличения числа уравнений системы. Иными словами, любая модификация моделируемой цепи требует здесь изменения вида многих уравнений системы, что представляет собой трудоемкую задачу.
В наших моделях определенные правила применяются индивидуально к каждой из нескольких миллионов фотосинтетических систем, входящих в рассматриваемый ансамбль. Поэтому модель Монте-Карло фотосинтетической цепи можно отнести к “rule-based” типу моделей, которые используются в современной системной биологии для описания регуляторных процессов в живой клетке (Chylek et al., 2014; Su et al., 2015). Несмотря на то, что в настоящее время метод требует больших компьютерных ресурсов, его востребованность будет расти с расширением экспериментальных знаний о системе фотосинтетических реакций и компьютерных технологий, поскольку позволяет естественным образом включать в модель все новые детали.
ЗАКЛЮЧЕНИЕ
В первой части статьи рассмотрены вопросы применения кинетических (системно-динамических) моделей для описания первичных процессов трансформации солнечной энергии в энергию химических связей в фотосинтетической мембране. Такие модели оказываются полезными для оценки параметров фотосинтетической цепи, недоступных прямому экспериментальному измерению, и для изучения изменений характеристик фотосинтетической цепи в различных условиях. Это имеет большое практическое значение при использовании характеристик фотосинтетических организмов в биотехнологии и экологическом мониторинге. Во второй части статьи мы рассмотрим агентные броуновские и молекулярные модели, которые используются в изучении молекулярных и клеточных механизмов, лежащих в основе фотосинтетических процессов. В заключительной части статьи мы обсудим возможности и перспективы применения разного типа моделей в фундаментальных исследованиях и практических задачах, связанных с изучением фотосинтеза.
Список литературы
Беляева Н.Е., Булычев А.А., Ризниченко Г.Ю., Рубин А.Б. Модель фотосистемы II для анализа нарастания индукционной кривой флуоресценции листьев высших растений // Биофизика. 2011. Т. 56(3). С. 489–505.
Вольтерра В. Математическая теория борьбы за существование М.: Наука, 1976. 286 с.
Гласс Л., Мэки М. От часов к хаосу: ритмы жизни. М.: Мир, 1991. 248 с.
Иваницкий Г.Р., Кринский В.И., Сельков Е.Е. Математическая биофизика клетки. М.: Наука, 1978. 312 с.
Колебательные процессы в биологических и химических системах / Ред. Г.М. Франк. М.: Наука, 1967. 440 с.
Конюхов И.В., Воробьева О.В. Флуориметр с импульсной модуляцией интенсивности возбуждающего света для оценки функционального состояния фитопланктона по параметрам флуоресценции хлорофилла // Процессы в геосредах. 2018. Т. 17. С. 64–65.
Кукушкин А.К., Тихонов А.Н., Блюменфельд Л.А., Рууге Э.К. Теоретические аспекты кинетики первичных процессов фотосинтеза высших растений и водорослей // Физиол. раст. 1975. Т. 22. С. 241–250.
Лебедева Г.В., Беляева Н.Е., Дёмин О.В. и др. Кинетическая модель первичных процессов фотосинтеза в хлоропластах. Описание быстрой фазы индукции флуоресценции хлорофилла при различной интенсивности света // Биофизика. 2002. Т. 47. С. 1044–1058.
Лебедева Г.В., Беляева Н.Е., Ризниченко Г.Ю. и др. Кинетическая модель фотосистемы II высших растений // Журн. физ. хим. 2000. Т. 74. С. 1874–1883.
Мальтус Т.Р. Опыт о законе народонаселения. Петрозаводск: Петроком, 1993. 139 с.
Маслаков А.С., Антал Т.К., Ризниченко Г.Ю., Рубин А.Б. Моделирование первичных процессов фотосинтеза с помощью кинетического метода Монте-Карло // Биофизика. 2016. Т. 61(3). С. 464–477.
Мюррей Дж. Математическая биология. Т. 1. Введение. М., Ижевск: ИКИ-РХД, 2009. 776 с.
Мюррей Дж. Математическая биология. Т. 2. Пространственные модели и их приложения в медицине. М., Ижевск: ИКИ-РХД, 2011. 1104 с.
Плюснина Т.Ю., Воронова Е.Н., Гольцев В.Н. и др. Редуцированная модель фотосистемы II для оценки характеристик фотосинтетического аппарата по данным индукции флуоресценции // Комп. иссл. моделир. 2012. Т. 4. № 4. С. 943–958.
Плюснина Т.Ю., Хрущев С.С., Ризниченко Г.Ю., Рубин А.Б. Анализ кинетики индукции флуоресценции хлорофилла с помощью спектральной мультиэкспоненциальной аппроксимации // Биофизика. 2015. Т. 60 (3). С. 487–495.
Плюснина Т.Ю., Хрущев С.С., Фролов А.Е. и др. Мониторинг фотосинтетической активности культуры микроводорослей Chlorella при истощении азота в среде // Биофизика. 2019. Т. 64 (3). С. 468–477.
Полетаев И.А. О математических моделях элементарных процессов в биогеоценозах. Проблемы кибернетики. Вып. 16. М.: Наука, 1966. С. 171–190
Полетаев И.А. Модели Вольтерра хищник–жертва и некоторые их обобщения с использованием принципа Либиха // Журн. общ. биол. 1973. Т. 34 (1). С. 43–57.
Ризниченко Г.Ю. Математические модели первичных процессов фотосинтеза. Успехи науки и техники. Серия Биофизика. Т. 31. М.: ВИНИТИ, 1991. 162 с.
Ризниченко Г.Ю. Лекции по математическим моделям в биологии. М., Ижевск: РХД, 2011. 560 с.
Ризниченко Г.Ю., Рубин А.Б. Модели регуляции фотосинтетического электронного транспорта // Проблемы регуляции в биологических системах / Ред. А.Б. Рубин. М., Ижевск: РХД, 2007. С. 165–194.
Ризниченко Г.Ю., Рубин А.Б. Математические методы в биологии и экологии. Биофизическая динамика продукционных процессов. М.: Юрайт, 2018. Ч. 1. 210 с. Ч. 2. 185 с.
Ризниченко Г.Ю., Воробьева Т.Н., Храброва Е.Н., Рубин А.Б. Сравнительный анализ кинетических и конформационных характеристик солюбилизированных и встроенных в липосомы пигмент-белковых комплексов фотосистемы I высших растений // Биофизика. 1986. Т. 31. С. 793–799.
Ризниченко Г.Ю., Беляева Н.Е., Коваленко И.Б. и др. Кинетические и многочастичные модели фотосинтетического электронного транспорта // Современные проблемы фотосинтеза. Т. 2 / Ред. С.И. Аллахвердиев, А.Б. Рубин, В.А. Шувалов. М., Ижевск: ИИКИ, 2014. С. 41–100.
Романовский Ю.М., Тихонов А.Н. Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза – вращающийся молекулярный мотор // Успехи физ. наук. 2010. Т. 180(9). С. 931–956.
Романовский Ю.М., Степанова Н.В., Чернавский Д.С. Математическое моделирование в биофизике. М.: Наука, 1975. 344 с.
Романовский Ю.М., Степанова Н.В., Чернавский Д.С. Математическая биофизика. М.: Наука, 1984. 304 с.
Романовский Ю.М., Степанова Н.В., Чернавский Д.С. Математическое моделирование в биофизике. Введение в теоретическую биофизику. М., Ижевск: ИКИ-РХД, 2004. 464 с.
Рубин А.Б. Биофизика. Т. 3. М., Ижевск: ИИКИ, 2013. 480 с.
Рубин А.Б., Шинкарев В.П. Транспорт электронов в биологических системах. М.: Наука, 1984. 319 с.
Рубин А.Б., Пытьева Н.Ф., Ризниченко Г.Ю. Кинетика биологических процессов. М.: МГУ, 1977. 330 с.
Рубин А.Б., Пытьева Н.Ф., Ризниченко Г.Ю. Кинетика биологических процессов. 2-е изд. М.: МГУ, 1987. 304 с.
Сельков Е.Е. Автоколебания в гликолизе. Простая одночастотная модель // Мол. биол. 1968. Т. 2. С. 252–266.
Современные проблемы фотосинтеза / Ред. С.И. Аллахвердиев, А.Б. Рубин, В.А. Шувалов. М., Ижевск: ИИКИ, 2014. Т. 1. 568 с. Т. 2. 544 с.
Сорокин Е.М. Нециклический транспорт электронов и связанные с ним вопросы // Физиол. раст. 1973. Т. 20. С. 733–741.
Тихонов А.Н. Системы дифференциальных уравнений, содержащие малые параметры при производных // Мат. сб. 1952. Т. 31 (73). С. 575–586.
Уинфри А.Т. Время по биологическим часам. М.: Мир, 1990. 208 с.
Штирбет A., Ризниченко Г.Ю., Рубин A.Б., Говинджи. Моделирование кинетики флуоресценции хлорофилла а: связь с фотосинтезом // Биохимия. 2014. Т. 79 (4). С. 379–412.
Эйген М. Самоорганизация материи и эволюция биологических макромолекул. М.: Мир, 1973. 224 с.
Эйген М., Шустер П. Гиперцикл. Принципы самоорганизации макромолекул. М.: Мир, 1982. 270 с.
Albertsson P.-A. A quantitative model of the domain structure of the photosynthetic membrane // Tr. Plant Sci. 2001. V. 6. P. 349–354.
Amesz J. Photosynthesis. Amsterdam: Elsevier, 1987. 354 p.
Antal T.K., Konyukhov V.I., Volgusheva A.A. et al. Chlorophyll fluorescence induction and relaxation system for the continuous monitoring of photosynthetic capacity in photobioreactiors // Physiol. Plantarum. 2018a. V. 165(3). P. 476–486.
Antal T.K., Maslakov A.S., Yakovleva O.V. et al. Simulation of chlorophyll fluorescence rise and decay kinetics, and P700-related absorbance changes by using a rule-based kinetic Monte-Carlo method // Photosyn. Res. 2018b. V. 138(2). P. 191–206.
Baake E., Shloeder J.P. Modelling the fast fluorescence rise of photosynthesis // Bull. Math. Biol. 1992. V. 54. P. 999–1021.
Barber J. The photosystems: structure, function and molecular biology. Amsterdam, London, N.Y., Tokio: Elsevier, 2015. 557 p.
Belyaeva N.E., Bulychev A.A., Riznichenko G.Yu., Rubin A.B. Thylakoid membrane model of the Chl a fluorescence transient and P700 induction kinetics in plant leaves // Photosynth. Res. 2016. V. 130. P. 491–515.
Belyaeva N.E., Bulychev A.A., Riznichenko G.Yu., Rubin A.B. Analyzing both the fast and the slow phases of chlorophyll a fluorescence and P700 absorbance changes in dark-adapted and preilluminated pea leaves using a thylakoid membrane model // Photosynth. Res. 2019. V. 140. P. 1–19.
Belyaeva N.E., Schmitt F.-J., Paschenko V.Z. et al. PSII model-based simulations of single turnover flash-induced transients of fluorescence yield monitored within the time domain of 100 ns–10 s on dark-adapted Chlorella pyrenoidosa cells // Photosyn. Res. 2008. V. 98. P. 105–119.
Belyaeva N.E., Schmitt F.-J., Paschenko V.Z. et al. PSII model-based analysis of transient fluorescence yield measured on whole leaves of Arabidopsis thaliana after excitation with light flashes of different energies // BioSystems. 2011. V. 103 (2). P. 188–195.
Belyaeva N.E., Schmitt F.-J., Paschenko V.Z. et al. Model-based analysis of transient fluorescence yield induced by actinic laser flashes in spinach leaves and cells of green algae Chlorella pyrenoidosa Chick // Plant Physiol. Biochem. 2014. V. 77. V. 49–59.
Belyaeva N.E., Schmitt F.-J., Paschenko V.Z. et al. Modelling of the redox state dynamics in photosystem II of Chlorella pyrenoidosa Chick cells and leaves of spinach and Arabidopsis thaliana from single flash induced fluorescence quantum yield changes on the 100 ns–10 s time scale // Photosynth. Res. 2015. V. 125. P. 123–140.
Blankenship R.E. Molecular mechanisms of photosynthesis. Oxford: Wiley-Blackwell Science, 2014. 312 p.
Boisvert S., Joly D., Carpentier R. Quantitative analysis of the experimental O–J–I–P kinetic fluorescence induction kinetics. Apparent activation energy and origin of each kinetic step // FEBS J. 2006. V. 273 (20). P. 4770–4777.
Bulychev A.A., Vredenberg W.J. Light-triggered electrical events in the thylakoid membrane of plant chloroplast // Physiol. Plant. 1999. V. 105. P. 577–584.
Bulychev A.A., Vredenberg W.J. Modulation of photosystem II chlorophyll fluorescence by electrogenic events generated by photosystem I // Bioelectrochemistry. 2001. V. 54. P. 157–168.
Chylek L.A., Harris L.A., Tung C.S. et al. Rule-based modeling: a computational approach for studying biomolecular site dynamics in cell signaling systems // WIREs Syst. Biol. Med. 2014. V. 6 (1). P. 13–36.
Dau H. Short-term adaptation of plants to changing light intensities and its relation to photosystem II photochemistry and fluorescence emission // J. Photochem. Photobiol. B. 1994. V. 26. P. 3–27.
Dau H., Sauer K. Electric field effect on chlorophyll fluorescence and its relation to photosystem II charge separation reactions studied by a salt jump technique // Biochim. Biophys. Acta. 1991. V. 1089. P. 49–60.
Dau H., Sauer K. Electric field effect on the picoseconds fluorescence of photosystem II and its relation to the energetic and kinetics of primary charge separation // Biochim. Biophys. Acta. 1992. V. 1102. P. 91–106.
Ebenhöh O., Fucile G., Finazzi G. et al. Short-term acclimation of the photosynthetic electron transfer chain to changing light: a mathematical model // Philos. Trans. R. Soc. B. Biol. Sci. 2014. V. 369. P. e20130223.
Govindjee. The photosynthesis page. 2019. http://www.life.illinois.edu/govindjee/
Hall D.O., Rao K. Photosynthesis. Cambridge: Cambridge University Press, 1999. 214 p.
Higgins J.A. A chemical mechanism for oscillations in glycolitic intermediates in yeast cells // PNAS USA. 1954. V. 51. P. 989–994.
Higgins J.A. The theory of oscillating reactions // Ing. Chem. 1967. V. 59 (5). P. 18–62.
Holzapfel C., Bauer R. Computer simulation of primary photosynthetic reactions compared with experimental results on O2-exchange and chlorophyll fluorescence of green plants // Z. Naturforsch. 1975. B. 30. S. 489–498.
Ke B. Photosynthesis: photobiochemistry and photobiophysics. Advances in photosynthesis and respiration. V. 10 / Ed. Govindjee. Dordrecht: Kluwer Academic, 2001. 763 p.
Ke B. Photosynthesis: photobiochemistry and photobiophysics. Springer Science + Business Media, 2006. 765 p.
Lazár D. Chlorophyll a fluorescence rise induced by high light illumination of dark adapted plant tissue studied by means of a model of photosystem II and considering photosystem II heterogeneity // J. Theor. Biol. 2003. V. 220. V. 469–503.
Lazár D. Modelling of light-induced chlorophyll a fluorescence rise (O–J–I–P transient) and changes in 820 nm-transmittance signal of photosynthesis // Photosynthetica. 2009. V. 47. P. 483–498.
Lazár D. Simulations show that a small part of variable chlorophyll a fluorescence originates in photosystem I and contributes to overall fluorescence rise // J. Theor. Biol. 2013. V. 335. P. 249–264.
Malkin S. Fluorescence induction studies in isolated chloroplast. On the electron-transfer equilibrium in the pool of electron acceptors of photosystem II // Biochim. Biophys. Acta. 1971. V. 234. P. 425–427.
Malthus T.R. An essay on the principal of population. London: Charleston, 1798. 126 p.
Michaelis L., Menten M.L. Die Kinetik der Invertinwirkung // Biochem Z. 1913. B. 49. S. 333–369.
Monod J. La technique de culture continue. Théorie et applications // Ann. Inst. Pasteur. 1950. V. 79. P. 390–410.
Nelson N., Yocum C.F. Structure and function of photosystems I and II // Ann. Rev. Plant Biol. 2006. V. 57. P. 521–565.
Papoian G.A. Coarse-grained modeling of biomolecules. Boca Raton: CRC-Press, 2017. 430 p.
Photosynthesis in silico. Understanding complexity from molecules to ecosystems / Eds A. Laisk, L. Nedbal, Govindjee. V. 29. Dordrecht: Springer, 2009. 508 p.
Pospíšil P., Dau H. Chlorophyll fluorescence transients of photosystem II membrane particles as a tool for studying photosynthetic oxygen evolution // Photosynth. Res. 2000. V. 65. P. 41–52.
Pospíšil P., Dau H. Valinomycin sensitivity proves that light induced thylakoid voltages result in millisecond phase of chlorophyll fluorescence transients // Biophys. Biochim. Acta. 2002. V. 1554. P. 94–100.
Rabinowitch E., Govindjee. Photosynthesis. N.Y.: Wiley, 1969. 273 p.
Reynolds I.A., Johnson E.A., Tanford C. Incorporation of membrane potential into theoretical analysis of electrogenic ion pumps // PNAS USA. 1985. V. 82. P. 6869–6873.
Riznichenko G.Yu., Chrabrova E.N., Rubin A.B. Identification of the parameters of photosynthetic electron transport system // Studia Biophys. 1988. V. 126. P. 51–59.
Riznichenko G.Yu., Lebedeva G.V., Demin O.V. et al. Kinetic mechanisms of biological regulation in photosynthetic organisms // J. Biol. Phys. 1999. V. 25. P. 177–192.
Riznichenko G.Yu., Vorobjeva T.N., Khrabrova E.N., Rubin A.B. Identification of kinetic parameters of plastocyanin and P 700 interactions in chloroplasts and pigment-protein complexes of photosystem 1 // Photosynthetica. 1990. V. 24. P. 37–51.
Roelofs T.A., Lee C.-H., Holzwarth A.R. Global target analysis of picosecond chlorophyll fluorescence kinetics from pea chloroplasts: a new approach to the characterization of the primary processes in photosystem II α- and β-units // Biophys. J. 1992. V. 61 (5). P. 1147–1163.
Rubin A.B. Compendium of biophysics. N.Y.: John Wiley and Sons, 2017. 640 p.
Rubin A.B., Riznichenko G.Yu. Modeling of the primary processes in a photosynthetic membrane // Photosynthesis in silico: understanding complexity from molecules to ecosystems / Eds A. Laisk, L. Nedbal, Govindjee. V. 29. Dordrecht: Springer, 2009. P. 151–176.
Rubin A.B., Riznichenko G.Yu. Mathematical biophysics. N.Y.: Springer, 2014. 273 p.
Schatz G.H., Brock H., Holzwarth A.R. Kinetic and energetic model for the primary processes in photosystem II // Biophys. J. 1988. V. 54. P. 397–405.
Shevela D., Björn L.O., Govindjee. Photosynthesis: solar energy for life. Hardcover: World Scientific Publishing Company, 2019. 204 p.
Steffen R., Eckert H.-J., Kelly A.A. et al. Investigations on the reaction pattern of photosystem II in leaves from Arabidopsis thaliana by time-resolved fluorometric analysis // Biochemistry. 2005. V. 44. P. 3123–3132.
Stirbet A., Govindjee. Chlorophyll a fluorescence induction: a personal perspective of the thermal phase, the J–I–P rise // Photosynth. Res. 2012. V. 113. P. 15–61.
Stirbet A., Govindjee. The slow phase of chlorophyll a fluorescence induction in silico: origin of the S-M fluorescence rise // Photosynth. Res. 2016. V. 130. P. 193–213.
Stirbet A., Strasser R.J. Numerical simulation of the fluorescence induction in plants // Arch. Sci. (Geneve). 1995. V. 48. P. 41–60.
Stirbet A., Strasser R.J. Numerical simulation of the in vivo fluorescence in plants // Math. Comp. Simul. 1996. V. 42. P. 245–253.
Stirbet A., Govindjee, Strasser B.J., Strasser R.J. Chlorophyll a fluorescence induction in higher plants: modelling and numerical simulation // J. Theor. Biol. 1998. V. 193. P. 131–151.
Strasser R.J., Govindjee. On the O–J–I–P fluorescence transients in leaves and D1 mutants of Chlamydomonas reinhardtii // Research in photosynthesis. V. 2 / Ed. N. Murata. Dordrecht: Kluwer Acad. Publishers, 1992. P. 29–32.
Strasser R.J., Stirbet A.D. Estimation of the energetic connectivity of PS II centers in plants using the fluorescence rise O–J–I–P // Math. Comput. Simulat. 2001. V. 56. P. 451–461.
Su B.-H., Tu Y.-S., Lin O.A., Harn Y.-C. Rule-based classification models of molecular autofluorescence // J. Chem. Inf. Model. 2015. V. 55 (2). P. 434–445.
Verhulst P.F. Notice sur la loi que la population suit dans son accroissement // Corr. Math. Phys. 1838. V. 10. P. 113–121.
Volterra V. Leçons sur la théorie mathématique de la lutte pour la vie. Paris: Gauthiers-Villars, 1931. 222 p.
Vredenberg W.J. System analysis and photoelectrochemical control of chlorophyll fluorescence in terms of trapping models of photosystem II: a challenging view // Chlorophyll a fluorescence: a signature of photosynthesis / Eds G.C. Papageorgiou, Govindjee. V. 19. Dordrecht: Springer, 2004. P. 133–172.
Vredenberg W.J. Algorithm for analysis of OJDIP fluorescence induction curves in terms of photo- and electrochemical events in photosystems of plant cells: derivation and application // J. Photochem. Photobiol. B. Biol. 2008. V. 91 (1). P. 58–65.
Vredenberg W., Prasil O. Modeling of chlorophyll a fluorescence kinetics // Photosynthesis in silico: understanding complexity from molecules to ecosystems / Eds A. Laisk, L. Nedbal, Govindjee. V. 29. Dordrecht: Springer, 2009. P. 125–149.
Xin C.-P., Yang J., Zhu X.-G. A model of chlorophyll a fluorescence induction kinetics with explicit description of structural constraints of individual photosystem II units // Photosynth. Res. 2013. V. 117. P. 339–354.
Zheng C., Davis M.E., McCammon J.A. Electrofield distribution inside the bacterial photosynthetic reaction center of Rhodopseudomonas viridis // Chem. Phys. Lett. 1990. V. 173. P. 246–252.
Zhu X.-G., Govindjee, Baker N.R. et al. Chlorophyll a fluorescence induction kinetics in leaves predicted from a model describing each discrete set of excitation energy and electron transfer associated with photosystem II // Planta. 2005. V. 223. P. 114–133.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


