Успехи современной биологии, 2020, T. 140, № 5, стр. 419-432
Вопросы математического моделирования в биологии. Часть 2. Модели процессов взаимодействия белков в фотосинтетической мембране
Г. Ю. Ризниченко 1, *, А. Б. Рубин 1
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра биофизики
Москва, Россия
* E-mail: riznich@biophys.msu.ru
Поступила в редакцию 03.05.2020
После доработки 03.05.2020
Принята к публикации 03.05.2020
Аннотация
Вторая часть статьи посвящена агентным – многочастичным броуновским и молекулярно-динамическим моделям. В этих моделях на основе аппарата броуновского и молекулярного моделирования описываются движение и взаимодействие индивидуальных белков – переносчиков электронов (броуновские многочастичные модели) и индивидуальных атомов в молекулах – переносчиках электрона (молекулярная динамика). Прямые многочастичные модели в явном виде моделируют броуновскую диффузию подвижных белковых переносчиков и их электростатические взаимодействия с мультиферментными комплексами как в растворе, так и в интерьере биомембраны. Анализ этих моделей раскрывает роль диффузии и электростатических факторов в регуляции электронного транспорта, влияние геометрии реакционного объема, ионной силы и рН клеточной среды на скорость реакций транспорта электронов между белками-переносчиками. Совместное использование методов кинетического и броуновского многочастичного моделирования позволяет изучать регуляцию целостной системы электрон-транспортных процессов на субклеточном и молекулярном уровнях, механизмы переключения электронных потоков в клетках растений и водорослей, оценивать оптимальные условия для получения клетками микроводорослей целевых продуктов, например, водорода как альтернативного топлива. Перспективы различных методов математического моделирования в изучении субклеточных систем обсуждаются в заключении. Материал статьи основан на результатах исследований, выполненных на кафедре биофизики биологического факультета МГУ им. М.В. Ломоносова.
ВВЕДЕНИЕ
В интерьере фотосинтетической мембраны электронный транспорт осуществляется подвижными переносчиками, взаимодействие которых с мультиферментными комплексами не соответствует представлениям о свободной диффузии и о случайных соударениях по типу реакций в растворах. Например, в узком люминальном пространстве фотосинтетической мембраны молекулы пластоцианина (Pc), размеры которых сравнимы с шириной люминального пространства, не могут свободно перемещаться (Haehnel et al., 1989). Их общее количество в объеме люмена одной граны, как и количество малоподвижных в мембране реакционных центров, составляет десятки–сотни молекул, что значительно меньше количества, необходимого для случайных столкновений и для реализации закона действующих масс.
Результаты, полученные методом электронной микроскопии, свидетельствуют о плотном расположении мультиферментных комплексов в мембране, что делает невозможным свободную диффузию пластохинона (PQ) во внутримембранном пространстве (Kirchhoff et al., 2002). Данные электронной микроскопии показывают также, что мембранные комплексы выступают на значительное расстояние внутрь люминального пространства (Albertsson, 2000, 2001; Dekker, Boekema, 2005; Ruban, 2012). Это ограничивает движение молекул подвижного переносчика Pc, передающего электроны с цитохромного комплекса на ФСI. То же относится и к диффузии в стромальном пространстве, где молекулы ферредоксина (Fd) участвуют в переносе электронов по линейному и циклическому (вокруг ФСI) путям. Особенности геометрии и гетерогенный характер среды (люмена и стромы), в которой перемещаются подвижные переносчики, могут быть учтены в кинетических моделях только косвенно в форме неких эффективных значений феноменологических параметров – констант скоростей реакций. В явном виде броуновская диффузия подвижных белковых переносчиков как в растворе, так и в интерьере биологической мембраны моделируется в так называемых прямых многочастичных моделях. Интегральные характеристики системы (вероятности переходов, концентрации веществ, средняя кинетическая энергия) в таких моделях рассчитываются как усредненные характеристики взаимодействующих белков по всему ансамблю.
Прямая модель дает наглядное трехмерное визуальное представление о динамике процессов в системе в разных пространственных и временных масштабах, возможность наблюдать за поведением отдельных компонентов и получать усредненные статистические сведения по всему ансамблю. Пример сцены в модели многочастичной броуновской динамики представлен на рис. 1.
МОДЕЛИ МНОГОЧАСТИЧНОЙ БРОУНОВСКОЙ ДИНАМИКИ
В последние годы метод прямого многочастичного моделирования разрабатывается для адекватного воспроизведения процессов электронного транспорта с участием подвижных переносчиков в фотосинтетической мембране. Модели поведения мобильных белков Pc и Fd и их взаимодействия с мультиферментными комплексами описаны в работах (Коваленко и др., 2009, 2014, 2016; Князева и др., 2010; Ризниченко и др., 2011, 2014; Устинин и др., 2013; Хрущев и др., 2013, 2015б; Дьяконова и др., 2016; Kovalenko et al., 2006, 2010, 2011a,b, 2017; Riznichenko et al., 2010; Diakonova et al., 2016; Riznichenko, Kovalenko, 2019), а также в книгах (Rubin, Riznichenko, 2014; Rubin, 2017).
С помощью этого метода воспроизводится диффузионное перемещение и взаимодействие отдельных мобильных переносчиков электронов белковой природы (Pc, Fd) с мультиферментными комплексами (рис. 2). Соответствующие результатам моделирования экспериментальные данные представляются в виде суммарного спектра поглощения всей совокупности макромолекул в клеточной суспензии. Поэтому для сопоставления с экспериментом необходимо просуммировать данные моделирования по всему ансамблю отдельных макромолекул, перемещающихся и взаимодействующих в реакционном объеме.
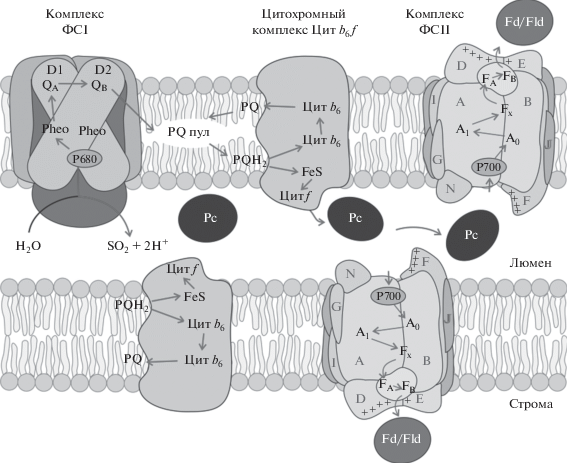
Рис. 2.
Схема электрон-транспортных процессов при фотосинтезе. Показаны две тилакоидные мембраны и люминальное пространство между ними. В мембрану встроены мультиферментные комплексы ФСI, -II и цитохромный комплекс. Молекулы мобильного белка Рс диффундируют в люминальном пространстве. Стрелки показывают пути переноса электрона. Связь с циклом Кальвина осуществляет белок ферредоксин (Fd) или флаводоксин (Fld).
В реальных процессах молекулы белков-переносчиков электронов осуществляют броуновское движение в среде и одновременно вступают в электростатические взаимодействия друг с другом и с заряженной поверхностью фотосинтетической мембраны. При достаточном сближении молекулы донора и акцептора способны образовывать окислительно-восстановительный комплекс. В результате последующих конформационных изменений в нем образуется внутримолекулярная электронная тропа и обеспечивается туннельный перенос электрона с молекулы-донора на молекулу-акцептор. Для описания конформационных движений в таком реакционном комплексе необходимо уже применение методов молекулярной динамики, а для описания собственно переноса электрона с реакционного центра молекулы-донора на реакционный центр молекулы-акцептора внутри комплекса – применение методов квантовой химии.
Описание броуновского движения и электростатического взаимодействия белков
Для упрощения расчетов движения во внутриклеточной среде молекулы белков представляются в виде эллипсоидов вращения, участвующих в поступательном и вращательном движении. Движение молекул подчиняется уравнению Ланжевена, которое описывает изменение координат центра масс каждой молекулы под действием случайной (толчки со стороны ближайшего окружения) и электростатической силы в вязкой среде. Трехмерные модели молекул строились по данным Protein Data Bank (PDB, http://wwpdb.org). Электростатическое поле вокруг молекулы белка рассчитывается по уравнению Пуассона–Больцмана. Принципы расчета движения молекул описаны в статьях (Коваленко и др., 2008; Kovalenko et al., 2006). Обычно расчет электростатического поля для одиночной молекулы белка, окруженной растворителем и мобильными зарядами (ионами), производится один раз при подготовке модели. В случае многочастичных моделей суммарное электростатическое поле рассматривается как суперпозиция полей отдельных молекул с учетом их положения и ориентации.
Для описания электростатических взаимодействий надо рассчитать электростатическую силу и ее момент, действующие на белок со стороны других белков. Необходимо учитывать только белки, находящиеся на расстояниях, меньших максимально возможного расстояния электростатического взаимодействия, которое для белков составляет около 35 Å (Финкельштейн, Птицын, 2002; Finkelstein, Ptitsyn, 2016). При бóльших расстояниях между поверхностями белков электростатические взаимодействия очень слабы из-за экранирования электрического поля диполями молекул воды и противоионами в растворе.
При сближении с другими белками, белок ориентируется в электрическом поле, создаваемом этими белками, и может занять выгодную позицию для последующего образования предварительного комплекса. Как подтвердили результаты вычислительных экспериментов, процесс электростатической ориентации значительно (на 1–2 порядка) увеличивает наблюдаемую кинетическую константу суммарной скорости реакции по сравнению с тем, как если бы белки соударялись случайными местами своих поверхностей в результате чисто броуновского движения без предварительной электростатической взаимной ориентации.
Стадии взаимодействия белков
Перенос электрона между белками включает несколько стадий:
1) диффузионное движение (поступательное и вращательное) белка под действием случайной броуновской силы к месту докинга или движение подвижного белка к другому белку, являющемуся частью встроенного в мембрану мультиферментного комплекса. Пока белки находятся на относительно больших расстояниях (>35 Å) друг от друга, электростатическими взаимодействиями между ними можно пренебречь;
2) на расстояниях, меньших 35 Å (расстояние электростатического взаимодействия), силы взаимодействия поверхностных зарядов на белках становятся сравнимыми с броуновской силой. Дальнейшее сближение и удаление белков (возможно, многократное) приводит к их взаимной ориентации, большую роль в которой играет вращательное движение;
3) при сближении реакционных центров двух белков на расстояние, равное так называемому радиусу взаимодействия (обычно составляет 15–20 Å), возможно образование диффузионно-столкновительного предварительного комплекса с правильной взаимной конфигурацией. Из него может образоваться финальный комплекс, в котором уже осуществляется собственно реакция переноса электрона. Если предварительный комплекс под действием броуновской силы успел распасться, то индивидуальные белки опять продолжат броуновское движение;
4) переход из предварительного в финальный комплекс происходит в результате спонтанных конформационных движений компонентов предварительного комплекса на расстояниях, где включаются ван-дер-ваальсовы взаимодействия. К образованию финального реакционного комплекса приводит сложная последовательность процессов, обеспечивающих конформационное соответствие молекул донора и акцептора. Для создания условий туннелирования электрона с молекулы-донора на молекулу-акцептор взаимодействующие белки, обладающие сложной пространственной структурой, должны правильно взаимно сориентироваться или как бы притереться друг к другу. Наличие зависимости скорости реакции от ионной силы свидетельствует о важной роли электростатических взаимодействий в образовании такого предварительного диффузионно-столкновительного комплекса (preliminary, encounter complex);
5) в финальном комплексе становится возможным туннельный перенос электрона между реакционными центрами белков донора и акцептора;
6) после осуществления реакции переноса электрона изменяются электронно-конформационные взаимодействия, и комплекс в ходе конформационных переходов распадается. Образуется пара белков, в которой бывший донор электрона оказывается окисленным, а бывший акцептор – восстановленным. Белки-переносчики снова готовы к участию в следующем акте переноса электрона.
С помощью метода многочастичной броуновской динамики были воспроизведены процессы взаимодействия подвижных переносчиков с мультиферментными комплексами (рис. 2): взаимодействия молекулы Рс с кофактором цитохромного комплекса Цит f в растворе (Kovalenko et al., 2008); взаимодействия Рс с Цит f и с донорной частью ФСI в люмене тилакоида (Князева и др., 2010; Kovalenko et al., 2017); взаимодействия Fd с акцепторной частью ФСI и дальнейшими акцепторами электронов – ферредоксин-НАДФ+-редуктазой (FNR) и гидрогеназой (Hd) (Diakonova et al., 2016). В версиях модели, описывающих совокупность процессов в фотосинтетической мембране, мы рассматривали в явном виде 1, 3 и 6 стадии (Коваленко и др., 2008, 2014; Князева и др., 2010; Устинин и др., 2010, 2013; Kovalenko et al., 2011a,b, 2017).
Продуктивные и непродуктивные столкновительные комплексы
Данные по конформации образующихся в процессе сближения и взаимной ориентации продуктивных и непродуктивных комплексов молекул донора и акцептора электронов приведены в работах (Хрущев и др., 2015а; Коваленко и др., 2016). Проведенный анализ траекторий диффузионного движения молекул в компьютерных экспериментах позволяет выявить наиболее часто возникающие варианты их взаимного расположения, оценить энергию взаимодействия между молекулами и получить оценку константы скорости реакции ассоциации белков.
Роль электростатических взаимодействий в образовании окислительно-восстановительного комплекса двух белков изучалась для пары фотосинтетических белков-переносчиков электрона – Рс и Цит f (Хрущев и др., 2015б; Коваленко и др., 2016; Kovalenko et al., 2006). Белки Рс и Цит f являются окислительно-восстановительными партнерами с четко локализованными реакционными центрами – атомами меди и железа соответственно. Эта пара белков является классическим объектом экспериментального исследования (Cruz-Gallardo et al., 2012) и изучения методом броуновской динамики (Ullmann et al., 1997; Ubbink et al., 1998; Pearson, Gross, 1998; Gross, Pearson, 2003; Gross, Rosenberg, 2006). Образованные финальные конфигурации взаимного расположения белков анализировались с помощью методов факторного и кластерного анализа (Хрущев и др., 2015б). Анализ нескольких тысяч структур показал, что в процессе диффузии образуется два типа столкновительных комплексов (рис. 3).
Рис. 3.
Структура комплекса Рс–Цит f из PDB (слева) и кластеров, полученных в ходе вычислительных экспериментов. В центре – кластер продуктивных комплексов, справа – кластер непродуктивных комплексов (Хрущев и др., 2015а).
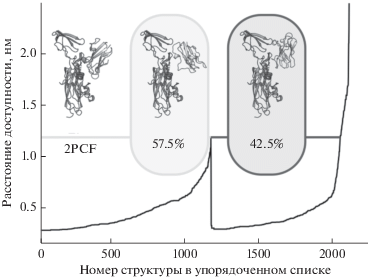
В кластере правильных конфигураций (рис. 3, в центре) взаимная ориентация молекул Рс и Цит f соответствует ориентации в функционально активном комплексе (слева), структура которого определена по данным ядерного магнитного резонанса (ЯМР) – структура PDB ID: 2PCF (Ubbink et al., 1998). В этих активных комплексах атомы Рс обладают достаточной подвижностью, чтобы осуществить дальнейшее сближение активных центров двух молекул белков. Наоборот, в кластере неправильных конфигураций (справа) взаимная ориентация молекул Рс и Цит f не соответствует ориентации в функционально активном комплексе, а сами молекулы Рс обладают весьма ограниченной подвижностью.
Гибридные броуновские/молекулярные модели взаимодействия фотосинтетических белков
Кластерный анализ десятков тысяч траекторий броуновского движения в процессе формирования предварительного комплекса белков Рс и Цит f позволил выявить различные энергетически выгодные метастабильные состояния. Конечные конфигурации молекул в группе наиболее часто встречающихся траекторий, ведущих к формированию предварительного комплекса, были затем использованы в качестве начальных для расчетов последующей внутримолекулярной динамики. Соответственно, на этом этапе в ходе молекулярно-динамического расчета происходило (либо не происходило) образование финального комплекса, где атом меди Рс и атом железа Цит f сближались до расстояний, на которых осуществляется туннельный перенос электрона.
Компьютерное воспроизведение процесса образования комплексов белков Рс и Цит f (Fedorov et al., 2019) было проведено для разных видов организмов: высших растений, зеленых микроводорослей и циановых бактерий. Метастабильные конформации, полученные с помощью метода кластерного анализа, сравнивали со структурами, независимо полученными методом ЯМР.
Данные ЯМР и рентгеноструктурного анализа показывают, что белки высших растений и зеленых водорослей имеют существенно отличающееся распределение заряда в области контакта по сравнению с белками из цианобактерий. Комплексы из цианобактерий значительно разнятся в отношении суммарного заряда на белках. Тем не менее, во всех этих организмах в паре белков Цит f–Рс осуществляется обмен электронами. На рис. 4 представлены результаты молекулярно-динамических расчетов взаимодействия Pc и Цит f из высших растений (Fedorov et al., 2019). Отметим, что для описания непосредственно процесса туннельного переноса электрона с атома железа Цит f на атом меди Pc надо использовать методы квантовой химии.
Рис. 4.
Центральные структуры первого (A1) и второго (B1) кластеров диффузионно-столкновительных комплексов Pc и Цит f из высших растений с энергией электростатического притяжения более 8 kT. Расстояние между атомами меди Pc и железа Цит f, полученное из расчетов молекулярной динамики, имеющих в качестве исходных конформаций центральную структуру первого (A2) и второго (B2) кластеров. Структуры первого (A3) и второго (B3) финальных комплексов, полученных из молекулярно-динамических расчетов (Fedorov et al., 2019).

В случае зеленых растений, ансамбль образовавшихся в процессе диффузионного движения структур с внутренней энергией 8 kT разбивается на два значительно отличающихся кластера. В первом кластере (рис. 4, А1, 61 % структур) молекулы белка имеют ориентацию, близкую к таковой в экспериментально полученном функционально активном комплексе. В этом кластере молекула Pc за счет вращения под действием тепловых флуктуаций имеет возможность занять выгодную для переноса электрона позицию относительно гема Цит f. Расстояние между кофакторами активных центров составляет около 1.5 нм.
Во втором кластере (рис. 4, B) молекулярная динамика приводит к метастабильной структуре, отличающейся от экспериментальной. Расстояние между кофакторами больше и составляет около 3.7 нм. Pc находится здесь в перевернутом положении относительно ориентации, которую он имеет в активных комплексах, полученных при помощи ЯМР. Очевидно, что структуры второго кластера находятся в непродуктивных метастабильных состояниях, которые не могут быть легко разрушены под действием случайной броуновской силы. В условиях низкой ионной силы среды, когда имеет место слабое экранирование электрических зарядов на поверхностях белков, стабильность этих непродуктивных состояний возрастает. Образование таких метастабильных неактивных состояний может быть основной причиной снижения доли активных белок–белковых комплексов, что наблюдается в экспериментах при низких значениях ионной силы (Князева и др., 2010; Meyer et al., 1993).
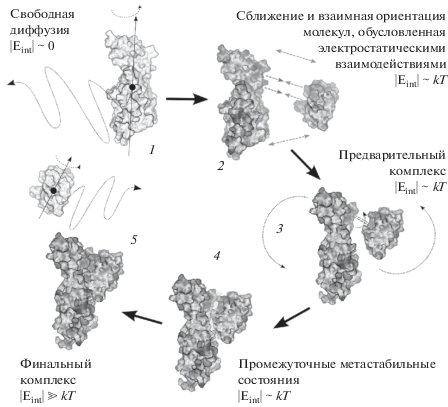
Общая последовательность этапов образования электрон-транспортного комплекса белков Рс и Цит f высших растений приведена на схеме на рис. 5.
Рис. 5.
Схема образования белок–белкового комплекса для электрон-транспортных белков Pc и Цит f высших растений. Eint – энергия электростатического взаимодействия. 1 – свободная диффузия молекул; 2 – взаимная ориентация, обусловленная электростатическими взаимодействиями; 3 – формирование энергетически выгодных конформаций; 4 – трансформация дифузионно-столкновительного комплекса в метастабильное энергетически выгодное состояние; 5 – формирование финального комплекса (функционально активная конфигурация) путем конформационных изменений в рамках белок–белкового интерфейса (Fеdorov et al., 2019).
В отличие от высших растений, у цианобактерий образование комплекса происходит без предварительной взаимной ориентации молекул по столкновительному типу, а константы скоростей этих реакций не зависят от ионной силы. В этих эволюционно более древних организмах электростатические взаимодействия, по-видимому, не играют особой роли в формировании комплексов фотосинтетических редокс-белков.
МЕХАНИЗМЫ РЕГУЛЯЦИИ ПРОЦЕССОВ ФОТОСИНТЕЗА В ВОДОРОД-ВЫДЕЛЯЮЩИХ ВОДОРОСЛЯХ. КИНЕТИЧЕСКИЕ И БРОУНОВСКИЕ МОДЕЛИ
Выделение H2 зелеными микроводорослями наблюдается после инкубации клеток в анаэробных условиях в темноте. Катализатором этого процесса является фермент Hd, в качестве донора электрона для Hd выступает белок Fd – конечный акцептор электрон-транспортной цепи фотосинтеза. В обычных условиях кислород является ингибитором Hd. В условиях голодания активируется темновое восстановление пула хинонов в процессе хлородыхания, что затрудняет переход электронов от ФСII к QA, нарушается ресинтез белка D1 ФСII, обновление которого в нормальных условиях происходит каждые полчаса. Поэтому при голодании подавляется активность ФСII, скорости окисления воды и выделения кислорода падают. Когда скорость выделения кислорода становится меньше скорости его поглощения в процессе дыхания, культура клеток становится анаэробной. Фермент Hd активируется и, как следствие, формируется электрон-транспортный путь, ведущий к выделению водорода. В условиях голодания обычный линейный транспорт электронов, направленный в цикл фиксации углерода Кальвина–Бенсона, нарушается, это ведет к перевосстановлению электрон-транспортной цепи. Формирование дополнительного пути электронов на путь образования водорода позволяет использовать избыточные электроны, понижает вероятность образования активных форм кислорода и, таким образом, носит защитный характер (Melis, Happe, 2001).
Организация фотосинтетической цепи водород-выделяющих водорослей
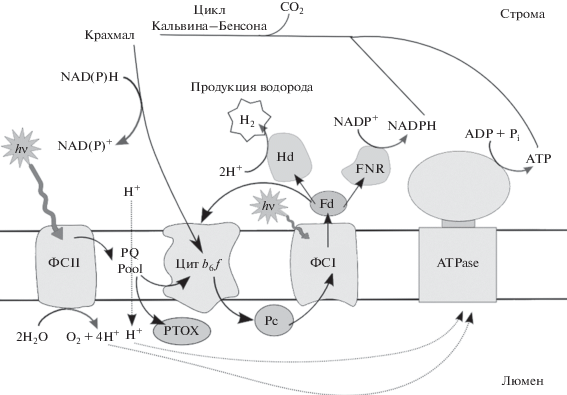
Схема электронных путей в клетках зеленых микроводорослей представлена на рис. 6.
Рис. 6.
Электрон-транспортная цепь фотосинтеза водород-выделяющих микроводорослей. Стрелками показаны пути переноса электронов и протонов. PTOX – plastid terminal oxidase (plastoquinol terminal oxidase) – пластидная терминальная оксидаза.
На 15–16 день серного голодания у водород-выделяющих водорослей Chlamydomonas reinhardtii активность ФСII резко падает (рис. 7, нижняя кривая; Antal et al., 2007), и в клеточной культуре устанавливаются анаэробные условия. После этого клетки микроводорослей начинают выделять молекулярный водород.
Рис. 7.
Кинетика переключения системы в процессе серного голодания. Верхняя кривая – изменение концентрации PQH2 во время голодания. Средняя кривая – изменение концентрации протонов в строме. Нижняя кривая – резкое снижение активности ФСII и изменение скорости переноса электронов с первичного на вторичный хинонный акцептор в фазе II голодания; точки – экспериментальные данные резкого изменения активности ФСII, полученные для C. reinhardtii в условиях серного голодания (Antal et al., 2007); линия – модельная кривая изменения квазистационарной скорости переноса электронов в ФСII, полученная на модели (Плюснина и др., 2013).
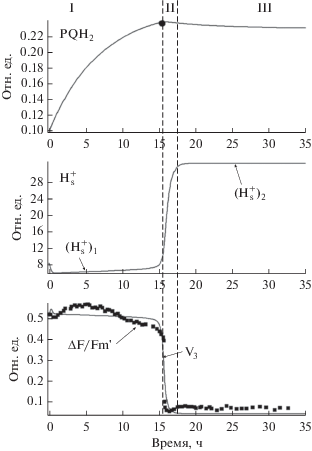
Вследствие подавления активности ФCII, поток электронов от ФCII в пул PQ и далее к ФСI падает. На акцепторной стороне ФСI в обычных условиях осуществляется поток электронов через Fd с фиксацией атмосферного углекислого газа CO2 и с образованием органических веществ в цикле Кальвина–Бенсона через фермент FNR. Этот классический путь переключается на путь переноса электронов через активированный фермент Hd с выделением водорода. Сам поток электронов в системе к ФСI при этом сохраняется за счет остаточной активности ФСII, а также поступления электронов через пул хинонов PQ с участием комплекса Цит b6 f и органических продуктов фотосинтеза (крахмала). В этих условиях обеспечивается производство АТФ за счет активного циклического электронного транспорта вокруг ФСI. Непосредственное переключение метаболизма клетки при голодании в режим выделения водорода происходит достаточно быстро, что указывает на существование триггерного механизма регуляции.
Для выяснения возможной роли изменения рН в триггерном механизме переключения электронных потоков на акцепторных участках ФСI и -II мы использовали совместно кинетические и многочастичные броуновские модели.
Общая система дифференциальных уравнений (Плюснина и др., 2013) описывает переходы между разными состояниями ФСII, изменение концентрации протонов вблизи фотосинтетической мембраны за счет обмена протонами стромы и гранальной примембранной области, потребление протонов в реакциях ФСII. В модели учитывается также образование дважды протонированной формы QAH2, которое происходит при высоких концентрациях протонов (Martin et al., 2011).
Модель была редуцирована с учетом разных временных масштабов, происходящих в системе процессов (Плюснина и др., 2013). Идентификация параметров модели ФСII по экспериментальной кинетической кривой индукции флуоресценции в условиях голодания показывает, что в начале голодания и после продолжительного голодания соответствующие значения локального рН вблизи акцепторной части ФСII существенно различаются (рис. 7, средняя кривая).
Развитие процессов вблизи ФСII в условиях голодания проходит через три фазы.
Фаза I – концентрация восстановленного пластохинона PQH2 медленно, в течение примерно 15 ч голодания, увеличивается (верхняя кривая, рис. 7) до достижения критической величины (PQH2 ≈ 0.24). До этого момента (t ≈ 15 ч) концентрация протонов (средняя кривая) находится вблизи стационарного состояния (${\text{H}}_{{\text{s}}}^{ + }$)1, соответствующего активному фотосинтезу (нижняя кривая) и активному потреблению протонов.
Фаза II – достижение значения PQH2 критической величины при росте культуры и резкое уменьшение активности ФСII в условиях стресса, что приводит к триггерному увеличению концентрации протонов вблизи ФСII (средняя кривая, рис. 7) и скачкообразному – за 10–20 мин – уменьшению скорости переноса электронов V3 (нижняя кривая, рис. 7).
Фаза III – система длительно, на протяжении десятков часов, находится в новом стационарном состоянии, соответствующем сниженной активности ФСII.
Таким образом, согласно модели, в ходе голодания происходит постепенное накопление избыточного количества восстановленных форм PQ, при достижении критического уровня которого резко падает активность ФСII. Также резко сокращается потребление и поток протонов внутрь тилакоида, соответственно, возрастает концентрация протонов вблизи акцепторной части ФСII. В модели адекватно воспроизводится триггерное переключение системы из устойчивого стационарного состояния в начале голодания, соответствующего активному электронному транспорту и интенсивному потоку протонов внутрь тилакоида, в другое стационарное состояние, которое характеризуется подавленным электронным транспортом через ФСII и, соответственно, существенно бо́льшими концентрациями протонов вблизи акцепторной стороны ФСII. Таким образом, изменение локальной концентрации протонов вблизи акцепторной части ФСII служит регуляторным фактором, переключающим систему с активного на неактивный тип фотосинтеза. Теперь синтез АТФ происходит за счет генерации трансмембранного градиента концентрации протонов при сопряжении с циклическим потоком электронов вокруг ФСI (Riznichenko et al., 2017).
Переключение электронных потоков на акцепторной стороне ФСI. Многочастичная броуновская модель
Непосредственным фактором, приводящим к выделению водорода, является успешная конкуренция Hd с FNR за восстановленный Fd в условиях голодания (Yacoby et al., 2011). Для выяснения конкретных механизмов переключения электронных потоков от Fd c FNR на Hd была исследована агентная броуновская модель взаимодействия белков – донора Fd и двух конкурирующих акцепторов FNR и Hd при разных значениях рН.
Анализ агентной модели показал, как изменение pH среды влияет на распределение потоков электронов от Fd, за счет разных рН-зависимостей скоростей образования комплексов Fd с FNR и c Hd. В области значений pH = 5–7.5 константа скорости связывания Hd и Fd практически не изменяется, а затем резко увеличивается и достигает максимума при pH = 9, когда рH стромы хлоропластов вблизи ФСI изменяется от 6 единиц pH в темноте до 8–8.5 единиц pH на свету. При этом и происходит увеличение сродства Hd и Fd друг к другу.
На рис. 8 представлены эквипотенциальные поверхности Fd, FNR и Hd при рН = 8 (Дьяконова и др., 2016; Diakonova et al., 2016). Темно-серый цвет соответствует положительно заряженным областям, светло-серый – отрицательно заряженным областям.
Рис. 8.
Эквипотенциальные поверхности FNR – ферредоксин-НАДФ+-редуктазы (а), Fd – ферредоксина (б) и Hd – гидрогеназы (в) при pH = 8. Ионная сила I = 150 мМ. Светло-серый цвет соответствует потенциалу –7 мВ, темно-серый – потенциалу +7 мВ. ФАД – флавинадениндинуклеотид – реакционный центр молекулы FNR, [2Fe–2S] – реакционный центр молекулы Fd, [4Fe–4S] – реакционный центр молекулы Hd (Diakonova et al., 2016).

Анализ эквипотенциальных поверхностей показывает, что у Hd при щелочных значениях pH формируется широкая область положительного заряда в окрестности [4Fe–4S]-кластера. Поэтому константа скорости образования комплекса Fd–Hd при pH = 7.5–9 существенно возрастает, а молекула Fd принимает в процессе броуновского движения в электростатическом поле Hd правильную ориентацию по отношению к кофактору.
Итак, в голодных клетках при активном циклическом потоке в окрестности акцепторной части ФСI сохраняется достаточно низкая концентрация протонов (рН = 8.5), в результате чего поток электронов на Hd способен успешно конкурировать с потоком электронов на FNR. Эти результаты соответствуют представлениям о возможной роли локального рН в отдельных компартментах клетки в качестве регуляторного фактора клеточных процессов.
ЗАКЛЮЧЕНИЕ
В настоящей статье рассматривались современные математические модели динамического поведения биологических систем на примере первичных процессов фотосинтеза. Общей целью динамического моделирования сложных систем является раскрытие закономерностей изменения во времени и их поведения, и количественных характеристик взаимодействующих компонентов. Ключевое условие адекватности модели реальному объекту состоит в соответствии структуры модели реальной системе, а также в соответствии формы уравнений механизмам и параметрам взаимодействия ее составных элементов. В моделях клеточных процессов это означает, что в полной модели должны присутствовать известные компоненты клеточного метаболизма, представленные в метаболических схемах. Сюда же относятся все связи между компонентами, в первую очередь прямые и обратные, положительные и отрицательные. Что касается самих математических уравнений, то они должны соответствовать конкретным механизмам взаимодействий компонентов, таким как свободное соударение по закону действующих масс, диффузионные перемещения в вязкой среде, внутримолекулярные кооперативные переходы в макромолекулярных комплексах. Все это возможно отразить в модели только на основе независимых данных экспериментов или наблюдений.
В свою очередь это требует и применения математических методов, адекватно отражающих характерные особенности взаимодействий в биологических системах. Так, по мере углубления наших знаний об устройстве биологической системы менялся и продолжает меняться арсенал применяемых математических методов. Этим обусловлен переход от обыкновенных дифференциальных уравнений кинетики в гомогенной среде к уравнениям кинетики, в которых наряду с химическими членами учитывается и диффузия веществ в гетерогенном реакционном пространстве.
В отдельных компартментах клетки, где взаимодействуют сравнительно небольшие ансамбли молекул, свою эффективность демонстрирует новый метод прямого многочастичного моделирования. На современных мощных компьютерах можно также адекватно в режиме реального времени методом Монте-Карло воспроизводить процессы, одновременно происходящие в миллионах цепей активных белков, которые взаимодействуют друг с другом. По-видимому, для адекватного построения полных клеточных моделей необходимо объединять кинетическое описание на основе дифференциальных уравнений с методами прямого многочастичного моделирования, Монте-Карло и вероятностного описания переходов в единых макромолекулярных комплексах.
Компьютерное воспроизведение броуновского диффузионного сближения белков основано на учете действия случайных толчков, которые испытывают белковые молекулы со стороны ближайшего окружения. Влияние электростатических взаимодействий вносит существенную поправку в “случайность” происходящих встреч белков, вызывая их взаимную нужную ориентацию. Это фактически означает наличие фактора дальнодействующих взаимодействий, который придает векторный характер, казалось бы, чисто случайным блужданиям белков. Можно предположить, что этим не исчерпывается векторизация броуновского движения в клетке и что возможно существование других дальнодействующих факторов взаимодействий в клетке. Например, правомерен вопрос о том, какой вклад в отбор случайных толчков может внести форма белковой глобулы по отношению к появлению преимущественного результирующего направления ее броуновского движения. Вообще, это может говорить о возможных скрытых пока от нас особенностях элементарных взаимодействий структурных элементов в живой системе, которые были выявлены и целесообразно использованы в биологии за миллионы лет эволюции на низших структурных уровнях организации живого.
В целом, критерий успешного математического моделирования заключается не только в правильном описании динамического поведения системы и в количественной обработке результатов экспериментов или наблюдений. Наиболее ценным является достижение нового понимания механизмов и способов регуляции клеточных процессов, которое может быть достигнуто путем изучения свойств адекватной математической модели. В истории моделирования характерным примером здесь служат модели колебательных процессов в биологии, начиная с классической нелинейной модели взаимодействия видов Вольтерра–Лотки. Базовый характер полученных здесь результатов состоит в том, что было найдено необходимое условие существования колебаний в биологической системе, а именно, нелинейный характер взаимодействий ее составных элементов. В этом и заключается эвристическая ценность моделирования, которая в полной мере проявилась в классических моделях автоколебаний при гликолизе в синхронной культуре дрожжей. Авторами был постулирован (или, как говорят, вложен руками) нелинейный автокаталитический характер реакции превращения фруктозо-6-фосфат в фруктозодифосфат, который в то время в биохимии еще не был известен. Были найдены и экспериментально подтверждены математические условия осуществления в культуре дрожжей автокаталитического режима колебаний.
Этому критерию эвристической ценности моделирования соответствуют и приведенные в первой части статьи результаты анализа процессов в ФСII. Установлено, что при повышенных интенсивностях света включается механизм обращения электронного потока, при котором происходит сброс (до 30%) избыточной энергии в тепло и флуоресценцию в наносекундном временном диапазоне. Эвристический характер носит и раскрытие механизма триггерного переключения потоков электронов при выделении водорода в голодных клетках.
Особая проблема – как включать данные моделирования систем более низкого уровня организации в сложные модели. В биологии речь идет о понимании поведения целостного организма на основании знаний о поведении его составных частей – клеток, субклеточных систем и биомакромолекул и их взаимодействий. То же может относиться к пониманию поведения популяций и экологических систем на основании знаний о поведении отдельных особей, хотя эта проблема может оказаться еще намного сложнее. Иными словами, как перейти от агентного элементарного описания к системно-динамическому описанию целостной системы. Это сродни вопросу о том, как, изучив каждую ниточку ковра, понять и представить в математическом виде закономерность его целостного прекрасного рисунка. Очевидно, ниточки необходимо правильно соединить, осознав закономерность этой правильности. Однако эта аналогия неполна, поскольку ковер статичен, а живые системы динамичны.
Вспомним слова Владимира Ивановича Вернадского: “…искание гармонии (в широком смысле), искание числовых соотношений является основным элементом научной работы. Найдя числовые соотношения, наш ум успокаивается, так как нам кажется, что вопрос, который нас мучил, – решен” (Вернадский, 2018, с. 46).
Но в действительности вопрос не решен, и мучения продолжаются.
Список литературы
Вернадский В.И. Биосфера и ноосфера. М.: T8RUGRAM, 2018. 576 с.
Дьяконова А.Н., Хрущев С.С., Коваленко И.Б. и др. Роль электростатических взаимодействий при образовании комплексов ферредоксин–ферредоксин-НАДФ-редуктаза и ферредоксин–гидрогеназа // Биофизика. 2016. Т. 61 (4). С. 677–685.
Князева О.С., Коваленко И.Б., Абатурова А.М. и др. Многочастичная модель диффузии и взаимодействия пластоцианина с цитохромом f в электростатическом поле фотосинтетической мембраны // Биофизика. 2010. Т. 55 (2). С. 259–268.
Коваленко И.Б., Абатурова А.М., Громов П.А. и др. Компьютерное моделирование образования комплекса между пластоцианином и цитохромом f в люмене тилакоида // Биофизика. 2008. Т. 53 (2). С. 261–270.
Коваленко И.Б., Абатурова А.М., Ризниченко Г.Ю. Новый метод компьютерного моделирования образования белок–белковых комплексов // Докл. АН. 2009. Т. 427 (5). С. 696–698.
Коваленко И.Б., Князева О.С., Ризниченко Г.Ю., Рубин А.Б. Компьютерное моделирование взаимодействия пластоцианина с цитохромом f и фотосистемой I в цианобактериях Phormidium laminosum // Биофизика. 2014. Т. 59 (1). С. 5–11.
Коваленко И.Б., Хрущев С.С., Федоров В.А. и др. Роль электростатических взаимодействий в процессе диффузионного сближения и докинга электрон-транспортных белков // Докл. АН. 2016. Т. 468 (2). С. 220–224.
Плюснина Т.Ю., Ризниченко Г.Ю., Рубин А.Б. Регуляция электрон-транспортных путей в клетках Сhlamydomonas reinhartii в условиях стресса // Физиол. раст. 2013. Т. 60 (4). С. 549–560.
Ризниченко Г.Ю., Коваленко И.Б., Абатурова А.М. и др. Многочастичное моделирование взаимодействия белков в фотосинтетической мембране // Биофизика. 2011. Т. 56 (5). С. 775–786.
Ризниченко Г.Ю., Беляева Н.Е., Коваленко И.Б. и др. Кинетические и многочастичные модели фотосинтетического электронного транспорта // Современные проблемы фотосинтеза. Т. 2 / Ред. С.И. Аллахвердиев, А.Б. Рубин, В.А. Шувалов. М., Ижевск: ИИКИ, 2014. С. 41–100.
Устинин Д.М., Коваленко И.Б., Грачев Е.А. и др. Метод прямого многочастичного компьютерного моделирования фотосинтетической электронно-транспортной цепи // Динамические модели процессов в клетках и субклеточных наноструктурах / Ред. Г.Ю. Ризниченко, А.Б. Рубин. М., Ижевск: РХД, ИИКИ, 2010. С. 241–262.
Устинин Д.М., Коваленко И.Б., Ризниченко Г.Ю., Рубин А.Б. Сопряжение различных методов компьютерного моделирования в комплексной модели фотосинтетической мембраны // Комп. иссл. моделир. 2013. Т. 5 (1). С. 65–81.
Финкельштейн А.В., Птицын О.Б. Введение в физику белка. Курс лекций. М.: КДУ, 2002. 376 с.
Хрущев С.С., Абатурова А.М., Дьяконова А.Н. и др. Моделирование белок–белковых взаимодействий с применением программного комплекса многочастичной броуновской динамики ProKSim // Комп. иссл. моделир. 2013. Т. 5 (1). С. 47–64.
Хрущев С.С., Абатуpова А.М., Дьяконова А.Н. и др. Моделиpование взаимодейcтвий белков фотоcинтетичеcкой электpон-тpанcпоpтной цепи фотоcинтеза методом бpоуновcкой динамики // Биофизика. 2015a. Т. 60 (2). С. 270–292.
Хрущев С.С., Абатуpова А.М., Федоpов В.А. и др. Идентификация пpомежуточныx cоcтояний в пpоцеccе диффузионного cближения электpон-тpанcпоpтныx белков плаcтоцианина и цитоxpома f // Биофизика. 2015б. Т. 60 (4). С. 629–638.
Albertsson P.-A. The domain structure and function of the thylakoid membrane // Res. Rec. Dev. Bioenerg. 2000. V. 1. P. 143–171.
Albertsson P.-A. A quantitative model of the domain structure of the photosynthetic membrane // Tr. Plant Sci. 2001. V. 6. P. 349–358.
Antal T.K., Krendeleva T.E., Rubin A.B. Study of photosystem 2 heterogeneity in the sulfur-deficient green alga Chlamydomonas reinhardtii // Photosynth. Res. 2007. V. 94. P. 13–22.
Cruz-Gallardo I., Díaz-Moreno I., Díaz-Quintana A., De la Rosa M.Á. The cytochrome f–plastocyanin complex as a model to study transient interactions between redox proteins // FEBS Lett. 2012. V. 586 (5). P. 646–652.
Dekker J.P., Boekema E.J. Supramolecular organization of thylakoid membrane proteins in green plants // Biochim. Biophys. Acta. 2005. V. 1706 (1–2). P. 12–39.
Diakonova A.N., Khrushchev S.S., Kovalenko I.B. et al. Influence of pH and ionic strength on electrostatic properties of ferredoxin, FNR, and hydrogenase and the rate constants of their interaction // Phys. Biol. 2016. V. 13 (5). P. e056004.
Fedorov V.A., Kovalenko I.B., Khruschev S.S. et al. Comparative analysis of plastocyanin–cytochrome f complex formation in higher plants, green algae and cyanobacteria // Physiolog. Plantar. 2019. V. 166 (1). P. 320–335.
Finkelstein A., Ptitsyn O. Protein physics. N.Y.: Academic Press, 2016. 528 p.
Gross E.L., Pearson D.C. Brownian dynamics simulations of the interaction of Chlamydomonas cytochrome f with plastocyanin and cytochrome c6 // Biophys. J. 2003. V. 85. P. 2055–2068.
Gross E.L., Rosenberg I. A brownian dynamics study of the interaction of Phormidium cytochrome f with various cyanobacterial plastocyanins // Biophys. J. 2006. V. 90. P. 366–380.
Haehnel W., Ratajczak R., Robenek H. Lateral distribution and diffusion of plastocyanin in chloroplast thylakoids // J. Cell Biol. 1989. V. 108. P. 1397–1405.
Kirchhoff H., Mukherjee U., Galla H.-J. Molecular architecture of the thylakoid membrane: lipid diffusion space for plastoquinone // Biochemistry. 2002. V. 41. P. 4872–4882.
Kovalenko I.B., Abaturova A.M., Gromov P.A. et al. Direct simulation of plastocyanin and cytochrome f interactions in solution // Phys. Biol. 2006. V. 3. P. 121–129.
Kovalenko I., Diakonova A., Abaturova A., Riznichenko G. Direct computer simulation of ferredoxin and FNR complex formation in solution // Proc. 16th Intern. Symp. on Flavins and Flavoproteins. Zaragoza Jaca, Spain: Prensas Universitarias, 2008. P. 437–442.
Kovalenko I.B., Diakonova A.N., Abaturova A.M. et al. Direct computer simulation of ferredoxin and FNR complex formation in solution // Phys. Biol. 2010. V. 7 (2). P. e026001.
Kovalenko I.B., Abaturova A.M., Diakonova A.N. et al. Computer simulation of protein–protein association in photosynthesis // Math. Model. Nat. Phenom. 2011a. V. 6. P. 39–54.
Kovalenko I.B., Diakonova A.N., Riznichenko G.Yu., Rubin A.B. Computer simulation of interaction of photosystem I with plastocyanin and ferredoxin // BioSystems. 2011b. V. 103. P. 180–187.
Kovalenko I.B., Knyaseva O.S., Antal T.K. et al. Multiparticle brownian dynamics simulation of experimental kinetics of cytochrome bf oxidation and photosystem I reduction by plastocyanin // Physiolog. Plantar. 2017. V. 161. P. 88–96.
Martin E., Samoilova R.I., Narasimhulu K.V. et al. Hydrogen bonding and spin density distribution in the QB semiquinone of bacterial reaction centers and comparison with the QA site // J. Am. Chem. Soc. 2011. V. 133. P. 5525–5537.
Melis A., Happe T. Hydrogen production. Green algae as a source of energy // Plant Physiol. 2001. V. 12. P. 3740–3748.
Meyer T.E., Zhao Z.G., Cusanovich M.A., Tollin G. Transient kinetics of electron transfer from a variety of c-type cytochromes to plastocyanin // Biochemistry. 1993. V. 32. P. 4552–4559.
Pearson D.C., Gross E.L. Brownian dynamics study of the interaction between plastocyanin and cytochrome f // Biophys. J. 1998. V. 75. P. 2698–2711.
Riznichenko G.Yu., Kovalenko I.B. Multiparticle models of brownian dynamics for the description of photosynthetic electron transfer involving protein mobile carriers // Int. J. App. Res. Bioinform. 2019. V. 9 (1). P. 1–19.
Riznichenko G.Yu., Kovalenko I.B., Abaturova A.M. et al. New direct dynamic models of protein interactions coupled to photosynthetic electron transport reactions // Biophysical Reviews. 2010. V. 2 (3). P. 101–110.
Riznichenko G.Yu., Plyusnina T.Yu., Diakonova A.N. et al. pH regulation of hydrogen-generating microalgae photosynthetic chain. Kinetic and multiparticle brownian models // Nonlinearity: problems, solutions and applications / Eds L.A. Uvarova, A.B. Nadykto, A.V. Latyshev. N.Y.: Nova Science Publishers Inc., 2017. P. 181–202.
Ruban A. The photosynthetic membrane: molecular mechanisms and biophysics of light harvesting. Chichester: Wiley, 2012. 282 p.
Rubin A.B. Compendium of biophysics. N.Y.: John Wiley and Sons, 2017. 660 p.
Rubin A.B., Riznichenko G.Yu. Mathematical biophysics. N.Y.: Springer, 2014. 273 p.
Ubbink M., Ejdebeck M., Karlsson B.G., Bendall D.S. The structure of the complex of plastocyanin and cytochrome f, determined by paramagnetic NMR and restrained rigid-body molecular dynamics // Structure. 1998. V. 6. P. 323–335.
Ullmann G.M., Knapp E.-W., Kostic N.M. Computational simulation and analysis of dynamic association between plastocyanin and cytochrome f. Consequences for the electrontransfer reaction // J. Am. Chem. Soc. 1997. V. 119. P. 42–52.
Yacoby I., Pochekailov S., Toporik H. et al. Photosynthetic electron partitioning between [FeFe]-hydrogenase and ferredoxin:NADP+-oxidoreductase (FNR) enzymes in vitro // PNAS USA. 2011. V. 108. P. 9395–9401.
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии



