Успехи современной биологии, 2020, T. 140, № 5, стр. 433-442
АТФ-синтаза клеток
Е. В. Узлова 1, *, С. М. Зиматкин 1
1 Гродненский государственный медицинский университет
Гродно, Республика Беларусь
* E-mail: uzlovaliza@gmail.com
Поступила в редакцию 02.06.2020
После доработки 02.06.2020
Принята к публикации 07.06.2020
Аннотация
Собраны и проанализированы данные о строении и организации, расположении, механизмах работы и функциях универсального в живой природе (присутствует во всех клетках прокариот и эукариот) и уникального по своим характеристикам фермента, синтезирующего АТФ, – АТФ-синтазы. Правильная структурная организация и работа АТФ-синтазы является ключевым условием для нормального протекания окислительного фосфорилирования, результатом которого является запасание энергии в виде АТФ. С нарушениями АТФ-синтазы ассоциировано большое количество заболеваний, в том числе нейродегенеративных и митохондриальных.
ВВЕДЕНИЕ
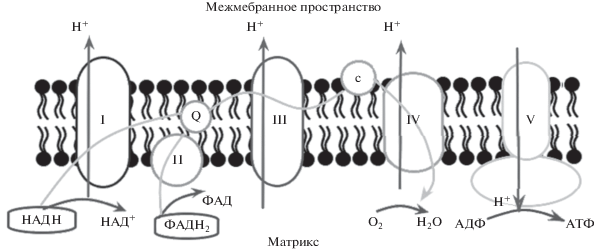
Аденозинтрифосфат (АТФ) – универсальный источник энергии в живых организмах, и его синтез является неотъемлемой частью жизнедеятельности клетки. Основной способ образования АТФ – окислительное фосфорилирование (Schapira, 2006) – представляет собой результат совместной работы электрон-транспортной цепи (ЭТЦ) и АТФ-синтазы митохондрий. ЭТЦ включает так называемые комплексы: I – НАДН-дегидрогеназный комплекс, II – сукцинатдегидрогеназу (единственный фермент цикла Кребса, связанный с мембраной митохондрий; служит переносчиком электронов на убихинон), III – цитохром-bc1-комплекс, IV – цитохром-c-оксидазу и АТФ-синтазу, которая иногда рассматривается как V комплекс цепи, хоть и не принимает участия в процессе переноса электронов (рис. 1). При этом особый интерес представляет АТФ-синтаза, поскольку именно она является основным компонентом в процессе синтеза АТФ и играет ключевую роль в развитии нейродегенеративных заболеваний (Kucharczyk et al., 2009).
Рис. 1.
Расположение и взаимодействие комплексов ЭТЦ во внутренней мембране митохондрий (I–V – комплексы ЭТЦ, Q – убихинон, с – цитохром c).
АТФ-синтаза – фермент, состоящий из белковых субъединиц и представляющий собой “молекулярную машину”, снабженную уникальным роторным механизмом (Allegretti et al., 2015; Morales-Rios et al., 2015; Zhou et al., 2015). АТФ-синтаза – универсальный фермент, поскольку присутствует как в клетках прокариот, так и эукариот. Выделяют три группы АТФ-синтаз: P-, F- и V-АТФ-синтазы (Nelson, Taiz, 1989; Nelson, 1992). Они различаются как по строению, так и по функциям. Примечательно, что F-тип АТФ-синтаз перешел к эукариотическим организмам в результате симбиогенеза, поэтому он встречается и у прокариот, и в двумембранных органеллах эукариот (Nelson, 1992).
Согласно данным Международного союза биохимиков и молекулярных биологов, принятым в настоящее время названием этого фермента является H+-транспортирующая двухсекторная АТФаза. Систематическое название – АТФ-фосфогидролаза (H+-транспортирующая). Другие названия данного фермента – АТФ-синтаза, F1-АТФаза, FoF1-АТФ-аза, H+-транспортирующая АТФаза, митохондриальная АТФаза, факторы сопряжения (Fo, F1 и CF1), АТФаза хлоропластов (cFocF1), бактериальная Ca2+/Mg2+ АТФаза (International Union …, 2020).
С 1984 года АТФ-синтаза числилась в классификации ферментов как фермент 3-го класса – гидролаза – код 3.6.1.34. В 2000 году она была перенесена в 7 класс – транслоказы, но сохранила систематическое название – АТФ-фосфогидролаза. В современной классификации АТФ-синтаза обозначается как 7.1.2.2 (BRENDA …, 2020; International Union …, 2020).
ОРГАНИЗАЦИЯ АТФ-СИНТАЗЫ ПРОКАРИОТ, ДРОЖЖЕЙ И РАСТИТЕЛЬНЫХ ОРГАНИЗМОВ
Наиболее современным методом определения структуры и организации АТФ-синтаз организмов является криоэлектронная микроскопия. Она позволяет визуализировать структуру множества хаотически расположенных макромолекул без их кристаллизации и получать высококачественное 3D-изображение (Milne et al., 2013; Nannenga, Gonen, 2014). На настоящий момент результаты криоэлектронной микроскопии указывают на аналогичную структуру функционально значимых частей АТФ-синтаз бактерий и всех эукариот (Davies et al., 2012).
Прокариотическая бактериальная АТФ-синтаза является наиболее просто устроенной: она содержит 8 субъединиц – пять в F1-компоненте и три – в Fo. У Архей, кроме АТФ-синтаз FoF1-типа, был найден AoA1-тип, который по своему строению напоминает АТФ-синтазы везикул дрожжей, растений и животных (Deckers-Hebestreit, Altendorf, 1996; Allegretti et al., 2015).
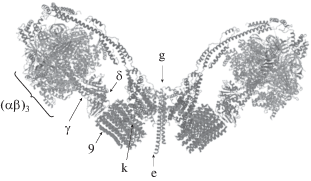
Наиболее хорошо изученной эукариотической АТФ-синтазой является АТФ-синтаза дрожжей (Saccharomyces cerevisiae) (рис. 2). Структуры фермента, необходимые для выполнения его функций, можно разделить на четыре условные структурные единицы: главная каталитическая группа (αβ)3, центральный стержень (γ, δ, ε), периферический стержень (4, d, h) и мембранная область (910, 6, 8, f). Первые две структурные единицы относятся к F1-компоненту, и последние две – к Fо. Олигомицин-чувствительный белок (OSCP, oligomycin sensitivity conferring protein) соединяет периферический стержень и каталитический домен (Davies et al., 2012). Также, кроме 13 основных субъединиц, АТФ-синтаза дрожжей включает четыре дополнительные – e, g, i и k (Rubinstein et al., 2003; Lau et al., 2008). Субъединицы e, g и k были впервые обнаружены в димерах АТФ-синтазы (Arnold et al., 1998) и предполагается, что основной задачей этих субъединиц является процесс димеризации (Davies et al., 2012).
Рис. 2.
Структура АТФ-синтазы Saccharomyces cerevisiae (α, β, γ, 9, k, e, g – названия субъединиц) (модифицировано по: Berman et al., 2000; Guo et al., 2017).
Растительная АТФ-синтаза хлоропластов (cF1FO-АТФ-синтаза) имеет 26 субъединиц, 17 из которых полностью или частично погружены в мембрану. Гидрофильная (αβ)3 каталитическая группа cF1-компонента соответствует таковой у других эукариот. сFo-компонент включает кольцо из 14 с-субъединиц, центральный стержень состоит из γ- и ε-субъединиц, а периферический – из b, b' и δ. Кроме того, в АТФ-синтазе хлоропластов выделяют три различных состояния, для каждого из которых была определена структура посредством криоэлектронной микроскопии (Hahn et al., 2018). Наличие трех различных функционально активных состояний АТФ-синтазы хлоропластов обусловлено тремя конформационными состояниями ε-субъединицы (Richter et al., 2005).
ОРГАНИЗАЦИЯ АТФ-СИНТАЗЫ МИТОХОДРИЙ МЛЕКОПИТАЮЩИХ
Митохондриальная АТФ-синтаза млекопитающих более сложна и весьма разнообразна. Она имеет вид грибовидной структуры с каналом внутри и включает два компонента, один из которых – Fо (или фактор сопряжения Fо, где индекс “о” обозначает олигомицин) пронизывает внутреннюю мембрану митохондрий – гидрофобный; второй – F1 (сокращение от “fraction 1” (часть 1), или фактор сопряжения F1) располагается в матриксе – гидрофильный. Каждый из этих компонентов, в свою очередь, состоит из множества субъединиц (Walker, Dickson, 2006; Devenish et al., 2008; Watt et al., 2010).
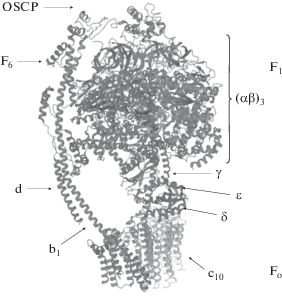
Компонент F1 эукариот, являющийся “головной” частью грибовидной структуры, состоит из девяти субъединиц: трех α и трех β, одной γ, δ и ε (Watt et al., 2010). Полипептидные цепи α и β расположены таким образом, что формируют шарообразный гексамер (αβ)3 с шестью сайтами связывания (три из которых – каталитические и три – некаталитические) и полостью (Kagawa et al., 1992; Mohanty et al., 2015; Xu et al., 2015). В полости гексамера (αβ)3 располагаются субъединицы γ и ε, при этом γ располагается и вращается под углом 120° к гексамеру; δ-субъединица располагается на наружной стороне. Вместе эти три субъединицы входят в состав центрального стержня (Devenish et al., 2008; Xu et al., 2015) (рис. 3).
Рис. 3.
Структура АТФ-синтазы митохондрий бычьих кардиомиоцитов, конформация 1А (OSCP, F6, d, b1, c10, α-, β-, γ-, δ-, ε-субъединицы) (модифицировано по: Berman et al., 2000; Zhou et al., 2015).
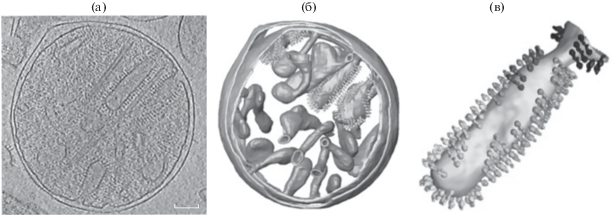
Диаметр фактора сопряжения F1 достигает 9 нм (Fernández-Morán et al., 1964), поэтому АТФ-синтазу возможно увидеть в электронном микроскопе на кристах внутренней мембраны митохондрий и с помощью криоэлектронной томографии (рис. 4) (Blum et al., 2019).
Рис. 4.
Расположение АТФ-синтазы на внутренней мембране митохондрий Polytomella sp. (а) – кристы внутренней мембраны митохондрий, окруженные димерами АТФ-синтазы; (б) – сегментированная структура, показывающая расположение димеров АТФ-синтазы (димеры изображены в виде “шипов” на внутренней мембране); (в) – криста митохондрий, окруженная и “сформированная” димерами. Криоэлектронная томография (модифицировано по: Blum et al., 2019).
Хорошо изучена F1Fo-АТФ-синтаза, изолированная из митохондрий бычьих кардиомиоцитов. В течение ротационного цикла она изменяет свою структуру, принимая различные конформации. Структура конформаций была определена и изучена (Zhou et al., 2015).
Весьма важен тот факт, что ключевыми компонентами для сборки АТФ-синтазы являются γ- и δ-субъединицы. Недостаток этих субъединиц или их дефекты являются предпосылками для снижения количества АТФ-синтазы. В то же время, отсутствие у низших эукариот γ-субъединицы не является критичным – гексамер (αβ)3 остается стабильным, что сопровождается компенсаторными мутациями в гене, кодирующем субъединицу β (Smith, Thorsness, 2005; Pecina et al., 2018). Так, результаты ряда исследований сообщали о димерах АТФ-синтазы дрожжей без субъединиц e и g, что ставит под сомнение их роль в димеризации (Paumard et al., 2002; Gavin et al., 2005; Wittig, Schagger, 2008).
Компонент Fо АТФ-синтазы весьма вариабелен и, в зависимости от вида организма, в нем возможно наличие большего или меньшего количества субъединиц (Meier et al., 2005; Pogoryelov et al., 2009; Vollmar et al., 2009; Jonckheere et al., 2012). Fo состоит из c-кольца (роторного кольца), содержащего 8 копий субъединицы, и одной копии каждой из субъединиц a и b (Walker, Dickson, 2006; Devenish et al., 2008; Watt et al., 2010). С-кольцо связано с b-субъединицей через a-субъединицу (Devenish et al., 2008; Xu et al., 2015). Кроме этих трех основных субъединиц, которые присутствуют в том числе и у бактерий, у эукариот имеются и другие: олигомицин-чувствительный белок (свое название белок получил благодаря антибиотику олигомицину, действие которого подавляет действие АТФ-синтазы) (Devenish et al., 2000; Salomon et al., 2001)), а также b, d, F6, иногда – f, e и g. Функции некоторых из этих субъединиц до сих пор не установлены. Известно, что субъединицы b, d, f, e, g и F6 формируют периферический стержень АТФ-синтазы (Walker, Dickson, 2006; Devenish et al., 2008) (рис. 3).
МЕХАНИЗМЫ РАБОТЫ АТФ-СИНТАЗЫ МИТОХОНДРИЙ
АТФ-синтаза использует энергию, созданную протонным электрохимическим градиентом, для фосфорилирования АДФ в АТФ в компоненте F1 (Nijtmans et al., 1995; Capaldi, Aggeler, 2002; Zeviani, Di Donato, 2004). Механизм ее работы носит название ротационного, или вращательного катализа (Boyer, 1975). В течение полного оборота субъединицы γ, каждый каталитический сайт меняет три конформации (Boyer, 1993). При этом можно выделить две функциональные части в АТФ-синтазе – движущуюся, т.н. ротор (с-кольцо, γ, δ и ε) и статор (F6, олигомицин-связывающий белок, α, β, a, b и d) (Devenish et al., 2008).
Механизм работы АТФ-синтазы представляется следующим образом: генерируемая протонным градиентом энергия поставляется из межмембранного пространства в матрикс через внутреннюю мембрану с помощью Fo-компонента; затем протонный градиент создает протон-движущую силу, включающую разность pH и электрический мембранный потенциал (Campanella et al., 2009); высвобожденная за счет этого энергия приводит в движение два ротационных двигателя, связанных друг с другом – c-кольцо в Fo и γ-, δ-, ε-субъединицы в F1 (Boyer, Kohlbrenner, 1981) и именно вращение γ-субъединицы обеспечивает энергию для синтеза АТФ.
Значительный вклад в изучение механизма работы АТФ-синтазы внесла группа японских ученых, сумевшая “прикрепить” к F1-АТФ-синтазе магнитные частицы и привести ее в действие. При движении по часовой стрелке происходил синтез АТФ в количестве 5 молекул в секунду, а при движении против часовой стрелки или отсутствии движения происходил гидролиз АТФ (Itoh et al., 2004). Примечательным является и то, что АТФ-синтаза отличается чрезвычайно высоким коэффициентом полезного действия – близким к 100% (Kinosita et al., 2000).
АТФ-синтаза способна осуществлять и обратный ротационному катализу процесс – гидролиз АТФ и перекачивать протоны через внутреннюю мембрану. В нормально функционирующих митохондриях АТФ-синтаза работает в направлении синтеза АТФ. Если же нормальное течение дыхания в митохондриях подвергается риску – АТФ-синтаза начинает осуществлять процесс гидролиза АТФ, а поскольку расщепление большого количества АТФ нежелательно, АТФ-синтаза ингибируется особым белком – фактором ингибирования IF1 (Pullman, Monroy, 1963; Devenish et al., 2008), активность которого зависит от уровня pH. IF1 блокирует F1-АТФазную активность (van Heeke et al., 1993), связываясь с двумя участками F1-компонента, и играет исключительно важную роль в защите клеток при ишемии (Campanella et al., 2008, 2009).
Иногда АТФ-синтаза не способна выполнять функцию синтеза АТФ – так происходит в бурой жировой ткани. Окислительное фосфорилирование в ее клетках находится на очень низком уровне вследствие присутствия белка термогенина UCP1 (Nicholls, 2017), относящегося к трансмембранным разобщающим белкам. Механизм его действия заключается в увеличении проницаемости внутренней мембраны для протонов, что за счет разобщения клеточного дыхания и окислительного фосфорилирования ведет к значительному снижению протонного градиента и снижению синтеза АТФ (LaNoue et al., 1986; Crichton et al., 2017).
Имеется и важная особенность F1Fo-АТФ-синтазы бактерий. Она способна “переключаться” с транспорта протонов водорода на транспорт ионов натрия. Впервые это было обнаружено у Propionigenium modestum (Laubinger, Dimroth, 1988), позже – у метаногенных бактерий (Becher, Muller, 1994) и Acetobacterium woodii (Reidlinger, Muller, 1994).
Кроме энергоснабжения, АТФ-синтаза участвует и в формировании структуры крист внутренней мембраны митохондрий (Allen, 1995; Paumard et al., 2002; Davies et al., 2012). Это осуществляется за счет существования АТФ-синтазы в виде V-образных димеров с углом 70°–90° градусов между фрагментами димера, которые соединяются в т.н. “ленты”, расположенные вдоль сильно изогнутых краев крист внутренней мембраны и “растягивающиеся” на сотни нанометров (Schagger, Pfeiffer, 2000; Paumard et al., 2002; Minauro-Sanmiguel et al., 2005; Strauss et al., 2008; Davies et al., 2011; Hahn et al., 2016; Blum et al., 2019). В то же время, структурно просто устроенные бактериальная и растительная АТФ-синтазы димеры не формируют вследствие отсутствия субъединиц, отвечающих за димеризацию (Lapaille et al., 2010): АТФ-синтаза хлоропластов является мономерной (Daum et al., 2010), а о наличии димеров у бактерий не сообщалось. В кристах других эукариотических организмов (дрожжей, животных) отдельных мономерных АТФ-синтаз обнаружено не было (Blum et al., 2019).
С помощью электронной криотомографии было доказано, что димеры АТФ-синтазы образуются самопроизвольно и таким образом “изгибают” мембраны, что является первой ступенью в формировании структуры внутренней мембраны митохондрий (рис. 5) (Blum et al., 2019).
Рис. 5.
Димеры АТФ-синтазы Polytomella sp., изгибающие мембраны. (а) – выделенная нижняя полоса градиента содержит протеолипосомы; (б) – плотно упакованные димерами мембраны; (в) – димеры; (г) – АТФ-синтаза направлена внутрь везикулы компонентом F1, что вызывает локальную кривизну мембраны; (д) – мембрана с параллельными рядами димеров. Криоэлектронная томография (модифицировано по: Blum et al., 2019).
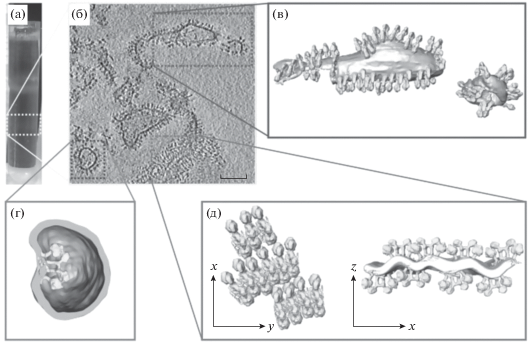
Исследование структуры димеров дрожжей показало, что наиболее важными для димеризации АТФ-синтазы являются два компонента – e и g. Это подтверждено посредством их удаления, что привело к нарушениям процессов димеризации и формирования крист внутренней мембраны (Hahn et al., 2016).
Исследование, проведенное на мутантных мышах с экспрессией человеческого IF1 в нервных клетках, продемонстрировало и возможную связь активностей АТФ-синтазы с клеточной смертью (Formentini et al., 2014). IF1, блокирующий синтазную и гидролазную активности АТФ-синтазы (Garcia-Bermudez, Cuezva, 2016), используется раковыми клетками для ингибирования ее способности синтезировать активные формы кислорода, т.к. их синтез приводит к запуску апоптотических процессов. Оказалось, что опосредованное IF1 метаболическое прекондиционирование приводило к “мягкому” окислительному стрессу и повышению функционального порога, на котором повреждения приводили к клеточной смерти. За счет ингибирования активностей АТФ-синтазы IF1-мыши оказались частично защищены от повреждения некоторыми агентами (например, хинолиновой кислотой), несмотря на весьма низкие количества АТФ и АДФ. Таким образом, удалось избежать значительного повреждения нервных клеток за счет предотвращения синтеза активных форм кислорода, что предполагает значительную роль АТФ-синтазы в гибели клеток и делает фермент потенциальной “мишенью” для ее предотвращения (Formentini et al., 2014).
НАРУШЕНИЯ АТФ-СИНТАЗЫ
Правильная сборка и функционирование АТФ-синтазы являются необходимыми условиями нормальной жизнедеятельности клетки. С нарушениями сборки и/или функции АТФ-синтазы ассоциировано достаточно большое количество различных заболеваний, среди которых нейродегенеративные и митохондриальные, ожирение, онкологические заболевания, иммунодефицит, диабет и муковисцидоз (García et al., 2000; Ahmad, Laughlin, 2010; Bartolome et al., 2013). Мутации в некоторых субъединицах АТФ-синтазы приводят к нарушениям ее сборки, что ведет к изменениям морфологии крист митохондрий (Strauss et al., 2008), и это еще раз подтверждает роль АТФ-синтазы как необходимого условия для формирования складок (крист) их внутренней мембраны. Например, такие изменения обнаруживаются при болезни Лея (мутация a-субъединицы), NARP-синдроме (мутация субъединицы F6), митохондриальной кардиомиопатии и др. (Kucharczyk et al., 2009; Dautant et al., 2018). Как следствие, АТФ-синтаза стала эффективной потенциальной мишенью для лекарственных препаратов (Ahmad et al., 2011). В настоящее время известно более 300 естественных и синтезируемых молекул, способных связываться с комплексом и изменять его активность (Hong, Pedersen, 2008; Ahmad et al., 2013).
Литературные данные указывают на связь митохондрий и нейродегенеративных заболеваний, таких как болезни Паркинсона, Альцгеймера, Гентингтона и боковой амиотрофический склероз (Federico et al., 2012). Имеется и ряд метаболических расстройств, обусловленных митохондриальной дисфункцией (Scholte, 1988), основной чертой которой является нарушение работы ЭТЦ (Federico et al., 2012).
АТФ-СИНТАЗА МОЗГА
Наиболее зависимой от нормальной работы митохондрий является центральная нервная система, поскольку нейроны требуют для своей работы большого количества энергии (Magistretti, Pellerin, 1996; Raichle, Gusnard, 2002; Peters et al., 2004; Filosto et al., 2011; Magistretti, Allaman, 2015). Поскольку уровень синтеза АТФ является центральным показателем биоэнергетики мозга, его функции, старения и нейродегенерации, а АТФ-синтаза непосредственно отвечает за данный процесс, ее исследование в структурах мозга является весьма актуальным. По строению и функциям мозг очень сложно организован, что предполагает и гетерогенность распределения в нем АТФ-синтазы. Однако имеющаяся информация фрагментарна и затрагивает очень малую часть его структур, и касается лишь патологических состояний, что недостаточно для оценки и сравнения энергетического потенциала разных микроотделов и типов клеток мозга.
Имеющаяся информация указывает на то, что АТФ-синтаза мозга является “ключевой” целью для повреждающих факторов. Причиной систематических нарушений различных субъединиц, особенно субъединиц α и β, является липоксидирование, что ведет к потере активности комплекса V. Результаты иммуногистохимических исследований свидетельствуют о повреждении в мозге нейронов, а также о том, что модификации АТФ-синтазы обнаруживаются в различных областях коры мозга, и их количество возрастает по мере старения организма и при патологии. При болезни Альцгеймера энторинальная кора страдает уже на самых ранних этапах болезни (Terni et al., 2010). Также липоксидирование АТФ-синтазы обнаружено в гиппокампе и париетальной коре при болезни Альцгеймера, но на более поздних этапах, чем в энторинальной коре (Reed et al., 2008; Terni et al., 2010). Особенно важно, что, несмотря на инактивацию АТФ-синтазы, уровень экспрессии компонентов белка данного фермента не снижается (Terni et al., 2010).
В клетках Пуркинье мозжечка и клетках фронтальной и теменной коры при холестазе установлены значительные волнообразные изменения (повышение, снижение, нормализация) количества АТФ-синтазы (Емельянчик и др., 2018).
Исследование структур мозга крыс при гипертензии указало на митохондриальную дисфункцию и значительные нарушения в сборке и работе АТФ-синтазы в стволе мозга. На основании этого было выдвинуто предположение, что именно недостаток АТФ и увеличение активных форм кислорода приводят к нарушению кардиоваскулярного гомеостаза (Lopez-Campistrous et al., 2008).
ЗАКЛЮЧЕНИЕ
АТФ-синтаза – представляет собой универсальный и уникальный по своим характеристикам фермент. Много десятилетий АТФ-синтаза различного происхождения являлась объектом пристального изучения, и в настоящее время мы обладаем большим объемом информации: о ее структуре и организации, механизмах работы и функциях, нарушениях при патологии.
АТФ-синтазы всех организмов содержат хорошо изученные одинаковые основные структурные единицы, необходимые для выполнения ферментом своих функций. При этом “уникальные” единицы некоторых конкретных видов АТФ-синтаз остаются не изученными. Учитывая, что функции АТФ-синтазы включают не только синтез или гидролиз АТФ, но и формирование структуры крист митохондрий у эукариот – можно утверждать, что правильная сборка и работа АТФ-синтазы являются ключевыми условиями для нормальной жизнедеятельности клеток. С нарушениями АТФ-синтазы ассоциировано большое количество заболеваний, в том числе нейродегенеративных и митохондриальных. Одним из наименее изученных вопросов остается вопрос о распределении АТФ-синтазы в различных отделах и типах клеток мозга. Актуальность этого вопроса определяется тем, что АТФ-синтаза является молекулярным маркером митохондрий и характеризует ее “энергетический потенциал”.
Список литературы
Емельянчик С.В., Карнюшко О.А., Зиматкин С.М. Изменения иммунореактивности АТФ-синтазы в нейронах коры мозга и мозжечка крыс при холестазе // Вестн. Смол. гос. мед. акад. 2018. Т. 17 (2). С. 55–60.
Ahmad Z., Laughlin T.F. Medicinal chemistry of ATP synthase: a potential drug target of dietary polyphenols and amphibian antimicrobial peptides // Curr. Med. Chem. 2010. V. 17 (25). P. 2822–2836. https://doi.org/10.2174/092986710791859270
Ahmad Z., Okafor F., Azim S., Laughlin T. F. ATP synthase: a molecular therapeutic drug target for antimicrobial and antitumor peptides // Curr. Med. Chem. 2013. V. 20 (15). P. 1956–1973. https://doi.org/10.2174/0929867311320150003
Ahmad Z., Okafor F., Laughlin T.F. Role of charged residues in the catalytic sites of Escherichia coli ATP synathse // J. Amino Acids. 2011. V. 2011. 785741. https://doi.org/10.4061/2011/785741
Allegretti M., Klusch N., Mills D.J. et al. Horizontal membrane-intrinsic α-helices in the stator a-subunit of an F-type ATP synthase // Nature. 2015. V. 521 (7551). P. 237–240. https://doi.org/10.1038/nature14185
Allen R.D. Membrane tubulation and proton pumps // Protoplasma. 1995. V. 189. P. 1–8. https://doi.org/10.1007/BF01280286
Arnold I., Pfeiffer K., Neupert W. et al. Yeast mitochondrial F1F0-ATP synthase exists as a dimer: identification of three dimer-specific subunits // EMBO J. 1998. V. 17 (24). P. 7170–7178. https://doi.org/10.1093/emboj/17.24.7170
Bartolome F., Wu H.C., Burchell V.S. et al. Pathogenic VCP mutations induce mitochondrial uncoupling and reduced ATP levels // Neuron. 2013. V. 78 (1). P. 57–64. https://doi.org/10.1016/j.neuron.2013.02.028
Becher B., Muller V. Delta mu Na+ drives the synthesis of ATP via an delta mu Na(+)-translocating F1F0-ATP synthase in membrane vesicles of the archaeon Methanosarcina mazei Go1 // J. Bacteriol. 1994. V. 176 (9). P. 2543–2550.https://doi.org/10.1128/jb.176.9.2543-2550.1994
Berman H.M., Westbrook J., Feng Z. et al. The protein data bank // Nucl. Acids Res. 2000. V. 28. P. 235–242. https://doi.org/10.1093/nar/28.1.235
Blum T.B., Hahn A., Meier T. et al. Dimer of mitochondrial ATP synthase induce membrane curvature and self-assemble into rows // PNAS USA. 2019. V. 116 (10). P. 4250–4255. https://doi.org/10.1073/pnas.1816556116
Boyer P.D. A model for conformational coupling of membrane potential and proton translocation to ATP synthesis and to active transport // FEBS Lett. 1975. P. 56 (1). P. 1–6. https://doi.org/10.1016/0014-5793(75)80212-2
Boyer P.D. The binding change mechanism for ATP synthase – some probabilities and possibilities // Biochim. Biophys. Acta. 1993. V. 1140 (3). P. 215–250.
Boyer P.D., Kohlbrenner W.E. The present status of the binding-change mechanism and its relation to ATP formation by chloroplasts // Energy Coupling in Photosynthesis / Eds B.R. Selman, S. Selman-Reimer. Amsterdam, New York: Elsevier/North-Holland Biomed. Press, 1981. V. 20. P. 231–240.
BRENDA:EC3.6.3.14. H+-transporting two-sector ATPasa [Electronic resource] // BRENDA. The Comprehensive Enzyme Information System. Mode of access: https://www.brenda-enzymes.org/index.php. Date of access: 29.04.2020.
Campanella M., Casswell E., Chong S. et al. Regulation of mitochondrial structure and function by the F1FO-ATPase inhibitor protein, IF1 // Cell. Metab. 2008. V. 8 (1). P. 13–25. https://doi.org/10.1016/j.cmet.2008.06.001
Campanella M., Parker N., Tan C.H. et al. IF1: setting the pace of the F1FO-ATP synthase // Trends Biochem. Sci. 2009. V. 34 (7). P. 343–350. https://doi.org/10.1016/j.tibs.2009.03.006
Capaldi R.A., Aggeler R. Mechanism of the F1F0-type ATP synthase, a biological rotary motor // Trends Biochem. Sci. 2002. V. 27 (3). P. 154–160. https://doi.org/10.1016/s0968-0004(01)02051-5
Crichton P.G., Lee Y., Kunji E.R. The molecular features of uncoupling protein 1 support a conventional mitochondrial carrier-like mechanism // Biochimie. 2017. V. 134. P. 35–50. https://doi.org/10.1016/j.biochi.2016.12.016
Daum B., Nicastro D., Austin J. 2nd et al. Arrangement of photosystem II and ATP synthase in chloroplast membranes of spinach and pea // Plant Cell. 2010. V. 22 (4). P. 1299–1312. https://doi.org/10.1105/tpc.109.071431
Dautant A., Meier T., Hahn A. et al. ATP synthase diseases of mitochondrial genetic origin // Front. Physiol. 2018. V. 9. P. 329. https://doi.org/10.3389/fphys.2018.00329
Davies K.M., Anselmi C., Wittig I. et al. Structure of the yeast F1Fo-ATP synthase dimer and its role in shaping the mitochondrial cristae // PNAS USA. 2012. V. 109 (34). P. 13602–13607. https://doi.org/10.1073/pnas.1204593109
Davies K.M., Strauss M., Daum B. et al. Macromolecular organization of ATP synthase and complex I in whole mitochondria // PNAS USA. 2011. V. 108 (34). P. 14121–14126. https://doi.org/10.1073/pnas.1103621108
Deckers-Hebestreit G., Altendorf K. The F1Fo-type ATP synthases of bacteria: structure and function of Fo complex // Ann. Rev. Microbiol. 1996. V. 50. P. 791–824. https://doi.org/10.1146/annurev.micro.50.1.791
Devenish R.J., Prescott M., Boyle G.M., Nagley P. The oligomycin axis of mitochondrial ATP synthase: OSCP and the proton channel // J. Bioenerg. Biomembr. 2000. V. 32 (5). P. 507–515. https://doi.org/10.1023/a:1005621125812
Devenish R.J., Prescott M., Rodgers A.J. The structure and function of mitochondrial F1F0-ATP synthases // Int. Rev. Cell Mol. Biol. 2008. V. 267. P. 1–58. https://doi.org/10.1016/S1937-6448(08)00601-1
Federico A., Cardaioli E., Da Pozzo P. et al. Mitochondria, oxidative stress and neurodegeneration // J. Neurol. Sci. 2012. V. 322 (1–2). P. 254–262. https://doi.org/10.1016/j.jns.2012.05.030
Fernández-Morán H., Oda T., Blair P.V., Green D.E. A macromolecular repeating unit of mitochondrial structure and function // J. Cell Biol. 1964. V. 22 (1). P. 63–100. https://doi.org/10.1083/jcb.22.1.63
Filosto M., Scarpelli M., Cotelli M.S. et al. The role of mitochondria in neurodegenerative diseases // J. Neurol. 2011. V. 258 (10). P. 1763–1764. https://doi.org/0.1007/s00415-011-6104-z
Formentini L., Pereira M.P., Sánchez-Cenizo L. In vivo inhibition of the mitochondrial H+-ATP synthase in neurons promotes metabolic preconditioning // EMBO J. 2014. V. 33 (7). P. 762–778. https://doi.org/10.1002/embj.201386392
García J.J., Ogilvie I., Robinson B.H., Capaldi R.A. Structure, functioning, and assembly of the ATP synthase in cells from patients with the T8993G mitochondrial DNA mutation. Comparison with the enzyme in Rho(0) cells completely lacking mtDNA // J. Biol. Chem. 2000. V. 275 (15). P. 11075–11081. https://doi.org/10.1074/jbc.275.15.11075
Garcia-Bermudez J., Cuezva J.M. The ATPase inhibitory factor 1 (IF1): a master regulator of energy metabolism and of cell survival // Biochim. Biophys. Acta. 2016. V. 1857 (8). P. 1167–1182. https://doi.org/0.1016/j.bbabio.2016.02.004
Gavin P.D., Prescott M., Devenish R.J. Yeast F1F0-ATP synthase complex interactions in vivo can occur in the absence of the dimer specific subunit e // J. Bioenerg. Biomembr. 2005. V. 37 (2). P. 55–60. https://doi.org/10.1007/s10863-005-4128-8
Guo H., Bueler S.A., Rubinstein J.L. Atomic model for the dimeric Fo region of mitochondrial ATP synthase // Science. 2017. V. 358 (6365). P. 936–940. https://doi.org/10.1126/science.aao4815
Hahn A., Parey K., Bublitz M. et al. Structure of a complete ATP synthase dimer reveals the molecular basis of inner mitochondrial membrane morphology // Mol. Cell. 2016. V. 63 (3). P. 445–456. https://doi.org/10.1016/j.molcel.2016.05.037
Hahn A., Vonck J., Mills D.J. et al. Structure, mechanism and regulation of the chloroplast ATP synthase // Science. 2018. V. 360 (6389). pii: eaat4318. https://doi.org/10.1126/science.aat4318
Hong S., Pedersen P.L. ATP synthase and the actions of inhibitors utilized to study its roles in human health, disease and other scientific areas // Microbiol. Mol. Biol. Rev. 2008. V. 72 (4). P. 590–641. https://doi.org/10.1128/MMBR.00016-08
International Union of Biochemistry and Molecular biology. Recommendations on Biochemical & Organic Nomenclature, Symbols & Terminology etc. [Electronic resource] // Queen Mary University of London. Mode of access: https://www.qmul.ac.uk/sbcs/iubmb. Date of access: 29.04.2020.
Itoh H., Takahashi A., Adachi K. et al. Mechanically driven ATP synthesis by F1-ATPase // Nature. 2004. V. 427 (6973). P. 465–468. https://doi.org/10.1038/nature02212
Jonckheere A.I., Smeitink J.A., Rodenburg R.J. Mitochondrial ATP synthase: architecture, function and pathology // J. Inherit. Metab. Dis. 2012. V. 35 (2). P. 211–225. https://doi.org/https://doi.org/10.1007/s10545-011-9382-9
Kagawa Y., Ohta S., Harada M. et al. The α3β3 and α1β1 complexes of ATP synthase // Ann. N. Y. Acad. Sci. 1992. V. 671. P. 366–376. https://doi.org/https://doi.org/10.1111/j.1749-6632.1992.tb43810.x
Kinosita K. Jr., Yasuda R., Noji H. F1-ATPase: a highly efficient rotary ATP machine // Essays Biochem. 2000. V. 35. P. 3–18. https://doi.org/https://doi.org/10.1042/bse0350003
Kucharczyk R., Zick M., Bietenhader M. et al. Mitochondrial ATP synthase disorders: molecular mechanisms and the quest for curative therapeutic approaches // Biochim. Biophys. Acta. 2009. V. 1793 (1). P. 186–199. https://doi.org/10.1016/j.bbamcr.2008.06.012
LaNoue K.F., Strzelecki T., Strzelecka D., Koch C. Regulation of the uncoupling protein in brown adipose tissue // J. Biol. Chem. 1986. V. 261 (1). P. 298–305.
Lapaille M., Thiry M., Perez E. et al. Loss of mitochondrial ATP synthase subunit beta (Atp2) alters mitochondrial and chloroplastic function and morphology in Chlamydomonas // Biochim. Biophys. Acta. 2010. V. 1797 (8). P. 1533–1539. https://doi.org/10.1016/j.bbabio.2010.04.013
Lau W.C., Baker L.A., Rubinstein J.L. Cryo-EM structure of the yeast ATP synthase // J. Mol. Biol. 2008. V. 382 (5). P. 1256–1264. https://doi.org/10.1016/j.jmb.2008.08.014
Laubinger W., Dimroth P. Characterization of the ATP synthase of Propionigenium modestum as a primary sodium pump // Biochemistry. 1988. V. 27 (19). P. 7531–7537. https://doi.org/10.1021/bi00419a053
Lopez-Campistrous A., Hao L., Xiang W. et al. Mitochondrial dysfunction in the hypertensive rat brain: respiratory complexes exhibit assembly defects in hypertension // Hypertension. 2008. V. 51 (2). P. 412–419. https://doi.org/10.1161/HYPERTENSIONAHA.107. 102285
Magistretti P.J., Pellerin L. Cellular mechanisms of brain energy metabolism. Relevance to functional brain imaging and to neurodegenerative disorders // Ann. N. Y. Acad. Sci. 1996. V. 777 (1). P. 380–387. https://doi.org/10.1111/j.1749-6632.1996.tb34449.x
Raichle M.E., Gusnard D.A. Apprasing the brain’s energy budget // PNAS USA. 2002. V. 99. №16. P. 10237–10239. https://doi.org/10.1073/pnas.172399499
Meier T., Yu J., Raschle T. et al. Structural evidence for a constant c11 ring stoichiometry in the sodium F-ATP synthase // FEBS J. 2005. V. 272 (21). P. 5474–5483. https://doi.org/10.1111/j.1742-4658.2005.04940.x
Milne J.L., Borgnia M.J., Bartesaghi A. et al. Cryo-electron microscopy – a primer for the non-microscopist // FEBS J. 2013. V. 280 (1). P. 28–45. https://doi.org/10.1111/febs.12078
Minauro-Sanmiguel F., Wilkens S., Garcia J.J. Structure of dimeric mitochondrial ATP synthase: novel F0 bridging features and the structural basis of mitochondrial cristae biogenesis // PNAS USA. 2005. V. 102 (35). P. 12356–12358. https://doi.org/10.1073/pnas.0503893102
Mohanty S., Jobichen C., Chichili V.P. et al. Structural basis for a unique ATP synthase core complex from Nanoarcheaum equitans // J. Biol. Chem. 2015. V. 290 (45). P. 27280–27296. https://doi.org/10.1074/jbc.M115.677492
Morales-Rios E., Montgomery M.G., Leslie A.G., Walker J.E. Structure of ATP synthase from Paracoccus denitrificans determined by X-ray crystallography at 4.0 A resolution // PNAS USA. 2015. V. 112 (43). P. 13231–13236. https://doi.org/10.1073/pnas.1517542112
Nannenga B.L., Gonen T. Protein structure determination by MicroED // Curr. Opin. Struct. Biol. 2014. V. 27. P. 24–31. https://doi.org/10.1016/j.sbi.2014.03.004
Nelson N. Evolution of organellar proton-ATPases // Biochim. Biophys. Acta. 1992. V. 1100 (2). P. 109–124. https://doi.org/10.1016/0005-2728(92)90072-a
Nelson N., Taiz L. The evolution of H+-ATPases // Trends Biochem. Sci. 1989. V. 14 (3). P. 113–116. https://doi.org/10.1016/0968-0004(89)90134-5
Nicholls D.G. The hunt for the molecular mechanism of brown fat thermogenesis // Biochimie. 2017. V. 134. P. 9–18. https://doi.org/10.1016/j.biochi.2016.09.003
Nijtmans L.G., Klement P., Houstĕk J. Assembly of mitochondrial ATP synthase in cultured human cells: implications for mitochondrial diseases // Biochim. Biophys. Acta. 1995. V. 1272 (3). P. 190–198. https://doi.org/10.1016/0925-4439(95)00087-9
Paumard P., Vaillier J., Coulary B. et al. The ATP synthase is involved in generating mitochondrial cristae morphology // EMBO J. 2002. V. 21 (3). P. 221–230. https://doi.org/10.1093/emboj/21.3.221
Pecina P., Nůsková H., Karbanová V. et al. Role of the mitochondrial ATP synthase central stalk subunits γ and δ in the activity and assembly of the mammalian enzyme // Biochim. Biophys. Acta. Bioenerg. 2018. V. 1859 (5). P. 374–381. https://doi.org/10.1016/j.bbabio.2018.02.007
Peters A., Schweiger U., Pellerin L. et al. The selfish brain: competition for energy resources // Neurosci. Biobehav. Rev. 2004. V. 28 (2). P. 143–180. https://doi.org/10.1016/j.neubiorev.2004.03.002
Magistretti P.J., Allaman I. A cellular perspective on brain energy metabolism and functional imaging // Neuron. 2015. V. 86 (4). P. 883–901. https://doi.org/10.1016/j.neuron.2015.03.035
Pogoryelov D., Yildiz O., Faraldo-Gómez J.D., Meier T. High-resolution structure of the rotor ring of a proton-dependent ATP synthase // Nat. Struct. Mol. Biol. 2009. V. 16 (10). P. 1068–1073. https://doi.org/10.1038/nsmb.1678
Pullman M.E., Monroy G.C. A naturally occurring inhibitor of mitochondrial adenosine triphosphatase // J. Biol. Chem. 1963. V. 238 (11). P. 3762–3769.
Reed T., Perluigi M., Sultana R. et al. Redox proteomic identification of 4-hydroxy-2-nonenal-modified brain proteins in amnestic mild-cognitive impairment: insight into the role of lipid peroxidation in the progression and pathogenesis of Alzheimer’s disease // Neurobiol. Dis. 2008. V. 30 (1). P. 107–120. https://doi.org/10.1016/j.nbd.2007.12.007
Reidlinger J., Muller V. Purification of ATP synthase from Acetobacterium woodii and identification as a Na(+)-translocating F1F0-type enzyme // Eur. J. Biochem. 1994. V. 223 (1). P. 275–283. https://doi.org/10.1111/j.1432-1033.1994.tb18992.x
Richter M.L., Samra H.S., He F., Giessel A.J., Kuczera K.K. Coupling proton movement to ATP synthesis in the chloroplast ATP synthase // J. Bioenerg. Biomembr. 2005. V. 37 (6). P. 467–473. https://doi.org/10.1007/s10863-005-9493-9
Rubinstein J.L., Walker J.E., Henderson R. Structure of the mitochondrial ATP synthase by electron cryomicroscopy // EMBO J. 2003. V. 22 (23). P. 6182–6192. https://doi.org/10.1093/emboj/cdg608
Salomon A.R., Voehringer D.W., Herzenberg L.A., Khosla C. Apoptolidin, a selective cytotoxic agent, is an inhibitor of F0F1-ATPase // Chem. Biol. 2001. V. 8 (1). P. 71–80. https://doi.org/10.1016/s1074-5521(00)00057-0
Schagger H., Pfeiffer K. Supercomplexes in the respiratory chain of yeasts and mammalian mitochondria // EMBO J. 2000. V. 19 (8). P. 1777–1783. https://doi.org/10.1093/emboj/19.8.1777
Schapira A.H. Mitochondrial disease // Lancet. 2006. V. 368 (9529). P. 70–82. https://doi.org/10.1016/S0140-6736(11)61305-6
Scholte H.R. The biochemical basis of mitochondrial diseases // J. Bioenerg. Biomembr. 1988. V. 20 (2). P. 161–191. https://doi.org/10.1007/BF00768393
Smith C.P., Thorsness P.E. Formation of an energized inner membrane in mitochondria with a γ-deficient F1-ATPase // Eukaryot. Cell. 2005. V. 4 (12). P. 2078–2086. https://doi.org/10.1128/EC.4.12.2078-2086.2005
Strauss M., Hofhaus G., Schröder R.R., Kühlbrandt W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane // EMBO J. 2008. V. 27 (7). P. 1154–1160. https://doi.org/10.1038/emboj.2008.35
Terni B, Boada J., Portero-Otin M. et al. Mitochondrial ATP-synthase in the entorhinal cortex is a target of oxidative stress as stages I/II of Alzheimer’s disease pathology// Brain Pathol. 2010. V. 20 (1). P. 222–233. https://doi.org/10.1111/j.1750-3639.2009.00266.x
van Heeke G., Deforce L., Schnizer R.A. et al. Recombinant bovine heart mitochondrial F1-ATPase inhibitor protein: overproduction in Escherichia coli, purification and structural studies // Biochemistry. 1993. V. 32 (38). P. 10140–10149. https://doi.org/10.1021/bi00089a033
Vollmar M., Schlieper D., Winn M. et al. Structure of the c14 rotor ring of the proton translocating chloroplast ATP // J. Biol. Chem. 2009. V. 284 (27). P. 18228–18235. https://doi.org/10.1074/jbc.M109.006916
Walker J.E., Dickson V.K. The peripheral stalk of the mitochondrial ATP synthase // Biochim. Biophys. Acta. 2006. V. 1757 (5–6). P. 286–296. https://doi.org/10.1016/j.bbabio.2006.01.001
Watt I.N., Montgomery M.G., Runswick M.J. et al. Bioenergetic cost of making an adenosine triphosphate molecule in animal mitochondria // PNAS USA. 2010. V. 107 (39). P. 16823–16827. https://doi.org/10.1073/pnas.1011099107
Wittig I., Schagger H. Structural organization of mitochondrial ATP synthase // Biochim. Biophys. Acta. 2008. V. 1777 (7–8). P. 592–598. https://doi.org/10.1016/j.bbabio.2008.04.027
Xu T., Pagadala V., Mueller D.M. Understanding structure, function, and mutations in the mitochondrial ATP synthase // Microb. Cell. 2015. V. 2 (4). P. 105–125. https://doi.org/10.15698/mic2015.04.197
Zeviani M., Di Donato S. Mitochondrial disorders // Brain. 2004. V. 127 (10). P. 2153–2172. https://doi.org/10.1093/emboj/17.24.7170
Zhou A., Rohou A., Schep D.G. et al. Structure and conformational states of the bovine mitochondrial ATP synthase by cryo-EM // Elife. 2015. V. 4. P. e10180. https://doi.org/10.7554/eLife.10180
Дополнительные материалы отсутствуют.
Инструменты
Успехи современной биологии


